近年来,我国人群中以高胆固醇、甘油三酯水平为特点的血脂异常患病率大幅上升,导致心血管疾病发病率明显上升[1]。因此,从丰富的食物资源中发现、筛选具有降血脂特性的功能因子具有重要意义。
乳酸菌是人体肠道中重要的益生菌,对维持宿主肠道的微生态平衡和提高其免疫功能有重要作用[2]。在生物医学、农业等领域,乳酸菌具有降低胆固醇[3]、抗氧化[4]、抗癌[5]、抗病毒[6]、抗真菌[7]、抗感染[8]、缓解炎症性肠病[9]等作用,有安全、高效的独特优势。同时乳酸菌是各种发酵食品的重要组成部分,在肉制品、乳制品、果蔬以及饮料市场等食品领域有广泛应用,具有改善食品营养价值和风味[10]、抑制食品中腐败菌等有害微生物的生长和降解有害物质[11]、延长食品保质期[12]等作用。但是乳酸菌进入人体后,受到胃肠环境、抗生素和其他微生物等因素的影响,最终的生物活性损失较大,需要筛选具有良好环境适应能力的菌株以保证其生物有效性。
乳饼是云南传统发酵食品,也是乳酸菌的重要资源。其以牛、羊乳经发酵制作而成,口感独特美味,具有较高的营养价值[13]。在长期的自然驯化中,不同地域的自然环境、原料以及加工工艺的差异,造成了云南乳饼中丰富多样性的乳酸菌资源。但目前对云南乳饼中乳酸菌的研究主要集中在菌种的分离、鉴定、发酵能力评估和优化等方面[14-16],对于其功能活性和应用的研究鲜有报道。
因此本文选取云南代表性地区的乳饼为原料,以降解胆固醇及甘油三脂能力、耐酸耐胆盐能力、耐药性和抑菌能力为指标,筛选得到降血脂和环境适应能力较好的乳酸菌菌株并进行鉴定,同时比较其与商业化乳酸菌菌株的体外抗氧化能力。旨在筛选出具有优良降血脂特性的乳酸菌菌株,促进乳酸菌在生产实践中的应用,同时为我国传统发酵食品资源的挖掘和开发提供理论依据。
1.1.1 样品
乳饼在2019年3月分别购于云南省大理白族自治州双廊镇、昆明市路南彝族自治县、曲靖市陆良县,均为羊乳为原料,经当地农户采用自然发酵制作。样品采集在无菌离心管中,置于冰块中运输到实验室后于-80℃储存。
1.1.2 试剂
甘油三酯(TG)试剂盒,南京建成生物工程研究所;1,1-二苯基-2-三硝基苯肼(DPPH)、三吡啶基三嗪(TPTZ)、胃蛋白酶,北京索莱宝科技有限公司;胆盐、胆固醇,上海瑞永生物科技有限公司;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS),上海阿拉丁生化科技有限公司;BBI EZ-10柱式细菌基因组DNA抽提试剂盒,上海生工生物工程股份有限公司;FeCl3、硫酸铁铵等常规试剂,均购于天津市大茂化学试剂有限公司。
1.1.3 试验菌株
保加利亚乳杆菌GDM1.155、干酪乳杆菌GDM1.159、嗜热链球菌GDM1.83、植物乳杆菌GDM1.140,广东省微生物菌种保藏中心;大肠杆菌ATCC80739、金黄色葡萄球菌A1、铜绿假单胞杆菌PAO1,西南林业大学西南地区生物多样性保育实验室。
1.1.4 仪器与设备
SHZ-82恒温振荡器,常州智博瑞仪器制造有限公司;XINYI-ⅡD超声波粉碎机,宁波新艺超声设备有限公司;BSA224S电子天平,赛多利斯科学仪器(北京)有限公司;UV-1000紫外可见分光光度计,北京莱伯泰科技仪器有限公司;酶标仪美国(SpectraMax Plus 384);DW-HL218超低温冷冻储存箱,中科美菱低温科技股份有限公司;DH6000BⅡ电热恒温培养箱,上海双旭电子有限公司;SW-CJ-2FD洁净工作台,苏净集团苏州安泰空气技术有限公司。
1.2.1 乳酸菌的分离纯化
从采集到的样品中心部分取10 g放入无菌研钵中研碎后,加入0.85%无菌生理盐水振荡30 min,制备成悬液,梯度稀释后均匀涂布到MRS、M17固体乳酸菌选择培养基上,分离样品中杆状及球状乳酸菌[17]。于恒温培养箱中37℃培养36 h,挑取平板上具有溶钙圈的菌落进行划线直至获得纯菌落。对分离纯化后的菌落进行革兰氏染色,在生物显微镜下进行镜检,并进行接触酶等生理生化试验[18]。挑取经初步鉴定后的纯菌落于MRS及M17液体培养基中,37℃培养36 h后用甘油保藏法进行保藏,-80℃超低温冰箱贮藏备用。
1.2.2 体外降解胆固醇能力的测定
将分离得到的乳酸菌按照4%的接种量接种至胆固醇培养基[19](胆固醇培养基:将胆固醇胶束溶液加入到MRS及M17液体培养基中,使培养基中胆固醇最终质量浓度为0.1 g/L;所述胆固醇胶束中含有胆固醇0.1 g、吐温-80 1.0 mL、蔗糖脂肪酸酯0.1 g、冰醋酸5.0 mL,水浴加热溶解。调pH至6.5±0.2,并在121℃下高压灭菌15 min,冷却备用)中,37℃培养36 h后,吸取培养液0.2 mL,加入4.8 mL无水乙醇旋涡振荡混匀,静置5 min后再次振荡混匀,4 000×g离心10 min,取2 mL上清液用于胆固醇的测定,胆固醇的测定采用硫酸铁铵比色法[20],测定OD560 nm值,以未接菌的胆固醇培养基作为对照,胆固醇降解率计算如公式(1):
胆固醇降解率![]()
(1)
1.2.3 体外降解甘油三酯能力的测定
将分离得到的乳酸菌按照4%的接种量接种至甘油三酯培养基[21](甘油三酯培养基:将2%的聚乙烯醇水溶液与植物油按3∶1混合,用高速分散均质机处理后作为甘油三酯的来源,并按照4%的用量加入MRS及M17液体培养基中,调pH至6.5±0.2,121℃高压灭菌15 min,冷却备用)中,37℃培养36 h后,4 000×g离心10 min,取上清液用于甘油三酯含量测定,利用甘油三酯试剂盒测定培养液中甘油三酯的含量。以未接菌的甘油三酯培养基作为对照。甘油三酯降解率计算如公式(2)、(3)所示:
甘油三酯含量![]() 标准液浓度
标准液浓度
(2)
甘油三酯降解率![]()
(3)
1.2.4 乳酸菌耐酸能力的测定
将分离得到的乳酸菌按4%的接种量接种到MRS及M17液体培养基中,37℃培养36 h后,12 000×g离心10 min收集菌体,用灭菌的去离子水将菌体洗涤2次后悬浮,并用分光光度计测定其浊度,使其OD560 nm为0.8, 4℃冰箱冷藏备用。
使用96孔板法测定其耐酸能力[22],具体方法操作为取150 μL菌悬液及100 μL pH 3.0的模拟胃液(模拟胃液:在缓冲液制备模拟胃液,所述缓冲液中含有NaCl 2.05 g/L,KH2PO40.60 g/L,CaCl20.11 g/L和KCl 0.37 g/L,用1.0 mol/L的HCl调pH至3.0,并在121℃下高压灭菌15 min。使用前,加入0.22 μm滤器过滤除菌的胃蛋白酶,使其最终浓度为0.3%,4℃冰箱冷藏备用)加入96孔无菌酶标板中,37℃培养16 h;分别在0 h和16 h测定其OD610 nm值,计算其存活率如公式(4):
存活率![]()
(4)
1.2.5 乳酸菌耐胆盐能力的测定
选择在pH 3.0的模拟胃液中存活率较高的乳酸菌,检测其在不同胆盐浓度下的耐受性。将150 μL菌悬液及100 μL含3、5、10 g/L胆盐的MRS和M17液体培养基[23](将牛胆盐加入MRS及M17液体培养基中,使其胆盐质量浓度分别为1、3和5 g/L,调pH至6.5±0.2,121℃高压灭菌15 min,冷却备用)加入96孔无菌酶标板中,37℃培养16 h;分别在0和16 h测定其OD610 nm值,计算其存活率如公式(5):
存活率![]()
(5)
1.2.6 乳酸菌致病菌抑制能力的测定
采用96孔板法[24]测定乳酸菌对致病菌的抑制作用。取100 μL含有致病性大肠杆菌、铜绿假单胞杆菌及金黄色葡萄球菌的培养基,添加到含150 μL乳酸菌无细胞提取液的96孔无菌酶标板中,37℃培养24 h后,酶标仪测定OD580nm值,以生理盐水代替乳酸菌无细胞提取液为对照组。计算乳酸菌的抑菌率如公式(6)所示:
抑菌率![]()
(6)
1.2.7 乳酸菌耐药性的测定
采用药敏纸片法[25]测定乳酸菌对抗生素的敏感性,选取青霉素、氨苄西林、头孢唑林、丁胺卡那、庆大霉素、红霉素、诺氟沙星、环丙沙星、复方新诺明及氯霉素等常用且对细菌作用位点不同的抗生素为测试对象,取0.2 mL的乳酸菌菌液均匀涂布于固体MRS及M17培养基上,后贴放标准药物纸片,37℃培养36 h,然后测量并记录抑菌圈的直径,根据美国临床和试验室标准化研究所(CLSI)制定的《抗菌药物敏感性试验执行标准》(2010年版)判定乳酸菌对抗生素的耐药性。
1.2.8 乳酸菌种属的鉴定
利用DNA提取试剂盒提取乳酸菌基因组DNA,将提取的乳酸菌基因DNA作为16S rDNA-PCR的模板进行扩增,电泳检测扩增产物后,送至上海生工生物工程股份有限公司进行测序,将测序结果通过BLAST程序与GenBank基因库进行在线比对以确定乳酸菌种属。
1.2.9 乳酸菌抗氧化能力的测定
1.2.9.1 乳酸菌无细胞提取液的制备
根据AFIFY等[26]方法并进行略微修改,菌株以MRS培养基在37℃培养24 h,后5 000×g离心15 min,收集菌体,用无菌水洗涤2次后调整菌数至1×109/mL。将菌悬液冰浴超声波破碎,10 000×g离心20 min,收集上清液,为乳酸菌无细胞提取液。
1.2.9.2 清除ABTS自由基能力的测定
根据KAVITA等[27]方法并进行略微修改,取100 μL乳酸菌无细胞提取液加入96孔酶标板,然后加200 μL ABTS工作液(5.0 mL浓度为7 mmol/L的ABTS溶液,加入88.0 μL浓度为140 mmol/L的过硫酸钾,在室温下置于暗处反应12 h,形成ABTS储备液。在波长734 nm处,用95%的甲醇将ABTS储备液稀释至吸光值为0.70±0.02),室温反应5 min后于734 nm测吸光值(As),以Vc和BHT为阳性对照,以70%甲醇代替ABTS溶液的反应体系为样品空白组(Ab),以70%甲醇代替无细胞提取液的反应体系为控制组(Ac),所有样品测定3次平行,ABTS自由基清除率的计算如公式(7):
ABTS自由基清除率![]()
(7)
1.2.9.3 清除DPPH自由基能力的测定
根据KAVITA等[27]方法并进行略微修改,取150 μL乳酸菌无细胞提取液与150 μL DPPH甲醇溶液于96孔酶标板上混合,避光室温反应30 min后,于517 nm测吸光值(As),以VC和BHT为阳性对照,以70%甲醇代替DPPH甲醇溶液的反应体系为样品空白组(Ab),以70%甲醇代替无细胞提取液的反应体系为控制组(Ac),所有样品测定3次平行,DPPH自由基清除率的计算如公式(8):
DPPH自由基清除率![]()
(8)
1.2.9.4 铁还原能力的测定
根据韩雪等[28] 方法并进行略微修改,准确移取50 μL的乳酸菌无细胞提取液于酶标板中,加入250 μL TPTZ工作液(由10 mmol/L的TPTZ溶液;20 mmol/L的FeCl3溶液;pH 3.6的乙酸缓冲液组成),迅速摇匀后,37 ℃反应10 min,于波长593 nm处测定吸光度值,以FeSO4为标准绘制标准曲线,计算相同吸光值下乳酸菌无细胞提取液的当量浓度,记为铁还原能力(ferric reducing ability of plasma),单位为μmol FeSO4/mL样品,所有样品测定3次平行。
每组参数均设置3组重复,实验数据均以平均值±标准差的形式表示,采用SPSS Statistics 19软件进行差异显著性分析,并由Origin 7.5软件绘制实验结果图。
对采集到的样品进行分离纯化试验,通过革兰氏染色镜检及接触酶实验,初步确认从中分离到149株乳酸菌,根据其来源及培养基依次命名为“S-”“D-”“L-”“MS-”“MD-”“ML-”系列。经传代培养后,于-80 ℃冰箱保藏备用。
149株乳酸菌的体外降胆固醇及甘油三酯能力结果如表1所示。
由表1可知,分离纯化得到的149株乳酸菌种,其中119株乳酸菌胆固醇降解率低于35.00%,甘油三脂降解率低于10.00%,故不再表中体现;有14株乳酸菌降解胆固醇及甘油三酯综合能力较强,降解率均分别大于38.00%及24.00%;其中D16、S41、ML36的胆固醇降解率显著大于其他菌株;菌株D16的胆固醇降解率及甘油三酯降解率综合来看最高,分别为62.22%及37.89%。陈依婷从天然发酵食品中分离筛选出的2株乳酸菌,其胆固醇降解率分别为35.33%和33.53%[29]。马长路等[30]从酸菜中分离得到乳杆菌的胆固醇降解率最高为52.84%。相比之下,菌株D16的胆固醇降解率及甘油三酯降解率较高,有良好的体外降血脂的功效。
表1 乳酸菌体外降解胆固醇及甘油三酯的实验结果
Table 1 The ability of lowering cholesterol and
triglycerides by lactic acid bacteria
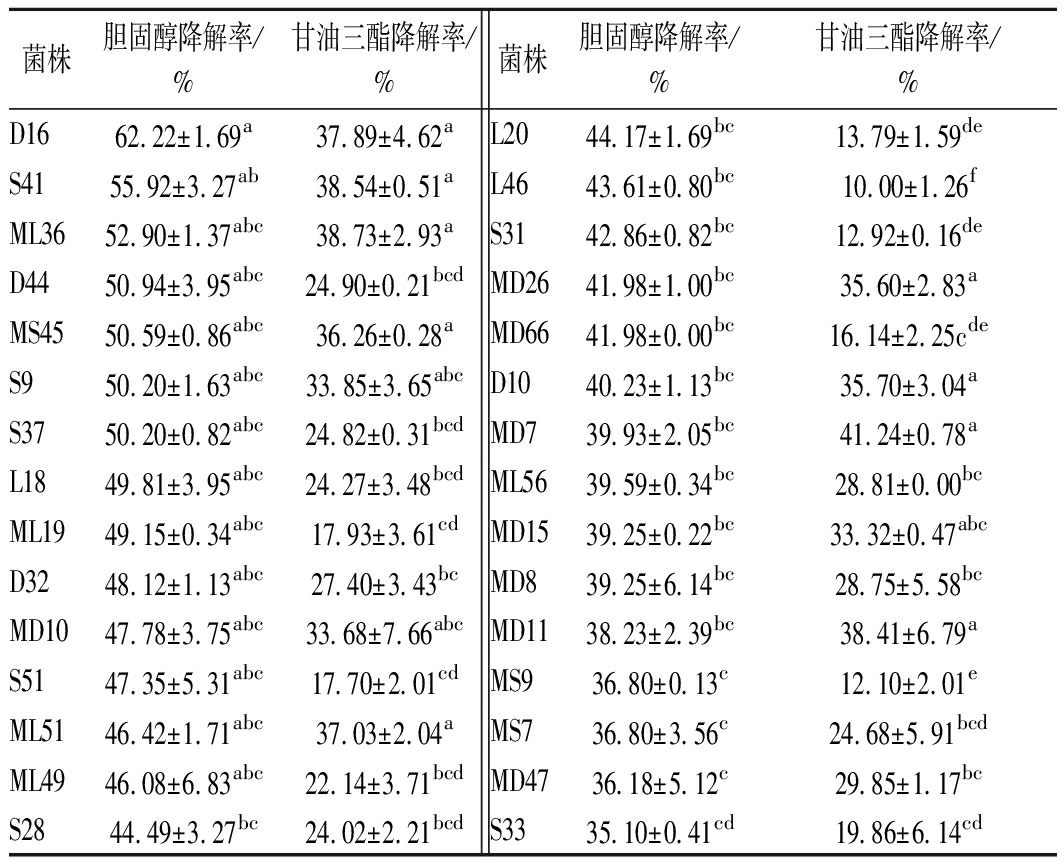
菌株胆固醇降解率/%甘油三酯降解率/%菌株胆固醇降解率/%甘油三酯降解率/%D1662.22±1.69a37.89±4.62aL2044.17±1.69bc13.79±1.59deS4155.92±3.27ab38.54±0.51aL4643.61±0.80bc10.00±1.26fML3652.90±1.37abc38.73±2.93aS3142.86±0.82bc12.92±0.16deD4450.94±3.95abc24.90±0.21bcdMD2641.98±1.00bc35.60±2.83aMS4550.59±0.86abc36.26±0.28aMD6641.98±0.00bc16.14±2.25cdeS950.20±1.63abc33.85±3.65abcD1040.23±1.13bc35.70±3.04aS3750.20±0.82abc24.82±0.31bcdMD739.93±2.05bc41.24±0.78aL1849.81±3.95abc24.27±3.48bcdML5639.59±0.34bc28.81±0.00bcML1949.15±0.34abc17.93±3.61cdMD1539.25±0.22bc33.32±0.47abcD3248.12±1.13abc27.40±3.43bcMD839.25±6.14bc28.75±5.58bcMD1047.78±3.75abc33.68±7.66abcMD1138.23±2.39bc38.41±6.79aS5147.35±5.31abc17.70±2.01cdMS936.80±0.13c12.10±2.01eML5146.42±1.71abc37.03±2.04aMS736.80±3.56c24.68±5.91bcdML4946.08±6.83abc22.14±3.71bcdMD4736.18±5.12c29.85±1.17bcS2844.49±3.27bc24.02±2.21bcdS3335.10±0.41cd19.86±6.14cd
注:同一列不同小写字母上标表示差异显著性(P<0.05)(下同)
乳酸菌作为肠道益生菌,必须具有相对好的耐酸性及耐胆盐能力,才能在胃和小肠前段存活。以体外降胆固醇及降甘油三酯能力为指标,筛选得到14株乳酸菌,评估其耐酸耐胆盐能力,实验结果见表2。
表2 乳酸菌耐酸耐胆盐能力实验结果
Table 2 The ability of tolerance of bile-salt and low
pH by lactic acid bacteria

菌株pH 3.0胆盐(1 g/L)胆盐(3 g/L)胆盐(5 g/L)D1687.29±0.66a82.36±0.30bc81.41±0.13abc79.26±1.29bcS4185.95±0.46ab71.62±0.97de63.24±4.09de61.28±0.47eML3685.68±1.85ab87.22±3.36b79.19±6.48bc72.61±0.40cdMD785.57±4.31ab85.81±4.16b77.37±3.66bc67.04±1.15deMD1185.15±2.56ab63.42±4.74f53.47±4.41e45.53±4.98fMS4582.37±1.12abc77.01±1.60cd76.57±5.13bc68.26±4.33deS2881.48±0.60abc69.31±1.91ef40.57±0.87f34.06±1.95gMD1080.80±1.04bc85.37±0.54b84.23±0.46ab83.83±1.17abMD2676.89±1.06cd87.77±0.68ab84.96±0.06ab83.52±0.62abL1874.99±2.00de88.98±0.89ab75.53±2.11bc64.75±0.76eML5172.28±3.83def73.35±7.03de70.55±3.51cd75.27±0.99cMD1570.65±4.53ef86.82±1.69b86.82±2.48ab77.58±0.86bcD1067.84±4.29fg93.57±2.74a92.62 ±2.34a89.90±0.04aS963.67±1.70g36.90±0.50g34.25±0.73f26.73±0.09h
结果表明,14株菌株中,有6株菌株在pH 3.0的人工胃液及胆盐浓度为1、3和5 g/L的培养基中培养16 h存活率分别大于60%、35%、30%及25%其中在pH 3.0的人工胃液中存活率大于85%,且在1、3和5 g/L胆盐含量的培养基中存活率分别大于82%、60%及45%。通常情况下,人体胃液pH为2~3;人体肠道胆盐浓度范围为0.03%~0.3%,乳酸菌在此pH和胆盐浓度内若能有较高的存活率,则表明菌株对酸和胆盐有一定的耐受性。而菌株D16的在pH=3的人工胃液及胆盐质量浓度为1、3、5 g/L的培养基中存活率分别为87.29%、82.36%、81.41%及79.26%,说明菌株D16对酸及胆盐有很好的耐受能力。
乳酸菌作为人体肠道中的重要有益微生物,可以通过产生短链脂肪酸、乳酸、甲酸、细菌素、过氧化氢及小分子肽类等一系列代谢产物来拮抗肠道致病菌[31],采用96孔板法检测2.3所述5株乳酸菌的致病菌抑制能力,结果如表3所示。
表3 乳酸菌对3种致病菌的抑制作用 单位:%
Table 3 The inhibition of three pathogenic bacteria by
lactic acid bacteria
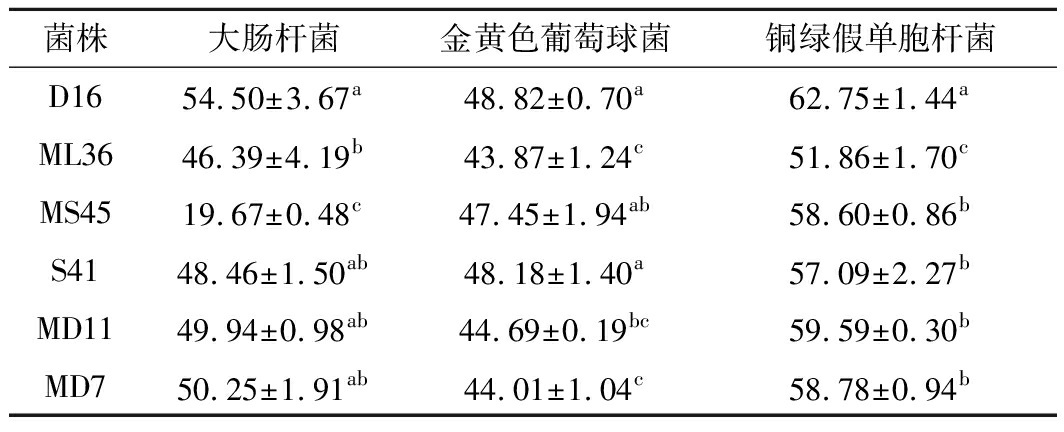
菌株大肠杆菌金黄色葡萄球菌铜绿假单胞杆菌D1654.50±3.67a48.82±0.70a62.75±1.44aML3646.39±4.19b43.87±1.24c51.86±1.70cMS4519.67±0.48c47.45±1.94ab58.60±0.86bS4148.46±1.50ab48.18±1.40a57.09±2.27bMD1149.94±0.98ab44.69±0.19bc59.59±0.30bMD750.25±1.91ab44.01±1.04c58.78±0.94b
结果表明,6株乳酸菌均有一定的致病菌抑制能力,其中D16及MD11对大肠杆菌、金黄色葡萄球菌、铜绿假单胞杆菌3种致病菌均有较好的抑制作用;菌株D16对大肠杆菌、金黄色葡萄球菌、铜绿假单胞杆菌的抑制能力较强,抑菌率分别为54.50%、48.82%和62.75%,这与路则宝等[32]的研究相似。
通过对益生菌进行药敏性测定,可避免耐药基因由于益生菌的广泛使用而传播。由表4可知,6株乳酸菌对头孢唑林、红霉素、复方新诺明均有一定的耐药性,可能是头孢唑林、红霉素、复方新诺明这3种抗生素较早被广泛使用的原因;6株乳酸菌对其他抗生素均有不同程度的敏感性;菌株D16耐药性低于其他菌株,对青霉素、氨苄西林、丁胺卡那、庆大霉素、诺氟沙星和氯霉素6种抗生素均敏感,对头孢唑林、红霉素、环丙沙星和复方诺明中度敏感。
表4 乳酸菌药敏性测定
Table 4 Determination of drug sensitivity of
lactic acid bacteria

抗菌药名纸片含药量/(μg·片-1)MS45MD7MD11ML36S41D16青霉素10SSRRRS氨苄西林10MMRSMS头孢唑林30MMRRRM丁胺卡那30SSMSMS庆大霉素10SSMMSS红霉素15RMRRMM诺氟沙星10SSSSSS环丙沙星5MSSSMM复方新诺明19MMRRRM氯霉素30SSSSSS
注:R为耐药,M为中度敏感,S为敏感
综合以上实验结果发现,菌株D16在体外具有较强的降胆固醇及甘油三酯能力,同时其耐酸耐胆盐能力也在一定程度上强于其他菌株,其对致病菌的抑菌能力较强,且耐药性较低。因此选择菌株D16作为辅助降血脂的乳酸菌进行进一步抗氧化性能研究。
以菌株D16基因组DNA为PCR扩增的模板,采用通用的16S rDNA引物进行PCR扩增,得到约1 500 bp的特异性扩增产物。电泳检测扩增产物后,送至上海生工生物工程有限公司进行测序。通过BLAST比对分析,产物PCR结果见图1。
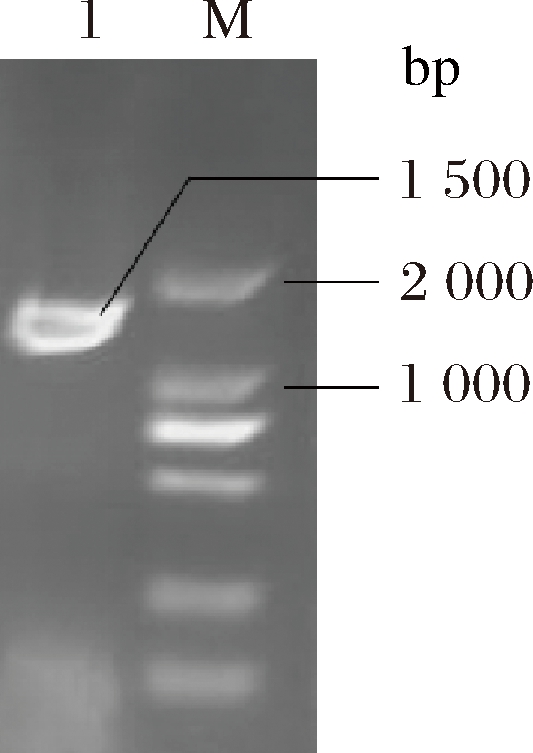
1-D16 16S rDNA扩增产物;M-BM2000+DNA Marker
图1 D16 16S rDNA的PCR扩增产物电泳图
Fig.1 The 16S rDNA amplification product of D16
由图1可知,PCR产物的测序片段长1 500 bp,具有典型的16S rDNA的特征。经GenBank比对分析发现,菌株D16与植物乳杆菌(Lactobacillus plantarum)亲缘关系最近,同源性达到99%,因此将D16鉴定为植物乳杆菌。
研究发现,氧化应激与肥胖、心血管疾病有着密切的关联[33-34]。因此,基于前面体外降解胆固醇和甘油三酯实验的基础上,对其体外抗氧化能力进行研究,并与市售的4株商业化乳酸菌进行对比。由表5可知,菌株D16与4株商业化乳酸菌均有一定的DPPH自由基清除能力,但D16的无细胞提取液DPPH清除率显著大于保加利亚乳杆菌、干酪乳杆菌、嗜热链球菌和植物乳杆菌(P<0.05),达到了37.9%; ABTS自由基清除率同样显著大于保加利亚乳杆菌、干酪乳杆菌、嗜热链球菌和植物乳杆菌(P<0.05),且清除能力差异较大,达到了84.74%;菌株D16与商业化乳酸菌均有一定的铁还原能力,但其铁还原能力差异不大,其中菌株D16与保加利亚乳杆菌的铁还原能力没有显著差异(P>0.05)。综合上述3个抗氧化指标,得出D16的抗氧化能力高于其他4种商业化乳酸菌。吴均[34]从耗牛酸乳中分离得到7株乳酸菌,其无细胞提取液的DPPH自由基清除率最高为29.69%;ABTS自由基清除率最高为35.43%;FRAP值最高为14.68 μmol FeSO4/mL样品。吴石金等[35]从传统发酵蔬菜中筛选等到34株乳酸菌中,其无细胞提取物的DPPH自由基清除率最高约为28%。因此D16的抗氧化能力相对较高。
表5 体外抗氧化能力实验结果
Table 5 Antioxidant activity of lactic acid bacteria
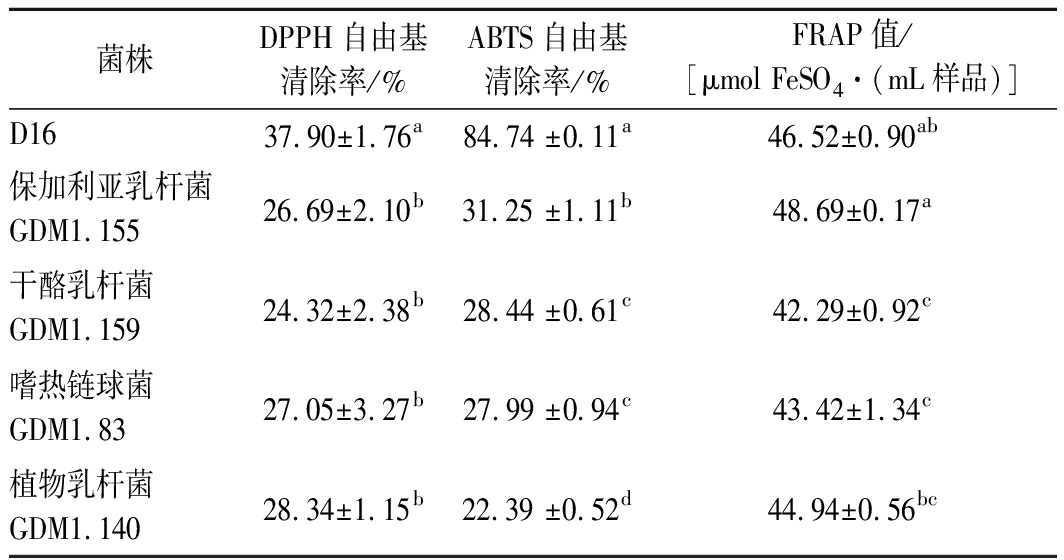
菌株DPPH自由基清除率/%ABTS自由基清除率/%FRAP值/[μmol FeSO4·(mL样品)]D1637.90±1.76a 84.74 ±0.11a46.52±0.90ab保加利亚乳杆菌GDM1.15526.69±2.10b 31.25 ±1.11b48.69±0.17a干酪乳杆菌GDM1.15924.32±2.38b 28.44 ±0.61c42.29±0.92c嗜热链球菌GDM1.8327.05±3.27b27.99 ±0.94c43.42±1.34c植物乳杆菌GDM1.14028.34±1.15b 22.39 ±0.52d44.94±0.56bc
本研究从云南传统发酵食品乳饼中分离乳酸菌,经体外降血脂能力初筛,体外胃肠模拟环境耐受性、抑菌及抗药性复筛,最终筛选得到1株体外降血脂能力及耐酸耐胆盐能力较强的植物乳杆菌D16,该菌株对大肠杆菌、金黄色葡萄球菌和铜绿假单胞杆菌均有一定的抑制作用,且对多种抗生素药物具有敏感性;在此基础上,本研究对该菌株与几种商业菌株的抗氧化性能进行比较研究,结果发现,植物乳杆菌D16的DPPH自由基清除能力及ABTS自由基清除能力均显著高于商业化乳酸菌(P<0.05),铁还原能力接近于其他菌株。
通过与其他文献报道和商业菌株的比较,菌株D16的降低胆固醇和甘油三酯能力、环境适应能力和抑制致病菌、敏感性、抗氧化能力较好,具有开发为益生产品的潜能。菌株D16的功能活性是否与云南特殊的高原环境、羊乳原料以及特殊的加工工艺有关,相比市场上众多的各种成熟商业化菌株,其益生功能和发酵性能如何,由于实验条件和时间限制,本论文并未进行深入和广泛的对比评估。另外虽然D16具有较好的体外功能活性,但是其经过胃肠道消化吸收后的体内降血脂、抗氧化等作用能力也尚不可知。因此,本课题组下一步拟对其发酵能力进行评估并对其体内功能活性进行深入研究。
乳酸菌是食品工业中重要微生物资源,在食品、生物、医药等领域具有广阔的应用前景。鉴于我国丰富的发酵食品种类和悠久的历史,从传统发酵食品中筛选具有良好降血脂和抗氧化功能的乳酸菌,对丰富我国益生菌种类、挖掘和开发传统发酵食品资源有重要意义。
[1] 诸骏仁, 高润霖, 赵水平, 等. 中国成人血脂异常防治指南(2016年修订版)[J]. 中国循环杂志, 2016,31(10):937-953.
[2] JIA H, REN S, WANG X. Heat-Killed probiotic regulates the body's regulatory immunity to attenuate subsequent experimental autoimmune arthritis[J]. Immunology Letters, 2019,216:89-96.
[3] CAVALCANTE R G S, DE ALBUQUERQUE T M R, de LUNA FREIRE M O, et al. The probiotic Lactobacillus Fermentum 296 attenuates cardiometabolic disorders in high fat diet-treated rats[J]. Nutrition, Metabolism and Cardiovascular Diseases, 2019,29(12):1 408-1 417.
[4] SHI Y, CUI X, GU S, et al. Antioxidative and probiotic activities of lactic acid bacteria isolated from traditional artisanal milk cheese from northeast china[J]. Probiotics and Antimicrobial Proteins, 2019,11(4):1 086-1 099.
[5] HEYDARI Z, RAHAIE M, ALIZADEH A M, et al. Effects of Lactobacillus Acidophilus and Bifidobacterium Bifidum probiotics on the expression of microRNAs 135B, 26B, 18A and 155, and their involving genes in mice colon cancer[J]. Probiotics and Antimicrobial Proteins, 2019,11(4):1 155-1 162.
[6] SEO D J, JUNG D, JUNG S, et al. Inhibitory effect of lactic acid bacteria isolated from kimchi against murine norovirus[J]. Food Control, 2020,109:106 881.
[7] MUHIALDIN B J, ALGBOORY H L, KADUM H, et al. Antifungal activity determination for the peptides generated by Lactobacillus Plantarum TE10 against Aspergillus Flavus in maize seeds[J]. Food Control, 2020,109:106 898.
[8] ONBAS T, OSMANAGAOGLU O, KIRAN F. Potential properties of Lactobacillus Plantarum f-10 as a bio-control strategy for wound infections[J]. Probiotics and Antimicrobial Proteins, 2019,11(4):1 110-1 123.
[9] VEMURI R, GUNDAMARAJU R, ERI R. Role of lactic acid probiotic bacteria in IBD[J]. Curr Pharm Des, 2017,23(16):2 352-2 355.
[10] GENG D, LIANG T, YANG M, et al. Effects of Lactobacillus combined with semidry flour milling on the quality and flavor of fermented rice noodles[J]. Food Research International, 2019,126:108 612.
[11] LICANDRO H, HO P H, NGUYEN T K C, et al. How fermentation by lactic acid bacteria can address safety issues in legumes food products?[J]. Food Control, 2020,110:106 957.
[12] DUAN X, DUAN S, WANG Q, et al. Effects of the natural antimicrobial substance from Lactobacillus Paracasei FX-6 on shelf life and microbial composition in chicken breast during refrigerated storage[J]. Food Control, 2020,109:106 906.
[13] 周玲仙, 吴少雄, 殷建忠, 等. 云南特产乳扇、乳饼营养成分分析及评价[J]. 中国乳品工业, 2008,36(6):34-35.
[14] 王昱敬, 黄艾祥, 刘雪英, 等. 德宏水牛乳饼中乳酸菌的分离鉴定及发酵性能研究[J]. 食品工业科技, 2017,38(2):226-230, 245.
[15] 马青雯, 王馨聆, 王昱敬, 等. 山羊乳饼中乳酸菌的分离鉴定及优良乳酸菌的初步筛选[J]. 中国乳品工业, 2018,46(3):8-12.
[16] 杨玉森, 潘红梅, 殷建忠, 等. 云南撒尼地区乳饼及酸乳清中优良乳酸菌的筛选和发酵性能研究[J]. 现代食品科技, 2015,31(11):107-112.
[17] 王友湘, 陈庆森, 阎亚丽. 用于乳酸菌分离鉴定的几种培养基的筛选及应用[J]. 食品科学, 2007,28(9):374-378.
[18] 杜鹏. 乳品微生物学实验技术[M]. 北京: 中国轻工业出版社, 2008: 256.
[19] 陈大卫. 辅助降血脂益生乳酸菌的筛选及其对高血脂大鼠肠道菌群的影响[D]. 扬州: 扬州大学, 2015.
[20] GB/T 5009. 128—2016 食品中胆固醇的测定[S]. 北京: 中国标准出版社, 2003.
[21] 刘宁. 降血脂益生菌选育及其特性研究[D]. 合肥: 合肥工业大学, 2007.
[22] BONATSOU S, KARAMOUZA M, ZOUMPOPOULOU G, et al. Evaluating the probiotic potential and technological characteristics of yeasts implicated in Cv. Kalamata natural black olive fermentation[J]. International Journal of Food Microbiology, 2018,271:48-59.
[23] 王俊国. 降胆固醇益生乳杆菌的筛选及其降胆固醇作用的研究[D]. 呼和浩特: 内蒙古农业大学, 2008.
[24] 马欢欢, 林洋, 吕欣然, 等. 96孔板法筛选抗黑曲霉性乳酸菌及抑菌机理研究[J]. 食品工业科技, 2017,38(12):171-175.
[25] 冯大伟, 周家春. 益生乳酸菌的纸片扩散法药敏性试验评价[J]. 微生物学通报, 2010,37(3):454-464.
[26] AFIFY A E M M R, ROMEILAH R M, SULTAN S I M, et al. Antioxidant activity and biological evaluations of probiotic bacteria strains[J]. Scholar cu edu eg, 2012,4(6):131-139.
[27] SHARMA K, ATTRI S, GOEL G. Selection and evaluation of probiotic and functional characteristics of autochthonous lactic acid bacteria isolated from fermented wheat flour dough babroo[J]. Probiotics and Antimicrobial Proteins, 2019,11(3):774-784.
[28] 韩雪, 王毕妮, 张富新, 等. 不同乳酸菌发酵对红枣浆游离态酚酸及其抗氧化性的影响[J]. 食品与发酵工业, 2018,44(3):121-127.
[29] 陈仪婷, 张红星, 谢远红, 等. 降胆固醇乳酸菌的筛选鉴定及其耐酸耐胆盐性能研究[J]. 食品与发酵工业, 2018,44(5):29-33.
[30] 马长路, 焦梦丽, 罗红霞, 等. 传统东北酸菜中乳杆菌的分离鉴定及其降胆固醇特性研究[J]. 食品研究与开发, 2019,40(21):209-213.
[31] 陈大卫, 刘莎莎, 黄玉军, 等. 具有潜在抑制肠道致病菌能力的乳酸菌的筛选[J]. 安徽农业科学, 2017,45(36):78-80.
[32] 路则宝, 王靓贤, 姬志林, 等. 具抑菌活性乳酸菌筛选及抑菌活性物质分析[J]. 江苏农业科学, 2019,47(6):170-173.
[33] BOGERS R P, BEMELMANS W J E, HOOGENVEEN R T, et al. Association of overweight with increased risk of coronary heart disease partly independent of blood pressure and cholesterol levels: A meta-analysis of 21 cohort studies including more than 300 000 persons[J]. Archives of Internal Medicine, 2007,167(16):1 720-1 728.
[34] 吴均. 牦牛酸乳中优良乳酸菌的筛选鉴定及发酵酸乳抗氧化特性研究[D]. 重庆: 西南大学, 2014.
[35] 吴石金, 张嘉琳, 陈彦霖, 等. 发酵食品中抗氧化乳酸菌的筛选与鉴定[J]. 浙江工业大学学报, 2019,47(6):685-691.