2018年贵州省蓝莓种植面积及产量达到1.5 km2和7.2万t,占全国总量的27%和39%,跃居全国第一[1]。高附加值的蓝莓果酒因其在酿造期间,随着糖酵解EMP等的发生,糖类物质逐渐被消耗,酒精发酵主副产物积累,使其逐渐形成自己的独特风味。MENDES-FERREIRA等[2]研究结果促进了消费者对其营养保健和功能特性的关注,使其在果酒市场备受青睐。BARNES等[3]鉴定出野生型高丛蓝莓含25种花青素,而在蓝莓酒中,花青素与糖类以糖苷键结合而形成花色苷,张杨等[4]研究表明蓝莓果经过发酵所得蓝莓酒中仍含有丰富的花色苷,SU等[5]对蓝莓花青素抗氧化活性进行的评价,使越来越多的人着手蓝莓果酒的生产开发,但随着发酵进行花色苷逐渐下降,多酚类化合物与蛋白质、多糖等大分子物质结合或吸附,酵母次级代谢产物等因素也会导致酒液中总酚下降[6-7]。
目前蓝莓果酒多以鲜果酿造,或采用后期酒精勾兑的方法加工而成,造成生产受到季节限制,面临品质的降低和同质化,且目前工艺优化主要指标为酒精度。本次试验以蓝莓原汁为原料,试图打破时间限制,并在前期所筛酵母的基础上开展以接种量、发酵温度、SO2添加量、初糖浓度为主要工艺参数的单因素试验,通过对发酵期间还原糖变化规律及发酵结束后的残糖、可滴定酸、酒精度、感官评分、花色苷、总酚、总抗氧化能力等指标的测定,初步探究其对发酵蓝莓果酒的影响,并在此基础上,以花色苷保存率为响应值,通过响应面优化试验回归模型系数的显著性检验,筛选出尽可能多地保留有效成分、减少活性物质在加工环节流失的工艺参数组合,在确定可实施蓝莓果酒最佳发酵工艺条件的同时,也为其营养保健性能的开发提供一定参考。
JK10酵母,烟台帝伯仕公司;纯净水,飞龙雨实业有限公司;蓝莓汁、苹果汁,市售100%纯果汁。
葡糖糖、NaOH,成都金山化学试剂有限公司;3,5-二硝基水杨酸溶液,国药集团化学试剂有限公司;色谱纯乙醇,科密欧化学试剂有限公司。
PHS-3C精密酸度计,上海大普仪器有限公司;synergy H4酶标仪,BioTek美国伯腾仪器有限公司;7890A-G3440AGC气相色谱仪,HP-INNOWAX色谱柱(30 m×0.25 mm×0.25 μm),美国安捷伦;SB-B30002精密电子天平,盛博电子衡器有限公司。
1.3.1 检测方法
还原糖采用3,5-二硝基水杨酸法[8];总酸参照GB/T32783-2016《蓝莓酒》[9];花色苷采用pH示差法[10-11];总抗氧化能力采用比色法[12];总酚采用福林酚法测[13];酒精度:气相色谱法[14]。
1.3.2 感官评定
以本院有品酒基础的20名学生为参评人员,并对其进行市售蓝莓果酒的感官辨识度进行培训,参照以GB/T 15038—2006《葡萄酒、果酒通用分析方法》[15-16]为原型的蓝莓果酒感官评分标准进行百分制的感官评分,数值越大感官评价越高,评分标准如表1所示。
1.4.1 蓝莓果酒加工工艺流程及操作要点
蓝莓果酒加工工艺流程如下:
表1 蓝莓果酒感官评分标准
Table 1 Sensory evaluation standards of blueberry wine

项目评价标准分值/分紫红色、悦目8.5~10色泽(10)宝石红色、光泽度好5~8.5砖红色、色泽一般1.5~5外观(20)呈暗棕红色、无光泽、色泽不良0~1.5清澈、透亮8.5~10澄清程度澄清度良好、明亮5~8.5(10)较澄清、极少细微悬浮物1.5~5浑浊、悬浮物较多0~1.5香气浓郁,怡人悠长25.5~30香气(30)香气清晰、果香与酒香较协调15~25.5酒香协调、香气单薄4.5~15香气滋味酵母或酸败味、怪味0~4.5(60)酒体丰满、纯正优雅、爽净、25.5~30滋味(30)酒体较完整,适口,15~25.5酸涩味稍重,滋味平淡4.5~15异味、过酸、过涩、口感黏腻0~4.5蓝莓特有风味、饱满纯正、爽口17~20典型性蓝莓特有风格、整体和谐10~17(20)果香明显、但蓝莓风味不突出3~10无特征果香风格0~3
发酵液调配:以蓝莓原汁为原料,苹果汁调糖至250g/L并以纯净水稀释;
调硫:以50 mg/L添加量用焦亚硫酸钾调硫,4~8 h后接种酵母;
接种:干酵母JK10用量为0.34 g/L[16],加入10倍体积的0.5%蔗糖水,30~37 ℃活化15~20 min,接种活化好的酵母种子液,适当搅拌并增加溶氧量;
发酵:将样品置于25 ℃恒温培养箱发酵,纱布封口发酵至发酵液有酒精味产生,或酵母活菌数约为107CFU/mL,期间适当搅拌,以带单向阀的硅胶塞取代纱布继续发酵;发酵过程以还原糖为监测指标,每天1次,当还原糖含量≤10 g/L或检测数据连续3次基本保持稳定时,视作发酵终点;
过滤:发酵液使用滤膜为120目的过滤机过滤;
装瓶:将过滤后的果酒迅速装瓶,16℃低温存放。
1.4.2 单因素设计
依照1.4.1进行发酵试验并按如下单因素进行相关参数的替换。
分别以0.1、0.3、0.6、0.9、1.2 g/L的酵母接种量;19、22、25、28 ℃的发酵温度, 190、220、250、280、310 g/L的初糖质量浓度;0、50、100、150、200 mg/L的SO2添加量为发酵蓝莓果酒主影响因子,以发酵结束的总酸、酒精度、残糖、总抗氧化能力及发酵前后花色苷、总酚保存率为评价指标。
1.4.3 响应面设计
在单因素基础上,确定Box-Behnken设计的自变量,以花色苷保存率为响应值,通过响应面优化试验回归模型系数的显著性检验,筛选出合适的工艺参数组合,试验因素水平编码设计如表2所示。
表2 响应面分析因素与水平
Table 2 Factors and levels of the response surface
methodology

编码水平试验因素A(发酵温度)/℃B(接种量)/(g·L-1)C(初糖浓度)/(g·L-1)D(SO2添加量)/(mg·L-1)-1220.122000250.3250501280.6280100
采用Design-Expert 8.0.6软件进行试验设计, 采用OriginPro 8.0、Graphpad、SPSS软件进行作图和数据分析,P<0.05,差异显著,结果以平均值±标准差表示。
拟合标准曲线为:葡糖糖标曲:y=2.793x-0.041,R2=0.999 3;总酚标曲:y=1 694.6x-135.42,R2=0.998 9;乙醇标曲:峰面积=792.673 94×Amt-286.402 27,R2=0.999 5;
2.1.1 酵母接种量对蓝莓果酒的影响
果酒发酵最主要环节是在酵母作用下,EMP酵解生成丙酮酸,并在无氧条件下经脱羧酶脱羧生成乙醛,再由乙醛脱氢酶还原成乙醇的过程[17],故酵母添加量影响着发酵周期和发酵进程。当酵母添加量过多,酵母大量繁殖,一方面自身养分需求消耗大量营养物质,导致生成酒精底物减少,酒精产量降低;另一方面,代谢的大量副产物影响发酵过程,增强“酵母”味,并且还会存在过量添加导致发酵提前终止不利风味物质形成的风险。酵母添加量过少,一方面无法保证酒精积累、残糖量过高;另一方面较长发酵迟滞期使发酵周期延长,增加杂菌污染机率;因此适合的酵母添加量直接影响成品酒质量。
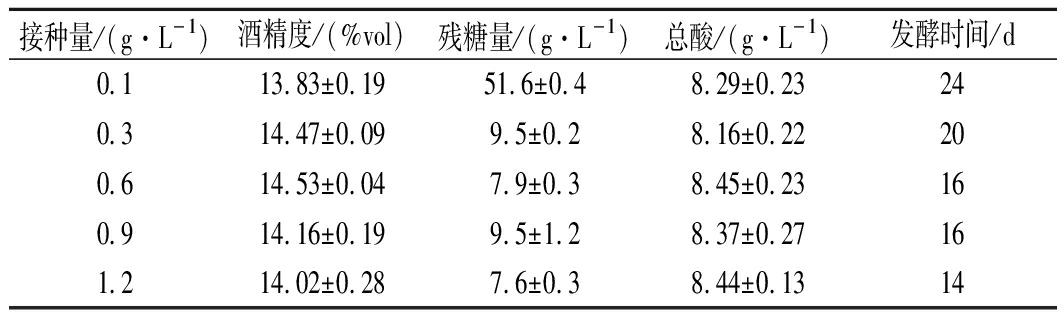
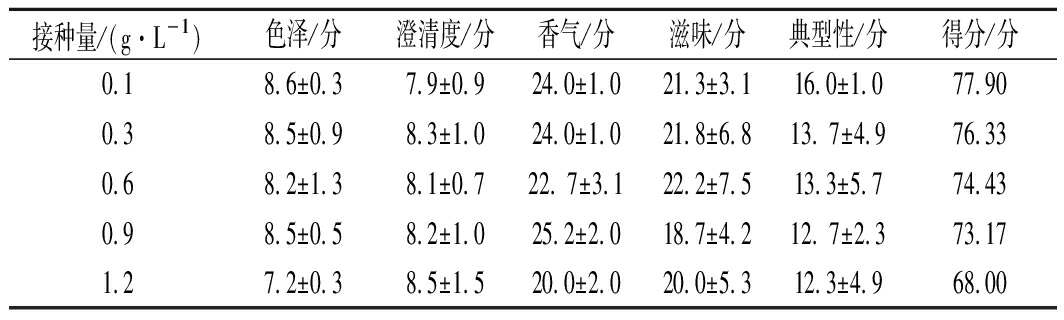
由图1可知,发酵液前期, 0.1 g/L接种量出现起酵慢且下降缓慢现象,导致发酵周期拉长;发酵后期,糖的消耗速度逐渐减缓,最终出现接种量和发酵周期负相关结果;由表3可知,0.3 g/L接种量的酒精度仅低于0.6 g/L,因此前者酵母利用率更好,残糖量及总酸也最低;由图2可知,随着酵母接种量增多花色苷保存率逐渐下降,这也与BOIDO等[18]提出的酿酒酵母细胞壁能够吸附降低果酒单体花青素含量、严红光[19]发现的发酵过程中细胞壁吸收的单体花青素含量可达酒体总花青素质量的1%~3%相吻合,0.1 g/L的接种量残糖量最高,但保存率也最高,而0.3 g/L接种量保存率与其差异不显著;抗氧化能力、总酚保存率与接种量大致呈负相关,与ESCVDERO- PEZ等[20]报道的酵母后期产生大量次级代谢产物,其多酚类化合物与蛋白质、多糖等大分子物质结合或吸附,使致酒液中总酚下降的研究结果一致,另外,花青素、总酚等多酚物质不稳定,随着发酵时间的推移,逐渐分解、失去原有特性,也解释了本次试验保存率与发酵周期呈现的负相关;就表4也可以看出,酵母添加量越多其色泽分值也相对降低,综合认为本次试验0.3g/L接种量最适。
PEZ等[20]报道的酵母后期产生大量次级代谢产物,其多酚类化合物与蛋白质、多糖等大分子物质结合或吸附,使致酒液中总酚下降的研究结果一致,另外,花青素、总酚等多酚物质不稳定,随着发酵时间的推移,逐渐分解、失去原有特性,也解释了本次试验保存率与发酵周期呈现的负相关;就表4也可以看出,酵母添加量越多其色泽分值也相对降低,综合认为本次试验0.3g/L接种量最适。
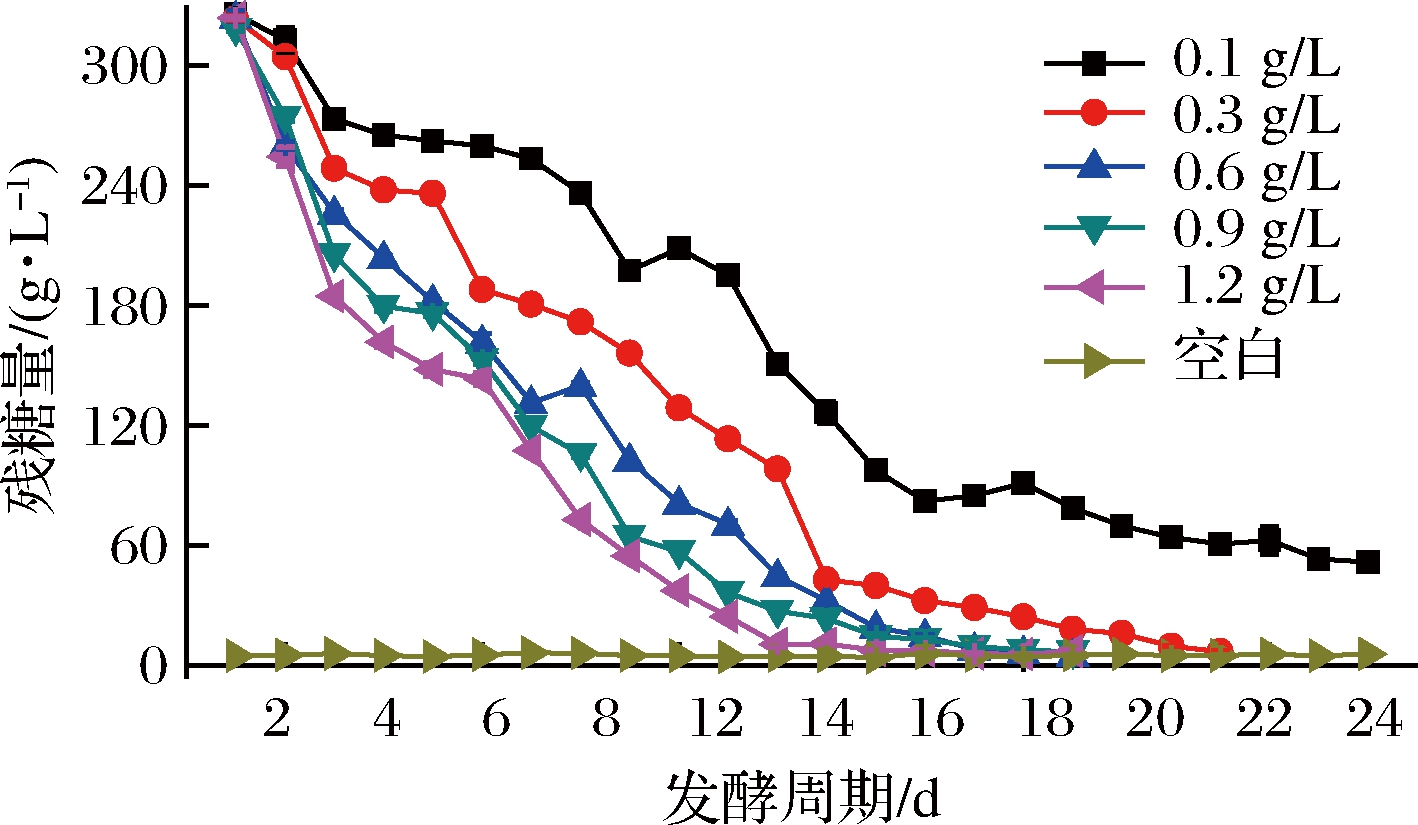
图1 发酵过程降糖进程
Fig.1 The process of reducing sugar content
during fermentation
表3 酵母接种量对蓝莓果酒影响-理化指标
Table 3 Effects of yeast inoculation on blueberry
wine-physicochemical indicators
接种量/(g·L-1)酒精度/(%vol)残糖量/(g·L-1)总酸/(g·L-1)发酵时间/d0.113.83±0.1951.6±0.48.29±0.23240.314.47±0.099.5±0.28.16±0.22200.614.53±0.047.9±0.38.45±0.23160.914.16±0.199.5±1.28.37±0.27161.214.02±0.287.6±0.38.44±0.1314
表4 蓝莓果酒感官评定结果
Table 4 Results of sensory evaluation of blueberry wine
接种量/(g·L-1)色泽/分澄清度/分香气/分滋味/分典型性/分得分/分0.18.6±0.37.9±0.924.0±1.021.3±3.116.0±1.077.900.38.5±0.98.3±1.024.0±1.021.8±6.813. 7±4.976.330.68.2±1.38.1±0.722. 7±3.122.2±7.513.3±5.774.430.98.5±0.58.2±1.025.2±2.018.7±4.212. 7±2.373.171.27.2±0.38.5±1.520.0±2.020.0±5.312.3±4.968.00
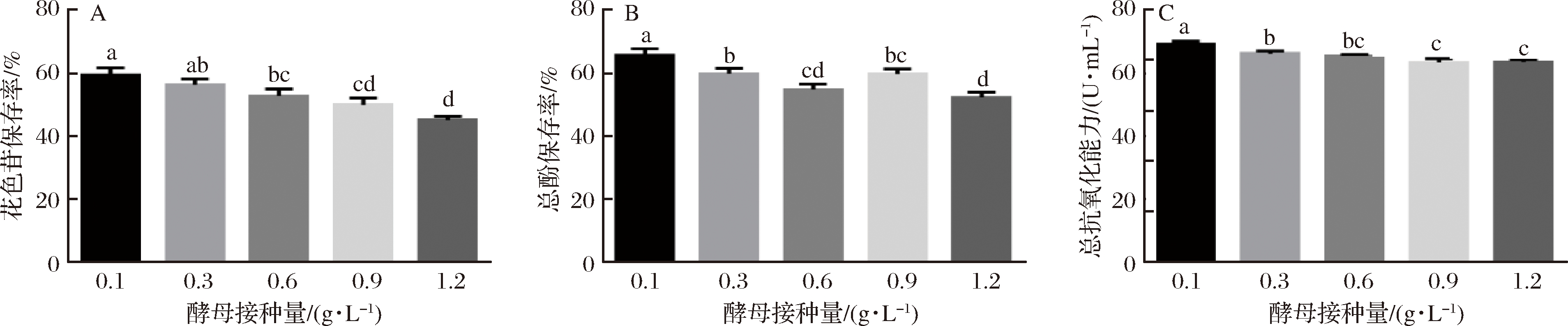
A-花色苷保存;B-总酚保存率;C-总抗氧化能力
图2 接种量对花色苷-总酚-总抗氧化能力的影响
Fig.2 Effect of yeast inoculation on the anthocyanins,total phenol and total antioxidant capacity
注:不同小写字母表示差异显著(P<0.05)(下同)
2.2.2 发酵温度对蓝莓果酒的影响
温度是影响酵母生长、繁殖与发酵的主要环境因素。温度过高,一方面酵母迅速繁殖,细胞衰老速度加快,容易出现酵母过早衰老,同时也会造成果香挥发,氧化损失加大[21];另一方面酵母生化反应属于放热反应,产生的大量热量及CO2未及时释放,引起高级醇、挥发酸、醛类等副产物增加。温度过低,一方面酵母起酵慢,延迟发酵周期;另一方面,酶活也会受到一定程度影响,不利于酒精及其他香气成分的积累[22],降低果酒品质。
由图3可知,发酵初期出现含糖量降低又回升的现象,可能是由于发酵液中的蔗糖还未分解成具有还原性的糖类,因此未能检测出而导致还原糖数值较低;而后,发酵液中的蔗糖、纤维素等非还原性糖通过水解生成相应的还原性单糖,从而又被重新检测出现,使还原糖含量数值有所增加。由表5可知,19℃的残糖量较高,28℃的酒精度最低,此现象证实了发酵温度高低对发酵结果产生的影响;由图4可知,随着发酵温度升高花色苷保存率逐渐下降,与刘小莉等[23]的研究结果相互佐证,22℃下,花色苷、总酚保存率及总抗氧化能力虽然高于25℃的,但降糖速度明显低于25℃,被污染的可能性及工厂生产成本将大大提高;由表6可知,低温下发酵酒样感官品评中典型性分值相对较高,一方面低温下风味损失较小,另一方面,高残糖量使原料残存较多从而典型性相对突出;考虑到酒精发酵和苹果酸-乳酸发酵同时进行,使剩余较多的发酵糖除了被乳酸菌发酵产生苹果酸外,还有可能形成乳酸、醋酸、甘露糖醇从而导致乳酸病的发生,因此综合认为本次试验25℃为最佳发酵条件。
2.2.3 初糖浓度对蓝莓果酒的影响
初糖浓度直接决定果酒酒精度,因为糖是酒精发
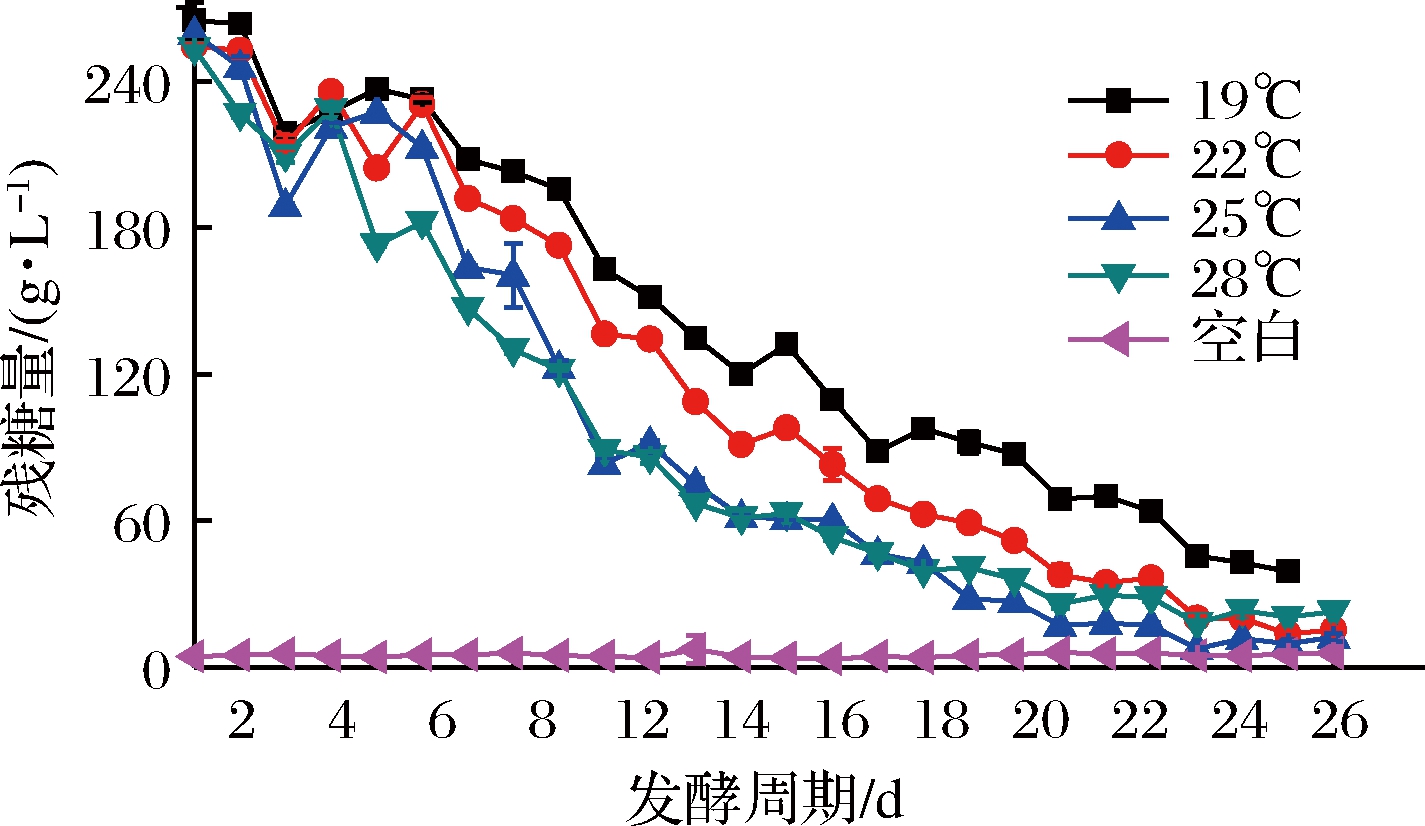
图3 发酵过程降糖进程(温度)
Fig.3 The process of reducing sugar content during
fermentation(temperature)
表5 发酵温度对蓝莓果酒的影响-理化指标
Table 5 Effects of temperature on blueberry
wine-physicochemical indicators
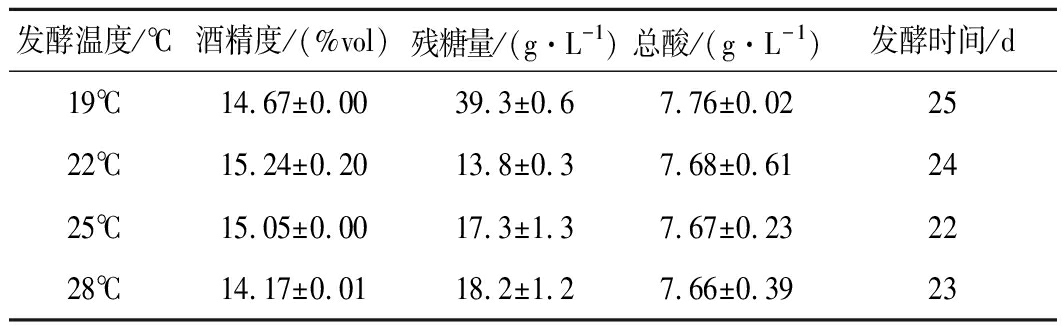
发酵温度/℃酒精度/(%vol)残糖量/(g·L-1)总酸/(g·L-1)发酵时间/d19℃14.67±0.0039.3±0.67.76±0.022522℃15.24±0.2013.8±0.37.68±0.612425℃15.05±0.0017.3±1.37.67±0.232228℃14.17±0.0118.2±1.27.66±0.3923
表6 蓝莓果酒感官评定结果
Table 6 Results of sensory evaluation of blueberry wine

发酵温度/℃色泽/分澄清度/分香气/分滋味/分典型性/分得分/分198.5±1.37.2±0.623.6±3.820.2±4.115.4±3.474.90227.1±2.58.2±0.822.3±3.020.9±2.614.9±1.973.40257.1±1.67.0±1.621.0±2.621.8±2.814.9±2.271.80285.9±1.07.6±1.520.8±2.618.8±2.213.8±3.066.90
酵和酯类物质的基质原料,也是酵母存活的能源物质[24],因此初糖过低达不到预期酒精度,也会造成酒体过于单薄。然而,初糖浓度过高,一方面葡萄糖阻遏和葡萄糖抑制作用会抑制酵母的繁殖代谢[25],同时高渗透压也会导致现有酵母因细胞水分流失而活性降低,导致残糖量较高,出现以胶体形式存在于酒体中的营养组分,因其自身高度分散的热力学不稳定体系,而产生酒体浑浊和沉底的现象;另一方面也会因发酵缪黏度较高出现CO2和热量释放缓慢,造成醋酸菌的大量繁殖[26],使挥发酸增加,酸化酒体。
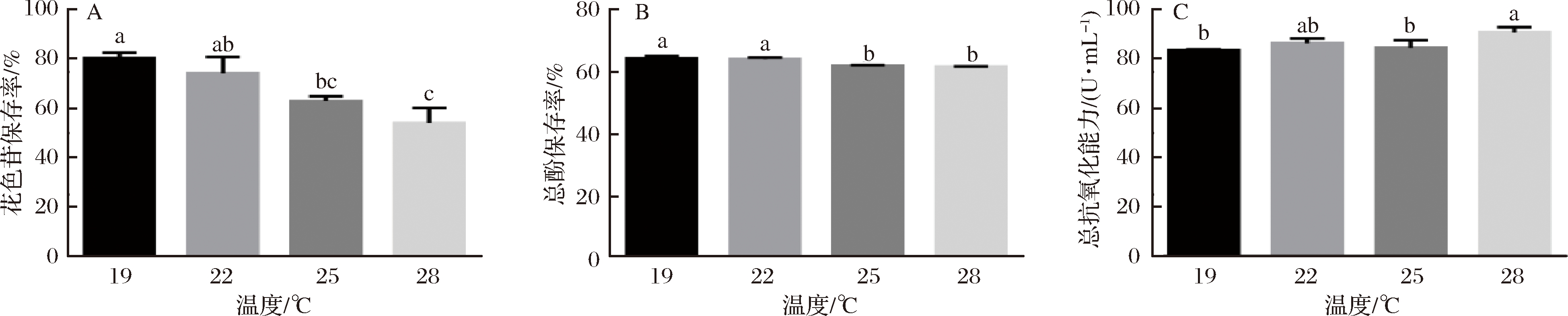
A-花色苷保存;B-总酚保存率;C-总抗氧化能力
图4 温度对花色苷-总酚-总抗氧化能力的影响
Fig.4 Effect of temperature on the anthocyanins,total phenol and total antioxidant capacity
由图5可知,310和280 g/L的初糖在发酵过程,降糖缓慢且残糖量较高,可能是高渗透压使酵母酒精转化能力受限,出现酒精度相对较低、残糖高的现象;由表7可知,190和220 g/L的初糖,其残糖量很低,同时发酵迅速并且发酵提前结束,导致糖类全部转化成酒精,而发酵过程中产生香气成分等物质的基质不足,造成酒体风味寡淡的现象,表8中190 g/L初糖的感官分值便证明了这一观点;另外,初糖310、280 g/L的酚类物质含量表现优异,由图6可知,250 g/L初糖的花色苷、总酚保存率与其差异不显著;结合酒精转化率和成本问题,综上,认为本次试验250 g/L的初糖为最佳浓度。
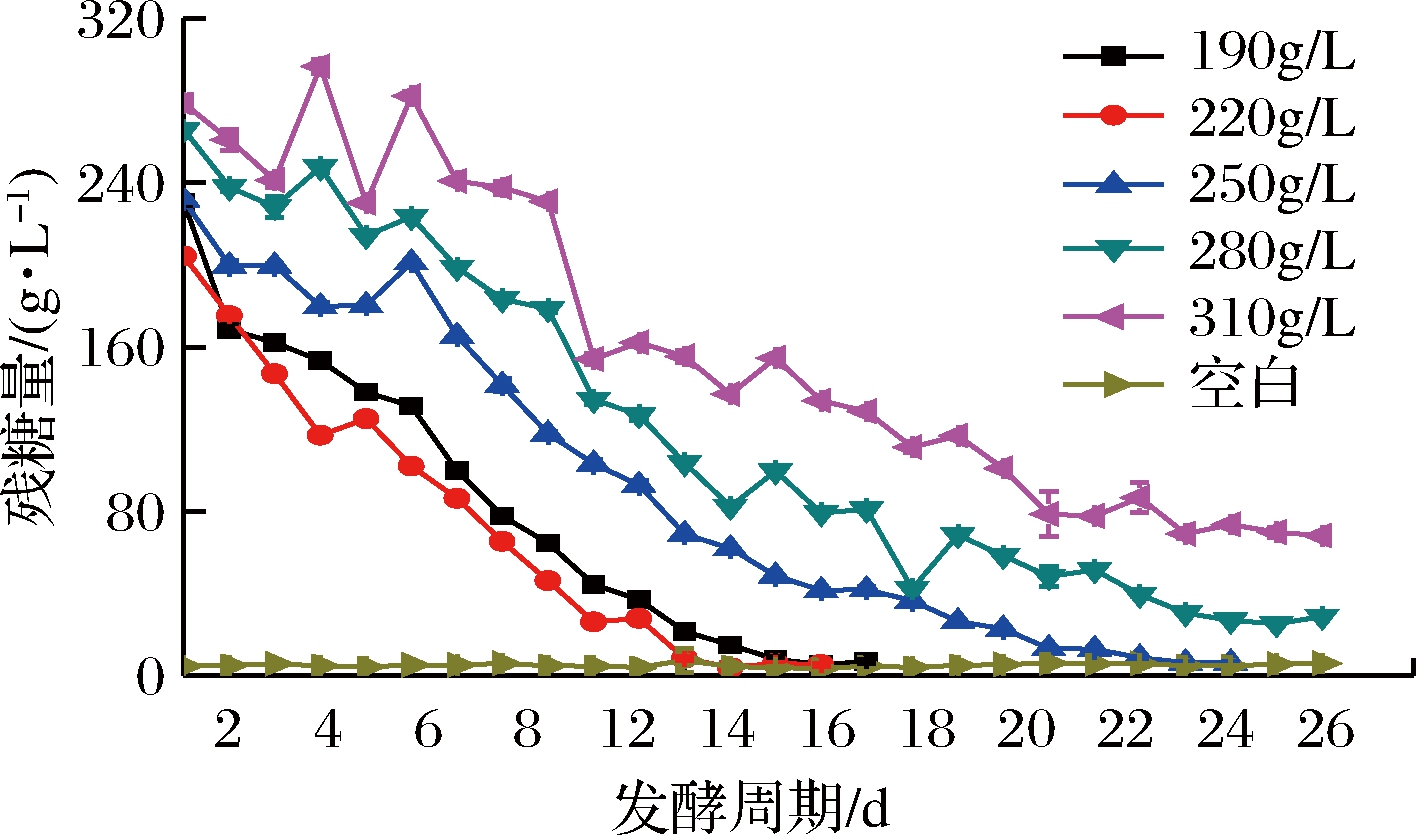
图5 发酵过程降糖进程
Fig.5 The process of reducing sugar content
during fermentation
表7 初始糖度对蓝莓果酒的影响-理化指标
Table 7 Effects of yeast inoculation on blueberry
wine-physicochemical indicators
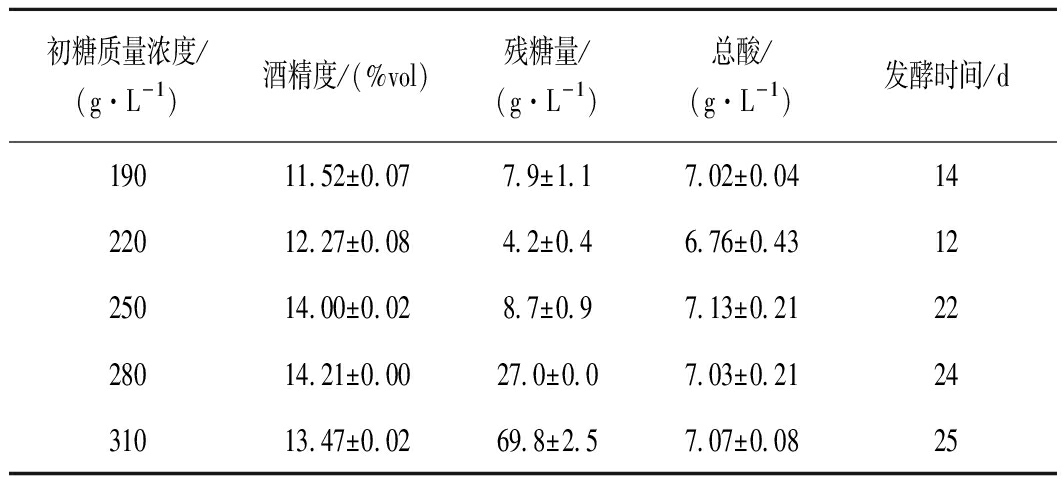
初糖质量浓度/(g·L-1)酒精度/(%vol)残糖量/(g·L-1)总酸/(g·L-1)发酵时间/d19011.52±0.077.9±1.17.02±0.041422012.27±0.084.2±0.46.76±0.431225014.00±0.028.7±0.97.13±0.212228014.21±0.0027.0±0.07.03±0.212431013.47±0.0269.8±2.57.07±0.0825
表8 蓝莓果酒感官评定结果
Table 8 Results of sensory evaluation of blueberry wine
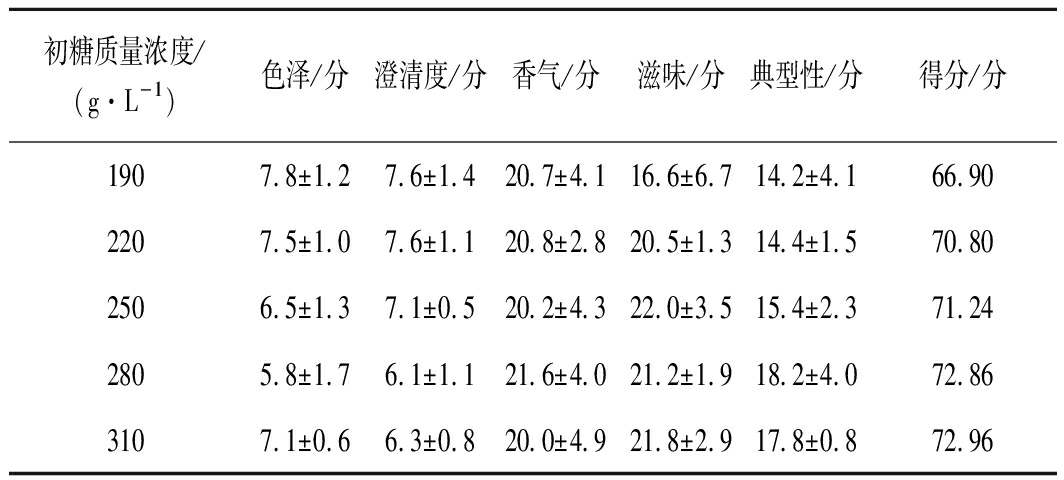
初糖质量浓度/(g·L-1)色泽/分澄清度/分香气/分滋味/分典型性/分得分/分1907.8±1.27.6±1.420.7±4.116.6±6.714.2±4.166.902207.5±1.07.6±1.120.8±2.820.5±1.314.4±1.570.802506.5±1.37.1±0.520.2±4.322.0±3.515.4±2.371.242805.8±1.76.1±1.121.6±4.021.2±1.918.2±4.072.863107.1±0.66.3±0.820.0±4.921.8±2.917.8±0.872.96

A-花色苷保存率;B-总酚保存率;C-总抗氧化能力
图6 初糖对花色苷-总酚-总抗氧化能力的影响
Fig.6 Effect of initial sugar on the anthocyanins,total phenol and total antioxidant capacity
2.2.4 SO2添加量对蓝莓果酒的影响
在果酒发酵过程中,适量的SO2不仅可以抑制有害微生物生长,还可起到抗氧化、溶解护色等作用。但SO2过量,不仅会中和化合物中游离羰基导致发酵迟缓[27],还会在基质中转化为酸,导致细胞中酸性可溶物质尤其是有机酸盐的溶解,致使发酵初期发酵液酸度升高[28];此外,过多游离SO2还会与花色苷在C4位置结合形成新的物质亚硫酸盐加合物,使蓝莓果酒中部分颜色消失[29]。SO2添加量不足时,一方面,不仅无法抑制杂菌生长,也无法抑制酒体中多酚氧化酶的活性,导致酒体氧化浑浊过早褐变[30];另一方面,在果酒发酵不完全或陈酿时,SO2与乙醛即使在有大量分子态氧存在的条件下也无法反应生成甘油,因此SO2的添加量对酒体风味起着重要作用,李小惠[22]的结果也显示SO2 的添加量对金刺梨糖腌发酵酒酒精度及总酯含量有一定的影响。
由图7可知,200和150的SO2添加量,其降糖速率相对缓慢,可能是蓝莓发酵缪本身酸度较高,额外添加过多SO2反而会起到副作用,这也与李华[13]研究表明的葡萄发酵繆酸度影响着SO2添加量的结果相似;图8中酚类物质及总抗氧化能力与SO2添加量存在大致正相关趋势,且该趋势在150 mg/L至200 mg/L添加量的跨度间有所减弱;由表9可知,0 mg/L的添加量发酵彻底,但可能发酵过程产酸细菌未能抑制使总酸含量最高;由表10可知,50 mg/L的添加量综合感官分值最高;而100 mg/L和50的添加量在花色苷、总酚保存率及总抗氧化能力方面差异不显著;考虑到蓝莓果酒本身酸度较高,SO2又可在基质中转化为酸,且促进细胞中酸性可溶物溶解的增酸机制[13],认为本次试验的最佳添加量为50 mg/L。
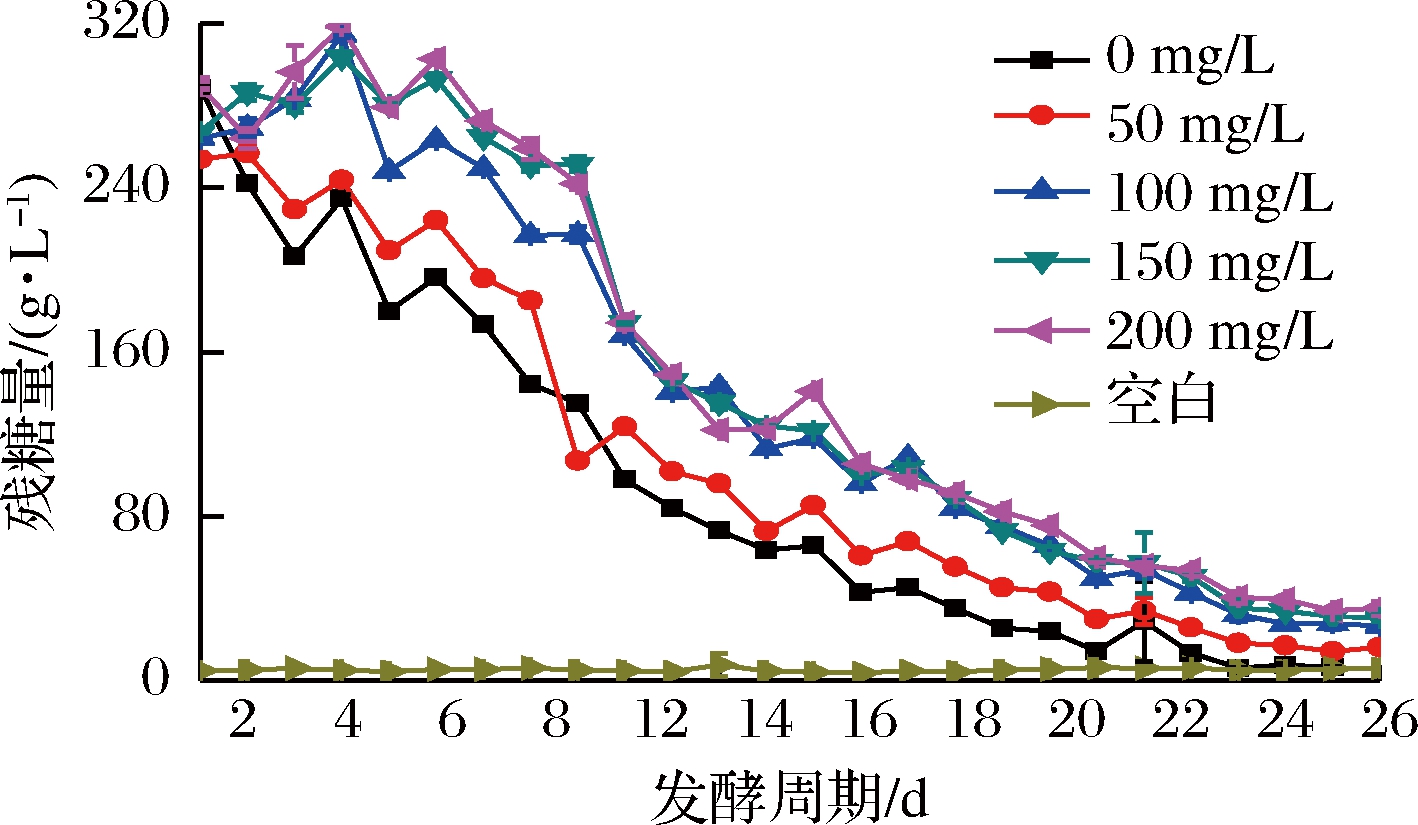
图7 发酵过程降糖进程
Fig.7 The process of reducing sugar content
during fermentation
表9 SO2添加量对蓝莓果酒理化指标的影响
Table 9 Effects of SO2 on blueberry
wine-physicochemical indicators

SO2添加量/(mg·L-1)酒精度/(%vol)残糖量/(g·L-1)总酸/(g·L-1)发酵时间/d015.42±0.355.9±0.37.87±0.17235014.84±0.2816.9±0.67.62±0.262410014.56±0.4127.5±0.07.83±0.132415013.77±0.3933.7±0.07.66±0.322420012.92±0.1133.9±0.97.62±0.2625
表10 蓝莓果酒感官评定结果
Table 10 Results of sensory evaluation of blueberry wine
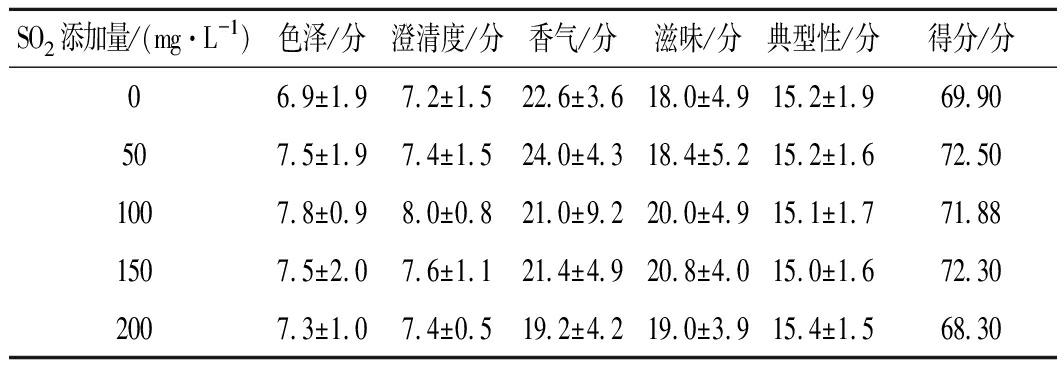
SO2添加量/(mg·L-1)色泽/分澄清度/分香气/分滋味/分典型性/分得分/分06.9±1.97.2±1.522.6±3.618.0±4.915.2±1.969.90507.5±1.97.4±1.524.0±4.318.4±5.215.2±1.672.501007.8±0.98.0±0.821.0±9.220.0±4.915.1±1.771.881507.5±2.07.6±1.121.4±4.920.8±4.015.0±1.672.302007.3±1.07.4±0.519.2±4.219.0±3.915.4±1.568.30

A-花色苷保存率;B-总酚保存率;C-总抗氧化能力
图8 SO2对花色苷-总酚-总抗氧化能力的影响
Fig.8 Effect of SO2 on the anthocyanins,total phenol and total antioxidant capacity
2.3.1 响应面模型的建立及方差分析
在单因素基础上,根据Box-Behnken中心组合试验设计原理,以花色苷保存率为响应值,通过响应面优化试验回归模型系数的显著性检验,筛选出合适的工艺参数组合,试验安排及结果如表11所示。
表11 响应面试验设计及结果
Table 11 Experimental design and results of the
response surface methodolog
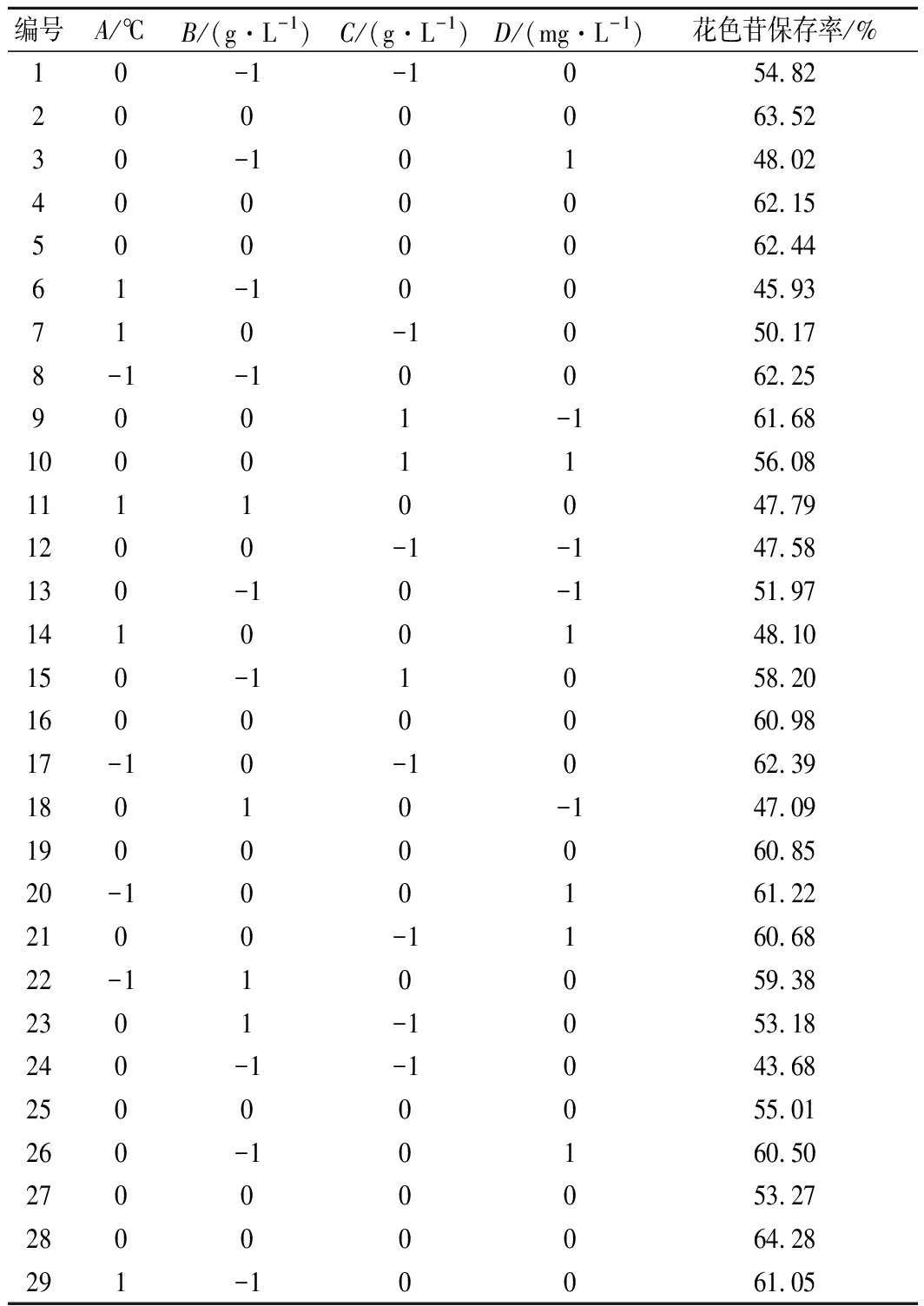
编号A/℃B/(g·L-1)C/(g·L-1)D/(mg·L-1)花色苷保存率/%10-1-1054.822000063.5230-10148.024000062.155000062.4461-10045.93710-1050.178-1-10062.259001-161.6810001156.0811110047.791200-1-147.58130-10-151.9714100148.10150-11058.2016000060.9817-10-1062.3918010-147.0919000060.8520-100161.222100-1160.6822-110059.382301-1053.18240-1-1043.6825000055.01260-10160.5027000053.2728000064.28291-10061.05
通过响应面优化试验回归模型的建立,得到蓝莓果酒中花色苷保存率多元二次回归方程: Y=61.99-6.61A+0.048B+2.29C+1.24D+1.18AB+0.74AC+0.93AD+1.12BC+2.53BD-4.68CD-3.17A2-5.39B2-0.12C2-5.77D2;由表12可知,失拟项不显著(P=0.284 1>0.05),花色苷保存率所选模型极显著(P<0.01),其中模型的一次项A、C、D对花色苷影响均为极显著(P<0.01);交互项BD、CD对花色苷影响均为极显著(P<0.01);二次项A2、B2、D2对花色苷影响均为极显著(P<0.01)。
由表13可知,回归方程的因变量和自变量之间的线性关系显著(R2=0.975 6),说明该模型可解释97%的响应值变化,变异系数较低(C.V=2.52%),说明试验重现性较好。得出蓝莓果酒发酵最佳工艺组合:发酵温度22.86℃,初糖浓度232.35 g/L,SO2添加量67.15 mg/L,接种量0.36 g/L,考虑到实际操作,修正为:发酵温度23 ℃,初糖浓度230 g/L,SO2添加量67 mg/L,接种量0.36 g/L。在此条件下花色苷保存率为64.4%,验证试验花色苷保存率为61.1%,相对偏差2.65%,说明该模型对蓝莓果酒发酵工艺中花色苷保存率做出了比较准确的预测。
表12 响应面方差分析结果
Table 12 ANOVA of response surface quadratic model
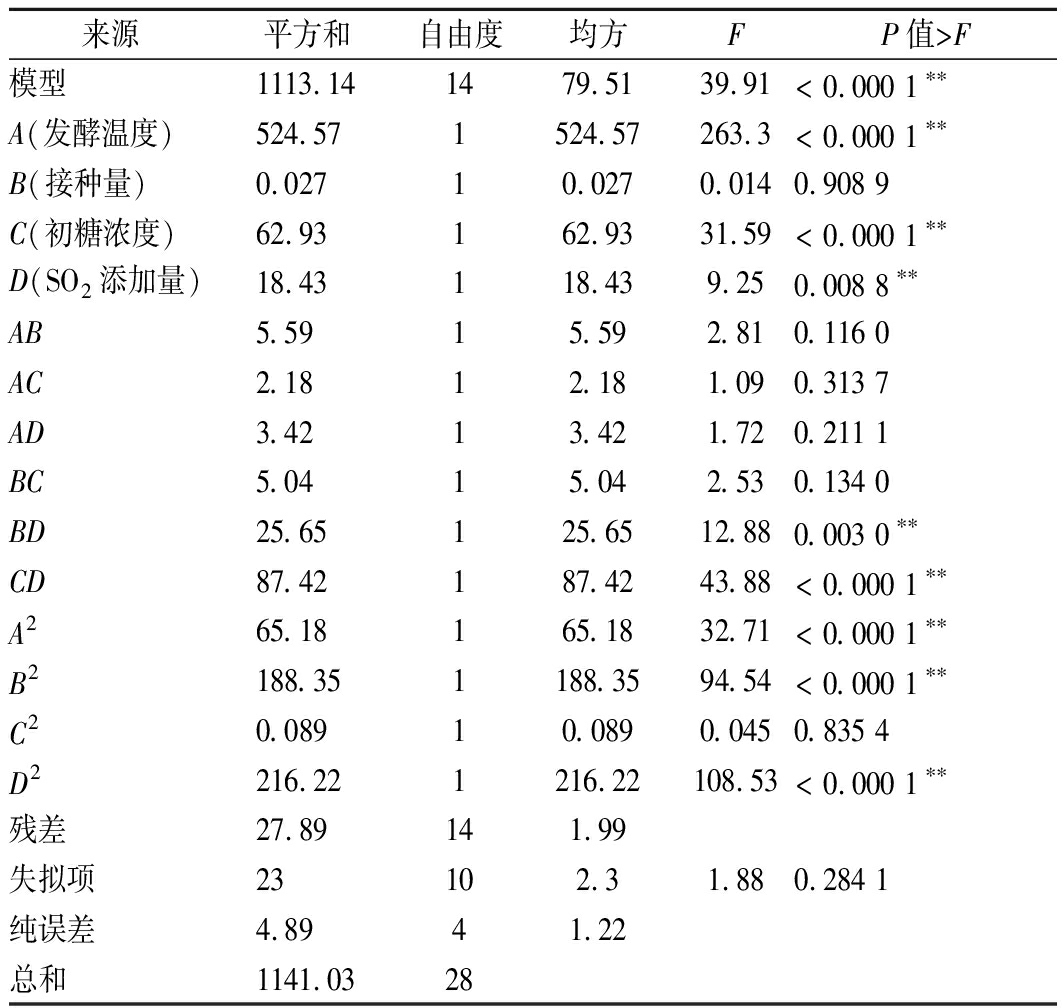
来源平方和自由度均方FP值>F模型1113.141479.5139.91< 0.000 1∗∗A(发酵温度)524.571524.57263.3< 0.000 1∗∗B(接种量)0.02710.0270.0140.908 9C(初糖浓度)62.93162.9331.59< 0.000 1∗∗D(SO2添加量)18.43118.439.250.008 8∗∗AB5.5915.592.810.116 0AC2.1812.181.090.313 7AD3.4213.421.720.211 1BC5.0415.042.530.134 0BD25.65125.6512.880.003 0∗∗CD87.42187.4243.88< 0.000 1∗∗A265.18165.1832.71< 0.000 1∗∗B2188.351188.3594.54< 0.000 1∗∗C20.08910.0890.0450.835 4D2216.221216.22108.53< 0.000 1∗∗残差27.89141.99失拟项23102.31.880.284 1纯误差4.8941.22总和1141.0328
注:*,统计结果差异显著(P<0.04),**,统计结果差异极显著(P<0.01)
表13 二次回归方程方差分祈
Table 13 Analysis of variance of the quadratic model
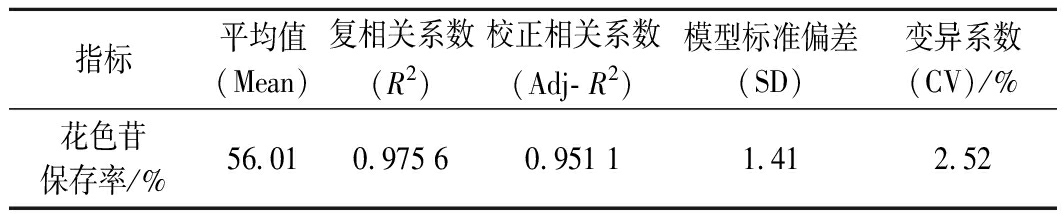
指标平均值(Mean)复相关系数(R2)校正相关系数(Adj- R2)模型标准偏差(SD)变异系数(CV)/%花色苷保存率/%56.010.975 60.951 11.412.52
通过单因素优化试验,及Design-Expert 8.0.6软件设计, 以发酵温度、接种量、初糖浓度及SO2添加量为自变量,花色苷保存率为响应值,对试验进行多元回归拟合。结合回归系数检验值F的大小可知,在所选试验范围内,得出影响花色苷保存率的因素依次为:A>C>D>B;筛选出发酵温度23℃、初糖浓度230 g/L、SO2添加量67 mg/L、接种量0.36 g/L为本次试验最佳工艺组合,也为尽可能多地保留有效成分、减少活性物质在加工环节的流失提供一定参考;但本次试验局限于实验室的初期摸索阶段,工业化生产还需通过逐级放大试验完成从实验室到工业化生产。
[1] 任艳玲,王涛,王瑞,等.贵州不同地区蓝莓灰霉病菌对5种杀菌剂敏感性测定[J].中国南方果树,2019,48(4):91-94.
[2] MENDES-FERREIRA A, COELHO E,BARBOSA C, et al.Production of blueberry wine and volatile characterization of young and bottle-aging beverages[J]. Food science & nutrition,2019,7(2): 617-627.
[3] BARNES J S, NGUYEN H P,SHEN S, et al. General method for extraction of blueberry anthocyanins and identification using high performance liquid chromatography-electrospray ionization-ion trap-time of flight-mass spectrometry[J]. Journal of Chromatography A, 2009, 1 216(23):4 728-4 735.
[4] 张杨,谢笔钧,孙智达.蓝莓酒渣、果、酒中花色苷成分鉴定及酒渣与果中花色苷抗氧化活性比较[J].食品科学,2016,37(2):165-171.
[5] SU M S,CHIEN P J. Antioxidant activity, anthocyanins, and phenolics of rabbiteye blueberry (Vaccinium ashei) fluid products as affected by fermentation[J]. Food Chemistry,2006,104(1):182-187.
[6] 饶炎炎,唐琳琳,陈思睿,等.红树莓果酒发酵过程中功效成分、香气物质及体外降血糖功效的动态变化[J/OL].食品科学:1-14[2020-01-05].http://kns.cnki.net/kcms/detail/11.2206.ts.20190710.0950.024.html.
[7] ESCUDERO-L PEZ B, CERRILLO I, HERRERO-MARJ
PEZ B, CERRILLO I, HERRERO-MARJ N G, et al. Fermented orange juice: Source of higher carotenoid and flavanone contents[J]. Journal of Agricultural and Food Chemistry, 2013, 61:8 773-8 782.
N G, et al. Fermented orange juice: Source of higher carotenoid and flavanone contents[J]. Journal of Agricultural and Food Chemistry, 2013, 61:8 773-8 782.
[8] 李环, 陆佳平, 王登进. DNS法测定山楂片中还原糖含量的研究[J]. 食品工业科技, 2013, 34(18):75-77.
[9] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.GB/T32783—2016蓝莓酒[S].北京:中国标准出版社, 2016.
[10] 张荣菲,王绍云.贵州黔东南蓝莓中花青素的提取与含量测定[J].中国食品添加剂,2016(11):190-194.
[11] 李金星,胡志和,马立志,等.蓝莓加工过程中出汁率及花青素的稳定性[J].食品科学,2014,35(2):120-125.
[12] 仇小妹,王英,董明盛,等.复合酶酶解对蓝莓出汁率及总抗氧化能力的影响[J].食品科学,2013,34(24):25-29.
[13] 叶新红. 不同处理方法对葡萄汁中多酚类物质溶出效果及抗氧化活性影响的研究[D]. 乌鲁木齐:新疆农业大学,2009.
[14] 唐开永,周鸿翔,刘彩婷,等.米酒中6种醇的气相色谱外标法测定研究[J].中国酿造,2019,38(4):183-187.
[15] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.GB/T 15038—2006 葡萄酒、果酒通用分析方法[S].北京:中国标准出版社, 2008.
[16] 刘彩婷,周鸿翔,王晓丹,等.八种商业酵母制备蓝莓苹果复合果酒的品质对比[J].中国酿造,2019,38(3):51-58.
[17] 李华,王华, 袁春龙.葡萄酒工艺学[M]. 北京:科学出版社,2007:76-77.
[18] BOIDO E, GARC A M MARINO, DELLACASSA E, et al. Characterisation and evolution of grape polyphenol profiles of Vitis vinifera L. cv. Tannat during ripening and vinification. Australian Journal of Grape and Wine Research 2011,17(3): 383-393.
A M MARINO, DELLACASSA E, et al. Characterisation and evolution of grape polyphenol profiles of Vitis vinifera L. cv. Tannat during ripening and vinification. Australian Journal of Grape and Wine Research 2011,17(3): 383-393.
[19] 严红光. 蓝莓生物学特性及生理活性物质研究[D].合肥:安徽农业大学,2012.
[20] ESCUDERO-L PEZ B, CERRILLO J,GILI
PEZ B, CERRILLO J,GILI , et al. Effect of thermal processing on the profile of bioactive compounds and antioxidant capacity of fermented orange juice[J]. International Journal of Food Sciences and Nutrition, 2016, 67(2):779-788.
, et al. Effect of thermal processing on the profile of bioactive compounds and antioxidant capacity of fermented orange juice[J]. International Journal of Food Sciences and Nutrition, 2016, 67(2):779-788.
[21] KILLIAN E, OUGH C S. Fermentation esters-formation and retention as affected by fermentation temperature[J]. American Journal of Enology & Viticulture, 1979, 30(4):301-305.
[22] 李小惠. 金刺梨发酵酒工艺研究[D].重庆:西南大学,2017.
[23] 刘小莉, 仇小妹, 王英, 等. 蓝莓果酒发酵工艺条件及品质研究[J]. 食品研究与开发, 2016, 37(11):85-89.
[24] 郑万明. 蓝莓果酒制备工艺优化研究[D]. 哈尔滨:黑龙江大学,2018.
[25] 郭志刚. 甘肃野生酵母菌株发酵特性评价及产地葡萄酒酿造研究[D]. 兰州:甘肃农业大学, 2008.
[26] 叶春苗. 蓝莓深加工技术研究进展[J]. 农业科技与装备, 2015(10):63-64.
[27] 赵静静. 沙城产区酿酒酵母的区分鉴定及菌学特性研究[D]. 石家庄:河北科技大学, 2012.
[28] 时月.玫瑰香葡萄酒自然酿造过程和酵母的分离鉴定与特性分析[D]. 河北:河北科技师范学院, 2015.
[29] 王子权, 姜辉, 陈初强, 等. 主发酵条件对蓝莓酒花色苷稳定性的影响[J]. 轻工科技, 2019(4):16-19.
[30] 周翔,尹珂,李青青,等.果酒中SO2变化影响因素的分析研究[J].酿酒科技,2019(5):62-64;70.