桔梗(Platycodon grandiflorum)为桔梗科桔梗属草本植物[1]。桔梗是一种兼具食用、药用、观赏价值的传统药食同源植物[2]。在我国大部分省区均有分布,在朝鲜、日本、俄罗斯远东地区也有分布[3]。桔梗为药食两用资源,是我国历史悠久的中药[4]。现代研究表明,桔梗具有多种药理活性[5]。多酚是在植物性食物中发现的,可以预防疾病,主要存在于植物的皮、根、叶、果中[6-7]。多酚不仅具抗氧化性,可清除自由基,而且多酚还具有很好的抑菌性[8]。因为多酚对健康有很大的好处,所以倍受关注,其在食品、医药和化工领域得到广泛应用[9]。目前,国内外有关从植物中提取多酚的研究有很多,但是从桔梗中提取多酚的研究少之又少。故本文对桔梗根中提取多酚进行了优化与功能性评价,以填补这部分研究上的空白。
由于传统的溶剂萃取技术需要较长的浸提时间,不仅提取效率低,而且占用更多的人力、物力等资源[10]。近年来,微波辅助提取法被广泛应用于提取有效活性物质[11]。利用微波和传统溶剂萃取相结合,具有减少提取时间,针对性加热,减少溶剂消耗等优点,是提取多酚的有效方法[12]。虽然微波辅助法提取植物中有效活性物质被广泛利用,但目前鲜有利用微波辅助法提取桔梗根中多酚的文献,故本文以药食同源的桔梗根为原料,对微波辅助提取桔梗根多酚工艺进行优化,并将其与传统水提法进行比较,为桔梗资源的进一步开发利用和功能性产品开发提供一定的指导与依据。
桔梗根,采于黑龙江省大兴安岭地区加格达奇区。没食子酸标准品(色谱纯)、福林-酚试剂、1,1-二苯基-2-三硝基苯(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2′-联氨-双-3-乙基苯并噻唑啉-6-磺酸(2,2′-azinobis(3-ethylbenzothiaoline-6-sulphonic acid),ABTS),美国Sigma公司;抗坏血酸、Trolox,美国Solarbio公司;其他常见试剂均为国产分析纯。
DHP-9162干燥箱,上海一恒科学仪器有限公司;HWS-24电热恒温水浴锅,昆山一恒有限公司;YP20002电子天平,上海越平科学仪器有限公司;G70D20CN1P-D2微波炉,格兰仕微波电器有限公司;TU-1810紫外可见分光光度计,北京普析通用仪器有限公司;万能高速粉碎机,上海菲力博实业公司;SHZ-Ⅲ型循环水真空泵,上海亚荣生化仪器厂;日本电色ZE-6000色差仪,上海首立实业有限公司;NICOLET iS10傅里叶红外光谱仪、su8010扫描电镜,日立中国有限公司。
1.3.1 原材料预处理
新鲜桔梗根洗净、去皮、切片后,于干燥箱80 ℃干燥至恒重,采用万能高速粉碎机粉碎后过60目筛,常温密封储存备用。
1.3.2 桔梗根多酚提取工艺优化
1.3.2.1 单因素试验设计
以桔梗根原料进行提取工艺的单因素试验。准确称取一定量样品粉末,按一定料液比(1∶10~1∶50, g∶mL)加入不同体积分数(20%~70%)的乙醇溶液,在不同的微波功率(70~420 W)条件下浸提一定时间(30~150 min),进行不同次数(1~4次)的提取后,真空抽滤收集滤液。
1.3.2.2 响应面优化试验设计
在上述单因素试验基础上,利用Box-Behnken数据处理软件,分别考察影响多酚提取过程的4个主要因素,即乙醇浓度(X1)、微波时间(X2)、微波功率(X3)和料液比(X4),设计4因素3水平响应面优化试验,优化微波辅助提取桔梗根多酚工艺参数。响应面试验因素及水平见表1。
表1 响应面试验因素及水平
Table 1 Factors and levels used in response surface analysis
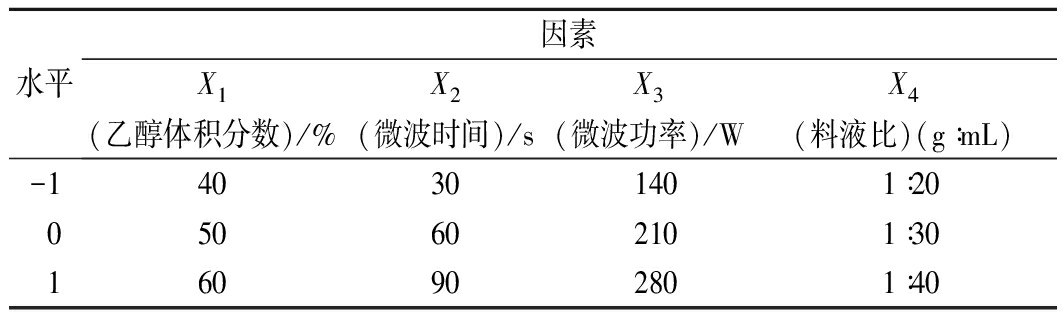
水平因素X1(乙醇体积分数)/%X2(微波时间)/sX3(微波功率)/WX4(料液比)(g∶mL)-140301401∶20050602101∶30160902801∶40
1.3.3 桔梗根提取物中多酚含量的测定
桔梗根提取物中多酚含量的测定,采用福林-酚测定法[13],吸取样品提取液1 mL于试管中,加入5 mL的蒸馏水,再加入1 mL的福林-酚试剂,摇匀后静置5 min,加入3 mL的质量分数为7%的Na2CO3溶液,70 ℃水浴条件下避光反应20 min,在765 nm波长下测定吸光度。以没食子酸为标准品在相同条件下测其吸光度,绘制标准曲线,得到线性回归方程为Y=5.827 3X+0.327 2(R2=0.999 3)。按照公式(1)计算桔梗根中多酚的含量。
(1)
式中:X,样品多酚含量,mg/g;ρ,由标准方程推算出的提取液多酚的质量浓度,mg/mL;V,提取液总体积,mL;N,稀释倍数;m,样品质量,g。
1.3.4 桔梗根提取物体外抗氧化活性的比较
在响应面优化微波辅助提取桔梗根多酚工艺参数的基础上,以相同的料液比、乙醇体积分数、浸提时间和提取次数,对桔梗粉末进行传统水提。根据响应面分析结果,对桔梗粉末进行微波辅助提取。分别收集微波辅助法和传统水提法的滤液,旋转蒸发并真空冷冻干燥,对获得的冻干粉末进行抗氧化活性的测定。
1.3.4.1 铁还原能力(FRAP)的测定
参照朱尚彬等[14]、杨少辉等[15]的方法略做改动,移取0.1 mL不同浓度的样品提取物溶液于试管,加入3 mL醋酸盐缓冲液(pH 3.6),加入10 mmol/L的TPTZ溶液0.1 mL,再加入10 mmol/L FeCl3溶液0.1 mL,充分混匀,25 ℃下反应6 min,在700 nm处测定其吸光度。另以不同浓度梯度的VC为对照组,实验重复3次。
1.3.4.2 超氧阴离子自由基![]() 清除率测定
清除率测定
参照李斌等[16]的方法略做改动,取200 μL待测样品,加入5.7 mL Tris-HCl缓冲溶液(0.05 mol/L,pH 8.20),再加入0.1 mL邻苯三酚溶液(6 mmol/L),充分混匀,在320 nm处测定其吸光度,记为Ai;以等体积的蒸馏水代替样品提取液测定吸光度,记为A0;以等体积的蒸馏水代替操作中的邻苯三酚溶液测定吸光度,记为At;以VC为对照组,实验重复3次,按照公式(2)计算![]() 清除率。
清除率。
![]() 清除率
清除率![]()
(2)
1.3.4.3 羟自由基(·OH)清除能力的测定
参照白生文等[17]的方法略做改动,取3 mL待测样品,依次向试管中加入2 mL FeSO4溶液(0.1 mol/L)、2 mL水杨酸溶液(0.1 mol/L)、2 mL过氧化氢溶液(0.1 mol/L),37 ℃水浴条件下反应30 min,在510 nm波长处测定其吸光度Ai;将体系中样品用等体积无水乙醇代替,在相同条件下测定其吸光度A0;将体系中过氧化氢溶液用蒸馏水代替在同条件下测定其吸光度At;以VC为对照组,实验重复3次,按照公式(3)计算·OH清除率。
·OH清除率![]()
(3)
1.3.4.4 DPPH·清除能力的测定
参考LI等[18]方法的基础上略做改动。精确配置浓度为0.1 mmol/L的DPPH乙醇溶液(现用现配),保存于棕色瓶。移取2 mL不同浓度的样品提取物溶液于试管,再加入2 mL的DPPH乙醇溶液,充分混合后室温避光30 min,在517 nm波长处测定其吸光度Ai;以等体积无水乙醇代替样品提取物溶液,在相同条件下测定其吸光度A0;以等体积无水乙醇代替DPPH乙醇溶液在同条件下测定其吸光度At;以VC为对照组,实验重复3次,按照公式(4)计算DPPH·清除率。
DPPH·清除率![]()
(4)
1.3.4.5 ABTS+·清除能力的测定
参考GARZ N 等[19]、林恋竹[20]方法的基础上略做改动。将7 mmol/L ABTS水溶液与2.45 mmol/L过硫酸钾溶液1∶1混合,避光放置16 h。用甲醇稀释ABTS溶液,以调节其在734 nm处的吸光度为0.7±0.02,记为A0;移取200 μL不同浓度的样品提取物溶液于试管,再加入4 mL ABTS溶液,充分混合后室温避光30 min,在517 nm波长处测定其吸光度Ai;以Trolox为对照组,实验重复3次,按照公式(5)计算ABTS+·清除率。
N 等[19]、林恋竹[20]方法的基础上略做改动。将7 mmol/L ABTS水溶液与2.45 mmol/L过硫酸钾溶液1∶1混合,避光放置16 h。用甲醇稀释ABTS溶液,以调节其在734 nm处的吸光度为0.7±0.02,记为A0;移取200 μL不同浓度的样品提取物溶液于试管,再加入4 mL ABTS溶液,充分混合后室温避光30 min,在517 nm波长处测定其吸光度Ai;以Trolox为对照组,实验重复3次,按照公式(5)计算ABTS+·清除率。
ABTS+·清除率![]()
(5)
打开色差仪,预热30 min,对色差仪进行校正,将桔梗多酚提取物冻干粉末放入测试皿中,把测试皿放入样品槽内,测定样品的亮度值(L*)、红度值(a*)和黄度值(b*)并计算得到颜色饱和度值(Chroma, C)和色相角度值(Hue,H*)值。实验重复3次,取平均值。按照公式(6)计算颜色饱和度值,按照式(7)计算色相角度值(Hue,H*)。
Chroma= (a*2+b*2)1/2
(6)
(7)
将经过微波辅助提取和传统水提后的桔梗粉末残渣至于鼓风干燥箱40 ℃至干燥,收集残渣。参考DAHMOUNE等的方法[21],对不同工艺提取后的残渣和提取物进行扫描电子显微镜观察。
将桔梗不同工艺提取物冻干粉、KBr压片,在波数400~4 000 cm-1处扫描[22]。
本实验采用Origin 9.1软件绘图,SPSS 22.0软件对数据进行单因素方差分析,Design Expert 8软件进行响应面优化处理,所有实验均重复3次。
2.1.1 乙醇含量(体积分数)对桔梗根多酚得率的影响
选取不同体积分数(20%、30%、40%、50%、60%、70%)的乙醇溶液提取桔梗根多酚,固定料液比1∶20 (g∶mL)、微波时间60 s、微波功率210 W,在此条件下提取一次,考察乙醇浓度对桔梗根多酚得率的影响,如图1所示,当乙醇体积分数20%~50%,桔梗根提取液中的多酚含量与乙醇体积分数成正比,乙醇溶液体积分数50%时,多酚得率最大,增加乙醇含量,多酚提取量逐渐降低。随着乙醇含量的逐渐增加,溶剂体系的极性降低,更容易破坏植物体内多酚类物质与多糖、蛋白质等物质间的氢键,促进多酚的溶出[23];随着乙醇含量的继续增加,蛋白质等生物大分子变性沉淀,使多酚物质从组织细胞内向提取溶剂中扩散的阻力增大,致使多酚得率降低[24]。故根据实验结果,选取乙醇体积分数40%、50%、60%作为响应面考察条件。
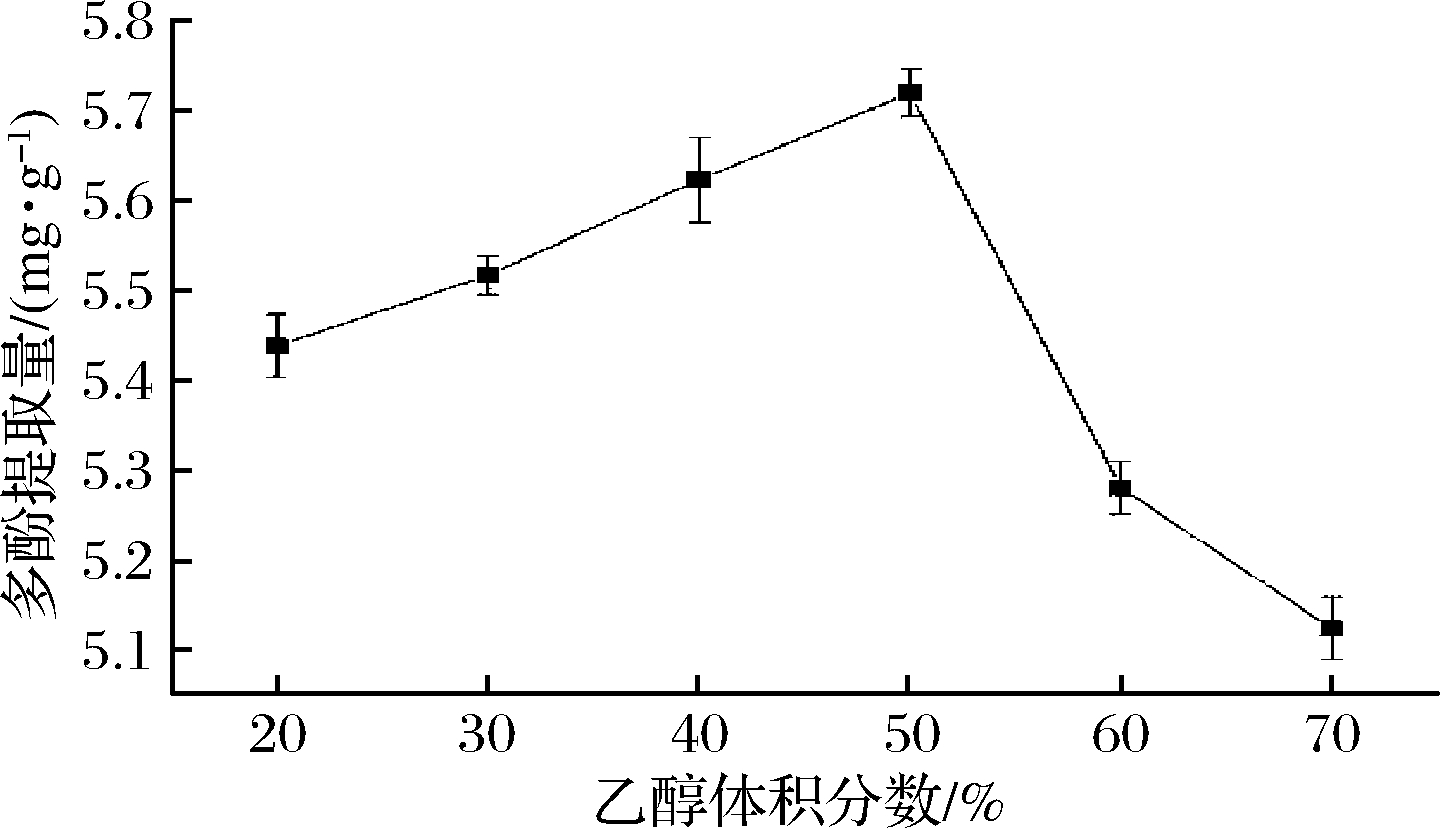
图1 乙醇体积分数对桔梗根多酚提取率的影响
Fig.1 Effect of ethanol concentration on the extraction
polyphenols from Platycodon grandiflorum roots
2.1.2 微波时间对桔梗根多酚得率的影响
称取一定量的桔梗根粉末,选取不同微波时间(30、60、90、120、150 s),固定料液比1∶20 (g∶mL)、乙醇浓度70%、微波功率210 W,在此条件下提取一次,考察微波时间对桔梗根多酚得率的影响,如图2所示。在微波时间30~60 s,桔梗根多酚提取量与提取时间成正比,在微波时间60 s时桔梗根多酚提取量达到最大值,进一步增加微波时间,多酚提取量与微波时间成反比。提取时间过短,多酚提取不完全,提取时间过长不仅会增加能耗,同时多酚类物质的稳定性将变差,从而降低多酚得率[25],故根据实验结果,选取微波时间30、60、90 s作为响应面考察条件。
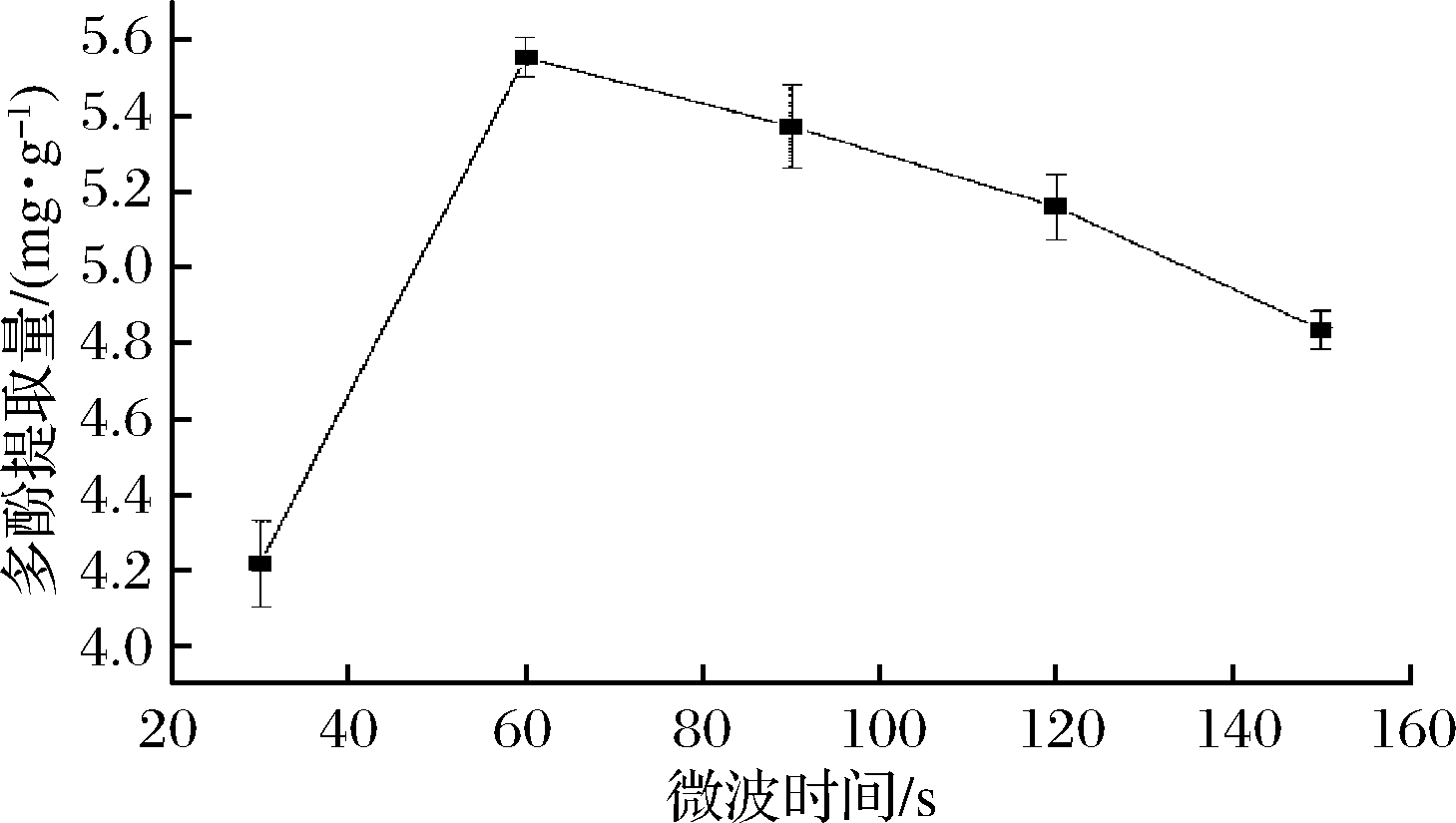
图2 提取时间对桔梗根多酚提取率的影响
Fig.2 Effect of extraction time on the extraction
polyphenols from Platycodon grandiflorum roots
2.1.3 微波功率对桔梗根多酚得率的影响
称取一定量的桔梗根粉末,选取不同微波功率(70、140、210、280、350、420 W),固定料液比1∶20(g∶mL)、乙醇含量70%、微波时间60 s,在此条件下提取1次,考察微波功率对桔梗根多酚得率的影响,如图3所示,在微波功率70~210 W,随着微波功率的增加,桔梗根多酚提取量逐渐增加,在微波功率210 W时,多酚提取量最大,进一步增加微波功率,多酚提取量显著降低。在微波功率小于210 W时,随着微波功率的增加,微波破坏桔梗根细胞壁的效果越好,从而使桔梗根多酚的提取效率呈上升趋势,当微波功率超过210 W后,随功率的增大,提取效率反而有下降的趋势,可能是由于功率太大,温度上升太快,对多酚成分有所破坏[26]。故根据实验结果,选取微波功率140、210、280 W作为响应面考察条件。
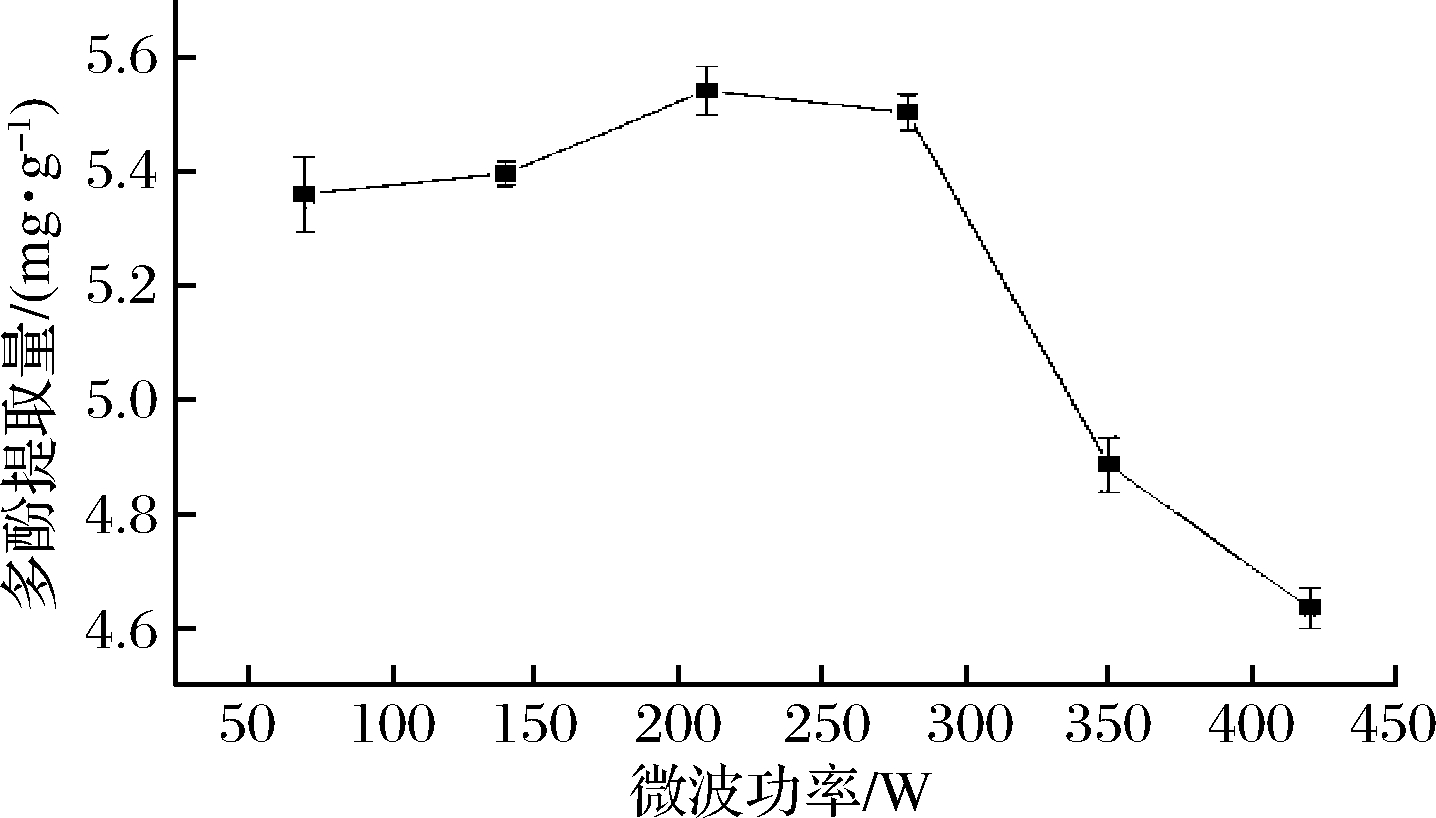
图3 微波功率对桔梗根多酚提取量的影响
Fig.3 Effect of microwave power on extraction
polyphenols from Platycodon grandiflorum roots
2.1.4 料液比对桔梗根多酚得率的影响
称取一定量的桔梗根粉末,选取不同料液比(1∶10、1∶20、1∶30、1∶40、1∶50, g∶mL),固定乙醇体积分数70%、微波时间60 s、微波功率210 W,在此条件下提取1次,考察乙醇浓度对桔梗根多酚得率的影响,如图4所示,在料液比1∶10~1∶30 (g∶mL)范围内,随着料液比的增加,桔梗根多酚提取量快速增加,在料液比1∶30 (g∶mL)时,多酚提取量最大,进一步增加料液比,多酚提取量显著降低。在料液比相对较低时,增加溶剂的用量,增大了桔梗根粉末中多酚类物质与溶剂间的浓度差,促进了多酚的溶出,而当料液比过大时,由于桔梗根多酚已大部分溶出,继续增加溶剂用量效果不再显著,反而会造成溶剂损耗[27]。故根据实验结果,选取料液比1∶20、1∶30、1∶40 (g∶mL)作为响应面考察条件。
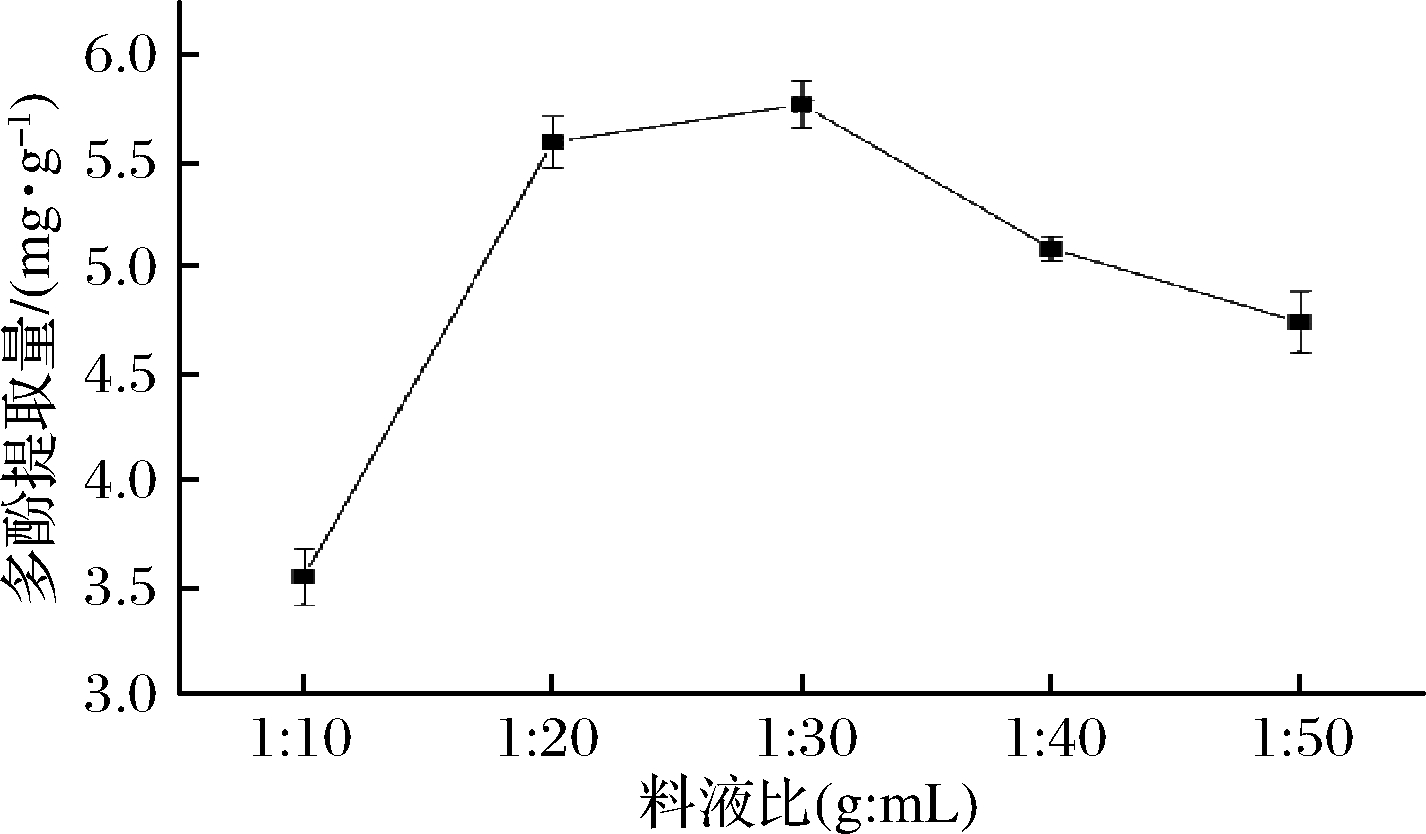
图4 料液比对桔梗根多酚提取量的影响
Fig.4 Effect of solid-to-liquid ratio on the yield of
polyphenols from Platycodon grandiflorum roots
2.1.5 提取次数对桔梗根多酚得率的影响
称取一定量的桔梗根粉末,选取不同提取次数(1、2、3、4次),固定料液比1∶20 (g∶mL)、乙醇体积分数70%、微波时间60 s,微波功率210 W,考察提取次数对桔梗根多酚得率的影响,如图5所示,在提取次数为2次时,桔梗根多酚提取量达到峰值,进一步增加提取次数,多酚提取量略有降低。原因在于,当提取次数为1次时,桔梗根细胞仍有部分破坏不完全,提取次数为2次时,桔梗根细胞破坏更加完全,随着提取次数的增加,桔梗根中其他成分也大量溶出,故多酚提取率略有降低,且综合考虑提取时间和提取效率,选择提取次数为2次。

图5 提取次数对桔梗多酚提取率的影响
Fig.5 Effect of extraction cycles on the extraction
efficiency of polyphenols from Platycodon grandiflorum roots
2.2.1 响应模型的建立与分析
通过统计分析软件Design Expert 8对表2中实验数据进行二次多项式回归拟合,建立二次回归多元方程如下:![]()
表2 响应面试验设计及结果
Table 2 Experimental design and results for response
surface analysis
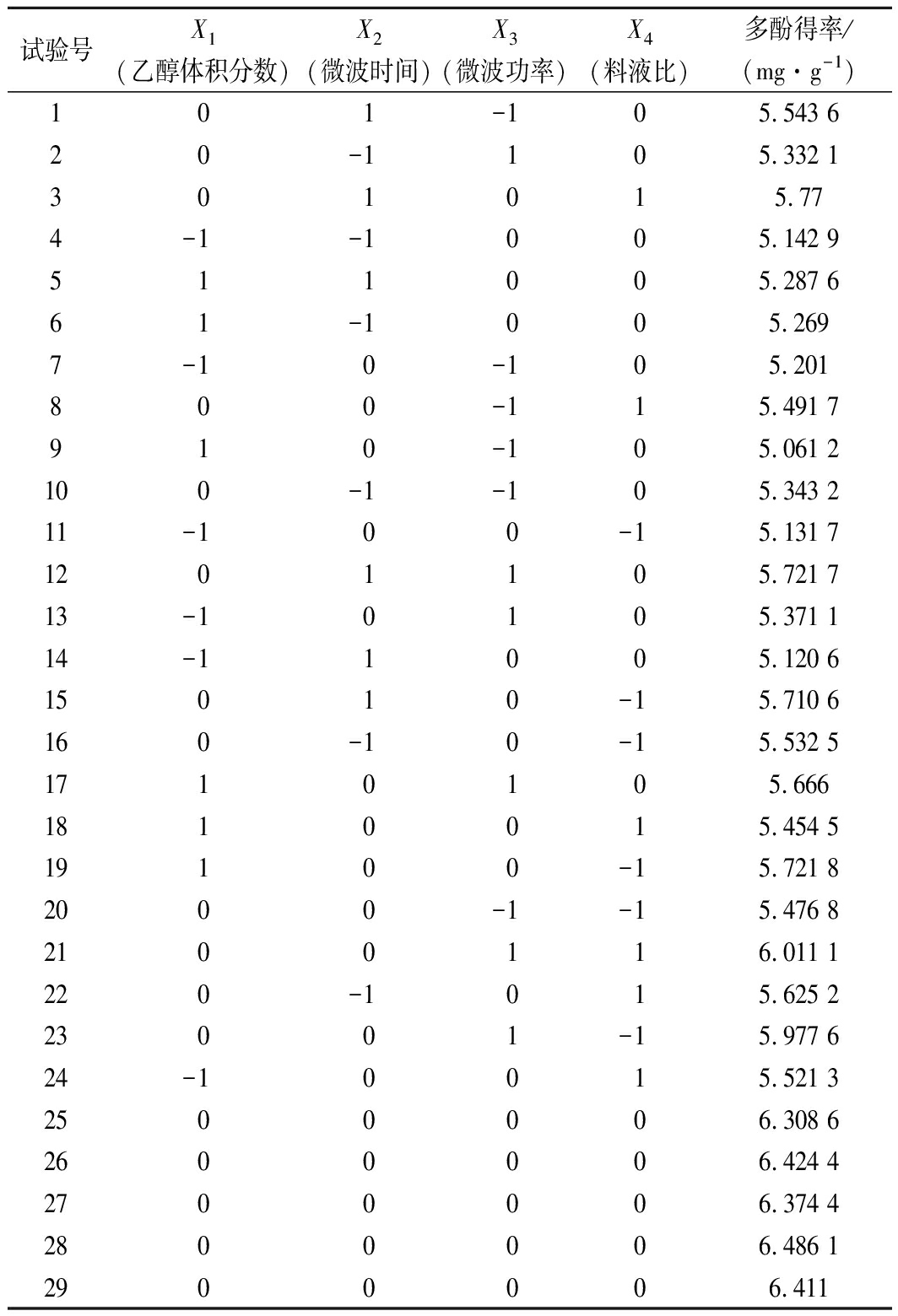
试验号X1(乙醇体积分数)X2(微波时间)X3(微波功率)X4(料液比)多酚得率/(mg·g-1)101-105.543 620-1105.332 1301015.774-1-1005.142 9511005.287 661-1005.2697-10-105.201800-115.491 7910-105.061 2100-1-105.343 211-100-15.131 71201105.721 713-10105.371 114-11005.120 615010-15.710 6160-10-15.532 51710105.6661810015.454 519100-15.721 82000-1-15.476 82100116.011 1220-1015.625 223001-15.977 624-10015.521 32500006.308 62600006.424 42700006.374 42800006.486 12900006.411
由表2可知,模型F值为27.26,表明模型因变量与自变量之间的线性关系明显,该模型回归极显著(P<0.000 1),失拟项和纯误差的平方和和均方值较低。该模型![]() 说明模型与试验拟合程度高,自变量与响应值之间的线性关系显著,可以用于不同变量条件下的响应值预测。
说明模型与试验拟合程度高,自变量与响应值之间的线性关系显著,可以用于不同变量条件下的响应值预测。
由表3可以看出,X12、X22、X32和X42项达到了极度显著的影响水平(P<0.01),X3项达到了高度显著影响水平(0.000 1<P<0.01),X1、X2、X4、X1X3、X1X4和X2X3项为显著影响水平(P<0.05)。根据F值和响应面的陡峭程度可知,各个因素对桔梗根多酚提取量影响的大小顺序为:微波功率(X3)>乙醇含量(X1)>微波时间(X2)>料液比(X4)。
表3 回归方程方差分析
Table 3 Analysis of variance and statistical parameters
of the regression model

来源自由度平方和均方F值P值显著性模型144.940.3527.26<0.000 1∗∗∗X1(乙醇浓度)10.0790.0796.160.026 3∗X2(微波时间)10.0690.0695.400.035 7∗X3(微波功率)10.320.3225.140.000 2∗∗X4(料液比)18.683×10-38.683×10-30.680.423 3∗X1 X214.182×10-44.182×10-40.0330.858 9X1 X310.0470.0473.70.074 9∗X1 X410.110.118.450.011 5∗X2 X318.949×10-38.949×10-30.70.416 4∗X2 X412.772×10-42.772×10-40.0220.884 9X3 X418.649×10-58.649×10-56.777×10-30.935 6X1213.043.04238.08<0.000 1∗∗∗X2211.641.64128.66<0.000 1∗∗∗X3211.061.0682.69<0.000 1∗∗∗X4210.410.4131.74<0.000 1∗∗∗残差140.180.18失拟项100.160.163.800.105 0纯误差40.0178.949×10-3总和285.12
注:***差异极度显著(P<0.000 1);**差异高度显著(0.000 1<P<0.01);*差异显著(P<0.05)
2.2.2 响应面优化实验结果
由回归方程所得的响应面立体图与等高线如图6所示,主要反映了提取时间、料液比、微波功率和乙醇体积分数之间的相互作用关系。等高线的形状可反映出交互效应的强弱,椭圆形表示两因素交互作用显著,而圆形则与之相反[28]。通过3D图,观察曲面的倾斜度确定两者对响应值的影响程度,倾斜度越高,即坡度越陡,说明两者交互作用越显著[29]。由等高线图和3D图可知料液比与微波时间、料液比与乙醇浓度、微波时间与微波功率、料液比与微波功率交互效应显著。

图6 各因素交互作用对桔梗根多酚提取量影响的响应面图
与等高线
Fig.6 Response surface and contour plots showing the effects
of extraction parameters on the yield of polyphenols from
Platycodon grandiflorum roots
2.2.3 最佳条件的确定和回归模型的验证
利用Design-Expert 8.0软件,分析得出微波辅助法提取桔梗根多酚的最佳提取条件为:提取时间62.56 s、料液比1∶30.30 (g∶mL)、微波功率225.26 W、乙醇体积分数50.73%,此时多酚提取率预测值为6.423 36 mg/g。考虑实际操作,选择提取时间(X1)60 s、料液比(X2)1∶30 (g∶mL)、微波功率(X3)210 W、乙醇体积分数(X4)50%,验证实验得到桔梗根多酚提取率为(6.456 6±0.177 8)mg/g,与理论值非常接近,说明试验优化得到的技术参数是可靠稳定的。
2.2.4 两种工艺提取桔梗根多酚含量的比较
微波辅助法提取桔梗根多酚工艺条件为微波功率210 W、料液比1∶30 (g∶mL)、微波时间60 s、乙醇含量50%、提取次数为2次。在此条件下桔梗根多酚的提取率平均为6.456 6 mg/g。
传统水提法提取桔梗根多酚工艺条件为料液比1∶30 (g∶mL)、浸提时间60 s、乙醇含量50%、提取次数为2次。在此条件下桔梗根多酚的提取率平均为4.764 4 mg/g。相同提取条件下,传统水提多酚含量低于微波辅助提取多酚含量。
2.3.1 铁还原能力分析
铁还原能力的测定中,吸光度与其抗氧化能力成正比,抗氧化能力越强,则吸光度越高。由图7可知,在所选质量浓度范围内,各样品的铁还原能力均与质量浓度成正比,桔梗根多酚的铁还原能力略低于VC对照组,微波提取桔梗根多酚的铁还原能力优于传统水提的桔梗根多酚。且随着浓度的增加,与传统水提法相比,微波提取桔梗根多酚的还原能力增加趋势更加明显。可能由于微波辅助提取,更有利于具有还原能力物质的溶出。由于FRAP法反映的不仅仅是样品对某一种自由基的清除活性,而是样品的总还原能力[30],故微波提取桔梗根多酚的总抗氧化活性高于相同提取条件下传统水提桔梗多酚。
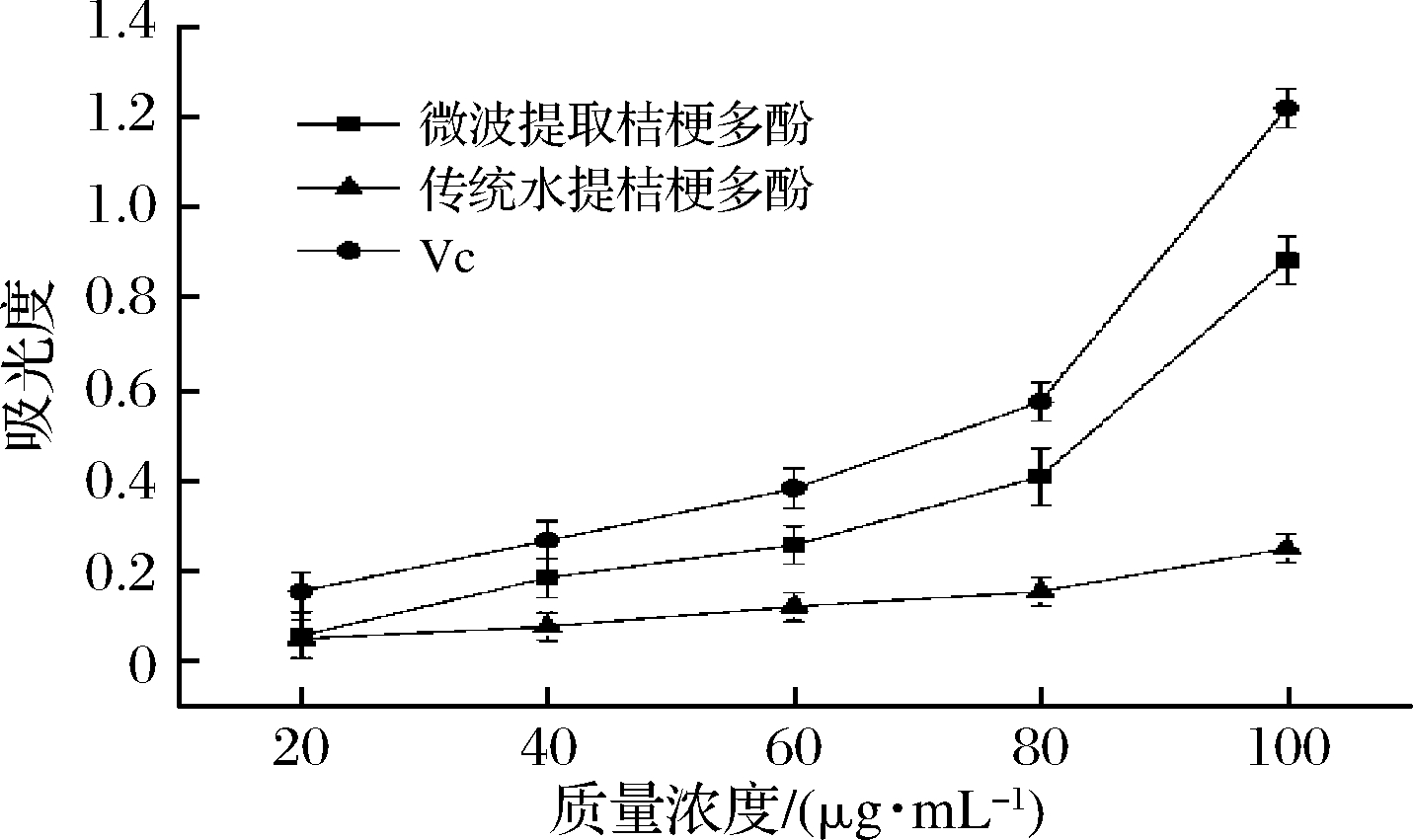
图7 桔梗根多酚的铁还原能力
Fig.7 FRAP of extracts of polyphenols from
Platycodon grandiflorum roots
![]() 清除能力
清除能力
![]() 的清除率实验是体外抗氧化实验中的一个重要指标[31]。由图8可知,在所选质量浓度范围内,各样品对
的清除率实验是体外抗氧化实验中的一个重要指标[31]。由图8可知,在所选质量浓度范围内,各样品对![]() 的清除率与质量浓度成正比。当质量浓度为100 μg/mL时,微波提取桔梗根多酚的清除率为41.18%,传统水提桔梗根多酚的清除率为39.40%,VC的清除率为26.53%。桔梗根多酚的
的清除率与质量浓度成正比。当质量浓度为100 μg/mL时,微波提取桔梗根多酚的清除率为41.18%,传统水提桔梗根多酚的清除率为39.40%,VC的清除率为26.53%。桔梗根多酚的![]() 清除率明显高于VC对照组,且微波提取桔梗多酚
清除率明显高于VC对照组,且微波提取桔梗多酚![]() 清除率大于传统水提桔梗根多酚,可见微波提取桔梗多酚对
清除率大于传统水提桔梗根多酚,可见微波提取桔梗多酚对![]() 较好的清除能力。
较好的清除能力。
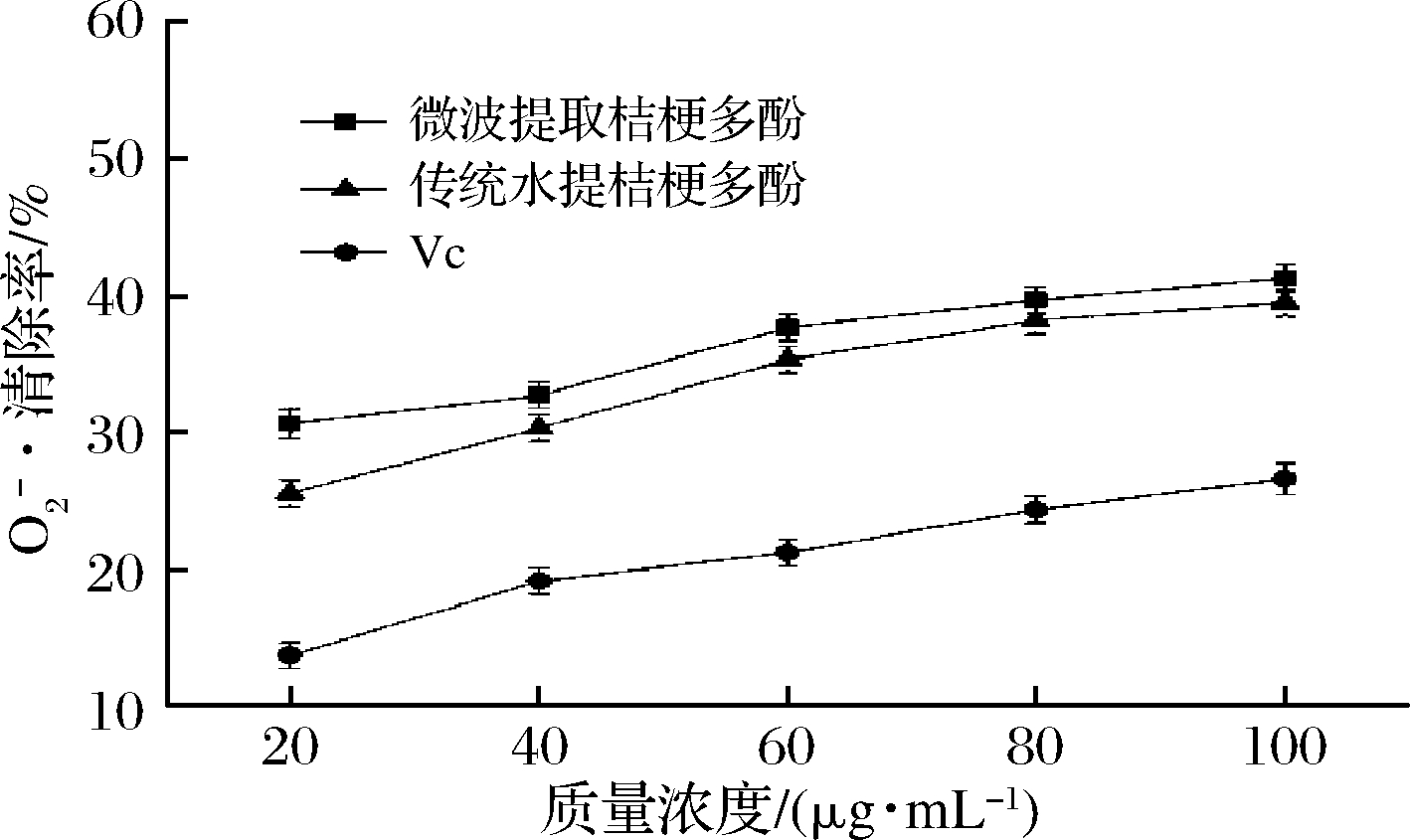
图8 桔梗根多酚对![]() 清除能力
清除能力
Fig.8 Superoxide anion radical scavenging activity
of extracts of polyphenols from Platycodon grandiflorum roots
2.3.3 ·OH清除能力
·OH可衍生出多种氧自由基,而氧自由基对细胞有较大的毒性,故·OH的清除率是抗氧化实验中的重要指标之一[32]。由图9可知,在所选质量浓度范围内,各样品对·OH的清除率与质量浓度成正比,当质量浓度为100 μg/mL时,微波提取桔梗多酚的清除率为85.31%,传统水提桔梗根多酚的清除率为83.91%,VC的清除率为82.06%,微波提取桔梗多酚的·OH清除率明显高于传统水提桔梗根多酚,可见微波提取桔梗多酚对·OH有一定的清除能力。
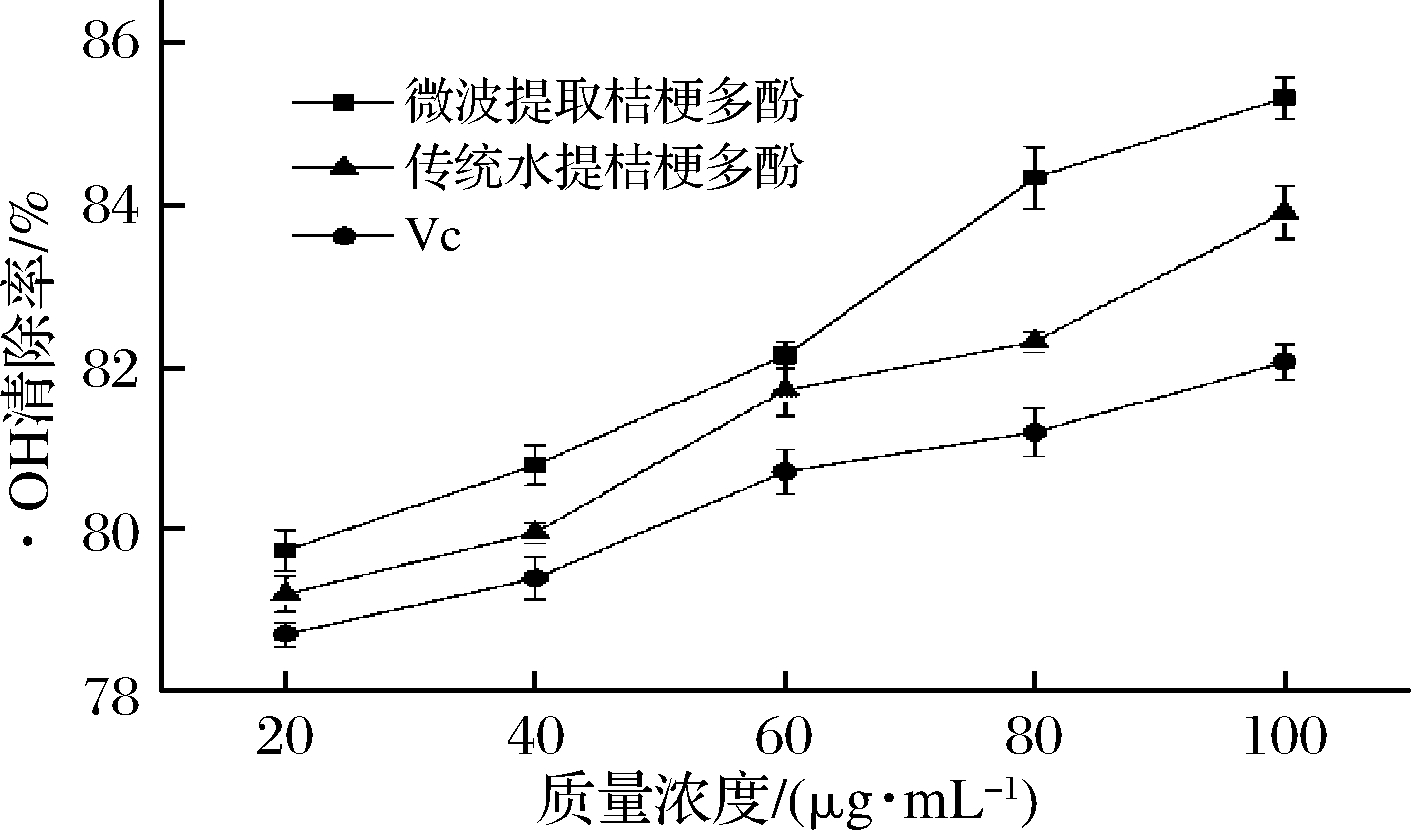
图9 桔梗跟多酚对·OH清除能力
Fig.9 Hydroxyl radical scavenging activity of extracts of
polyphenols from Platycodon grandiflorum roots
2.3.4 DPPH·清除能力
由图10可知,在所选质量浓度范围内,各样品对DPPH·的清除率与质量浓度成正比,且桔梗根多酚的DPPH·清除能力与VC自由基清除能力有明显的差异性。桔梗根提取物在质量浓度为20~40 μg/mL时,DPPH·清除能力增幅不明显;在40~100 μg/mL时,桔梗根多酚DPPH·清除能力增幅明显,当质量浓度为100 μg/mL时,微波提取桔梗多酚的清除率为83.51%,传统水提桔梗根多酚的清除率为79.33%,VC的清除率为87.68%,可见微波提取桔梗多酚对DPPH·的清除能力优于传统水提桔梗根多酚。
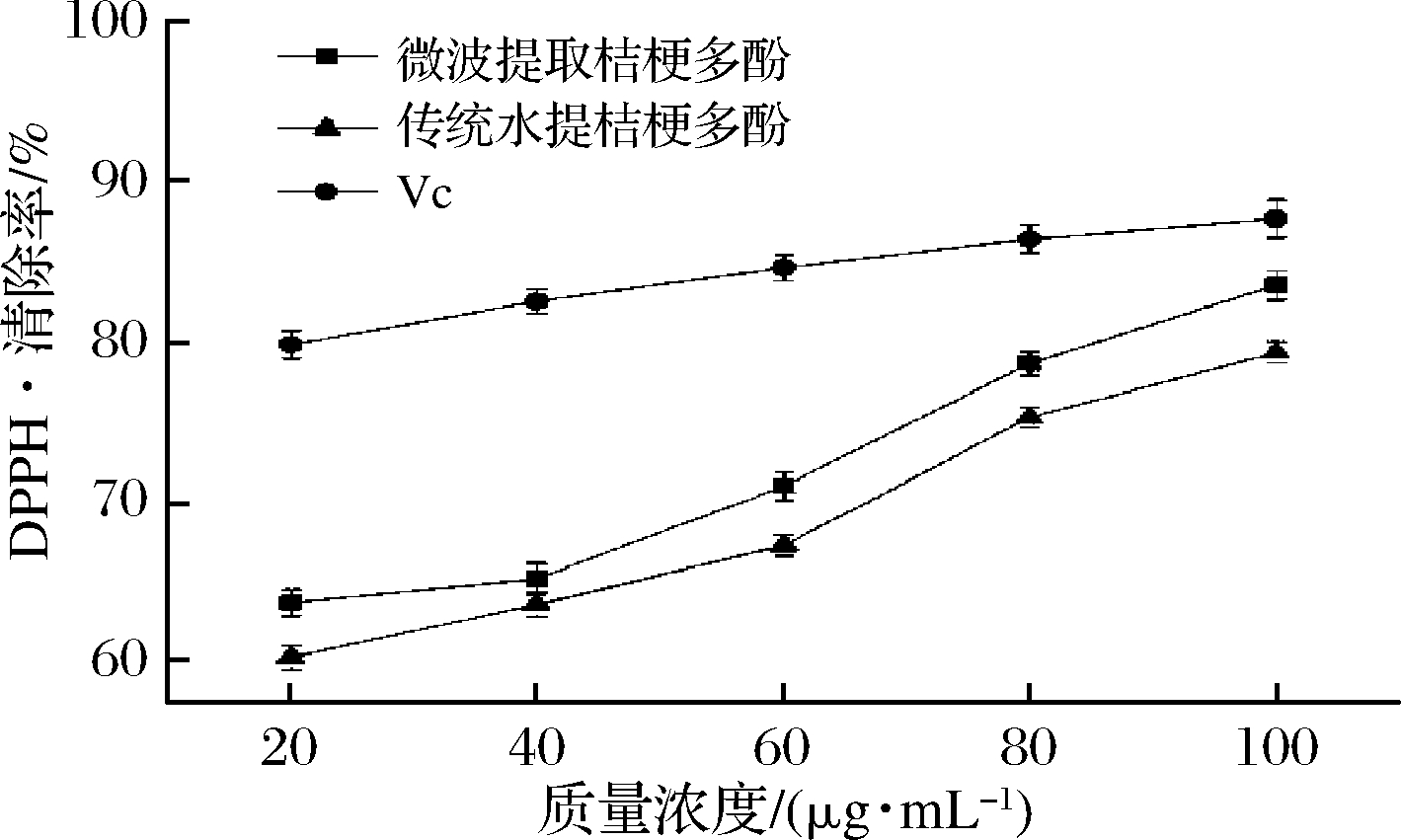
图10 桔梗根多酚对DPPH·清除能力
Fig.10 DPPH· scavenging activity of extracts
of polyphenols from Platycodon grandiflorum roots
2.3.5 ABTS+·清除能力
ABTS+·为一稳定的有机自由基,试样抗氧化能力越强,与该有机自由基反应量越大,反应速率也越快,反应液吸光度的变化越大[33]。由图11可知,在所选质量浓度范围内,与Trolox相比,桔梗根多酚ABTS+·清除率低一些,质量浓度为100 μg/mL时,微波提取桔梗根多酚的ABTS+·清除率为90.39%,传统水提桔梗根多酚的清除率为89.25%,Trolox的清除率为95.07%,但结果表明桔梗根多酚对ABTS+·仍有较好的清除作用,且微波提取法优于传统水提法得到的桔梗根多酚。
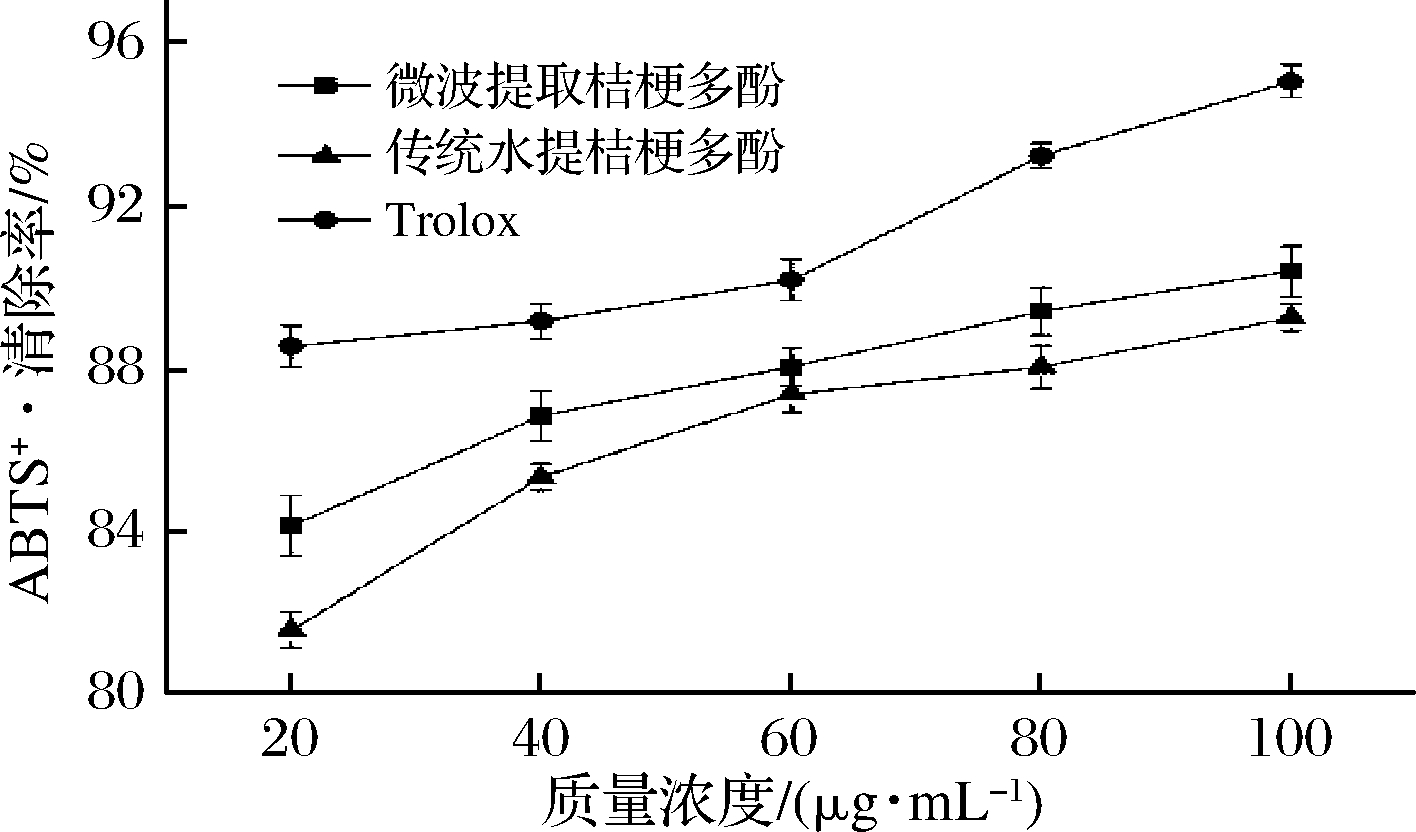
图11 桔梗根多酚对ABTS+·自由基清除能力
Fig.11 ABTS+· scavenging activity of extracts
of polyphenols from Platycodon grandiflorum roots
色差值是目前最通用的反映物体颜色差异的指标之一,由亮度值(L*)、红度值(a*)、黄度值(b*)将颜色用数字反应出来。L*值代表亮度,L*值越大表示亮度越大;a*、b*值为色坐标值,a*值表示红绿方向颜色变化,+a*表示偏向红色,-a*表示偏向绿色;b*表示黄蓝方向变化,+b*表示偏向黄色,-b*表示偏向蓝色[34];色相角度值,用角度数值表示,取值在0~90时,数值越低说明样品越红,越高则表示样品越黄;颜色饱和度值表示由无彩色与颜色对象的色度点之间连接的直线的长度[35]。不同工艺提取物如图12所示,其中a是微波辅助法提取物,b是传统水提法提取物,不同工艺提取物色差值如表4所示。

a-微波辅助法提取物; b-传统水提法提取物
图12 不同提取工艺提取物色差图
Fig.12 Chromaticity diagrams of extracts from different
extraction processes
物质的颜色与化学成分有着密切的联系,是物质化学品质及组成的外观反映,根据物质颜色来分析物质组成是种重要且简单的方法[36]。提取物的颜色越深,表明提取的更加完全。可知微波辅助提取可以让物质更好地溶解在溶剂中。
由图12和表4可知,微波提取法和传统水提法的提取物,色差值和色泽有较明显的差异。L*、 a*、b*、C值差异极显著(P<0.01);h值差异不显著(P>0.05)。表明微波提取桔梗根多酚的亮度大于传统水提桔梗根多酚;微波提取桔梗根多酚相对于传统水提桔梗根多酚偏向红色;微波提取桔梗根多酚相对于传统水提桔梗根多酚更偏向于黄色;且微波提取桔梗根多酚颜色饱和度值更高。
表4 不同提取工艺提取物色差比较
Table 4 Comparison of color difference of extracts from different extraction processes

样品L∗a∗b∗Ch传统水提法提取物85.503 3±0. 0252.543 3±0.02317.930±0.06918.112 8±0.08281.935 3±0.097微波辅助法提取物 83.540±0.010∗∗ 3.056 7±0.051∗∗ 21.683 3±0.032∗∗ 21.852 1±0.091∗∗81.975 9±0.145
注:与传统水提法提取物比较:*,P<0.05,**,P<0.01
利用扫描电镜对桔梗粉末和经2种提取方法处理后干燥的桔梗根粉末进行观察,结果如图13所示。由图13可知,未经提取处理的桔梗根粉末(a)表面,由于干燥失水有轻微的褶皱,但无明显破裂现象;经过传统水提处理的桔梗根粉末(b)表面有较少的褶皱,但是细胞壁基本没有被破坏;经过微波提取的桔梗根粉末(c)细胞被严重破坏,不仅表面褶皱很多,而且破裂情况明显,细胞壁表面可以看到空洞,这是由于细胞吸收微波后,内部温度会迅速上升,使得内部压强升高,导致细胞破裂,组织结构破坏严重[37]。故微波辅助法可以使得多酚类化合物从植物细胞中释放出来,融入溶剂中。因此相对于传统水提法,微波辅助法对有效活性成分的提取更加有效。

a-未提取; b-传统水提; c-微波辅助提取
图13 桔梗根粉末扫描电镜照片
Fig.13 Scanning electron microscope photographs
of Platycodon grandiflorum roots
提取物红外光谱扫描见图14,其中a为微波辅助提取物红外光谱图,b为传统水提物红外光谱图。
如图14所示,两种提取工艺的光谱图整体趋势一致,虽然部分峰位有微小程度的蓝移或红移,但都在可允许范围,认为是基团相互影响的结果,则表明它们的化学成分相同[38]。由图14可知,3 281.19、3 265.20 cm-1处有强宽的吸收峰对应O—H伸缩振动;1 614.24、1 613.60 cm-1对应羰基吸收峰;1 409.17、1 408.99 cm-1处的吸收峰对应次甲基面内弯曲振动,1 300~1 000 cm-1有C—O的伸缩振动峰,950 ~500 cm-1有多个吸收峰,说明苯环上有多个取代结构。与红外光谱特征和文献[39-41]报道多酚类化合物红外光谱特征一致,可确认化学组成为多酚类物质。
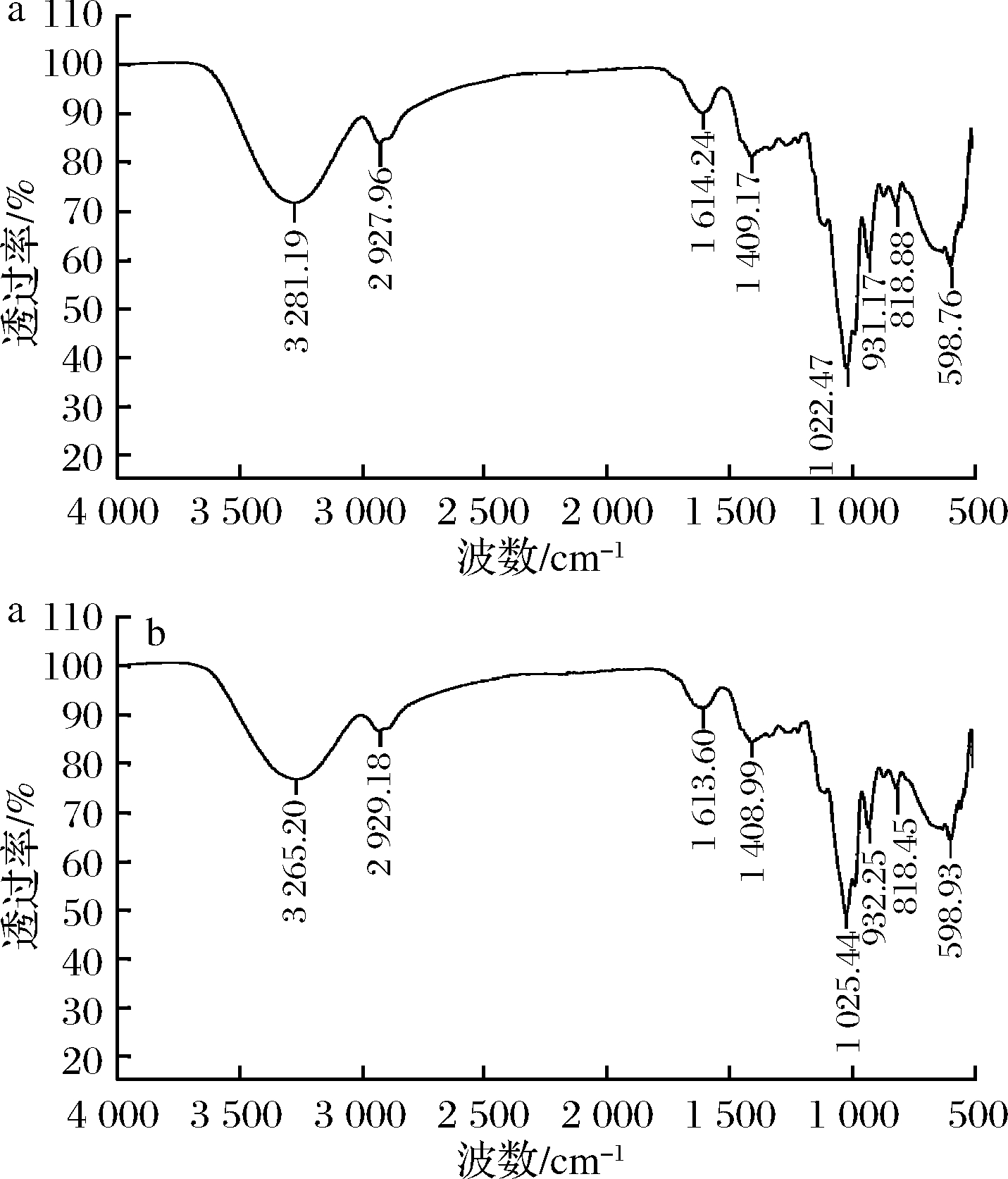
a-微波辅助提取物红外光谱图; b-传统水提物红外光谱图
图14 桔梗根提取物的红外光谱图
Fig.14 IR spectrogram for extraction of
Platycodon grandiflorum roots
本试验采用微波提取桔梗根中多酚,通过响应面优化得到最佳提取工艺为:微波功率210 W、料液比1∶30 (g ∶mL)、微波时间60 s、乙醇浓度50%、提取次数为2次。在此条件下,桔梗根多酚提取率达6.49 mg/g,与预测值相差较小,表明模型是可靠稳定的。通过与传统水提法比较不同工艺提取的桔梗多酚对![]() 和ABTS+·的清除能力及总还原力,评价其抗氧化活性;色差及扫描电镜下桔梗根粉末的微观结构,评价其提取能力;并用红外光谱法对提取物进行了表征鉴定。微波辅助提取桔梗根多酚抗氧化能力较强,其IC50值分别为329.918、0.076、10.129、0.164 μg/mL。结果表明微波辅助提取桔梗根多酚,不仅提取率增加,而且抗氧化能力也有较大的提升,为桔梗资源的进一步开发利用和功能性产品开发提供一定的指导与依据。
和ABTS+·的清除能力及总还原力,评价其抗氧化活性;色差及扫描电镜下桔梗根粉末的微观结构,评价其提取能力;并用红外光谱法对提取物进行了表征鉴定。微波辅助提取桔梗根多酚抗氧化能力较强,其IC50值分别为329.918、0.076、10.129、0.164 μg/mL。结果表明微波辅助提取桔梗根多酚,不仅提取率增加,而且抗氧化能力也有较大的提升,为桔梗资源的进一步开发利用和功能性产品开发提供一定的指导与依据。
近年来,随着人们生活水平的提高和科技的进步,药食同源植物的开发与利用日益受到人们的重视。桔梗作为传统药食同源植物,不仅有较大的经济效益,而且具有深远的研究意义。本实验表明,通过微波辅助提取的方法,从桔梗中提取多酚的效率较高,且更加节约时间与资源。通过对桔梗根多酚提取物抗氧化能力的测定,表明桔梗根多酚具有良好的抗氧化能力。为食品工业开发新型的抗氧化剂和功能性食品提供了基本的科学依据,对桔梗的深入研究与开发利用具有重要意义。
[1] 中华人民共和国药典编委会.人民共和国药典[M].北京:人民卫生出版社,2010:196.
[2] 谢雄雄,张迟,曾金祥,等.中药桔梗的化学成分和药理活性研究进展[J].中医药通报,2018,17(5):66-72.
[3] 王玲,付志文,董其亭,等.桔梗配方施肥方法研究[J].中国中药杂志,2008,33(6):697-698.
[4] 桔梗的化学成分分析及药理活性研究[D].长春:吉林农业大学,2017.
[5] OU Lolan, YU Xin, ZHU Y, et al. Study on screening of anti-inflammatory activity areas in the stems and leaves of platycodon grandiflorum[J].Medicinal Plant,2014,5(1):37-40.
[6] EDWARDS C A, HAVLIK J, CONG W, et al. Polyphenols and health: Interactions between fibre, plant polyphenols and the gut microbiota[J]. Nutrition Bulletin, 2017, 42(4):356-360.
[7] AWIKA J M, DUODU K G. Bioactive polyphenols and peptides in cowpea (Vigna unguiculata) and their health promoting properties: A review [J]. Journal of Functional Foods, 2017,38:686-697.
[8] 古绍彬,吴影,董红敏,等.苹果多酚抗氧化作用及其清除自由基能力的研究[J].中国粮油学报,2013, 28(4):58-61;128.
[9] 张路路,陈奕,王玉婷,等.葡萄渣多酚的分布、生物活性及其在食品中的应用研究进展[J].食品安全质量检测学报, 2015(12):4 871-4 877.
[10] SHANKARANANTH V, RAJASEKHAR K K, NARENDRA J, et al. Microwave assisted extraction of alkaloids from Nux vomica seeds and Cinchona bark[J]. Journal of Pharmacy Research, 2010, 3(11):2 763-2 764.
[11] KUMAR B, SMITA K, KUMAR B, et al. Microwave-assisted extraction and solid-phase separation of quercetin from solid onion (Allium cepa, L.)[J]. Separation Science and Technology,2014,49(16):2 502-2 509.
[12] 武娇,任祎,孙希平,等.微波辅助提取燕麦总酚及其抗氧化能力评价[J].中国农学通报,2015,31(7):229-234.
[13] 王炬,张秀玲,高宁,等.老山芹全株及其不同部位酚类物质含量及抗氧化能力分析[J].食品科学,2019,40(7):54-59.
[14] 朱尚彬,聂少平,朱盼,等.黑灵芝不同溶剂提取物抗氧化活性比较研究[J].食品科学,2009,30(17):98-101.
[15] 杨少辉,宋英今,王洁华,等.雪莲果体外抗氧化和自由基清除能力[J].食品科学,2010,31(17):166-169.
[16] 李斌,雷月,孟宪军,等.响应面试验优化超声波辅助提取蓝靛果多酚工艺及其抗氧化活性[J].食品科学,2015,36(22):33-39.
[17] 白生文,汤超,田京,等.沙棘果渣总黄酮提取工艺及抗氧化活性分析[J].食品科学,2015,36(10):59-64.
[18] LI Xiuxia, HAN Lujia, CHEN Longjian. In vitro antioxidant activity of protein hydrolysates prepared from com glutenmeal[J]. Journal of the Science Food and Agriculture,2008,88(9):1 660-1 666.
[19] GARZ N G A, NARV
N G A, NARV EZ C E, RIEDL K M, et al. Chemical composition, anthocyanins, non-anthocyanin phenolics and antioxidant activity of wild bilberry (Vaccinium meridionale Swartz) from Colombia[J]. Food Chemistry, 2010, 122(4):980-986.
EZ C E, RIEDL K M, et al. Chemical composition, anthocyanins, non-anthocyanin phenolics and antioxidant activity of wild bilberry (Vaccinium meridionale Swartz) from Colombia[J]. Food Chemistry, 2010, 122(4):980-986.
[20] 林恋竹,赵谋明.反应时间对DPPH·法、ABTS+·法评价抗氧化性结果的影响[J].食品科学,2010, 31(5): 63-67.
[21] DAHMOUNE F, NAYAK B, MOUSSI K, et al. Optimization of microwave-assisted extraction of polyphenols from Myrtus communis L. leaves[J]. Food Chemistry, 2015, 166:585-595.
[22] 黄琦,王启越,李颖, 等. 石榴皮总多酚的微波辅助提取工艺及抗氧化活性研究[J].食品研究与开发,2016, 37(12):46-51.
[23] BOUSSETTA N, VOROBIEV E, LE L H, et al. Application of electrical treatments in alcoholic solvent for polyphenols extraction from grape seeds [J]. LWT-Food Science and Technology, 2012, 46(1):127-134.
[24] 任虹,朱晓霞,韩东桓,等.微波辅助提取花生红衣多酚及其抗氧化活性研究[J].中国食品学报,2013,13(7):25-33.
[25] 肖凤艳,高磊,赵子健,等.短梗五加果多酚提取工艺优化及抗疲劳作用[J].食品科学,2018,39(22):235-240.
[26] 陈钢,籍保平,黄立山,等.黑木耳中多酚化合物微波提取工艺[J].食品科学,2010,31(24):210-213.
[27] 郭宏垚,李冬,雷雄,等.花椒多酚提取工艺响应面优化及动力学分析[J].食品科学,2018,39(2):247-253.
[28] 刘军海,黄宝旭,蒋德超.响应面分析法优化艾叶多糖提取工艺研究[J]. 食品科学, 2009, 30(2):114-118.
[29] 陈小雷,胡王,李海洋,等.响应面法优化封鳊鱼腌制工艺条件[J].云南农业大学学报, 2015, 30(6):859-867.
[30] 谢瑞,魏艳霞,丁玉竹,等.不同处理方法对白刺多糖抗氧化活性的影响[J].天然产物研究与开发, 2016,28(1):41-45.
[31] ATAWODI S E, ATAWODI, J C, IDAKWO P, et al. Evaluation of the polyphenol composition and antioxidant activity of african variety of, Dacryodes edulis, (G.Don) H.J lam fruit[J]. Journal of Medicinal Food, 2009, 12(6):1 321-1 325.
[32] SAHA S S, GHOSH M. Antioxidant and anti-inflammatory effect of conjugated linolenic acid isomers against streptozotocin-induced diabetes[J]. British Journal of Nutrition, 2012, 108(6):974-983.
[33] 杨少辉,宋英今,王洁华,等.雪莲果体外抗氧化和自由基清除能力[J].食品科学,2010,31(17):166-169.
[34] 侯召华,刘畅,任贵兴.煮炸和冷冻干燥对鹿茸中脂溶性成分及色差的影响[J]. 现代食品科技, 2017,33(10):164-170;267.
[35] 周志刚.鸭肉宰后肌肉色差研究性分析[J].肉类工业, 2014(8);23-26.
[36] 杜天浩,周小婷,朱兰英,等.褪黑素处理对盐胁迫下番茄果实品质及挥发性物质的影响[J].食品科学, 2016, 37(15):69-76.
[37] DAHMOUNE F, NAYAK B, MOUSSI K, et al. Optimization of microwave-assisted extraction of polyphenols from Myrtus communis L. leaves[J]. Food Chemistry, 2015, 166:585-595.
[38] 童晓滨.从雷竹叶中提取茶多酚及其红外光谱的研究[J].化学世界, 2010, 51(10):609-612.
[39] 黄琦,王启越,李颖, 等.石榴皮总多酚的微波辅助提取工艺及抗氧化活性研究[J].食品研究与开发, 2016, 37(12):46-51.
[40] 王琼,初丽君,寇莉萍.近红外光谱快速检测石榴果皮多酚与黄酮含量[J].食品工业科技, 2017,38(20):298-302;333.
[41] 童晓滨.从雷竹叶中提取茶多酚及其红外光谱的研究[J].化学世界, 2010, 51(10):609-612.