植物乳杆菌是发酵食品中常见的乳酸菌,其作为发酵剂应用于发酵食品生产时,可以避免继代培养引起的活力退化和杂菌污染等问题[1-2],并可显著提高生产效率和改善发酵风味。近几十年的研究亦发现,植物乳杆菌具有很广泛的益生作用,如降低胆固醇、降血糖、抗菌消炎、提高人体免疫力等益生功能[3-8]。随着物乳杆菌的应用越来越广泛,提高植物乳杆菌的增殖浓度,进而提高生产效率、降低成本,对植物乳杆菌的进一步推广具有重要的促进意义。
营养底物与高密度培养技术是影响植物乳杆菌生长繁殖的主要因素。细胞生长所必需的成分包括碳源、氮源、无机盐、促生长物质等,这些营养成分显著影响乳酸菌生长速率及最大生物量。其中,碳源、氮源是乳酸菌生长繁殖不可或缺的营养物质。葡萄糖为单糖且价格低廉,是益生菌的最佳利用碳源[9-10],微生物生长代谢与产物合成需要氮源,乳酸菌对不同氮源的利用效率不同,寻求经济、利用效果好的食品级氮源对于菌株发酵培养至关重要[11-12]。提高植物乳杆菌增殖浓度,不仅要优化培养基营养成分,而且需要改善高密度培养技术手段。高密度培养是通过改善发酵工艺,提高单位体积发酵液的生物量[13]。目前主要的高密度培养技术有恒pH培养、循环培养、固定化培养、过滤培养等[1]。恒pH培养因其操作简单,易于控制,依然是国内乳酸菌工业化生产的主流方式,但是恒pH培养方式仍有待解决两个问题:分批培养过程中出现的碳氮源缺乏或初始浓度过高抑制菌株生长;补料模式不科学,未根据消耗规律科学补料且非智能化控制,几乎无法实现工业化应用[14]。
本研究通过解析植物乳杆菌的关键生长底物,并基于渗透压和最适底物优化恒pH分批培养和恒pH分批自动反馈补料培养,从而提高菌株单位体积的活菌数,为提高植物乳杆菌的工业化生产效率奠定基础。
1.1.1 菌株
L.plantarum X1、L.plantarum N8、L.plantarum N9,来源于江南大学食品生物中心菌种保藏中心。
1.1.2 试剂
胰蛋白胨、牛肉膏、酵母粉、无水葡萄糖、无水乙酸钠、MgSO4·7H2O、MnSO4·H2O、柠檬酸氢二钠、无水K2HPO4、吐温80,国药集团化学试剂有限公司;葡萄糖测定试剂盒,上海荣盛生物药业有限公司;酵母蛋白FM103、酵母浸粉FM803、酵母浸粉FM528、酵母提取物FD00-A、大豆蛋白胨FP410、鱼骨蛋白胨FP350,安琪酵母股份有限公司;胰蛋白胨AL-17445、水解植物蛋白AL-17446,上海创赛科技有限公司。
高速冷冻离心机,Eppendorf公司;löser-om806m型冰点渗透压测定仪,德国löser公司;T&J-Minipod 1L×8型迷你平行发酵罐,迪必尔生物工程有限公司;GRP-9080型隔水式恒温培养箱,上海森信实验仪器有限公司;FE20型pH计、EL3002型电子天平,梅特勒-托利多仪器有限公司;MS 3 basic型涡旋振荡器,德国IKA公司;MLS-3750型高温高压灭菌锅,日本SANYO公司;ZHJH-C1115B型超净工作台,上海智诚分析仪器制造有限公司;UV-2450紫外分光光度计,日本岛津公司。
1.3.1 植物乳杆菌的活化和培养
从冰箱取出冷冻的保菌管,置于冰盒中冰浴溶解后,使用接种环挑取种子液在固体培养基上划线,置于37℃恒温培养箱中培养24~48 h,使菌种复壮。挑取单菌落接种于5 mL液体MRS培养基中,在37℃ 恒温培养箱中培养18~24 h。重复上述操作2次得到活力旺盛的种子液用于后续实验。
1.3.2 生长曲线测定
将活力旺盛的种子液以1%接种量接种于新鲜MRS培养基中,置于37 ℃ 恒温培养箱培养,分别取2、4、6、8、10、12 h的菌悬液测波长600 nm处的OD值。以培养时间为横坐标,各时间点OD600为纵坐标,绘制植物乳杆菌生长曲线。
1.3.3 氮源利用分析
不同氮源培养基(g/L):氮源1(酵母蛋白FM103、酵母浸粉FM803、酵母浸粉FM528、酵母提取物FD00-A、大豆蛋白胨FP410、鱼骨蛋白胨FP350、胰蛋白胨AL-17445、水解植物蛋白AL-17446)、葡萄糖6、无水K2HPO410、Na2HPO4 10、MgSO4·qH2O0.25、MnSO4·H2O 0.05,对照组氮源为胰蛋白胨0.4、牛肉膏 0.4、酵母粉 0.2,培养基灭菌后接入1%种子液,置于37℃恒温培养箱中静置培养,待菌株生长至稳定期测定OD600。
1.3.4 生长限制性无机盐的测定
用NaCl替换MRS培养基中的无机盐(K2HPO4、柠檬酸氢二铵和乙酸钠),以MRS培养基作为对照,调节渗透压保持一致。各培养基以2/3的装样量置于500 mL的平行发酵罐,灭菌后接入5%种子液扩大培养,以缩短发酵周期和减少染菌机会。控制发酵温度37℃,恒pH 6.0培养,每隔2 h取样测定发酵液的OD600和活菌数。
1.3.5 微量元素(Mn)最适浓度的测定
按最适氮源25 g/L,葡萄糖20 g/L,微量元素MnSO4质量浓度分别为0.05、0.15、0.25、0.35 g/L,配制不同MnSO4浓度的培养基,各培养基以2/3的装样量置于平行发酵罐,灭菌后接入5% 种子液扩大培养,控制发酵温度37 ℃,恒pH 6.0自动反馈补糖培养, 待菌株生长至稳定期测定活菌数。
1.3.6 促生长物质分析
采用1.3.3方法,以实验菌株的最佳氮源为培养基氮源,添加不同种类的促生长物质0.3 g/L (核苷酸(I+G)、核苷酸、腺嘌呤、复合维生素、VB族、胡萝卜粉、番茄粉),对照组不添加促生长物质,测定菌株稳定期OD600和活菌数。
1.3.7 最适生长pH的测定
将MRS中氮源替换成最佳氮源配制培养基,各培养基以2/3的装样量置于平行发酵罐,灭菌后接入5%种子液扩大培养,控制发酵温度37℃,在不同pH条件下(pH 5.0、5.5、6.0、6.5)恒pH培养至稳定期,测定发酵液活菌数。
1.3.8 最适生长渗透压及完全抑制渗透压的测定
MRS培养基渗透压为350 mOsm/kg,1 L MRS中添加3 g NaCl,渗透压可增加100 mOsm/kg;添加NaCl调节MRS培养基的渗透压,配制350、500、600、700、800、900、1 200、1 500、2 400、2 700、3 000 mOsm/kg不同渗透压条件的培养基。各培养基灭菌后接入1%种子液,置于37℃恒温静置培养;采用方法1.3.2,以时间为横坐标,lg OD600为纵坐标绘制植物乳杆菌在不同渗透压环境下生长曲线。
1.3.9 碳氮消耗比的测定
采用1.3.3方法的培养基配方,将最佳氮源作为培养基氮源。在发酵过程中不断监测发酵液中葡萄糖浓度和OD600,计算菌株生长速率被抑制时糖消耗量(碳氮比)。根据碳氮消耗比,配制不同梯度的碳氮比培养基,各培养基以2/3的装样量置于平行发酵罐,灭菌后接入5%种子液扩大培养,控制发酵温度37℃,恒pH 6.0自动反馈补糖培养, 待菌株生长至稳定期测定活菌数。
1.3.10 恒pH分批培养
根据培养基营养底物分析,确定菌株培养基最优底物组成。根据可耐受渗透压与最佳碳氮比,推算培养基中氮源含量,培养基中碳氮源初始浓度低于抑制生长渗透压的原则进行设定3个渗透压梯度。各培养基以2/3的装样量置于平行发酵罐,灭菌后接入5%种子液扩大培养,控制发酵温度37℃,以最优pH进行恒pH培养至稳定期,测定发酵液活菌数。
1.3.11 恒pH自动反馈补料培养[15-18]
根据培养基营养底物分析、最适碳氮比、可耐受渗透压与完全抑制渗透压,优化恒pH反馈补料工艺;(1)推算恒 pH 培养时菌体被完全抑制时消耗的氮源,配制渗透压为(350±20) mOsm/kg的培养基,补料液为400 g/L葡萄糖;(2)根据碳氮比配制环境渗透压为(350±20) mOsm/kg培养基,补料液为碳氮混合液(葡萄糖质量浓度都为200 g/L,氮源浓度按照最佳碳氮消耗比添加)。培养基以2/3的装样量置于平行发酵罐,灭菌后接入5%种子液扩大培养,控制发酵温度37℃,在最适pH条件下恒pH培养至稳定期,测定发酵液活菌数。
1.3.12 分析方法
测定生物量,采用光密度法;测定葡萄糖浓度,采用葡萄糖氧化酶-过氧化物酶法;活菌数,采用平板菌落计数法。
1.3.13 数据统计与分析
试验中每个实验值均为3次平行实验的平均值,在后期的统计分析中不再重复强调。
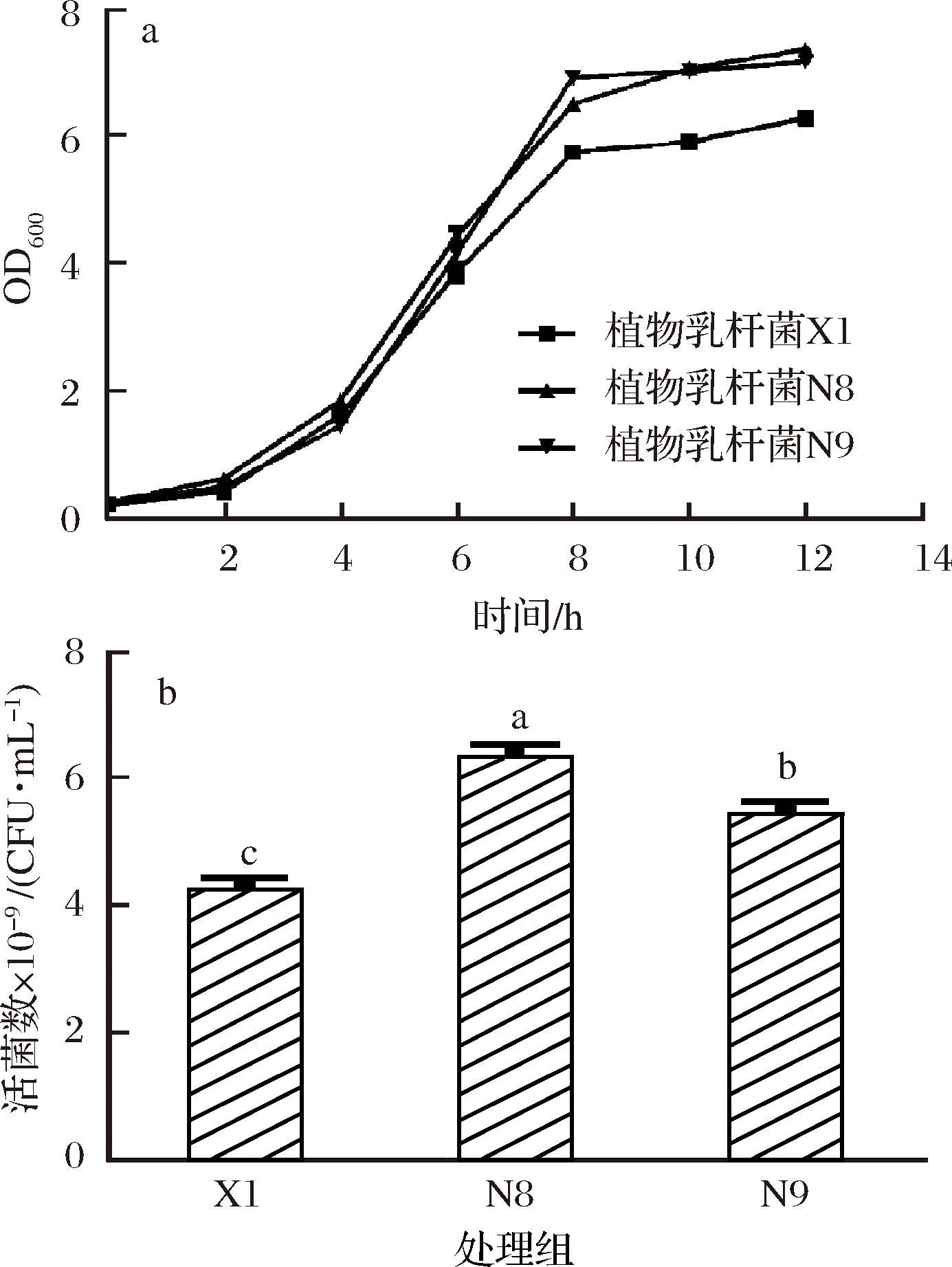
由图1可知,3株植物乳杆菌的生长趋势相同,菌株发酵均在8~12 h达到稳定期,此时生物量最大且基本保持稳定,测定稳定期活菌数。

a-植物乳杆菌生长曲线图;b-植物乳杆菌稳定期活菌数
图1 植物乳杆菌生长曲线和最大生物量
Fig.1 Growth curve and viable counts of L.plantarum
in MRS medium
注:不同小写字母表示具有显著性差异(P<0.05)(下同)
植物乳杆菌在发酵培养过程中容易受到酸和碳源不足的抑制,发酵结束后发酵液中仍有氮源剩余,从而无法比较同等质量氮源对菌株的增殖差异。氮源筛选培养基可以提高培养基中碳氮比、增强无机盐缓冲能力,从而缓解发酵过程中的酸抑制及弥补发酵体系中碳源不足。
采用氮源筛选方法1.3.3,分析单位质量氮源对植物乳杆菌增殖效果。从表1可以看出,3株植物乳杆菌对微生物类氮源的利用具有偏好性,特别是对酵母蛋白FM103、酵母浸粉FM803与酵母浸粉FM528的利用。植物乳杆菌X1、N8、N9的最佳利用氮源分别为酵母浸粉FM803、酵母浸粉FM 528、酵母浸粉FM 803,植物乳杆菌利用1g最佳氮源的增殖效果(OD600)分别达到1.48±0.02、1.56±0.01、1.82±0.07。
为了进一步探究不同种类氮源条件下菌株增殖差异是否因氮源含有生长因子,研究复合氮源对菌株的增殖效果。将增殖效果差的氮源和可能含有生长因子的酵母类氮源按照1∶1比例复配,分析对3株植物乳杆菌的增殖效率。通过计算得知,增殖效果差的氮源与含生长因子的酵母复配并未提高最大生物量。
表1 不同氮源发酵液分批培养植物乳杆菌的最高生物量(OD600)
Table 1 Maximum biomass of L. plantarum in batch culture with different nitrogen sources
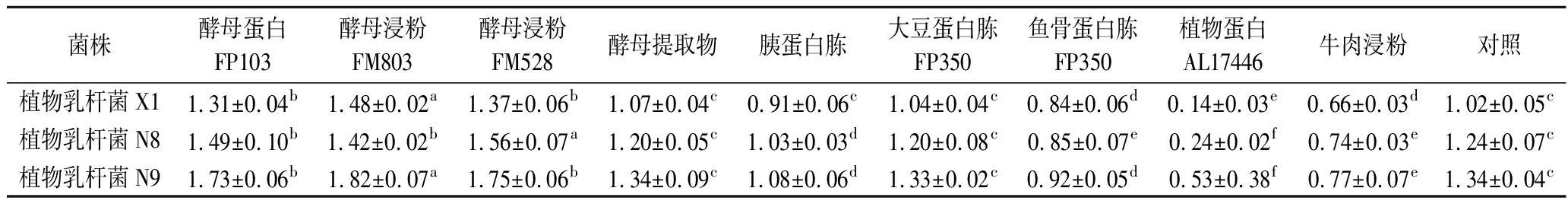
菌株酵母蛋白FP103酵母浸粉FM803酵母浸粉FM528酵母提取物胰蛋白胨大豆蛋白胨FP350鱼骨蛋白胨FP350植物蛋白AL17446牛肉浸粉对照植物乳杆菌X11.31±0.04b1.48±0.02a1.37±0.06b1.07±0.04c0.91±0.06c1.04±0.04c0.84±0.06d0.14±0.03e0.66±0.03d1.02±0.05c植物乳杆菌N81.49±0.10b1.42±0.02b1.56±0.07a1.20±0.05c1.03±0.03d1.20±0.08c0.85±0.07e0.24±0.02f0.74±0.03e1.24±0.07c植物乳杆菌N91.73±0.06b1.82±0.07a1.75±0.06b1.34±0.09c1.08±0.06d1.33±0.02c0.92±0.05d0.53±0.38f0.77±0.07e1.34±0.04c
注:不同小写字母表示具有显著性差异(P<0.05)(下同)
综上,植物乳杆菌对微生物氮源利用具有偏好性,对其他种类氮源利用较差。即使在增殖效果较差的氮源中添加增殖效果好酵母粉也并没有促进菌株对其利用,说明植物乳杆菌对不同种类氮源利用效果的不同,不是由氮源中生长因子导致的,而是因氮源中有效成分。该结果进一步证明氮源中肽含量是乳酸菌生长的限制因素[19-20]。
不同微生物生长繁殖需要的无机盐不同,不同无机盐在发酵培养中作用不同。乙酸盐、柠檬酸盐与磷酸盐具有缓冲作用,可以避免乳酸菌在发酵过程中因 pH 迅速下降而死亡[21]。微生物的胞内代谢反应需要高钾低钠生态环境,防止细胞水肿,势能储备[22]。
由图3可知,在培养基中添加缓冲盐,仅仅起到缓冲剂的作用,对植物乳杆菌生长无促进作用。因此,植物乳杆菌在恒pH培养时培养基中无需添加无机盐。
不同乳杆菌的代谢途径不同,不同代谢途径中关键酶也不同,因此,乳杆菌生长繁殖所需要的微量元素不同。植物乳杆菌代谢属于同型发酵,葡萄糖发酵利用糖酵解途径(embden-meyerhof-parnas,EMP),主要代谢产物是乳酸。在EMP途径中,丙酮酸与NADH在乳酸脱氢酶作用下生成乳酸,Mn不仅对NADH氧化有巨大的刺激作用[23],还是乳酸脱氢酶的组成成分[24],因此Mn是EMP途径中关键代谢酶的激活剂[25]。
由图4可知,植物乳杆菌最大生物量与低浓度微量元素呈正相关。当质量浓度高于0.25 g/L,持续增高并未显著提高活菌数。因此,植物乳杆菌的MnSO4最适添加量为0.25 g/L。

a-植物乳杆菌X1;b-植物乳杆菌N8;c-植物乳杆菌N9;
图2 复合氮源发酵液分批培养植物乳杆菌的最高生物量(OD600)
Fig.2 Maximum biomass of L. plantarum in batch culture with different composite nitrogen sources
注:1-酵母浸粉803+大豆蛋白陈;2-酵母浸粉803+酵母提取物;3-酵母浸粉803+牛肉浸粉;4-酵母浸粉803+水解植物蛋白;
5-酵母浸粉803+胰蛋白腺;6-酵母浸粉803+鱼骨蛋白膝;7-酵母浸粉803
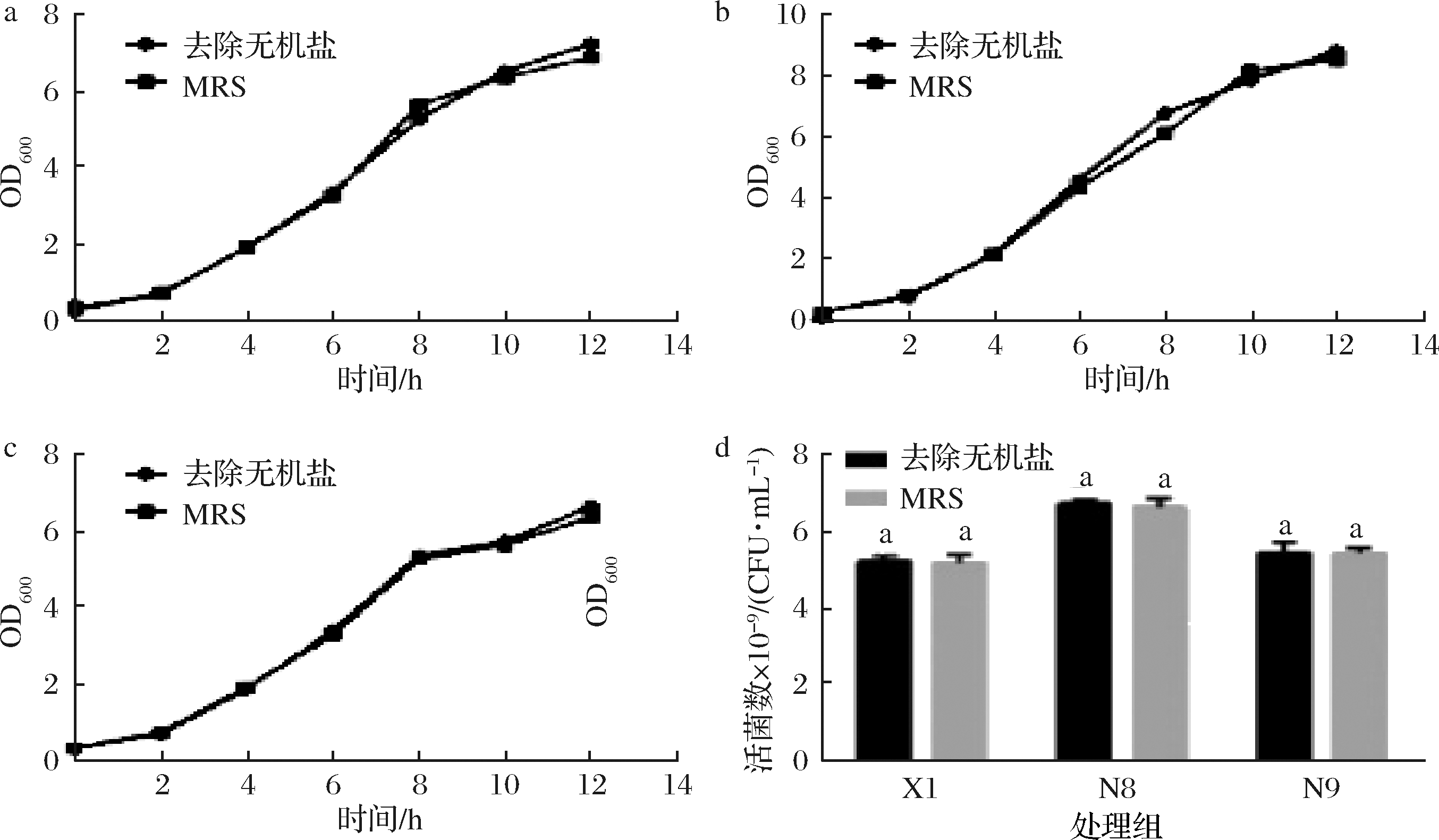
a、b、c-植物乳杆菌X1、N8、N9的生长曲线;d-植物乳杆菌X1、N8、N9利用无机盐恒pH培养的活菌数
图3 植物乳杆菌利用无机盐恒pH培养生长曲线和活菌数
Fig.3 Growth curve and viable counts of L. plantarum in mediums containing different inorganic salts under pH-controlled condition
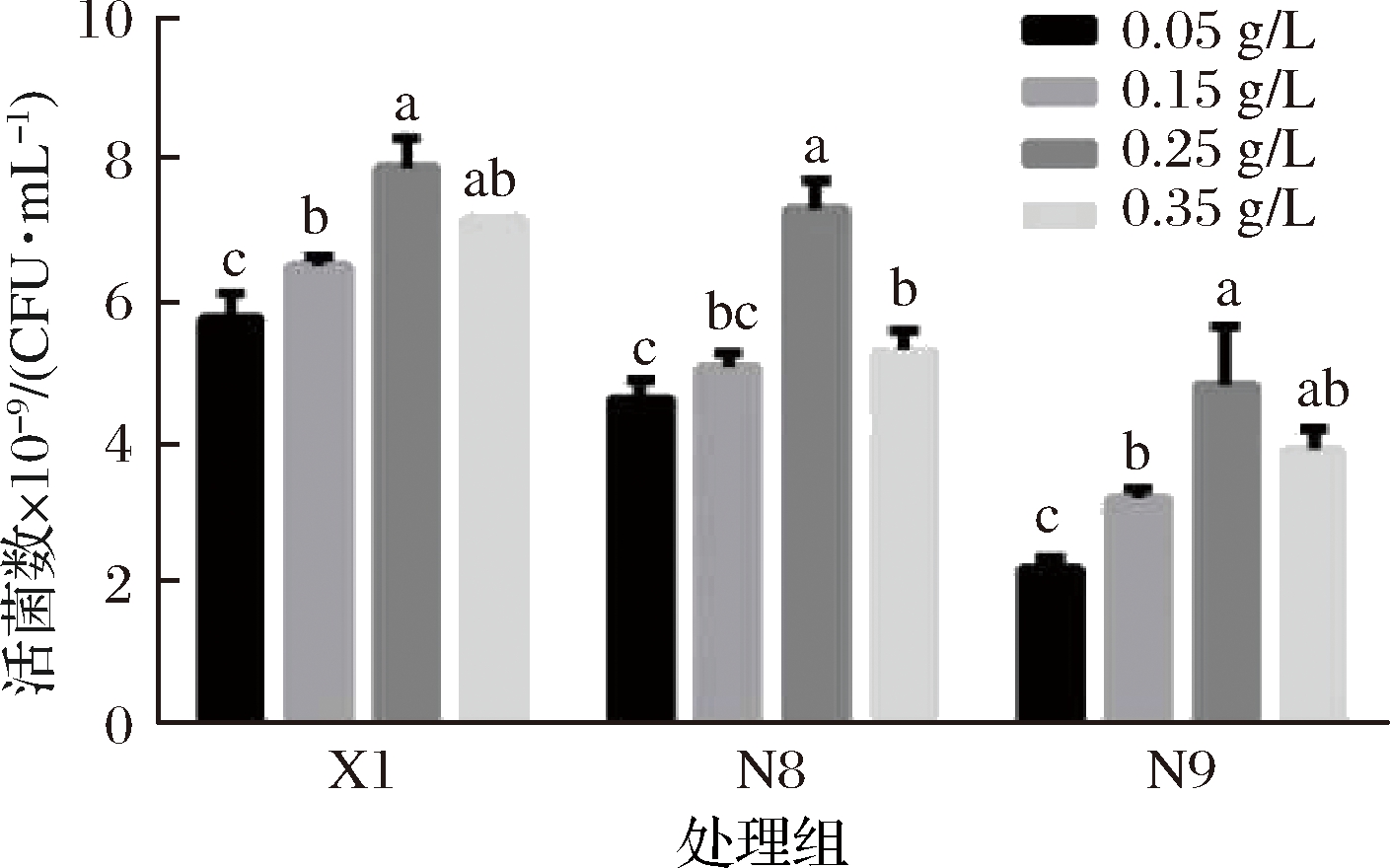
图4 植物乳杆菌利用不同浓度微量元素MnSO4
恒pH补料培养的活菌数
Fig.4 Proliferation concentration of L.plantarum cultured
in mediums with different manganese concentrations
under pH-controlled condition
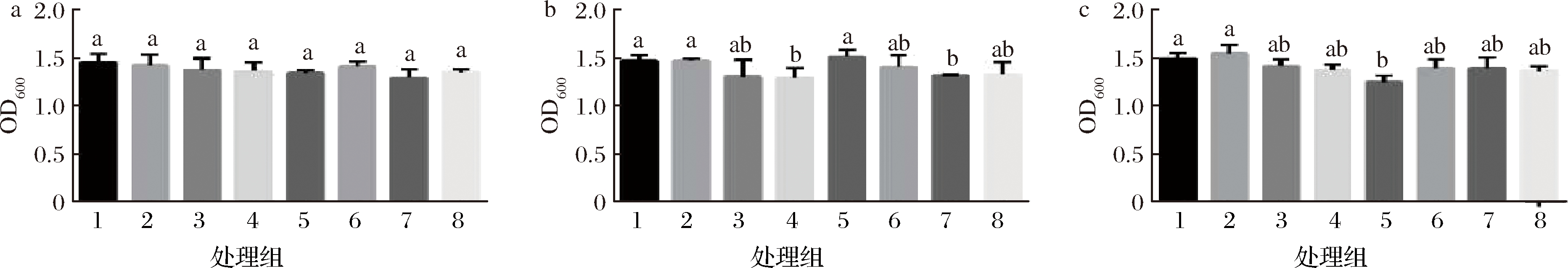
促生长因子是可以刺激微生物的生长活性、调节细胞生长和细胞生理功能的多肽物质。本实验以酵母粉为基础氮源,添加生长因子分析植物乳杆菌的促生长物质。从图5可知,以酵母浸粉类为氮源时,不需要额外添加其他促生长物质。
在培养基或环境中,pH从多方面影响着植物乳杆菌生命活动,pH不仅影响胞内外酶的生物活性,还影响影响植物乳杆菌对营养物质的吸收以及改变培养基中化合物离子化程度,由而促进或抑制乳酸菌的繁殖生长。不同菌株的最适生长pH条件不同,由图6可知,植物乳杆菌X1、植物乳杆菌N8最适生长pH条件为 5.5,植物乳杆菌N9最适生长pH条件为6.0。
渗透压是影响微生物生长繁殖的环境因子之一,通过影响细胞内水分活度、细胞膜通透性、蛋白质分子结构与细胞生理功能,从而影响菌株生长繁殖。乳杆菌在生长繁殖过程中产生代谢产物会引起渗透压升高,因此菌株高密度培养最大生物量与乳杆菌环境耐渗性有关[2, 26]。
由图7可知,植物乳杆菌X1在培养基渗透压超过800 mOsm/kg时生长速率被抑制,渗透压达到2 700 mOsm/kg时菌株生长完全被抑制; 植物乳杆菌N8在培养基渗透压超过800 mOsm/kg时生长速率被抑制,渗透压达到3 000 mOsm/kg时菌株生长完全被抑制;植物乳杆菌N9在培养基渗透压超过1 200 mOsm/kg时生长速率被抑制,渗透压达到2 700 mOsm/kg时菌株生长完全被抑制。
a-分别以植物乳杆菌X1;b-植物乳杆菌N8;c-植物乳杆菌N9
图5 植物乳杆菌分析促生长物质(OD600)
Fig.5 Maximum biomass of L. plantarum in mediums with different composite nitrogen sources
注:1-酵母浸粉803;2-酵母浸粉803+I+G;3-酵母浸粉803+VB族;4-酵母浸粉803+番茄粉;5-酵母浸粉803+复合核苷酸;
6-酵母浸粉803+复合维生素;7-酵母浸粉803+胡萝卜粉;8-酵母浸粉803+腺嘌呤
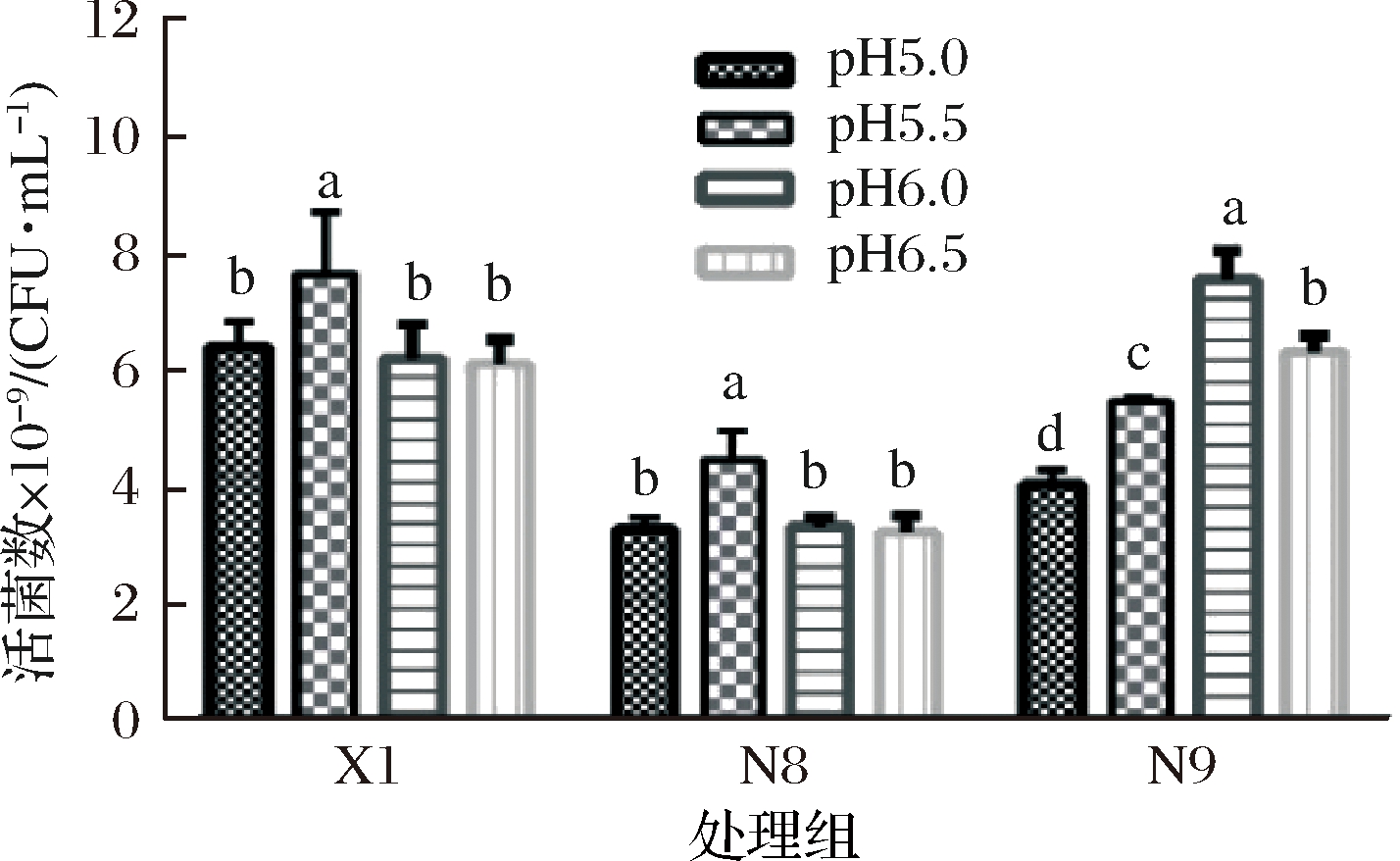
图6 植物乳杆菌在不同pH条件下恒pH培养的活菌数
Fig.6 Proliferation concentration of L. plantarum
cultured under different pH-controlled condition
基于氮源优化结果,选择增殖效果最佳的氮源,采用快速筛选氮源的培养基和方法,测定植物乳杆菌生长速率拐点的葡萄糖消耗量,即碳氮消耗比,结果如表2所示。
根据碳氮消耗比,设置不同梯度的碳氮比,使培养基初始渗透压低于影响各自菌株生长速率的渗透压值。由图8可知,过高的碳氮比没有促进菌株的生长,反而会对菌株的生长速率有一定影响,因此植物乳杆菌X1、N8、N9的最佳碳氮比分别为2.2 ∶1、2.2 ∶1、3.0 ∶1;
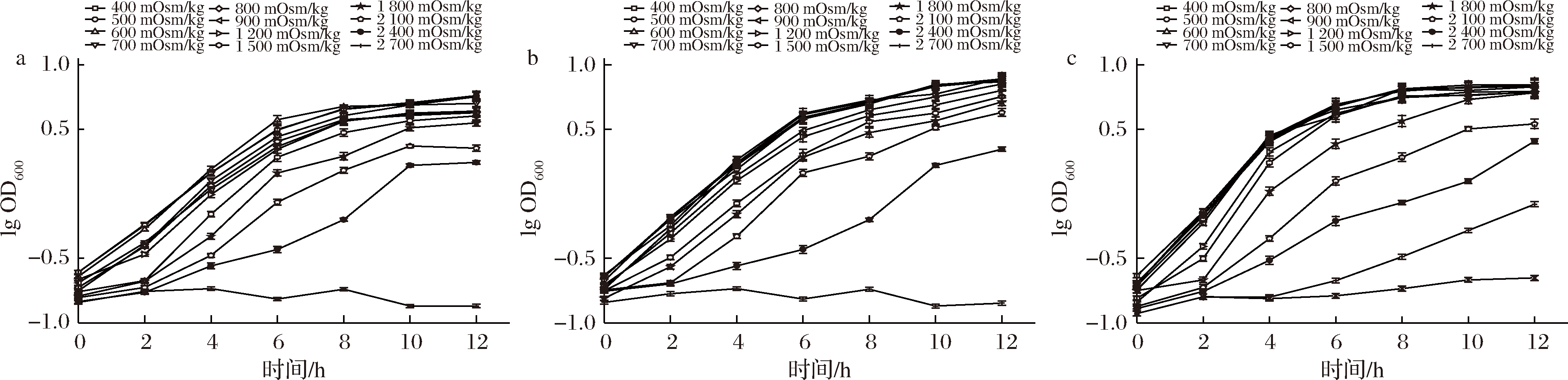
a-植物乳杆菌X1;b-植物乳杆菌N8;c-植物乳杆菌N9
图7 植物乳杆菌在不同渗透压条件下的生长曲线
Fig.7 Proliferation concentration of L.plantarum in different osmotic pressure
表2 植物乳杆菌生长速率被抑制时碳氮消耗比
Table 2 Consumption ratio of carbon to nitrogen when the
growth rate of L.plantarum is inhibited

菌株植物乳杆菌X1植物乳杆菌N8植物乳杆菌N9碳氮消耗比(2.2±0.02)∶1(2.2±0.05)∶1(3.0±0.03)∶1
葡萄糖为单糖且价格低廉,是益生菌的最佳利用碳源[9-10],理论上菌株生长繁殖最大生物量与碳源含量呈正相关,但当发酵液的渗透压高于最适生长渗透压时,菌株的生长速率受到抑制渗透压,因此探究恒pH培养工艺的最适底物浓度至关重要(图9)。
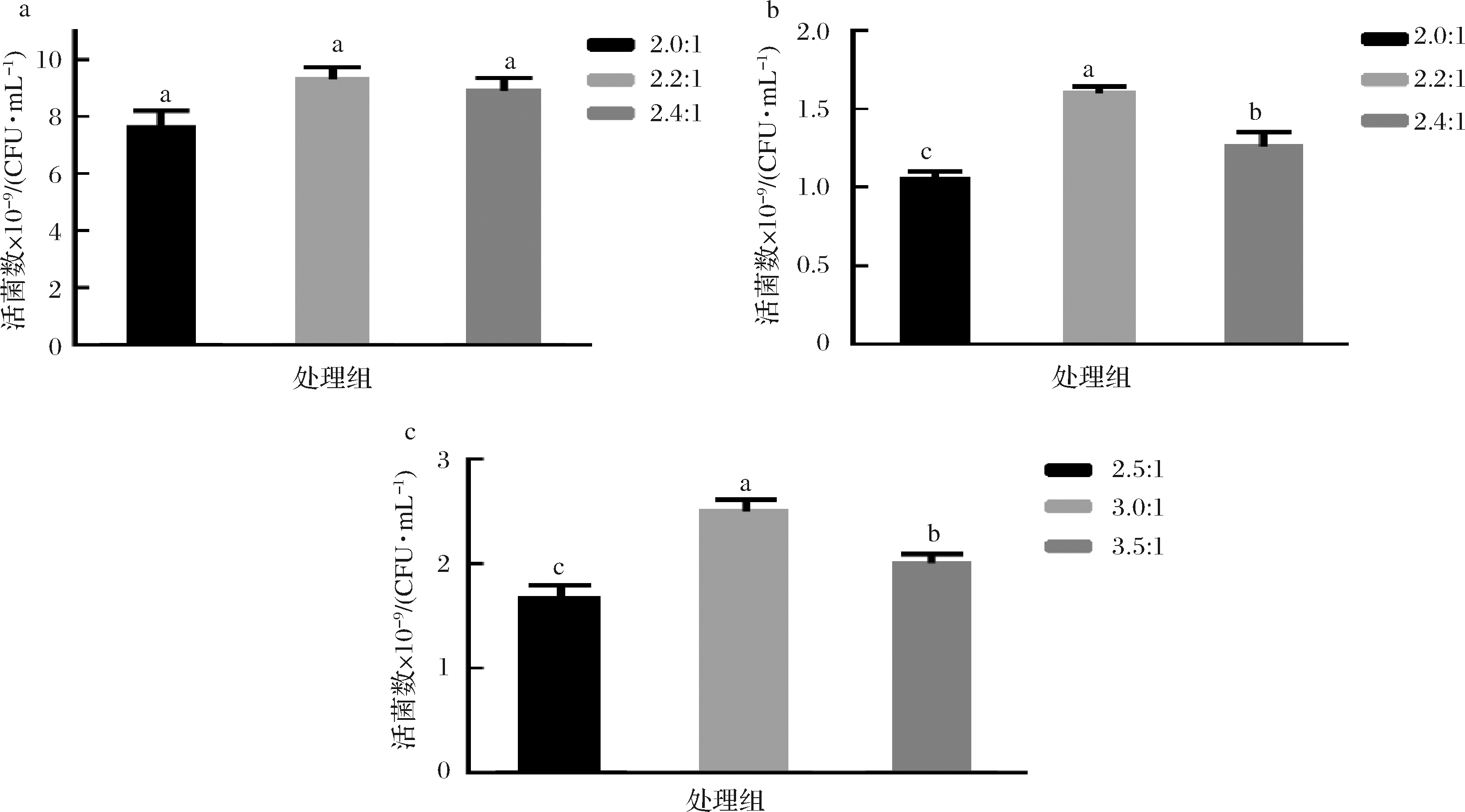
a-分别为植物乳杆菌X1;b-植物乳杆菌N8;c-植物乳杆菌N9
图8 不同碳氮比恒 pH 培养的活菌数
Fig.8 The viable counts with different carbon and nitrogen ratios under pH-controlled condition
2.8.1 植物乳杆菌X1恒pH分批培养
由上述结果可知,菌株的最佳氮源为酵母浸粉FM803、最适MnSO4浓度为0.25 g/L、最佳碳氮比2.2 ∶1、影响菌株生长的初始渗透压为800 mOsm/kg以及完全抑制渗透压为2 700 mOsm/kg。通过计算,配制酵母浸粉FM803 30、35、40 g/L,碳氮比2.2 ∶1,MnSO4 0.25 g/L,培养基环境渗透压分别为(600±5)、(700±7)、(800±9)mOsm/kg,恒pH 5.5分批培养。发酵培养12h达到稳定期,发酵液渗透压均低于1 800 mOsm/kg。碳氮比同等条件下,酵母浸粉FM803 40 g/L,葡萄糖88 g/L,MnSO4 0.25 g/L对植物乳杆菌X1增殖效果好,活菌数达到3.1×1010CFU/mL。
2.8.2 植物乳杆菌N8恒pH分批培养
配制酵母浸粉FM528 30、35、40 g/L,碳氮比2.2 ∶1,MnSO4 0.25 g/L,3种培养基的渗透压分别为(585±5)、(695±7)、(784±9) mOsm/kg,恒pH 5.5分批培养,发酵培养12 h达到稳定期,发酵液渗透压低于2 200 mOsm/kg,没有达到完全抑制渗透压。碳氮比同等条件下,酵母浸粉FM528 40 g/L,葡萄糖88,MnSO4 0.25 g/L分批培养对植物乳杆菌N8增殖效果好,葡萄糖几乎没有剩余,最终的活菌数可以达到2.9×1010 CFU/mL。
2.8.3 植物乳杆菌N9恒pH分批培养
配制酵母浸粉FM 528 35、40、45 g/L,碳氮比3∶1,MnSO40.25 g/L,3种培养基的渗透压分别为(875±7)、(1 000±6)、(1 125±9) mOsm/kg,恒pH 6.0分批培养。发酵培养12 h至稳定期,发酵后环境渗透压低于2 200 mOsm/kg,没有达到完全抑制渗透压。碳氮比同等条件下,氮源45 g/L,葡萄糖135 g/L对植物乳杆菌X1增殖效果好,最终的活菌数可以达到6.2×1010 CFU/mL。
由图10可知,植物乳杆菌X1最佳补料工艺为酵母浸粉FM803 40 g/L,葡萄糖15 g/L,MnSO4 0.25 g/L,持续补糖36 mL,葡萄糖补料液浓度为400 g/L,活菌数达到4.1×1010 CFU/mL。植物乳杆菌N8补糖补料工艺与补糖氮补料工艺的活菌数没有显著差别,均可达到2.2×1010 CFU/mL。植物乳杆菌N9的补糖氮工艺活菌数比补糖工艺显著增高,最佳补料工艺为酵母浸粉FM803 15 g/L,葡萄糖45 g/L,MnSO4 0.25 g/L,持续补料150 mL,该补料液为碳氮比为3∶1(酵母浸粉FM803 50 g/L),活菌数可以达到5.4×1010 CFU/mL。
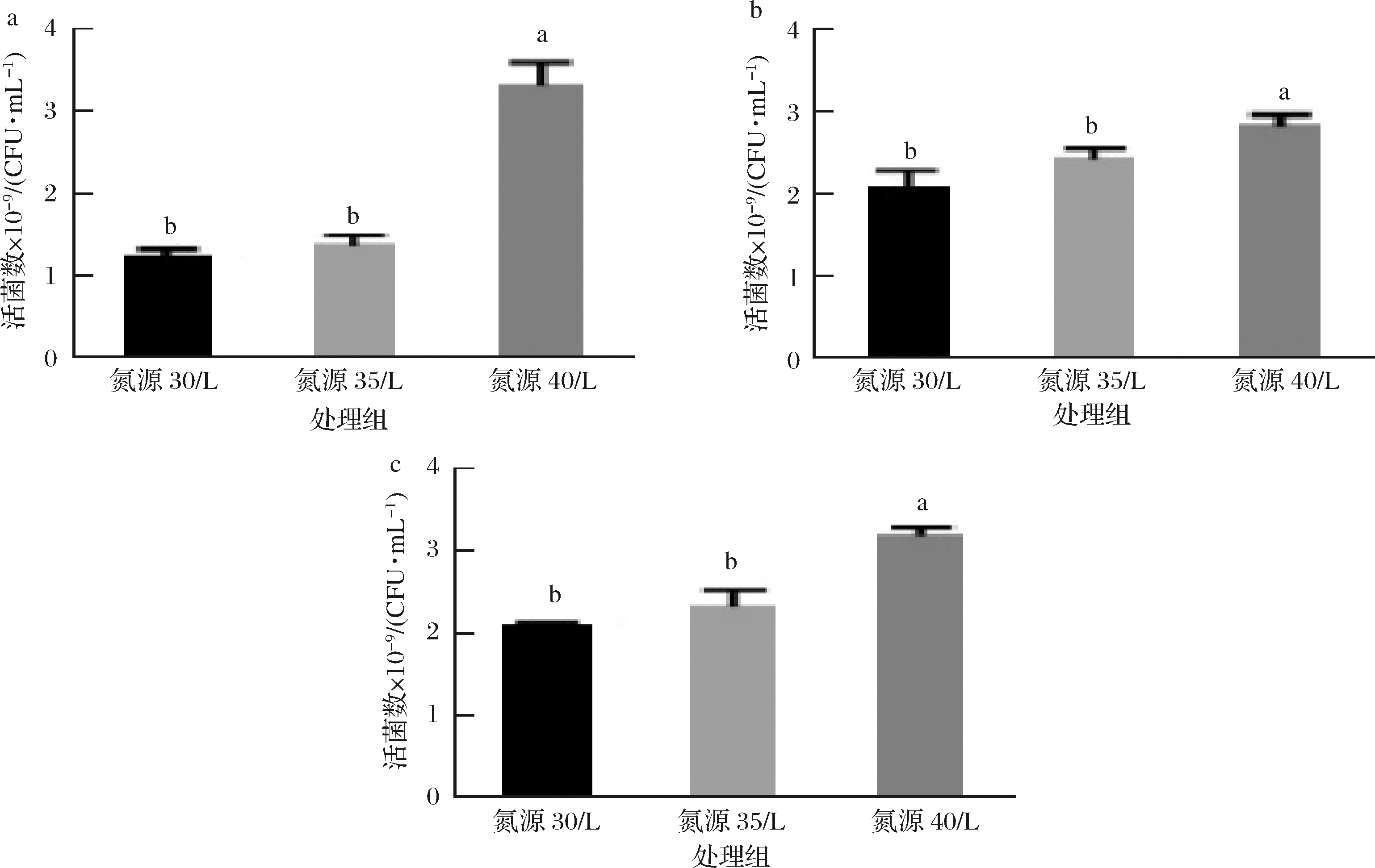
a-植物乳杆菌X1分批培养活菌数;b-植物乳杆菌N8分批培养活菌数;c-植物乳杆菌N9分批培养活菌数
图9 植物乳杆菌恒pH分批培养的活菌数
Fig.9 Proliferation concentration of L.plantarum during constant pH feeding culture
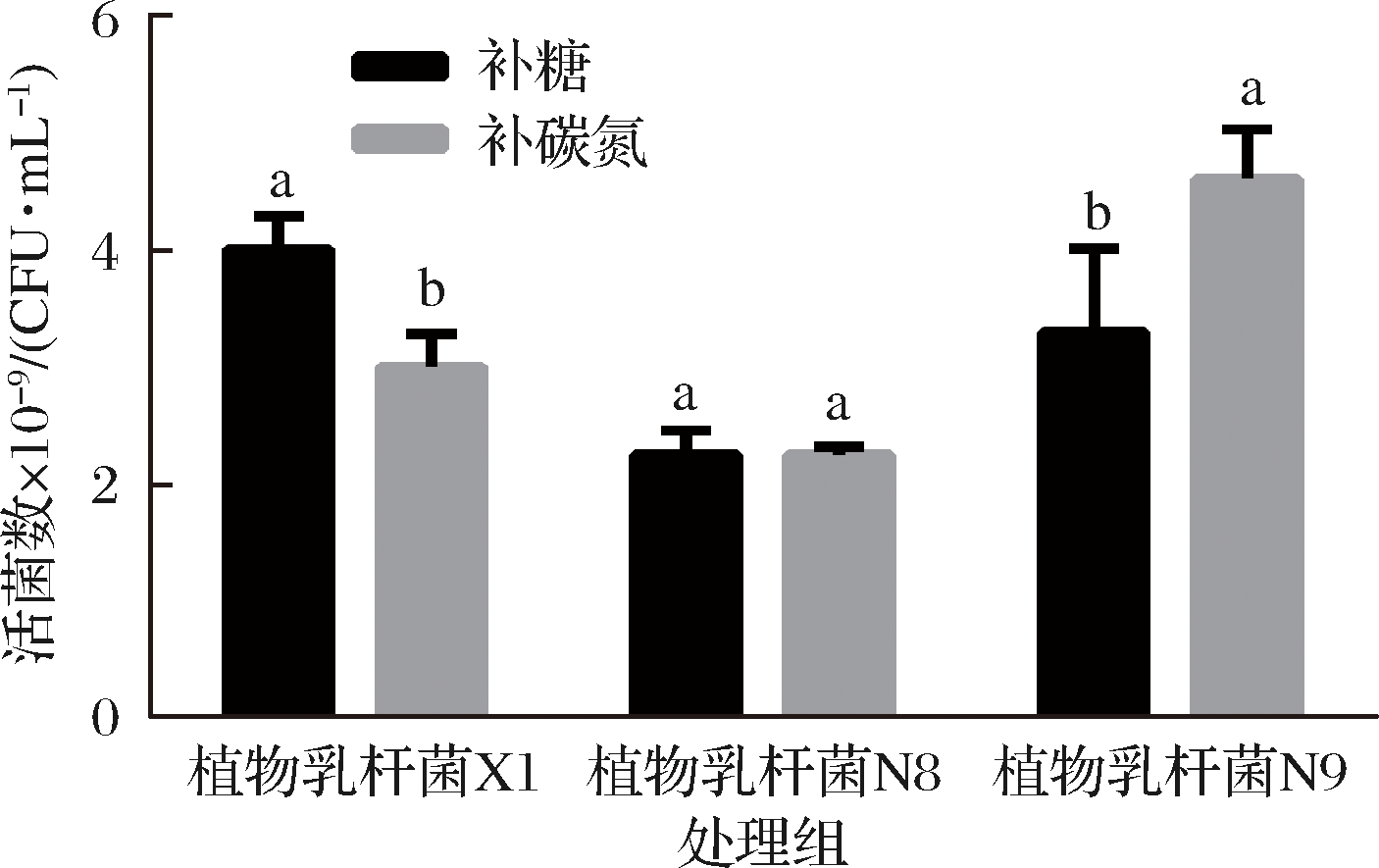
图10 植物乳杆菌恒pH自动反馈补料工艺
Fig.10 Proliferation concentration of L.plantarum
during pH-controllde using the automatic feedback
feeding method
植物乳杆菌对不同种类氮源的利用具有偏好性,其可高效利用酵母类氮源,对胰蛋白胨和大豆蛋白胨利用较差,几乎不利用植物水解蛋白胨。
植物乳杆菌对氮源的偏好性归因去菌体自身不能利用非酵母类氮源的肽,与促生长因子无关。且以酵母浸粉类为氮源时,不需要额外添加其他促生长物质。
缓冲盐在分批培养时通过减缓pH的降低提高乳酸菌的生物量,但在恒pH培养时缓冲盐对对植物乳杆菌的生长没有促进作用。
植物乳杆菌生长浓度与微量元素浓度呈正相关,当培养基中MnSO4浓度低于0.25 g/L时,浓度越高菌株能达到的最高生物量越高,但过高的微量元素浓度会抑制菌株生长。
植物乳杆菌在恒pH培养时渗透压是其主要抑制因素,植物乳杆菌X1在培养基渗透压超过800 mOsm/kg时生长速率被抑制,渗透压达到2 700 mOsm/kg时菌株生长完全被抑制;植物乳杆菌N8在培养基渗透压超过800 mOsm/kg时生长速率被抑制,渗透压达到3 000 mOsm/kg时菌株生长完全被抑制;植物乳杆菌N9在培养基渗透压超过1 200 mOsm/kg时生长速率被抑制,渗透压达到2 700 mOsm/kg时菌株生长完全被抑制。
植物乳杆菌培养过程中最适碳氮比为对数生长期生长速率被抑制时的碳氮消耗比,植物乳杆菌X1和植物乳杆菌N8最适碳氮比均为2.2 ∶1,植物乳杆菌N9最适碳氮比为3.0 ∶1,菌株最适碳氮比对培养工艺策略优化具有重要的指导意义。
植物乳杆菌的培养应控制发酵体系渗透压在各自的可耐受渗透压范围内,植物乳杆菌X1最适培养策略:酵母浸粉FM803 40 g/L,葡萄糖15 g/L,MnSO4 0.25 g/L,恒pH 5.5恒温37℃自动反馈补料36 mL葡萄糖溶液(质量浓度为400 g/L),活菌数提高约10倍,达到4.1×1010 CFU/mL;植物乳杆菌N8最适培养策略为酵母浸粉FM528 40 g/L,葡萄糖88 g/L,MnSO4 0.25 g/L恒pH 5.5恒温37℃分批培养,活菌数提高约5倍,达到2.9×1010CFU/mL。植物乳杆菌N9最适培养策略为酵母浸粉FM803 45 g/L,葡萄糖135 g/L,MnSO40.25 g/L,恒pH 6.0恒温37℃分批培养,活菌数提高约12倍,达到6.2×1010 CFU/mL。
[1] 熊涛, 黄锦卿, 宋苏华, 等. 植物乳杆菌发酵培养基的优化及其高密度培养技术[J]. 食品科学, 2011, 32(7): 262-268.
[2] CUI S, ZHAO J, LIU X, et al. Maximum-biomass prediction of homofermentative Lactobacillus[J]. Journal of Bioscience & Bioengineering, 2016, 122(1): 52-57.
[3] 华宝珍, 李莎, 徐爱才, 等. 植物乳杆菌ST-Ⅲ脱脂乳的发酵工艺优化[J]. 农业工程学报, 2014, 30(11): 276-284.
[4] 韩庆功,崔艳红,王元元,等.植物乳杆菌的生理特性及体外益生效果研究[J]. 粮食与饲料工业, 2018(3):42-46.
[5] MANN G V. Studies of a surfactant and cholesteremia in the Maasai[J]. American Journal of Clinical Nutrition, 1974, 27(5): 464-469.
[6] KIM Y, YOON S,LEE-S B, et al. Fermentation of soy milk via Lactobacillus plantarum improves dysregulated lipid metabolism in rats on a high cholesterol diet[J]. Plos One, 2014, 9(2): e88 231.
[7] THIRAWORAWONG T, SPINLER J K, WERAWATGANON D, et al. Anti-inflammatory properties of gastric-derived lactobacillus plantarum XB7 in the context of helicobacter pylori Infection[J]. Helicobacter, 2014, 19(2): 144-55.
[8] PANWAR H, CALDERWOOD D, GRANT I R, et al. Lactobacillus strains isolated from infant faeces possess potent inhibitory activity against intestinal alpha- and beta-glucosidases suggesting anti-diabetic potential [J]. European Journal of Nutrition, 2014, 53(7): 1 465-1 474.
[9] LOOIJESTEIJN PJBOELS I C, KLEEREBEZEM M, HUGENHOLTZ J. Regulation of exopolysaccharide production by Lactococcus lactis subsp. cremoris by the sugar source [J]. Appl Environ Microbiol, 1999, 65(11): 5 003-5 008.
[10] 徐洪伟, 鞠红梅, 孙琪, 等. 小分子肽产生菌培养基碳源与氮源的优化[J]. 中国卫生检验杂志, 2011, 21(8): 1 931-1 932.
[11] 朱丹凤, 王园园, 崔树茂, 等. 罗伊氏乳杆菌氮源利用的选择性与特征分析[J]. 食品与发酵工业, 2018,44(11): 39-45.
[12] 张白曦, 李敏, 陈海琴, 等. 氮源对解脂耶氏酵母合成共轭亚油酸的影响[J]. 食品与发酵工业, 2016,43(3): 8-11.
[13] Efficient secretory production of alkaline phosphatase by high cell density culture of recombinant Escherichia coliusing the Bacillussp. endoxylanase signal sequence [J]. Applied Microbiology & Biotechnology, 2000,53(6): 640-645.
[14] 童群义, 陈坚. 恒pH补料分批培养技术培养谷胱甘肽合成酶系 [J]. 食品与生物技术学报, 2002, 21(4): 350-356.
[15] NEWBY D, MARKS L, LYALL F. Dissolved oxygen concentration in culture medium: Assumptions and pitfalls[J]. Placenta, 2005, 26(4): 353-357.
[16] PAN J G, RHEE J S, LEBEAULT J M. Physiological constraints in increasing biomass concentration of Escherichia coli B in fed-batch culture [J]. Biotechnology Letters, 1987, 9(2): 89-94.
[17] XIONG T, SONG S H, HUANG J Q, et al. Tolerance of Lactobacillus plantarum NCU116 in Stimulated Digestive Environments [J]. Food Science, 2011, 32(11): 114-117.
[18] YE K, SHA J, SHIMIZU K. Fuzzy neural network for the control of high cell density cultivation of recombinant Escherichia coli[J]. Journal of Fermentation & Bioengineering, 1994, 77(6): 663-673.
[19] 杜越欧, 侯俊财. 乳酸菌蛋白水解体系及相关基因表达的研究进展 [J]. 食品工业科技, 2013, 34(3): 383-386.
[20] LIU M, BAYJANOV J R, RENCKENS B, et al. The proteolytic system of lactic acid bacteria revisited: A genomic comparison [J]. 11(1): 36.
[21] 王世强, 何伟杰. 磷酸缓冲盐对酸奶增菌发酵过程的影响 [J]. 食品工业科技, 2009, 30(6): 109-111.
[22] MORTH J P, PEDERSEN B P, TOUSTRUP-JENSEN M S, et al. Crystal structure of the sodium-potassium ump [J]. Nature, 2007, 450(7 172): 1 043-1 049.
[23] HALLIWELL B. Lignin synthesis: The generation of hydrogen peroxide and superoxide by horseradish peroxidase and its stimulation by manganese (Ⅱ) and phenols[J]. Planta, 1978, 140(1): 81-88.
[24] KRISCHKE W, SCHR DER M, TR SCH W. Continuous production of l -lactic acid from whey permeate by immobilized Lactobacillus casei subsp. casei [J]. Applied Microbiology & Biotechnology, 1991, 34(5): 573-578.
[25] 崔树茂. 乳酸菌的生长抑制和冻干存活的影响因素及规律 [D]. 无锡:江南大学, 2017.
[26] CUI S, ZHAO J, LIU X, et al. Maximum biomass concentration prediction for Bifidobacteria in the pH-controlled fed-batch culture [J]. Letters in Applied Microbiology, 2016, 62(3): 256-263.