血橙属甜橙类,其种植起源于欧洲。我国种植的血橙品种有路比(Ruby)、塔罗科(Tarocco)、桑吉耐洛(Sanguinello)、摩洛(Moro)等,主要从意大利、西班牙等国家引进[1]。目前,我国种植面积最广的是‘Tarocco’血橙[2]。血橙因富含多酚、类黄酮、抗坏血酸等具有抗氧化活性的物质,深受消费者喜爱。血橙是唯一含花色苷的柑橘,花色苷的积累使其果实呈现特有的紫红色[3]。花色苷是一种天然水溶性色素,属于黄酮类化合物[4]。花色苷是血橙中主要的抗氧化活性成分,具有极强的抗氧化性,可有效地清除羟自由基[5]、增强植物抗胁迫能力[6]。花色苷还对人体具有许多生理保健功能,如抗衰老、预防肥胖症、抗炎症[7-8]。因此,探究采后处理对血橙花色苷积累和抗氧化活性的影响具有重大意义。
温度对花色苷的积累有一定的影响[9-12]。SHINOMIYA等[9]对葡萄进行采前低温结合光照处理,花色苷合成途径的关键基因UFGT达到最高水平表达,从而促进花色苷积累,使得果皮色泽更加诱人。CARMONA等[10]报道在4 ℃和9 ℃下贮藏‘Moro’血橙均能增加花色苷的含量,且进一步研究发现,在9℃条件下可诱导血橙中花色苷合成相关的结构基因上调幅度显著,其中DFR/FLS远大于在4 ℃条件下贮藏,使二氢黄酮醇代谢途径更加偏向于生成花色苷的方向。PANNITTERI等[11]发现‘Tarocco’血橙在4 ℃下贮藏70 d花色苷的含量明显高于对照组(20 ℃),但在1 ℃时贮藏20 d,血橙中花色苷含量没有明显的变化。而TSANIKLIDIS等[12]研究发现甜樱桃在1℃下贮藏,其花色苷含量低于对照组(20 ℃),进一步研究得到,生成花色苷途径的结构基因ANS和UFGT表达降低。因此,在温度过低的情况下,反而抑制花色苷合成途径的基因表达,不利于果实中花色苷的积累。
由此可知,适宜的贮藏温度能更有效地增加果实中花色苷含量。目前,国内外对低温诱导花色苷合成的研究报道不少,但对于低温诱导血橙花色苷合成,同时维持果实的良好品质有待进一步研究。本实验拟通过不同温度贮藏‘Tarocco’血橙,探究贮藏温度对血橙花色苷合成规律及血橙果肉中的总酚、总黄酮含量和酶活性的变化规律,筛选出适宜血橙贮藏的温度,有利于提高血橙营养价值及商品价值,并为采后血橙品质调控提供理论依据及可行技术。
血橙品种为‘Tarocco’血橙,2019年2月26日下午在重庆市万州区血橙基地采摘,次日运回北碚区实验室。挑选出大小均匀,表面无损伤,无病害的果实,并用500 mg/L咪鲜胺溶液和250 mg/L 2,4-D溶液浸泡1 min,取出晾干备用。
乙酸钠(优级纯),上海麦克林生物公司;Al(NO3)3(分析纯),冰醋酸(优级纯),成都市科隆化学品有限公司;愈创木酚(化学纯),中国佘山化工厂;NaNO2、邻苯二酚、PEG 6000(分析纯),成都市科龙化工试剂厂;福林酚试剂(生物试剂),生工生物工程股份有限公司;儿茶素标准品和没食子酸标准品,南通飞宇生物科技有限公司。
PCR仪,成都立德赛科技有限公司;CF16RN高速冷冻离心机,长沙湘仪离心机仪器有限公司;TU-1901双光束紫外可见分光光度计,北京普析通用仪器有限责任公司;HZK-FA210S电子天平,福州华志科学仪器有限公司;CM-5分光色差仪,柯尼卡美能达公司。
1.3.1 样品处理
将晾干的血橙单果包装随机分在不同温度下贮藏。温度的选择参考相关文献[10-11]得出,并结合实际情况作相应调整:对照组,15~20 ℃、80%~85% RH(CK);处理组1,6~8 ℃、80%~85% RH(T1);处理组2,4~6℃、80%~85% RH(T2),每组约300个果实,分别在空间大小都一致、且处于无光照条件下的冷库室及通风室内贮藏。每隔15 d随机取样1次,每组取15个果实进行各项指标测定,3个生物学重复。最后,果肉用液氮速冻后置-80 ℃的冰箱备用。
1.3.2 色差测定
柑橘榨汁,过滤混合后取样,根据CIE L*、a*、b*参数采用CM-5色差仪于室温下测得。参考CHEN[13]等采用色泽指数(citrus color index,CCI)表示柑橘果汁颜色变化。CCI值为正则表示红黄色,为负表示蓝绿色,值的绝对值越大代表颜色越深;为零表示红,黄和蓝绿复合色。CCI计算如公式(1)所示:
(1)
式中:L*为亮度;a*为红绿色差;b*为黄蓝色差。
1.3.3 花色苷含量测定
采用pH示差法[14-15]。使用两种缓冲液,pH=1.0的KCl缓冲液和pH=4.5的乙酸钠缓冲液。用相应的缓冲液(1∶6)稀释样品,于510 nm和700 nm处测定吸光度。
1.3.4 总酚含量和总黄酮含量测定
液氮研磨冷冻的血橙果肉样品,称取2 g粉末,加入80%甲醇10 mL,涡旋混匀,室温超声30 min,然后将混合液离心(22 ℃、5 000×g、10 min),取上清液到25 mL容量瓶中,残渣重提1~2次,将所有上清液用80%甲醇定容于25 mL容量瓶中,混合后溶液置于5 mL离心管中,低温保存备用。
总酚含量测定:参考季露等[16]方法并略作修改。采用Foiln-Ciocalte法,用没食子酸作标准物。准确取待测样品溶液0.3 mL,加入1.2 mL蒸馏水,再加入福林酚试剂0.3 mL,混匀后暗反应6 min,再加入3 mL 7%Na2CO3、2.4 mL蒸馏水,室温静置90 min,于760 nm下测定吸光度,重复3次。以每克果蔬样品干重相当于没食子酸的毫克数。
总黄酮含量测定:参考季露等[16]和张东峰等[17]方法并略作修改。用儿茶素做标准物。准确称取待测溶液0.6 mL、2.4 mL 80%甲醇、0.3 mL 5%NaNO2溶液,混匀后静置6 min,再加入0.3 mL 10%Al(NO3)3溶液,混匀后静置6 min,最后加入2.4 mL 4%NaOH溶液,混匀静置15 min,于510 nm下测吸光度,重复3次。以每克果蔬样品干重相当于儿茶素的毫克数。
1.3.5 多酚氧化酶(polyphenol oxidase,PPO)和过氧化物酶(peroxidase,POD)活性测定
称取5 g血橙果肉冻样,置于预冷的研钵中,加入5 mL提取缓冲液(1 mmol聚乙二醇6 000、4%聚乙烯吡咯烷酮和1%Triton X-100),在冰浴下研磨成匀浆,于4 ℃、12 000×g离心30 min,收集上清液,即为酶提取液,放置4 ℃低温保存备用。
PPO活性测定:参考ZHOU等[18]方法略作修改,取一支干净试管,向其加入4.0 mL 0.1 mol/L、pH 5.5乙酸-乙酸钠缓冲液和1.0 mL 100 mmol/L邻苯二酚溶液,再加入1 mL酶提取液,立即混合均匀,在波长420 nm测吸光度,重复3次。以每克果蔬样品在420 nm处每分钟吸光度变化值增加0.01为1个PPO活性单位。
POD活性测定:参考CHANCE等[19]方法略作修改,取一支干净试管,向其加入3 mL 25 mmol/L愈创木酚溶液、0.5 mL酶提取液,再加入200 μL 0.5 mol/L H2O2溶液迅速混合后启动反应,在波长470 nm测吸光度,重复3次。以每克果蔬样品在470 nm波长每分钟吸光度变化值增加1为1个POD活性单位。
1.3.6 RNA提取、cDNA第一链合成及荧光定量PCR
1.3.6.1 RNA提取和cDNA第一链的合成
根据Tiangen植物多糖多酚总RNA试剂盒操作说明书,提取果肉中RNA。以提取的RNA为模板,利用Tiangen FastKing RT Kit反转录试剂盒操作说明合成cDNA。
1.3.6.2 荧光定量PCR(qRT-PCR)
基因PAL、C4H、4CL、CHI、FLS、F3H、F3′5′H、DFR、ANS、UFGT、GST的引物参考CARMONA[10]等;内参基因(EF-1α)和CHS引物参考LO PIERO[20]等。qRT-PCR反应在96孔PCR板上加入如下反应体系:EvaGreen Express 2X,5 μL;Forward Primer,0.4 μL;Reverse Primer,0.4 μL;cDNA,1 μL;RNase-Free ddH2O,3.2 μL;总体积为10 μL。qRT-PCR反应使用BIO-RAD CFX96TM Real-Time Systerm仪器,其中反应程序是:95 ℃、30 s;95 ℃、5 s;58 ℃、30 s;经过40个反应循环。溶解曲线为:95 ℃、10 s,降温至65 ℃之后再开始升温,维持5 s采集荧光信号,到95 ℃结束反应。每个模板做3次重复,采用2-△△CT法计算基因相对表达量。
采用Origin 2018软件绘图和SPSS 20.0软件进行单因素方差分析、LSD多重比较及Pearson相关系数分析。
血橙色差变化由L*、a*、b*、CCI参数大小来表示(图1)。L*值表示血橙果汁的亮度,整个贮藏期间,CK组在贮藏30 d急剧上升,显著高于T1、T2组,而T1、T2组在贮藏15 d后显著下降,趋于稳定状态;a*值表示果汁的红绿色差,在这里,a*值越大,表明红色越深。T1和T2组a*值逐渐升高,而CK组呈现下降趋势;b*值表示黄蓝色差,这里则表明b*值越大,黄色越深,CK组升高趋势显著,突出CK组贮藏的果实的果汁颜色会倾向于黄色;CCI值表示综合色差,CCI值越大,果汁红色越深,T1和T2组逐渐升高,而CK组逐渐下降,可能由于在贮藏期间CK组中的亮度变亮,黄色占主要颜色,反之T1和T2组亮度变暗,红色占主要颜色。其中,在贮藏后期,L*、a*、b*、CCI值在各处理温度之间均出现显著性差异(P<0.05)。
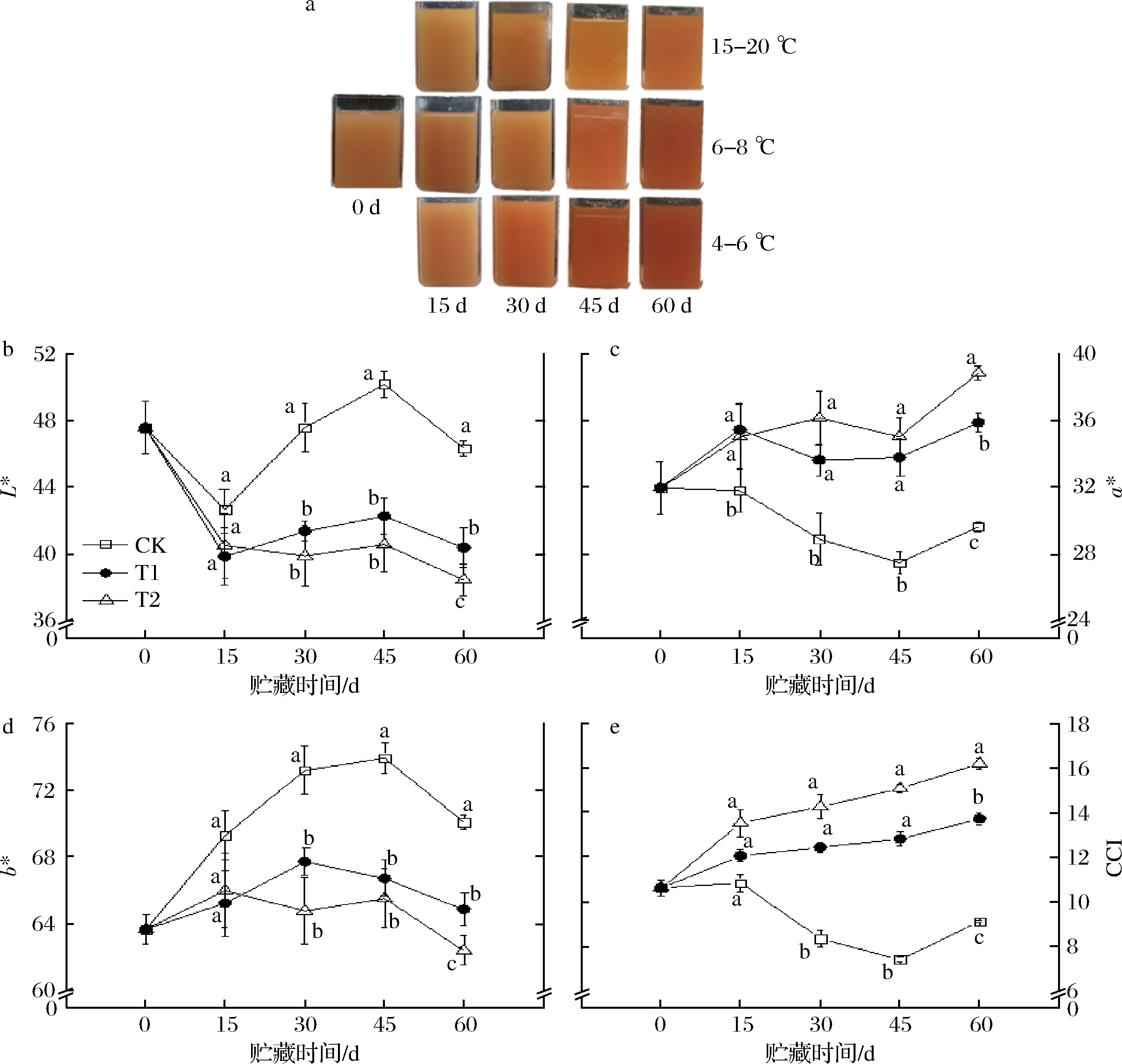
a-颜色变化;b-L*;c-a*;d-b*;e-CCI;CK-15~20 ℃;T1-6~8 ℃;T2-4~6 ℃;下同
图1 贮藏期间血橙颜色变化
Fig.1 Color changes of blood orange during storage
注:图中的不同字母表示在P<0.05范围内存在显著性差异
如图2-a所示,T1、T2组,血橙中的花色苷呈现逐渐上升的趋势。T2组,血橙果肉中花色苷从15.98 mg/L增加到28.36 mg/L。而CK组,血橙果肉中花色苷含量总体呈现下降趋势,贮藏到60 d时,血橙中花色苷含量为11.07 mg/L,与T1和T2组存在显著差异(P<0.05)。相较于CK组血橙中花色苷的积累,T1、T2组更有利于花色苷的积累。由此可见,花色苷生成对低温有一定依赖性,这与前人研究结果一致[21-22]。
如图2-b所示,总黄酮含量均增加。在整个贮藏中,CK、T1和T2之间不存在显著差异性(P>0.05)。其中,T2组的总黄酮含量一直呈现逐渐上升状态,贮藏至60 d时,达到最大值。如图2-C所示,血橙总酚含量也有一定的增加。T2组,其含量从0.76 mg/g增加到1.05 mg/g-1。其中,在贮藏至15,45,60 d时,CK与T1、T2均出现显著性差异(P<0.05)。
如图3-a所示,在整个贮藏期间,CK、T1组,POD活性呈现先下降再升高再下降,且贮藏至30 d时,POD活性达到最大值,随后CK组的酶活性出现大幅度下降。T2组,POD活性出现先下降再升高再降低再升高,且始终低于0 d时的酶活性。并且,在各个贮藏阶段,各处理温度之间均存在显著差异(P<0.05)。其中,CK组的POD活性保持在较高水平,而在T2组处于较低状态。

a-花色苷;b-总黄酮;c-总酚
图2 在贮藏期间花色苷含量、总黄酮含量、总酚含量的变化
Fig.2 Changes of anthocyanin content、total flavonoids content and total phenols content during storage
图3-b所示,CK组,PPO酶活性变化趋势与POD活性一致,在贮藏到30 d时出现最大值,之后急剧下降;T1组,酶活性呈现先下降再升高再下降,并在贮藏后期的PPO活性高于CK和T2组;T2组,PPO活性出现先下降后略微上升趋于平稳,处于最低水平。
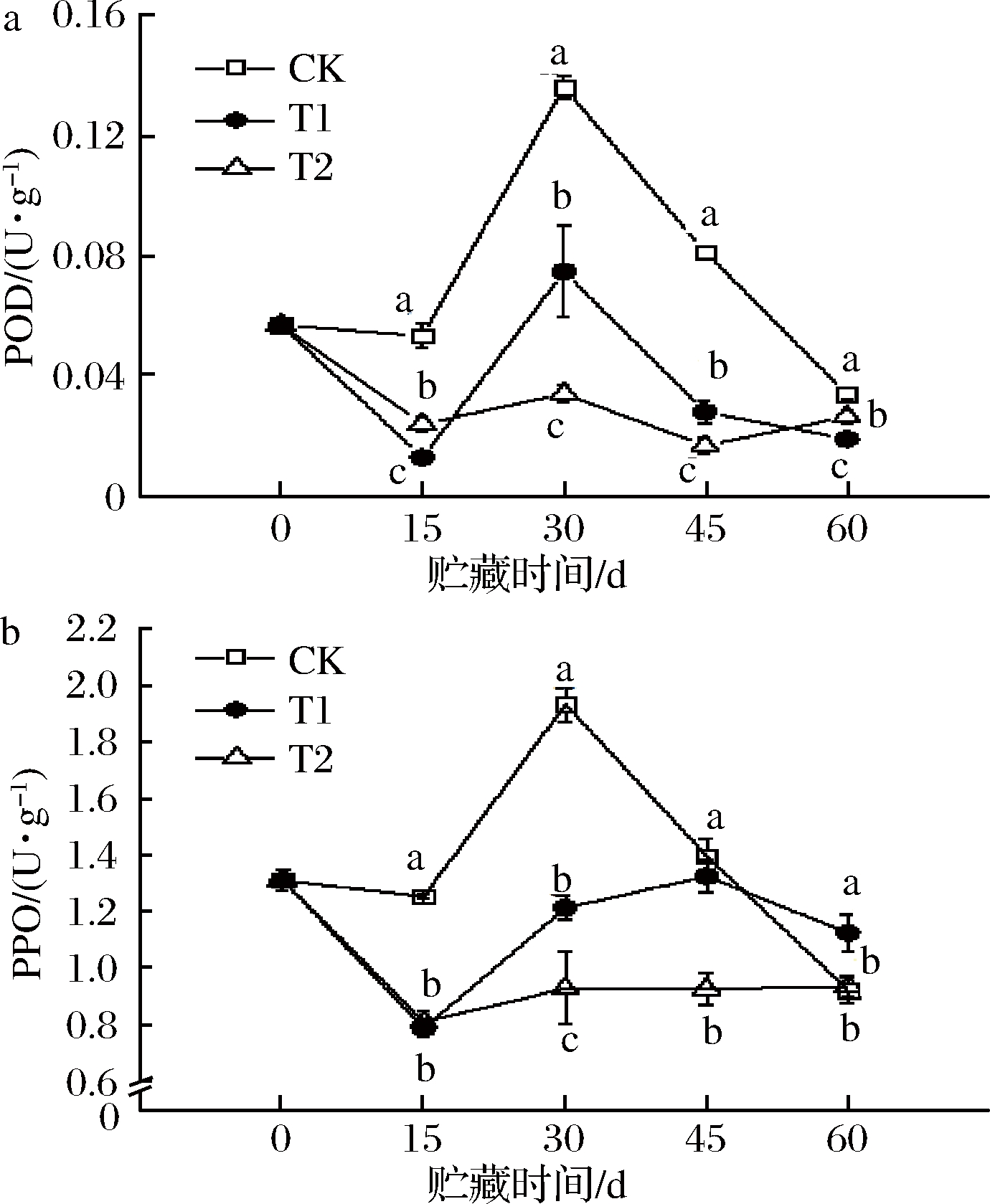
a-POD;b-PPO
图3 贮藏期间血橙中POD、PPO的变化
Fig.3 Changes of POD and PPO in blood
oranges during storage
血橙中的花色苷合成通路已经有较为成熟的阐述[10]。首先,由苯丙烷代谢途径中的苯丙氨酸在苯丙氨酸解氨酶(phenylalanine ammonia lyase,PAL)、肉桂酸羟化酶(cinnamate hydroxylase,C4H)、香豆酞CoA连接酶(coriander CoA ligase,4CL)、查尔酮合成酶(chalcone synthase,CHS)、查尔酮异构酶(chalcone isomerase,CHI)、黄烷酮-3-羟化酶(flavanone-3-hydroxylase,F3H)和类黄酮-3,5-羟化酶(flavonoid-3,5-hydroxylase,F3′5′H)的作用下发生一系列反应生成二氢黄酮醇。紧接着二氢黄酮醇可通过黄酮醇合成酶(flavonol synthase,FLS)作用下反应生成黄酮醇,还可由二氢黄酮醇-4-还原酶(dihydroflavonol-4-reductase,DFR)、花青素合成酶(anthocyanin synthase,ANS)和类黄酮3,5-糖苷转移酶(flavonoid 3,5-glycoside transferase,UFGT)作用下生成稳定的花色苷,最后,花色苷在谷胱甘肽转移酶(glutathione transferase,GST)作用下储藏于液泡中。
如图4所示,基因表达量T1、T2组均有增强。以二氢黄酮醇为分节点,即花色苷早期合成基因有PAL、C4H、4CL、CHS、CHI、F3H和F3′5′H;后期合成基因有DFR、ANS、UFGT和GST。从图中看出,早期合成基因中无相对一致的变化规律性。花色苷的合成初始基因PAL在3组温度中出现明显差异,CK组PAL表达量几乎为零,而T2组贮藏至15、30 d时,PAL表达量提高,达到0 d的10.5~11.0倍,并达到CK组的34.3~49.1倍。随后,在贮藏到60 d时,PAL表达量达到CK组的76倍。同时,T2组,早期结构基因CHS和F3′5′H表达量一直呈现上升趋势,在贮藏60 d时,与CK组相比,达到13.4倍(CHS),9.92倍(F3′5′H);与T1组相比,达到1.8倍(CHS),1.3倍(F3′5′H)。其他早期合成基因C4H、4CL、CHS、CHI、F3H的表达量出现先升高后降低趋势,但均高于CK组。而另一条途径二氢黄酮醇通过黄酮醇合成酶(FLS)作用下反应生成黄酮醇中FLS的基因表达在各贮藏温度中均出现下调,T1和T2组基因下调更为显著。后期合成花色苷的基因DFR、ANS、UFGT和GST。T2组,贮藏至30 d时,达到了贮藏期间的较高值,与CK组相比,达到14.2倍(ANS),5倍(UFGT),16.2倍(GST);贮藏到60 d时,相比CK组,达到16倍(DFR),15.1倍(ANS),8.1倍(UFGT),28.4倍(GST)。尽管基因DFR、ANS、UFGT和GST在贮藏30 d达到较大值,但贮藏60 d时与CK组的比值更大,即随着贮藏时间加长,花色苷合成速率减缓,在CK组血橙中花色苷合成途径受到的影响更大。并且T1、T2组,DFR基因的高表达与FLS基因的低表达,从而诱导血橙中花色苷的生成。
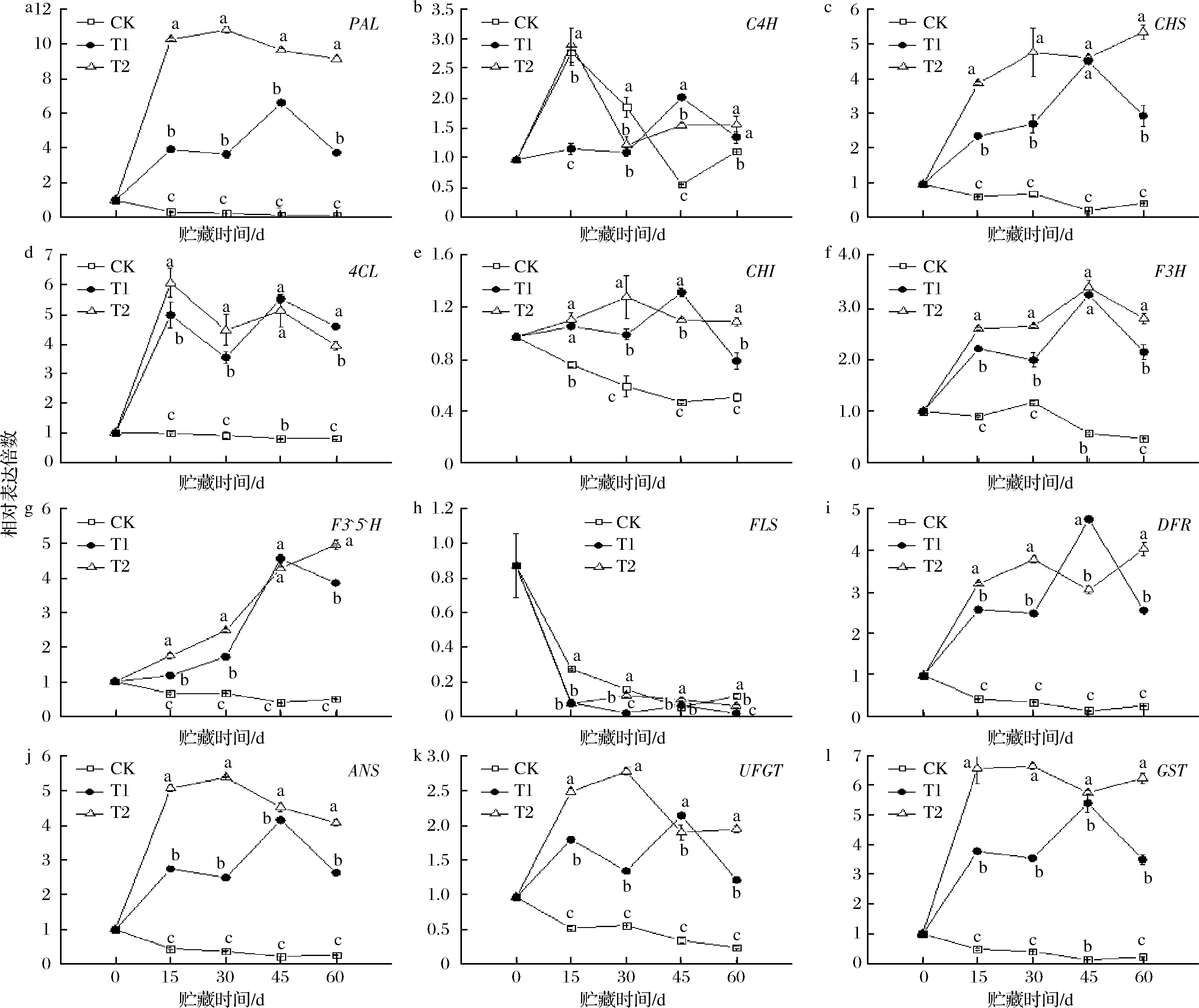
a-PAL;b-C4H;d-SCL;e-CHI;f-F3H;g-F3′5′H;h-FLS;i-DFR;g-ANS;k-UFGT;l-GST
图4 血橙果肉中花色苷合成相关结构基因相对表达量的变化
Fig.4 Changes in relative expression of anthocyanin-related structural genes in blood orange pulp
如表1所示,在整个贮藏期间,血橙中花色苷含量与结构基因PAL、C4H、4CL、CHS、CHI、F3H、F3′5′H、DFR、ANS、UFGT和GST呈正相关,与基因FLS呈现负相关,且结构基因之间也基本呈现显著正相关;基因C4H与其他结构基因和花色苷未有显著性。
血橙因含有花色苷,酚类物质、维生素等营养物质,得到广泛的关注。本文对血橙采后进行不同温度贮藏,贮藏30 d直至60 d,4~6 ℃条件的CCI值与15~20 ℃呈现显著差距,其血橙果汁红色逐渐加深。相应的,在4~6 ℃条件下的花色苷含量从30 d开始出现线性增加。进一步发现,血橙中花色苷合成的主要基因PAL、CHS、DFR、ANS、UFGT和GST的表达量处于较高水平,并与花色苷含量呈显著正相关。其中,C4H与花色苷含量之间存在较低的相关性,可能因为C4H属于花色苷合成的前期基因,而低温对花色苷合成的后期基因DFR、ANS、UFGT和GST有主要促进作用。则还可能是低温启动了血橙果实中Ruby转录因子表达,从而调控血橙中花色苷合成相关的后期结构基因表达显著上调。BUTELLI等[23]研究中低温启动了血橙中Ruby转录因子的显著表达,提高了花色苷合成的相关基因表达量,从而诱导血橙中花色苷积累。其他研究者也得出花色苷合成的结构基因受到相应转录因子的调控,进而影响结构基因的表达。KOBAYASHI等[24]报道了MYB基因调控UFGT基因表达上调,从而促进巨峰葡萄果实中花色苷积累。柑橘中R2R3-MYB转录因子基因CsMYBF1,该转录因子可激活CHS基因的启动子,提高CHS基因的表达[25]。在菊花中,CmbHLH2和CmMYB6结合调控DFR基因表达上调而提高花色苷的含量[26]。因此,之后还可对血橙中花色苷合成相关的转录因子进行更深一步研究。
表1 皮尔逊相关系数
Table 1 Pearson correlation coefficients

指标PALC4HCHS4CLCHIF3HF3′5′H FLSDFRANSUFGTGST花色苷PAL10.2710.946∗∗0.844∗∗0.817∗∗0.891∗∗0.702∗∗-0.329 0.872∗∗ 0.981∗∗ 0.941∗∗ 0.977∗∗ 0.669∗C4H10.2050.2790.2450.2590.114-0.0940.1950.260.2550.2560.134CHS10.862∗∗0.853∗∗0.953∗∗0.868∗∗-0.365 0.961∗∗ 0.955∗∗ 0.907∗∗ 0.973∗∗ 0.812∗∗4CL10.799∗∗0.920∗∗0.692∗∗-0.458 0.899∗∗ 0.914∗∗ 0.889∗∗ 0.917∗∗ 0.710∗∗CHI10.862∗∗0.639∗-0.018 0.903∗∗ 0.878∗∗ 0.923∗∗ 0.869∗∗ 0.673∗F3H10.848∗∗-0.374 0.943∗∗ 0.928∗∗ 0.887∗∗ 0.937∗∗ 0.781∗∗F3′5′H 1-0.319 0.835∗∗ 0.717∗∗ 0.619∗ 0.752∗∗ 0.836∗∗FLS1-0.349-0.336-0.241-0.373-0.249DFR1 0.928∗∗ 0.915∗∗ 0.945∗∗ 0.782∗∗ANS1 0.976∗∗ 0.992∗∗ 0.692∗∗UFGT1 0.964∗∗ 0.642∗GST1 0.751∗∗花色苷1
注:表中每列“**”表示P<0.01;“*”表示P<0.05
血橙中抗氧化活性成分除花色苷外,果实中富含的多酚、类黄酮也具有抗氧化活性。本文中4~6 ℃条件,血橙中的总酚、总黄酮含量高于15~20 ℃、6~8 ℃条件的果实,并在贮藏期逐渐上升。可能因为多酚、类黄酮均属于苯丙烷途径中的代谢产物,4~6 ℃条件提高PAL、CHS、4CL的基因表达量,促进了多酚及类黄酮的积累,从而增强了果实的抗氧化性。HABIBI等[27]研究发现了血橙中的花色苷和酚类物质可增强总抗氧化活性。这一结果与何礼等[28]一致,低温诱导花色苷积累,花色苷含量与血橙果实的抗氧化性呈显著正相关。说明在4~6 ℃条件下,血橙中的花色苷和总酚可提高果实的抗氧化能力。
POD和PPO活性高低与果实中酚类物质的氧化有关[29-30]。图3所示,在4~6 ℃条件下贮藏血橙,POD和PPO活性均处于较低水平。由此可见,该温度贮藏抑制了果实中POD和PPO活性,降低血橙果肉中酚类物质的氧化,而使血橙中酚类物质的含量高于15~20 ℃、6~8 ℃条件的果实。这一结论与王雅楠等[29]一致:水扬酸(salicylicacid,SA)处理李果实,推迟POD和PPO活性上升,降低酚类物质氧化,从而减轻了果实褐变程度。
本文中低温诱导血橙果实合成花色苷结构基因的表达,从而促进花色苷积累。同时,还提高果实中总酚总黄酮含量,增强了果实的抗氧化性,从而保持血橙采后品质。其中,以4~6 ℃贮藏的血橙中花色苷含量、总酚总黄酮含量最高,所以4~6 ℃贮藏血橙最适宜。但本文对血橙果实抗氧化活性只在于初步研究,针对低温下果实抗氧化活性变化规律还需进一步研究。
[1] CARUSO M,FERLITO F,LICCIARDELLO C,et al.Pomological diversity of the Italian blood orange germplasm[J].Scientia Horticulturae,2016,213:331-339.
[2] 刘义武,孔昭华,王碧.血橙营养成分研究进展[J].食品工业科技,2012,33(15):366-370.
[3] 朱春钊,彭良志,江才伦,等.塔罗科血橙果面色泽与果实品质相关性研究[J].中国南方果树,2014,43(1):32-33;37.
[4] 袁久坤,周英.万州塔罗科血橙果实花色苷的影响因素分析[J].中国园艺文摘,2014(7):4-5;165.
[5] 常世敏,李乾丽,谢婵媛,等.黑米与欧洲越橘花色苷抗氧化活性比较研究[J].食品工业科技,2019,40(9):57-61;67.
[6] 常仁杰,何勇,朱祝军.植物花色苷抗逆性作用研究进展[J].北方园艺,2013(9):216-219.
[7] GUO Honghui,LING Weihua.The update of anthocyanins on obesity and type 2 diabetes: Experimental evidence and clinical perspectives[J].Reviews in Endocrine and Metabolic Disorders,2015,16(1):1-13.
[8] JEONG J H,JUNG H,LEE S R,et al.Anti-oxidant, antiproliferative and anti-inflammatory activities of the extracts from black raspberry fruits and wine[J].Food Chemistry,2010,123(2):338-344.
[9] SHINOMIYA R,FUJISHIMA H,MURAMOTO K,et al.Impact of temperature and sunlight on the skin coloration of the ‘Kyoho’ table grape[J].Scientia Horticulturae,2015,193:77-83.
[10] CARMONA L,ALQU ZAR B,MARQUES V V, et al.Anthocyanin biosynthesis and accumulation in blood oranges during postharvest storage at different low temperatures[J].Food Chemistry,2017,237:7-14.
ZAR B,MARQUES V V, et al.Anthocyanin biosynthesis and accumulation in blood oranges during postharvest storage at different low temperatures[J].Food Chemistry,2017,237:7-14.
[11] PANNITTERI C,CONTINELLA A, CICERO L L,et al.Influence of postharvest treatments on qualitative and chemical parameters of Tarocco blood orange fruits to be used for fresh chilled juice[J].Food Chemistry,2017,230: 441-447.
[12] TSANIKLIDIS G,KAFKALETOU M,DELIS C,et al.The effect of postharvest storage temperature on sweet cherry (Prunus avium L.) phenolic metabolism and colour development[J].Scientia Horticulturae,2017,225:751-756.
[13] CHEN Ming,JIANG Qian,YIN Xueren,et al.Effect of hot air treatment on organic acid- and sugar-metabolism in Ponkan(Citrus reticulata)fruit[J].Scientia Horticulturae,2012,147:118-125.
[14] HONDA C,BESSHO H,MURAI M,et al.Effect of temperature on anthocyanin synthesis and ethylene production in the fruit of early-and-medium maturing apple cultivars during ripening stages[J].Hortscience, 2014,49(12):1 510-1 517.
[15] 喻最新,王日葵,王晶,等.草酸处理对塔罗科血橙采后花色苷积累和糖酸含量的影响[J].食品与发酵工业,2019,45(8):67-74.
[16] 季露,郎娅,裘迪红,等.不同柑橘品种果汁中抗氧化成分比较[J].宁波大学学报(理工版),2016,29(4):20-25.
[17] 张东峰,陈家豪,郭静,等.7种柑橘多酚、黄酮含量及其抗氧化活性比较研究[J].食品研究与开发,2019,40(6):69-74.
[18] ZHOU Yahan,DENG Lili,ZENG Kaifang.Enhancement of biocontrol efficacy of Pichia membranaefaciens by hot water treatment in postharvest diseases of citrus fruit[J].Crop Protection,2014,63(5):89-96.
[19] CHANCE B,MAEHLY A C.Assay of catalases and peroxidases[J].Methods in Enzymology,1955,2:764-775.
[20] LO PIERO A R,PUGLISI I,RAPISARDA P,et al.Anthocyanins accumulation and related gene expression in red orange fruit induced by low temperature storage[J].Journal of Agricultural and Food Chemistry,2005,53(23):9 083-9 088.
[21] SCHIRRA M,CHESSA I.Physiological behaviour of Tarocco oranges during cold storage[C].Proceedings of the 6th International Citrus Congress,1988:1 491-1 498.
[22] RAPISARDA P, BELLOMO S E,INTELISAN O S.Storage temperature effects on blood orange fruit quality[J]. Journal of Agricultural and Food Chemistry,2001,49(7):3 230-3 235.
[23] BUTELLI E,LICCIARDELLO C,ZHANG Y,et al.Retrotransposons control fruit specific cold dependent accumulation of anthocyanins in blood oranges[J].The Plant Cell,2012,24(3):1 242-1 255.
[24] KOBAYASHI S,ISHIMARU M,HIRAOKA K,et al.Myb-related genes of the Kyoho grape (Vitis labruscana) regulate anthocyanin biosynthesis[J].Planta,2002,215(6):924-933.
[25] LIU C,LONG J,ZHU K,et al.Characterization of a citrus R2R3-MYB transcription factor that regulates the flavonol and hydroxycinnamic acid biosynthesis[J].Scientific Reports,2016,6(1):25 352.
[26] XIANG L,LIU X,LI X,et al. A novel bHLH transcription factor involved in regulating anthocyanin biosynthesis in chrysanthemums (Chrysanthemum morifolium Ramat.)[J]. Plos One,2015,10(11):e0 143 892.
[27] HABIBI F,RAMEZANIAN A.Vacuum infiltration of putrescine enhances bioactive compounds and maintains quality of blood orange during cold storage[J].Food Chemistry,2017,227:1-8.
[28] 何礼,陈克玲,何建,等.低温贮藏下塔罗科血橙抗氧化性能研究[J].西南农业学报,2015,28(6):2 666-2 671.
[29] 王雅楠,张一冉,杨杨,等.乙烯信号参与水杨酸提高采后李果实抗冷性的研究[J/OL].食品工业科技:1-10[2020-01-10].http://kns.cnki.net/kcms/detail/11.1759.ts.20190909.1507.004.html.
[30] 王曼玲,胡中立,周明全,等.植物多酚氧化酶的研究进展[J].植物学通报,2005(2):215-222.