表1 双孢蘑菇感官指标评价标准
Table 1 Standard of sensory properties

评分/分开伞色泽异味是否发黏质地8~10无色泽洁白无无有弹性6~8轻度开伞色泽洁白稍异味稍发黏稍软4~6明显开伞稍褐变明显异味明显发黏明显软烂<4开伞严重严重褐变异味严重严重发黏严重软烂
双孢菇因其味道好,营养高,已成为世界上最广泛栽培及食用的菌种[1]。但双孢菇呼吸作用强,菌体易腐败[2]。根据市场调研,双孢菇需要在不同地点收集后统一贮藏,由于地点不同,收集时间分散,经销商很有可能不方便对蘑菇进行入库前统一处理,因此探讨收入冷库后再处理的方式对蘑菇品质的影响,寻找替代入库前处理的方法具有现实操作意义。
目前对于双胞菇采后贮藏保鲜措施有气调保鲜[3]、臭氧处理[4]、辐照保鲜[5]、涂膜保鲜[6]以及化学药剂处理[7]等。乙醇作为植物天然代谢物[8],无毒无害,不易残留,应用到果蔬中能够杀灭微生物[9],抑制呼吸作用从而起到保鲜效果[10]。同时乙醇便宜易得,熏蒸操作简单,挥发后无残留,更安全、更容易为消费者接受。HAN等[11]用浓度为6 mL/kg乙醇处理西兰花,结果显示乙醇能有效抑制西兰花贮藏阶段失重率;WANG等[12]以乙醇蒸气熏蒸枇杷,发现乙醇能有效抑制真菌引起的炭疽病;刘洪丽[13]的研究证明乙醇能有效减弱鲜切荸荠呼吸强度;WANG等[14]以浓度为150~750 μL/L乙醇熏蒸鲜切菊芋,发现菊芋的呼吸强度、PAL酶活和总酚含量的上升趋势得到显著抑制。有研究表明,入库前乙醇处理菇类能够有效改善其采后品质[15],但目前乙醇处理时间主要集中在入库前,有关乙醇处理时期的研究极为匮乏。所以本文研究乙醇处理的不同时期对双孢菇保鲜品质的影响,在经销商没有时间进行入库前处理的情况下,寻找一种补救措施以延长双孢菇的保鲜期。
从北碚种植户得到无病虫害和机械损伤的双孢蘑菇,要求种植户采后8 h内运送至实验室。
Headspace analyzer,Pac Check® Model 650EC,US MOCON);色差仪,UltraScan® PRO,HunterLab,USA;UV 分光光度计 (UV-2450PC),岛津制作所。
挑选尺寸接近,无病害,无机械损伤,处于闭伞阶段的双孢菇进行处理,试验共有4组,每组3个平行。
A组:入库前对A组进行乙醇熏蒸处理(乙醇浓度400 μL/L,时间3 h),熏蒸温度保持25 ℃。熏蒸完毕,通风半小时后保持温度在2~4 ℃预冷0.5 h,最后分装到统一体积PE袋(每袋100 g),共21袋放入冷库(温度2~4 ℃,湿度95%)贮藏12 d,每隔1 d随机取3袋检测指标。
B组:入库后即分装至PE袋(每袋100 g)贮藏12 d,冷库温度2~4 ℃,湿度95%。贮藏第4天重复A组熏蒸处理,从入库开始每隔1 d随机取3袋检测指标。
C组:入库后即分装至PE袋(每袋100 g)贮藏12 d,冷库温度2~4 ℃,湿度95%。贮藏第8天重复A组熏蒸处理,从入库开始每隔1 d随机取3袋检测指标。
CK组:入库后即分装至PE袋(每袋100 g)贮藏12 d,冷库温度2~4 ℃,湿度95%。从入库开始每隔1 d随机取3袋检测指标。
1.4.1 呼吸强度
通过顶空分析仪静置法[16]测定。呼吸强度以每小时每千克双孢蘑菇在呼吸代谢过程中释放的CO2的质量表示。
1.4.2 PAL(phenylalamine ammonialyase)活性
参考曹健康等[17]方法。以每小时每克(鲜重)菇肉组织酶促反应体系吸光度值增加0.01为1个PAL活性单位(U)。
1.4.3 总酚含量
参照ZHOU等[18]方法。以每克(鲜重)菇肉组织在波长280 nm处吸光度值表示总酚含量(U)。
1.4.4 PPO(polyphenol oxidase)活性
参考OMS-OLIU等[19]方法并略做修改。以每克果蔬样品每分钟吸光度变化值增加0.01为一个活性单位。
1.4.5 POD(perxidase)活性
参考MOERSCHBACHER等[20]方法并稍作修改。在470 nm处测吸光度值,以每克果蔬样品每分钟吸光度变化值增加0.01为1个过氧化物酶活性单位(U),计算POD活性。
1.4.6 相对电导率
参考蒋冬花等[21]方法。以蘑菇的相对电导率值来表示其相对电导率。
1.4.7 菌落总数
参照GB/T 4789.2—2016[22] 测定菌落总数,结果以lgCFU/g表示。
1.4.8 硬度
参考JIANG等[23]方法。硬度用美国CT-3型质构仪测定,探头直径为5 mm,将双孢蘑菇去柄,菌盖上切掉2 mm厚的表皮,将切好的双孢蘑菇固定在操作台上,保持双孢蘑菇切面与探头接触面平行,探头以2 mm/s的穿刺速率进行下压,下压深度为6 mm,通过力与时间的作用曲线,以最大峰值(Nmax)为硬度指标。
1.4.9 白度
参考JAWORSKA等[24]方法,略有改动,L*值越大表示白度越大。
1.4.10 感官评价
由经过培训的6人对双孢蘑菇的色泽、质地、异味等感官指标进行评定。感官指标评定标准如表1所示。
表1 双孢蘑菇感官指标评价标准
Table 1 Standard of sensory properties

评分/分开伞色泽异味是否发黏质地8~10无色泽洁白无无有弹性6~8轻度开伞色泽洁白稍异味稍发黏稍软4~6明显开伞稍褐变明显异味明显发黏明显软烂<4开伞严重严重褐变异味严重严重发黏严重软烂
采用Microsoft Excel 2010 进行数据整理,用SPSS 13.0、LSD法对各项指标进行显著性分析,显著性水平为0.05。Origin 2016对数据进行图像处理。
双孢菇作为呼吸跃变型园艺产品,采摘后得不到能量补充,只能通过呼吸作用消耗自身有机物以获得能量。呼吸作用产生大量水汽和呼吸热滋生细菌,影响双孢蘑菇商品性和耐贮性。根据图1,处理组和对照组双孢菇呼吸强度均上升到第2天后下降。A组双孢菇的呼吸峰值显著低于CK组(P<0.05)。B组在第4天处理后呼吸强度短暂上升至第6天,这可能是B组熏蒸处理时从冷柜中转移出来,温度上升,也可能是重新包装后新包装内高氧气促进了双孢菇的呼吸强度。
B组呼吸强度从第6天开始迅速减少,并在第10天与CK组有极明显差异(P<0.05),呼吸强度明显低于A组(P<0.05),这可能是由于乙醇对部分细菌有即时杀灭作用,从而抑制菇上微生物呼吸作用,也可能是因为乙醇使呼吸作用酶失活[25]。同时有研究表明,乙醇能降低乙烯合成相关酶活性以减弱双胞菇呼吸作用[26]。B组处理时间居中,乙醇在贮藏末期残留较A组多,故而维持呼吸作用酶较低活性的效果优于A组。C组与CK组在整个贮藏过程中没有差异,或许是因为后期乙醇熏蒸对双孢菇作用不大。综上,A、B组处理后均能有效减弱呼吸作用,C组则作用不大。
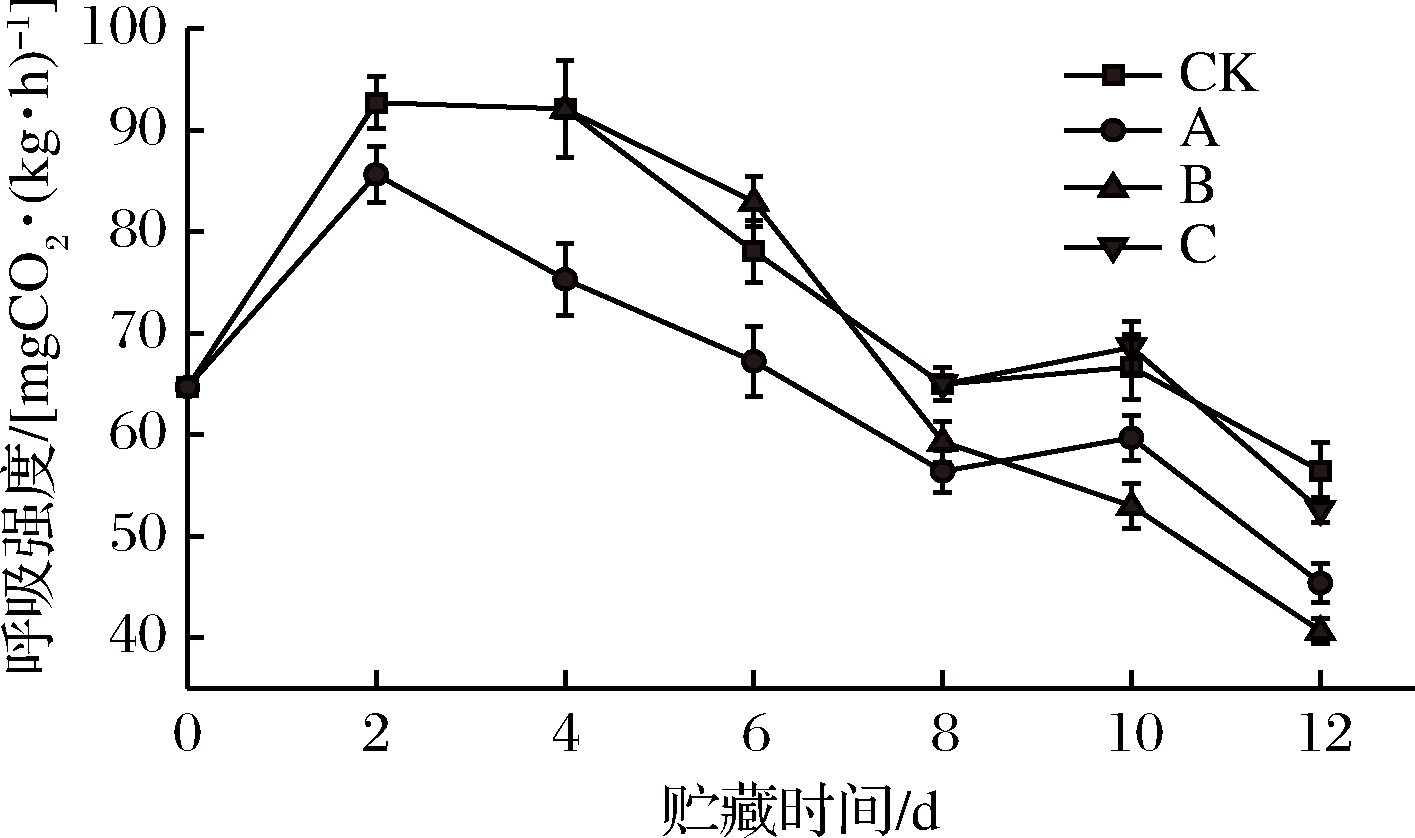
图1 不同时期乙醇处理对双孢菇呼吸强度的影响
Fig.1 Effect of ethanol treatment used at different times
during storage on respiration rate of Agaricus bisporus
PAL酶催化L-苯丙氨酸并同时生成酚类物质从而导致双孢菇褐变[27],失去商品价值。根据图2,各组PAL活性贮藏前2天持续增强,也许是样品去根导致了逆境胁迫[28]。从第4天开始,A组PAL酶活明显降低、并与CK组之间存在极显著差异(P<0.01)直到贮藏结束,这可能是由于乙醇能够迅速抑制PAL的mRNA合成,从而降低其活性。乙醇处理莴苣[29]也得出相似结论。
与CK组相比,B组从第8天开始,C组从第12天开始能极显著抑制PAL的活性(P<0.01),但二者效果不如A组(P<0.05)。C组从第10天开始与B组没有显著差异(P>0.05)。总之,A组能很好的抑制PAL活性(P<0.01),B组、C组也能很好的抑制后期PAL活性,但不能达到A组的效果。

图2 不同时期乙醇处理对双孢菇PAL活性的影响
Fig.2 Effect of ethanol treatment used at different times
during storage on PAL activity of Agaricus bisporus
酚类物质是酶促褐变的底物之一[30],过高的总酚含量会使双孢菇易褐变。如图3所示,处理组和对照组总酚含量均先增加后降低,也许是外源乙醇减弱PAL酶活,即减少酚类产生。这与王慧倩等对鲜切西兰花进行乙醇熏蒸处理得到的趋势类似[31]。各组前2 d酚类含量的上升可能是因为去根胁迫诱导了PAL活性提高[32]。第2天以后,各组总酚含量持续下降,可能是由于PPO活性一直存在导致总酚不断消耗,也可能是因为是总酚作为氢供体参与了自由基清除[33]。在整个贮藏期间A组能够显著降低总酚含量(P<0.01)。B组总酚从第4天开始迅速降低,第6天开始与CK组存在显著差异(P<0.05),这时B组PPO、POD活性并未上升,总酚含量迅速下降的原因可能是本实验中PAL活性的下降。B组第10天、C组第12天开始与CK组存在极显著差异(P<0.01),但与A组差异不大(P>0.05)。总之,A、B、C组都能降低总酚含量,但3个处理组之间没有显著差异。

图3 不同时期乙醇处理对双孢菇总酚含量的影响
Fig.3 Effect of ethanol treatment used at different
times during storage on total polyphenols content of
Agaricus bisporus
PPO是一种导致蘑菇采后褐变的重要蛋白酶[34]。PPO酶能催化酚类形成醌类[35],从而使得双孢菇产生褐变降低商品价值。根据图4,各组PPO活性在贮藏前2 d上升很快,可能是因为去根处理导致膜结构遭到破坏,PPO活性增强以催化木质素及其他酚类物质氧化产物的生成,对伤口形成屏障[36]。A组第6天,B组第8天,C组第10天开始与CK组有明显区别(P<0.05),这可能是因为乙醇熏蒸处理抑制了PAL酶活,也就抑制了酚类物质的合成,减少了PPO作用底物故而抑制其活性,也有可能是因为乙醇分子和PPO作用底物有类似化学解离特性的羟基,通过与底物共同争夺酶活性中心基团以降低PPO活性[37],但是A、B组之间一直并不存在显著性差异(P>0.05),可能是因为贮藏前4 d 各组PPO活性均上升,掩盖了部分乙醇熏蒸的效果。贮藏结束时,所有处理组与对照组都存在极显著差异(P<0.01),B组抑制PPO效果较A组稍差但差异不大,C组效果最差(P<0.05)。总之,3个处理组均可减弱PPO活性并且A,B组效果相当。
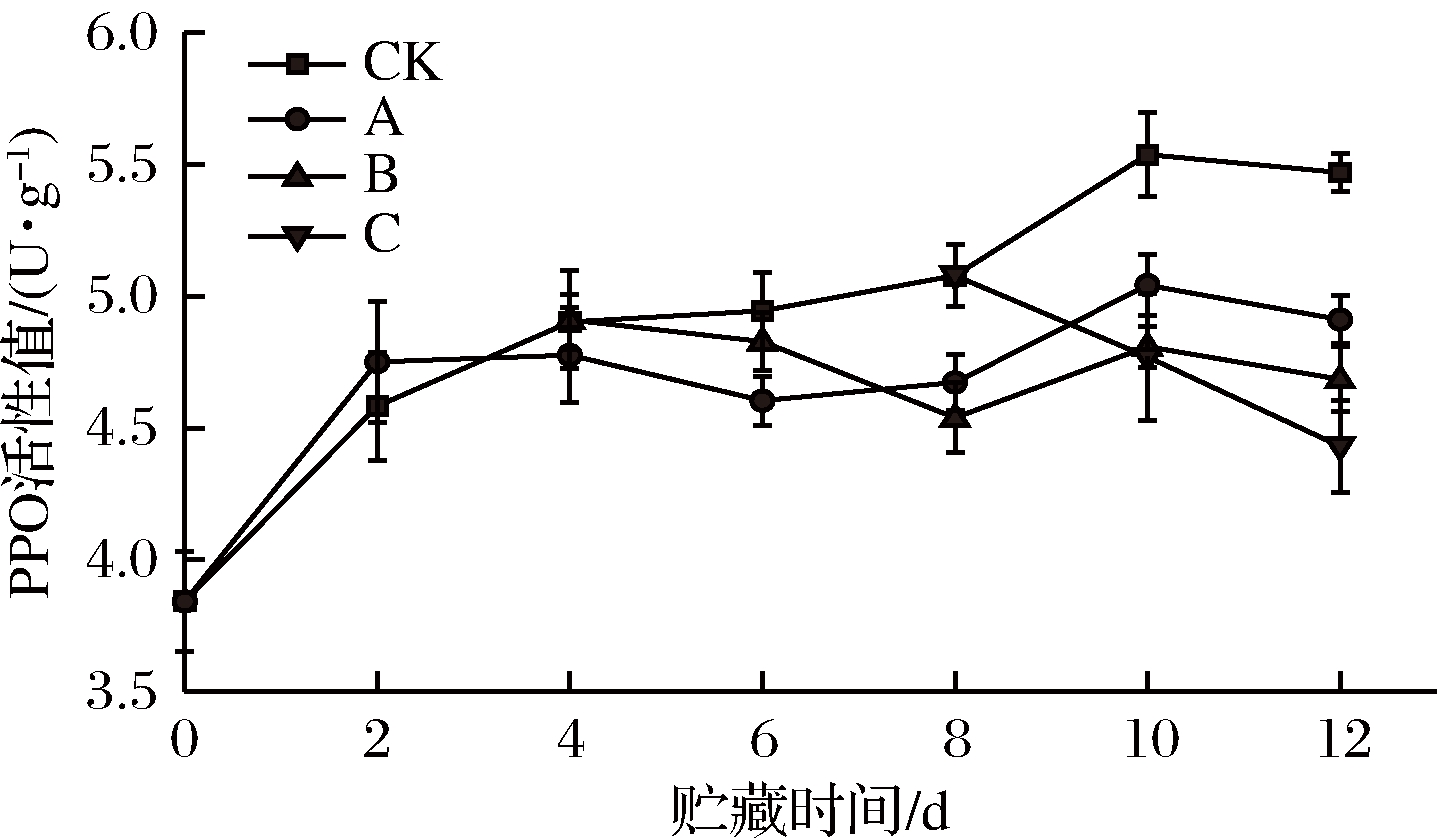
图4 不同时期乙醇处理对双孢菇PPO活性的影响
Fig.4 Effect of ethanol treatment used at different
times during storage on PPO activity of Agaricus bisporus
POD酶在有过氧化氢存在时可以氧化酚类成醌类,导致双孢菇褐变[38]。各组POD活性总体呈上升趋势,但存在波动。A组在贮藏前4 d未能显著抑制抑制双孢菇POD酶活性(P>0.05),可能是因为处理时操作破坏了细胞组织膜结构,细胞中游离态POD增加。与CK相比,A组第6天开始能显著抑制POD活性(P<0.05),第8天开始A组达到了极显著水平(P<0.01)。
和CK相比,B组从第8天开始能显著抑制POD活性(P<0.05),在整个贮藏期间效果与A组相当。C组第8天后POD活性急速减弱。贮藏结束,C组POD活性明显低于CK组(P<0.05),但仍高于A组和B组,3个处理组都能抑制双孢菇POD的活性,可能是因为乙醇熏蒸抑制![]() 形成速度[39],减少了样品中过氧化氢占比,也有可能是乙醇熏蒸减弱了PAL酶活使POD反应底物总酚含量降低,从而抑制其活性。B组效果最佳,可能是因为B组乙醇处理时间居中,因此在贮藏结束时较之A组有更多的乙醇残留,较之C组则更早地对PAL酶活以及过氧化氢含量起到控制作用。
形成速度[39],减少了样品中过氧化氢占比,也有可能是乙醇熏蒸减弱了PAL酶活使POD反应底物总酚含量降低,从而抑制其活性。B组效果最佳,可能是因为B组乙醇处理时间居中,因此在贮藏结束时较之A组有更多的乙醇残留,较之C组则更早地对PAL酶活以及过氧化氢含量起到控制作用。
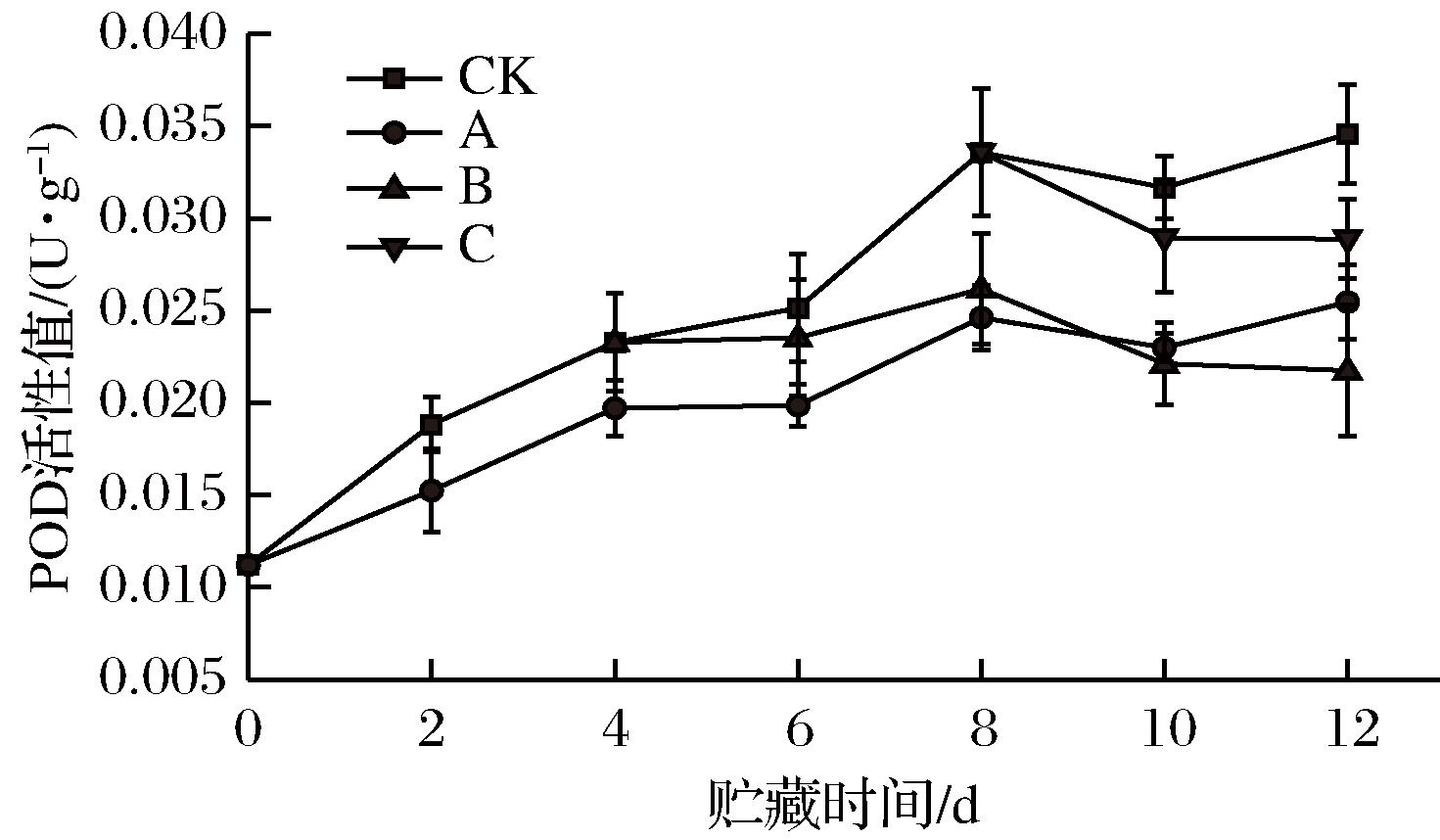
图5 不同时期乙醇处理对双孢菇POD活性的影响
Fig.5 Effect of ethanol treatment used at different
times during storage on POD activity of Agaricus bisporus
相对电导率可以表征细胞膜完整度,相对电导率越大,细胞完整度越低[40]。根据图6,各组相对电导率随时间总体上升,这可能是因为双胞菇贮藏期间组成细胞壁的果胶大量降解,导致细胞结构被破坏。A组从第6天开始显著抑制了双孢菇的相对电导率(P<0.05)到贮藏结束,而B组需要从第8天开始才能显著抑制相对电导率(P<0.05),但与A组差异不大(P>0.05)。第12天,A、B组均可以极显著减弱相对电导率上升趋势(P<0.01),A、B组之间无明显区别,也许是因为活性氧的产生受到了抑制,保护了细胞。C组也能显著抑制双孢菇相对电导率的上升(P>0.05),但由于乙醇在第8天才处理,活性氧已经在相当长的时间内对细胞造成了伤害,故而效果不如A、B组。由此可见,A、B、C组都能很好地抑制双孢菇相对电导率的上升,并且B组和A组效果相当。

图6 不同时期乙醇处理对双孢菇相对电导率的影响
Fig.6 Effect of ethanol treatment used at different times
during storage on relative conductivity of Agaricus bisporus
双孢菇作为食用菌,其子实体营养丰富且无角质层,易滋生细菌。乙醇对微生物有致死作用,这是因为乙醇可以破坏菌体蛋白的肽键,使其变性,同时乙醇还具有溶菌作用[41-43]。根据图7,各组菌落总数在贮藏期间呈增加趋势。与CK组相比,A组第0 d菌落总数下降了1.19 lg CFU/g,并且在贮藏期间二者差异极显著(P<0.01),这可能是因为乙醇熏蒸对双孢菇有直接的杀菌作用。B组经乙醇熏蒸处理后菌落总数立刻下降了1 lg CFU/g,从第4天开始到第12天与CK组存在非常明显差别(P<0.01),但与A组差异不大。C组第8天的菌落总数下降了1.14 lg CFU/g,与CK组存在极显著差异(P<0.01)直到贮藏结束。贮藏结束时,A组、B组、C组分别达到7.11、7.29、7.26 lg CFU/g,3个处理组之间没有显著差异(P>0.05)。由此可见,乙醇不同处理时间均可以有效抑制菌落生长(P<0.01),且3个处理组之间差异不大(P>0.05)。
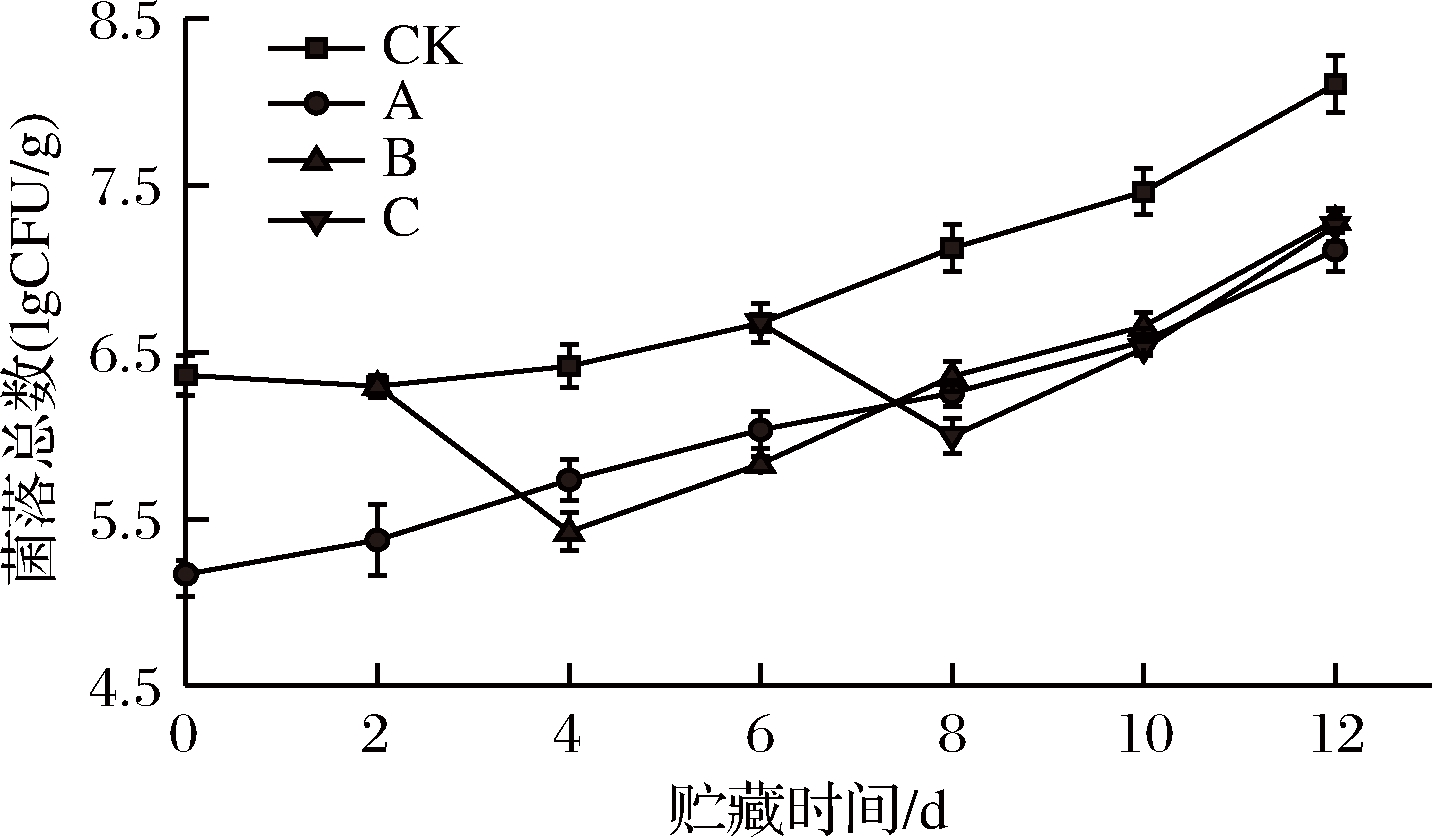
图7 不同时期乙醇处理对双孢菇菌落总数的影响
Fig.7 Effect of ethanol treatment used at different
times during storage on total bacterial counts of
Agaricus bisporus
硬度是果蔬贮藏质量的标志,对消费者购买欲有重要影响,乙醇通过抑制双孢菇的呼吸强度能够保持较好的硬度。根据图8可知,双孢菇硬度值随着时间延长不断下降,这可能是因为双孢菇呼吸消耗大量有机物。与CK组相比,A组从第2天开始显著抑制双孢菇硬度下降直到贮藏结束(P<0.05),也许是因为A组从第2天开始呼吸作用受到抑制。B、C组经乙醇熏蒸后与CK组差异不大(P>0.05)甚至略有下降,可能是因为双孢菇乙醇熏蒸时从4 ℃环境转移到常温,温度上升引起硬度下降,这与郭禹等[39]对马铃薯的研究结果类似,也有可能是因为B组、C组经乙醇熏蒸后呼吸作用略有加剧导致硬度下降。第12天,A组与CK组存在显著差异(P<0.05),但B、C两组与CK组差异不大(P>0.05)。A组能很好地抑制双孢菇硬度值的下降(P<0.05),B组、C组则不能起到明显作用。
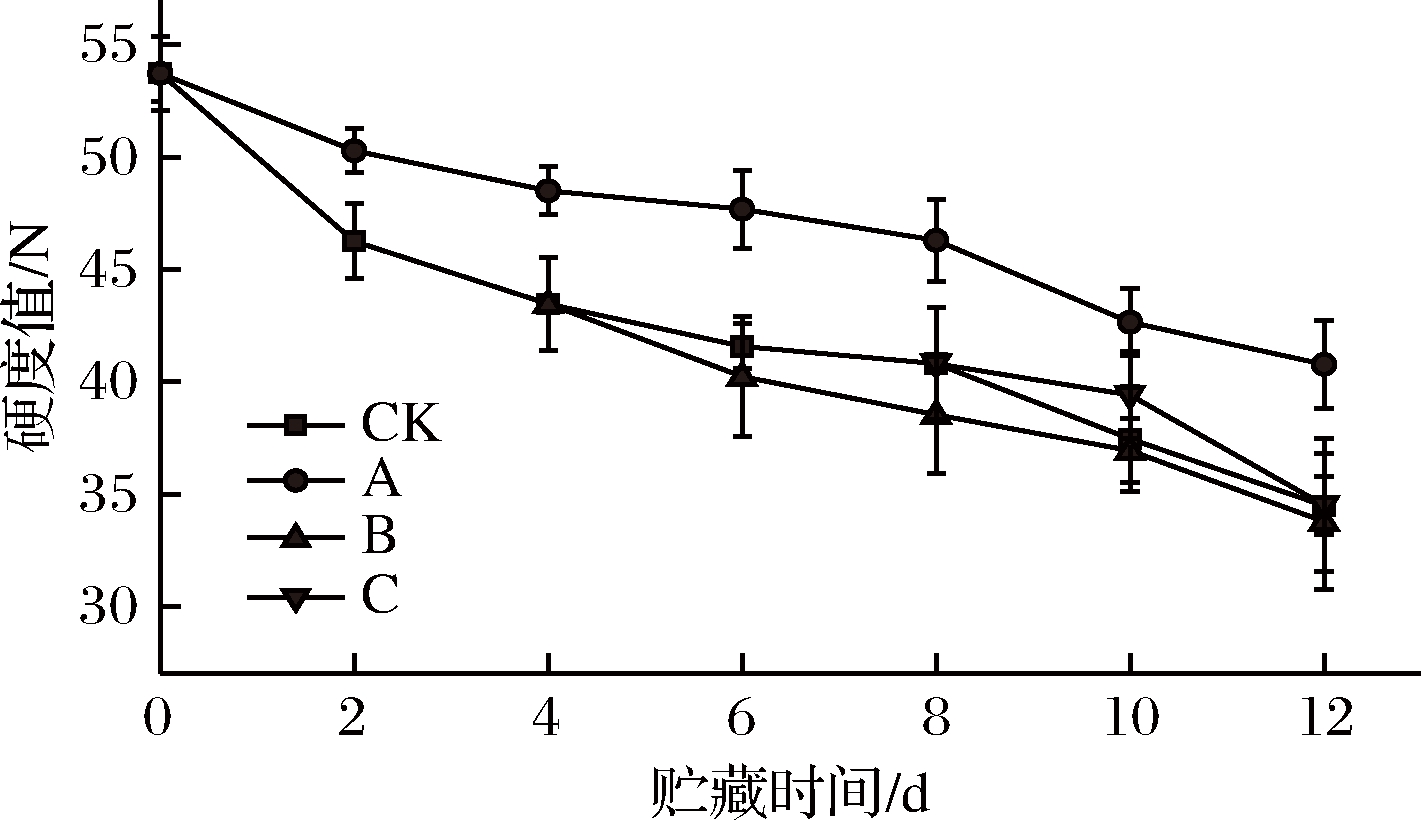
图8 不同时期乙醇处理对双孢菇硬度的影响
Fig.8 Effect of ethanol treatment used at different
times during storage on firmness of Agaricus bisporus
白度是消费者购买双孢菇时重要的指标,当L*值小于80时,从外观上来说双孢菇丧失了商品价值[40]。根据图9,双孢菇的白度值在贮藏过程中不断下降。与CK组相比,A组从第4天开始显著抑制白度的下降(P<0.05),并从第6天开始达到极显著效果(P<0.01)。B组从第6 d开始显著抑制白度的下降(P<0.05),第10天开始达到极显著效果(P<0.01),且B组与A组第6天后没有显著差异(P>0.05),说明乙醇熏蒸能够即时起到保护双孢菇白度值的作用,也许是因为乙醇熏蒸能明显减弱PPO、POD酶活以及相对电导率、总酚上升速率。C组双孢菇白度值从第10天开始下降,但与CK组相差不大(P>0.05)。第8天乙醇熏蒸对白度作用较小,可能是C组样品呼吸强度已经无明显减弱。由此可见,A组在贮藏期间显著抑制双孢菇白度值的下降(P<0.05),B组在贮藏中后期显著维持了白度值(P<0.05)并且在第12天略高于A组(P>0.05),这与本实验中B组能在贮藏末期更好抑制PPO和POD酶活的结果保持一致。C组能在后期抑制双孢菇白度值的下降,但是与CK组没有显著差异(P>0.05),这可能是因为C组后期未能有效抑制POD酶活以及相对电导率的上升。
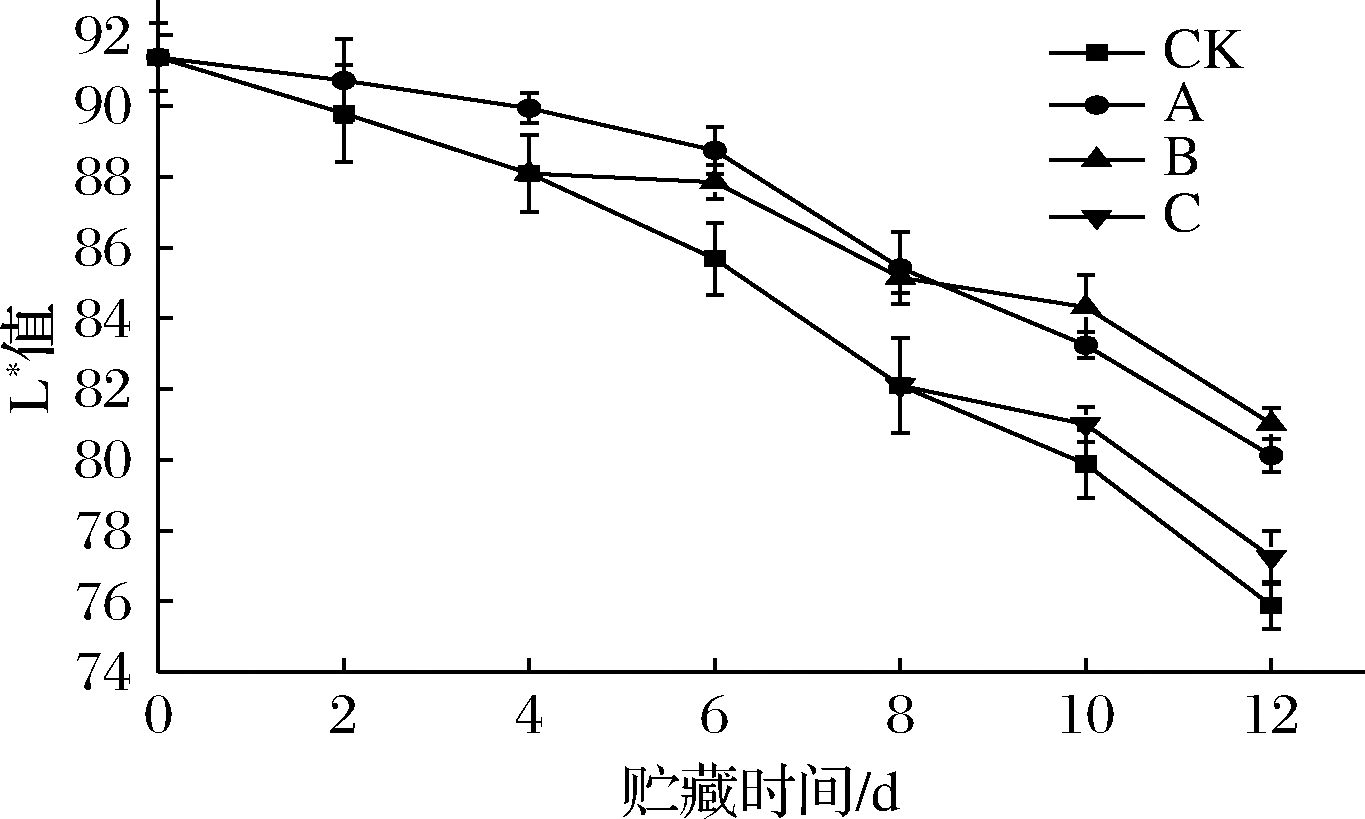
图9 不同时期乙醇处理对双孢菇白度的影响
Fig.9 Effect of ethanol treatment used at different
times during storage on whiteness of Agaricus bisporus
根据图10,在贮藏期间双孢菇的感官评价分值不断下降。与CK组相比,A组从第4天开始显著抑制了感官品质的劣变(P<0.05)并在第6天达到极显著水平(P<0.01)。B组第6天开始显著抑制了感官品质的劣变(P<0.05)直到贮藏结束。第8天开始CK组和C组出现肉眼可见的褐变,气味改变,手感发黏而A、B气味和手感正常,可能是乙醇抑制了A、B组微生物的生长并维持PPO、POD较低活性。第10天,CK组得分仅5.5。C组略高于CK组。第12天,A、B两组得分分别为6.5、6.25分。综上,与CK组相比,A、B两组保持双孢菇感官评价效果较好(P<0.01),且A、B作用相当(P>0.05),而C组与CK组不存在显著性差异(P>0.05)。
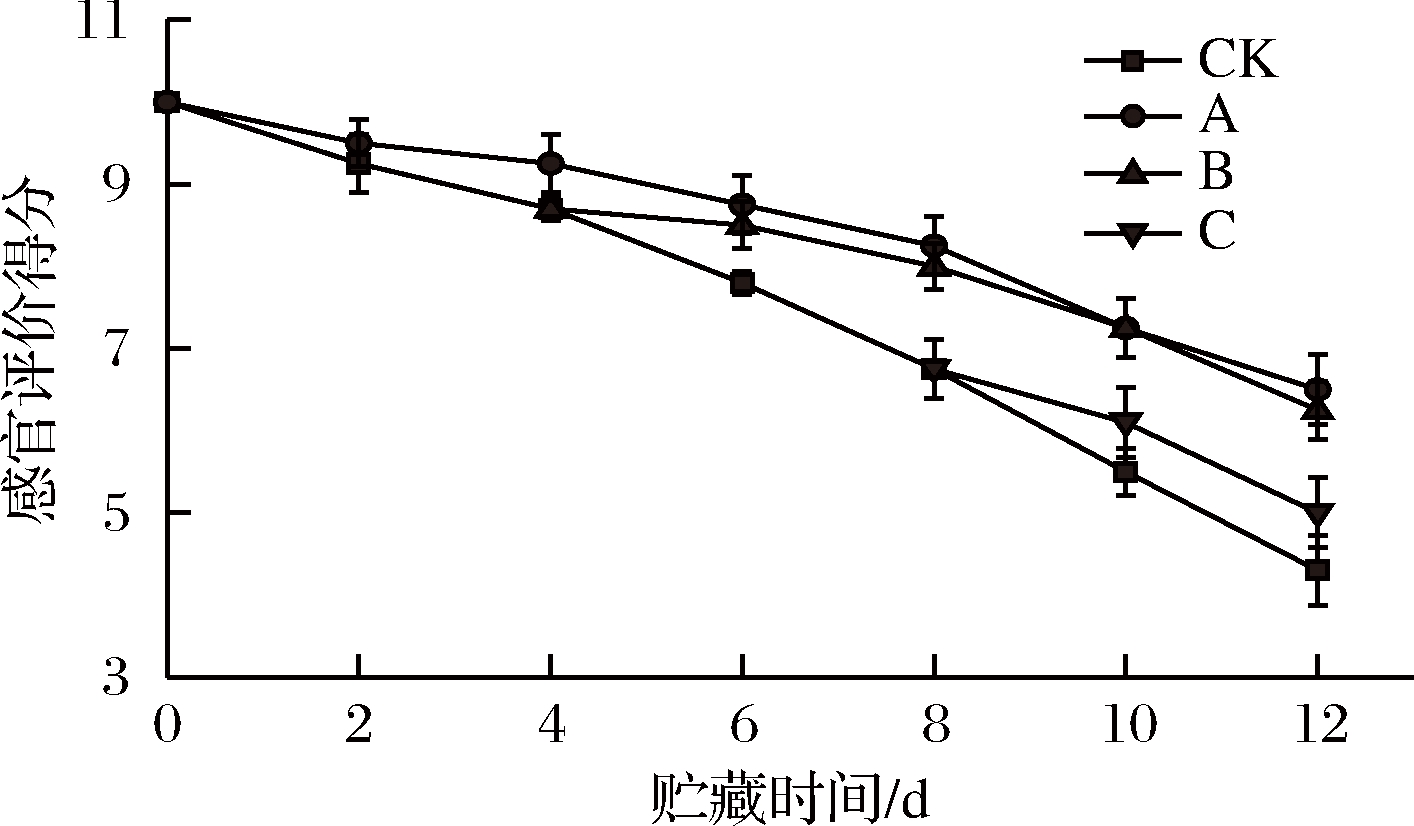
图10 不同时期乙醇处理对双孢菇感官评价的影响
Fig.10 Effect of ethanol treatment used at different times
during storage on sensory properties of Agaricus bisporus
本研究表明,与入库前乙醇熏蒸处理相比,贮藏前期(第4天)对双孢菇进行乙醇熏蒸处理虽然在抑制PAL活性和维持硬度方面效果略差,但是仍然可以保持其较低的相对电导率、总酚含量和菌落总数,抑制PAL、PPO、POD的活性,维持较高的白度值和感官评价。贮藏前期处理(第4天)抑制双孢菇后期呼吸强度效果最好。而贮藏后期(第8天)处理虽能更好抑制贮藏后期PPO的活性,但在呼吸强度、白度、硬度、感官评价方面效果不好。综上所述,对于双胞菇来说乙醇入库前处理效果最好,贮藏前期处理(第4天)虽无法完全达到入库前处理的效果,但依然能保持很好的商品性。对于商家来说,即使不同采收时间,不同地域送来的双孢菇需要分批进入冷库,在其贮藏第4天才处理,效果依然会不错,但不建议在贮藏后期也就是第8天才进行处理。
[1] FOULONGNE-ORIOL M, RODIER A, CAUMONT P, et al. Agaricus bisporus cultivars: Hidden diversity beyond apparent uniformity[C]//Proceedings of the 7th International Conference on Mushroom Biology and Mushroom Products (ICMBMP7). Institut National de la Recherche Agronomique (INRA) France, 2011: 4-7.
[2] 李云云, 魏丹, 张敏. 微孔膜对双孢蘑菇物流升温后保鲜品质的影响[J]. 包装工程, 2016,37(11):52-57.
[3] DJEKIC I, VUNDUK J, ![]() I, et al. Total quality index of Agaricus bisporus mushrooms packed in modified atmosphere[J]. Journal of the Science of Food and Agriculture, 2017, 97(9): 3 013-3 021.
I, et al. Total quality index of Agaricus bisporus mushrooms packed in modified atmosphere[J]. Journal of the Science of Food and Agriculture, 2017, 97(9): 3 013-3 021.
[4] 张晓聪.白色双孢蘑菇褐变机理及控制技术研究[D]. 福州:福建农林大学, 2010.
[5] 徐丽婧,常明昌,孟俊龙,等. UV-C处理对双孢蘑菇采后品质的影响[J]. 食品工业科技, 2016, 37(1):347-350;380.
[6] BAN Z, LI L,GUAN J,et al. Modified atmosphere packaging (MAP) and coating for improving preservation of whole and sliced Agaricus bisporus[J]. Journal of Food Science and Technology, 2014, 51(12):3 894-3 901.
[7] JAFRI M, JHA A,BUNKAR D S,et al.Quality retention of oyster mushrooms (Pleurotus florida) by a combination of chemical treatments and modified atmosphere packaging[J]. Postharvest Biology and Technology, 2013, 76: 112-118.
[8] FAN W,CAO Y,REN H, et al. Effects of ethanol fumigation on inhibiting fresh-cut yam enzymatic browning and microbial growth[J]. Journal of Food Processing and Preservation,2018,42(2):e13434.
[9] DAO T, DANTIGNY P. Control of food spoilage fungi by ethanol[J]. Food Control, 2011, 22(3-4):360-368.
[10] 杨建华,马瑜,李勃,等.乙醇气体缓释处理对鲜食葡萄保鲜效果的影响[J].保鲜与加工,2015,15(4):32-38.
[11] HAN J, TAO W, HAO H, et al. Physiology and quality responses of fresh-cut broccoli florets pretreated with ethanol vapor[J]. Journal of Food Science, 2006, 71(5):S385-S389.
[12] WANG K, CAO S, DI Y, et al. Effect of ethanol treatment on disease resistance against anthracnose rot in postharvest loquat fruit[J]. Scientia Horticulturae, 2015, 188:115-121.
[13] 刘洪丽. 鲜切莴苣、荸荠抗褐变剂筛选及其机理研究[D].武汉:华中农业大学,2016.
[14] WANG Q, NIE X, CANTWELL M. Hot water and ethanol treatments can effectively inhibit the discoloration of fresh-cut sunchoke (Helianthus tuberosus L.) tubers[J]. Postharvest Biology and Technology, 2014, 94:49-57.
[15] 张莉,许欣,刘林德.乙醇熏蒸对杏鲍菇贮藏品质的影响[J]. 食品科技, 2018, 43(11):50-54.
[16] 李云云. 乙醇熏蒸处理对双孢蘑菇保鲜品质的影响[D].重庆:西南大学,2017.
[17] 曹建康, 姜微波, 赵玉梅.果蔬采后生理生化实验指导[M]. 北京:中国轻工业出版社, 2007:142-144.
[18] ZHOU Y, DENG L, ZENG K. Enhancement of biocontrol efficacy of Pichia membranaefaciens by hot water treatment in postharvest diseases of citrus fruit[J]. Crop Protection, 2014, 63:89-96.
[19] OMS-OLIU G,AGUIL -AGUAYO I,MART
-AGUAYO I,MART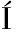 N-BELLOSO O,et al.Effects of pulsed light treatments on quality and antioxidant properties of fresh-cut mushrooms (Agaricus bisporus)[J]. Postharvest Biology and Technology, 2010, 56(3): 216-222.
N-BELLOSO O,et al.Effects of pulsed light treatments on quality and antioxidant properties of fresh-cut mushrooms (Agaricus bisporus)[J]. Postharvest Biology and Technology, 2010, 56(3): 216-222.
[20] MOERSCHBACHER B M, NOLL U M, FLOTT B E,et al. Lignin biosynthetic enzymes in stem rust infected, resistant and susceptible near-isogenic wheat lines[J]. Physiological and Molecular Plant Pathology, 1988, 33(1): 33-46.
[21] 蒋冬花,许朝渊,张萍华,等. 3种保鲜剂对香菇保鲜效果[J]. 食品科学, 2004, 25(9):194-197.
[22] 中华人民共和国卫生部. GB 47892—2010 中国标准书号[M]. 北京: 中国标准出版社, 2010.
[23] JIANG T, WANG Q, XU S, et al. Structure and composition changes in the cell wall in relation to texture of shiitake mushrooms (Lentinula edodes) stored in modified atmosphere packaging[J]. Journal of the Science of Food and Agriculture, 2010, 90(5): 742-749.
[24] JAWORSKA G, ![]() E. The effect of preliminary processing and period of storage on the quality of frozen Boletus edulis (Bull: Fr.) mushrooms[J]. Food Chemistry, 2009, 113(4): 936-943.
E. The effect of preliminary processing and period of storage on the quality of frozen Boletus edulis (Bull: Fr.) mushrooms[J]. Food Chemistry, 2009, 113(4): 936-943.
[25] RAMOS B, MILLER F A, BRAND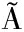 O T R S, et al. Fresh fruits and vegetables-an overview on applied methodologies to improve its quality and safety[J]. Innovative Food Science & Emerging Technologies, 2013, 20(1): 1-15.
O T R S, et al. Fresh fruits and vegetables-an overview on applied methodologies to improve its quality and safety[J]. Innovative Food Science & Emerging Technologies, 2013, 20(1): 1-15.
[26] 刘文玮. 外源乙醇对采后薄皮甜瓜乙烯合成及其贮藏品质的影响[D]. 沈阳:沈阳农业大学, 2012.
[27] 李静,李顺峰,田广瑞,等.高压二氧化碳处理对双孢蘑菇贮藏品质的影响[J]. 食品与机械, 2016, 32(2): 101-105.
[28] 俞雅琼,董明,王旭东,等.机械损伤对砀山酥梨采后生理生化变化的影响[J]. 保鲜与加工, 2011, 11(3):10-15.
[29] YAN S, YANG T, LUO Y. The mechanism of ethanol treatment on inhibiting lettuce enzymatic browning and microbial growth[J]. LWT-Food Science and Technology, 2015, 63(1): 383-390.
[30] 梁亚男,叶发银,雷琳,等.苹果汁褐变控制技术研究进展[J].食品与发酵工业,2018,44(3):280-286.
[31] 王慧倩,郑聪,王华东,等.乙醇熏蒸处理对鲜切西兰花活性成分和抗氧化活性的影响[J].食品科学,2014,35(16):250-254.
[32] CUTR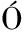 A C, HOLLMANN A, CEJAS J, et al. Phenylalanine interaction with lipid monolayers at different pHs[J]. Colloids and Surfaces B: Biointerfaces, 2015, 135: 504-509.
A C, HOLLMANN A, CEJAS J, et al. Phenylalanine interaction with lipid monolayers at different pHs[J]. Colloids and Surfaces B: Biointerfaces, 2015, 135: 504-509.
[33] 路媛媛. UV-C和高CO2处理对双孢蘑菇采后生理及抗氧化品质的影响研究[D]. 北京:中国农业科学院,2016.
[34] WU S, NIE Y, ZHAO J, et al. The synergistic effects of low-concentration acidic electrolyzed water and ultrasound on the storage quality of fresh-sliced button mushrooms[J]. Food and bioprocess technology, 2018, 11(2): 314-323.
[35] LI B, DING Y,TANG X,et al. Effect of L-arginine on maintaining storage quality of the white button mushroom (Agaricus bisporus)[J]. Food and Bioprocess Technology, 2019, 12(4): 563-574.
[36] ONG M K, ALI A, ALDERSON P G, et al. Effect of different concentrations of ozone on physiological changes associated to gas exchange, fruit ripening, fruit surface quality and defence-related enzymes levels in papaya fruit during ambient storage[J]. Scientia Horticulturae, 2014, 179: 163-169.
[37] 彭益强, 刘鹏, 邓峰,等. 源于马铃薯的多酚氧化酶活性中心必需基团组成与抑制机理[J]. 化工进展, 2016, 31(2):406-411.
[38] SARAIVA J A, CL UDIA S. NUNES, COIMBRA M A. Purification and characterization of olive (Olea europaea L.) peroxidase-Evidence for the occurrence of a pectin binding peroxidase[J]. Food Chemistry, 2007, 101(4):1 571-1 579.
UDIA S. NUNES, COIMBRA M A. Purification and characterization of olive (Olea europaea L.) peroxidase-Evidence for the occurrence of a pectin binding peroxidase[J]. Food Chemistry, 2007, 101(4):1 571-1 579.
[39] 郭禹, 姜宇芙,钟佳,等.乙醇熏蒸对采后油豆角衰老相关生理指标的影响[J]. 食品与机械, 2016, 32(5): 144-147.
[40] SONG X, LI Y. Cell membrane damage by vacuum treatment at different pressure reduction rates[J]. Journal of Food Process Engineering, 2012, 35(6): 915-922.
[41] 马学芬,王利强,刘靖,等.乙醇气体发生剂在抗菌包装中的研究进展[J].包装工程,2012,33(23):144-149.
[42] TANO K, OUL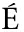 , M K DOYON G, et al. Comparative evaluation of the effect of storage temperature fluctuation on modified atmosphere packages of selected fruit and vegetables[J]. Postharvest Biology and Technology, 2007, 46(3):212-221
, M K DOYON G, et al. Comparative evaluation of the effect of storage temperature fluctuation on modified atmosphere packages of selected fruit and vegetables[J]. Postharvest Biology and Technology, 2007, 46(3):212-221
[43] BRIONES G L,VAROQUAUX P,CHAMBROY Y, et al.Storage of common mushroom under controlled atmospheres[J]. International Journal of Food Science & Technology, 1992, 27(5):493-505.