白玉菇(white Hypsizygus marmoreu)是真姬菇的白色品系,又名白玉蕈、白色海鲜菇,属伞菌目、白蘑科、玉蕈属[1],其菇体洁白,质地细腻,具有独特的海蟹味,深受消费者的欢迎[2]。白玉菇营养丰富,含有多种营养成分,其中多糖含量高达7.5%(占干重),相较于其他药用真菌如猴头菇、猪苓等要高很多[3],药用价值高;此外,白玉菇子实体中还含有21.8%(占干重)的蛋白质和多种微量元素等,王耀松等[4]通过对白玉菇的营养性分析发现白玉菇蛋白的氨基酸模式与人体氨基酸模式非常接近,是一种优质蛋白质。近年来,随着人们对蛋白质需求量的大幅度增加,植物蛋白以其不含胆固醇且资源丰富、价格低廉的特点,越来越受到人们的关注[5],国际上提取和利用植物蛋白已成为研究热点,而对于白玉菇的研究主要集中在多糖的提取及分析上[3,6],对于其蛋白质的提取及利用还鲜有报道。
蛋白质的提取方法主要有碱法提取、酶法提取、有机溶剂提取等,其中碱提法操作简单,成本低廉,提取率高[7]。因此本实验采用碱提法从白玉菇中提取蛋白质,并通过单因素分析,结合响应面法,确定提取白玉菇蛋白的最佳工艺条件,在此基础上进一步研究不同pH值对白玉菇蛋白功能特性的影响及氨基酸组成,以期为白玉菇蛋白在食品工业体系中的应用提供理论依据。
新鲜白玉菇,江西星火农林科技有限公司提供;鲁花压榨特香菜籽油,购于江西农大超市。
浓HCl、硼酸、H3PO4(分析纯),四川西陇化工有限公司;NaOH(分析纯),天津永大化学试剂有限公司;牛血清蛋白(BSA),上海源叶生物科技有限公司;考马斯亮蓝G-250,上海强顺化学试剂有限公司。
BSA124S电子天平,赛多利斯科学仪器(北京)有限公司;Q500B高速多功能粉碎机,上海冰都电器有限公司;SCZL-2数显控温磁力搅拌器,巩义市予华仪器有限公司; SF-TGL-16G台式高速离心机,上海菲恰尔分析仪器有限公司;便携式pH计,上海大普仪器有限公司;T-25 basic高速分散机,艾卡(广州)仪器设备有限公司;WFJ 2100可见分光光度计,尤尼科(上海)科学仪器有限公司;Scientz-10N 冷冻干燥机,宁波新芝生物科技股份有限公司;L-8800型氨基酸分析仪,日本日立有限公司。
1.3.1 样品预处理
取适量新鲜白玉菇洗净置于60 ℃恒温干燥箱中烘干至恒重,粉碎后过80目筛,制得白玉菇粉,备用。
1.3.2 白玉菇蛋白的提取
白玉菇蛋白的提取参照刘静等[8]的方法略作修改。
白玉菇粉→加水溶解→调pH、温度碱提→离心(3 000 r/min,15 min)→取上清液→测蛋白含量→调pH至等电点→4℃过夜沉淀→离心(8 000 r/min,10 min)→沉淀水洗调pH至中性→冷冻干燥→白玉菇蛋白粉
1.3.3 白玉菇蛋白提取率的测定
提取液中蛋白含量的测定采用Bradford法[9],配制不同浓度梯度的BSA标准品溶液,加入考马斯亮蓝G-250染色,于595 nm处测吸光值,绘制BSA标准曲线,得到方程y=6.77x+0.395 6(R2=0.992 2)。白玉菇蛋白含量测定参照国标GB 5009.5—2016中凯氏定氮法。根据公式(1)计算白玉菇蛋白提取率:
白玉菇蛋白提取率/%
(1)
1.3.4 单因素试验
在白玉菇蛋白碱提工艺中,固定提取条件pH为10、提取温度为50 ℃、料液比为1∶30 (g∶mL)、提取时间为2 h。对4个因素:pH(8、9、10、11、12、13)、提取温度(30、40、50、60、70 ℃)、料液比(1∶15、1∶20、1∶25、1∶30、1∶35、1∶40、1∶45、1∶50)、提取时间(0.5、1.0、1.5、2.0、2.5、3.0 h)分别进行单因素试验,考察各因素对白玉菇蛋白提取率的影响。
1.3.5 响应面优化设计
在单因素试验的基础上,运用Design-Expert 8.0.6软件,依据Box-Behnken设计原理,以A(pH)、B(提取温度)、C(料液比)、D(提取时间)为自变量,以白玉菇蛋白提取率为响应值,设计4因素3水平的响应面优化试验。具体的试验因素、水平及编码见表1。
表1 试验因素水平及编码表
Table 1 Experiment factor level and coding table

水平因素A(pH)B(提取温度)/℃C(料液比)(g∶mL)D(提取时间)/h-111501∶351.5012601∶402.0113701∶452.5
1.3.6 白玉菇蛋白等电点(pI)的测定
等电点的测定参照孙小斐等[10]的方法略作修改。准确量取25 mL碱提液,加1 mol/L HCl 调溶液pH至3.2、3.4、3.6、3.8、4.0、4.2、4.4、4.6、4.8、5.0,静置2 h,以8 000 r/min离心10 min,取1 mL上清液于595 nm处测吸光值,溶液的吸光值与蛋白含量有关,上清液吸光值最低的溶液,其pH值即为白玉菇蛋白等电点。
1.3.7 白玉菇蛋白功能特性的测定
1.3.7.1 溶解性(nitrogen solubility index,NSI)的测定
参照LEE等[11]的方法并略作修改。准确称取0.2 g白玉菇蛋白于20 mL蒸馏水中,用1 mol/L HCl或1 mol/L NaOH调溶液pH至2.0、4.0、6.0、8.0、10.0,磁力搅拌45 min,以3 000 r/min离心15 min,测上清液蛋白含量。蛋白样品中的蛋白含量测定参照GB 5009.5—2016中的凯氏定氮法。根据公式(2)计算白玉菇蛋白的溶解性:
(2)
1.3.7.2 乳化性(emulsifying activity index,EAI)及乳化稳定性(emulsifying stability index,ESI)的测定
参照薛蕾等[12]的方法并略作修改。准确称取0.5 g白玉菇蛋白于25 mL蒸馏水中,用1 mol/L HCl或1 mol/L NaOH调溶液pH至2.0、4.0、6.0、8.0、10.0,加入等体积25 mL菜籽油,在高速分散机中以9 500 r/min高速搅打2 min,随后迅速量取30 mL于离心管中,以2 000 r/min离心10 min,测量乳化层的高度及离心管液体总高度,然后再将离心管放入80 ℃水浴30 min,冷却至室温后以2 000 r/min离心10 min,测量乳化层的高度。根据公式(3)、公式(4)计算白玉菇蛋白的乳化性及乳化稳定性:
(3)
(4)
1.3.7.3 起泡性(foamability,FA)及泡沫稳定性(foaming stability,FS)的测定
参照张思思等[13]的方法略作修改。准确称取0.8 g白玉菇蛋白粉于40 mL蒸馏水中,用1 mol/L HCl或1 mol/L NaOH 调溶液pH至2.0、4.0、6.0、8.0、10.0,在高速分散机中以9 500 r/min高速搅打2 min,随后迅速将其倒入量筒中,记录上层泡沫的体积,静置30 min后,再次记录上层泡沫的体积。计算白玉菇蛋白的起泡性及泡沫稳定性,如公式(5)、(6)所示:
(5)
(6)
1.3.7.4 持水性(water holding capacity,WHC)的测定
参照杨希娟等[14]的方法并略作修改。准确称取0.25 g白玉菇蛋白粉于预先称量过的10 mL离心管中,加入5 mL蒸馏水,充分振荡摇匀,静置1 h,以4 000 r/min离心10 min,倒去上清液,测定离心管中残留物的重量。根据公式(7)计算白玉菇蛋白的持水性:
(7)
1.3.7.5 持油性(oil holding capacity,OHC)的测定
参照张维农等[15]的方法并略作修改。准确称取0.25 g白玉菇蛋白粉于预先称量过的10 mL刻度的离心管中,加入5 mL菜籽油,充分振动摇匀,静置1 h,以4 000 r/min离心10 min,倒去上清液,测定离心管中残留物的质量。根据公式(8)计算白玉菇蛋白的持油性:
(8)
1.3.8 氨基酸组成分析
参照GB 5009.124—2016对白玉菇蛋白氨基酸的组成及含量进行测定。
2.1.1 pH对白玉菇蛋白提取率的影响
如图1所示,蛋白提取率随pH的升高呈先上升后下降的趋势。当溶液pH为8~12时,随着pH的升高,蛋白提取率上升显著(P<0.05),这可能是因为蛋白质分子间的氢键被打破,促进了蛋白质分子的溶出,当pH为12时,提取率达到最高值为35.83%;当溶液pH大于12后,蛋白提取率下降显著(P<0.05),这可能是因为强碱溶液较为黏稠不利于蛋白的溶出,且易使蛋白质变性。所以选取pH=12进行后续试验。
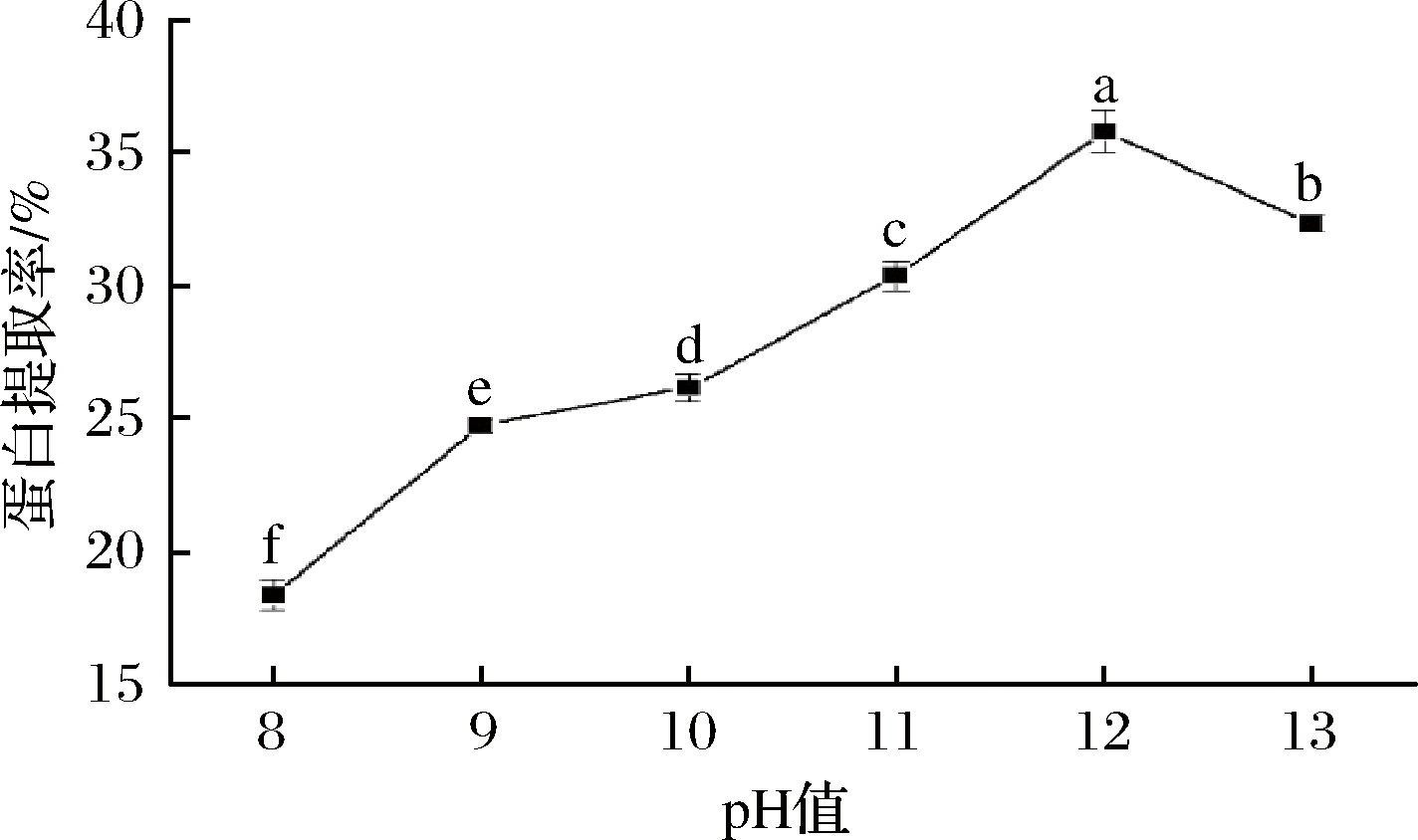
图1 pH对白玉菇蛋白提取率的影响
Fig.1 Effect of pH on protein extraction rate
注:不同小写字母表示具有显著性差异(P<0.05)(下同)
2.1.2 提取温度对白玉菇蛋白提取率的影响
如图2所示,蛋白提取率随提取温度的升高呈先上升后下降的趋势。当提取温度为30~60 ℃时,蛋白提取率上升显著(P<0.05),这可能是因为温度的升高使蛋白质分子热运动增加,溶出率增高,当提取温度为60 ℃时,蛋白提取率达到最高值为33.30%;当提取温度大于60 ℃后,蛋白提取率下降显著(P<0.05)。所以选取提取温度60 ℃进行后续试验。

图2 提取温度对蛋白提取率的影响
Fig.2 Effect of extraction temperature on protein
extraction rate
2.1.3 料液比对白玉菇蛋白提取率的影响
如图3所示,蛋白提取率随料液比的增加呈先上升后平缓的趋势。当料液比为(1∶15)~(1∶40)(g∶mL)时,随着料液比的增加,蛋白提取率增长显著(P<0.05);当料液比大于1∶40后,白玉菇蛋白提取率虽略有下降,但趋于平缓,下降不显著(P<0.05)。这可能是因为当料液比较小时,菇粉本身溶解不完全,且此时溶液黏性较大,不利于蛋白质分子的溶出,当料液比增大时,菇粉充分溶解,蛋白提取率增加。所以选取料液比1∶40进行后续试验。

图3 料液比对蛋白提取率的影响
Fig.3 Effect of materials-to-liquid ratio on protein
extraction rate
2.1.4 提取时间对白玉菇蛋白提取率的影响
如图4所示,蛋白提取率随提取时间的延长呈先上升后下降的趋势。当提取时间为0.5~2.0 h时,蛋白提取率增长显著(P<0.05),这可能是因为随着提取时间的增加,溶液经长时间的搅拌,菇粉细胞壁被充分破坏,蛋白质分子更易溶出,当提取时间为2.0 h,蛋白提取率最高值为36.08%;当提取时间大于2.0 h后,蛋白提取率下降显著(P<0.05)。所以选取提取时间2.0 h进行后续试验。

图4 提取时间对蛋白提取率的影响
Fig.4 Effect of extraction time on protein extraction rate
2.2.1 响应面试验设计及结果
以A(pH)、B(提取温度)、C(料液比)、D(提取时间)4个因素为自变量,以白玉菇蛋白提取率为响应值,设计出4因素3水平共29组响应面优化试验,具体试验设计及结果见表2。
表2 响应面试验设计及结果
Table 2 Response surface test design and results
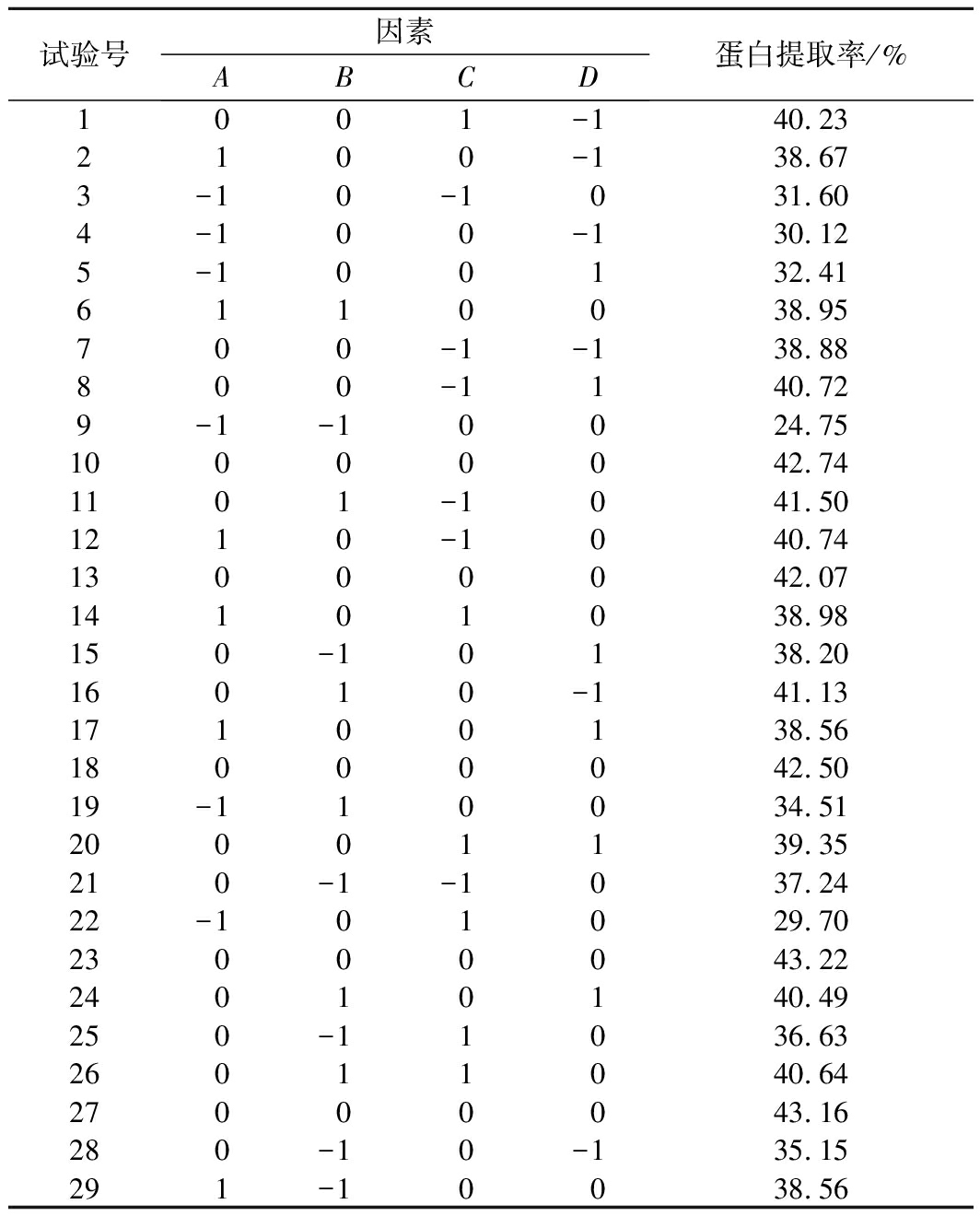
试验号因素ABCD蛋白提取率/%1001-140.232100-138.673-10-1031.604-100-130.125-100132.416110038.95700-1-138.88800-1140.729-1-10024.7510000042.741101-1041.501210-1040.7413000042.0714101038.98150-10138.2016010-141.1317100138.5618000042.5019-110034.5120001139.35210-1-1037.2422-101029.7023000043.2224010140.49250-11036.6326011040.6427000043.16280-10-135.15291-10038.56
2.2.2 二次回归模型的建立及显著性分析
运用Design-Expert 8.0.6软件,对响应面试验结果进行回归拟合,得到以A(pH)、B(提取温度)、C(料液比)、D(提取时间)为自变量,以白玉菇蛋白提取率Y为响应值的二次多项回归方程:
Y/%=42.74+4.28A+2.22B-0.43C+0.46D-2.34AB+0.035AC-0.60AD-0.063BC-0.92BD-0.68CD-6.16A2-2.39B2-1.33C2-1.62D2
对回归模型的方差分析见表3。由表3可以看出,该模型F值为100.04,P值<0.000 1,表明该模型差异极显著;失拟项P值0.248 1>0.05,不显著,表明回归模型可以接受;模型决定系数R2=0.990 1,校正系数![]() 说明白玉菇蛋白提取率与该模型拟合程度较高,能够较好地反映各因素与响应值的关系。模型中A、B、AB、A2、B2、C2、D2对蛋白提取率影响极显著;C、D、BD对蛋白提取率影响显著;AC、AD、BC、CD影响不显著。根据F值和P值,各因素对蛋白提取率的影响的主次顺序为pH>提取温度>提取时间>料液比。
说明白玉菇蛋白提取率与该模型拟合程度较高,能够较好地反映各因素与响应值的关系。模型中A、B、AB、A2、B2、C2、D2对蛋白提取率影响极显著;C、D、BD对蛋白提取率影响显著;AC、AD、BC、CD影响不显著。根据F值和P值,各因素对蛋白提取率的影响的主次顺序为pH>提取温度>提取时间>料液比。
表3 回归模型方差分析表
Table 3 Regression model variance analysis table
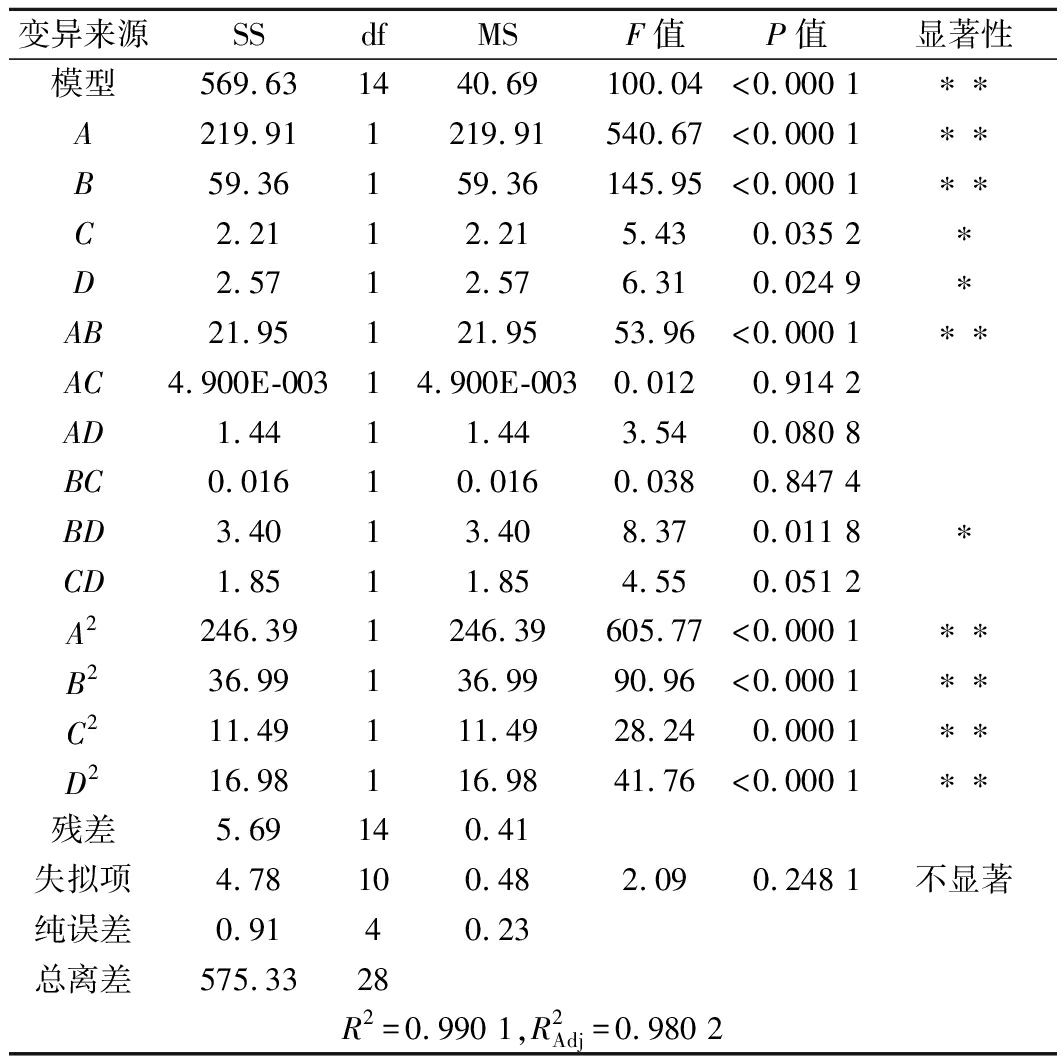
变异来源SSdfMSF值P值显著性模型569.631440.69100.04<0.000 1∗∗A219.911219.91540.67<0.000 1∗∗B59.36159.36145.95<0.000 1∗∗C2.2112.215.430.035 2∗D2.5712.576.310.024 9∗AB21.95121.9553.96<0.000 1∗∗AC4.900E-00314.900E-0030.0120.914 2AD1.4411.443.540.080 8BC0.01610.0160.0380.847 4BD3.4013.408.370.011 8∗CD1.8511.854.550.051 2A2246.391246.39605.77<0.000 1∗∗B236.99136.9990.96<0.000 1∗∗C211.49111.4928.240.000 1∗∗D216.98116.9841.76<0.000 1∗∗残差5.69140.41失拟项4.78100.482.090.248 1不显著纯误差0.9140.23总离差575.3328R2=0.990 1,R2Adj=0.980 2
注:*差异显著(P<0.05);**差异极显著(P<0.01)
2.2.3 响应面各因素交互作用分析
运用Design-Expert8.0.6软件,分析响应面优化试验结果,得到响应曲面图5。
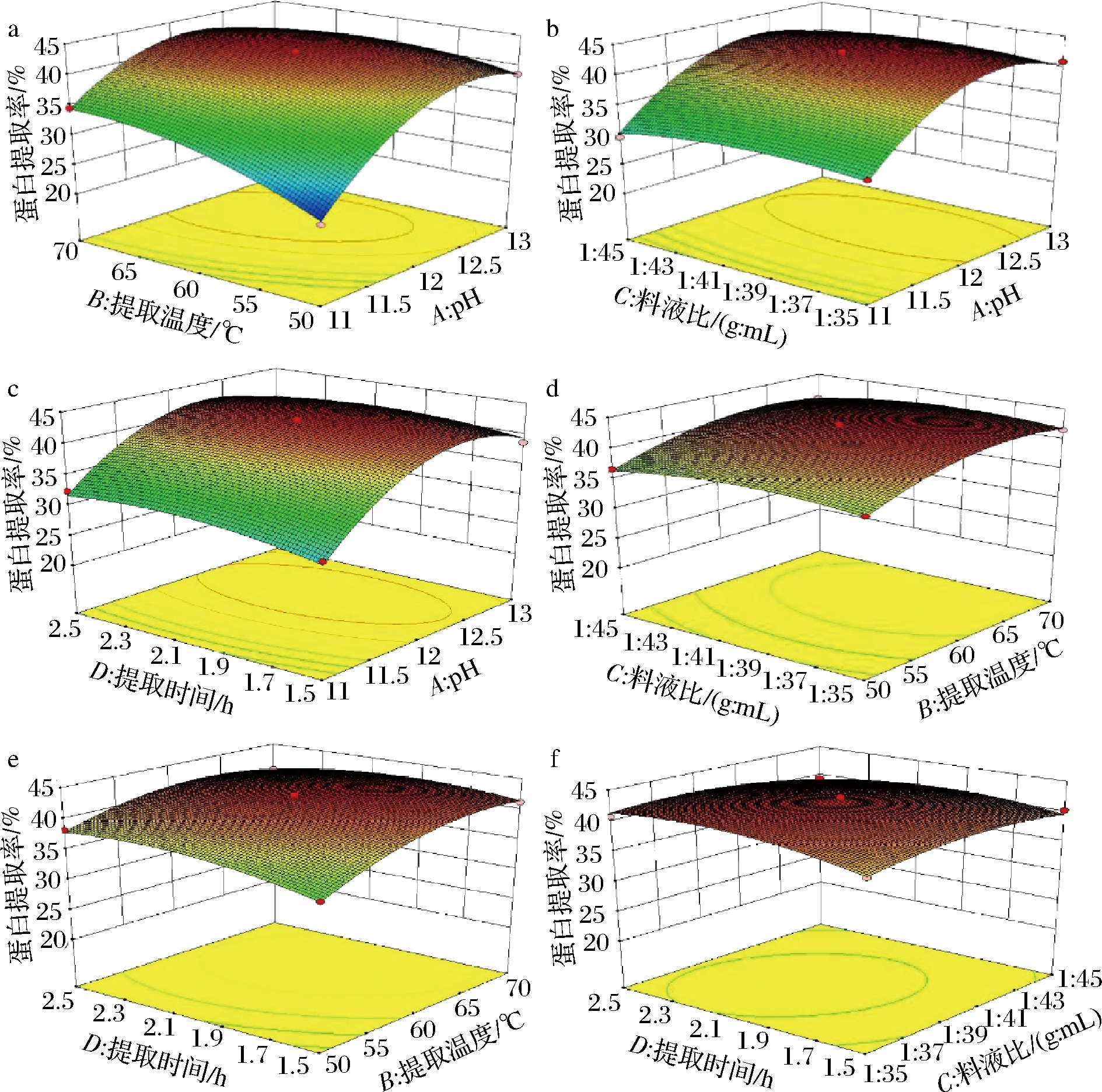
图5 各因素两两交互作用对蛋白提取率的影响的
响应面图
Fig.5 Response surface of the influence of the interaction
of various factors on the protein extraction rate
三维曲面图是对各因素影响蛋白提取率大小最直观的展示,曲面越陡峭,说明因素对响应值的影响越大;曲面越平缓,说明因素对响应值的影响越小[16]。综合观察图5,可看出图5-a、5-b、5-c三图中曲面较为陡峭,说明pH与提取温度、料液比、提取时间的交互作用对蛋白提取率的影响较大,而且根据曲面的陡峭程度,可看出pH值对蛋白提取率的影响最大,其次为提取温度,提取时间与料液比两者相差不大且影响较小,与方差分析结果一致;图5-d、5-e、5-f三图曲面平缓,说明提取温度与料液比、提取温度与提取时间及料液比与提取时间的交互作用对蛋白提取率的影响较小。
2.2.4 最佳工艺验证试验
运用Design-Expert8.0.6软件,分析响应面试验结果,得到蛋白提取的最佳工艺参数为pH 12.15,提取温度61.5 ℃,料液比1∶39.5 (g∶mL),提取时间2.08 h,预测蛋白提取率为43.51%。在实际操作过程中,将最佳工艺参数控制为pH 12.1,提取温度61 ℃,料液比1∶40 (g∶mL),提取时间2 h,重复3次验证试验,得到的蛋白提取率为(43.19±0.22)%,与模型预测值的相对偏差仅为0.74%,说明该模型能够较好地预测白玉菇蛋白提取率。
如图6所示,当pH为4.2时,上清液吸光值最低,说明此时蛋白沉淀最多,这是因为当蛋白质溶液pH处于等电点时,蛋白质分子表面不带电荷呈电中性,分子间的斥力减弱,容易受静电引力影响聚集而产生沉淀[17],所以pH 4.2为白玉菇蛋白的等电点。
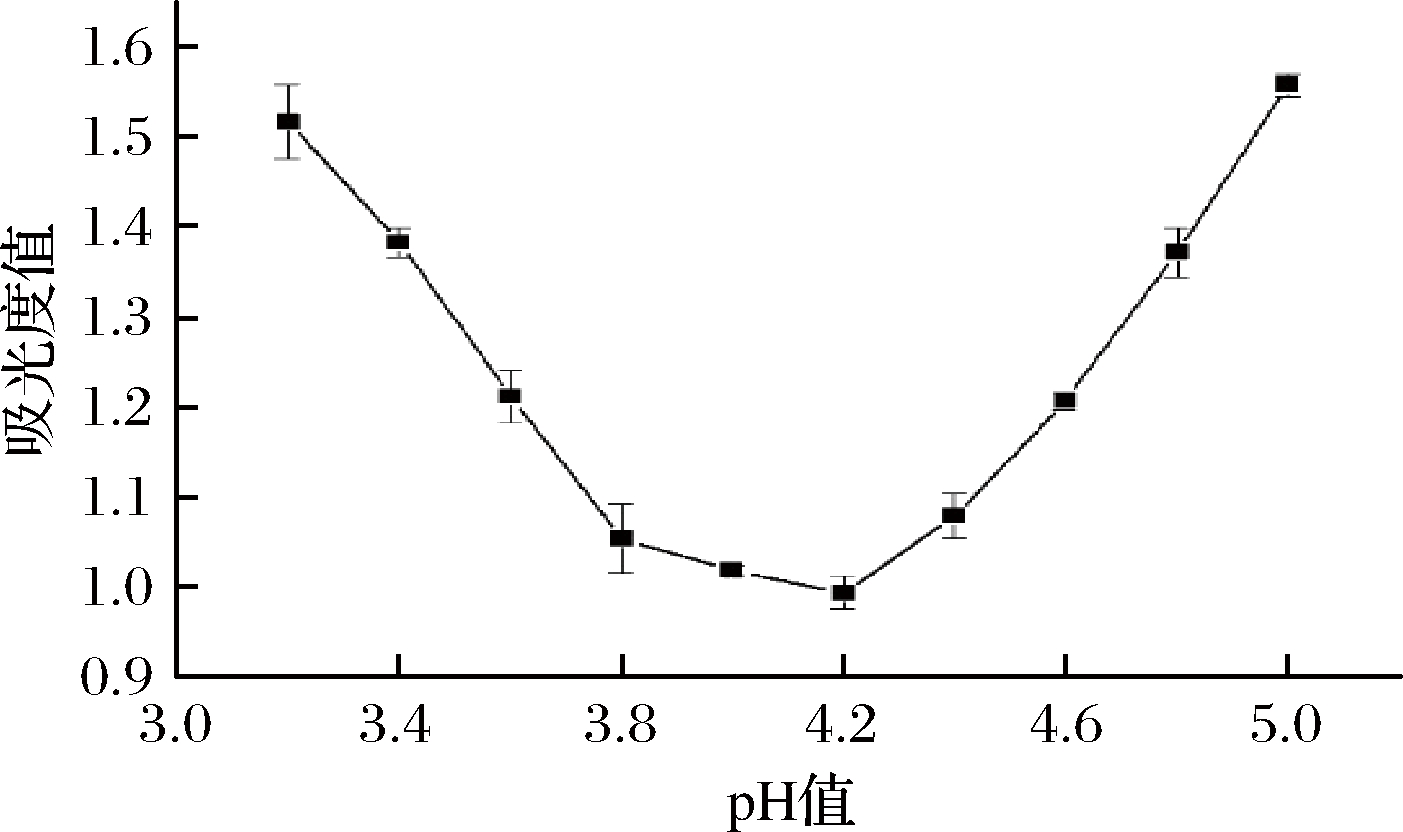
图6 白玉菇蛋白等电点
Fig.6 White Hypsizygus marmoreu protein isoelectric point
2.4.1 pH对白玉菇蛋白溶解性的影响
蛋白溶解度是指蛋白溶解于水溶液或盐溶液的能力,是蛋白能够在食品加工业应用的一个重要因素,利用蛋白的溶解性,可以提高饮料的口感、风味和营养价值[18]。如图7所示,随着pH逐渐增大,蛋白的溶解度呈先降低后升高的趋势,当pH为4接近pI时,此时蛋白的溶解度最小,仅为4.38%;当pH偏离pI后,蛋白溶解度增大,这可能是因为偏离pI后,溶液中分子间作用力增强,凝聚力减小,有利于溶解;pH接近pI时,蛋白质分子容易受静电作用力影响聚集产生沉淀,溶解度减小。

图7 pH对白玉菇蛋白溶解性的影响
Fig.7 Effect of pH on protein solubility of white
Hypsizygus marmoreu protein
2.4.2 pH对白玉菇蛋白乳化性及乳化稳定性的影响
蛋白质可作为一种表面活性剂,降低水的表面能,使油和水互溶形成乳化液,这是蛋白质的乳化性;乳化稳定性指的是乳化液保持稳定且不出现明显的两项分层的能力[19]。
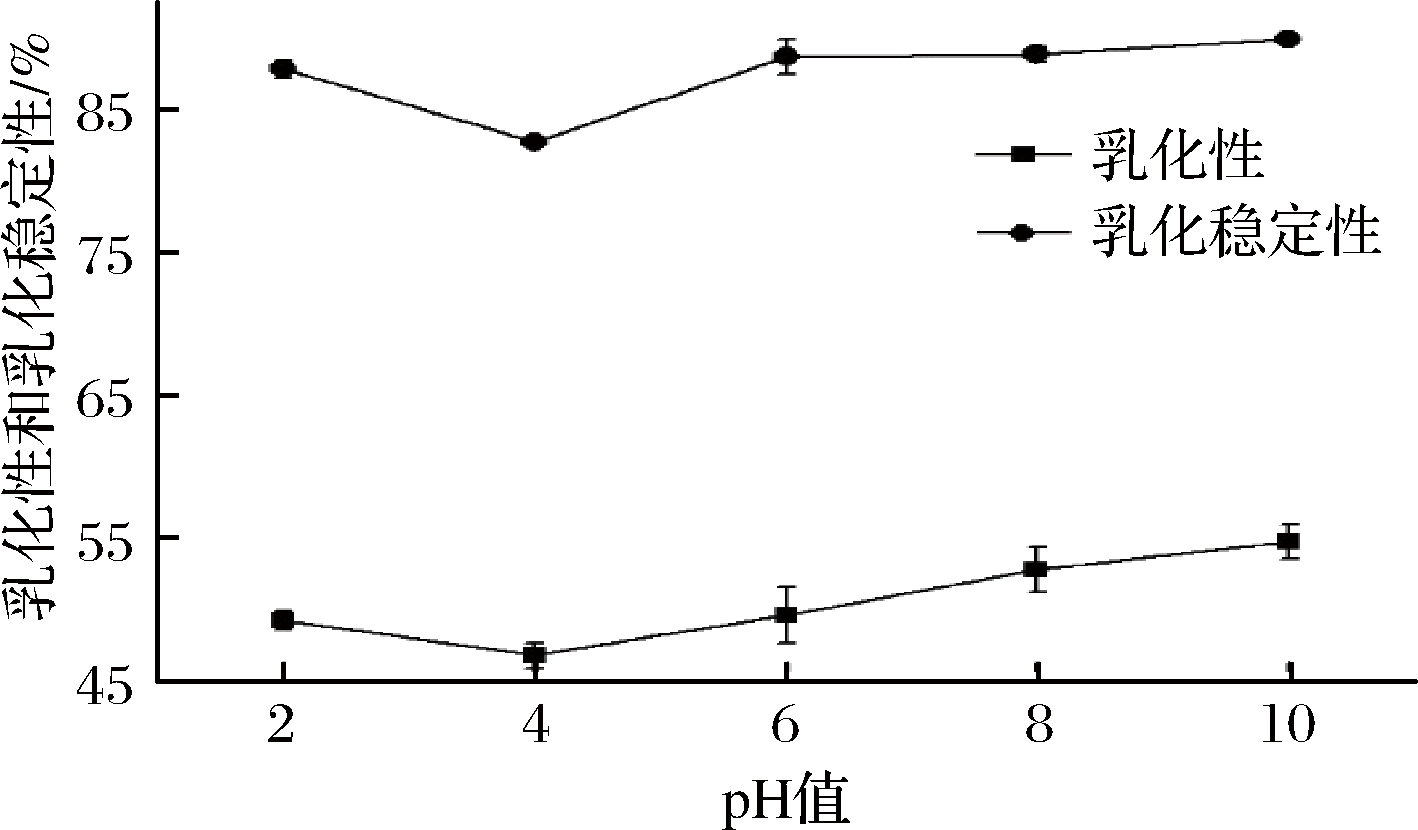
图8 pH对白玉菇蛋白乳化性及乳化稳定性的影响
Fig.8 Effect of pH on emulsifying and emulsifying stability
of white Hypsizygus marmoreu protein
如图8所示,随着pH逐渐增大,蛋白的乳化性和乳化稳定性都呈先减小后增大的趋势,当pH为4接近pI时,此时蛋白的乳化性最小,仅为46.77%,乳化稳定性也最小,为82.76%;但当pH偏离pI后,蛋白质的乳化性和乳化稳定性都有所增加,其中乳化性在碱性环境下表现更好,而乳化稳定性差别不大。这可能是pH接近等电点时,蛋白质分子间静电作用力减弱,分子表面无法形成水化层且容易聚集产生沉淀,使其乳化性和乳化稳定性均减弱;当pH偏离pI,蛋白溶解度增大,分子间作用力增加,使其乳化能力增强,且在pH显碱性时,蛋白质分子与水分子的结合能力增强,蛋白的乳化性更高。
2.4.3 pH对白玉菇蛋白起泡性及泡沫稳定性的影响
蛋白质降低了水的表面张力,推动了空气与水结合形成气泡,这就是蛋白的起泡性;泡沫稳定性是指保持泡沫稳定使得气-液间液膜中液体不被析出的能力[20]。蛋白质的起泡性常用于蛋糕、冰激凌等食品的加工中,较好的起泡能力赋于食品良好的口感和蓬松的结构[21]。
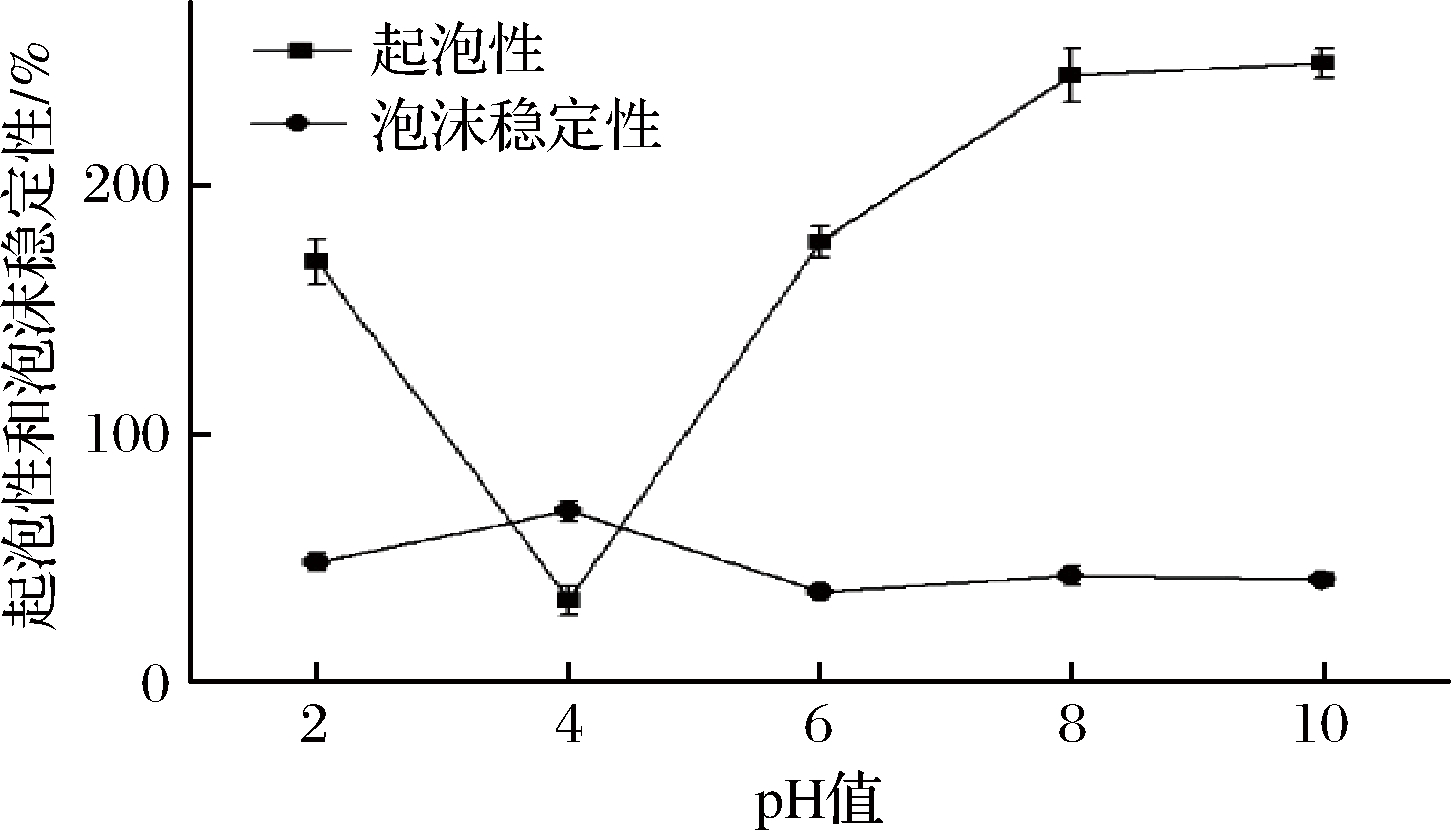
图9 pH对白玉菇蛋白起泡性及泡沫稳定性的影响
Fig.9 Effect of pH on foaming and foam stability of white
Hypsizygus marmoreu protein
如图9所示,随着pH逐渐增大,蛋白的起泡性呈先减小后增大的趋势,而蛋白的泡沫稳定性却相反,呈先增大后较小的趋势。当pH为4接近pI时,蛋白的起泡性最小,为33%,而此时泡沫的稳定性最高,为69.23%;当pH偏离pI时,蛋白的起泡性都有所增大,且在碱性时起泡性更高,而偏离pI后蛋白的泡沫稳定性都有所减弱。这可能是因为当pH接近pI时,蛋白质溶出较多,参与水溶液形成气泡的蛋白质较少,所以起泡性较弱,且在搅打过程中沉淀的蛋白质颗粒通过静电作用与泡沫结合,增加了泡沫的厚度,从而增加了泡沫的稳定性。
2.4.4 白玉菇蛋白的持水性和持油性
蛋白的持水性是指蛋白与水相结合的能力,与食品加工完成后的储藏有关,好的持水性有利于产品外形的稳定[21]。蛋白的持油性是指蛋白吸附油脂的能力,常用于肉制品的生产加工中,蛋白吸附油脂能够防止产品渗油,保持产品良好的口感[22]。经过试验测定,白玉菇蛋白的持水力为4.10 g/g,持油力为4.38 g/g。
由于制样过程采用酸水解,所以白玉菇蛋白中色氨酸未能检测,其余氨基酸测定结果见表4。
表4 白玉菇蛋白的氨基酸组成及含量
Table 4 Amino acid content of white Hypsizygus
marmoreu protein
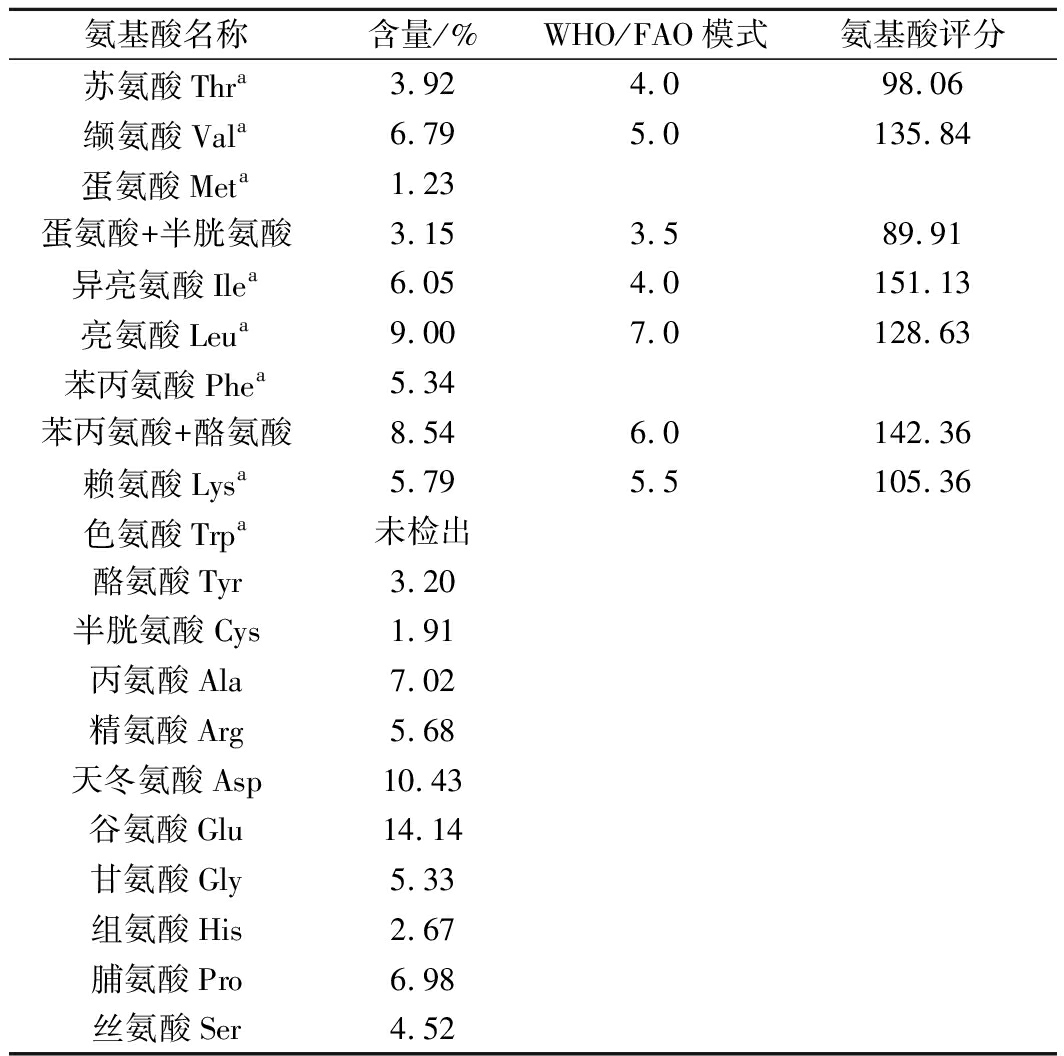
氨基酸名称含量/%WHO/FAO模式氨基酸评分苏氨酸Thra3.924.098.06缬氨酸Vala6.795.0135.84蛋氨酸Meta1.23蛋氨酸+半胱氨酸3.153.589.91异亮氨酸Ilea6.054.0151.13亮氨酸Leua9.007.0128.63苯丙氨酸Phea5.34苯丙氨酸+酪氨酸8.546.0142.36赖氨酸Lysa5.795.5105.36色氨酸Trpa未检出酪氨酸Tyr3.20半胱氨酸Cys1.91丙氨酸Ala7.02精氨酸Arg5.68天冬氨酸Asp10.43谷氨酸Glu14.14甘氨酸Gly5.33组氨酸His2.67脯氨酸Pro6.98丝氨酸Ser4.52
注:a,必需氨基酸;氨基酸评分(AAS)=[样品蛋白质氨基酸含量(%)∕WHO/FAO标准模式相应氨基酸含量(%)]×100
由表4可知,白玉菇蛋白氨基酸种类齐全,富含17种氨基酸,其中含量最高的两种氨基酸为谷氨酸和天冬氨酸,分别为14.14%和10.43%,2种氨基酸都属于鲜味氨基酸[23],这与白玉菇鲜美的风味相符合。白玉菇蛋白中必需氨基酸占氨基酸总量的38.12%,接近FAO/WHO提出的理想蛋白质必需氨基酸/总氨基酸应达40%的要求[24],说明白玉菇蛋白较为优质。从氨基酸评分看,蛋氨酸为白玉菇蛋白的第一限制性氨基酸,与王耀松等[4]测定结果一致,食品生产中可通过与其他蛋白质搭配使用,以达到互补效果。综合分析,白玉菇蛋白是一种优良的植物蛋白源,而且丰富的鲜味氨基酸使其具有开发复合调味料的潜力。
本实验采用碱法提取白玉菇蛋白,并通过响应面优化得到白玉菇蛋白最适提取工艺,同时研究了不同pH值对白玉菇蛋白功能特性的影响,得出以下结论:
(1)碱提法中各因素影响白玉菇蛋白提取率的主次顺序为pH>提取温度>提取时间>料液比;白玉菇蛋白碱提的最佳提取工艺为pH 12.1,提取温度61 ℃,料液比1∶40 (g∶mL),提取时间2 h,此件下的白玉菇蛋白提取率为(43.19±0.22)%,与预测值接近,说明响应面法能够有效分析和预测白玉菇蛋白提取率。
(2)pH值对白玉菇蛋白的功能特性有显著影响,当溶液pH在白玉菇蛋白pI附近时,蛋白的溶解性、乳化性、乳化稳定性及起泡性均为最小,而此时白玉菇蛋白的泡沫稳定性最大,偏离等电点后除泡沫稳定性有所下降外,其余各项指标都有所回升。
(3)白玉菇蛋白氨基酸种类齐全,鲜味氨基酸含量丰富,必需氨基酸占氨基酸总量的38.12%,是一种优质蛋白,蛋氨酸为其第一限制性氨基酸。
[1] HAWKSWORTH D L, KIRK P M, SUTTON B C, et al. Ainsworth & Bisby's dictionary of the fungi[J]. Revista Do Instituto De Medicina Tropical De São Paulo, 1996, 38(4):17-19.
[2] 陈成弟. 白玉菇优质高产栽培技术[J]. 北京农业, 2002(8):22.
[3] 郭永月, 陶明煊, 赵云霞,等. 白玉菇多糖提取方法的比较和优化[J]. 南京师范大学学报(自然科学版), 2013, 36(3):87-92.
[4] 王耀松, 邢增涛, 白冰,等. 白玉蕈营养成分的测定[J]. 西北农业学报, 2006, 15(5):222-224.
[5] 刘成梅, 王芳, 钟俊桢,等. 腰果蛋白的功能特性研究及其氨基酸组成分析[J]. 食品工业科技, 2016, 37(2):88-92.
[6] 霍宗庆, 徐婉晴, 刘言娟. 响应面法优化白玉菇多糖的提取工艺[J]. 食品工业科技, 2017, 38(22):145-149.
[7] 张璐. 香菇柄多肽的制备及其抗氧化活性研究[D]. 扬州:扬州大学, 2017.
[8] 刘静, 李湘利, 魏海香,等. 鸡枞菌粗蛋白超声辅助提取工艺优化及其抗氧化活性[J]. 食品工业科技, 2019,40(10):221-226.
[9] LIU X P, GOLDRING C E P, WANG H Y, et al. Extract of Ginkgo biloba induces glutathione-S-transferase subunit-P1 in vitro[J]. Phytomedicine, 2009, 16(5):451-455.
[10] 孙小斐, 乔玉辉. 白果蛋白的提取分离及其等电点的测定[J]. 食品工业, 2012,33(9):156-158.
[11] LEE S Y, MORR C V, HA E Y W. Structural and functional properties of caseinate and whey protein isolate as affected by temperature and pH[J]. Journal of Food Science, 1992, 57(5):1 210-1 229.
[12] 薛蕾, 李大文, 尉芹,等. 苦杏仁蛋白的功能特性[J]. 食品科学, 2013, 34(7):70-75.
[13] 张思思. 扁桃仁蛋白特性及多肽的功能活性研究[D]. 晋中:山西农业大学, 2014.
[14] 杨希娟, 党斌, 吴昆仑,等. 青稞蛋白的超声波辅助提取工艺及其功能特性研究[J]. 中国食品学报, 2013, 13(6):48-56.
[15] 张维农, 刘大川, 胡小泓. 花生蛋白产品功能特性的研究[J]. 中国油脂, 2002,27(5):60-65.
[16] 郭宏垚, 李冬, 雷雄,等. 花椒多酚提取工艺响应面优化及动力学分析[J]. 食品科学, 2018, 39(2):247-283.
[17] 施树. 两种胡麻饼粕提取蛋白质等电点测定[J]. 粮食与油脂, 2007, 136(8):25-26.
[18] 董贝森, 于跃芹. 花生蛋白粉溶液流变学特性及功能性的研究[J]. 农业工程学报, 1999, 15(1):251-252.
[19] 王金水, 张长付, 郭录峰,等. 绿豆分离蛋白功能特性研究[J]. 中国粮油学报, 1998, 13(2):36-39.
[20] 徐红华, 谭俊艳, 谢明明,等. 纤维诱导对乳清浓缩蛋白起泡性的改善作用分析[J]. 农业机械学报, 2018,.49(8):360-366.
[21] 曾志红, 王强, 林伟静,等. 绿豆蛋白营养及功能特性分析[J]. 中国粮油学报, 2012, 27(6):51-55.
[22] 范雪层, 邓红, 李招娣,等. 文冠果蛋白的功能特性及其氨基酸组成分析[J]. 中国油脂, 2009, 34(6):26-30.
[23] 沈雨佳, 陆利霞, 林丽军, 等. 酶解鲫鱼肉制取呈味氨基酸研究[J]. 中国调味品, 2015, 40(1):27-31.
[24] 朱淑云, 董英, 陈晓东,等. 水飞蓟粕蛋白氨基酸组成及加工功能特性研究[J]. 中国粮油学报, 2011, 26(8):71-74;83.