
食品添加剂已成为现代食品工业的重要组成部分,是食品工业技术进步和科技创新的重要推动力。山梨酸(sorbic acid)和苯甲酸(benzoic acid)均为食品添加剂,是目前食品业应用最为广泛的防腐剂。在食品生产、加工及储藏过程中,为了防止微生物的生长、繁殖,延长食品的保质期,常加入山梨酸或苯甲酸或二者的混合物。而其中的山梨酸是国际公认的具有低毒及高效抗菌性能的防腐剂,其抑菌效果优于苯甲酸,毒性只有苯甲酸的1/4,目前,山梨酸是食品业发展潜力相对较好的一种防腐剂。尽管如此,当过量摄入山梨酸时也会引起某些较严重的副作用(如对皮肤、黏膜的刺激性和接触性皮炎等),给人们的健康造成一定危害,为此,世界各国对食品中山梨酸的含量均做出了严格限定,我国食品安全标准GB2760 规定饮料中山梨酸的最大使用量为0.5 g/kg,糕点中山梨酸的最大使用量为1.0 g/kg。鉴于此,研究食品中山梨酸含量的检测方法有着重要意义。近年,国内外对山梨酸的检测方法主要有:高效液相色谱法[1-5], 气相色谱法[6-7],气-质联用法[8-11]、液-质联用法[12-17]、电化学法[18-19] 和紫外-可见分光光度法[20-23]等。前4 种方法有高的准确度,但分析成本较高,前处理工作也较繁杂;电化学法条件要求较为苛刻;紫外-可见分光光度法简便、快速,长期以来深受分析工作者的喜爱,但他的灵敏度通常不高,选择性欠佳,尤其是用于食品分析时,更需考虑选择性这一重要条件。在食品生产中,为了延长保质期,可能不止添加一种防腐剂,苯甲酸和山梨酸是最常用的2种防腐剂,可能共存于某食品中(苯甲酸可能干扰山梨酸的测定),这样一来,要想单独测定某一物质,就得采用分离、掩蔽等其他措施,使操作复杂化。本工作通过试验找到了一种不需分离苯甲酸即可直接测定山梨酸的方法,目前尚未见文献报道。本方法以三苯甲烷染料碱性紫作探针,在紫外光区及一定酸性条件下,采用单波长、双波长或三波长紫外吸收光谱法来研究食品中山梨酸的检测方法,实验表明,在某一酸度和某一波长下,共存的苯甲酸不会干扰山梨酸的测定,从而实现不用分离苯甲酸就可直接测定山梨酸的目的。本方法有较高的灵敏度,是文献[23] 的1.7~7.6 倍,且简便、快速,适于饮料及糕点中山梨酸的定量分析。
碱性紫(basic violet,BSV,99%),上海如吉生物科技发展有限公司;三羟甲基氨基甲烷(Tris):99.9%,上海吉至生化科技有限公司;HCl(AR级),重庆川东(化工)集团有限公司;山梨酸(SBA,99.8%),上海迈瑞尔化学技术有限公司;苯甲酸(BZA,≥99%),成都化夏化学试剂有限公司;水,超纯水;糕点(蛋糕1#、2#),饮料(葡萄汁3#、尖叫4#、可口可乐5#、营养快线6#),市售。
碱性紫溶液:1.00×10-3 mol/L 水溶液;山梨酸标准溶液:准确称取适量山梨酸(精确至±0.000 1 g)于小烧杯中,加少许无水乙醇,搅拌,使其溶解,再用水定容,贮备液为1.00×10-3 mol/L,操作液为1.00×10-4 mol/L。苯甲酸标准溶液:准确称取适量苯甲酸(精确至±0.000 1 g)于小烧杯中,加少许无水乙醇,待其溶解后,用水定容,配成贮备液为1.00×10-3 mol/L,操作液为1.00×10-4 mol/L;三羟甲基氨基甲烷溶液:0.20 mol/L 水溶液;HCl溶液:0.10 mol/L 水溶液;Tris-HCl 溶液:pH 3.0~9.2(用pH 计测定HCl 和Tris 的混合液)。
EL104型电子天平,上海精密仪器仪表有限公司;pHS-3C 精密酸度计,上海虹益仪器仪表有限公司;KQ-200VDE 超声波清洗机,昆山市超声仪器有限公司;TD5A-WS型离心机,湖南湘仪离心机仪器有限公司;U-3010型紫外-可见分光光度计,日本日立公司。
1.3.1 糕点
准确称取粉碎、混匀后的1# 和2# 样品各25~30 g(精确至±0.000 1 g),加适量水,搅拌,40 ℃ 水浴超声提取20~30 min,于4 000 r/min 离心分离5~10 min,清液用水定容至100 mL,摇匀,待用。
1.3.2 非乳饮料
准确移取3#~5# 饮料样品各10 mL,于40 ℃水浴超声20~30 min,取出冷至室温后用水定容至100 mL,摇匀,待用。
1.3.3 乳饮料
准确移取6# 样品10.00 mL于小烧杯中,加20 mL 无水乙醇(沉淀蛋白质),搅拌5 min,超声提取20~30 min,4 500 r/min 离心分离5~10 min,清液移入100 mL 容量瓶中,用水定容,待用。
于10 mL 比色管中,准确依次加入一定量的山梨酸标准操作液、1.00 mL pH 3.25 Tris-HCl 溶液及1.50 mL 碱性紫溶液,用水稀至刻度,摇匀,15 min 后,在紫外-可见分光光度计上,扫描吸收光谱(以试剂空白作参比),分别在紫外区测定254 nm、305 nm 及223 nm 处的吸光度A。
图1是山梨酸-碱性紫体系与可能共存的苯甲酸-碱性紫体系的紫外吸收光谱图,表1 是两体系的吸收光谱特征比较。由图1可知,碱性紫溶液在紫外光区吸收信号较弱(在可见光区有很强的吸收信号),他们的吸收峰分别位于594 nm、306 nm 及223 nm,如曲线1所示。山梨酸溶液自身和苯甲酸溶液自身在可见光区几乎无吸收,在紫外光区有较强吸收,最大吸收峰分别位于的256 nm 和226 nm,如曲线2和曲线3 所示。当在山梨酸的酸性溶液(pH 3.25 Tris-HCl 溶液)中加入一定浓度的碱性紫溶液后,在可见光区出现2个吸收强度不大的吸收峰(峰位见表1),在紫外光区则出现3个具有较强吸光度的吸收峰,分别位于254 nm(紫移340 nm)、305 nm(紫移289 nm)和223 nm(紫移371 nm),曲线5~10所示,且在这3个峰处,随着山梨酸浓度的增大,吸光强度逐渐增强,山梨酸在一定浓度范围内,其浓度与体系的吸光强度A呈线性关系,并服从朗伯-比尔定律。而可能与山梨酸-碱性紫体系共存的苯甲酸-碱性紫体系在同条件下的紫外光区的吸收光谱见曲线4,可知,在山梨酸-碱性紫体系的3个特征吸收峰(254 nm、305 nm 和223 nm)处,苯甲酸-碱性紫体系的吸收强度很弱,借此可以直接测定山梨酸,共存的苯甲酸不干扰。两体系的其他吸收特征见表1。
由上可知,在紫外光区及pH 3.25 Tris-HCl 介质存在下,山梨酸-碱性紫体系在紫外光区的254 nm、305 nm 及223 nm处,有较强的吸光强度,并遵从朗伯-比尔定律,而同条件下的苯甲酸-碱性紫体系在紫外光区的254 nm、305 nm 及223 nm处的吸收很弱。故在这3 个波长处,可以不经分离,直接定量检测与苯甲酸共存的山梨酸。

1-2.00×10-5 mol/L 碱性紫, 水作参比; 2-1.00×10-5 mol/L
苯甲酸, 水作参比; 3-1.00×10-5 mol/L 山梨酸, 水作参比;
4-1.00×10-5 mol/L 苯甲酸-1.50×10-4 mol/L 碱性紫,试剂空白作参比;
5~10-(0.20、0.40、0.60、0.80、1.00、1.20)×10-5 mol/L
山梨酸-1.50×10-4mol/L碱性紫,试剂空白作参比;pH3.25
图1 山梨酸-碱性紫体系及苯甲酸-碱性紫体系的吸收光谱
Fig.1 Absorption spectra of sorbic acid-basic violet
systems and benzoic acid-basic violet systems
表1 山梨酸-碱性紫体系与苯甲酸-碱性紫体系吸收光谱特征
Table 1 Absorption spectrum characteristics of sorbic
acid- basic violet system and benzoic acid- basic
violet system

物质A254A305A223λAbλF山梨酸———256 (A=0.257)—苯甲酸———226 (A=0.197)—山梨酸-乙基紫(pH 3.25)0.4490.1900.254495,633—苯甲酸+乙基紫(pH 3.25)-0.011 0-0.022 70.047230,610316,495,632
注:—表示无
若要提高方法的灵敏度,可在254 nm、305 nm 及223 nm处,采用双波长或三波长吸收光谱法来定量检测有苯甲酸共存时的山梨酸(依据吸光度的加和性),其灵敏度可提高到1.5~4.4 倍。
2.2.1 溶液酸度及用量的选择
室温下,以254 nm为例,考察了山梨酸-碱性紫体系及可能与之共存的苯甲酸-碱性紫体系在同条件下,不同pH值的Tris-HCl 溶液在254 nm处对不同体系缔合物吸光度A 的影响,见图2。由图2可知,山梨酸-碱性紫体系在pH 3.25 Tris-HCl 条件下,有相对较强的吸光度,此时灵敏度也相对较大。而苯甲酸-碱性紫体系在254 nm处,当pH在3.5~9.2时,酸度对体系负吸光度有较大影响,只有当pH<3.5时,体系基本不受酸度的影响(缔合物的吸收强度十分微弱),故在pH<3.5的条件下测定山梨酸,共存的苯甲酸不会干扰测定。由此说明,严格控制溶液的酸度(pH <3.5),即可实现不分离苯甲酸而直接定量检测山梨酸的目的。
随即又考察了254 nm 处,pH 3.25 Tris-HCl 溶液用量0.50、1.00、1.50、2.00、2.50、3.00 mL时对山梨酸-碱性紫体系吸光度的影响,结果表明,用量为1.00 mL 时,体系有相对较大的吸光度,灵敏度也相对较高。故后续实验用pH 3.25 Tris-HCl 溶液1.00 mL。
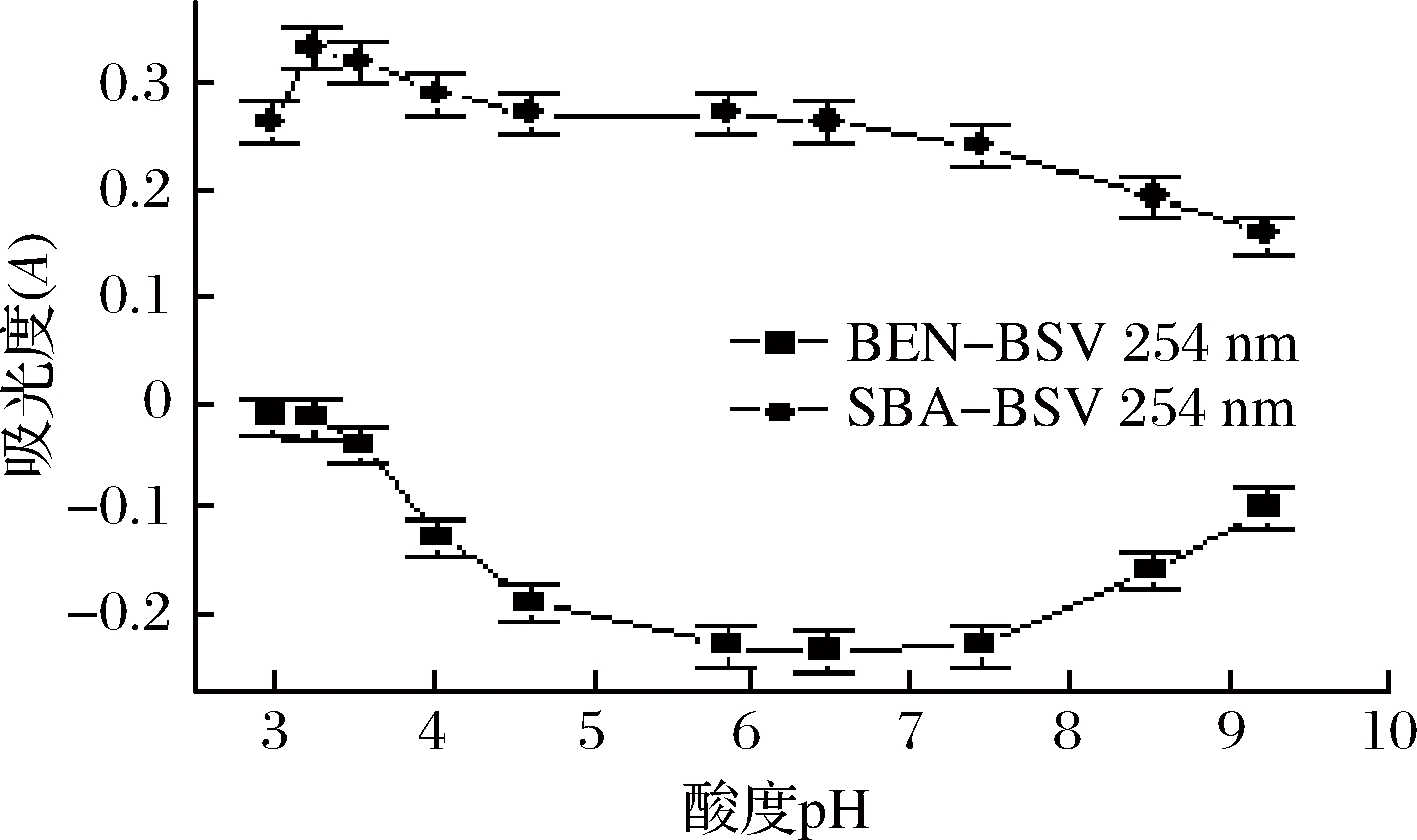
图2 Tris-HCl溶液 pH 对缔合物A的影响
Fig.2 Effect of Tris-HCl solution pH on association A
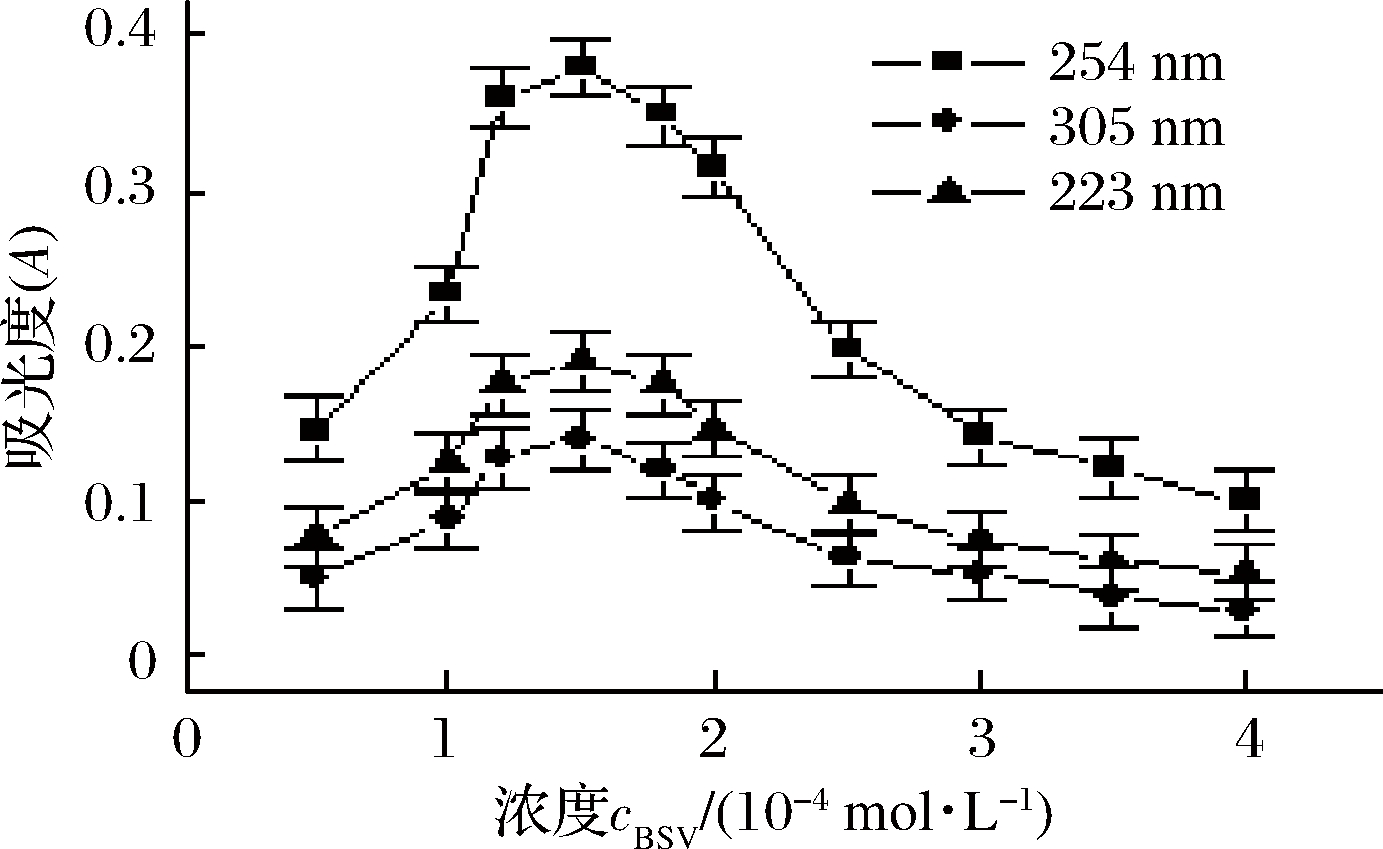
图3 BSV溶液浓度对缔合物A的影响
Fig.3 Effect of BSV solution concentration on association A
2.2.2 碱性紫溶液浓度的选择
室温下,考察了254 nm、305 nm 及223 nm 处碱性紫溶液用量为0.50、1.00、1.50、2.00、2.50、3.00、3.50、4.00 mL 时对山梨酸-碱性紫体系生成的缔合物吸光度A 的影响,见图3。可知,在这三波长处,碱性紫溶液用量为1.50 mL 时,吸光度相对较大,即碱性紫溶液浓度为1.50×10-4 mol/L 时,体系有相对较高的灵敏度。当碱性紫溶液用量大于1.50 mL 时,因用量过大而使自身聚集作用增强,从而导致吸光强度降低;当碱性紫溶液用量小于1.50 mL 时,因用量不够,使山梨酸反应不完全,致使吸光度有所降低。故后续实验用1.50 mL 碱性紫溶液。由图3 还可看出,以254 nm 作为单波长法的测定波长时,灵敏度相对最高,其次是223 nm。若采用双波长(254 nm+305 nm 或254 nm+223 nm)法或三波长(254 nm+305 nm+223 nm)法测定,灵敏度均较单波长法高(见表2)。
2.2.3 试剂加入顺序的选择
室温下,以双波长(254 nm+305 nm)法为例,考察1.00 mL 山梨酸标准操作液、1.50 mL 碱性紫溶液及1.00 mL pH 3.25 Tris-HCl溶液在不同加入顺序时对山梨酸-碱性紫体系缔合物吸光度A 的影响,结果表明,这几种物质的先后加入顺序对体系灵敏度有一定影响。实验表明,灵敏度相对较高时的加入顺序为:山梨酸溶液、Tris-HCl溶液、碱性紫溶液。后续实验按物质的最佳加入顺序进行。
2.2.4 反应速度及缔合物的稳定性
室温下,考察了254 nm、305 nm 及223 nm 处,山梨酸与碱性紫溶液的反应时间对体系缔合物A 的影响。实验显示,在这3 个波长处,反应在15 min 内均可进行完全,15 min 时,吸光度达最大,之后至80 min 内,吸光度基本不变,80 min 后,吸光度逐渐下降。这些现象表明,缔合物的稳定时间约为1 h。后续实验选在缔合物的稳定时间内进行。
准确移取山梨酸标准操作液0.00、0.20、0.40、0.60、0.80、1.00、1.20 mL 于10 mL比色管中,再加入前述选定条件的其他试剂溶液,配制山梨酸的标准系列溶液,扫描吸收光谱,在254 nm、305 nm及223 nm处,作单波长法、双波长法及三波长法测定时的各标准曲线,见图4。方法的灵敏度及其他相关参数见表2。从表可知,用单波长法、双波长法及三波长法测定的灵敏度顺序为:三波长法>双波长法>单波长法。

图4 山梨酸的标准曲线
Fig.4 Standard curve of sorbic acid
室温下,以双波长(254 nm+305 nm)法为例,考察相对误差 ≤ ±5% 时,某些常见共存物质对测定山梨酸(1.12 mg/L)的干扰情况。实验显示,100 倍的L-丙氨酸、L-赖氨酸、L-组氨酸、L-色氨酸、L-亮氨酸、L-白氨酸、乳糖、葡萄糖、蔗糖、麦芽糖、苯甲酸钠![]() 倍的烟酸、甘氨酸、果糖、柠檬酸三钠
倍的烟酸、甘氨酸、果糖、柠檬酸三钠![]() 倍的淀粉、尿素;5 倍的Al3+、Fe3+、Zn2+等不干扰测定。故方法的选择性良好。
倍的淀粉、尿素;5 倍的Al3+、Fe3+、Zn2+等不干扰测定。故方法的选择性良好。
表2 山梨酸标准曲线相关参数
Table 2 Related parameters of standard curves of sorbic acid
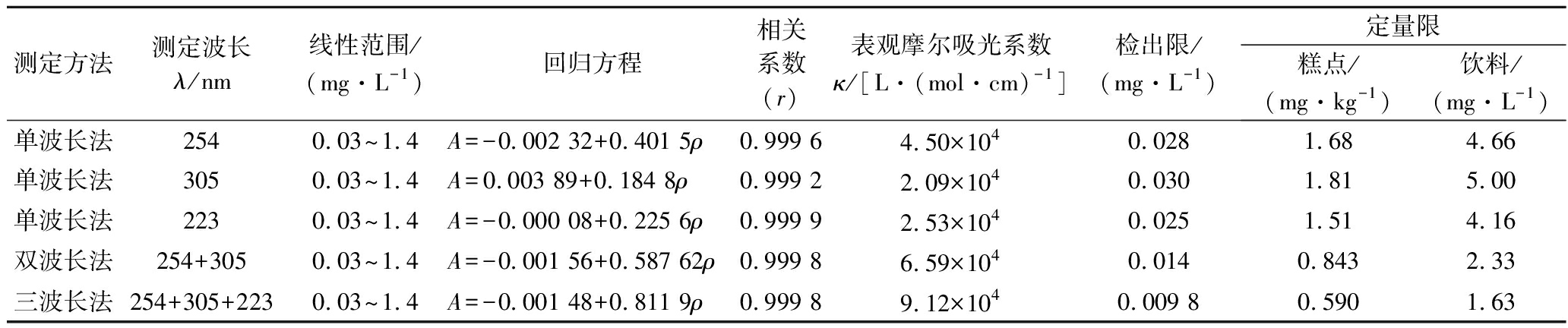
测定方法测定波长λ/nm线性范围/(mg·L-1)回归方程相关系数(r)表观摩尔吸光系数κ/[L·(mol·cm)-1]检出限/(mg·L-1)定量限糕点/(mg·kg-1)饮料/(mg·L-1)单波长法2540.03~1.4A=-0.002 32+0.401 5ρ0.999 64.50×1040.0281.684.66单波长法3050.03~1.4A=0.003 89+0.184 8ρ0.999 22.09×1040.0301.815.00单波长法2230.03~1.4A=-0.000 08+0.225 6ρ0.999 92.53×1040.0251.514.16双波长法254+3050.03~1.4A=-0.001 56+0.587 62ρ0.999 86.59×1040.0140.8432.33三波长法254+305+2230.03~1.4A=-0.001 48+0.811 9ρ0.999 89.12×1040.009 80.5901.63
取1#~6# 待测液各2.00 mL,按实验方法配制溶液后,以双波长(254 nm+305 nm)法为例测定各样液及原始样品中山梨酸的含量。
加标回收试验:准确称取已粉碎、混匀的1#和2#样品各25~30 g(精准至±0.000 1 g),各称取3份,分别加入5.00、10.00、20.00 mL 山梨酸标准操作液,后续操作同1.3.1项中样品的处理方法(3 种加标水平各平行处理5份),最后用水定容至100 mL,待测。另准确移取3#、4# 和5# 饮料样各10.00 mL(各3份),分别加入5.00、15.00、30.00 mL 山梨酸标准操作液,后续操作同1.3.2 项中样品的处理方法(3 种加标水平各平行处理5 份),最后用水定容至100 mL,待测。另准确移取6# 样品10.00 mL 3 份,分别加入5.00、15.00、30.00 mL 山梨酸标准操作液,后续操作同1.3.3 项中样品的处理方法(3 种加标水平各平行处理5 份),最后用水定容至100 mL,待测。取各定容液适量,以双波长(254 nm+305 nm)法为例,按实验方法测其含量,并计算回收率。
样品测定结果及回收试验见表3。
表3 饮料及糕点中山梨酸的分析结果及回收试验
Table 3 Analysis results and recovery test of sorbic acid in beverages and pastries

样品样品测得值(DWO(254 nm+305 nm)-UV法)本底值/(10-3mg)加标量/(10-3mg)测得平均值/(10-3mg)平均回收率/%相对标准偏差/%1.123.7099.12.31#4.68 mg/kg2.592.244.8199.12.24.487.0298.92.21.123.1197.32.52#3.64 mg/kg2.022.244.2398.72.74.486.4398.42.41.124.41022.53# 16.3 mg/L3.263.366.671012.66.7210.11022.31.125.8598.22.74#47.5 mg/L4.753.368.0698.52.56.7211.498.92.21.121.1798.22.65#ND<0.143.363.3998.82.56.726.6497.82.31.121.211022.46#ND<0.143.363.481012.66.726.911022.2
注:ND 为未检出;样品含量<检出限的按检出限的1/2 计算回收率
山梨酸-碱性紫体系的单波长法、双波长法及三波长法均可在苯甲酸共存的条件下定量检测山梨酸,方法有较高的灵敏度、准确度及精密度,且简便、快速,样品处理简单。该体系适于市售饮料及糕点中山梨酸的快速定量测定。
[1] 刘书来,郭元帅,许凯希,等.高效液相色谱法测定秘鲁鱿鱼肌肉中的有机酸[J].食品与发酵工业,2015,41(10):135-139.
[2] IRINA T, DARIA K, KIRA S, et al. A simple and highly-available microextraction of benzoic and sorbic acids in beverages and soy sauce samples for high performance liquid chromatography with ultraviolet detection [J]. Journal of Chromatography A, 2019,1 588:1-7.
[3] MARION P C, BEATRIZ DA S F, BRUNO R C C L, et al. Simultaneous analysis of carbohydrates and organic acids by HPLC-DAD-RI for monitoring goat's milk yogurts fermentation [J]. Talanta,2016,152(1):162-170.
[4] ZHENG Huiwen, ZHANG Qiuyun, QUAN Junping, et al. Determination of sugars, organic acids, aroma components, and carotenoids in grapefruit pulps [J]. Food Chemistry,2016,205:112-121.
[5] 于淼,阮成江,李贺,等.HPLC法测定10 个引自北美蓝莓品种果实中的糖酸组分及含量[J].食品工业科技,2016,37(10):77-81.
[6] 张霞,刘志华,杨光宇,等.固相萃取富集/气相色谱法测定烟草中的9 种有机酸[J].分析测试学报,2014,33(5):545-550.
[7] TAHER A K, KHALIL F, ARAM A K. Optimized dispersive liquid-liquid microextraction and determination of sorbic acid and benzoic acid in beverage samples by gas chromatography [J]. Food Analytical Methods,2012,5 (3):351-358.
[8] SUN J, TAN L, CAO L, et al. Determination of 25 preservatives in cosmetics by gas chromatography-tandem mass spectrometry [J]. Chinese journal of chromatography, 2019,37(3):331-339.
[9] 王李平,汤逊尤,张志军,等.响应面优化-气相色谱质谱联用测定食品中山梨酸、苯甲酸和肉桂酸[J].分析试验室,2018,37(9):1 020-1 024.
[10] DING M Z, LIU W X, PENG J, et al. Simultaneous determination of seven preservatives in food by dispersive liquid-liquid microextraction coupled with gas chromatography-mass spectrometry [J]. Food Chemistry,2018,269:187-192.
[11] SAGANDYKOVA G N, ALIMZHANOVA M B, NURZHANOVA Y T, et al. Determination of semi-volatile additives in wines using SPME and GC-MS [J]. Food Chemistry,2017,220:162-167.
[12] 李艳美,李芳,粟有志,等.QuEChERS前处理结合高效液相色谱-串联质谱法同时测定酵母产品中4 种抗氧化剂和5 种防腐剂[J].食品与发酵工业,2019,45(12):215-221.
[13] 张勋,刘韬,吴连鹏,等.高效液相色谱-串联质谱法测定多种食品中7 种酚类抗氧化剂和对羟基苯甲酸酯类防腐剂[J].食品与发酵工业,2016,42(11):206-211.
[14] 马帅,王纪华,高媛,等.超高效液相色谱-串联质谱法同时测定5 个产地花椰菜和西兰花中的23 种酚酸类化合物[J].食品科学,2018,39(4):176-187.
[15] LUCIANO M, HEITOR D, LEANDRO A S P, et al. A multi-purpose tool for food inspection: Simultaneous determination of various classes of preservatives and biogenic amines in meat and fish products by LC-MS [J]. Talanta, 2018,178:1 053-1 066.
[16] HO J K, MI J L, HYE J P, et al. Simultaneous determination of synthetic food additives in kimchi by liquid chromatography-electrospray tandem mass spectrometry [J]. Food Science and Biotechnology, 2018,27(3):877-882.
[17] 黄思棋,刘晓雪,张华,等.LC-MS法测定果蔬中6种有机酸[J].食品科技,2016,41(1):275-279.
[18] JIRI Z, ZDENKA F, MIODRAG M, et al. Various instrumental approaches for determination of organic acids in wines [J]. Food Chemistry,2016,194(8):432-440.
[19] AUNG H P, PYELL U. In-capillary derivatization with o-phthalaldehyde in the presence of 3-mercaptopropionic acid for the simultaneous determination of monosodium glutamate, benzoic acid, and sorbic acid in food samples via capillary electrophoresis with ultraviolet detection [J]. Journal of Chromatography A, 2016, 1449:156-165.
[20] TOMOHARU F, TAKAHITO I, KOJI K, et al. Direct quantitation of the preservatives benzoic and sorbic acid in processed foods using derivative spectrophotometry combined with micro dialysis [J]. Food Chemistry, 2018,240:386-390.
[21] ABDOLHOSSEIN N, FARNAZ F, SAHELEH S, et al. Coupling of air-assisted liquid-liquid microextraction method with partial least squares for simultaneous spectrophotometric determination of some preservatives [J]. Journal of the Iranian Chemical Society, 2017,14(3):643-653.
[22] FRANCIELLY F S D J, ALINE G C, LAIS D A P, et al. Simple and fast method for simultaneous determination of propionate and sorbate in bread by capillary electrophoresis with UV spectrophotometric detection [J]. Journal of Food Composition and Analysis, 2018,72:93-96.
[23] 闫家伟.紫外分光光度法测定饮料中山梨酸钾的含量[J].南阳师范学院学报,2007,6(6):47-48.