苯并(a)芘,是一种常见高活性间接致癌物,被国际卫生组织列为Ⅰ类致癌物质[1-4]。近两年食品安全抽检结果显示,我们日常食用的油脂如花生油、芝麻油、棉籽油、菜籽油、葵花籽油等都存在苯并芘超标现象。据相关研究报道[5-10],食用油脂受到苯并(a)芘污染主要有以下3个途径:(1)油料、成品在生产过程中接触食品加工机械润滑油;(2)油料在干燥环节接触沥青;(3)油料在存储过程中发生了霉变而产生苯并(a)芘,随后在加工过程中带入食用油脂产品。因此,研究食用油脂中苯并(a)芘快速检测方法,对了解并控制其对食用油脂污染及保障公众食品安全具有十分重要的意义。
目前,食品中苯并(a)芘的检测方法主要有高效液相色谱法、气相色谱-质谱联用法、液相色谱-质谱联用法、免疫学法、薄层色谱法、荧光分光光度法等[11-15]。采用国标方法GB 5009.27—2016对食用油脂进行前处理并检测其苯并(a)芘含量时,由于实验过程需要苯并(a)芘分子印迹柱净化﹑氮吹仪浓缩等手工操作步骤,而且由于使用二氯甲烷高毒害性有机试剂作为溶剂,导致操作分析时间过长且消耗大量有毒有害有机溶剂[16]。近年来,在线净化与超高速液相色谱仪联用技术已在食品安全检测分析中得到应用[17-20],该技术具有净化与检测一体化、自动化程度高等优点。本研究建立在线净化与超高速液相色谱仪联用并应用于食用油脂中苯并(a)芘检测,其原理为通过2个不同色谱柱联用,分别完成对食用油脂的净化与检测工作,整个试验无需使用高毒性有机试剂与价格昂贵的固相小柱,样品提取过程方便快捷,具有经济、高效、对环境友好、自动化程度高等优点。
市场上售卖的猪油、土榨花生油、茶籽油、大豆油、调和油;正己烷、二氯甲烷、乙腈、异丙醇(色谱级),德国CNW公司; 苯并(a)芘专用 SPE 印迹柱(500 mg,6 mL),博纳艾杰尔科技有限公司;浓度苯并(a)芘标准溶液(20±0.038)μg/mL):农业部环境保护科研监测所。
XS105du 电子天平,瑞士梅特勒公司; ST16R离心机,美国热电公司;J2正压固相萃取,北京普利泰科仪器有限公司;1290 Infinity液相色谱仪(包括2个高压二元泵、一个六通阀),美国安捷伦科技有限公司;Kromasil 反C18色谱柱(4.6 mm×150 mm,5 μm)柱,瑞典阿克苏诺贝尔公司;ChromSpher Pi色谱柱(80 mm×3.0 mm,5 μm),美国安捷伦科技有限公司。
双柱在线净化检测系统实现了样品在线净化与检测的自动一体化,其运行步骤:第1步中的,样品由自动进样器进样后,进入第1根色谱柱进行初步的分离与富集,将样品中大部分非目标物质、杂质分离,然后将样品(500 μL)中的目标物苯并(a)芘分析物在色谱柱上进行富集,其间分离出来的杂质组分不进入检测器,而是经阀门直接进入废液池;第2步,进样一段时间后,系统中六通阀进行切换,将第1根色谱柱流出的组分进入第2根色谱柱进行分离、检测,同时由于系统流动相的变化,在第1根色谱柱上富集的苯并(a)芘进行洗脱进入第2根色谱柱分析,并在第2根色谱柱进一的分离后进入荧光检测器检测含量。
1.4.1 标准曲线绘制
用正己烷-异丙醇(体积比1∶1)将(20±0.038)μg/mL苯并(a)芘标准溶液稀释至50 ng/mL的苯并(a)芘标准溶液中间液,然后再用正己烷-异丙醇(体积比1∶1)逐级稀释浓度为1.0、2.5、5.0、7.5、10.0、20 ng/mL的标准工作液,现配现用。
1.4.2 样品前处理方法
称取均匀样品2.50 g置于15 mL离心管中,加入正己烷-异丙醇溶液(体积比1∶1)并至5.00 mL,摇匀,用涡旋器混合1.0 min,然后放入设置条件为4 000 r/min、4 ℃冷冻离心机离心4 min,取出后吸取溶液的上清液,用0.22 μm有机相微孔滤膜过滤,滤液待测。
1.4.3 色谱条件
系统中第1根色谱柱(Kromasil 反C18柱)色谱条件:流动相,乙腈-水(体积比80∶20),流速:1.0 mL/min,柱温40 ℃;第2根色谱柱(ChromSpher Pi)色谱条件:流动相,异丙醇-乙腈(体积比65∶35),流速:1.2 mL/min。柱温40 ℃;检测器:FLD(荧光)检测器;发射波长:406 nm;激发波长:384 nm。进样量500 μL(500 μL定量环)。
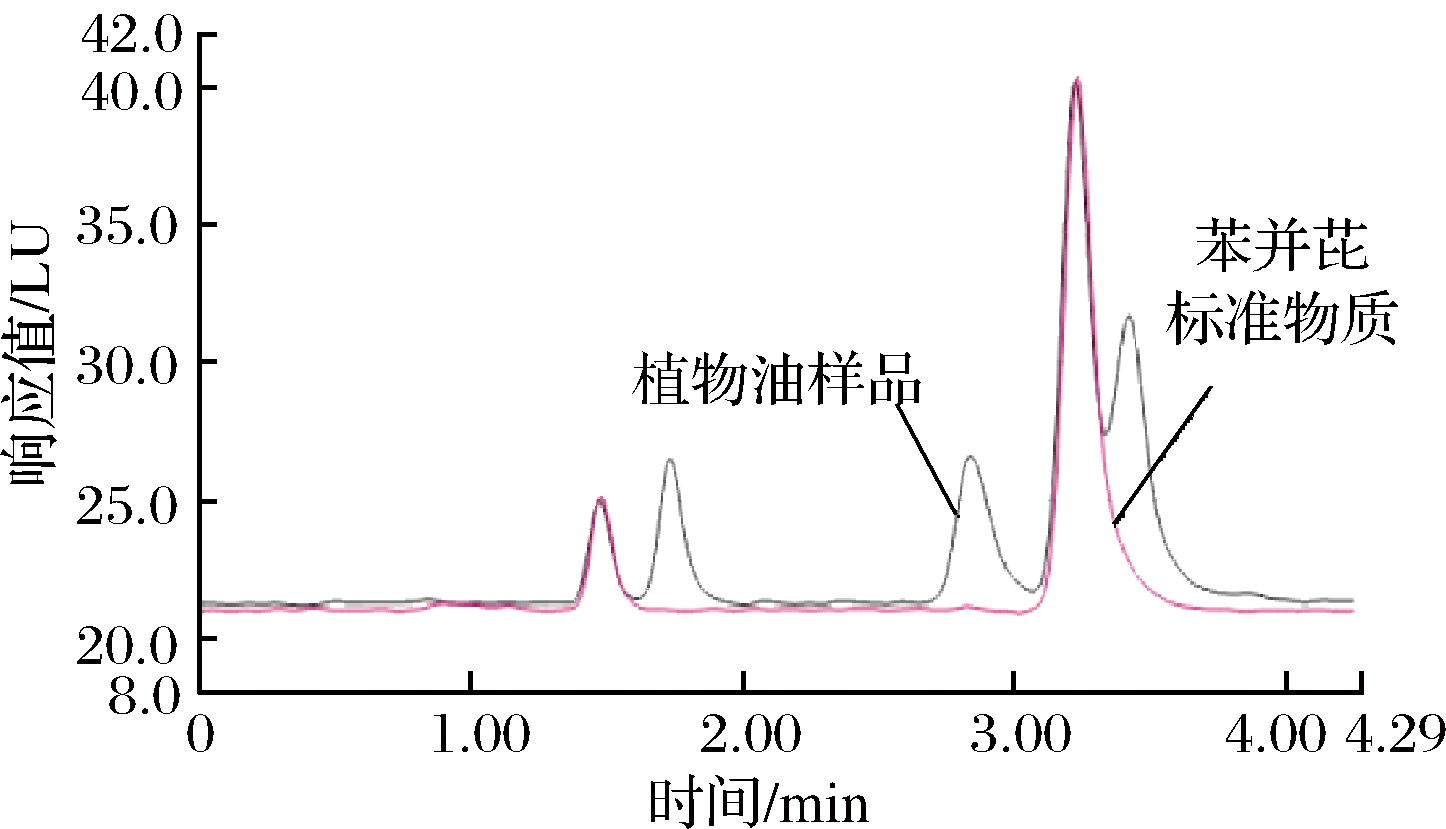
第1根色谱柱采用Kromasil反C18(4.6 mm×150 mm,5 μm)柱,其负责分离样品中的杂质和富集苯并(a)芘。通过流动相比例变化将第1根色谱柱富集的样品中的苯并(a)芘洗脱至第2根色谱柱进行分离、检测,第2根色谱柱采用苯并芘分析专用色谱柱安捷伦ChromSpher Pi柱。当第1根色谱柱以乙腈-水(体积比80∶20)为流动相时,样品与苯并(a)芘标准物质所得色谱图见图1。

图1 第1根色谱柱系统中样品与苯并(a)芘标准溶液色谱图
Fig.1 Standard solution chromatogram of sample and benzo
(a) pyrene in the first column system
由图1可见,样品中非目标物质在3 min内流出第1根色谱柱,样品中目标分析物苯并(a)芘流出的时间约为3.3 min后,在第1根色谱柱中待分析物与基体杂质基本能够分离。因此在线净化系统中六通阀切换到第2根色谱柱时间确定为3.5 min。如切换系统早于3.5 min,则导致进入第2根色谱柱的非目标物较多,从而引起检测结果偏高;而如果将阀门切换时间确定在3.5 min之后,样品中目标物苯并(a)芘流入废液池,导致方法的回收率降低、结果偏低。
2.2.1 线性范围的测定
以标准溶液浓度为横坐标(X)、标准物质荧光峰面积为纵坐标(Y)绘制标准曲线,进而得到线性回归方程及线性相关系数和范围。该试验方法的苯并(a)芘在1.0~20.0 ng/mL(浓度范围与国标方法一致)时样品浓度与响应值之间呈线性关系,其线性回归方程为Y=1.872 8X-0.038 5,相关系数r2为0.999 6,具有良好线性关系。
2.2.2 检出限的测定
准确称取样品2.50 g,加入0.10 mL的1.3配制的质量浓度为50 ng/mL的苯并(a)芘标准溶液中间液。按照1.4的前处理方法处理样品,即为其检出限,信噪比S/N=4.5。
检出限为各化合物的3倍信噪比即(S/N=3)即被定为最低检出限(LOD),测得数据显示,检出限苯并(a)芘信噪比S/N>3,可以确定方法的检出限在0.08 μg/kg,优于国家标准中0.1 μg/kg要求。
2.2.3 样品的测定
从市场上购买5份动植物油脂样品,分别采用双柱在线净化检测系统和国标GB 5009.27—2016进行测定,每份样品重复测定6次,2种方法检测结果分别见表1。
表1 实际样品检测结果(n=6)
Table 1 Test results of actual samples

样品双柱在线净化检测系统国标GB 5009.27—2016检测方法测定结果/(μg·kg-1)标准偏差变异系数/%测定结果/(μg·kg-1)标准偏差变异系数/%猪油2.860.065 352.292.680.057 452.14土榨花生油6.180.068 771.115.910.049 300.83茶籽油6.860.061 400.907.080.054 040.76大豆油1.020.053 855.281.190.061 815.20调和油未检出(检出限0.08 μg/kg)00未检出(检出限0.10 μg/kg)00
从以上5份实际样品检测结果中,考察在线净化系统与国标方法2种方法在分析结果、标准偏差、变异系数等,本文双柱在线净化检测系统在检测结果、标准偏差、变异系数与国标方法测定方法相近。
2.2.4 方法回收率与精密度
对市场上购买的常见5种动植物油脂中添加苯并(a)芘标准溶液,分别进行1、5、10 μg/kg三个水平添加,每个添加水平测定6次,分别采用双柱在线净化检测系统与国标GB 5009.27—2016方法测定并计算回收率和精密度,试验结果见表2、表3。
表2 本文试验方法的回收率、精密度测定结果(n=6)
Table 2 The results of recovery and precision measurement
of the test method in this paper
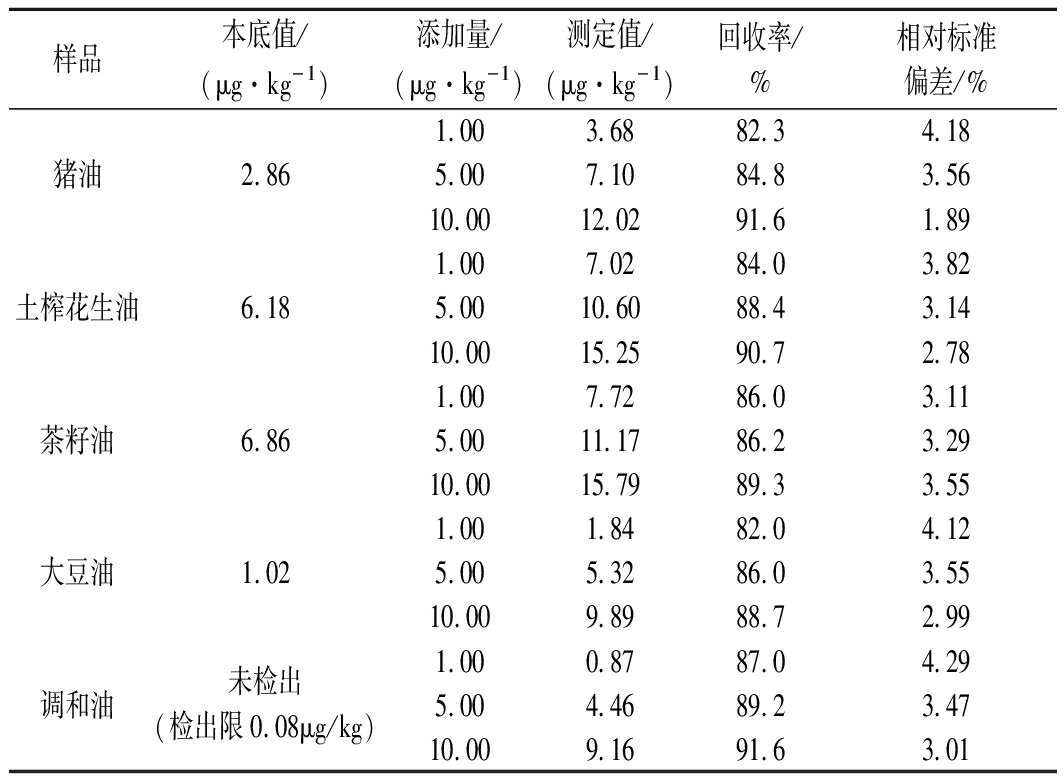
样品本底值/(μg·kg-1)添加量/(μg·kg-1)测定值/(μg·kg-1)回收率/%相对标准偏差/%1.00 3.68 82.34.18猪油2.865.00 7.10 84.83.5610.00 12.02 91.61.891.00 7.02 84.0 3.82土榨花生油6.185.00 10.60 88.43.1410.00 15.25 90.72.781.007.72 86.0 3.11茶籽油6.865.00 11.17 86.23.2910.00 15.79 89.33.551.00 1.84 82.0 4.12大豆油1.025.00 5.32 86.0 3.5510.00 9.89 88.72.99未检出1.00 0.87 87.0 4.29调和油(检出限0.08μg/kg)5.00 4.46 89.23.4710.00 9.16 91.63.01
从以上测定结果可以看出,双柱在线净化系统方法回收率均在82.0%~91.6%,相对标准偏差(RSD)为1.89%~4.29%,与国标方法的回收率、相对标准偏差接近,双柱在线净化系统试验结果符合GB/T 27404—2008《实验室质量控制规范 食品理化检测》中回收率和精密度的要求,满足含量在μg/kg级别的动植物油脂检测要求[21],表明该方法适用于动植物油脂中苯并(a)芘的检测。
表3 国标GB 5009.27—2016方法的回收率、
精密度测定结果(n=6)
Table 3 The results of recovery and precision of
GB 5009.27—2016 method
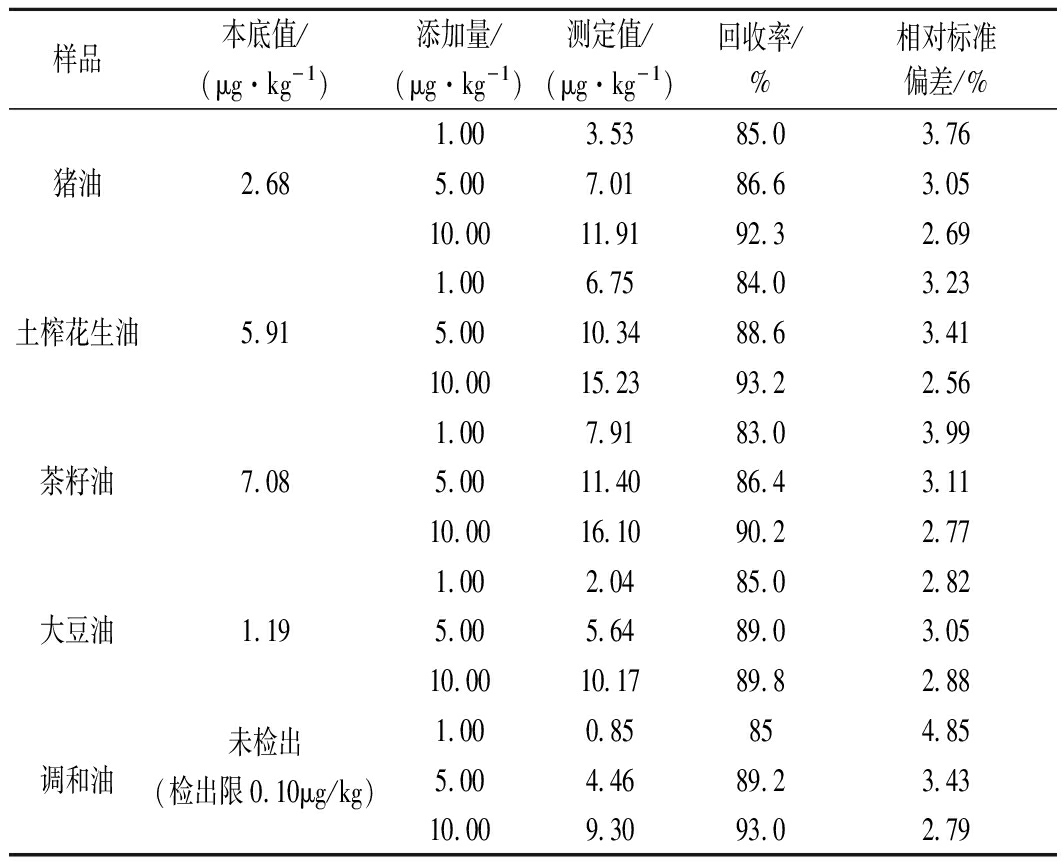
样品本底值/(μg·kg-1)添加量/(μg·kg-1)测定值/(μg·kg-1)回收率/%相对标准偏差/%1.00 3.53 85.0 3.76猪油2.685.00 7.01 86.63.0510.00 11.91 92.32.691.00 6.75 84.0 3.23土榨花生油5.915.00 10.34 88.63.4110.00 15.23 93.22.561.00 7.91 83.0 3.99茶籽油7.085.00 11.40 86.43.1110.00 16.10 90.22.771.00 2.04 85.0 2.82大豆油1.195.00 5.64 89.0 3.0510.00 10.17 89.82.88未检出1.00 0.85 854.85调和油(检出限0.10μg/kg)5.00 4.46 89.23.4310.00 9.30 93.0 2.79
本试验采用双柱在线净化分析系统,实现分析样品高度自动化,样品加入正己烷、异丙醇溶剂提取、过滤后可直接进样分析,系统首先利用第1根色谱柱对样品进行净化与苯并(a)芘目标物质富集,经过3.5 min后利用六通阀将组分切换到系统中的第2根色谱柱,目标物进一步得到分离与检测,整个试验实现了净化与检测一体化,自动化程度高,无需使用有毒有机溶剂,对操作者与环境友好。双柱在线净化分析系统在精密度、回收率等指标与国家标准方法GB 5009.27—2016接近,检出限优于国家标准,本系统可应用于常见动植物油脂如猪油、土榨花生油、茶籽油、大豆油、调和油等易受苯并(a)芘污染的样品快速检测。
[1] 吴丹.食品中苯并(a)芘污染的危害性及其预防措施[J].食品工业科技,2008,29(5):309-311.
[2] 李进伟,王兴国,金青哲.食用油中苯并(a)芘的来源、检测和控制[J].中国油脂,2011,26(6):7-11.
[3] 王欣,周智慧,赵晓联.苯并[a]芘危害性及其检测技术[J].粮食与油脂,2011(3):48-49.
[4] 汪敏.肉及肉制品中苯并(a)芘研究进展[J].肉类工业,2016(10):49-51.
[5] 郝蔚霞.植物油中苯并(a)芘安全风险分析及有效防控措施的探讨[J].食品质量安全检测学报,2015,6(7):2 558-2 562.
[6] 史巧巧,席俊,陆启玉.食品中苯并(a)芘的研究进展[J].食品工业科技,2014,35(5):379-381;386.
[7] 张杏敏,宋伟光,陈运霞,等.棉籽及棉籽油中苯并芘来源研究[J].中国油脂,2017,42(5):100-102.
[8] 陈胜姝,孟祥忍.食品中苯并(a)芘的来源及减控方法的研究[J].现代食品,2018(13):18-19.
[9] 王广峰.苯并(a)芘对人体的危害和食品中苯并(a)芘的来源及防控[J].菏泽学院学报,2014,36(2):66-70.
[10] 冯亚净,王瑞鑫,李书国.食品中苯并(a)芘的来源及减控方法的研究[J].粮食与油脂,2017,30(2):72-75.
[11] 贾涛.液相色谱-荧光法测定饲料用油中的苯并(a)芘含量[J].饲料研究,2012(7):70-72.
[12] 梁瑞,段兰萍,黄瑞,等.固相萃取-高效液相色谱法测定粮油中苯并(a)芘残留[J].粮食科技与经济,2016,41(5):46-49.
[13] 黄坤.高效液相色谱法测定大米和小麦粉中的苯并(α)芘[J].粮食与油脂,2018,31(10):86-88.
[14] 李念念,周宏光,徐幸莲,等.高效液相色谱-荧光法测定腊肉中的苯并(a)芘残留[J].食品工业科技,2013,34(1):319-322.
[15] 彭小东.液相萃取-反相高效液相色谱法联用测定植物油中的苯并(a)芘[J].中国油脂,2018,43(10):112-114.
[16] GB 5009.27—2016 食品安全国家标准 食品中苯并(a)芘的测定[S].北京:中国标准出版社,2016.
[17] 张艳海,朱晓艳,曹国洲,等.在线二维柱切换-高效液相色谱法同时测定婴幼儿强化奶粉中维生素A、D3和E的含量[J].分析化学,2013,4(5):771-775.
[18] 周提军,陈小珍,王瑾,等.基于柱切换技术的高压液相色谱法检测奶粉中的维生素D[J].食品安全质量检测学报,2013(2):467-472.
[19] 张艳海,其布勒哈斯,金燕,等.在线二维柱切换-高效液相色谱法同时测定婴幼儿和成人配方营养品中维生素A、D3和E的含量[J].色谱,2015,33(3):291-297.
[20] 赵孔祥,陈旭燕,刘暘,等.双柱在线净化快速测定鱼肉中孔雀石绿、结晶紫及其代谢物[J].食品研究与开发,2019,40(5):191-197.
[21] GB/T 27404—2008 实验室质量控制规范 食品理化检测 [S].北京:中国标准出版社,2008.