微生物胞内所有的低分子质量(<1 000)的代谢物的定性和定量分析是微生物代谢组学的主要研究内容之一。通过建立高灵敏度和高专属性的液相色谱串联质谱(liquid chromatography-tandem mass spectromrtey,LC-MS/MS)分析方法[1],可实现代谢物的特异性分析。代谢物是生命体内生物化学活动与功能最直接的信号或结构组成分子,是生命体基因表达与调控以及与外界环境共同作用的产物,在生命活动中既反映了基因及其作用的下游输出,又能表现环境因素的上游摄入[2-4]。利用代谢组学与其他组学来揭示微生物发酵过程中的产物代谢与调控机理,将成为今后传统发酵行业的主要研究方向[5]。在前期研究中,我们利用低能离子注入介导外源基因遗传转化技术获得了遗传稳定的重组酵母菌N6076[6]。本研究应用代谢组学方法,以期获得的重组菌株N6076与原始菌株Kh08在不同发酵时期的胞内代谢差异,为进一步理解酵母菌胞内小分子化合物的代谢提供依据。
酿酒酵母(Saccharomyces cerevisiae)N6076来源于低能氮离子注入介导外源DNA随机转化酿酒酵母(Saccharomyces cerevisiae)Kh08获得的遗传稳定的产醌类物质的重组酵母菌,由新疆大学物理科学与技术学院放射生态与离子束生物技术中心保存。
YPD斜面培养基(g/L):酵母膏10,蛋白胨20,葡萄糖20,琼脂粉10g。
液体培养基(g/L):葡萄糖·H2O 80, 蛋白胨10,酵母膏粉5,KH2PO4 1.5,MgSO4·7H2O 0.5,pH自然。
将YPD斜面培养基上培养48 h的新鲜菌种置于4 ℃保存24 h后接种至液体培养基中,置摇床150 r/min、28~30 ℃发酵96 h。分别于0、48和96 h收集菌液 5 mL于离心管内,3 000 r/min离心3 min,弃上清液,在菌体细胞中立即加入5mL淬灭液(V(甲醇)∶V(乙腈)∶V(水)=2∶2∶1),充分混匀,-80 ℃冰箱内淬灭10 min。然后于4 ℃、10 000×g离心5 min,弃上清液。加入1 mL、-20 ℃的提取液(V(甲醇)∶V(氯仿)∶V(水)=2∶2∶1),加等体积SiO2 beads,加液氮反复冻融,最大速度涡振3次,使菌体细胞充分破碎。在进行胞内产物制备过程中,样本置于冰中,保证代谢产物的稳定。
将菌体破碎液,于4℃、10 000×g离心5 min,收集上清,N2常温吹干,复溶于0.5 mL、-20℃的萃取液(V(乙腈)∶V(水)=1∶1),再于4 ℃、10 000×g离心5 min。收集上清,N2常温吹干,-80 ℃冻存。在进行UPLC-Q-TOF/MS和LC-MS/MS检测时,复溶于200 μL的溶液(V(乙腈)∶V(水)=7∶3)中即可。
本研究设置3个生物学重复,每个生物学重复的0、48、96 h的样品均设置6个技术重复。
UPLC-Q-TOF/MS(超高效液相色谱-四级杆飞行时间质谱仪,德国Bruker公司 Maxis plus)离子源:ESI; 检测模式:ESI+;毛细管电压:3 500 V,离子源温度:200 ℃;气体流速设定为8 L/min,雾化气体设置为4 bar。m/z扫描范围为50~2 000。数据采集速率设置为0.2 s,延迟0.1 s。色谱柱:C18(Waters BEH,50 mm × 2.1 mm,1.7 μm);柱温:40 ℃;进样量:5 μL,流速:0.20 mL/min。流动相A(V(乙腈)∶V(水)=5∶95+0.1%甲酸,流动相B为纯乙腈+0.1%甲酸)。梯度洗脱:0~2 min(100%A),2~24 min(100%~1%A),24~28 min1%A),28~29 min(1%~100%A),29~30 min(100%A)。质量轴以甲酸钠为校准液,以确保准确度和重现性。
LC-MS/MS(高效液相色谱-质谱/质谱联用仪,Waters XEVO-TQD,美国Waters公司)的离子扫描模式为MRM扫描模式,正离子检测,母离子:229.235 8;子离子:131.340 0;锥孔电压:14 V;碰撞电压:8 V。色谱柱:C18 (Waters BEH,50 mm × 2.1 mm,1.7 μm);柱温:40 ℃;进样量:5 μL,流速:0.20 mL/min。流动相A(水+0.1%的甲酸),流动相B(乙腈+0.1%的甲酸);梯度洗脱:0~1 min(100%A) 1~3.5 min(100%~1%A),3.5~4.5 min(1%A),4.5~4.9 min(1%~100%A),5 min(100%A)。LC-MS/MS定量分析用的MVAP标准品购自Sigma-Aldrich公司,纯度>99%。
2株酵母菌不同发酵时间的胞内代谢物的UPLC-Q-TOF/MS检测数据用Data Analysis程序转换为CDF格式,进行XCMS-Online分析[7],分析结果导入SIMCA-P,利用PLS-DA进行代谢物的鉴定。
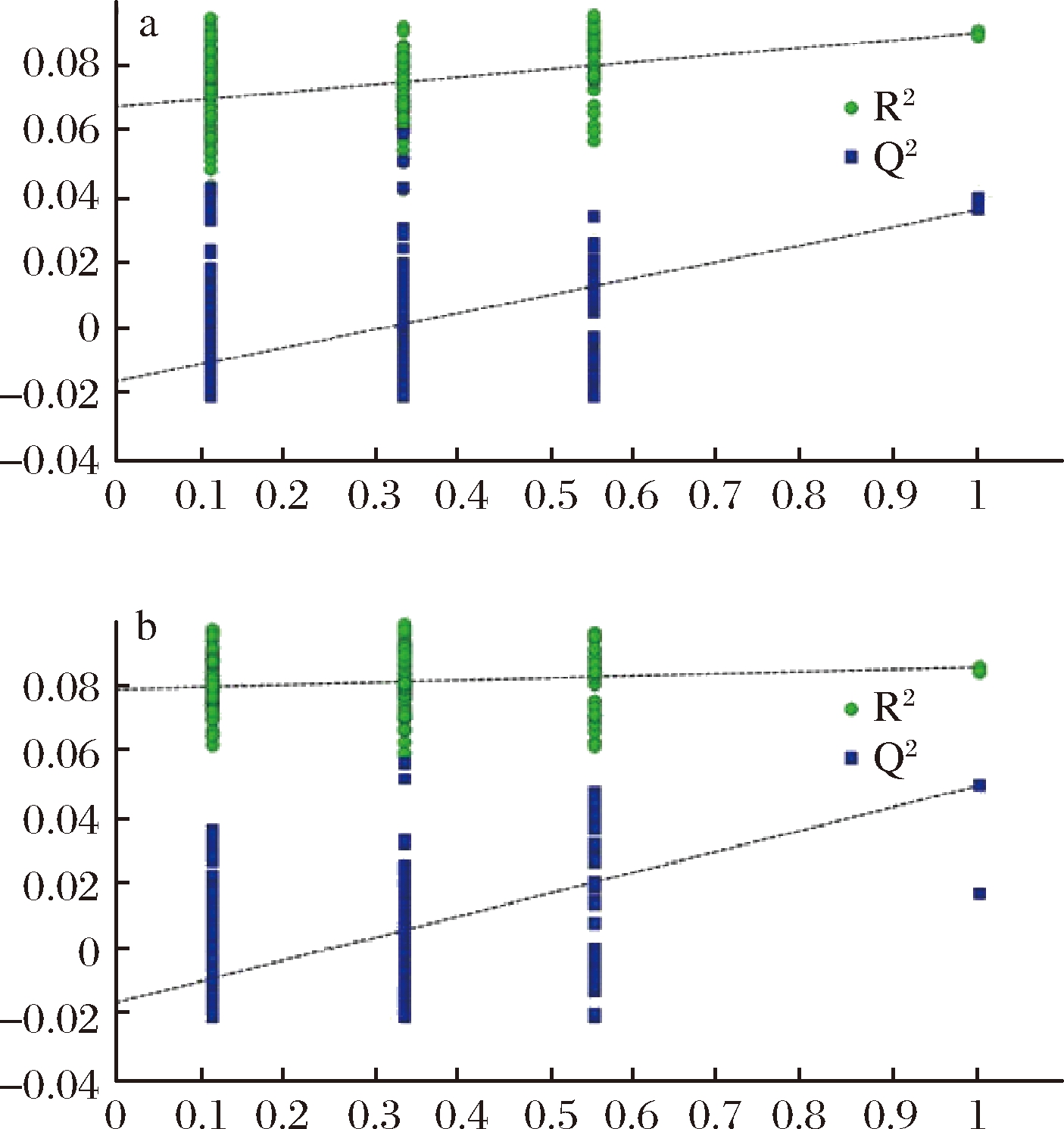
分析结果表明,重组菌株N6076的PLS-DA模型中R2X=0.492,R2Y=0.999,Q2=0.745; 原始菌株Kh08的PLS-DA模型中,R2X=0.361,R2Y=0.999,Q2=0.605。2株酵母菌PLS-DA模型的R2Y与Q2均>0.5,说明PLS-DA模型能够较好的预测2个菌株的胞内代谢物的差异。PLS-DA模型的200次排序检验验证结果如图1所示,其回归线的斜率较大,且与纵坐标的截距小于零,说明模型质量较好,没有出现过于拟合的状况。

a-N6076;b-Kh08
图1 重组酵母菌N6076与原始菌株Kh08的
PLS-DA的模型置换检验图
Fig.1 The PLS-DA model permutations test of metabolites
in recombinant yeast strain N6076 and original strain Kh08
在进行代谢物PLS-DA分析时,将每株菌0 h的代谢产物分为一组,48与96 h的分为一组。代谢物PLS-DA分布图(图2)显示,重组菌株N6076与其原始菌株Kh08的胞内代谢物的分离效果较好,每个菌株的48和96 h的代谢物与其0 h的有明显差异。重组菌株N6076的胞内代谢物,从第一主成分看,0 h组分布在负轴位置,48与96 h组主要分布正轴位置;从第二主成分看,0 h组主要分布在负轴上,48与96 h组分布于正负轴两侧。而原始菌株Kh08代谢物,从第一主成分看,0 h组的都分布在负轴上,48与96 h组分布在正轴上;从第二主成分看,0 h组主要集中在负轴,48与96 h组主要集中在正轴上。

a-N6076;b-Kh08
图2 重组酵母菌N6076与其原始菌株Kh08的
代谢物PLS-DA分布图
Fig.2 Score plot of metabolites in recombinant yeast
strain N6076 and original strain Kh08
选取VIP>1、P<0.05的代谢物差异点进行代谢物的PLS-DA载荷分析,结果显示了重组酵母菌N6076与其原始菌株Kh08代谢物的不同主成分的分布,距离中心越远的代谢物,其差异越大(图3)。2株酵母菌胞内代谢物在PLS-DA中的载荷均呈椭圆形分布,对差异贡献最大的点分别分布在第一主成分与第二主成分的正负轴两端(即椭圆的两端)。

a-N6076;b-Kh08
图3 重组酵母菌N6076与其原始菌株Kh08的
代谢物PLS-DA载荷图
Fig.3 Loading plot of metabolites in recombinant
yeast strain N6076 and original strain Kh08
UPLC-Q-TOF/MS测试结果(图4和图5)显示,重组菌株N6076的小分子代谢物的种类平均为88种,原始菌株Kh08的小分子代谢物平均为83种。重组菌株N6076的0与48 h的小分子代谢物的质荷比(m/z)大部分在170~850,96 h的小分子代谢物含有m/z>900的化合物。而原始菌株Kh08的48 h小分子代谢物就含有m/z>900的代谢产物。这说明,重组菌株中分子量>900的小分子代谢产物的生物合成时间较原始菌株延迟了48 h。对于重组菌株N6076中出现的质荷比为906.823 8、945.593 2、987.640 1的物质,尚没有相关报道,其性质有待进一步研究。
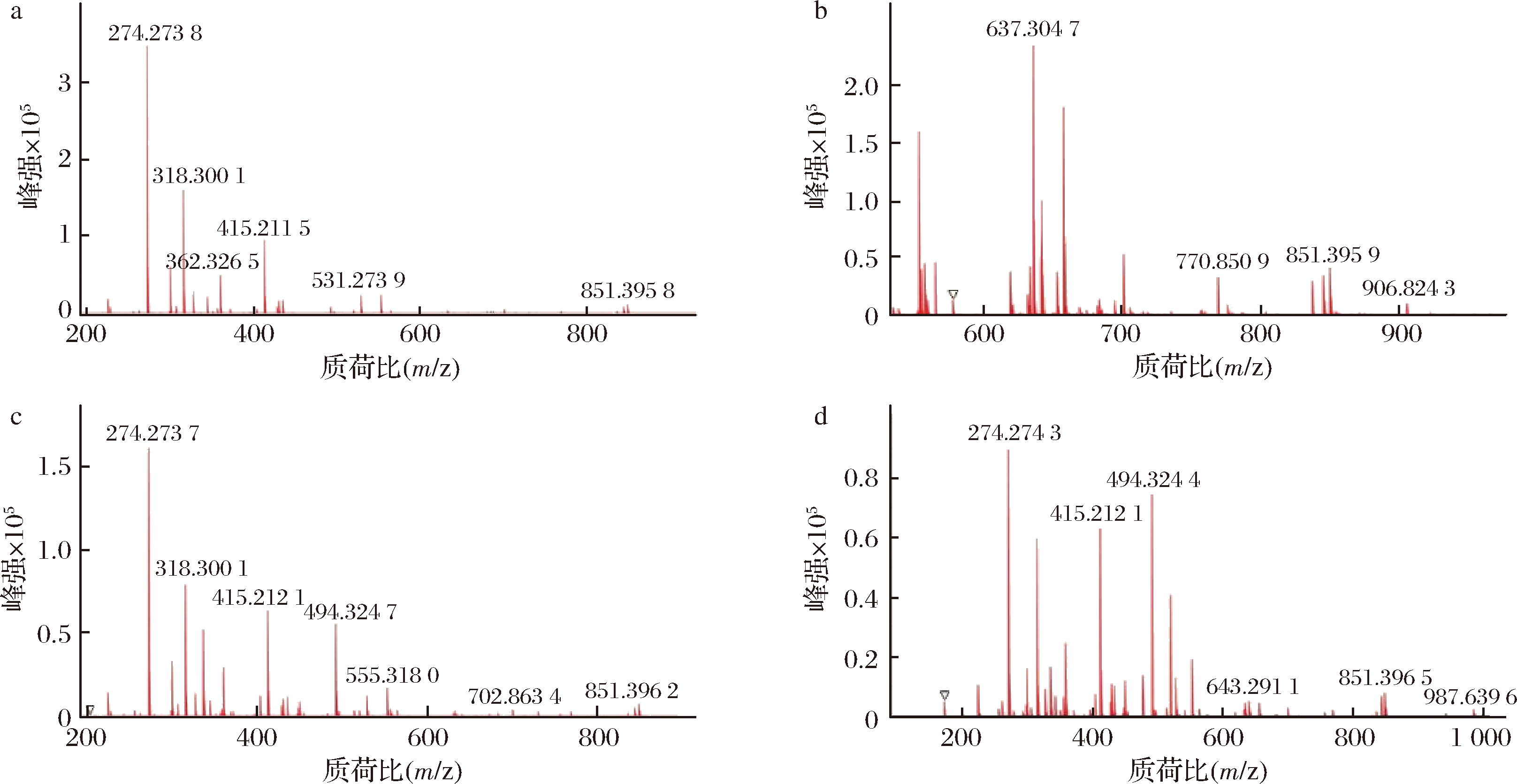
a-菌株N6076 48 h样本;b-菌株Kh08 48 h样本;c-菌株N6076 96 h样本;d-菌株Kh08 96 h样本
图4 重组菌株N6076及其原始菌株Kh08胞内代谢产物的UPLC-Q-TOF/MS部分质谱图
Fig.4 Partial UPLC-Q-TOF/MS Mass Spectrogram of intracellular metabolites of recombinant yeast strain N6076 and original strain Kh08
图5 重组菌株N6076及其原始菌株Kh08胞内
代谢产物的UPLC-Q-Tof/MS色谱图
Fig.5 UPLC-Q-Tof/MS chromatogram of
intracellular metabolites of recombinant yeast strain
N6076 and original strain Kh08
将统计分析得到的重组菌株N6076与原始菌株Kh08胞内代谢物进行相互比较分析,获得了2株酵母菌株的差异代谢物,分别将其质谱信息与HMDB数据库进行比对,确定了酵母菌的胞内差异化合物,其中重组菌株N6076的差异化合物为11种(表1),原始菌株Kh08的差异化合物为10种(表2)。
在2株酵母的胞内代谢差异物中,根据HMDB中的超级分类,重组菌株N6076代谢差异物中有7种脂类物质,原始菌株Kh08中有6种,在已鉴定出的差异物中占比很高。差异物丰度图(图6、图7)的结果显示,在重组菌株N6076中,脂类物质1-花生酰甘油三酯、4-O-methylmelleolide、β-谷甾醇乙酸酯、单甲基磷脂胺的浓度较高,且β-谷甾醇乙酸酯在各个样本中都是在96 h时浓度最高。在原始菌株Kh08已鉴定的差异物中,脂类物质 PG(25∶0)、β-谷甾醇乙酸酯、PE(22∶2/15∶0)浓度最高。
表1 重组菌株N6076中的差异化合物
Table 1 The differential compounds in recombinant
yeast strain N6076
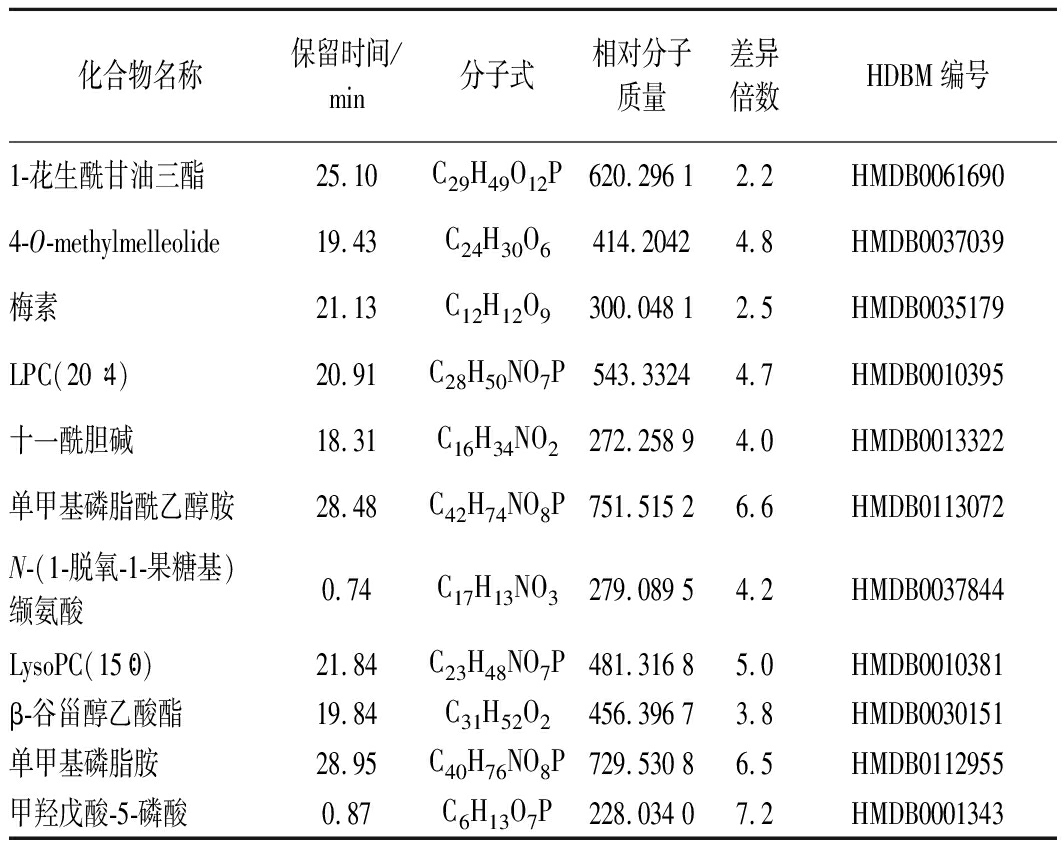
化合物名称保留时间/min分子式相对分子质量差异倍数HDBM编号1-花生酰甘油三酯25.10C29H49O12P620.296 12.2HMDB00616904-O-methylmelleolide19.43C24H30O6414.20424.8HMDB0037039梅素21.13C12H12O9300.048 12.5HMDB0035179LPC(20∶4)20.91C28H50NO7P543.33244.7HMDB0010395十一酰胆碱18.31C16H34NO2272.258 94.0HMDB0013322单甲基磷脂酰乙醇胺28.48C42H74NO8P751.515 26.6HMDB0113072N-(1-脱氧-1-果糖基)缬氨酸0.74C17H13NO3279.089 54.2HMDB0037844LysoPC(15∶0)21.84C23H48NO7P481.316 85.0HMDB0010381β-谷甾醇乙酸酯19.84C31H52O2456.396 73.8HMDB0030151单甲基磷脂胺28.95C40H76NO8P729.530 86.5HMDB0112955甲羟戊酸-5-磷酸0.87C6H13O7P228.034 07.2HMDB0001343
表2 原始菌株Kh08中的差异化合物
Table 2 The differential compounds in original strain Kh08
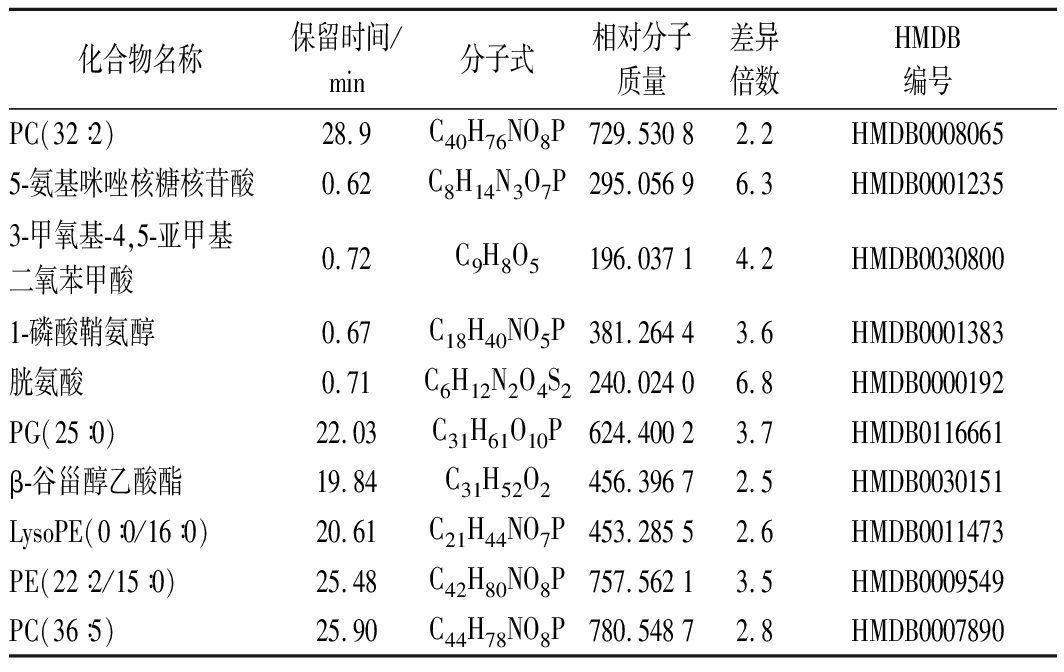
化合物名称保留时间/min分子式相对分子质量差异倍数HMDB编号PC(32∶2)28.9C40H76NO8P729.530 82.2HMDB00080655-氨基咪唑核糖核苷酸0.62C8H14N3O7P295.056 96.3HMDB00012353-甲氧基-4,5-亚甲基二氧苯甲酸0.72C9H8O5196.037 14.2HMDB00308001-磷酸鞘氨醇0.67C18H40NO5P381.264 43.6HMDB0001383胱氨酸0.71C6H12N2O4S2240.024 06.8HMDB0000192PG(25∶0)22.03C31H61O10P624.400 23.7HMDB0116661β-谷甾醇乙酸酯19.84C31H52O2456.396 72.5HMDB0030151 LysoPE(0∶0/16∶0)20.61C21H44NO7P453.285 52.6HMDB0011473PE(22∶2/15∶0)25.48C42H80NO8P757.562 13.5HMDB0009549PC(36∶5)25.90C44H78NO8P780.548 72.8HMDB0007890

图6 重组菌株N6076中差异物的丰度图
Fig.6 The abundance diagram of differential compounds in
recombinant yeast strain N6076

图7 原始菌株Kh08中差异物的丰度图
Fig.7 The abundance diagram of differential
compounds in original strain Kh08
在重组菌株N6076的差异物中,差异倍数最大的是甲羟戊酸-5-磷酸。甲羟戊酸-5-磷酸(mevalonate-5-phosphate,MVAP),又称甲戊酸-5-磷酸或5-磷酸甲戊酸,属于单烷基磷酸酯类化合物,为甲羟戊酸途径中重要的中间产物,是合成类异戊二烯、萜类和醌类物质的前体[8]。研究表明,MVAP为甲羟戊酸途径的重要中间产物,参与了细胞内许多酶促反应,是萜类和醌类等次生代谢产物合成的前体物质[9-12]。萜类化合物在食品中有重要的应用,可用作香精香料、甜味剂、营养强化剂等[13]。MVAP对重组菌株N6076的差异代谢物贡献最大,说明该菌株的甲羟戊酸代谢途径活跃,有利于次生代谢产物的合成。
在原始菌株Kh08的差异物中,差异倍数最大的是胱氨酸[14]。从KEGG数据库的胱氨酸代谢通路可知,其生物合成前体为S-腺苷-L-高半胱氨酸,而含有半胱氨酸的小分子肽具有较高的抗氧化活性[15]。在食品、药品中有抗氧化和防止非酶褐变作用, 常用作抗氧化剂或营养强化剂[16]。这暗示原始菌株Kh08的抗氧化能力优于重组菌株N6076。
利用LC-MS对MVAP进行定量测试,标准溶液的MVAP浓度梯度分别为50.0、25.0、12.5、10.0、5.0、1.0 μg/mL,拟合获得标准曲线为:y=1 669.72x-23 031.82;r=0.996 724,r2=0.993 458。
检测结果表明,重组菌株N6076发酵48h时,其胞内MVAP的质量浓度达到1.32 μg/mL,其MRM质谱图如图8所示,而原始菌株Kh08在相同发酵时间点时,其胞内MVAP未检出。对于这种情况的出现,到底是由甲羟戊酸途径中MVAP合成酶基因的改变造成的还是MVAP上游代谢相关基因调控的,还需进一步研究。
图8 重组菌株N6076发酵48 h胞内MVAP的MRM图谱
Fig.8 MRM mapping of intracellular MVAP of recombinant
strain N6076 fermented for 48 h
UPLC-Q-TOF/MS的测试分析结果表明,重组菌株N6076代谢产物中分子质量>900的小分子化合物的合成时间较原始菌株Kh08延迟了48 h。
2株酵母菌胞内代谢物的相互比较分析结果显示,重组菌株N6076的差异化合物为11种,原始菌株Kh08的差异化合物为10种。这些差异代谢物中,脂类物质多,且丰度高,其中MVAP和胱氨酸分别是2株酵母菌最大的差异代谢物。
LC-MS测试结果,重组菌株N6076在48 h时,其胞内MVAP质量浓度达到1.32 μg/mL,而在原始菌株Kh08中未检出。
重组菌株N6076中脂类物质种类多于原始菌株Kh08,且浓度相对也高,而且存在合成萜类物质的MVAP,有利于次生代谢产物的合成[17]。原始菌株Kh08的代谢产物中存在胱氨酸,在抗氧化上更有优势[18]。
[1] 王国才, 贺玖明. 液相色谱质谱联用技术在临床检测和代谢研究中的应用进展[J]. 国际检验医学杂志, 2018, 39(22): 2 750-2 755.
[2] GREEN D R, GALLUZZI L, KROEMER G. Metabolic control of cell death [J]. Science, 2014, 345(6 203): 1 250-1 256.
[3] NICHOLSON J K, LINDON J C. Systems biology: Metabonomics [J]. Nature, 2008, 455(7 216): 1 054-1 056.
[4] MAMAS M, DUNN W B, NEYSES L, et al. The role of metabolites and metabolomics in clinically applicable biomarkers of disease [J]. Arch Toxicol, 2011, 85(1): 5-17.
[5] 周钺, 李键, 张玉,等.多组学技术联用在传统发酵乳品风味代谢调控中的应用研究进展[J].食品与发酵工业,2019,45(8):238-243.
[6] 吕杰, 马媛, 毛培宏, 等. 离子束重组酵母菌N6076的基因表达与蛋白质组学初步研究[J]. 基因组学与应用生物学, 2017, 36(11), 4 678-4 685.
[7] FORSBERG E M, HUAN T, RINEHART D, et al. Data processing, multi-omic pathway mapping, and metabolite activity analysis using XCMS online [J]. Nature protocols, 2018, 13(4): 633-651.
[8] HENNEMAN L, CRUCHTEN A G V, DENIS S W, et al. Detection of nonsterol isoprenoids by HPLC-MS/MS [J]. Analytical Biochemistry, 2008, 383(1):18-24.
[9] BUHAESCU I, IZZENDINE H. Mevalonate pathway: a review of clinical and therapeutical implications [J]. Ciln Biochem, 2007, 40(9-10): 575-584.
[10] GOLDSTEIN J L, BROWN M S. Regulation of the mevalonate pathway [J]. Nature, 1990, 343(6 257): 425-430.
[11] VANCE D E, VANDEN B H. Cholesterol in the year 2000 [J]. Bioehim Biophys Acta, 2000, 1 529(1-3): 1-8.
[12] VAUGHAN C J, GOTTO A M J. Update on statins: 2003 [J]. Cireulation, 2004, 110(7): 886-892.
[13] 宗朕, 程磊, 陈卓静, 等. 食品用萜类化合物的生物合成研究进展[J]. 中国酿造, 2018, 37(9): 28-33.
[14] 蒋林蓉, 徐志伟, 程立媛, 等. 酱油中胱氨酸的高效液相色谱-串联质谱法测定[J]. 中国调味品, 2015,40 (5): 100-104.
[15] JUAN J R, INMACULADA A, VICTORIA M M, et al. Impact of glutathione-enriched inactive dry yeast preparations on the stability of terpenes during model wine aging [J]. Journal of Agricultural and Food Chemistry, 2014, 62(6), 1 373-1 383.
[16] 叶丽君,黄雪松.旋光法研究L-半胱氨酸在食品加工条件下的稳定性[J].食品与发酵工业,2013,39(3):27-31.
[17] 原苗苗, 赵新节, 孙玉霞. 低温对葡萄酒香气成分和酵母代谢的影响[J]. 食品与发酵工业, 2017, 43(12): 268-276.
[18] 曾智娟,邓杰,任志强,等. 不同酵母菌发酵对生姜梨酒品质的影响[J]. 食品与发酵工业,2020,4(1):229-236.