共表达谷氨酰-tRNA还原酶增强染料脱色过氧化物酶在大肠杆菌中的表达活性
顾鹏帅1,潘梅1,丁亮亮1,唐蕾1,2*
1(工业生物技术教育部重点实验室 (江南大学),江苏 无锡,214122) 2 (江南大学 生物工程学院,江苏 无锡,214122)
摘 要 染料脱色过氧化物酶(dye-decoloorizing peroxidase,DyP)属于以血红素为辅基的新型过氧化物酶类,常因缺乏辅因子而导致催化活性低。将来源于褐色嗜热裂孢菌(Thermobifida fusca)的染料脱色过氧化物酶基因(TfuDyP)与大肠杆菌谷氨酰-tRNA还原酶基因(hemA),构建重组质粒phemA-DyP,转化至E.coli BL21中进行共表达。分别以2,2-联氮-二(3-乙基苯并噻唑-6-磺酸)二铵盐(ABTS)和顽固性染料活性蓝19(RB19)、溴酚蓝、溴甲酚绿为底物检测TfuDyP的催化活力以及染料脱色效率。结果表明,诱导后的共表达菌株pAD胞内血红素含量为9.8 μmol/L,而单独过表达基因TfuDyP的菌株pD仅为3.4 μmol/L。TfuDyP纯酶的全波长扫描分析表明,在菌株pAD中DyP酶与血红素的结合度相比pD有较大幅度的提升。pAD菌株表达的DyP酶活力较pD菌株提高了110%,酶活力的提高使其在染料脱色应用方面也得到增强。在pAD菌株培养基中分别添加谷氨酸(Glu)、FeCl2使得胞内血红素含量、DyP酶活力和染料脱色效率比未添加时进一步提高。以上结果为TfuDyP的功能开发奠定了基础,同时也为其他血红素依赖性过氧化物酶的研发提供借鉴。
关键词 大肠杆菌;褐色嗜热裂孢菌;血红素;染料脱色过氧化物酶;共表达
第一作者:硕士研究生(唐蕾教授为通讯作者,E-mail: ltang@jiangnan.edu.cn)
基金项目:111引智计划(111-2-06);国家轻工技术与工程一流学科自主课题(LITE2018-27);江苏省现代工业发酵协同创新中心资助
收稿日期:2019-10-06,改回日期:2019-11-29
DOI:10.13995/j.cnki.11-1802/ts.022459
引用格式:顾鹏帅,潘梅,丁亮亮,等.共表达谷氨酰-tRNA还原酶增强染料脱色过氧化物酶在大肠杆菌中的表达活性[J].食品与发酵工业,2020,46(4):45-50.GU Pengshuai, PAN Mei, DING Liangliang, et al. Co-expression of glutamyl tRNA reductase improves catalytic activities of a dye-decolorizing peroxidase in Escherichia coli[J].Food and Fermentation Industries,2020,46(4):45-50.
Co-expression of glutamyl tRNA reductase improves catalytic activities of a dye-decolorizing peroxidase in Escherichia coli
GU Pengshuai1, PAN Mei1, DING Liangliang1, TANG Lei1,2*
1(Key Laboratory of Industrial Biotechnology, Ministry of Education, Jiangnan University, Wuxi 214122, China)2(School of Biotechnology, Jiangnan University, Wuxi 214122, China)
ABSTRACT Dye-decolorizing peroxidase (DyP) with heme as a prosthetic group is regarded as a novel type of peroxidase. Usually, the catalytic activity of DyP is low due to the lack of cofactor heme. In this study, the recombinant plasmid phemA-DyP with the DyP gene from Thermobifida fusca (TfuDyP) gene and glutamyl tRNA reductase gene from E.coli (hemA) was constructed and transformed into E.coli BL21 for co-expression. The catalytic ability and decolorization efficiency of TfuDyP were detected using ABTS and dyes RB19, bromophenol blue and bromocresol green as substrates respectively. The results showed that the intracellular heme content in the co-expressing strain pAD was 9.8 μmol/L, whereas in the strain pD with over-expressed TfuDyP it was 3.4 μmol/L. Full-wavelength scanning of purified TfuDyp showed that the binding degree of DyP to heme increased in the co-expressing strain pAD. In addition, the activity of TfuDyP from the pAD strain was 110% higher than that from the pD strain, and the increase of enzyme activity also enhanced the dye decolorization. The exogenous addition of glutamic acid (Glu) and FeCl2 to the culture medium of pAD strain increased the intracellular heme content, the TfuDyP activity and dye decolorization efficiency. The results laid the foundation for the functional development of TfuDyP, and also provided reference for the development of other heme-dependent peroxidases.
Key words Escherichia coli; Thermobifida fusca; dye-decolorizing peroxidase; heme; co-expression
过氧化物酶是一类重要的氧化还原酶,能利用过氧化氢催化一系列有机物和无机物发生化学反应,在生物合成、降解等生命活动中发挥重要的作用[1-3]。大多数过氧化物酶含有血红素,这些血红素过氧化物酶一般分为两个超家族,动物和植物过氧化物酶[4]。最近发现了一个新的血红素过氧化物酶家族,并被归类为染料脱色过氧化物酶型(dye-decoloorizing peroxidase,DyP)家族[5]。这种酶类能降解蒽醌类染料以及木质素等顽固性化合物,可利用生物法实现对染料废水以及木质素废弃物的处理[6],因此在纺织、造纸、环保等方面具有广泛的应用潜力[7]。
在自然界中,生物体有两条途径可对血红素进行合成,即C4和C5途径[8]。以往对血红素蛋白的研究表明,血红素辅助因子的充足供应对于血红素蛋白可溶性表达及活性有重要作用[9]。对于提高大肠杆菌胞内血红素的积累已有较多报道,根据其相关机制分为两种策略。第一种策略通过外源添加血红素前体物质,来增强胞内血红素的合成,最终实现血红素的累积。例如,陈丹园等[10]在培养基中添加FeCl2、谷氨酸(Glu)、5-氨基乙酰丙酸、葡萄糖(Glc)对血红素积累有一定的促进作用,使得实验组血红素产量相对对照组血红素产量大幅度提高。第二种策略是通过过表达血红素合成途径中的关键酶基因来实现血红素的累积。例如PRANAWIDJAJA等[11]将来自球形红细菌的5-氨基乙酰丙酸合成酶基因(ALAS)和大肠杆菌自身基因组的泛酸激酶基因(coaA)导入大肠杆菌,通过C4途径促进了大肠杆菌胞内血红素的积累。这些研究为解析大肠杆菌血红素合成途径调控机制提供了一定的理论依据,证实了通过外源添加血红素前体物质以及过表达血红素合成相关途径的基因可提高大肠杆菌胞内血红素的含量,但未对血红素与过氧化物酶的功能关系作出进一步探讨。
大肠杆菌利用C5途径合成血红素。在这种生物合成途径中,谷氨酸五碳骨架首先经过一系列转化,变为谷氨酰-tRNA,并以此作为前体物质流向下游代谢途径,最后经亚铁鳌合酶鳌合胞内铁离子形成血红素。其中,谷氨酰-tRNA经hemA编码的谷氨酰-tRNA还原酶催化生成谷氨酰-1-半醛,被认为是血红素合成限速步骤之一[12]。本研究将来自大肠杆菌的hemA与嗜热放线菌(Thermobifida fusca)的DyP过氧化物酶基因(TfuDyP)共表达,在提高细胞内血红素含量的同时,进一步增强TfuDyP活性。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和质粒
本研究中使用的质粒与菌株如表1所示。
表1 本研究中使用的质粒和菌株
Table 1 Plasmids and strains used in this study
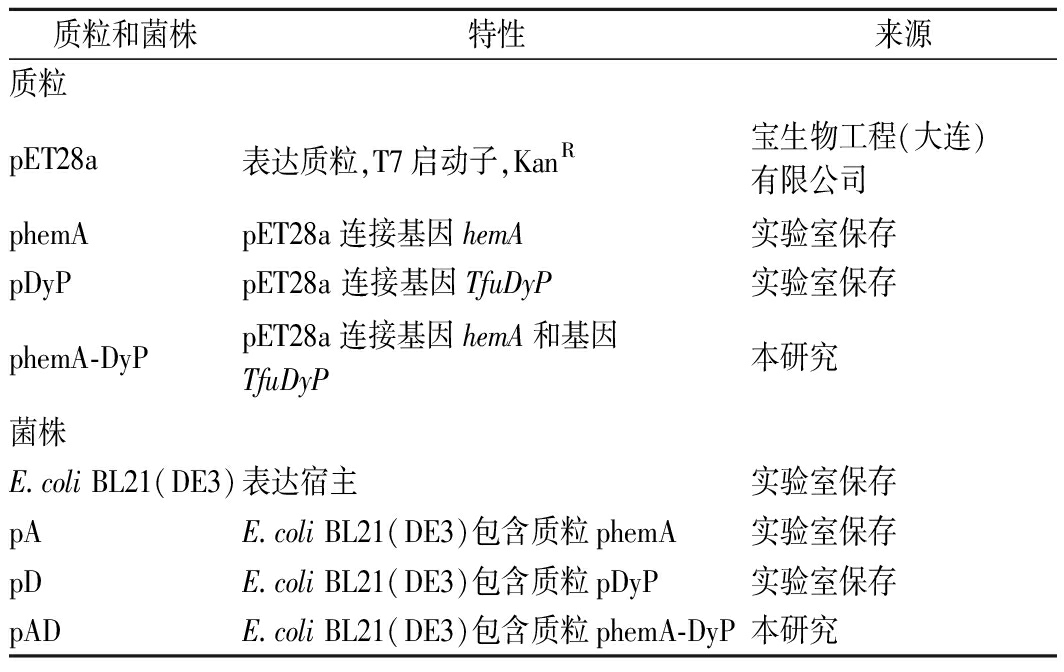
质粒和菌株 特性 来源质粒pET28a表达质粒,T7启动子,KanR宝生物工程(大连)有限公司phemApET28a连接基因hemA实验室保存pDyPpET28a 连接基因TfuDyP实验室保存phemA-DyPpET28a连接基因hemA和基因TfuDyP本研究菌株E.coli BL21(DE3)表达宿主实验室保存pA E.coli BL21(DE3)包含质粒phemA实验室保存pD E.coli BL21(DE3)包含质粒pDyP实验室保存pADE.coli BL21(DE3)包含质粒phemA-DyP本研究
1.1.2 酶和试剂
引物,由天霖生物科技有限公司(上海)合成;限制性内切酶EcoRⅠ、Hind Ⅲ 和XhoⅠ,Takara 公司;CloneExpressR Ⅱ One Step Cloning Kit试剂盒,诺唯赞生物科技有限公司;2,2-联氮-二(3-乙基苯并噻唑-6-磺酸)二铵盐(ABTS)、草酸,Sigma公司;活性蓝19(Reactive Blue 19,RB19),上海源叶生物科技有限公司;异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)、硫酸卡那霉素(Kan),上海生工。
1.2 实验方法
1.2.1 hemA和TfuDyP基因的克隆
hemA基因参考NCBI上公布序列(https://www.ncbi.nlm.nih.gov/nuccore/AM946981.2)。TfuDyP基因来源于实验室保藏质粒pDyP。
1.2.2 重组质粒的构建
用pDyP质粒作为模板,利用上游引物5′-AAGCTTGCGGCCGCACTCGAGTAATACGACTCACTAT-AGGGGA-3′和下游引物5′-GTGGTGGTGGTGGTGCT-CGAGTTAACCTTCAATCAGATCCTGACCC-3′扩增得到TfuDyP基因。用Xho I单酶切phemA质粒载体,胶回收后通过同源重组酶在37 ℃中连接30 min,将连接产物用热激法转入JM109感受态细胞。筛选阳性重组子,送天霖生物科技有限公司(上海)测序。质粒构建如图1所示。
1.2.3 重组蛋白的表达与纯化鉴定
重组菌于37 ℃,200 r/min过夜活化培养后,按4%接种量转接至含50 μg/mL Kan抗生素的LB液体培养基中。实验中所需的谷氨酸、FeCl2经无菌水溶解过滤除菌后分别按40、20 μmol/L含量与活化重组菌一同加入LB液体培养基中。待菌体的OD值为0.6~0.8 时,加入终浓度0.3 mmol/L IPTG,37 ℃条件诱导8 h。用磷酸缓冲液(20 mmol/L, pH=7.4)悬浮菌体,超声破碎细胞20 min,4 ℃,10 000 r/min离心30 min。粗酶液用 0.45 μm过滤膜进行过滤,以除去杂质。用含有20 mmol/L咪唑的磷酸缓冲液进行平衡后上样,最后用含有500 mmol/L咪唑的磷酸缓冲液进行线性洗脱。根据洗脱图谱,收集对应洗脱峰的酶液。纯化后的蛋白用12%的SDS-PAGE进行分析。
1.2.4 血红素浓度测定
利用荧光法来检测血红素浓度,参考陈丹园[10]胞内血红素检测方法。
1.2.5 TfuDyP的光谱分析
DyP在408 nm 处有一个明显的亚铁血红素酶的特征吸收峰[13-15],因此可以通过光谱分析TfuDyP与血红素结合度。取200 μL纯酶样品,运用多功能酶标仪biotek在280~700 nm对其进行波长扫描。
1.2.6 TfuDyP的活性检测
以ABTS为底物,检测TfuDyP过氧化物酶的活性[16-17]。反应体系包括20 mmol/L的醋酸缓冲液、终浓度0.2 mmol/L的ABTS、适量稀释后的100 μL纯酶液,终浓度0.2 mmol/L的H2O2启动反应,反应时间为30 s,终止剂为200 μl、2%SDS。使用紫外可见分光光度计仪检测反应产物在420 nm(ε= 36 000 mol/cm)-1)的光吸收值。一个酶活力单位定义为:在25 ℃、pH 4.5条件下,氧化1 μmol ABTS所需要的酶量。比酶活(U/mg)= 酶活(U/mL) ÷蛋白浓度(mg/mL)。
1.2.7 TfuDyP对不同染料的脱色测定
以活性蓝(RB19)、溴甲酚绿、溴酚蓝为研究对象,反应体系包括20 mmol/L的醋酸缓冲液、终浓度0.1 mmol/L的染料溶液、适量稀释后的100 μL纯酶液,终浓度0.2 mmol/L的H2O2启动反应,终止剂为200 μL、2%SDS。在25 ℃、pH 4.5条件下,反应15 min后检测溶液在最大吸收波长的光吸收值,记为A,脱色率计算如公式(1)所示:
染料的脱色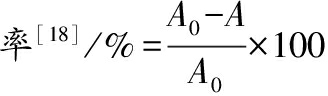
(1)
式中:A0为对照组光吸收值。
2 结果与分析
2.1 共表达菌株构建
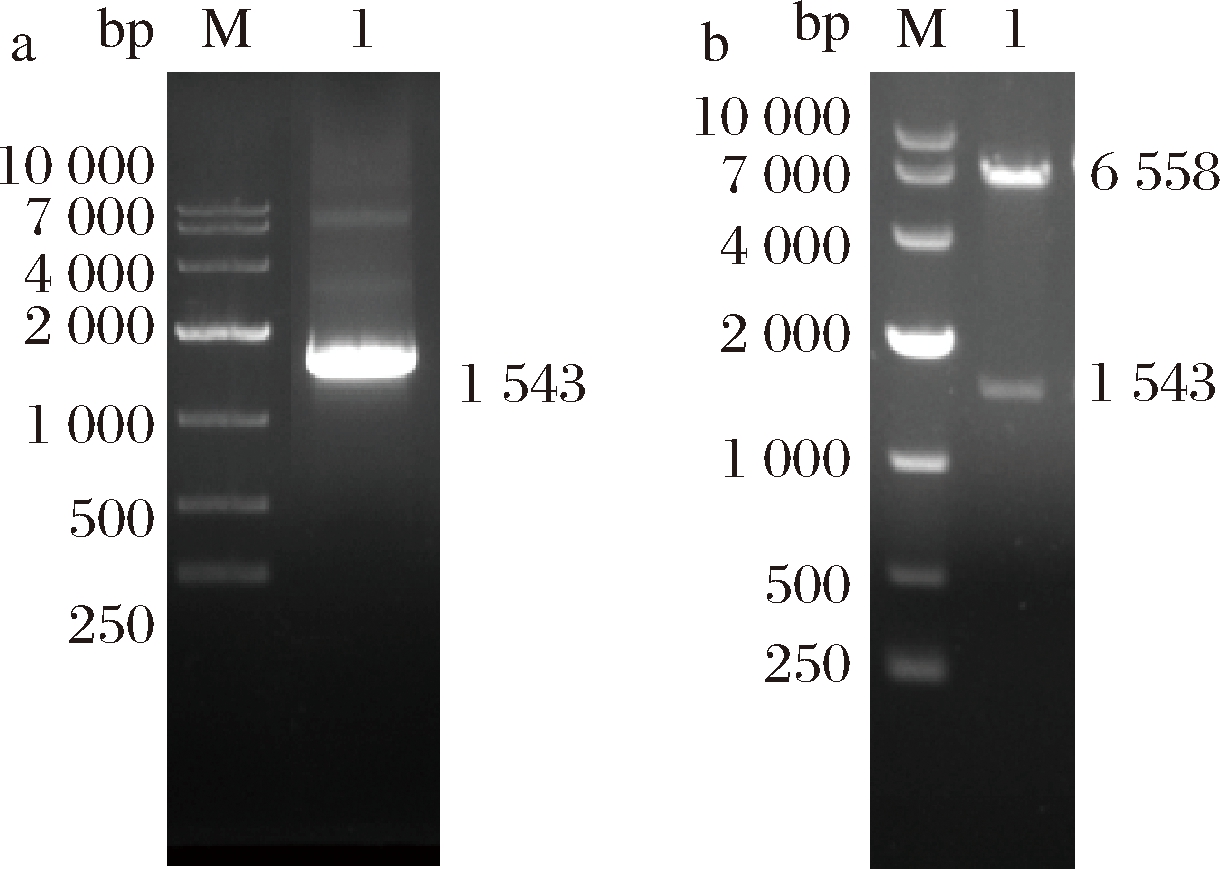
以实验室保存的pDyP质粒为模板,使用特异性引物PCR扩增获取目的基因片段,琼脂糖凝胶电泳结果显示与预期大小1 543 bp相符(图2-a)。通过同源重组酶连接到phemA质粒上,组成新的重组质粒phemA-DyP,用Xho I酶切并用琼脂糖凝胶电泳进行验证(图2-b),phemA质粒约为6 558 bp,大小相符,进一步测序验证,确保无误后用于后续实验。
2.2 重组蛋白的表达与纯化鉴定
将新构建的重组质粒转化至大肠杆菌BL21(DE3)中,在相同条件下进行诱导表达,获得具有活性的可溶性TfuDyP,TfuDyP粗酶液经镍柱纯化和脱盐柱脱盐处理后,利用SDS-PAGE蛋白电泳检测重组蛋白纯度。如图3所示,酶纯度已到达了酶学性质分析的要求,融合蛋白理论大小约为47.4 kDa,与目的条带在电泳图中的位置吻合。
2.3 重组菌的血红素浓度检测
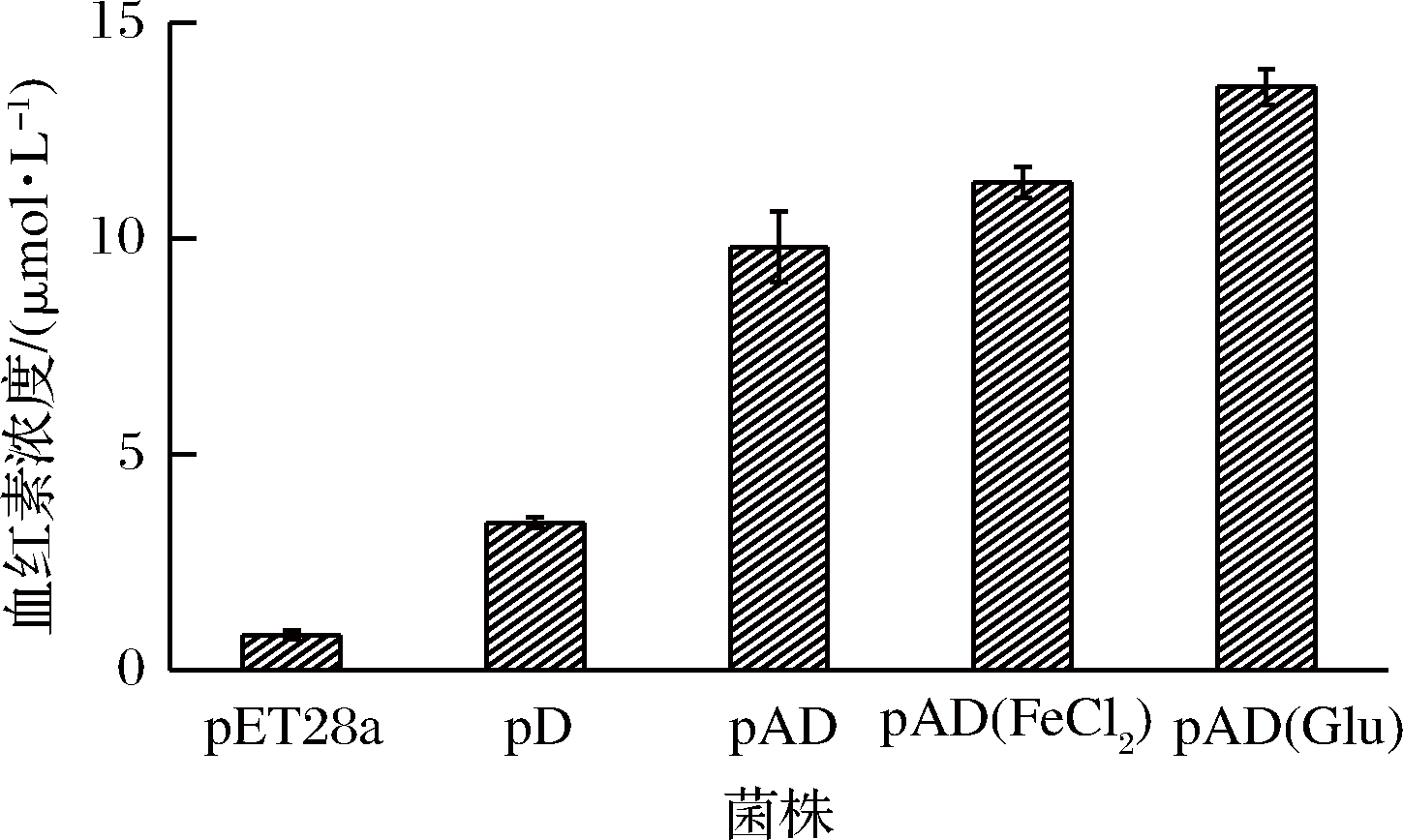
将重组菌在37 ℃、0.3 mmol/L IPTG诱导后,进行胞内血红素检测,结果如图4所示,pD菌株血红素浓度为3.4 μmol/L,而共表达菌株pAD血红素浓度明显提高,达到9.8 μmol/L,在菌株pAD培养基中外源添加20 μmol/L FeCl2(下同)、40 μmol/L谷氨酸(下同)血红素浓度进一步提高到11.3 μmol/L、13.5 μmol/L。诱导后的共表达菌株菌体棕红色加深,这可能是由于胞内血红素的积累所致。
2.4 TfuDyP的光谱吸收
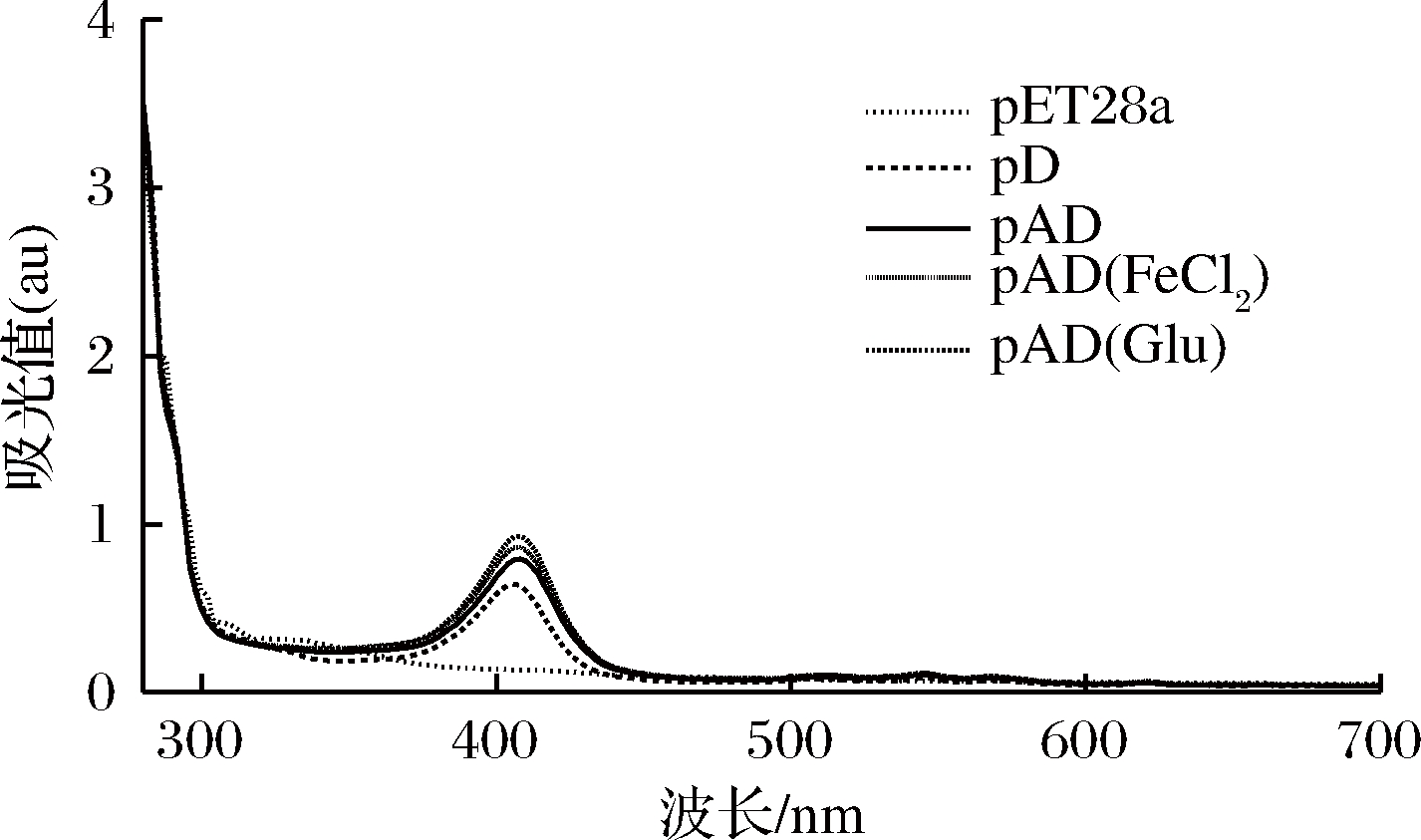
纯化后的TfuDyP溶液呈棕红色,进一步表明酶的活性位点存在着亚铁血红素基团[3]。DyP的血红素和蛋白质含量通过408 nm处(Soret峰值)和280 nm表示。Soret峰值为血红素的特征吸收峰[19],可用来表征血红素掺入TfuDyP中的水平。除包含空载质粒的菌株外,其他菌株均在408 nm处出现Soret峰值(图5)。分析此处峰值表明,与pD菌株0.637相比,共表达菌株pAD为0.794,可知将TfuDyP与hemA基因共表达,增强了DyP与辅因子血红素的结合度。此外,在pAD菌株培养基中外源添加 FeCl2、Glu分别将峰值提高至0.865、0.889,结合图4的结果,表明前体物质的加入提高了血红素辅因子的含量,最终使得酶蛋白与血红素辅因子结合度进一步增加。
2.5 TfuDyP的酶活性检测
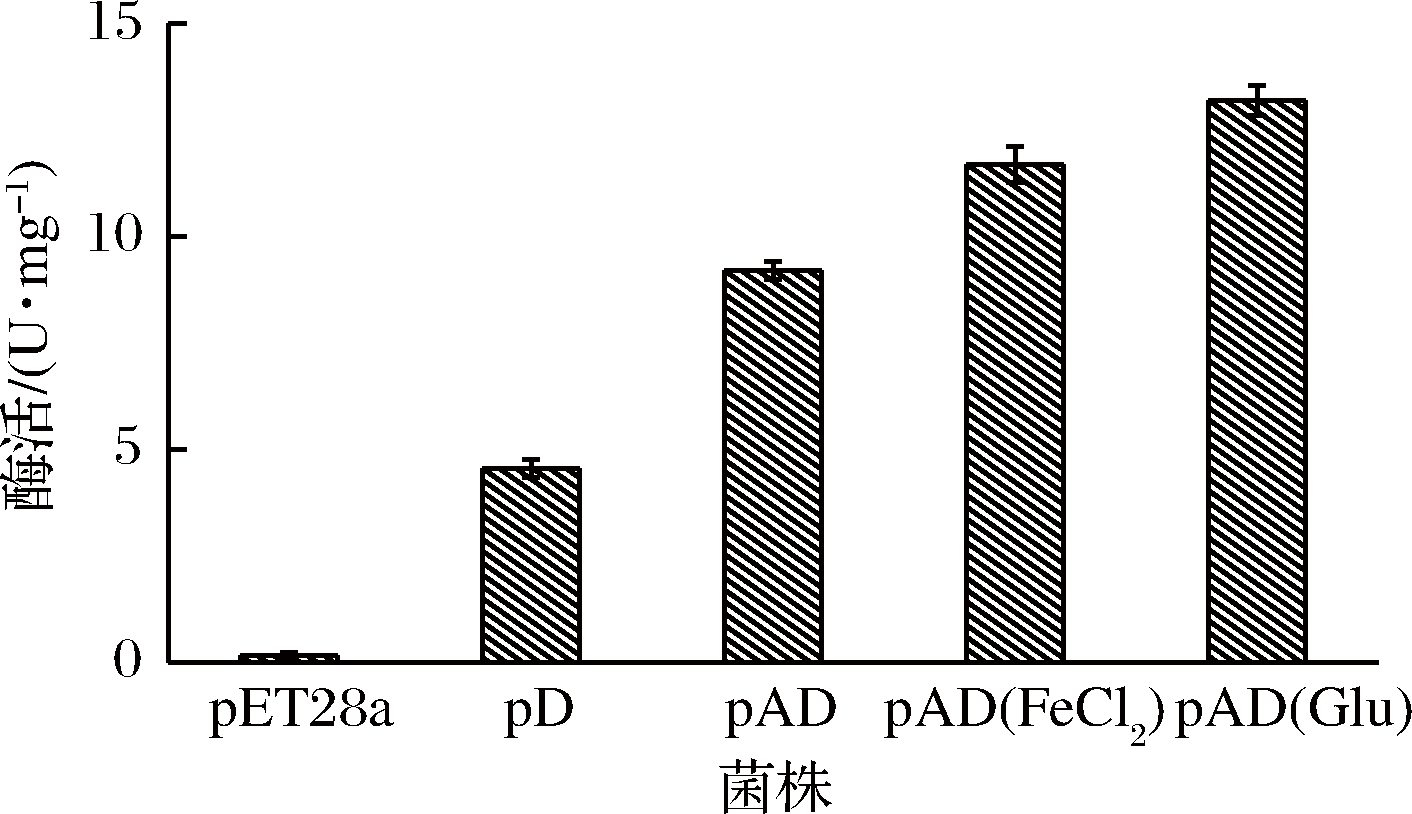
以ABTS为底物测定TfuDyP酶活性,测定结果如图6所示。单独过表达TfuDyP的菌株pD酶活为4.5 U/mg,而共表达菌株pAD酶活性达到9.2 U/mg,比原来提高110%。共表达菌株酶活力提高的原因可能归因于血红素代谢途径hemA的表达,由于胞内血红素含量提高,使得TfuDyP结合辅因子量增加[9,20]。在pAD菌株培养基中外源添加 FeCl2、Glu分别将TfuDyP的酶活提高至11.8、13.2 U/mg。结合图5的结果,表明前体物质的加入使得酶蛋白与血红素辅因子结合度增加,酶活性进一步提高,二者成正相关性。
2.6 TfuDyP对不同染料脱色活性的增强
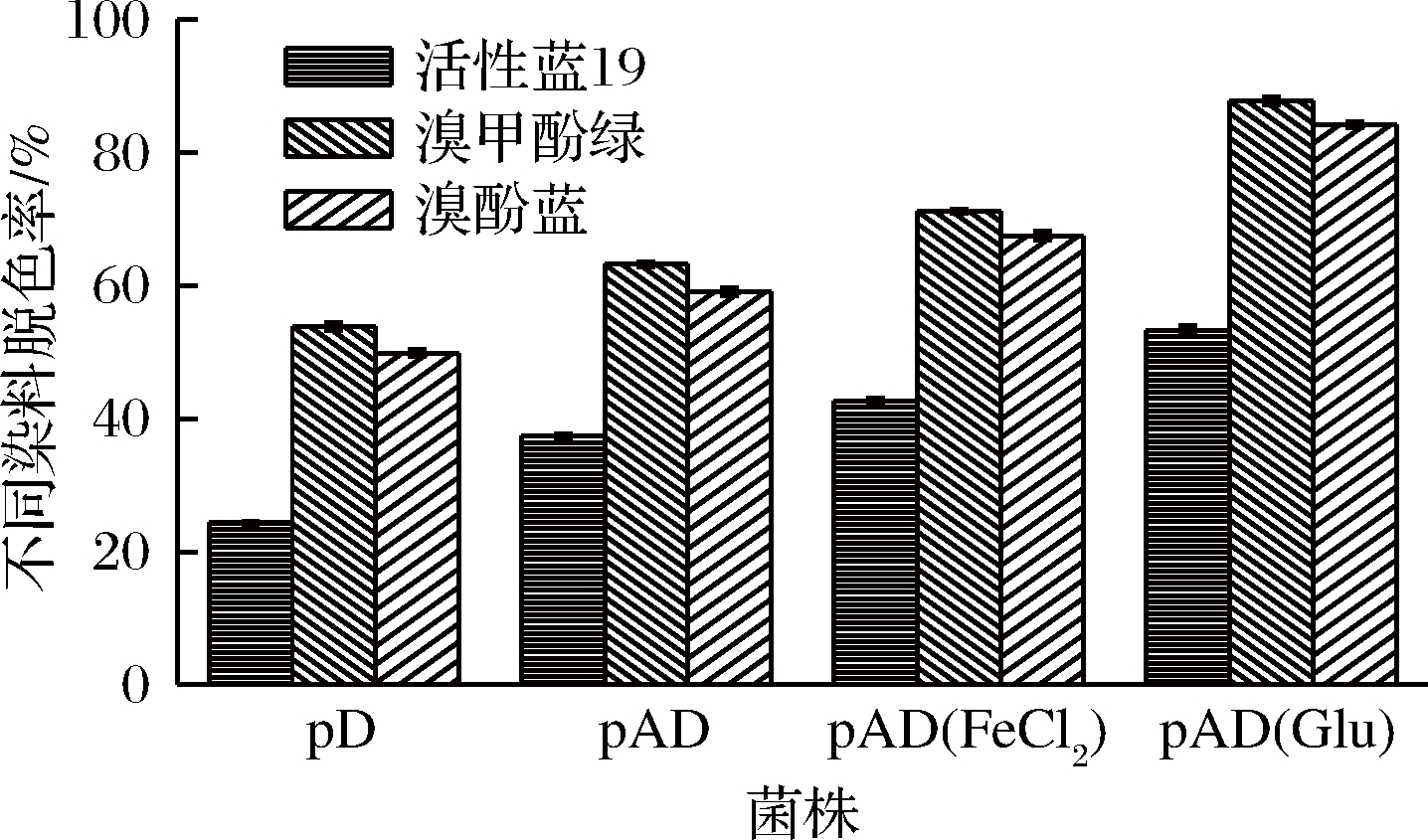
为了探究TfuDyP对不同染料溶液的降解活性是否增强,选用RB19、溴甲酚绿、溴酚蓝作为底物,进行TfuDyP的脱色测定。将不同染料与酶反应前后的溶液在280~700 nm进行扫描,反应前后不同染料溶液的吸收光谱图见图7。由图7可知,RB19、溴酚蓝、溴甲酚绿溶液分别在其最大吸收波长595、591、620 nm处的吸收峰减弱,说明染料溶液在酶的作用下存在降解。分析重组菌株对不同染料脱色率方面发现,单独表达菌株pD对RB19、溴甲酚绿、溴酚蓝脱色率分别为24.4%、53.9%、49.9%,共表达菌株pAD依次提高到37.4%、63.2%、59.1%。这表明共表达菌株在胞内血红素增加后,酶活性得到增强。此外,对pAD菌株培养基外源添加FeCl2、Glu脱色率逐步得到提高,这是可能因为外源添加血红素前提后,胞内血红素进一步积累,酶活力增强。其中,外源添加FeCl2脱色率提高到42.7%、71.2%、67.5%,添加Glu效果较好,脱色率进一步提高到53.3%、87.8%、84.2%。结果展示了这种代谢工程策略的可行性,由hemA与TfuDyP基因共表达产生的重组系统,使得TfuDyP在生物降解染料活性方面有所提高,在pAD菌株培养基中添加外源物质的前提下脱色活性也相应增强。
3 结论
染料脱色过氧化物酶(DyP)是血红素过氧化物酶家族中的新家族,以血红素为辅基,过氧化氢为电子受体,催化多种有机物[21]。在目前研究发现,DyP酶类常因胞内血红素辅因子的不足,不能形成有效的全酶形态,导致其酶催化活性较低。虽然通过外源直接添加血红素,能有效提高其催化活性,但由于成本高,不利于实现工业化应用。在大肠杆菌中,hemA基因编码的谷氨酰-tRNA还原酶能以谷氨酰-tRNA为底物,催化生成谷氨酰-1-半醛是细菌血红素合成限速步骤之一。本研究利用大肠杆菌血红素合成途径,提高内源血红素含量,增加酶蛋白与辅因子的结合,最终增强重组TfuDyP的催化活性。对不同染料溶液的脱色率方面分析,也展示出共表达后的TfuDyP与最初酶活性相比具有更好的应用性。以上研究为重组TfuDyP的研究及工业应用提供了一定的理论依据。
参考文献
[1] PASSARDI F,COSIO C,PENEL C,et al.Peroxidases have more functions than a Swiss army knife[J].Plant Cell Reports,2005,24(5):255-265.
[2] DAVIES M J,HAWKINS C L,PATTSON D I,et al.Mammalian heme peroxidases:from molecular mechanisms to health implications[J].Antioxidants & Redox Signaling,2008,10(7):1 199-1 234.
[3] 汪立群,CHANG A K,袁文杰,等.一种新的DyP-type过氧化物酶在大肠杆菌中的重组表达、纯化及鉴定[J].生物工程学报,2013,29(6):772-784.
[4] COLPA D I,FRAAIJE M W,VANBLOOIS E.DyP-type peroxidases:A promising and versatile class of enzymes[J].Journal of Industrial Microbiology & Biotechnology,2014,41(1):1-7.
[5] RAMZI A B,HYEON J E,HAN S O.Improved catalytic activities of a dye-decolorizing peroxidase (DyP) by overexpression of ALA and heme biosynthesis genes in Escherichia coli[J].Process Biochemistry,2015,50(8):1 272-1 276.
[6] SANTOS A,MENDES S,BRISSOS V,et al.New dye-decolorizing peroxidases from Bacillus subtilis,and Pseudomonas putida,MET94:Towards biotechnological applications[J]. Applied Microbiology & Biotechnology, 2013,98(5):2 053-2 065.
[7] COUTO S R,HERRERA J L T.Industrial and biotechnological applications of laccases:A review[J].Biotechnology Advances,2006,24(5):500-513.
[8] GRAVES P E,HENDERSON D P,HORSTMAN M J,et al.Enhancing stability and expression of recombinant human hemoglobin in E. coli:Progress in the development of a recombinant HBOC source[J].Biochimica et Biophysica Acta,2008,1 784(10):1 471-1 479.
[9] 李芳芳.大肠杆菌血红素合成途径的改造与调控对5-氨基乙酰丙酸积累和菌体代谢的影响[D].济南:山东大学,2014.
[10] 陈丹园,沈云杰,杨燕,等.关键酶基因的过表达与环境因素对大肠杆菌血红素合成的调控[J].食品与发酵工业,2018,44(11):7-14.
[11] PRANAWIDJAJA S,CHOI S,LAY B W,et al.Analysis of heme biosynthetic pathways in a recombinant 3 Escherichia coli[J].Journal of Microbiology Biotechnology,2014,25(6):880-886.
[12] RAMZIA B,HYEON J E,KIM S W,et al.5-aminolevulinic acid production in engineered Corynebacterium glutamicum via C5 biosynthesis pathway[J].Enzyme and Microbial Technology,2015,81:1-7.
[13] OGOLA H J O,KAMIIKE T,HASHIMOTO N,et al.Molecular characterization of a novel peroxidase from the Ccyanobacterium Anabaena sp.Strain PCC 7120[J].Applied and Environmental Microbiology,2009,75(23):7 509-7 518.
[14] VANBLOOIS E,PAZMI UDET,WINTER R T,et al.A robust and extracellular heme-containing peroxidase from Thermobifida fuscaas prototype of a bacterial peroxidase superfamily[J].Applied Microbiology and Biotechnology,2010,86(5):1 419-1 430.
UDET,WINTER R T,et al.A robust and extracellular heme-containing peroxidase from Thermobifida fuscaas prototype of a bacterial peroxidase superfamily[J].Applied Microbiology and Biotechnology,2010,86(5):1 419-1 430.
[15] ROBERTS J N,SINGH R,GRIGG J C,et al.Characterization of dye-decolorizing peroxidases from Rhodococcus jostii RHA1[J]. Biochemistry,2011,50(23):5 108-5 919.
[16] 林俊芳,刘志明,陈晓阳等.真菌漆酶的酶活测定方法评价[J].生物加工过程,2009,7(4):1-8.
[17] DICKO M H,GRUPPEN H,HILHORST R,et al.Biochemical characterization of the major sorghum grain peroxidase[J].The FEBS Journal,2006,273(10):2 293-2 307.
[18] CHANWUN T,MUHAMAD N,CHIRAPONGSATONKUL N,et al. Hevea brasiliensis cell suspension peroxidase:Purification,characterization and application for dye decolorization[J].AMB Express,2013,3(1):14.
[19] ZUBIETA C,KRISHNA S S,KAPOOR M,et al.Crystal structures of two novel dye-decolorizing peroxidases reveal a β-barrel fold with a conserved heme-binding motif[J].Proteins Structure Function and Bioinformatics,2007,69(2):223-233.
[20] COLPA D I,FRAAIJE M W.High overexpression of dye decolorizing peroxidase TfuDyP leads to the incorporation of heme precursor protoporphyrin IX[J].Journal of Molecular Catalysis B Enzymatic,2016,134:372-377.
[21] 朱竹兵,孙亚武,唐蕾.褐色嗜热裂孢菌脱色过氧化物酶的表达及发酵条件优化[J].食品与发酵工业, 2019,45(13):23-30.



 UDET,WINTER R T,et al.A robust and extracellular heme-containing peroxidase from
UDET,WINTER R T,et al.A robust and extracellular heme-containing peroxidase from