表1 脱脂蚕豆粉液态发酵条件
Table 1 Liquid fermentation conditions of defatted broad
bean powder
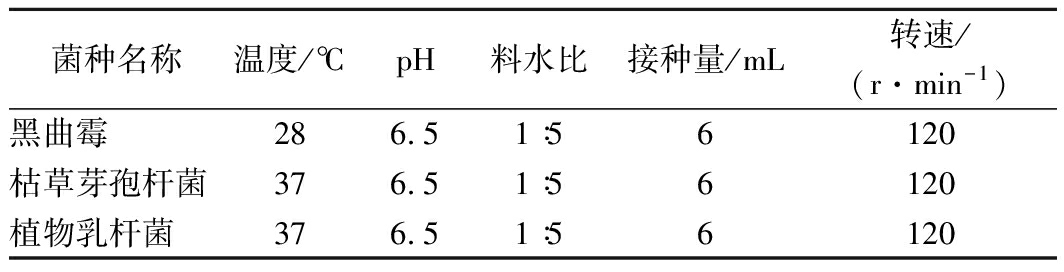
菌种名称温度/℃pH料水比接种量/mL转速/(r·min-1)黑曲霉286.51∶56120枯草芽孢杆菌376.51∶56120植物乳杆菌376.51∶56120
蚕豆(Vicia Faba L.),又名胡豆,罗汉豆等,一年生草本植物。我国作为最大的蚕豆种植国,在甘肃、青海、云南等地均有分布,青海省主要分布于门源县、湟中县、大通县、共和县、互助县等灌溉农业区[1]。蚕豆作为青海传统农作物,由于青海阳光日照时间长,昼夜温差大,生产的蚕豆以粒大虫少、颗粒饱满[2]。蚕豆中存在多种生物活性物质,具有提高人体免疫力、抗癌、降血压、抗氧化等作用[3-5],因此蚕豆具有较高的营养价值及保健功能[6-7]。
蚕豆蛋白作为一种植物蛋白,其含量可达25%~30%[8],仅次于大豆,是良好的蛋白质营养源,可预防脑溢血、糖尿病以及动脉粥样化等疾病[9]。在埃及和摩洛哥人们将蚕豆作为蛋白质的重要来源,伊朗人们将其作为物美价廉的儿童高蛋白食品[10]。而对于大分子植物蛋白而言,提高其营养价值及吸收率最佳的方法是发酵,研究表明,发酵豆制品的抗氧化活性明显高于非发酵制品[11]。发酵法利用微生物分泌的蛋白酶水解蛋白质,能够优化每一种植物源的质构和营养成分组成,促进健康发酵植物基发展,植物蛋白的营养价值及生物活性明显提升。
发酵植物蛋白及发酵植物基也是目前获得新型食品源的重要手段[12-14]。但是植物微生物发酵法存在某些不足之处,如微生物发酵及代谢过程复杂,目前微生物自身的复合酶系的作用机理尚未完全揭示,产物难以控制,另外,发酵体系中的原辅料成分较多,造成产物的分离纯化较为困难等问题,未来可考虑研发精确发酵控制技术,精简发酵过程,从而实现高效、精确制备。本试验目的在于考察几种微生物对蚕豆籽液态发酵后的营养成分及功能特性变化,以期为后续精准化发酵制备活性多肽及精准制备高营养蚕豆粉奠定基础研究数据。本研究采用植物乳杆菌,枯草芽孢杆菌,黑曲霉对青海当地蚕豆果实进行液态发酵,对发酵前后脱脂蚕豆粉中理化性质指标及功能特性予以比较,同时就脱脂蚕豆粉发酵液对体外自由基清除能力予以探讨,挑选出最适宜蚕豆粉液态发酵的菌种,以期提高青海农牧产品高值化利用及其综合利用。
1.1.1 材料与试剂
蚕豆,产自青海西宁;福林酚试剂,北京索莱宝科技有限公司;1.1-二苯基-2-苦基肼/DPPH,南京奥多福尼生物科技有限公司;ABTS,北京酷尔化学科技有限公司;琼脂、葡萄糖、马铃薯、双缩脲试剂、考马斯亮蓝G-250、标准牛血清白蛋白、酪氨酸标准品、三氯乙酸、氯仿,天津市河东区红岩试剂厂;MRS肉汤,北京澳博星生物科技有限责任公司;营养肉汤,青岛高科技工业园海博生物技术有限公司;黑曲霉、枯草芽孢杆菌,中国工业微生物菌种保藏中心;植物乳杆菌,中国农业微生物菌种保藏中心。
1.1.2 仪器与设备
HH-4S型数显恒温水浴锅,江苏省金坛市友联仪器研究所;KC-130型小型粉碎机,北京开创同和科技发展有限公司;UV-2600型紫外可见分光光度计,岛津企业管理有限公司;101-3AB型烘箱,北京中兴伟业仪器有限公司;H/T16MM型台式高速离心机,湖南赫西仪器装备有限公司;YM-75型立式压力蒸汽灭菌锅,上海三申医疗机械有限公司。
1.2.1 脱脂蚕豆粉的制备
准确称取干蚕豆粉100 g于500 mL的锥形瓶中,加入300 mL石油醚,在40℃条件下水浴3 h,过滤后重复2次,在室温下晾至石油醚挥发完,即得脱脂蚕豆粉。
1.2.2 菌种活化与扩大培养及发酵菌液制备
1.2.2.1 菌种活化
将枯草芽孢杆菌、黑曲霉菌和植物乳杆菌参考张鹏飞[12]的方法进行活化。
1.2.2.2 发酵菌液制备
将扩大培养的1 mL菌液接种于相应液体培养基中,在相应最适条件下,按照测得的菌种生长对数期时间培养,制成发酵菌液。
1.2.3 液态发酵脱脂蚕豆粉
称取脱脂蚕豆粉20 g于锥形瓶中,加65℃左右的灭菌蒸馏水100 mL,搅拌均匀,采用紫外灯照射30 min后,加入6 mL已培养好的发酵菌液,按表1所示条件进行48 h发酵后取样,存于冰箱。
表1 脱脂蚕豆粉液态发酵条件
Table 1 Liquid fermentation conditions of defatted broad
bean powder

菌种名称温度/℃pH料水比接种量/mL转速/(r·min-1)黑曲霉286.51∶56120枯草芽孢杆菌376.51∶56120植物乳杆菌376.51∶56120
1.2.4 液态发酵前后营养价值相关指标测定
1.2.4.1 可溶性蛋白含量测定
采用考马斯亮蓝法测定可溶性蛋白质的含量[15]。
1.2.4.2 粗蛋白和酸溶蛋白测定
参照GB/T 6432—2018用凯氏定氮法测定粗蛋白含量;参照GB/T 22492—2008测定酸溶蛋白质含量。
1.2.4.3 多肽含量测定
参考陈学红等[16]的方法并稍作修改,测定发酵液中多肽含量。
1.2.4.4 发酵前后脱脂蚕豆粉中氨基酸含量测定
氨基酸含量用氨基酸自动分析仪测定,按国标GB/T 5009.124—2003进行测定。
1.2.4.5 蛋白酶活性的测定
采用福林酚法测定发酵液中蛋白酶活[17]。
1.2.5 发酵前后蚕豆蛋白抗氧化活性比较
1.2.5.1 ABTS自由基清除率的测定
将发酵液中可溶性蛋白的浓度配置成:10.5、21、42、84、168 μg/mL,利用ABTS法[18]测定发酵液中蛋白清除ABTS自由基的能力(公式(1))。
ABTS自由基清除率![]()
(1)
式中:Ac为乙醇代替样品溶液测定的吸光值;As为样品加ABTS后测定的吸光值。
1.2.5.2 DPPH自由基清除率的测定
参考王毕妮等[19]的方法,并略作修改,将发酵液中可溶性蛋白的质量浓度配置成:10.5、21、42、84、168 μg/mL,取DPPH溶液2 mL加入不同蛋白浓度的发酵液各4 mL,放置1 h后测定517 nm处的吸光度值。测定发酵液中蛋白清除DPPH自由基的能力(公式(2))。
DPPH自由基清除率![]()
(2)
式中:Ac为DPPH溶液测定的吸光值;As为样品加DPPH后测定的吸光值。
1.2.6 液态发酵前后功能特性相关指标测定
1.2.6.1 蛋白粉起泡性与泡沫稳定性的测定
参考李雪琴等[20]的方法测定蛋白粉起泡性及泡沫稳定性。
1.2.6.2 蛋白粉吸水性和吸油性的测定
参考李静娟等[21]的方法测定蛋白粉吸水性及吸油性。
1.2.6.3 蛋白粉持水性和持油性的测定
参考李述刚[22]的方法测定蛋白粉持水性和持油性。
1.2.7 试验数据分析
所有的试验数据均表示为![]() 采用SPSS 21.0软件进行单因素方差分析,以P<0.05表示显著性差异,P<0.01表示极显著性差异。
采用SPSS 21.0软件进行单因素方差分析,以P<0.05表示显著性差异,P<0.01表示极显著性差异。
本试验采用比浊法,分别测定了黑曲霉,枯草芽孢杆菌和植物乳杆菌种子液中的菌体浓度,绘制生长曲线。由图1可知,枯草芽孢杆菌(图1-A),黑曲霉(图1-B),植物乳杆菌(图1-C)的对数期分别为2~8 h,8~16 h,10~16 h,所以种子液接入蚕豆粉中的最佳培养时间为8、16和16 h,此时为各菌种发酵液最佳接种时间。
2.2.1 不同微生物发酵前后多肽含量变化结果与分析
不同微生物发酵前后多肽含量变化试验结果如图2所示。未发酵脱脂蚕豆粉中含有一定含量的多肽。在油脂天然提取产物中,含有一定量的蛋白质,推测前期对蚕豆粉进行脱脂处理,在一定温度下采用石油醚进行脱脂操作可能使蚕豆粉中与油脂所结合部分蛋白质发生降解及分离,所以,在脱脂蚕豆粉中含有一定量的多肽成分。其次,由图2可知,经微生物发酵后蚕豆粉多肽含量均有一定量的增加;并且不同菌种发酵后多肽含量有所不同,其中植物乳杆菌最为明显(P<0.05),多肽得率达到1.46%,与未处理的蚕豆粉相比,其增幅高达71.65%(P<0.01),效果极其明显。因此,通过微生物的液态发酵可提高蚕豆蛋白发酵液的多肽得率,促进蛋白的消化吸收,提高其营养价值。
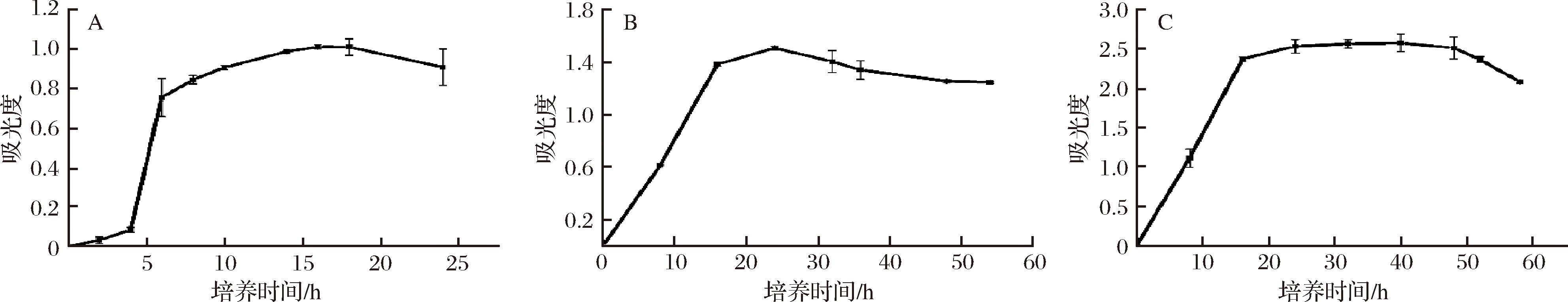
A-枯草芽孢杆菌;B-黑曲霉;C-植物乳杆菌
图1 生长曲线(X±SD, n=3)
Fig.1 The growth curve

图2 不同微生物发酵前后的肽含量变化
Fig.2 The change of peptide content before and after
fermentation by differert microoganisms
经过48 h的发酵后,枯草芽孢杆菌和植物乳杆菌作为细菌会处于延滞期或者衰亡期,产生并积累大量的次级代谢产物,如淀粉酶,蛋白酶,纤维素酶、脂肪酶、果胶酶等[23],这些次级产物将进一步将蚕豆蛋白进行分解为小分子的蚕豆多肽和游离的氨基酸,从而导致氨基酸和多肽积累,但黑曲霉作为霉菌生长缓慢,可能还未到达其积累次级代谢产物的最佳时间,因而试验结果显示,经植物乳杆菌发酵后发酵液中多肽得率显著提高(P<0.05),增幅达到了71.65%,并且高于枯草芽孢杆菌和黑曲霉。
2.2.2 不同微生物发酵前后粗蛋白与酸溶蛋白变化结果与分析
从表2可知,经过3种不同菌种发酵后,脱脂蚕豆粉中粗蛋白含量均显著下降(P<0.05),并且植物乳杆菌发酵后的蚕豆粉中粗蛋白含量明显低于黑曲霉和枯草芽孢杆菌(P<0.05);酸溶蛋白含量均显著提高(P<0.01),其中以黑曲霉的变化最为显著,酸溶蛋白增加65.06%。
表2 不同微生物发酵前后粗蛋白与酸溶蛋白
变化结果与分析 单位:%(相对百分含量)
Table 2 Comparison results and analysis of different
extraction solvents

样品未处理植物乳杆菌黑曲霉枯草芽孢杆菌粗蛋白29.86±1.00a20.56±0.65b22.75±0.47c22.66±1.22cd酸溶蛋白4.34±0.20a11.48±0.21b12.41±0.19c8.44±0.23d
注:同行数据中小写字母不同表示差异显著(*P<0.05)
在本试验的发酵过程中,菌种在生长和繁殖过程中需要利用脱脂蚕豆粉中的所含的营养物质作为自身生长的营养来源,发酵后脱脂蚕豆粉中的粗蛋白含量减少,但由于菌种的自身差异导致各菌种的生长代谢能力、对脱脂蚕豆粉的适应和利用能力不同,经过不同菌种发酵后发酵产物中粗蛋白也存在差异,如植物乳杆菌相对于枯草芽孢杆菌和黑曲霉,其粗蛋白含量下降幅度较大,且下降幅度明显大于枯草芽孢杆菌和黑曲霉(P<0.05),其原因可能是植物乳杆菌的生长繁殖能力较强,降解大分子蛋白质的速度较快,并且经过48 h的发酵后,在发酵后期产生了一定的反馈抑制,从而导致植物乳杆菌的粗蛋白显著少于黑曲霉。
本试验结果显示经3种不同微生物液态发酵后,脱脂蚕豆粉中酸溶蛋白黑曲霉显著高于枯草芽孢杆菌(P<0.05),枯草芽孢杆菌高于植物乳杆菌(P<0.05)。此结果与发酵液中多肽得率结果并不一致。可能是不同的微生物在生长繁殖过程中产生的蛋白酶种类不同,蚕豆蛋白被剪切的位置以及剪切的程度不同,使得不同微生物发酵后,生成的游离氨基酸种类不同,而氨基酸会因为R基的不同,水溶性也不同。
2.2.3 不同微生物发酵前后蚕豆粉中必需氨基酸评价
脱脂蚕豆粉经3种不同菌种48 h发酵后,其必需氨基酸测定结果如表3所示。脱脂蚕豆粉共检出17种氨基酸,其中除色氨酸缺失外,包含人体所需的其他7种必需氨基酸,氨基酸总量(total amino acid,TAA)达到30.27%,必需氨基酸含量(esenital amino acid,EAA)高达9.69%,占氨基酸总含量的34.01%。脱脂蚕豆粉中谷氨酸(Glu)的含量显著高于其他氨基酸,达到了5.99%。此外,经过枯草芽孢杆菌、黑曲霉及植物乳杆菌3种不同的微生物发酵后,各种氨基酸的含量均发生了显著性变化(P<0.01),与未发酵的脱脂蚕豆粉相比,经植物乳杆菌发酵后,精氨酸(Arg)、脯氨酸(Pro)、胱氨酸(Cys)、异亮氨酸(Ile)的含量的变化最大,其中胱氨酸(Cys)和异亮氨酸(Ile)的含量是未经发酵的脱脂蚕豆粉中相应氨基酸的 2.6倍(P<0.01)和 2.5倍(P<0.01),精氨酸(Arg)和脯氨酸(Pro)的含量分别提高了80%(P<0.01)和90%(P<0.01);经黑曲霉发酵后,胱氨酸(Cys)含量是未经发酵的脱脂蚕豆粉的6.4倍。分析经不同微生物液态发酵后氨基酸组成发生较大差异的原因,可能是不同的微生物在生长繁殖过程中产生的蛋白酶种类不同,蚕豆蛋白被剪切的位置以及剪切的程度不同,使得不同的微生物发酵后,生成的游离氨基酸种类不同[24-25]。
现代营养学者研究认为[26],氨基酸不足和过剩都会影响蛋白质的营养价值。依据WHO/FAO提出的氨基酸平衡理论,计算得出样品中EAA含量和(amino acid acroe,AAS),结果如表4所示。与WHO/FAO推荐的人体必需氨基酸相比,除色氨酸之外,其余必需氨基酸含量相互较为平衡,尤其经不同微生物发酵后,各类氨基酸的EAA和AAS值都不同程度得到提升,并且更加符合必需氨基酸模式。此外,脱脂蚕豆粉中含有大多数谷类蛋白质中所缺乏的限制性氨基酸—赖氨酸,尤其经黑曲霉发酵后,其赖氨酸AAS评分高达114.68,较未处理组呈现显著性差异(P<0.05)。因此通过微生物发酵后可以有效提高蛋白质的吸收利用率和应用价值。
表3 不同微生物发酵前后必需氨基酸含量结果 单位:%
Table 3 Results of essential amino acids before
and after fermentation by different microoganisms

名称脱脂蚕豆粉枯草芽孢杆菌黑曲霉植物乳杆菌天冬氨酸(Asp)3.458±0.0142.099±0.099∗∗4.257±0.027∗∗3.816±0.027∗∗苏氨酸(Thr)2.301±0.0033.041±0.04∗∗2.006±0.006∗∗3.107±0.007∗∗丝氨酸(Ser)1.222±0.1962.604±0.014∗∗2.098±0.002∗∗1.876±0.01∗∗谷氨酸(Glu)5.985±0.0978.091±0.091∗∗9.204±0.006∗∗6.749±0.048∗∗甘氨酸(Gly)0.89±0.1000.786±0.028∗0.234±0.006∗∗0.665±0.004∗∗丙氨酸(Ala)1.677±0.0550.187±0.010∗∗3.95±0.060∗∗1.207±0.008∗∗胱氨酸(Cys)0.801±0.0112.341±0.040∗∗5.125±0.013∗∗2.101±0.003∗∗缬氨酸(Val)1.864±0.0103.11±0.110∗∗2.618±0.020∗∗2.113±0.010∗∗蛋氨酸(Met)0.195±0.0030.569±0.024∗∗0.452±0.022∗∗0.316±0.018∗∗异亮氨酸(Ile)0.799±0.0111.879±0.003∗∗1.926±0.038∗∗2.014±0.014∗∗亮氨酸(Leu)1.867±0.0073.096±0.008∗∗3.356±0.019∗∗2.684±0.025∗∗酪氨酸(Tyr)0.74±0.0512.153±0.013∗∗1.949±0.037∗∗1.334±0.010∗∗苯丙氨酸(Phe)1.054±0.0222.077±0.0170∗∗1.783±0.083∗∗1.092±0.004组氨酸(His)0.752±0.0091.344±0.020∗∗1.206±0.050∗∗1.067±0.008∗∗赖氨酸(Lys)1.611±0.5552.786±0.006∗∗3.493±0.004∗∗2.018±0.002精氨酸(Arg)2.641±0.0025.404±0.304∗∗6.091±0.003∗∗4.202±0.013∗∗脯氨酸(Pro)2.41±0.0202.655±0.015∗∗5.63±0.140∗∗4.712±0.012∗∗氨基酸总量(TAA)30.26744.22255.37841.073
注:与未处理比较,*表示P<0.05,**表示P<0.01
表4 发酵前后必需氨基酸组成与WHO/FAO建议值的对比
Table 4 Comparison of essential amino acid composition before and after fermentation with recommended
values of WHO/FAO
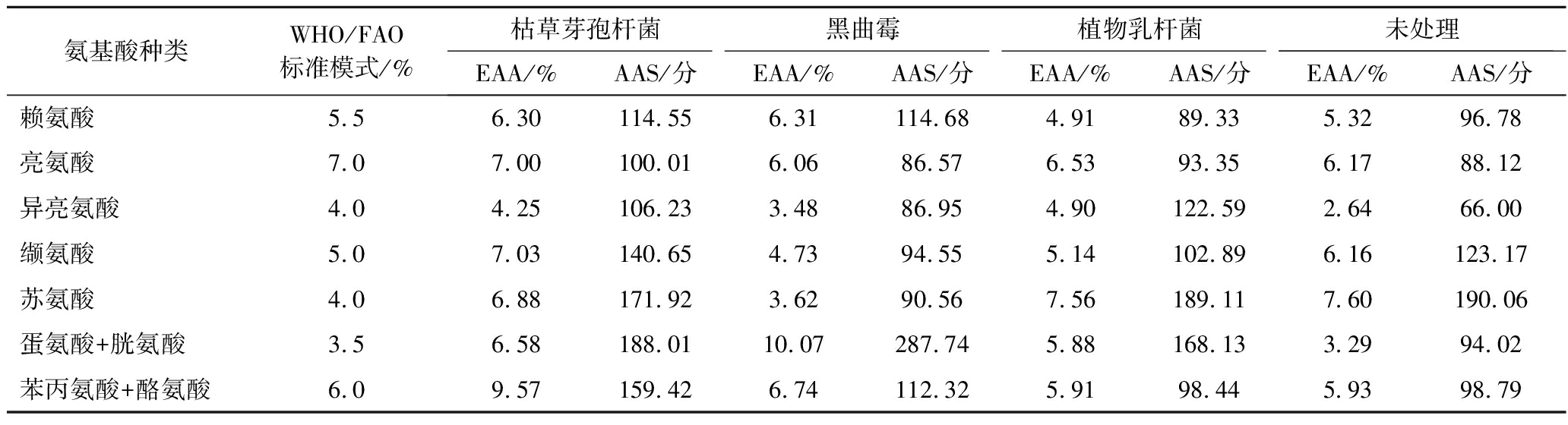
氨基酸种类WHO/FAO标准模式/%枯草芽孢杆菌黑曲霉植物乳杆菌未处理EAA/%AAS/分EAA/%AAS/分EAA/%AAS/分EAA/%AAS/分赖氨酸5.56.30114.556.31114.684.9189.335.3296.78亮氨酸7.07.00100.016.0686.576.5393.356.1788.12异亮氨酸4.04.25106.233.4886.954.90122.592.6466.00缬氨酸5.07.03140.654.7394.555.14102.896.16123.17苏氨酸4.06.88171.923.6290.567.56189.117.60190.06蛋氨酸+胱氨酸3.56.58188.0110.07287.745.88168.133.2994.02苯丙氨酸+酪氨酸6.09.57159.426.74112.325.9198.445.9398.79
2.2.4 不同微生物发酵后蛋白酶活力变化
由于不同微生物在发酵过程中产生的酶不尽相同,不同微生物发酵后蛋白酶活力变化结果见表5。从表5中可知,在相同条件下,3种微生物对脱脂蚕豆粉进行液态发酵,都能产生一定量的蛋白酶,且具有良好的降解蚕豆蛋白质的作用,酶活力大小依次为:枯草芽孢杆菌<黑曲霉<植物乳杆菌。说明在相同的条件下发酵,相等的时间内植物乳杆菌将分解更多的脱脂蚕豆粉。
表5 不同微生物发酵后蛋白酶活力测定
Table 5 Protease activity by fermentation of different

测定指标植物乳杆菌黑曲霉枯草芽孢杆菌中性酸性中性碱性吸光度0.3840.1890.0830.079酶活/(U·g-1)171.87±0.00484.59±0.00937.15±0.00435.21±004
对于蛋白质生物大分子而言,许多具有抗氧化性氨基酸和疏水性氨基酸被包埋与内部,无法起到抗氧化的作用,但是通过微生物的发酵可将其中的氨基酸暴露出来,从而起到抗氧化的作用。所以本次试验用ABTS自由基、DPPH自由基清除率来评价不同微生物发酵后发酵液的体外抗氧化活性。
2.3.1 ABTS自由基清除率的评价
比较3种微生物发酵后制得蚕豆肽对ABTS自由基清除率的差异,如图3所示,试验结果表明,经3种微生物发酵后的发酵液对ABTS自由基的清除率均有提高,且不同菌种对ABTS清除率的影响不同(P<0.05),在蛋白质量浓度高于41.9 ug/mL时,对于ABTS的抑制率都显著提升。经黑曲霉液态发酵后的发酵液对于ABTS自由基的抑制率与枯草芽孢杆菌相近,抑制率分别可达87.89%与87.65%,且都明显高于未发酵的蚕豆粉水溶液(P<0.05)。

图3 不同微生物发酵液对ABTS清除率对比图
Fig.3 Comparison of the removal rate of ABTS by different
microoganisms
2.3.2 DPPH自由基清除率的评价
比较3种微生物发酵后制得蚕豆肽对DPPH自由基清除率的差异(图4),蚕豆多肽对DPPH自由基亦有较强的清除作用。经3种微生物发酵后的发酵液对于DPPH的清除率均不同程度提高。但不同微生物对DPPH清除率的影响不同,其中黑曲霉发酵液的清除能力明显低于枯草芽孢杆菌(P<0.01)和植物乳杆菌(P<0.05);在蛋白质量浓度高于41.9 μg/mL时,植物乳杆菌发酵液的清除率最高,达到85.46%。

图4 不同微生物发酵液对DPPH清除率对比图
Fig.4 Comparison of the removal rate of DPPH by different
microoganisms
2.4.1 蛋白粉起泡性与泡沫稳定性的测定结果
蚕豆粉起泡性与泡沫稳定性试验结果如图5所示。经不同微生物发酵后蛋白粉的起泡性都呈现增长的趋势,起泡性大小表现为:黑曲霉>枯草芽孢杆菌>植物乳杆菌,经黑曲霉发酵后蚕豆粉的起泡性显著增强,并且泡沫稳定性也较强于其他菌种样品。

图5 蚕豆蛋白起泡性与泡沫稳定性
Fig.5 The foamability and stability of broad bean protein
2.4.2 蛋白粉吸水性和吸油性的测定结果
如图6所示,样品经发酵后吸水性有较小幅度的增长,显著性检验中,其吸水性之间无显著性差异。但蚕豆蛋白质吸油性检验中,不同微生物发酵后吸油性存在显著的差异(P<0.05)。发酵后样品吸油性均有增长,植物乳杆菌发酵后吸油性最好。

图6 蚕豆蛋白吸水性与吸油性
Fig.6 The water and oil absorbing capacity of
broad bean protein
2.4.3 蛋白粉持水性和持油性的测定结果
如图7所示,样品经发酵后持水性有较小幅度的增长,但显著性检验中,其持水性之间无显著性差异。蚕豆蛋白质持油性检验中,不同微生物发酵后持油性存在显著性差异(P<0.05)。发酵后样品持油性均有增长,植物乳杆菌发酵后持油性最好,说明所选植物乳杆菌发酵有助于提高蚕豆蛋白的持油性。

图7 蚕豆蛋白粉持水性与持油性
Fig.7 The water and oil holding capacity of broad
bean protein
本文通过植物乳杆菌,枯草芽孢杆菌以及黑曲霉对脱脂蚕豆粉进行液态发酵,研究表明经不同微生物液态发酵后,蚕豆粉多肽得率、蛋白酶活力、酸溶蛋白、氨基酸含量均呈现不同程度提高,作用效果依次为黑曲霉>枯草芽孢杆菌>植物乳杆菌,且经发酵后,蚕豆粉对于ABTS自由基、DPPH自由基清除显著增强。此外,经微生物液态发酵后蚕豆粉的功能特性也得到了一定程度提升,其中尤以植物乳杆菌发酵后蚕豆粉吸水性、吸油性、持水性和持油性的提升最为明显,因此,通过微生物液态发酵可以显著提高蚕豆粉的营养价值及功能特性,具有很好的开发前景。
[1] 王吉福, 胡英忠. 青海蚕豆发展现状及技术对策探讨[J]. 农业科技通讯, 2017(10): 20-21.
[2] 柴国贤, 吴妍雯. 青海蚕豆:世界上最好的蚕豆[J]. 中国检验检疫, 2013(6): 51-52.
[3] LI Y, JIAO A, LI J, et al. Effect of extrusion pretreatment on the physical and chemical properties of broad bean and its relationship to koji preparation[J]. Food Chemistry, 2019, 286: 38-42.
[4] AI Y, CICHY K A, HARTE J B, et al. Effects of extrusion cooking on the chemical composition and functional properties of dry common bean powders[J]. Food Chemistry, 2016, 211: 538-45.
[5] TAZRART K, ZAIDI F, SALVADOR A, et al. Effect of broad bean (Vicia faba) addition on starch properties and texture of dry and fresh pasta[J]. Food Chemistry, 2019, 278: 476-481.
[6] 郑敏, 欧阳, 黄强. 蚕豆蛋白质的营养价值及利用分析[J]. 现代食品, 2017(20): 26-27.
[7] 李爱萍, 郑开斌, 蔡宣梅. 蚕豆的利用价值[J]. 粮油食品科技, 2001(4): 45-46.
[8] 李雪琴, 苗笑亮, 裘爱泳. 蚕豆蛋白的提取分离及相对分子质量的测定[J]. 无锡轻工大学学报(食品与生物技术), 2003,22(6): 71-74.
[9] 王煜祥, 毕良田. 青海蚕豆前景广阔[J]. 中国食粮经济, 2003(2): 41-41.
[10] 方唯微, 马永焕, 丘相国, 等. 蚕豆蛋白质的营养价值及其综合利用的研究[J]. 南昌大学学报, 1994,16(2): 11-13.
[11] 吴非, 刘丽平, 曾婷. 发酵豆制品的抗氧化活性研究[J]. 食品与发酵工业, 2008, 34(11): 53-56.
[12] 张鹏飞. 不同微生物液态发酵对大豆蛋白营养价值影响的研究[D]. 长春:吉林农业大学, 2013.
[13] 李慧娟, 孙云鹏, 丁鹏程, 等. 混合菌固态发酵豆粕制备大豆活性肽[J]. 食品与发酵工业, 2014, 40(11): 121-126.
[14] 秦卫东, 陈学红, 马利华, 等. 黑曲霉发酵豆粕制备抗氧化肽研究[J]. 食品科学, 2010, 31(23): 289-293.
[15] 张永芳, 原媛. 微波萃取-考马斯亮蓝法提取大豆蛋白的工艺研究[J]. 食品工业, 2018, 39(9): 44-48.
[16] 陈学红, 秦卫东, 马利华, 等. 微生物发酵法制备芝麻蛋白肽的研究[J]. 食品工业科技, 2010, 31(6): 237-238;241.
[17] 周景祥, 王桂芹, 余涛. 蛋白酶和淀粉酶活性检测方法探讨[J]. 中国饲料, 2001(11): 23-24.
[18] RE R, PELLERGINI N, PROTEGGENTE A, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology and Medicine, 1999, 26(9-10): 1 231-1 237.
[19] 王毕妮, 曹炜, 高慧, 等. 红枣酱的体外抗氧化作用[J]. 食品与发酵工业, 2012, 38(7): 128-131.
[20] 李雪琴, 苗笑亮, 裘爱泳. 蚕豆分离蛋白的制备及其功能性质研究[J]. 粮食与饲料工业, 2003(5): 41-43.
[21] 李静娟, 易建华, 朱振宝, 等. 桃仁蛋白与大豆分离蛋白功能特性比较[J]. 食品与发酵工业, 2010, 36(12): 100-104.
[22] 李述刚. 新疆扁桃核仁蛋白质及其加工功能特性研究[D]. 武汉:华中农业大学, 2017.
[23] 黄青云. 畜牧微生物学[M]. 北京,中国农业出版社,2010:2-128.
[24] 张树政. 酶制剂工业(下)[M]. 北京:科学出版社, 1998: 389-437.
[25] 徐克芹, 朱绪春, 张党权, 等. 西伯利亚杏仁粕营养物质测定与其氨基酸组成评价[J]. 经济林研究, 2019, 37(1): 133-138.
[26] 林金莺. 火麻仁蛋白水解及其抗氧化肽的研究[D]. 广州:华南理工大学, 2010.