乳清是以牛乳为原料生产干酪过程中的主要副产品之一。而乳清蛋白是乳清的主要固形物之一,具有较高的营养价值和生物利用效率,被广泛的应用于各种食品中。乳清蛋白主要由β-乳球蛋白、α-乳白蛋白、免疫球蛋白及其他多种活性成分组成。其中,β-乳球蛋白、α-乳白蛋白分别约占乳清蛋白的50%和19%,均为球状蛋白质。乳清蛋白产品可以分为蛋白质含量在35%~85%的乳清浓缩蛋白(whey protein concentration,WPC)和蛋白质含量在90%以上的乳清分离蛋白(whey protein isolates,WPI)等。
超高压(ultra-high pressure, UHP)是一种非热处理技术。通过将样品密封于腔体中,以水或其他流体作为传压介质,在仪器内部瞬时且均匀的将压力传送至样品。超高压技术能够使蛋白质发生结构变化,从而改变蛋白质的功能特性。超高压一般不会改变蛋白质的共价键及氢键,对一级结构基本无影响,但会明显改变蛋白质的非共价键,从而影响其高级结构[1]。超高压技术对蛋白质结构构象的影响是一种复杂的现象,与蛋白质的种类、浓度、压力大小、施压时间、温度和pH有关[2]。
近年来,超高压技术在食品中有着广泛的应用,研究表明经过20 min和 400 MPa处理的干酪抗氧化性能显著提高[3]。将超高压技术应用于蛋白质含量更高的WPI时,发现超高压处理可以增强其抗氧化活性,这可能与蛋白质内部结构的部分瓦解及埋藏于乳清蛋白内部的疏水区域暴露有关。WPI中3种主要蛋白对超高压的抵抗能力的大小为β-乳球蛋白>免疫球蛋白>α-乳白蛋白[4]。并且蛋白质结构的改变可能会导致暴露出更多的酶切位点,从而提高后续蛋白酶水解的效率,因此超高压也是一种有效的预处理方式[5]。但由于WPI包含了种类繁多的蛋白,因此各种蛋白之间的存在使得超高压诱导的变性机制变得十分复杂。例如,超高压处理容易使得免疫球蛋白的球状结构展开,从而有利于免疫球蛋白通过二硫键与其他的蛋白结合而形成聚集体[6]。本研究的目的是对WPI进行不同压力和时间条件下的超高压处理,以考察超高压处理条件对WPI结构和抗氧化活性的影响,为超高压技术在乳清蛋白产品中的应用提供科学依据。
乳清分离蛋白(WPI,蛋白质质量分数90%),购于马可瑞斯商贸(上海)有限公司;其他所有试剂均为分析纯。FPG7100型超高压,德国IKA公司;SepectraMax M5酶标仪,美国Molecular Devices公司;Nicolet6 700傅里叶红外光谱仪,美国Waltham公司;SPECORD-205紫外分光光度计,德国analytikjena公司; PROTEAN3电泳仪,美国Bio-Rad公司;Geldoc-XR+凝胶成像仪,美国Bio-Rad公司。
1.2.1 超高压处理
配制WPI溶液(10 g/L),将100 mL的WPI溶液分装于聚乙烯袋中并真空包装,置于超高压容器中。考察超高压压力(100、200、300、400、500、600 MPa)、时间(5、15、30 min)等因素对WPI的影响。
1.2.2 SDS-PAGE电泳检测
将不同处理前后的WPI(1 mg/mL)分别取样进行SDS-PAGE电泳,采用15%分离胶,5%浓缩胶,上样量为10 μL,电泳初始电压为100 V,待样品进入分离胶时电压调至200 V,待样品泳动至距凝胶底部0.5 cm处停止电泳。
1.2.3 表面疏水性的测定
参考KATO等[7]的方法,进行表面疏水性(surface hydrophobicity, Ho)的测定。采用1-苯胺基-8-萘磺酸(1-anilino-8-naphthalisene sulfonate, ANS)作为荧光探针。用pH 7.0的PBS(10 mmol/L)连续稀释经超高压处理后的WPI样品,使其最终浓度为0.062 5~1 mg/mL。在稀释过后的2 mL WPI样品溶液中,加入10 μL的ANS(8.0 mmol/L),振荡后静置3 min。利用SepectraMax M5酶标仪,在390 nm(激发波长)与470 nm(发射波长)的条件下,测定其荧光强度。表面疏水性Ho值用荧光强度与WPI浓度比值的斜率表示。
1.2.4 乳清分离蛋白结构分析
1.2.4.1 傅里叶变换红外光谱分析
傅里叶变换红外光谱(Fourier transform infrared spectrum, FTIR)被用来分析不同超高压处理前后WPI的构象变化。称取WPI样品的冻干粉与干KBr混合,压片后,利用傅里叶红外光谱仪进行扫描(4 000~400 cm-1)。
1.2.4.2 自由巯基含量测定
参考AMBROSI等[2]的方法,进行自由巯基含量的测定。250 μL的WPI样品和1 mL 的Tris-甘氨酸缓冲液(0.1 mol/L,pH 8.0,含有0.1 mol/L甘氨酸,8 mol/L尿素)进行混合,随后加入10 μL的Ellman’s 试剂(4 mg/mL)。室温(25 ℃)孵育30 min后,测量412 nm处的吸光度(A412)。自由巯基的含量通过公式(1)进行计算。
自由巯基含量![]()
(1)
式中:A412,412nm处吸光度;D,稀释度;C,WPI中的蛋白浓度,mg/mL;自由基含量巯,μmol/g蛋白。
1.2.4.3 内源荧光光谱分析
参考GINA等[8]的方法,将不同超高压处理前后WPI样品利用酶标仪进行色氨酸内源性荧光测定。激发波长设定为280 nm,扫描300~400 nm的发射光谱。
1.2.5 乳清分离蛋白抗氧化活性的测定
1.2.5.1 ABTS自由基清除能力的测定
参考ATHIRA等的方法[9],测定ABTS自由基清除活性。在20 mL 7 mmol/L ABTS溶液中加入2.45 mmol/L过硫酸钾,制成40 mL ABTS+·工作液,使用前室温避光静置12~16 h。之后将ABTS+·工作液用PBS稀释至合适的倍数(20~50倍),使734 nm下的吸光度为(0.70±0.02)。取5 μL的WPI样品加入到500 μL稀释后的ABTS+·工作液中。室温反应6 min后,测定734 nm处的吸光度。清除率通过公式(2)计算,结果用1g WPI中Trolox当量表示(μmol TE/g 蛋白)。
ABTS自由基清除率![]()
(2)
式中:As,加入样品后ABTS+·工作液吸光度;Ab,空白对照组吸光度;Ad,未加样品时ABTS+·工作液的吸光度。
1.2.5.2 DPPH自由基清除能力的测定
参考BRAND-WILLIAMS等[10]的方法,测定DPPH自由基清除活性。将1 mL WPI样品加入到4 mL的DPPH溶液(60 mmol/L)中。室温避光反应30 min后,测定517 nm处的吸光度。清除率通过公式(3)计算,结果用1g WPI中Trolox当量表示(μmol TE/g 蛋白)。
DPPH自由基清除率![]()
(3)
式中:A0,DPPH溶液吸光度;A1,样品+DPPH溶液吸光度;A2,样品溶液吸光度。
1.2.5.3 总还原力的测定
参考YEN等[11]的方法测量WPI的总还原力。将200 μL的WPI样品加入到0.5 mL PBS(0.2 mol/L,pH 6.6)和0.5 mL铁氰化钾(10 g/L)中。50 ℃反应20 min后加入0.5 mL三氯乙酸(100 g/L)。3 000 r min条件下离心10 min,取0.5 mL上清液与0.5 mL去离子水、0.1 mL三氯化铁 FeCl3(1 g/L)混合,反应10 min后,测定700 nm处的吸光度。吸光度越高,说明样品还原能力越强。结果用1g WPI中Trolox当量表示(μmol TE/g 蛋白)。
1.2.6 统计分析
所有实验均平行测定3次,数据用平均值±标准差表示。采用Excel及GraphPad prism 7.04软件对所得到的数据进行统计分析,采用Origin 8.0软件作图。
超高压处理后WPI的电泳特性如图1所示,超高压处理前后的WPI电泳条带均位于14.4、18.4 kDa附近,这与WPI的蛋白成分保持一致,WPI的主要成分β-乳球蛋白的分子质量为18 kDa左右、α-乳白蛋白的分子质量为14.4 kDa左右。不同超高压处理后的WPI的电泳特性并没有发生显著改变,各条带之间差异不明显。这表明超高压处理并未引起WPI分子质量的改变,且WPI未降解。

图1 WPI 的SDS-PAGE电泳图
Fig.1 SDS-PAGE electrophoresis of WPI
注:M-蛋白质标准品,WPI-未处理样品,A1-100 MPa,5 min,
A2-100 MPa,15 min,A3-100 MPa,30 min,B1-200 MPa,5 min,
B2-200 MPa,15 min,B3-200 MPa,30 min,C1-300 MPa,5 min,
C2-300 MPa,15 min,C3-300 MPa,30 min,D1-400 MPa,5 min,
D2-400 MPa,15 min,D3-400 MPa,30 min,E1-500 MPa,5 min,
E2-500 MPa,15 min,E3-500 MPa,30 min,F1-600 MPa,5 min,
F2-600 MPa,15 min,F3-600 MPa,30 min
氨基酸残基的非极性侧链基团之间的疏水相互作用对维持蛋白质三级结构的稳定具有重要作用,因此表面疏水性常被用于评价蛋白质的三级结构[12],并且疏水基团能够加强蛋白质与疏水性多不饱和脂肪酸互作,使蛋白质与氧结合或抑制脂质中氢的释放,从而保护脂质体系、膜质的完整性,起到抗氧化作用[13]。超高压对WPI表面疏水性的影响如图2所示,与对照组即未处理的WPI相比,100 MPa处理后的WPI表面疏水性无显著变化,超高压200 MPa及以上压力处理后WPI表面疏水性则显著上升。这可能是由于蛋白质分子展开,使原先包埋在球状蛋白质分子内部的疏水基团暴露在表面,导致了表面疏水性增加。当压力一定时,WPI的Ho值随着时间的增加而增加。当保压时间分别为5 min和15 min时,WPI的Ho值随着压力的增加而增加,这表明蛋白质疏水区的暴露程度随着压力的增大而增加。当保压时间为30 min时,WPI的Ho值在400 MPa达到最大值(2 121.4),之后随着压力的增加Ho值略有下降。这可能是由于当保压时间过长时,较高的压力使蛋白质疏水氨基酸暴露过多导致更易发生疏水反应,使得展开的蛋白质分子重新聚集形成新的聚合体而导致检测到的疏水性氨基酸残基减少[14]。而有研究表明[14-16],超高压处理后,大豆蛋白分离物的Ho值随压力的增加呈现先上升后下降的趋势,花生分离蛋白则随压力增加呈现持续上升趋势,这说明不同种类的蛋白质所受压力的影响存在差异。

图2 不同超高压处理对WPI表面疏水性的影响
Fig.2 Effects of different UHP treatments on surface
hydrophobicity of WPI
注:小写字母不同表示差异显著(P<0.05)。下同
2.3.1 超高压对乳清分离蛋白二级结构的影响
酰胺I带通常用于分析蛋白质的二级结构,包括α-螺旋、β-折叠、β-转角和无规则卷曲。通过适当的拟合、分峰和峰面积计算,可以比较WPI中二级结构含量的变化[17]。从上述实验中选取具有显著性差异,压力分别为200、400、600 MPa,时间为5 min、30 min的实验组进行傅里叶变换红外光谱分析,考察超高压对WPI二级结构的影响。由表1可以看出,超高压处理过后WPI的α-螺旋含量显著升高,其中400 MPa-30 min的α-螺旋含量显著高于其他实验组。当压力达到600 MPa时,WPI的α-螺旋含量反而降低,这可能是发生了解螺旋现象。超高压处理后WPI的β-折叠的含量显著降低,在400 MPa-30 min时降至最低,这可能与蛋白质的部分展开有关。当压力达到600 MPa时,WPI的β-折叠含量反而升高,这可能是发生了一定程度的重新折叠。β-转角的含量在400MPa-5 min 和400 MPa-30 min时达到最高。无规则卷曲的含量与对照组相比显著降低。这些结果表明,超高压处理可以使WPI的结构展开,使β-折叠和无规则卷曲转变为α-螺旋和β-转角,降低β-折叠的含量,对WPI的二级结构产生显著影响。
表1 超高压处理前后WPI二级结构分析
Table 1 Secondary structure analysis of WPI before
and after UHP treatments
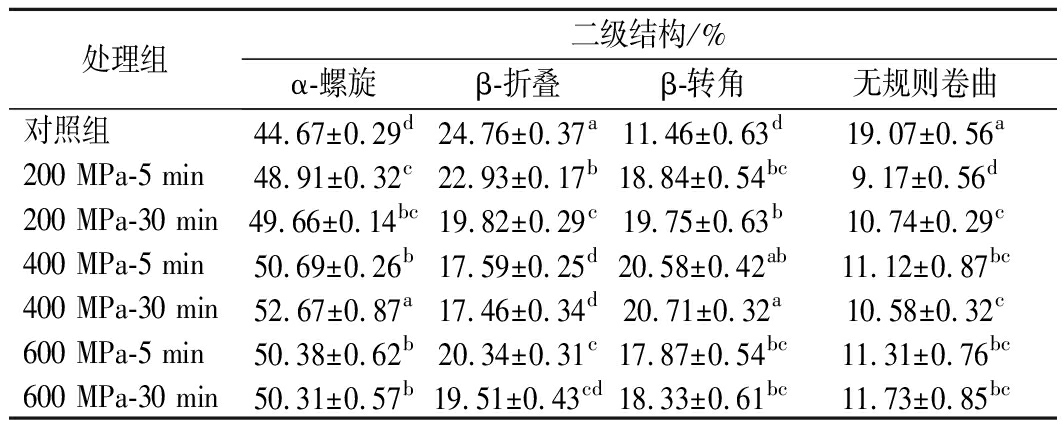
处理组二级结构/%α-螺旋β-折叠β-转角无规则卷曲对照组44.67±0.29d24.76±0.37a11.46±0.63d19.07±0.56a200 MPa-5 min48.91±0.32c22.93±0.17b18.84±0.54bc9.17±0.56d200 MPa-30 min49.66±0.14bc19.82±0.29c19.75±0.63b10.74±0.29c400 MPa-5 min50.69±0.26b17.59±0.25d20.58±0.42ab11.12±0.87bc400 MPa-30 min52.67±0.87a17.46±0.34d20.71±0.32a10.58±0.32c600 MPa-5 min50.38±0.62b20.34±0.31c17.87±0.54bc11.31±0.76bc600 MPa-30 min50.31±0.57b19.51±0.43cd18.33±0.61bc11.73±0.85bc
2.3.2 超高压对乳清分离蛋白三级结构的影响
自由巯基(—SH)及二硫键(—S—S—)对蛋白质结构起着重要的作用,并且有研究表明含巯基的半胱氨酸对蛋白质的抗氧化活性具有影响[18]。超高压处理对WPI巯基的影响如图3所示。超高压处理后,WPI的自由巯基含量发生明显变化,这是由于超高压使得蛋白质分子内或分子间发生—SH/—S—S—互换反应,使得自由巯基和二硫键相互转化。对照组即未处理的WPI自由巯基含量为12.46 μmol/g蛋白,超高压处理后的WPI自由巯基含量明显增加,在400 MPa-30 min时提高了49%,达到最大值(16.63 μmol/g蛋白)。由图3可以看出,当压力一定时,保压时间越长,WPI的自由巯基含量越高,表明超高压对WPI 的影响与保压时间相关,这与HINRICHS等[19]的研究一致。而在相同的保压时间下,随着压力的增加,WPI自由巯基含量呈现先上升后下降的趋势。KLEBER等[5]认为蛋白质在受压变性的过程中存在一个压力阈值,低于压力阈值时蛋白质的展开是可逆的。因此当压力为200 MPa时,WPI受压后发生可逆展开,压力释放后蛋白质发生一定程度的重新折叠。当压力为600 MPa时,WPI发生不可逆的变性聚集。当压力为400 MPa时,WPI变性伸展,暴露出最多的巯基基团,这与JOSEFINA等[20]的结果类似。
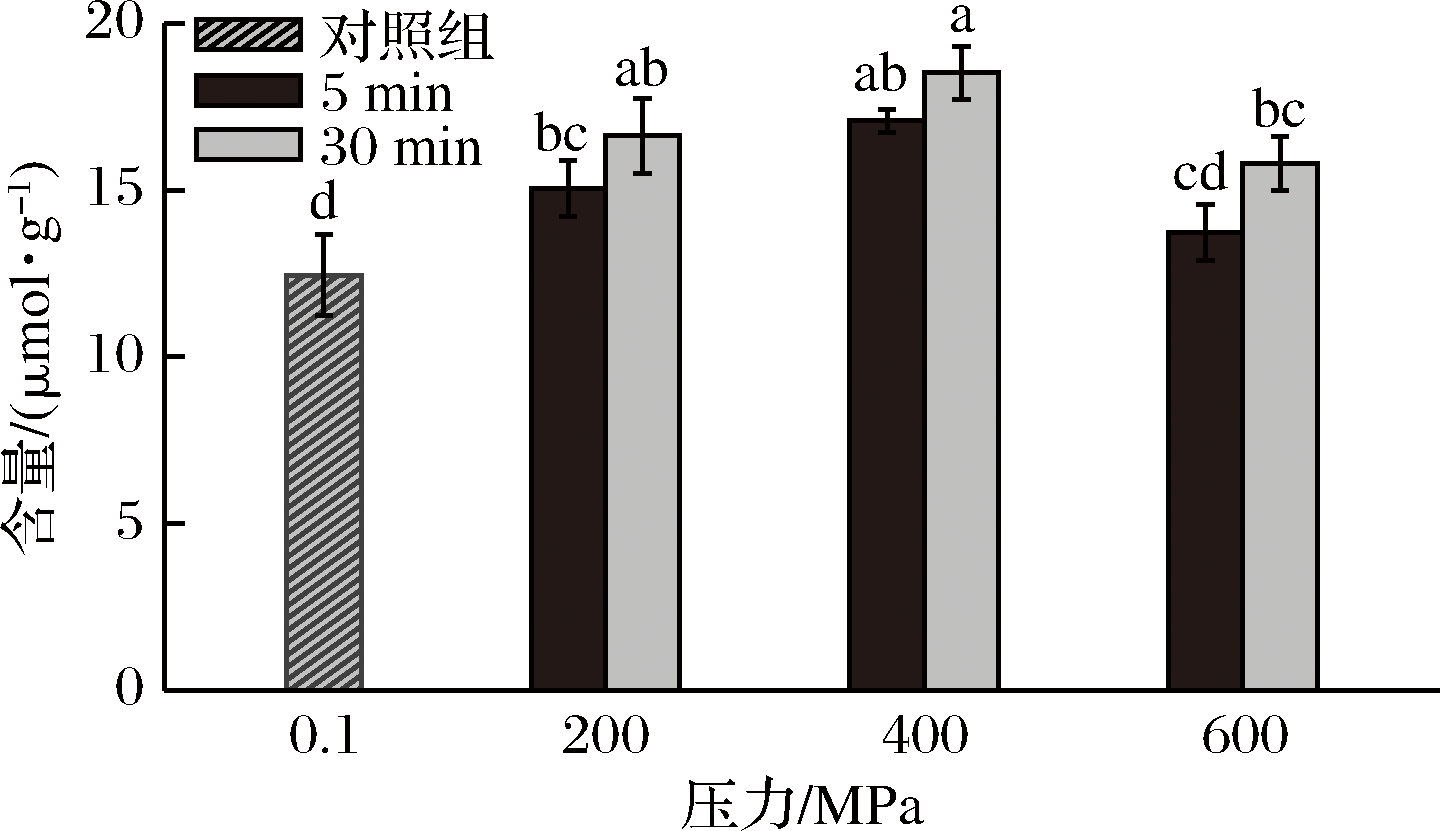
图3 超高压处理对WPI自由巯基含量的影响
Fig.3 Effects of different UHP treatments on free
sulfhydryl contents of WPI
WPI中的色氨酸、苯丙氨酸等氨基酸能够发射荧光,因此常常被用作内源性探针检测蛋白质三级结构的构象变化[21]。因此WPI的色氨酸荧光光谱可以反应出WPI的结构变化。荧光强度的变化以及图谱的蓝移和红移反应了氨基酸侧链发生改变[22]。由图4可知,与对照组即未处理的WPI相比,200 MPa-5 min、200 MPa-30 min、400 MPa-5 min组的WPI荧光强度略有下降,而400 MPa-30 min、600 MPa-5 min、600 MPa-30 min组的WPI的荧光强度则显著增强。所有实验组的图谱发生均发生明显红移。在相同压力下,随着保压时间的增加,WPI的荧光强度也随之增强。在相同保压时间下,随着压力的增加,WPI内源荧光强度也随之增强。并且400 MPa条件下的WPI荧光强度不仅高于200 MPa,400 MPa-30 min组的荧光强度还略高于600 MPa-5 min组,600 MPa-30 min组的荧光强度达到最大值,荧光强度的变化表明超高压处理后色氨酸残基在溶剂中的暴露量发生变化[23]。超高压处理使得蛋白质展开导致色氨酸残基在溶剂中的暴露量改变,这些结果证实了超高压处理对WPI的变性作用。
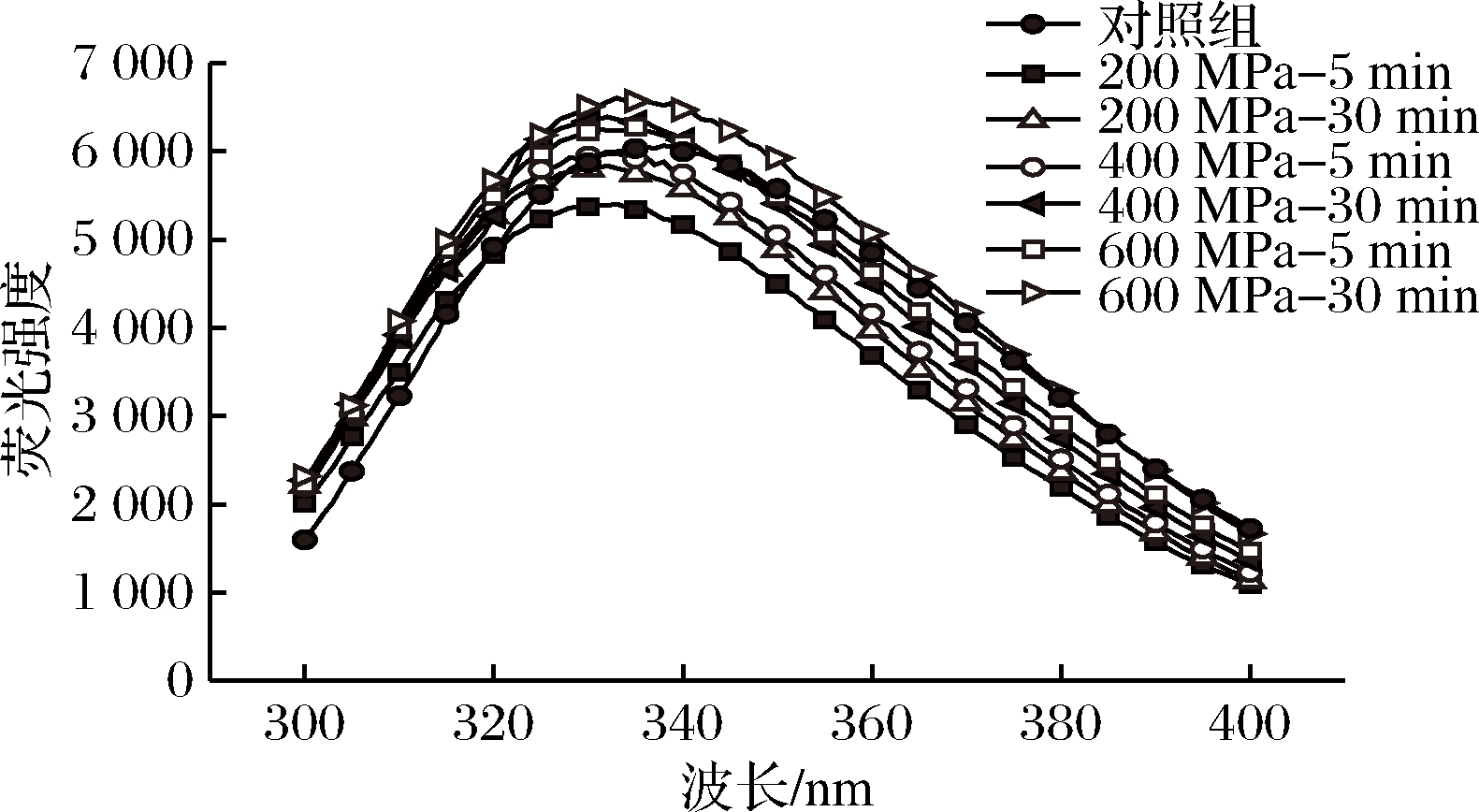
图4 超高压处理前后WPI内源荧光光谱
Fig.4 Endogenous fluorescence spectra of WPI
before and after UHP treatments
抗氧化剂的抗氧化活性是由不同的机制所引起的,包括DPPH自由基清除活性、ABTS自由基清除活性、总还原力,或是这些因素的组合[24],较高的ABTS值、DPPH值和还原力值代表着较高的抗氧化活性。有研究表明[25],超高压处理会导致冰沙的抗氧化活性增加。超高压处理WPI对抗氧化活性的影响如表2所示,与对照组即未处理的WPI相比,经过超高压处理的WPI明显具有更高的ABTS自由基清除活性、DPPH自由基清除活性和总还原力。但与对照组(0.7±0.07)相比,200 MPa-5 min组的DPPH自由基清除活性略有降低。
由表2可以看出,在保压时间为5 min的情况下,压力越大,WPI的ABTS自由基清除活性越大。在保压时间为30 min的情况下,WPI的ABTS自由基清除活性随压力的增加呈现先上升后下降的趋势,在400 MPa-30 min组时达到最大值,且差异显著,DPPH自由基清除活性也显示出了相同的趋势。在压力为200 MPa和400 MPa时,WPI的ABTS自由基清除活性和DPPH自由基清除活性均随着保压时间的延长而增加,而当压力为600 MPa时,ABTS自由基清除活性和DPPH自由基清除活性反而随着保压时间的延长而降低。WPI的还原力则是在200 MPa时,随着保压时间的延长而略有降低,在400 MPa和600 MPa时,随着保压时间的延长而增加。在保压时间一定时,压力越大,WPI的还原力也越大。
超高压处理对WPI抗氧化活性的影响,可能与蛋白质高级结构和构象的变化有关。超高压处理导致蛋白质发生一定程度的展开,结构发生变化,使原本埋藏在天然蛋白结构内部的活性基团如疏水基团等暴露于溶剂中,因此增强了自由基清除能力导致抗氧化活性的提高。
表2 超高压处理对WPI抗氧化活性的影响
Table 2 Effects of different UHP treatments on
antioxidant activity of WPI
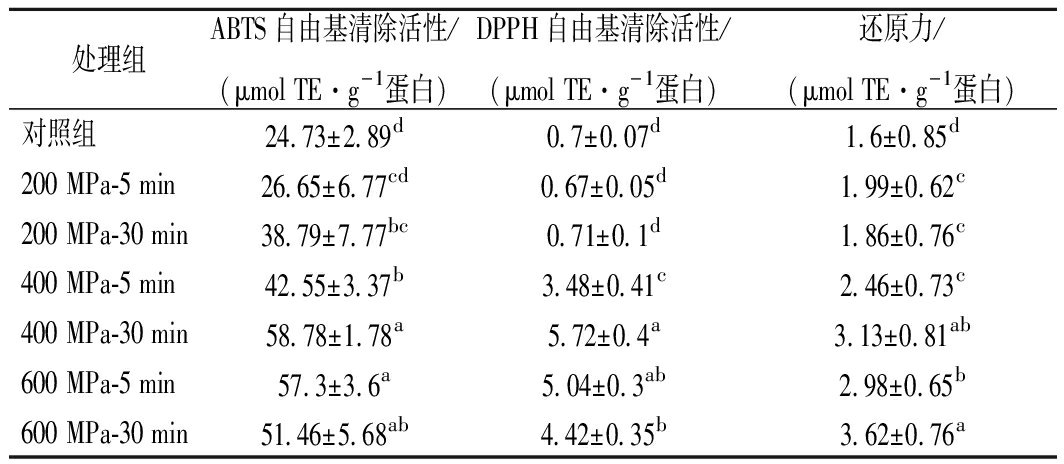
处理组ABTS自由基清除活性/(μmol TE·g-1 蛋白)DPPH自由基清除活性/(μmol TE·g-1 蛋白)还原力/(μmol TE·g-1 蛋白)对照组24.73±2.89d0.7±0.07d1.6±0.85d200 MPa-5 min26.65±6.77cd0.67±0.05d1.99±0.62c200 MPa-30 min38.79±7.77bc0.71±0.1d1.86±0.76c400 MPa-5 min42.55±3.37b3.48±0.41c2.46±0.73c400 MPa-30 min58.78±1.78a5.72±0.4a3.13±0.81ab600 MPa-5 min57.3±3.6a5.04±0.3ab2.98±0.65b600 MPa-30 min51.46±5.68ab4.42±0.35b3.62±0.76a
注:TE=Trolox 当量
本研究通过对WPI进行不同压力和时间条件下的超高压处理,以考察超高压处理条件对WPI结构和抗氧化活性的影响。相对于未经处理的WPI,200 MPa及以上压力处理后WPI的表面疏水性显著上升(P<0.05),在400 MPa-30 min时达到最大值(2 121.4),而100 MPa的超高压处理则对WPI的表面疏水性无显著影响(P>0.05)。这可能是由于一定的压力使蛋白质分子展开,原先位于WPI内部的疏水区域暴露在表面,导致表面疏水性增加。对于WPI的二级结构,超高压处理后使WPI 的结构展开,β-折叠和无规则卷曲转变为α-螺旋和β-转角,降低β-折叠的含量,对WPI的二级结构产生显著影响。对于WPI三级结构,自由巯基含量在400 MPa-30 min时提高了49%,达到最大值,这表明压力使WPI变性伸展,暴露出最多的巯基基团。并且400 MPa-30 min的WPI内源荧光强度与对照相比也表现出了显著变化,证明了超高压处理引起色氨酸残基的变化,导致WPI三级结构展开。在所有的超高压处理条件中,400 MPa-30 min对WPI结构的影响最为显著,并显示出了最高的抗氧化活性。
综上所述,超高压处理能显著改变WPI的二、三级结构,从而对抗氧化活性产生影响。本研究为超高压技术在乳清蛋白产品中的应用提供了科学依据,有利于促进超高压技术在乳制品加工领域的应用。
[1] NORTON T,SUN D W. Recent Advances in the use of high pressure as an effective processing technique in the food industry[J]. Food & Bioprocess Technology, 2008, 1(1): 2-34.
[2] AMBROSI V,POLENTA G,GONZALEZ C, et al. High hydrostatic pressure assisted enzymatic hydrolysis of whey proteins[J]. Innovative Food Science and Emerging Technologies, 2016, 38: 294-301.
[3] PAUL M,BREWSTER J D,VAN HEKKEN D L, et al. Measuring the antioxidative activities of queso fresco after post-packaging high-pressure processing[J]. Advances in Bioscience and Biotechnology, 2012, 3(4): 297-303.
[4] CHAWLA R,PATIL G R,SINGH A K. Hydrostatic pressure technology in dairy processing: A Review[J]. Journal of Food Science and Technology-mysore, 2011, 48(3): 260-268.
[5] KLEBER N,MAIER S,HINRICHS J. Antigenic response of bovine β-lactoglobulin influenced by ultra-high pressure treatment and temperature[J]. Innovative Food Science & Emerging Technologies, 2007, 8(1): 39-45.
[6] CONSIDINE T,PATEL H A,ANEMA S G, et al. Interactions of milk proteins during heat and high hydrostatic pressure treatments-a review[J]. Innovative Food Science & Emerging Technologies, 2007, 8(1): 1-23.
[7] KATO A,NAKAI S. Hydrophobicity determined by a fluorescence probe method and its correlation with surface properties of proteins[J]. Biochimica Et Biophysica Acta, 1980, 624(1): 13-20.
[8] GINA C U M, PERREAULT V, HENAUX L, et al. Impact of a high hydrostatic pressure pretreatment on the separation of bioactive peptides from flaxseed protein hydrolysates by electrodialysis with ultrafiltration membranes[J]. Separation and Purification Technology, 2019, 211:242-251.
[9] ATHIRA S,MANN B,SAINI P, et al. Production and characterization of whey protein hydrolysate having antioxidant activity from cheese whey[J]. Journal of the Science of Food & Agriculture, 2015, 95(14): 2 908-2 915.
[10] BRAND-WILLIAMS W,CUVELIER M E,BERSET C. Use of a free radical method to evaluate antioxidant activity[J]. Lwt Food Sci Technol, 1995, 28(1): 25-30.
[11] YEN G C,DUH P D. Antioxidative properties of methanolic extracts from peanut hulls[J]. Journal of the American Oil Chemists’ Society, 1993, 70(4): 383-386.
[12] MOHAMED A,PETERSON S C,HOJILLA-EVANGELISTA M P, et al. Effect of heat treatment and ph on the thermal, surface, and rheological properties of lupinus albus protein[J]. Journal of the American Oil Chemists Society, 2005, 82(2): 135-140.
[13] CHEN H, MURAMOTO K, YAMAUCHI F, et al. Antioxidative properties of histidine-containing peptides designed from peptide fragments found in the digests of a soybean protein[J]. Journal of Agricultural and Food Chemistry, 1998, 46(1): 49-53.
[14] LI H,ZHU K,ZHOUA H. Effects of high hydrostatic pressure treatment on allergenicity and structural properties of soybean protein isolate for infant formula[J]. Food Chemistry, 2012, 132(2): 808-814.
[15] HE X H,LIU H Z,LIU L, et al. Effects of high pressure on the physicochemical and functional properties of peanut protein isolates[J]. Food Hydrocolloids, 2014, 36(5): 123-129.
[16] SHRIVER S K,YANG W W. Thermal and nonthermal methods for food allergen control[J]. Food Engineering Reviews, 2011, 3(1): 26-43.
[17] STATHOPULOS P B, SCHOLZ G A, HWANG Y M, et al. Sonication of proteins causes formation of aggregates that resemble amyloid[J]. Protein Science, 2004, 13(11):3 017-3 027.
[18] CHAN K M, DECKER E A. Endogenous skeletal muscle antioxidants[J]. Critical Reviews in Food Science and Nutrition, 1994, 34(4): 403-426.
[19] HINRICHS,J,RADEMACHER B. High pressure thermal denaturation kinetics of whey proteins[J]. Journal of Dairy Research, 2004, 71(4): 480.
[20] JOSEFINA B,ROSA C,ROSINA L F. Unfolding and refolding of beta-lactoglobulin subjected to high hydrostatic pressure at different pH values and temperatures and its influence on proteolysisz[J]. Journal of Agricultural & Food Chemistry, 2007, 55(13): 5 282-5 288.
[21] ZHANG T,LV C,YUN S, et al. Effect of high hydrostatic pressure (HHP) on structure and activity of phytoferritin[J]. Food Chemistry, 2012, 130(2): 273-278.
[22] FLORENCE L, BENOIT F, THOMPSON J W, et al. Thermal denaturation and aggregation properties of atlantic salmon myofibrils and myosin from white and red muscles[J]. Journal of Agricultural & Food Chemistry, 2007, 55(12): 4 761-4 770.
[23] YIN Shouwei,TANG Chuanhe,WEN Qibiao, et al. Functional properties and in vitro trypsin digestibility of red kidney bean (phaseolus vulgaris L.) protein isolate: Effect of High-pressure Treatment[J]. Food Chemistry, 2008, 110(4): 938-945.
[24] CORR A A P,DAROIT D J,COELHO J, et al. Antioxidant, antihypertensive and antimicrobial properties of ovine milk caseinate hydrolyzed with a microbial protease[J]. Journal of the Science of Food & Agriculture, 2011, 91(12): 2 247-2 254.
A A P,DAROIT D J,COELHO J, et al. Antioxidant, antihypertensive and antimicrobial properties of ovine milk caseinate hydrolyzed with a microbial protease[J]. Journal of the Science of Food & Agriculture, 2011, 91(12): 2 247-2 254.
[25] ANDR S V,VILLANUEVA M J,TENORIO M D. The effect of high-pressure processing on colour, bioactive compounds, and antioxidant activity in smoothies during refrigerated storage[J]. Food Chemistry, 2016, 192: 328-335.
S V,VILLANUEVA M J,TENORIO M D. The effect of high-pressure processing on colour, bioactive compounds, and antioxidant activity in smoothies during refrigerated storage[J]. Food Chemistry, 2016, 192: 328-335.