鳙鱼(Aristichthys nobilis)又名胖头鱼、花鲢、黑鲢,与鲢鱼、草鱼、青鱼并称我国四大家鱼[1],是中国特有的淡水经济鱼类,有“水中清道夫”的雅称[2]。鳙鱼头富含胶质所以味道特别鲜美[3],且其头部脑髓和磷脂含量丰富,素有“鳙鱼头,肉馒头”的说法[1]。三文鱼(Salmon Salar),又名大马哈鱼、鲑鱼、撒蒙鱼,被国际美食界誉为“水中珍品”“冰海之皇”[4],它的肉质鲜美,营养丰富,含有大量DHA和EPA等[5]。三文鱼在加工过程中会产生大量的副产物,如鱼头、鱼皮和鱼骨等,都有很高的利用价值,对三文鱼副产物的再利用也越来越受到人们的重视[6],但对鱼头的研究较少。
汤种类众多、味道鲜美、制作便捷[7]。在熬煮过程中经过一系列化学物理反应,汤中的化学成分既有从食品中迁移的原始成分,也有原始成分通过相互作用形成的新成分,这些成分还可以通过分子间次级键相互作用形成新的超分子结构[8]。汤中含有大量水溶性营养成分,可以很容易被吸收,同时也具有各种生物活性。王莉嫦[9]以鲮鱼下脚料为原料,熬煮得到的鲮鱼汤营养成分含量高,味道鲜美。徐红梅[10]研究发现熬煮鳙鱼汤2 h后组织中各营养物质的迁移总量达到最大值。蒋静[11]研究发现在熬煮鲫鱼汤过程中,粗蛋白、水溶性蛋白和氨基酸含量不断增加。田沁等[12]利用电炖锅熬制鲢鱼头汤,在一定条件下,熬制鱼头汤的营养成分和风味成分含量高。HONDA等[13]研究发现受试者摄取干鲣鱼高汤4周后,视觉疲劳主观症状能得到良好的改善。ISHIZAKI等[14]研究发现适量的干鲣鱼高汤能有效改善受试者的不良情绪。黄国榕[15]和张勇[16]研究发现鲫鱼汤具有治疗肝硬化腹水作用和肾脏保护作用。ZHANG等[17]研究了鲫鱼汤和黑鱼汤的营养成分和抗氧化能力,发现黑鱼汤矿物质含量高于鲫鱼汤,但氨基酸总量和抗氧化能力低于鲫鱼汤。
鱼头汤在熬煮的过程中会自组装形成不同粒径大小的微纳胶粒,本文在前期优化熬煮鱼头汤方式[18]的基础上选取熬煮时间为150 min的鳙鱼和三文鱼头汤,通过粗滤、离心、微滤和超滤不同方式处理得到不同粒径大小胶粒的鱼头汤,采用马尔文激光粒度分析仪测定其胶粒的粒径分布,利用6种化学法研究鱼头汤中不同粒径胶粒的体外抗氧化活性,以期为鱼头汤的精深加工提供理论依据,从而创造更大的经济效益。
本实验所用原料鳙鱼头、三文鱼头均购自大连翔祥食品有限公司,捕捞于丹麦法罗群岛。大豆油,市售。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH),无水乙醇,FeCl2,菲啰嗪(Ferrozine),过硫酸钾,磷酸盐(PBS)缓冲液(pH=7.4,pH=6.6),2,2′-二氮-双(3-乙基苯并噻唑-6-磺酸)(2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS),三羟甲基氨基甲烷(Tris),HCl,邻苯三酚,H2O2,水杨酸(CH3CH2OH-C7H6O3),FeSO4,K4Fe(CN)6,FeCl3,三氯乙酸(TCA),均购自上海麦克林生物科技有限公司。
C21-WT2112T 美的电磁炉,广东美的网络科技有限公司;UV-2200 紫外分光光度计,美国Unico公司;SLFPTAD Synergy 多功能酶标仪,美国伯腾仪器有限公司;MS2000 激光粒度分析仪,英国马尔文仪器有限公司;TG16-WS 台式高速离心机,湖南湘仪实验室仪器开发有限公司;HWS-24 电热恒温水浴锅,上海恒科学仪器有限公司。
1.3.1 样品生物学测量
抽取相近规格大小鳙鱼、三文鱼头各25只,平均头长、头宽、头重见表1。置于-80 ℃冰箱中贮藏待用。
表1 鳙鱼、三文鱼头的生物学测量(湿重, mean±SD,
n=25)
Table 1 The biochemical indicator of A.nobilis, Salmon
Salar head

测试指标鳙鱼三文鱼鱼头宽/cm13.30±1.359.80±0.10鱼头长/cm 18.50±1.2215.03±0.67鱼头重/kg0.96±0.030.66±0.12
1.3.2 鱼头汤熬煮
参照QIAN等[19]的方法并稍作修改。鳙鱼和三文鱼头流水解冻后去鳃,分别切成3 cm×3 cm×2 cm的小块,洗净备用。取(20±1)g市售大豆油倒入锅中于电磁炉(120 ℃)上预热30 s,加入鱼头块(400±2)g,煎炸40 s。然后将煎炸鱼头块与3.2 kg饮用水(鱼水质量比为1∶8)倒入不锈钢锅中大火熬煮((97±2)℃)至煮沸后,转小火熬煮((90±2)℃)150 min后弃去鱼头块即得鳙鱼和三文鱼头汤。
1.3.3 鱼头汤胶粒粒径分布
鳙鱼和三文鱼头汤经过滤纸粗滤除去不溶物即为原汤,原汤经10 000 r/min离心15 min取上清液为离心样品,离心样品过0.45 μm水相滤膜为微滤样品,微滤样品经100 kDa超滤膜得到超滤样品,由此共制得4种不同粒径大小的鱼头汤胶粒样品。用MS2000激光粒度分析仪测定经不同方式处理后的鳙鱼和三文鱼头汤胶粒的平均粒径。平均粒径的分布主要通过表面积平均粒径D(3,2)=(Σdi3/Σdi2)、体积平均粒径D(4,3)=(Σdi4/Σdi3)、d(0.1)、d(0.5)和d(0.9)进行评价(d(0.1)、d(0.5)和d(0.9)分别表示粒度范围内体积占颗粒总体积的10%,50%和90%时的粒径大小)。
1.3.4 鱼头汤胶粒DPPH·清除率测定
参照ABU BAKAR等[20]的方法并稍作修改。取不同粒径的鳙鱼和三文鱼头汤各1 mL,分别加入DPPH溶液(0.4 mg/mL)1 mL,混合均匀,室温反应30 min后,取200 μL于96孔板中,在酶标仪517 nm处测其吸光值A1(此操作过程应全程严密避光)。以等量的蒸馏水代替样品溶液为空白组,测得吸光度A0,等量的蒸馏水代替DPPH溶液作为对照组,测得吸光度A2。DPPH·清除率计算如公式(1):
DPPH·清除率![]()
(1)
1.3.5 鱼头汤胶粒Fe2+螯合能力测定
参照韩娜等[21]的方法并稍作修改。取不同粒径的鳙鱼和三文鱼头汤各1 mL,依次加入50 μL FeCl2(2 mmol/L)、200 μL Ferrozine(5 mmol/L)与2.75 mL蒸馏水混合摇匀,室温下反应10 min,562 nm处测得吸光值A1,以等量的蒸馏水代替样品为空白组,测得吸光度A0,以等量的蒸馏水代替FeCl2为对照组,测得吸光度A2。Fe2+螯合能力的计算如公式(2):
Fe2+螯合率![]()
(2)
1.3.6 鱼头汤胶粒ABTS+·清除率测定
参照白海娜等[22]的方法并稍作修改。取5 mL ABTS溶液(7 mm)和88 μL过硫酸钾溶液(140 mm)混合,并在室温条件下避光放置12~16 h,作为ABTS+·储备液,用蒸馏水稀释ABTS+·储备液至其在734 nm波长的吸光度为0.700±0.005(大约稀释50倍),作为ABTS+·工作液。取ABTS自由基工作液4 mL,加入不同粒径的鳙鱼和三文鱼头汤各40 μL,室温避光反应10 min后在734 nm处测得吸光值A1,以等量的蒸馏水代替样品为空白组,测得吸光度A0,以等量的蒸馏水代替ABTS工作液为对照组,测得吸光度A2。ABTS+·清除率的计算如公式(3):
ABTS+·清除率![]()
(3)
1.3.7 鱼头汤胶粒![]() 自由基清除率测定
自由基清除率测定
参照崔红军等[23]的方法并稍作修改。采用邻苯三酚自氧化法测定,取450 μL Tris-HCl缓冲液(50 mmol/L,pH=8.2),置于25 ℃的水浴中保温20 min,分别加入不同粒径的鳙鱼和三文鱼头汤各100 μL,再加入40 μL邻苯三酚溶液(25 mmol/L),混匀后在25 ℃的水浴中反应5 min,再加入100 μL HCl溶液(8 mmol/L)终止反应,在325 nm处测得吸光值A1,以等量的蒸馏水代替样品为空白组,测得吸光度A0,以等量的蒸馏水代替邻苯三酚溶液为对照组,测得吸光度![]() 清除率的计算如公式(4):
清除率的计算如公式(4):
![]() 清除率
清除率![]()
(4)
1.3.8 鱼头汤胶粒·OH清除率测定
参照LAI等[24]的方法并稍作修改。取不同粒径的鳙鱼和三文鱼头汤各1 mL,依次加入FeSO4、CH3CH2OH—C7H6O3、H2O2、H2O各1 mL,混匀启动反应,在37 ℃培养箱中反应30 min后取上清液在510 nm处测得吸光值A1,以等量的蒸馏水代替样品为空白组,测得吸光度A0,以等量的蒸馏水代替H2O2溶液为对照组,测得吸光度A2,·OH清除率的计算如公式(5):
·OH清除率![]()
(5)
1.3.9 鱼头汤胶粒总还原能力测定
参照陈静等[25]的方法并稍作修改。取不同粒径的鳙鱼和三文鱼头汤各0.5 mL,加入2.5 mL PBS缓冲液(0.2 mol/L,pH=6.6)和2.5 mL K4Fe(CN)6(1%)混匀,在50 ℃的水浴中反应20 min,迅速冷却后加入2.5 mL TCA(10%),混匀后在3 000 r/min下离心10 min,取上清液2 mL,加入2 mL H2O和1 mL FeCl3(0.1%)混匀,室温放置10 min后于700 nm处测其吸光值。
所有实验均重复3次,结果以平均值±标准偏差(mean±SD)的形式表示。采用SPSS 16.0软件,根据单因素方差(One-Way ANOVA)方法对数据进行差异显著性比较分析,P<0.05为数据之间存在显著性差异。Origin 8.0(Origin Lab,USA)软件用于处理和生成图像。
如果D(3,2)和D(4,3)的值接近,则颗粒的形状将更加规则并且分布更加集中;如果值之间的差异很大,则分布将更宽。由表2可知,随着处理方法的不同,鳙鱼头汤和三文鱼头汤形成胶粒的平均粒径显著变小,并且三文鱼头汤胶粒的平均粒径大于鳙鱼头汤,可能与三文鱼是海水鱼,含有更高浓度的油脂有关。鳙鱼和三文鱼头原汤胶粒的粒径分布范围比较大,10 000 r/min离心15 min后,鳙鱼头汤和三文鱼头汤胶粒的各粒径参数都有显著性变化(P<0.05),说明汤经过离心之后平均粒径显著变小,在通过0.45 μm的滤膜微滤和100 kDa的超滤离心管超滤之后,较大的颗粒在膜过滤过程中被滤膜截留,而较小的颗粒则通过膜,平均粒径变得非常小。所以,经过不同方式处理后鱼头汤胶粒分布粒径大小不同,这为之后研究鱼头汤中不同粒径胶粒与其抗氧化活性之间的关系提供参考。
表2 不同方式处理的鳙鱼和三文鱼头汤胶粒粒径分布
Table 2 Colloidal particle size distribution of A. nobilis and Salmon Salar head soup with different treatment methods
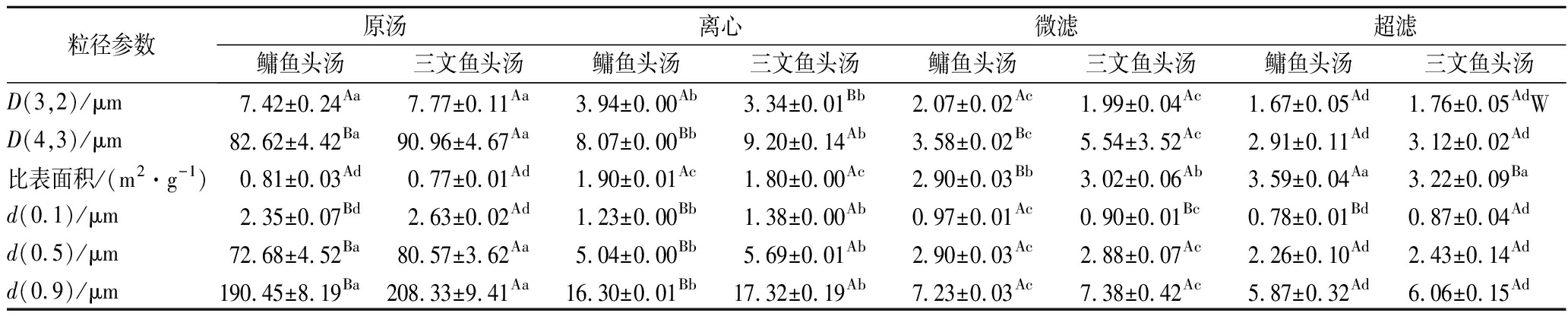
粒径参数原汤离心微滤超滤鳙鱼头汤三文鱼头汤鳙鱼头汤三文鱼头汤鳙鱼头汤三文鱼头汤鳙鱼头汤三文鱼头汤D(3,2)/μm7.42±0.24Aa7.77±0.11Aa3.94±0.00Ab3.34±0.01Bb2.07±0.02Ac1.99±0.04Ac1.67±0.05Ad1.76±0.05AdWD(4,3)/μm82.62±4.42Ba90.96±4.67Aa8.07±0.00Bb9.20±0.14Ab3.58±0.02Bc5.54±3.52Ac2.91±0.11Ad3.12±0.02Ad比表面积/(m2·g-1)0.81±0.03Ad0.77±0.01Ad1.90±0.01Ac1.80±0.00Ac2.90±0.03Bb3.02±0.06Ab3.59±0.04Aa3.22±0.09Bad(0.1)/μm2.35±0.07Bd2.63±0.02Ad1.23±0.00Bb1.38±0.00Ab0.97±0.01Ac0.90±0.01Bc0.78±0.01Bd0.87±0.04Add(0.5)/μm72.68±4.52Ba80.57±3.62Aa5.04±0.00Bb5.69±0.01Ab2.90±0.03Ac2.88±0.07Ac2.26±0.10Ad2.43±0.14Add(0.9)/μm190.45±8.19Ba208.33±9.41Aa16.30±0.01Bb17.32±0.19Ab7.23±0.03Ac7.38±0.42Ac5.87±0.32Ad6.06±0.15Ad
注:上标小写字母表示不同处理方式之间具有显著性差异,上标大写字母表示不同鱼汤之间具有显著性差异,P<0.05
DPPH·是一种稳定的以氮原子为中心的自由基,它的稳定性来源于空间障碍和3个苯环的共振稳定作用,使夹在中间的氮原子上不成对的电子不能发挥电子成对作用[26]。DPPH的醇溶液为深紫色,在517 nm处有最大吸收峰,当体系中存在自由基清除剂时,氮原子上的孤电子被配对,DPPH·便会被还原成黄色的DPPH-H非自由基的形式[27]。
图1为不同处理方式的鳙鱼和三文鱼头汤胶粒的DPPH·清除率。由图1可知,处理方式不同,样品的DPPH·清除率之间存在明显差别。具体表现为鳙鱼头和三文鱼头原汤胶粒DPPH·清除率显著高于离心、微滤和超滤鱼头汤(P<0.05),并且经过离心和微滤的鱼头汤胶粒DPPH·清除率显著高于超滤后的鱼头汤(P<0.05),这与分布的结果一致,表明在一系列处理过程中,大部分大颗粒物质被截留,有效活性物质也被截留,导致其DPPH·清除率减小。鳙鱼头和三文鱼头的原汤和微滤样品胶粒DPPH·清除率不存在显著性差别(P>0.05),但离心和超滤样品胶粒DPPH·清除率存在显著性差别(P<0.05),且2种鱼头汤胶粒DPPH·清除率均表现为原汤>离心>微滤>超滤。
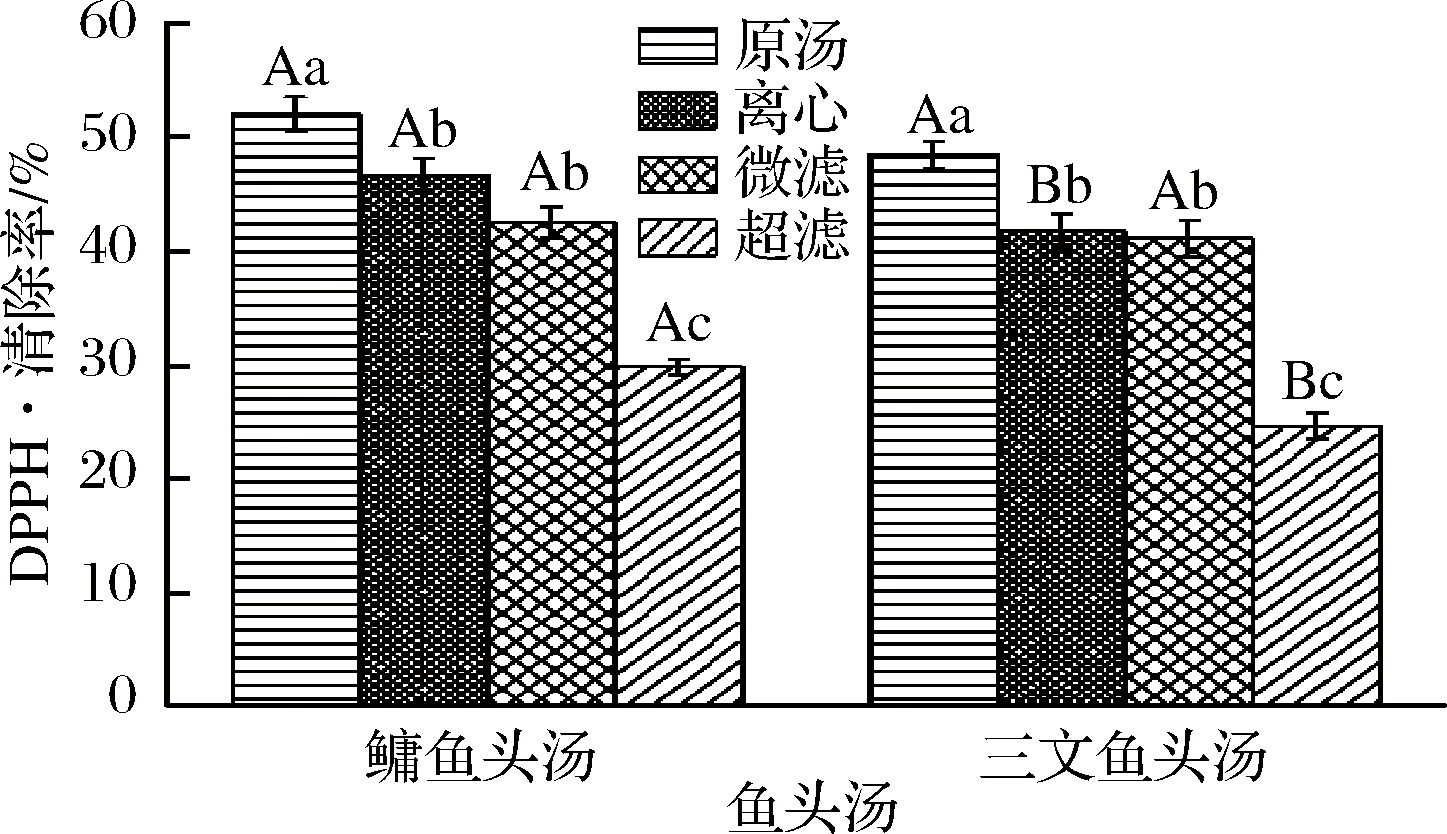
图1 不同处理方式的鳙鱼和三文鱼头汤胶粒的DPPH·
清除率
Fig.1 DPPH free radical scavenging rate of A. nobilis
and Salmon Salar head soup colloidal with different
treatment methods
注:上标小写字母表示不同处理方式之间具有显著性差异,
上标大写字母表示不同鱼汤之间具有显著性差异,P<0.05(下同)
![]() 是产生于人体的活性氧自由基,能够引发体内的脂质过氧化,加快人体整个身体的衰老,而且能够诱发皮肤病变、癌症和心血管疾病等,严重危害人们的身体健康。本文测定
是产生于人体的活性氧自由基,能够引发体内的脂质过氧化,加快人体整个身体的衰老,而且能够诱发皮肤病变、癌症和心血管疾病等,严重危害人们的身体健康。本文测定![]() 的方法是邻苯三酚法[28],即在碱性(Tris-HCl缓冲液,pH=8.2)环境中,邻苯三酚会发生自氧化产生
的方法是邻苯三酚法[28],即在碱性(Tris-HCl缓冲液,pH=8.2)环境中,邻苯三酚会发生自氧化产生![]() 反应过程中会生成有色的中间产物,若样品体系中含有自由基清除剂,则会清除
反应过程中会生成有色的中间产物,若样品体系中含有自由基清除剂,则会清除![]() 抑制有色中间产物的产生。
抑制有色中间产物的产生。
图2为不同处理方式的鳙鱼和三文鱼头汤胶粒的![]() 清除率。由图可知,鳙鱼头和三文鱼头原汤和离心鱼头汤胶粒
清除率。由图可知,鳙鱼头和三文鱼头原汤和离心鱼头汤胶粒![]() 清除率均不存在显著性差异(P>0.05),但都显著性高于微滤和超滤鱼头汤(P<0.05),并且微滤鱼头汤胶粒
清除率均不存在显著性差异(P>0.05),但都显著性高于微滤和超滤鱼头汤(P<0.05),并且微滤鱼头汤胶粒![]() 清除率显著性高于超滤鱼头汤(P<0.05)。鳙鱼头和三文鱼头的原汤、离心和微滤样品胶粒
清除率显著性高于超滤鱼头汤(P<0.05)。鳙鱼头和三文鱼头的原汤、离心和微滤样品胶粒![]() 清除率均不存在显著性差异(P>0.05),但超滤样品胶粒
清除率均不存在显著性差异(P>0.05),但超滤样品胶粒![]() 清除率存在显著性差异(P<0.05),且两种鱼头汤胶粒
清除率存在显著性差异(P<0.05),且两种鱼头汤胶粒![]() 清除率均表现为原汤>离心>微滤>超滤,这与DPPH·清除率的结果类似。
清除率均表现为原汤>离心>微滤>超滤,这与DPPH·清除率的结果类似。
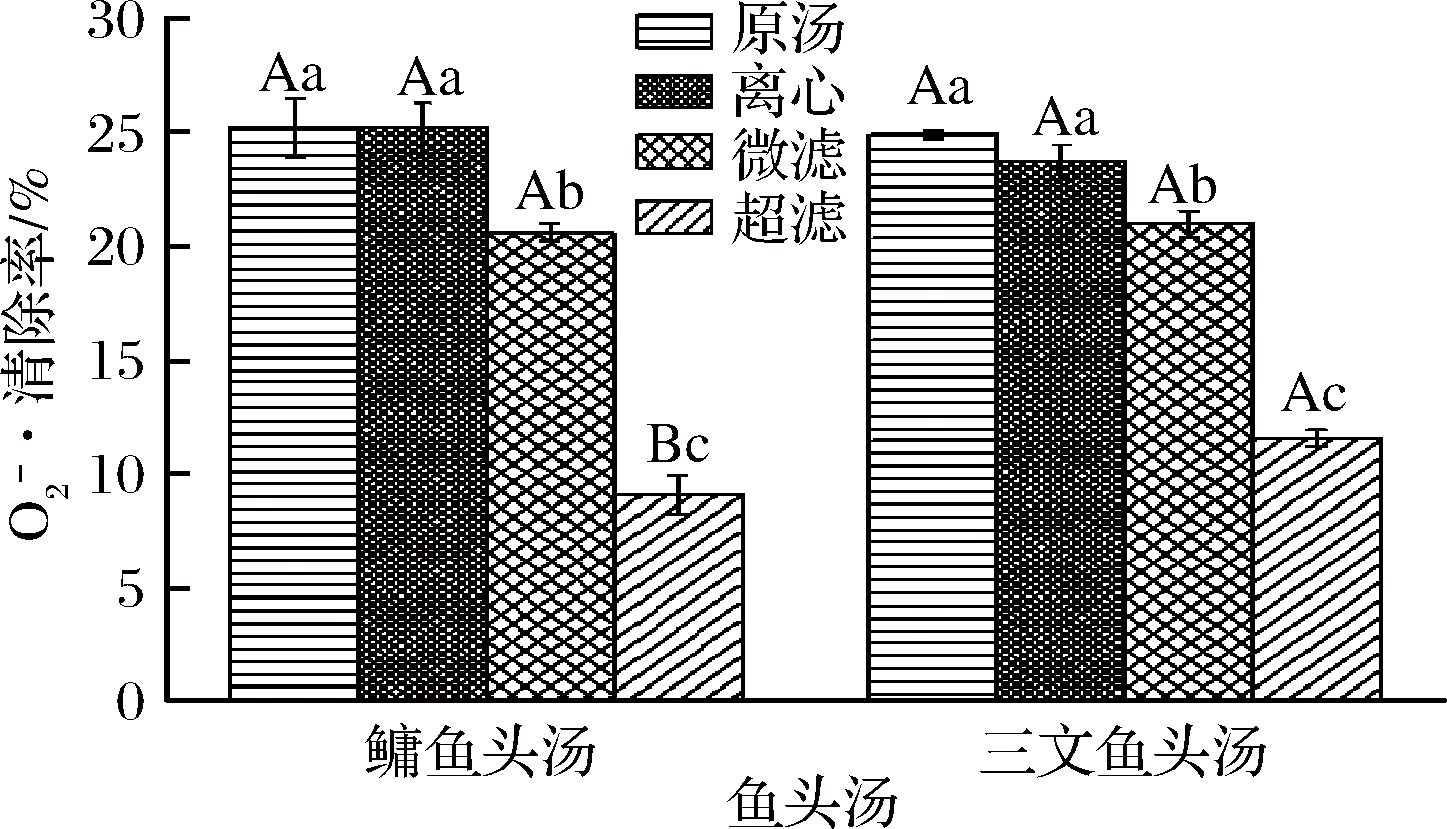
图2 不同处理方式的鳙鱼和三文鱼头汤胶粒的![]()
清除率![]() scavenging rate of A. nobilis and Salmon Salar
scavenging rate of A. nobilis and Salmon Salar
head soup colloidal with different treatment methods
Fe2+能够与抗氧化剂发生鳌合反应[29],避免了Fe2+与H2O2发生Fenton反应而产生自由基,在反应结束时,在反应体系中加入Ferrozine试剂,没有被螯合的Fe2+会与Ferrozine试剂反应生成有色基团,该有色基团在563 nm处有强的吸收峰,从而能够间接反映鱼头汤的抗氧化能力。
图3为不同处理方式的鳙鱼和三文鱼头汤胶粒的Fe2+螯合能力。由图3可知,鳙鱼头原汤与离心鱼头汤胶粒Fe2+螯合能力不存在显著性差异(P>0.05),但都显著性高于微滤与超滤鱼头汤(P<0.05),微滤鱼头汤胶粒Fe2+螯合能力显著性高于超滤鱼头汤(P<0.05);不同粒径的三文鱼头汤胶粒Fe2+螯合能力之间存在显著性差异(P<0.05)。两种鱼头汤胶粒Fe2+螯合能力均表现为原汤>离心>微滤>超滤。而且不同粒径鳙鱼头汤胶粒Fe2+螯合能力均大于三文鱼头汤。ZHANG等[17]用同种方法测定了鲫鱼汤和黑鱼汤原汤经过模拟体外消化后的抗氧化活性,经对比可知,鳙鱼头汤Fe2+螯合率高于鲫鱼汤(60.05%)和黑鱼汤(43.48%),但鲫鱼汤和黑鱼汤Fe2+螯合率高于三文鱼头汤。
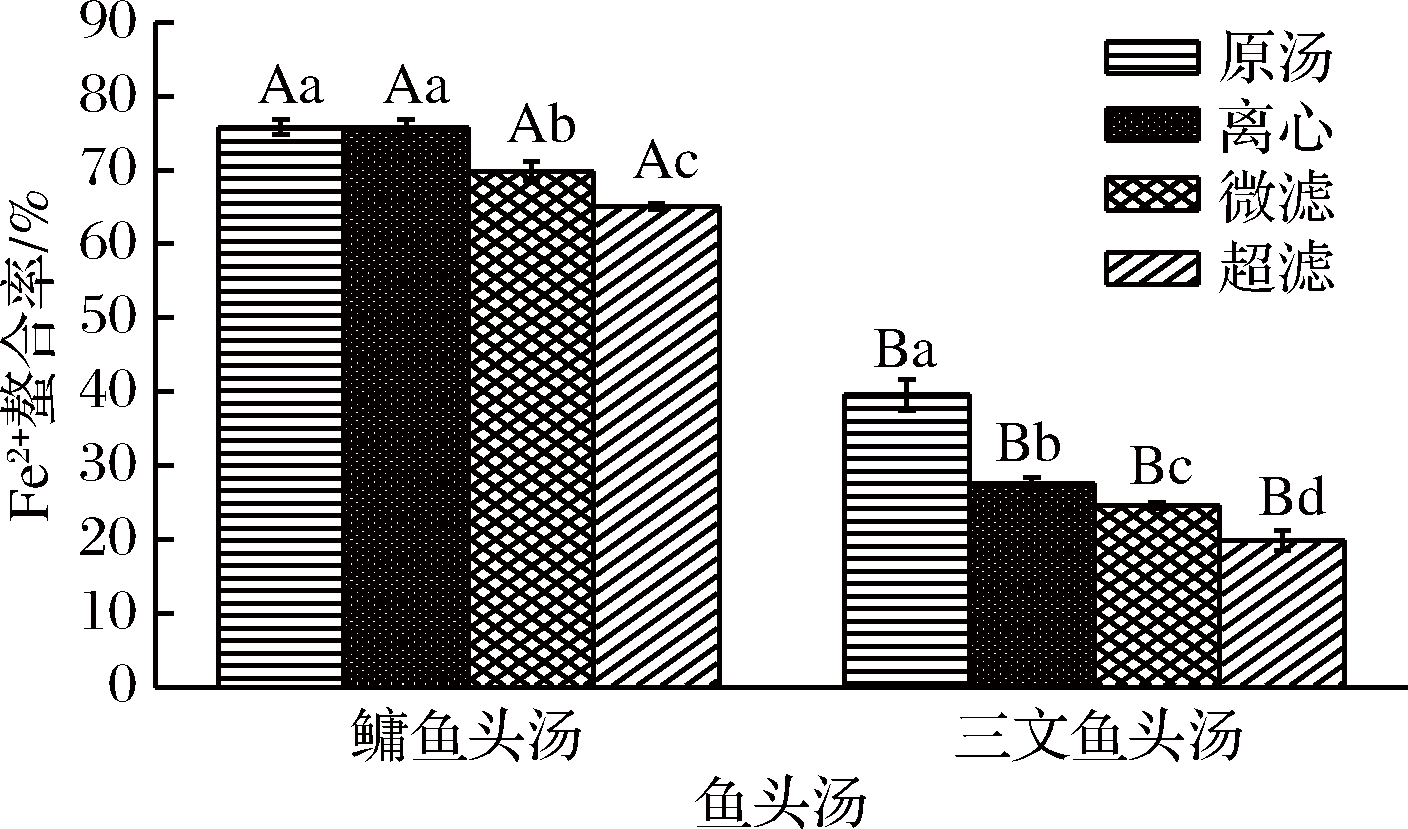
图3 不同处理方式的鳙鱼和三文鱼头汤胶粒的Fe2+
螯合率
Fig.3 The Fe2+ chelation rate of A. nobilis and Salmon Salar
head soup colloidal with different treatment methods
ABTS+·是一种人工合成的自由基,其在氧化剂的作用下会生成绿色的阳离子ABTS+·,该自由基在734 nm处有吸收峰[30]。若反应体系中含有抗氧化剂,则会抑制ABTS+·的产生,从而间接反映样品抗氧化能力的大小。
图4为不同处理方式的鳙鱼和三文鱼头汤胶粒的ABTS+·清除率。由图4可知,鳙鱼头原汤胶粒ABTS+·清除率显著性高于离心、微滤和超滤鱼头汤(P<0.05),离心与微滤鱼头汤胶粒ABTS+·清除率无显著性差异(P>0.05),但都显著高于超滤鱼头汤(P<0.05);三文鱼头原汤、离心与微滤鱼头汤胶粒ABTS+·清除率不存在显著差异(P>0.05),但都显著性高于超滤鱼头汤(P<0.05)。2种鱼头汤胶粒ABTS+·清除率均表现为原汤>离心>微滤>超滤,且不同粒径鳙鱼头汤胶粒ABTS+·清除率均大于三文鱼头汤,这与鳙鱼和三文鱼头汤胶粒的Fe2+螯合能力的结果一致。
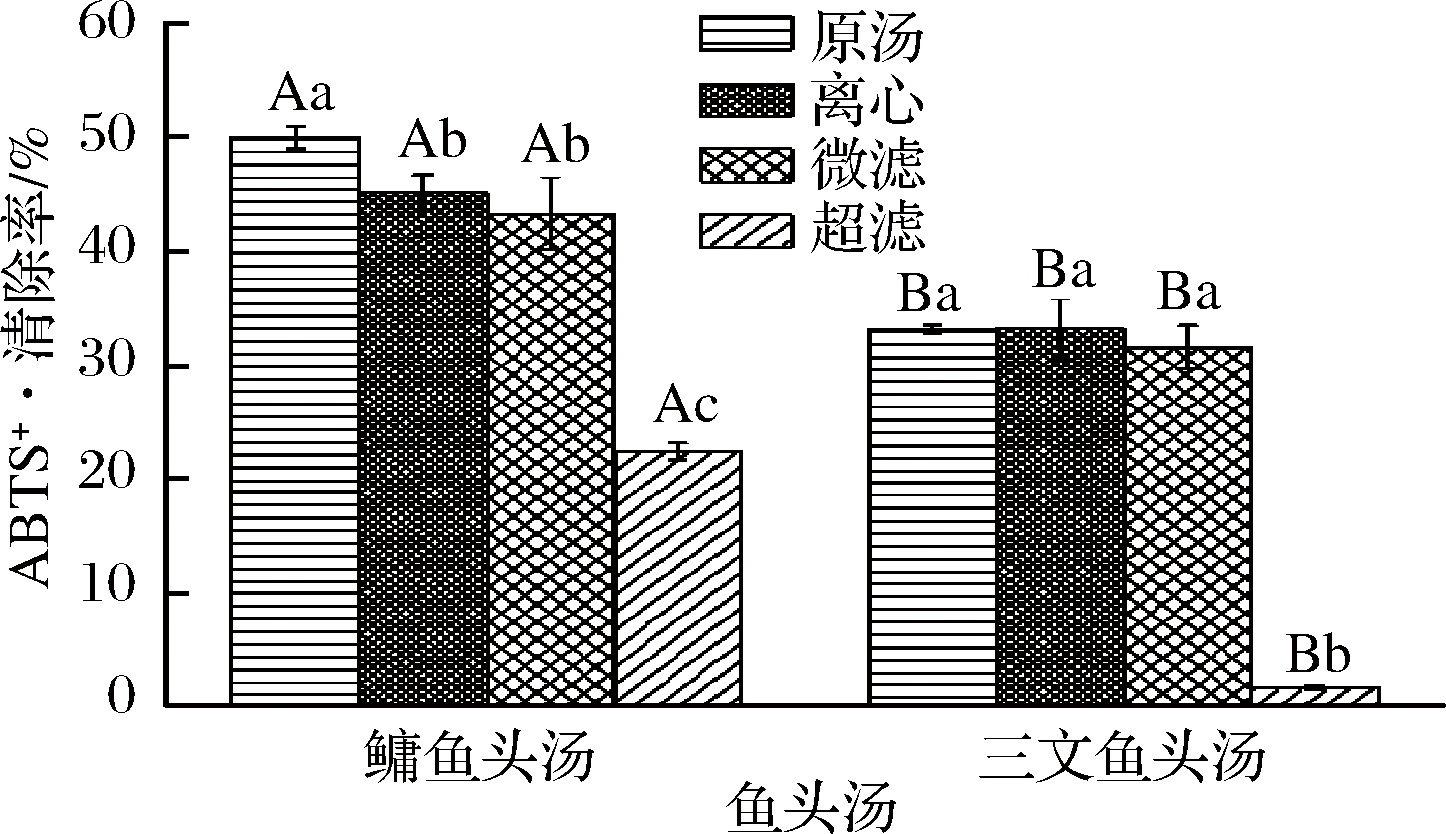
图4 不同处理方式的鳙鱼和三文鱼头汤胶粒的ABTS+·
清除率
Fig.4 ABTS+· scavenging rate of A. nobilis and Salmon
Salar head soup colloidal with different treatment methods
鳙鱼和三文鱼头汤胶粒的DPPH·清除能力![]() 清除能力、Fe2+螯合能力和ABTS+·清除能力都表现为原汤>离心>微滤>超滤(图1~4)。在熬煮过程中,鱼头组织中的脂质、EPA、DHA和蛋白质等营养成分不断迁移进入到汤中[19],这些成分会自组装形成不同粒径大小的微纳胶粒。本研究中,经不同处理方式将鱼头汤中不同粒径大小的胶粒分离,可能导致其中的活性成分在原汤、离心、微滤和超滤样品中的含量存在差异。此外,易发生氧化的甘油三酯中的长链多不饱和脂肪酸,大粒径胶粒中的EPA、DHA等被包裹程度相对小粒径高,使得它们具有较好的氧化稳定性,因此导致大粒径鱼头汤胶粒的抗氧化活性优于小粒径鱼头汤胶粒。这与何蕾[31]研究的猪骨汤原汤、过滤与超滤样品胶粒的体外抗氧化能力结果一致。
清除能力、Fe2+螯合能力和ABTS+·清除能力都表现为原汤>离心>微滤>超滤(图1~4)。在熬煮过程中,鱼头组织中的脂质、EPA、DHA和蛋白质等营养成分不断迁移进入到汤中[19],这些成分会自组装形成不同粒径大小的微纳胶粒。本研究中,经不同处理方式将鱼头汤中不同粒径大小的胶粒分离,可能导致其中的活性成分在原汤、离心、微滤和超滤样品中的含量存在差异。此外,易发生氧化的甘油三酯中的长链多不饱和脂肪酸,大粒径胶粒中的EPA、DHA等被包裹程度相对小粒径高,使得它们具有较好的氧化稳定性,因此导致大粒径鱼头汤胶粒的抗氧化活性优于小粒径鱼头汤胶粒。这与何蕾[31]研究的猪骨汤原汤、过滤与超滤样品胶粒的体外抗氧化能力结果一致。
·OH能杀死红细胞,降解DNA、细胞膜和多糖化合物[16],它是迄今发现最活跃的自由基之一,可以快速有效的氧化几乎所有化合物[32]。利用Fe2+与H2O2发生Fenton反应而产生·OH[33],它能够与水杨酸反应产生2,3-二羟基苯甲酸,其在510 nm处有最大吸收峰。
图5为不同处理方式的鳙鱼和三文鱼头汤胶粒的·OH清除率。由图5可知,鳙鱼头原汤与离心鱼头汤胶粒·OH清除率不存在显著性差异(P>0.05),但都显著高于微滤与超滤鱼头汤(P<0.05),且微滤与超滤鱼头汤胶粒·OH清除率不存在显著性差异(P>0.05);三文鱼头原汤、离心与微滤鱼头汤胶粒·OH清除率不存在显著性差异(P>0.05),但都显著性高于超滤鱼头汤(P<0.05),且不同粒径三文鱼头汤胶粒·OH清除率高于鳙鱼头汤。
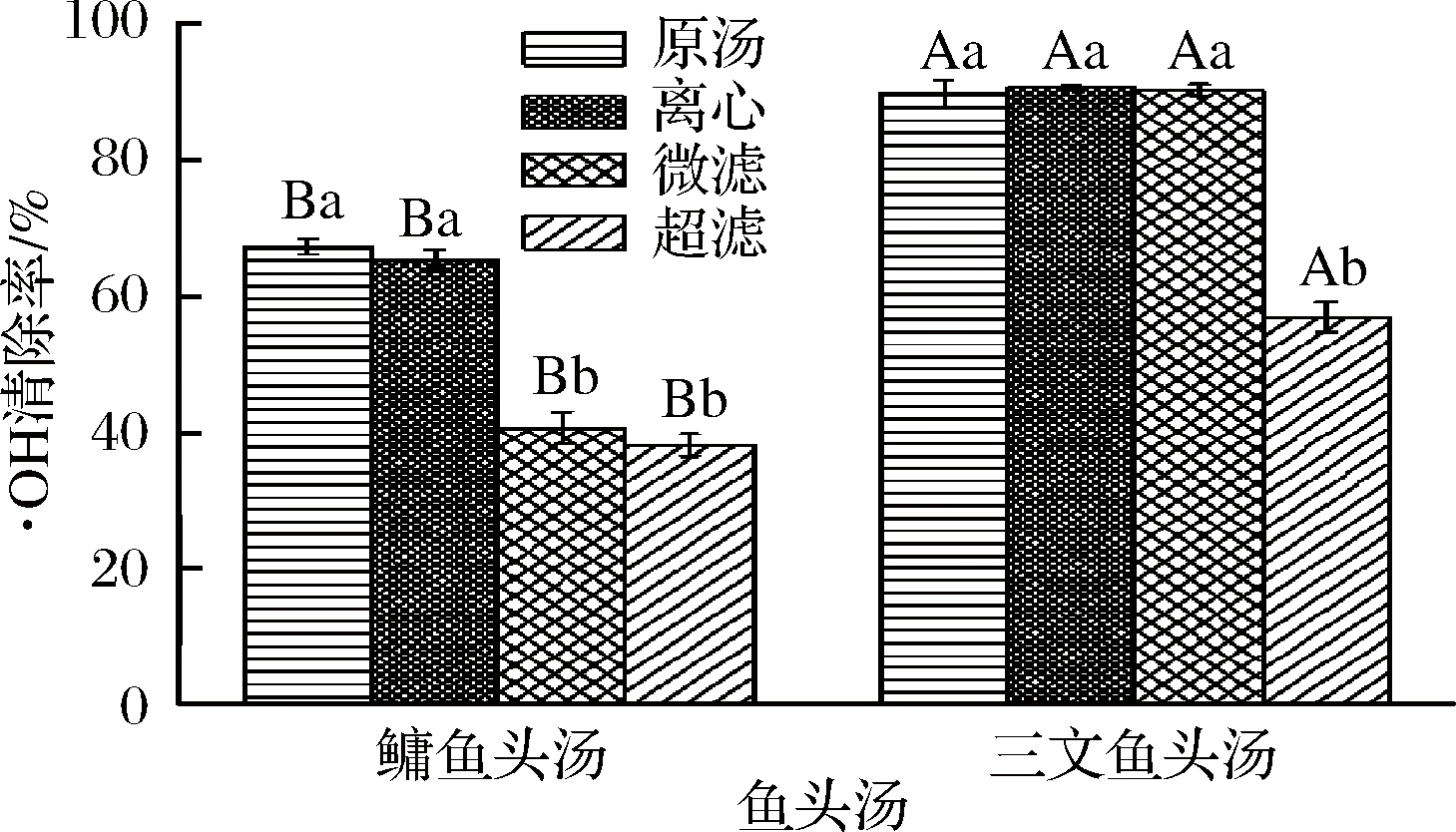
图5 不同处理方式的鳙鱼和三文鱼头汤胶粒的
·OH清除率
Fig.5 The hydroxyl free radical scavenging rate of A. nobilis
and Salmon Salar head soup colloidal with different treatment
methods
样品的抗氧化剂能使K4Fe(CN)6的Fe3+还原成Fe2+[KFe(CN)3],Fe2+进一步和FeCl3反应生成在700 nm处有最大吸光度的普鲁士蓝Fe4[Fe(CN)6]3,因此测定700 nm处的高低可以间接反映抗氧化剂的还原能力大小,吸光度越大,还原能力越强[34]。反应式如下:
3K4Fe(CN)6+4FeCl3→Fe4[Fe(CN)6]3+12KCl
图6为不同处理方式的鳙鱼和三文鱼头汤胶粒的总还原能力。由图6可知,鳙鱼头原汤与离心鱼头汤胶粒总还原能力不存在显著性差异(P>0.05),但都显著高于微滤与超滤鱼头汤(P<0.05),且超滤鱼头汤胶粒显著高于微滤鱼头汤(P<0.05);三文鱼头原汤胶粒总还原能力显著性高于离心、微滤与超滤鱼头汤(P<0.05),离心与微滤鱼头汤胶粒总还原能力不存在显著性差异(P>0.05),但都显著高于超滤鱼头汤(P<0.05)。而且不同粒径三文鱼头汤胶粒的总还原能力均大于鳙鱼头汤,这与鳙鱼和三文鱼头汤胶粒·OH清除率的结果一致。
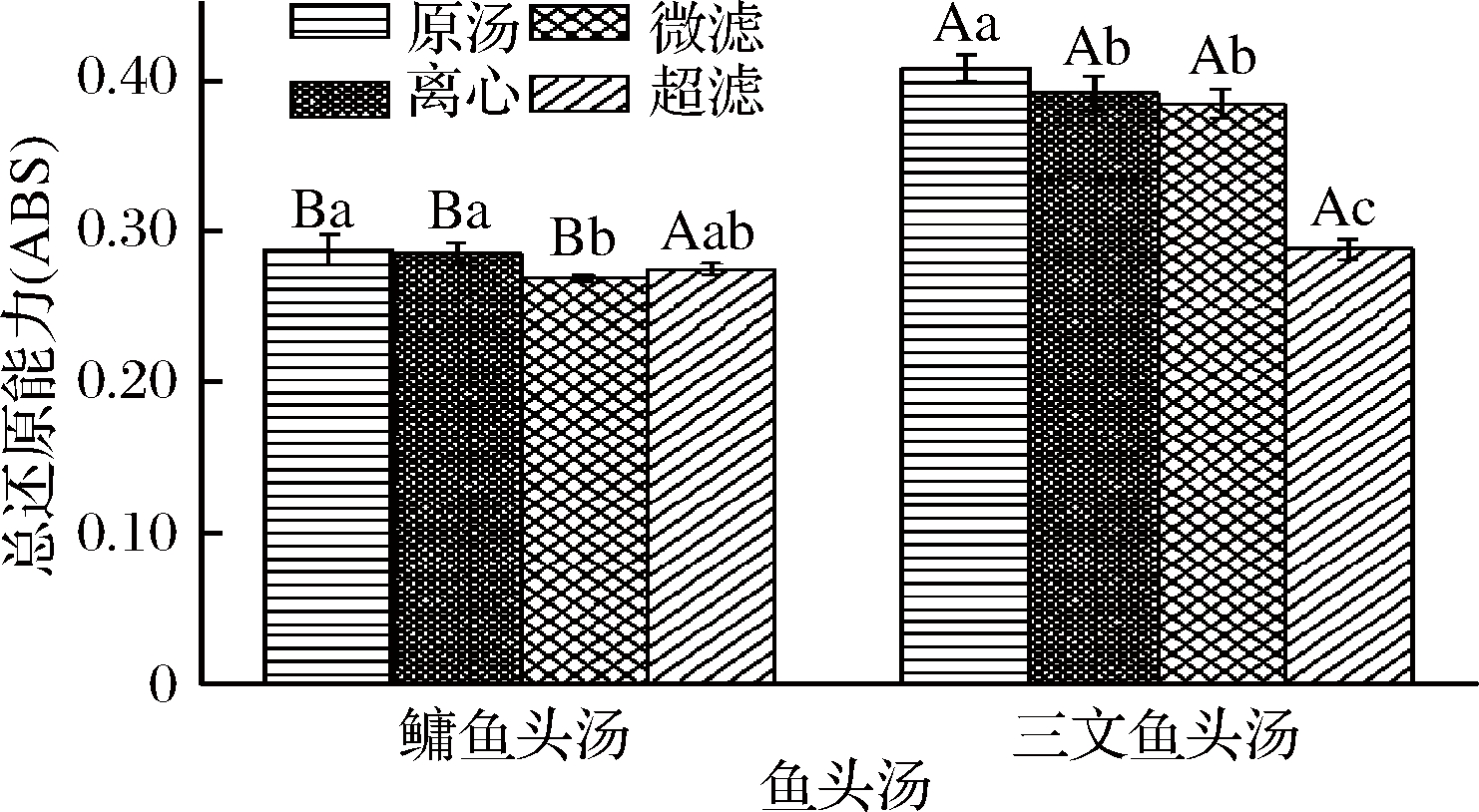
图6 不同处理方式的鳙鱼和三文鱼头汤胶粒的总还原能力
Fig.6 The total reducing power of A. nobilis and Salmon
Salar head soup colloidal with different treatment methods
通过马尔文激光粒度分析仪测定了熬煮时间为150 min的鳙鱼和三文鱼头汤经粗滤、离心、微滤和超滤等不同方式处理后的胶粒粒径分布,结果表明,经过一系列不同的处理,汤中不同粒径大小的颗粒能被初步分离。采用6种化学法研究不同粒径大小的鳙鱼和三文鱼头汤胶粒的体外抗氧化能力,结果表明,鳙鱼和三文鱼头汤胶粒的DPPH·清除能力和![]() 清除能力接近(P>0.05),鳙鱼头汤胶粒的Fe2+螯合能力和ABTS+·清除能力大于三文鱼头汤(P<0.05),且2种鱼头汤胶粒的DPPH·清除能力
清除能力接近(P>0.05),鳙鱼头汤胶粒的Fe2+螯合能力和ABTS+·清除能力大于三文鱼头汤(P<0.05),且2种鱼头汤胶粒的DPPH·清除能力![]() 清除能力、Fe2+螯合能力和ABTS+·清除能力都表现为原汤>离心>微滤>超滤。三文鱼头汤胶粒的·OH清除能力和总还原能力大于鳙鱼头汤(P<0.05)。不同粒径大小鱼头汤胶粒的抗氧化能力不同可能是因为分离的过程改变了汤中颗粒物质的化学组成以及结构,导致抗氧化能力下降,不同化学测定法的作用机理和基质有所差异,导致同种鱼头汤胶粒的体外抗氧化能力具有一定差异,在以后的研究中可对其进行探讨。
清除能力、Fe2+螯合能力和ABTS+·清除能力都表现为原汤>离心>微滤>超滤。三文鱼头汤胶粒的·OH清除能力和总还原能力大于鳙鱼头汤(P<0.05)。不同粒径大小鱼头汤胶粒的抗氧化能力不同可能是因为分离的过程改变了汤中颗粒物质的化学组成以及结构,导致抗氧化能力下降,不同化学测定法的作用机理和基质有所差异,导致同种鱼头汤胶粒的体外抗氧化能力具有一定差异,在以后的研究中可对其进行探讨。
[1] 施海涛. 最爱还是鳙鱼头[J]. 中国水产, 2012(4): 80.
[2] 林伟. 中药复方对鲢鳙鱼出血病的防治研究[J]. 当代水产, 2016(9): 90-91.
[3] 谈正衡. 鳙鱼头青鱼尾[J]. 特别健康, 2015(4): 64.
[4] 薛山, 陈慧芳, 黄艺婷, 等. 三文鱼鱼骨油粗提工艺优化及脂肪酸组成分析[J]. 中国食品添加剂, 2019,30(1): 77-85.
[5] HAQ M, CHUN B S. Microencapsulation of omega-3 polyunsaturated fatty acids and astaxanthin-rich salmon oil using particles from gas saturated solutions (PGSS) process[J]. LWT, 2018, 92: 523-530.
[6] 田婷婷. 三文鱼鱼骨和梭子蟹休闲食品的研制[D]. 厦门:集美大学, 2016.
[7] CAI Y Y, YAN H W, HAO H J, et al. Flavor research on traditional boiled pork soup and investigation of its industrialization[J]. China Condiment, 2013, 38(12): 99-101.
[8] 禄彦科. 猪骨汤微纳米胶粒的形成、化学性质及其初步分离[D]. 杭州:浙江工商大学, 2016.
[9] 王莉嫦. 鲮鱼下脚料生产方便鱼汤的关键技术研究[D]. 广州:仲恺农业工程学院, 2015.
[10] 徐红梅. 热加工对鳙鱼汤品质影响的研究[D]. 无锡:江南大学, 2008.
[11] 蒋静. 电磁加热模式对鲫鱼汤营养素释放的影响[D]. 武汉:华中农业大学, 2016.
[12] 田沁, 吴珂剑, 谢雯雯, 等. 鲢鱼头汤烹制工艺优化及烹饪模式对汤品质的影响[J]. 华中农业大学学报, 2014, 33(1): 103-111.
[13] HONDA M, ISHIZAKI T, KURODA M. The effect of dried skipjack soup stock on visual fatigue[J]. Nippon Shokuhin Kagaku Kogaku Kaishi, 2006, 53(8): 443-446.
[14] ISHIZAKI T, KURODA M, SUGITA M. The effect of dried skipjack soup stock on mood and emotional states, especially the fatigue state[J]. Nippon Shokuhin Kagaku Kogaku Kaishi, 2006, 53(4): 225-228.
[15] 黄国榕. 黑鲫鱼汤治疗肝硬化腹水30例临床研究[J]. 国医论坛, 2018,33(1):37-39.
[16] 张勇. 鲫鱼汤对阿霉素肾病大鼠治疗作用及机制的研究[D]. 青岛:青岛大学, 2013.
[17] ZHANG G, ZHENG S, FENG Y, et al. Changes in nutrient profile and antioxidant activities of different fish soups, before and after simulated gastrointestinal digestion[J]. Molecules 2018, 23(8):1 965.
[18] 钱雪丽, 苏红, 樊馨怡, 等. 金枪鱼头汤中脂肪酸组成、维生素E含量分析及微观形貌观察[J]. 上海海洋大学学报, 2019, 28(5): 801-810.
[19] QIAN X L, FAN X Y, SU H, et al. Migration of lipid and other components and formation of micro/nano-sized colloidal structure in Tuna(Thunnus obesus)head soup[J]. LWT-Food Science and Technology, 2019,111:69-76.
[20] BAKAR M F A, MOHAMDE M, RAHMAT A, et al. Phytochemicals and antioxidant activity of different parts of bambangan(Mangifera pajang)and tarap(Artocarpus odoratissimus)[J]. Food Chemistry, 2009,113(2): 479-483.
[21] 韩娜, 杨敏, 杨继涛, 等. 酪蛋白酶解物的分离及其抗氧化活性[J]. 食品工业科技, 2019, 40(9): 166-170;229.
[22] 白海娜, 王振宇, 刘瑞海, 等. 白藜芦醇与黑木耳多糖协同清除ABTS自由基活性的研究[J]. 现代食品科技, 2014, 30(3): 64-68.
[23] 崔红军, 徐宝才, 王莉, 等. 脱脂米糠碱溶醇溶物抗氧化活性研究[J]. 食品与生物技术学报, 2016, 35(1): 35-41.
[24] LAI F R, WEN Q B, LI L, et al. Antioxidant activities of watersoluble polysaccharide extracted from mung bean (Vigna radiata L.) hull with ultrasonic assisted treatment[J]. Carbohydrate Polymers, 2010, 81(2): 323-329.
[25] 陈静, 陈志宏, 张汆, 等. 青、红花椒提取物体外抗氧化性质分析[J]. 中国调味品, 2018, 43(9): 62-66;72.
[26] 戴结玲, 杨琼利, 孙红梅. 化妆品抗氧化功效评价方法研究进展[J]. 化工管理, 2018, 490(19): 63-65.
[27] GULCIN I. Comparison of in vitro antioxidant and antiradical activities of L-tyrosine and L-Dopa[J]. Amino Acids, 2007, 32(3):431-438.
[28] 张雪, 苗婷婷, 陆炯, 等. 天然产物抗氧化活性评价方法研究进展[J]. 广州化工, 2017, 45(19): 7-10.
[29] 王晓宇, 杜国荣, 李华. 抗氧化能力的体外测定方法研究进展[J]. 食品与生物技术学报, 2012, 31(3): 247-252.
[30] FAN W J, QIAO J L, GUAN X H. Multi-wavelength spectrophotometric determination of Cr(VI) in water with ABTS[J]. Chemosphere, 2017, 171: 460-467.
[31] 何蕾. 猪骨汤微纳米胶粒构造对胶体特性及其生物活性的影响[D]. 杭州:浙江工商大学, 2018.
[32] PAN B, LI H, LANG D, et al. Environmentally persistent free radicals: Occurrence, formation mechanisms and implications[J]. Environmental Pollution, 2019(248): 320-331.
[33] ALI B, MOJTABA S, HAMID A. Hemoglobin detection using carbon dots as a fluorescence probe[J]. Biosensors and Bioelectronics, 2015(71): 470-475.
[34] 谈利红, 杨宗发, 张丹, 等. 中药抗氧化活性成分及评价方法研究进展[J]. 亚太传统医药, 2017, 13(10): 35-37.