随着新版药品生产质量管理规范(good manufacturing practices,GMP)的深入落实,更加标准化的预罐装培养平皿被应用于洁净环境的微生物监测。无菌预罐装培养平皿是经钴60辐照终端灭菌的培养基[1]。一定剂量的辐照可以确保无菌但会引起其他物质的物理和化学变化,抑制某些类群微生物的生长[2-5]。为确保监测结果的准确性,必须要对辐照培养基进行适用性检查并提高辐照培养基的适用性。前人研究指出[6-8],金属离子或某些还原性较强的化合物对过氧化物有不同的影响。1991年,MARTHI等[9]首次报道了氨基酸的抗氧化作用,发现氨基酸的抗氧化活性很高。另外,微生物来源的过氧化氢酶由于其高活性、快速繁殖、易于处理并且可作为解毒系统,抵抗不同氧化反应形成的活性氧[10-12]。因此寻找改善辐照培养基的添加剂和研究添加剂的作用,具有一定的现实意义。
实验采用标准菌株金黄色葡萄球ATCC 6538、枯草芽孢杆菌ATCC 6633、铜绿假单胞菌ATCC 9023、白色念珠菌ATCC 10231、黑曲霉ATCC 16404、人参土芽孢杆菌对胰酪大豆胨琼脂(tryptic soy agar,TSA)辐照培养基进行质量评价[13]。同时,通过延长辐照培养基贮存时间以及向辐照培养基中添加某些无菌还原性化合物(过氧化氢酶、五倍子酸、抗坏血酸、硫胺素、焦性没食子酸)、氨基酸(主要是L-半胱氨酸、蛋氨酸、丝氨酸、丙氨酸、酪氨酸)、金属离子(Mg2+、Cu2+、K+、Mn2+、Zn2+、Fe3+)、产过氧化氢酶菌株(C3、H1、GL3、H5、1-5、1-10、2-4、2-9)的无菌发酵液等,观察各因素对辐照培养基中微生物恢复生长有何种直接影响,来反映各因素对辐照培养基适用性的改善效果。
1.1.1 菌种与试剂
金黄色葡萄球菌(Staphylococcus aureus)ATCC 6538、枯草芽孢杆菌(Bacillus subtilis)ATCC 6633、铜绿假单胞菌(Pseudomonas aeruginosa)ATCC 9023、白色念珠菌(Candida albicans)ATCC 10231、黑曲霉(Aspergissus niger)ATCC 16404、人参土芽孢杆菌(Bacillus ginsengihumi),由上海诺狄生物科技有限公司及本实验室提供;菌株C3、H1、GL3、H5、1-5、1-10、2-4、2-9,分别筛选自上海东海海水及药厂洁净环境,其中GL3是具有高过氧化氢酶活性的菌株,经生理生化鉴定后命名为Bacillus firmus GL3(B. firmus GL3)。以上菌株均由本实验室保存在-80℃冰箱。
实验所用化学试剂均为分析纯,国药化学试剂有限公司。
1.1.2 培养基
胰酪大豆胨琼脂(TSA)培养基,分为辐照终端灭菌与对照培养基2种。
种子培养基,胰酪大豆胨液体(TSB)培养基和2216E液体培养基(用于海生细菌培养),121 ℃灭菌15 min。
发酵培养基同种子培养基。
1.1.3 仪器与设备
紫外可见分光光度计UV-VIS 2 300,上海天美科学仪器有限公司; 台式pH730精密测试仪,德国WTW;ClassⅡBSC生物安全柜,ESCO公司;高速台式离心机,上海安亭科学仪器厂。
1.2.1 辐照培养基适用性检查
按照《中国药典》2015年版四部“1106非无菌产品微生物限度检查。微生物计数法”的规定[14-16]培养基的适用性以菌落回收率和菌落形态作为判定标准。洁净环境监测用的TSA培养基经辐照终端灭菌后产生自由基的氧化反应,因此要对辐照TSA培养基进行适用性检查。
菌液制备:将5种标准菌株和人参土芽孢杆菌的新鲜培养物,用0.9%的无菌生理盐水稀释成不大于100 CFU/mL的菌悬液。取各供试菌的菌悬液0.1 mL分别涂布于对照TSA培养基、辐照TSA培养基上,置于30~35℃的恒温培养箱中培养72 h,每个TSA培养基上的供试菌都要有3次平行实验,最后进行菌落计数并观察菌落形态及菌落分布均匀情况如公式(1)所示。
平均菌落相对回收率![]()
(1)
1.2.2 影响辐照培养基适用性的因素
主要考察辐照培养基贮存时间以及辐照培养基中添加某些辅助添加剂对辐照培养基适用性的影响,添加剂都经过0.25 μm的细菌过滤器过滤除菌。实验以敏感菌株金黄色葡萄球菌ATCC 6538和人参土芽孢杆菌为供试菌,菌液制备同1.2.1所述。
1.2.2.1 培养基贮存时间对辐照培养基适用性的影响
取供试菌的菌悬液0.1 mL分别涂布于经钴60辐照灭菌后贮存0、5、10、15、20、25 d的TSA培养基上,置于37 ℃恒温培养箱中培养48 h,进行菌落计数。
1.2.2.2 还原性化合物对辐照培养基适用性的影响
取供试菌的菌悬液0.1 mL分别涂布于添加有10 μL 0.1 mol/L的无菌还原性化合物硫脲、五倍子酸、抗坏血酸、硫胺素、焦性没食子酸的辐照TSA培养基上,置于37 ℃的恒温培养箱中培养48 h,进行菌落计数。
1.2.2.3 氨基酸对微生物生长的影响
取供试菌的菌悬液0.1 mL分别涂布于添加10 μL 0.1 mol/L的氨基酸L-半胱氨酸、蛋氨酸、丝氨酸、丙氨酸、酪氨酸、苯丙氨酸的辐照TSA培养基上,置于37 ℃的恒温培养箱中培养48 h,进行菌落计数。
1.2.2.4 金属离子对微生物生长的影响
取供试菌的菌悬液0.1 mL分别涂布于添加10 μL 0.1 mol/L的金属离子Mg2+、Cu2+、K+、Mn2+、Zn2+、Fe3+的辐照TSA培养基上,置于37 ℃的恒温培养箱中培养48 h,进行菌落计数。
1.2.2.5 粗酶发酵液对微生物生长的影响
将菌株C3、H1、GL3、H5、1-5、1-10、2-4、2-9的发酵液在10 000 r/min的条件下离心10 min,并将上清液通过0.25 μm的细菌过滤器以除去细菌。取供试菌的菌悬液0.1 mL分别涂布于添加10 μL 0.1 mol/L的无菌粗酶发酵液的辐照TSA培养基上,置于37 ℃的恒温培养箱中培养48 h,进行菌落计数。
1.2.3 菌株GL3产过氧化氢酶条件的优化及应用
菌株GL3是前期通过生理生化鉴定的1株高过氧化氢酶活性菌株。在单因素的基础上,通过pLackett- burman(PB)实验筛选出显著影响因素并利用中心复合设计(box-benhnken design, BBD)优化显著因素的响应面实验,以期获得更高过氧化氢酶活性为改善培养基的适用性奠定基础。
1.2.3.1 过氧化氢酶活性的测定
采用分光光度法测定无菌体发酵液的酶活性[17-18]。以过氧化氢在240 nm处的分解速率计算酶活性。反应体系为pH=7,50 mmol/L的磷酸缓冲液,H2O2浓度30 mmol/L。取40 μL粗酶液加入2 mL磷酸缓冲液中,在比色杯中混匀,在迅速加入以磷酸缓冲液配制的30 mmol/L的H2O2 1 mL起始反应,反应总体积为3.04 mL。酶活性单位(1U)定义为25 ℃每分钟降解1 μmol H2O2(1 μmol/min)。酶活性计算如公式(2):
过氧化氢酶活性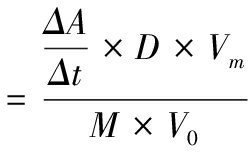
(2)
式中:ΔA,240 nm下的吸光度变化值;Δt,反应时间,min;D,粗酶的稀释倍数;Vm,反应总体积,mL;M,1 μmol/mL过氧化氢在 240 nm处的吸光度,其值为0.043 6;V0,稀释的粗酶体积,mL;酶活性,U/mL。
1.2.3.2 显著因素筛选实验
由于NaCl(g/L)、pH、时间(h)、温度(℃)、H2O2(%)、接种量(%)、Mg2+(g/L)和装液量(mL)都会影响菌株GL3产过氧化氢酶的活性。因此通过PB实验对上述8因素进行显著因素的筛选。
1.2.3.3 响应面优化实验
对筛选的显著因素采用Box-Benhnken实验设计,进行菌株GL3产过氧化氢酶活性的条件优化,最后在优化条件下得到GL3产过氧化氢酶的最优酶活性。
1.2.3.4 B. firmus GL3优化后发酵液的应用
向辐照TSA培养基分别添加10 μL 0.1 mol/L的过氧化氢酶、未优化的GL3无菌粗酶发酵液以及优化后的GL3无菌粗酶发酵液,最后每个TSA培养基分别接种0.1 mL供试菌的菌悬液,并置于37 ℃的恒温培养箱中培养48 h,进行菌落计数。
《中国药典》规定被检培养基菌落数与对照培养基菌落数比值应在0.5~2,且菌落形态大小应与对照培养基上的菌落一致[19]。通过各种供试菌在对照培养基与辐照培养基上菌落回收数率的比较可知(表1),辐照培养基中供试菌金黄色葡萄球菌ATCC 6 538和人参土芽孢杆菌的菌落回收率低于50%,且菌落分布较均匀;而其余供试菌的菌落回收率正常,菌落分布均匀。表明辐照后培养基发生自由基的氧化反应,产生某种物质抑制金黄色葡萄球菌和人参土芽孢杆菌的正常生长。
表1 TSA辐照培养基适用性检查结果
Table 1 The suitability test results of TSA irradiation medium

菌种菌落总数×10-6/(CFU·mL-1)对照TSA培养基辐照TSA培养基平均菌落相对回收率/%菌落分布金黄色葡萄球菌ATCC 65381014242较均匀枯草芽孢杆菌ATCC 66331089891很均匀铜绿假单胞菌ATCC 9027989597很均匀白色念珠菌ATCC 102311039794很均匀黑曲霉ATCC 16404978285很均匀人参土芽孢杆菌961213较均匀
2.2.1 贮存时间对辐照培养基适用性的影响
比较了辐照终端灭菌的培养基贮存时间对其适用性的影响,结果如图1所示。图1结果显示辐照培养基贮存期在0~15 d,2种供试菌的生长仍然受到抑制;当贮存时间超过15 d后,2种供试菌的生长恢复正常。此研究结果表明辐照对敏感菌的抑制作用能够随培养基贮存时间的延长而消失。对于辐照的TSA培养基贮存15 d后可以正常使用。
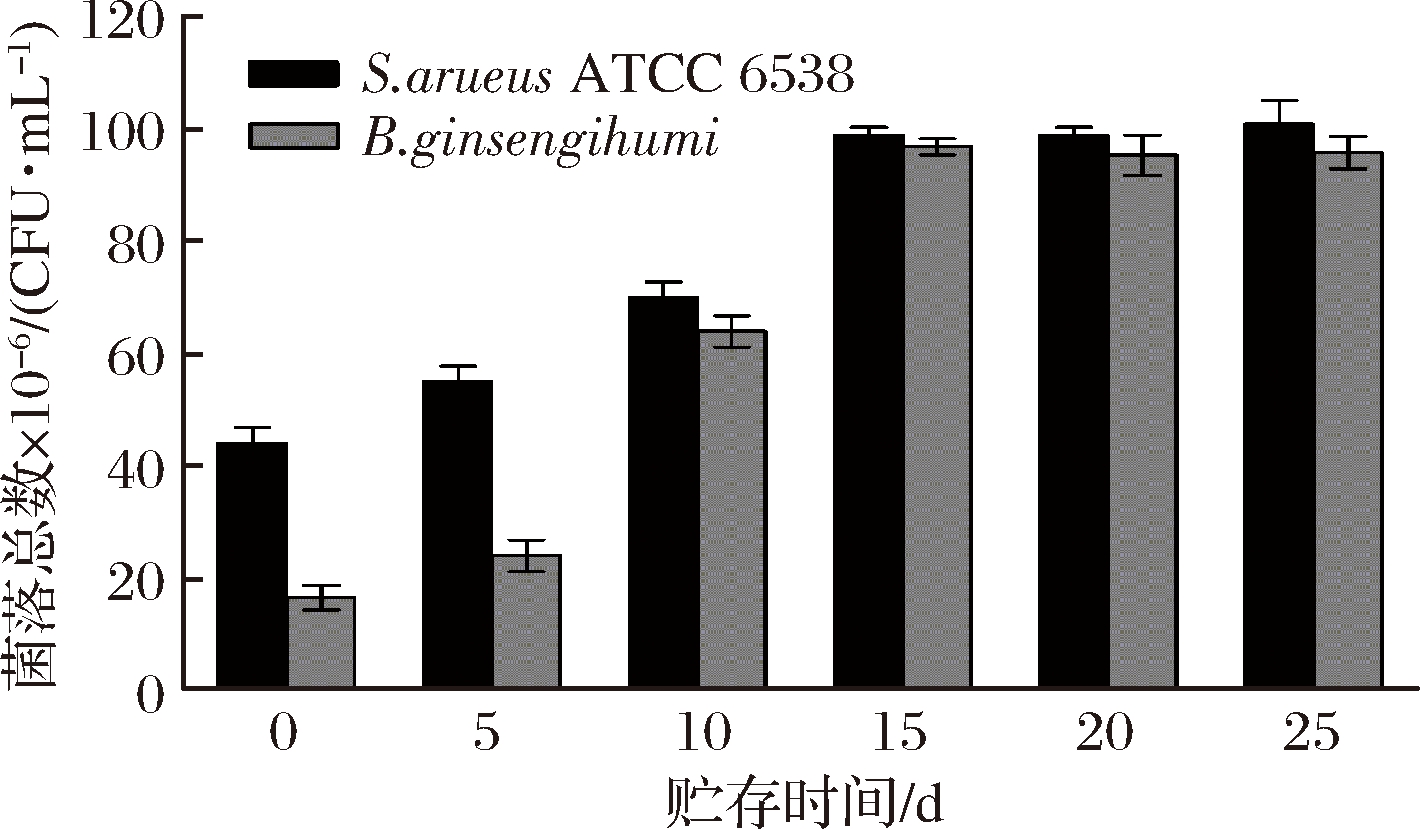
图1 贮存时间对辐照培养基适用性的影响
Fig.1 The effect of storage time on the suitability of
irradiation medium
2.2.2 有机化合物对辐照培养基适用性的影响
比较了不同化合物对辐照培养基适用性的影响,结果如图2所示。考虑到辐照产生自由基的氧化反应,在辐照培养基中添加各种具有还原性的化合物后,金黄色葡萄球菌与人参土芽孢杆菌的菌落生长有所恢复,其中焦性没食子酸与五倍子酸对辐照培养基中菌株恢复生长的效果比硫胺素、硫脲、抗坏血酸的恢复效果好,但是2种菌菌落总数还是低于对照培养基中的菌落总数。
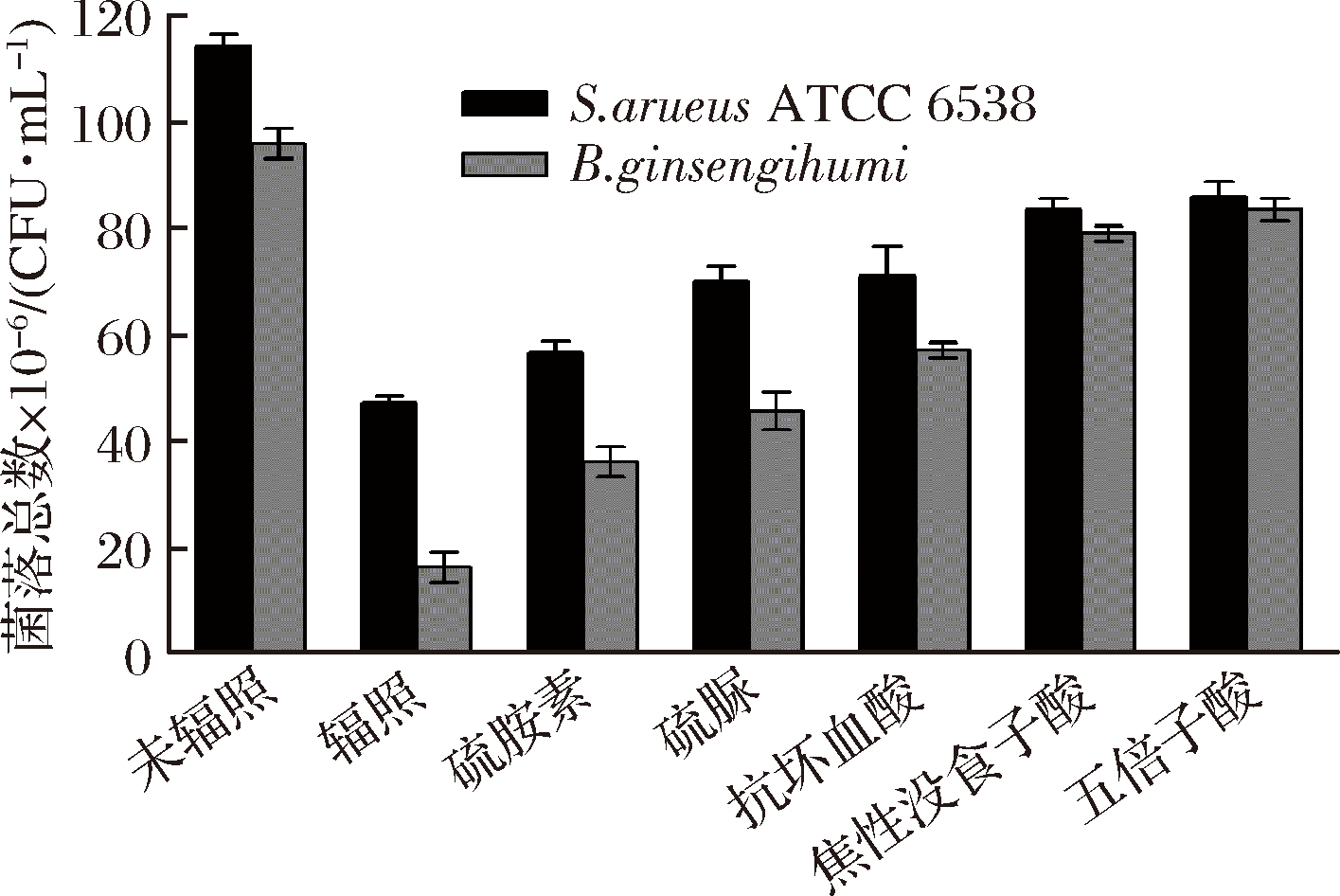
图2 还原性化合物对辐照培养基适用性的影响
Fig.2 The effect of reducing compounds on the
suitability of irradiation medium
2.2.3 氨基酸对辐照培养基适用性的影响
比较了不同氨基酸对辐照培养基适用性的影响,结果如图3所示。辐照产生自由基的氧化反应,辐照培养基中不同外源氨基酸的添加对自由基的清楚能力不同。辐照培养基中添加蛋氨酸、丙氨酸、丝氨酸后,对金黄色葡萄球菌ATCC 6538和人参土芽孢杆菌的生长有抑制作用;而L-半胱氨酸、酪氨酸、苯丙氨酸的添加能够促进2种供试菌在辐照培养基的生长。实验表明L-半胱氨酸、酪氨酸对辐照产生的自由基清除能力最强,苯丙氨酸次之;蛋氨酸、丙氨酸、丝氨酸无自由基的清楚能力。此研究结果与李新、许猛的研究结果一致[20-21]。
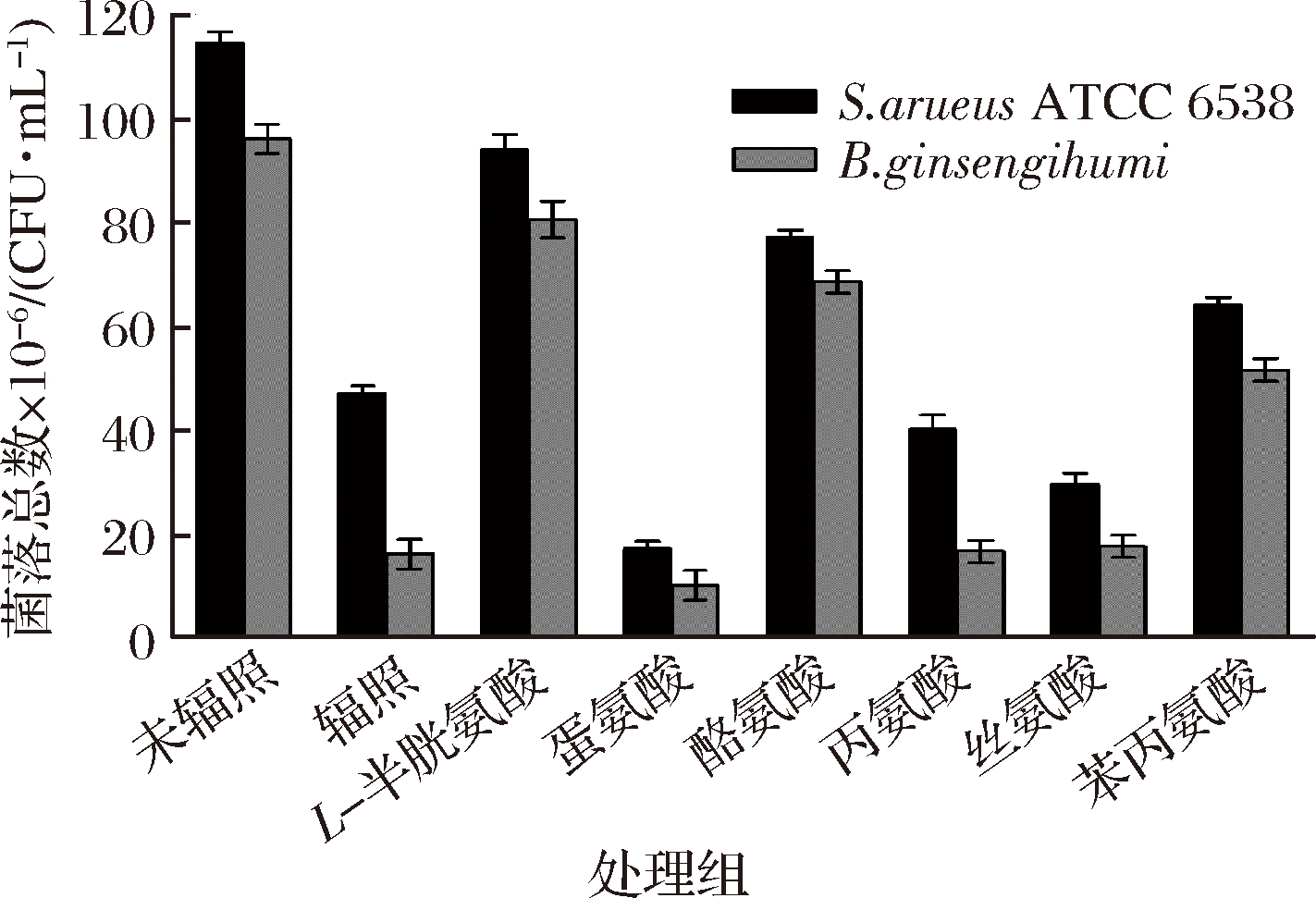
图3 氨基酸对辐照培养基适用性的影响
Fig.3 The effect of amino acids on the applicability
of irradiated medium
2.2.4 金属离子对辐照培养基适用性的影响
比较了不同金属离子对辐照培养基适用性的影响,结果如图4-a所示。多种金属离子的添加对辐照培养基中微生物的生长具有直接的影响,Mg2+、Mn2+、K+的添加对辐照培养基中微生物的生长具有一定的促进作用,而培养基中Cu2+、Fe3+的添加对微生物生长具有抑制作用,Zn2+对辐照培养基适用性的影响不大。此研究结果与RICCIARDI等和JUNILLON等的研究结果一致[22-23]。同时比较了不同金属离子对金黄色葡萄球菌和人参土芽孢杆菌的过氧化氢酶活性的影响(图4-b),通过研究发现Mg2+、Mn2+、K+的添加可以促进2种菌过氧化氢酶的产生,而Cu2+、Fe3+的添加对菌株的过氧化氢酶活性有抑制作用。以上研究结果表明,辐照产生自由基的氧化反应主要生成过氧化氢,2种供试菌对辐照产生的过氧化氢敏感,特别是人参土芽孢杆菌;另外,菌株过氧化氢酶活性的提高可以抵消过氧化氢对敏感菌株的胁迫作用。
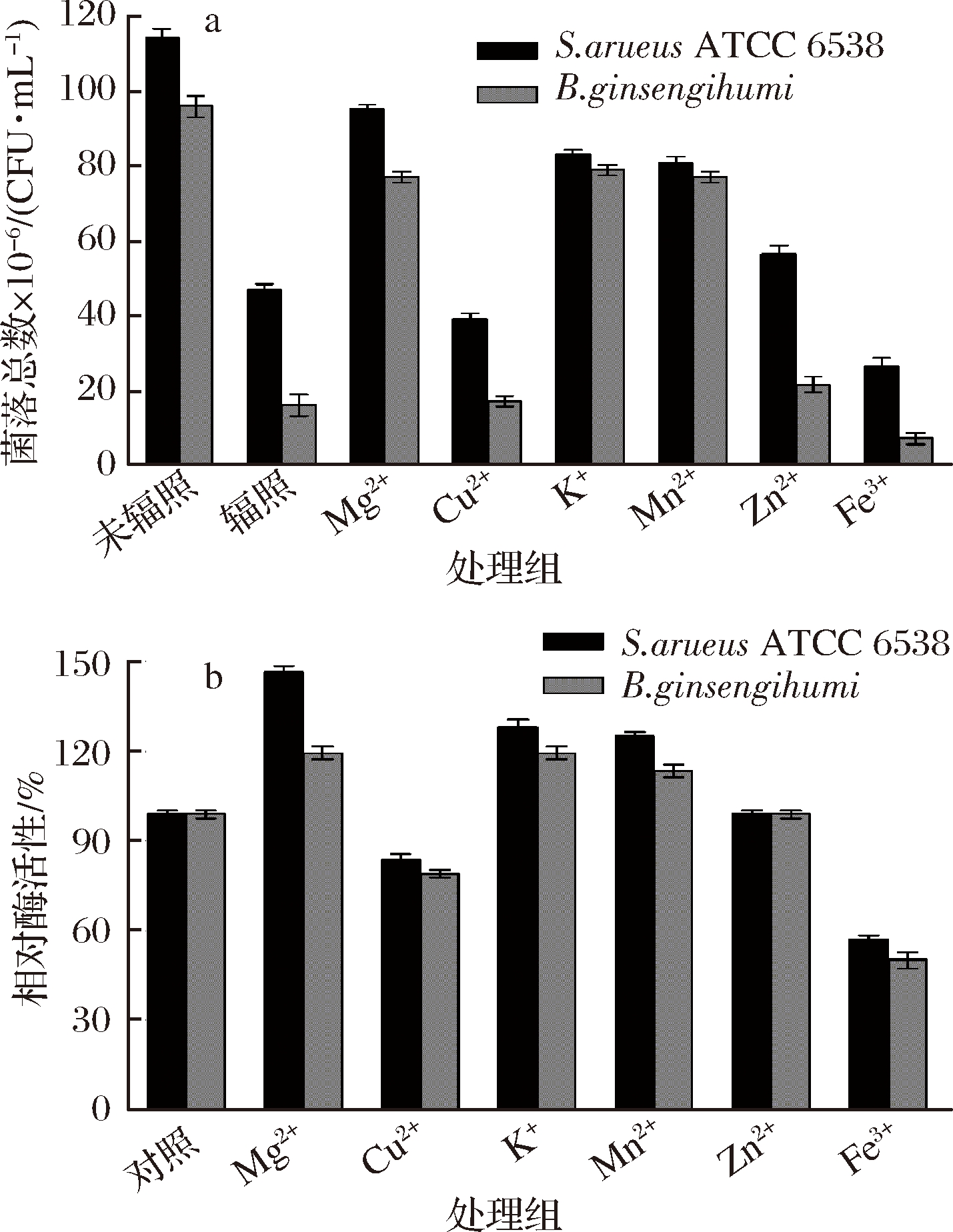
a-菌落总数;b-相对酶活性
图4 金属离子对辐照培养基适用性及供试菌酶活性的影响
Fig.4 The applicability of metal ions to irradiation medium
and the activity of enzymes for test bacteria
2.2.5 筛选菌株的粗酶发酵液对辐照培养基适用性的影响
辐照培养产生自由基氧化反应形成过氧化氢,它可以被过氧化氢酶利用。FREY等和STRUHARNANSKA等[24-25]证明过氧化氢酶可以用作敏感菌株生长培养基的良好添加剂。通过从上海市东海海水与药厂洁净环境中筛选出8株高过氧化氢酶活性菌株,从中提取各菌株的无菌体粗过氧化氢酶发酵液。比较了8株筛选菌株的粗过氧化氢酶发酵液对辐照培养基适用性的影响。结果如图5所示,具有高过氧化氢酶活性的菌株粗酶发酵液对受过氧化氢胁迫的敏感菌生长有复苏作用。菌株GL3的粗酶发酵液对敏感菌的促生长作用效果相较于其他产过氧化氢酶的菌株效果最好。因此决定对菌株GL3进行进一步的研究。

图5 粗酶发酵液对培养基适用性的影响
Fig.5 The effect of crude enzyme fermentation
broth on the suitability of medium
2.3.1 显著因素的筛选结果
根据《伯杰细菌学手册》(第九版)并参考《常见细菌系统鉴定手册》的部分方法对菌株GL3进行生理生化鉴定并将菌株GL3的16SrDNA基因序列进行在线Blast比对分析。根据GL3的形态特征、生理生化鉴定结果以及GL3的16S rRNA基因序列的系统发育树,将GL3鉴定为坚强芽孢杆菌(Bacillus firmus)并命名为Bacillus firmus GL3。利用PB设计对影响B. firmus GL3的产过氧化氢酶活性的的8因素进行筛选。筛选出最显著因素,实验设计及结果如表2所示。利用Minitab17对表2数据进行分析,结果表明回归方程显著(P=0.001),R2=0.999 7表明该模型可信。
表2 Plackett-Burman实验的设计及其响应值表(N=12)
Table 2 The design and response table of Plackett-Burman
experiment

实验号因子与水平ABCDEFGHJK酶活Y/(U·mL-1)11-11-1-1-1111-117 983.4211-11-1-1-111116 111.73-111-11-1-1-11119 597.241-111-11-1-1-1118 557.8511-111-11-1-1-117 171.96111-111-11-1110 667.97-1111-111-11-116 403.88-1-1111-111-1117 783.89-1-1-1111-111-115 119.4101-1-1-1111-11117 446.311-11-1-1-1111-119 778.912-1-1-1-1-1-1-1-1-1-120 446.9
PB实验模型方差分析结果如表3所示,显著性排序为Mg2+含量>培养时间>NaCl>装液量>H2O2含量>初始pH>接种量>培养温度,P<0.05的因素对响应面有显著影响,因此进一步选择Mg2+(g/L)、培养时间(h)、NaCl(g/L)3个显著影响因素进行优化研究。
2.3.2 显著因素响应面优化结果
通过对响应面的中心复合设计得到NaCl、培养时间、Mg2+的最佳组合。酶活性的优化预测结果见表4所示,当NaCl为11.24 g/L,培养时间18.09 h,Mg2+为0.54 g/L时,预测B. firmus GL3产过氧化氢酶活性高达21 013.8 U/mL。为了验证响应面所得的最佳产酶活性条件的可实施性,在实际实验条件,NaCl为11.24 g/L,培养时间18 h,Mg2+为0.54 g/L为最佳产酶活性条件,分别进行5次平行实验,所得B. firmus GL3的过氧化氢酶活性为(20 668±103) U/mL,结果与预测值基本一致,证明优化模型有效。
表3 Plackett-Burman实验的分析结果
Table 3 Analysis results of the Plackett-Burman experiment
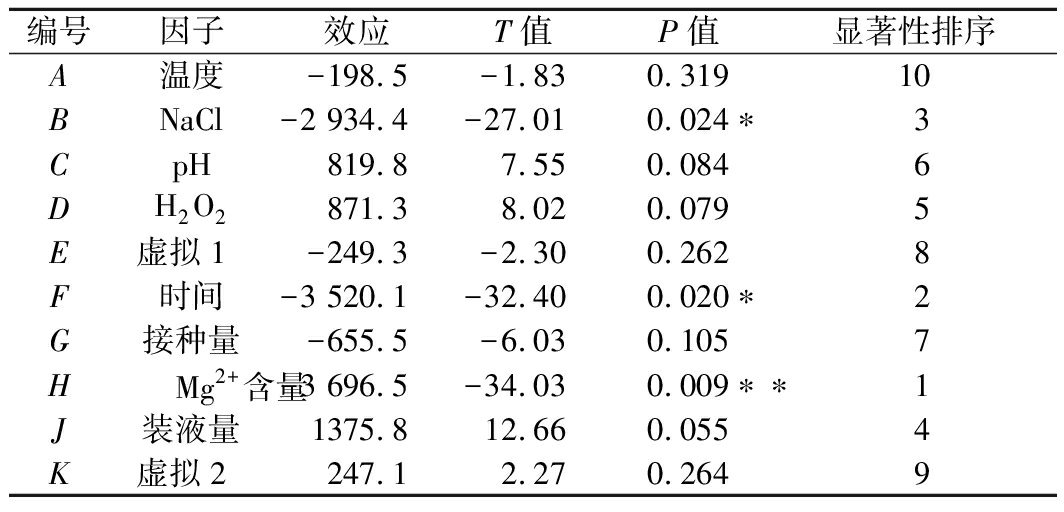
编号因子效应T值P值显著性排序A温度-198.5-1.830.31910BNaCl-2 934.4-27.010.024∗3CpH819.87.550.0846DH2O2871.38.020.0795E虚拟1-249.3-2.300.2628F时间-3 520.1-32.400.020∗2G接种量-655.5-6.030.1057HMg2+含量-3 696.5-34.030.009∗∗1J装液量1375.812.660.0554K虚拟2247.12.270.2649
注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)
表4 过氧化氢酶活性的优化预测结果
Fig.4 Optimization prediction results of catalase activity
NaCl/(g·L-1)培养时间/hMg2+/(g·L-1)过氧化氢酶活/(U·mL-1)11.2418.090.5421 013.8
2.3.3 优化后B. firmus GL3粗酶发酵液应用结果
菌株B. firmus GL3产高过氧化氢酶活性的条件通过响应面优化后,结果相比未优化的过氧化氢酶活性提高了78.84%。优化后B. firmus GL3粗酶发酵液应用结果如图6所示,以未接种菌株B. firmus GL3的液体发酵液作为空白对照,将优化过的菌株B. firmus GL3产生的过氧化氢酶粗酶发酵液无菌添加到辐照的TSA培养基后,优化后的粗酶发酵液对2种供试敏感菌金黄色葡萄球菌ATCC 6 538和人参土芽孢杆菌的具有促生长作用。由图6可知优化后的粗酶发酵液对2种供试菌的促生长作用效果最佳,且趋向于纯过氧化氢酶的作用效果。
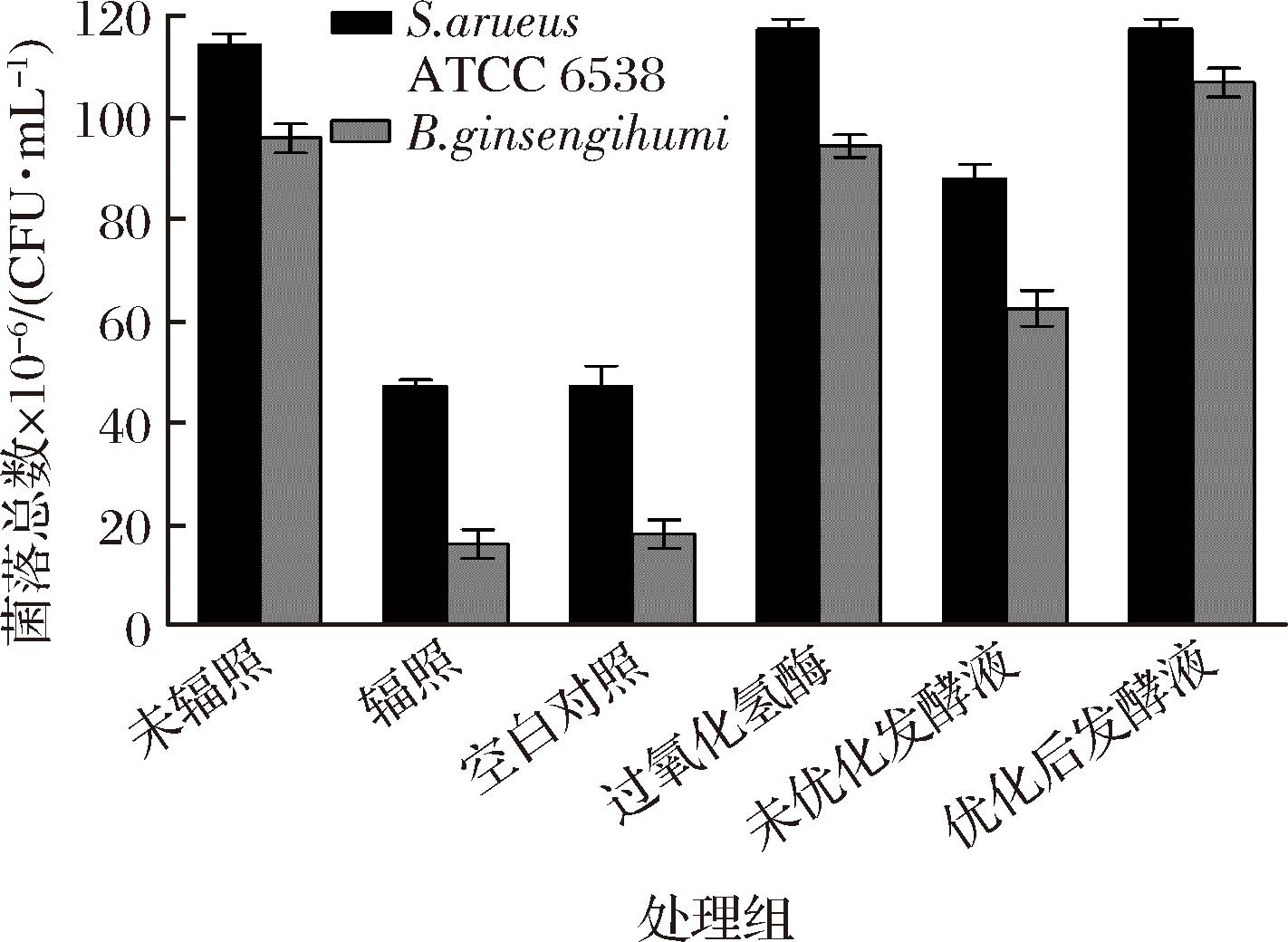
图6 优化的B. firmus GL3粗酶发酵液的应用结果
Fig.6 Optimized application results of B. firmus
GL3 crude enzyme fermentation broth
本实验对辐照的TSA培养基进行适用性检查发现,标准菌株金黄色葡萄球菌ATCC 6538与人参土芽孢杆菌在辐照TSA培养基上的菌落回收率低于50%,结果表明商业TSA培养基经辐照终端灭菌后产生有毒物质抑制了2种供试菌的生长。在辐照培养基贮存15 d以后,辐照TSA的培养基中2种供试菌恢复正常生长;同时发现还原性化合物焦性没食子酸与五倍子酸,氨基酸L-半胱氨酸、酪氨酸、苯丙氨酸,金属离子Mg2+、Mn2+、K+以及高过氧化氢酶菌株的粗酶发酵液对辐照培养基中敏感菌株的恢复生长有一定的作用。
尽管国内外对于微生物产过氧化氢酶的研究一直没有中断,但相对于它们的潜力,大多数商业过氧化氢酶都无法承受恶劣的工艺条件并且在实际的工业领域规模化生产中报道的微生物过氧化氢酶还未获得广泛应用[26-27]。因此开发高活性、稳定的、新型微生物过氧化氢酶迫在眉睫,本研究通过前期筛选分离得到的高过氧化氢酶菌株GL3,经生理生化鉴定将其命名为B. firmus GL3。通过响应面优化实验将菌株B. firmus GL3产过氧化氢酶活性提高了78.84%,优化后的粗酶发酵液对2种供试菌的促生长作用效果最佳,与纯过氧化氢酶的作用效果基本一致。因此,优化的B. firmus GL3的过氧化氢酶粗酶发酵液不仅对改善辐照培养基适用性具有重要作用,也为工业生产过氧化氢酶及其应用提供参考依据。
[1] 黄家乐,王玥,何睿,等.无菌预灌装培养平皿的质量控制[J].中国药事, 2017,31(10):1 147-1 152.
[2] 王贺,曹文红,章超桦,等.UV-C辐照对凡纳滨对虾虾头主要内源酶酶学性质的影响[J].食品与发酵工业, 2019,45(19):32-37.
[3] OUNALLI L, MEJRI A, MEJRI N. Radiation efficiency of a depleted cobalt-60 source for products that require low radiation doses[J]. Radiation Physics and Chemistry,2018, 150: 169-171.
[4] 程述震,刘伟,冯晓琳,等.电子束辐照对冷鲜猪里脊肉品质及蛋白特性的影响[J].食品与发酵工业, 2017,43(3):151-153.
[5] REICHERT-SCHWILLINSKY F, PIN C, DZIECIOL M, et al. Stress- and growth rate-related differences between plate count and real-time PCR data during growth of Listeria monocytogenes[J]. Appl Environ Microbiol, 2009, 75 (7): 2 132-2 138.
[6] GEBICKA L, KRYCH-MADEJ J. The role of catalases in the prevention/promotion of oxidative stress[J]. J Inorg Biochem, 2019, 197 (45): 110-119.
[7] PEZZOIN M, PIZARRO R A, COSTA C S, Protective role of extracellular catalase (KatA) against UVA radiation in Pseudomonas aeruginosa biofilms[J]. J Photochem Photobiol B, 2014, 131 (32):53-64.
[8] GUO L, ZHANG C, CHEN G, et al. Reactive oxygen species inhibit biofilm formation of Listeria monocytogenes[J]. Microb Pathog 2019, 127:183-189.
[9] MARTHI B, SHAFFER B T, LIGHTHART B, et al. Resuscitation effects of catalase on airborne bacteria[J]. Applied and Environmental Microbiology, 1991,57(9): 2 775-2 776.
[10] 龙霞,黄先智,丁晓雯.鸭油对D-gal诱导小鼠氧化应激的改善作用[J].食品与发酵工业, 2019, 45 (19):90-97.
[11] DING R, LI Z F, CHEN S, et al. Enhanced secretion of recombinant α-cyclodextrin glucosyltransferase from E. coli by medium additives[J]. Process Biochemistry 2010, 45(6):880-886.
[12] NAGAMORI E, OMOTE M, HONDA H, et al. Enhanced and prolonged production of plantlets regenerated from carrot callus in a viscous additive-supplemented medium[J]. Journal of Bioscience and Bioengineering 2001, 91(3):283-287.
[13] 武永秀,马仕洪,杨美琴,等.人参土芽孢杆菌用于胰酪大豆胨琼脂培养基的质量控制研究[J].中国药事2019, 33(2):166-171.
[14] 黄有兴,吴小权,黄玉华.头孢类生产环境监测用培养基适用性研究[J].中国检验检测,2018, 26(5):70-72.
[15] 甘良英,张晓军,邓祥,等.新型胰蛋白胨葡萄糖培养基用于透析用水细菌检测的临床适用性多中心研究[J].中国血液净化,2018, 17(9):613-616.
[16] 刘竞鸥,严东珍,卢美玲,等.洁净室环境监测用培养基贮存效期的验证及方法学确认[J].微生物学免疫学进展, 2018, 46(5):61-65.
[17] HADWAN M H, ALI S K. New spectrophotometric assay for assessments of catalase activity in biological samples[J]. Anal Biochem, 2018, 542: 29-33.
[18] 张言周. Bacillus altitudinis SYBC hb4的分离鉴定及其过氧化氢酶性质与应用研究[D].无锡:江南大学,2016.
[19] 国家药典委员会.中华人民共和国药典(2015年版)(四部)[M].北京:化学工业出版社, 2015.
[20] 李新.氨基酸和酚类化合物的联合抗氧化作用研究[D].长春:吉林大学, 2017.
[21] 许猛.复合氨基酸制剂对小白菜和棉花抗逆性的影响[D].北京:中国农业大学, 2018.
[22] RICCIARDI A, IANNIELLO RG, PARENTE E, et al. Factors affffecting gene expression and activity of heme- and manganese- dependent catalases in Lactobacillus casei strains[J]. International Journal of Food Microbiology 2018, 280:66-77.
[23] JUNILLON T, FLANDROIS J P. Diminution of 2,3,5-triphenyltetrazolium chloride toxicity on Listeria monocytogenes growth by iron source addition to the culture medium[J]. Food Microbiology 2014, 38:1-5.
[24] FREY H E, POLLARD E C. Ionizing radiation and bacteria: Nature of the effect of irradiated medium[J]. Radiation Research, 1996, 28:668-676.
[25] STRUHARNANSKA E, LEVARSKI Z, BIROVA S, et al. Effect of recombinant catalase AfKatG as an additive in growth media of food strains[J]. Journal of Biotechnology, 2018, 280:32-91.
[26] ATALAH J, CACERES-MORENO P, ESPINA G, et al. Thermophiles and the applications of their enzymes as new biocatalysts[J]. Bioresource Technology, 2019, 280:478-488.
[27] LIU Q, XUN G, FENG Y, et al. The state-of-the-art strategies of protein engineering for enzyme stabilization[J]. Biotechnology Advances, 2019, 37(4):530-537.