在许多国家,弯曲杆菌属会导致结肠炎的发生 [1]。在美国,受到弯曲杆菌感染而发病的概率已经达到4.4‰,并且每年已经被统计在案的病例超过130万例[2]。而在我国,每年的发病率也达到了1.2‰[3]。空肠弯曲杆菌(Campylobacter jejuni)属于弯曲杆菌,会导致某些外周神经性疾病的发生,比如说格林-巴利综合征[4]。在鸡、鸭等家禽体内,空肠弯曲杆菌被发现的频率颇高,而其他农副产品,比如猪肉和牛肉,也会成其宿主。全球零售肉制品及其他农副产品中弯曲杆菌的感染率超过50%,人类食入未煮熟或已经受污染的食物及水源都会引起感染[5]。
迄今为止,尤其是在禽类行业,对空肠弯曲杆菌的治疗还是集中在抗生素方面。伴随抗生素的滥用,具有抗性的空肠弯曲杆菌呈逐年递增之态,严重的二次污染以及宿主体内微生态紊乱等问题也会随之而来[6-8]。随着研究的深入,乳酸菌可以在人体肠道内有效定植并在维持肠道功能和宿主健康方面发挥至关重要的作用已经成为不争的事实。目前,乳酸菌已被证明可用于预防弯曲杆菌感染。NISHIYAMA等[9]从健康的鸡粪便中分离出的格氏乳杆菌Lactobacillus gasseri SBT2055可以在鸡体内有效降低空肠弯曲杆菌的定植量。另一项研究显示,受空肠弯曲杆菌感染的火鸡在接受唾液乳杆菌Lactobacillus salivarius NRRL B-30514治疗后,病原菌的侵袭明显减少,通过对NRRL B-30514的抑菌成分研究发现,其生长产生的细菌素能有效抑制空肠弯曲杆菌的繁殖。另外,NRRL B-30514在体内对空肠弯曲杆菌形成的竞争性排斥也是其抑制病原菌体内占位定植的机制之一[10]。
笔者研究发现,唾液乳杆菌(L. salivarius)CCFM 1054体外培养后具有较强的产酸能力,且能抑制空肠弯曲杆菌的生长,在人工模拟胃肠液的情况下具备良好的耐受能力,并且能够在共培养的条件下对空肠弯曲杆菌生长产生抑制作用。与此同时,CCFM 1054具备了对HT-29细胞的高黏附性及较强的自我成膜能力;干预于空肠弯曲杆菌和弓形虫复合感染的小鼠,能显著改变肠道菌群的组成,降低空肠弯曲杆菌在小鼠体内的定植率并缓解其在体内的感染。
1 材料与方法
1.1 菌株、细胞及小鼠
唾液乳杆菌Lactobacillus salivarius CCFM 1054、鼠李糖乳杆菌Lactobacillus rhamnosus LGG、植物乳杆菌Lactobacillus plantarum N49,空肠弯曲杆菌NCTC 11168,人结肠癌细胞株HT-29均来自于江南大学食品学院生物技术中心菌种库。
实验小鼠采用C57BL/6品系,SPF级,雌性,3周龄,购于上海斯莱克实验动物有限公司,于江苏省血吸虫病防治研究所动物房中分笼饲养。
1.2 实验试剂
MRS培养基,青岛海博生物技术有限公司;脑心浸液肉汤(BHI),Oxoid(英国)公司;无菌绵羊血,杭州新锐生物工程有限公司;胎牛血清,HyClone(美国)公司;哥伦比亚血平板培养基,Oxoid(英国)公司;青霉素/链霉素溶液以及庆大霉素,上海生物工程有限公司;RPMI-1640培养基,Gibco(美国)公司;粪便样品基因组提取试剂盒(Fast DNA SPIN Kit for Feces),美国MP公司;胶纯化回收试剂盒(QIAquick Gel Extraction Kit),德国Qiagen 公司。
人工胃液:pH 2.0、3 g/L胃蛋白酶(Sigma)的PBS(5.0 g/L),过0.22 μm无菌微孔滤膜。
人工肠液:pH 8.0、1 g/L胰蛋白酶(Sigma)和0.3 g/L牛胆盐的PBS(5.0 g/L),过0.22 μm无菌微孔滤膜。
1.3 仪器与设备
第二代高通量测序仪(Mi Seq),Illumina(美国)公司;生物安全柜,Labconco(美国)公司;小型台式高速离心机(5415R),Eppendorf(德国)公司;pH计(starter3100),Haus(美国)公司;三气培养箱(BD150L),Bingd(德国)公司;凝胶成像仪( Universal hood II),美国伯乐(Bio-Rad)公司;酶标仪,Thermo(美国)公司;隔水式恒温培养箱(GRP-9160型),上海森信实验仪器有限公司;光学显微镜(Leica DM2000),Leica光学仪器(日本)公司;电子天平(ME3002E/02),上海METTLER TOLEDO仪器有限公司。
1.4 细菌菌悬液及上清液(CFS)的制备
乳酸菌:在液体MRS中按照2%的接种量接种,37 ℃下培养24 h为一代,传代2次,8 000 r/min,6 min,4 ℃条件下离心,收集发酵上清液及菌体。用PBS清洗2次菌体,重悬,调整所需浓度备用;采用 0.22 μm无菌微孔滤膜对上清液进行过膜处理,4 ℃冰箱保存。
空肠弯曲杆菌:在液体BHI培养中按照2%的接种量接种,置于三气(气体成分为5% O2、10% CO2和85% N2)培养箱,37 ℃隔天培养48 h为一代,传代2次, 5 000 r/min、10 min、4 ℃条件下离心,用PBS清洗2次菌体,重悬,调整所需浓度备用。
1.5 乳酸菌产酸能力与体外牛津杯抑菌实验
将pH计探头插入乳酸菌上清液中,测定其pH。采用牛津杯法[11]测定乳酸菌发酵上清液对空肠弯曲杆菌的生长抑制效果,实验进行了3次重复。
1.6 乳酸菌对模拟人工胃肠液的耐受实验
(1)人工模拟胃液耐受性实验
人工胃液重悬乳酸菌菌体,使其浓度为109 CFU/mL,37 ℃培养2 h,梯度稀释后涂布培养进行平板菌落计数,实验进行了3次重复。
(2)人工模拟肠液耐受性实验
人工肠液重悬乳酸菌菌体,使其浓度为109 CFU/mL,37 ℃培养2 h,梯度稀释后涂布培养进行平板菌落计数,实验进行了3次重复。
1.7 乳酸菌对与空肠弯曲杆菌共培养生长的测定
以体积分数为5%的牛血清的液体BHI重悬空肠弯曲杆菌菌体,使其浓度为107 CFU/mL,加入以体积分数为10%的乳酸菌活细胞(107 CFU/mL),置于三气培养箱中,37 ℃条件下0、24、48 h后取样,梯度稀释并涂布于哥伦比亚血平板中,三气条件下37 ℃培养48 h后进行菌落计数[12],实验进行了3次重复。
1.8 乳酸菌对HT-29细胞的粘附实验及自身生物膜的形成
(1)粘附实验
将生长融合至80%的HT-29细胞消化,将盖玻片放置在6孔培养板中,加入2 mL/孔的细胞完全培养悬液(1×105 个/mL),37 ℃条件下放入5% CO2培养箱中培养,待细胞贴壁后,弃去培养基,加入1 mL/孔的乳酸菌菌悬液(1×108 CFU/mL),补加基础细胞培养液至2 mL,随后孵育2 h。结束后,用PBS清洗以除去未粘附的乳酸菌,甲醇固定20 min后进行革兰氏染色,显微镜观察。随机选取20个视野计算每百个细胞所黏附的细菌数目,即为粘附指数,实验进行了3次重复。
(2)生物膜形成量
根据姚沛琳[13]的实验方法,测定乳酸菌生物膜的形成量。
1.9 动物实验
(1)小鼠分组及处理
5~6只小鼠为一组,300 μL/只为小鼠的灌胃剂量。第1天,对小鼠灌胃弓形虫,弓形虫灌胃剂: 300 μL 含20个包囊的弓形虫脑匀浆悬液[14];第2、3、4天正常饲养;第5、6天对小鼠分别灌胃空肠弯曲杆菌菌悬液和乳酸菌菌悬液,间隔1 h;第7、8、9、10天正常饲养,小鼠表现出空肠弯曲杆菌感染症状;第11天小鼠处死。
(2)小鼠粪便中空肠弯曲杆菌活菌数的检测
取小鼠新鲜粪便,称重,采用PBS对其进行梯度稀释,吸取 100 μL菌悬液涂布于哥伦比亚血平板中,置于三气培养箱37 ℃培养48 h,随后进行菌落计数。
(3)小鼠粪便菌群丰度检测
按照WANG[15]的方法进行粪便微生物基因组DNA提取及上机测序。最后采用QIIME分析16S rRNA的序列数据。
1.10 统计与绘图
采用SPSS对数据进行单因素方差分析、相关性分析,绘图采用Graphpad Prism 6、TBtools,LEfSe分析在http://huttenhower.sph.harvard.edu/galaxy/完成。所有实验结果表示为Mean±SD。小写字母(abcdef)以及“*”表示为(P<0.05)。
2 结果与分析
2.1 CCFM 1054 产酸能力及对空肠弯曲杆菌的体外抑制
本研究在考察唾液乳杆菌L. salivarius CCFM 1054的各项体外指标时,引入已市场化的对人体有益的鼠李糖乳杆菌L. rhamnosus LGG和中心自行筛选的植物乳杆菌L. plantarum N49作为对照菌株。利用发酵上清液的pH表征乳酸菌的产酸能力,采用抑菌圈实验检测了CCFM 1054拮抗空肠弯曲杆菌的能力。实验结果如表1所示。
表1 各菌株发酵上清液pH值及牛津杯法对C. jejuni的抑制效果
Table 1 The resoults of pH for Lactobacillus cell free supernatant and their abilities in anti-C. jejuni growth by well diffusion agar assays

菌株种属来源pH抑菌圈大小CCFM 1054唾液乳杆菌(L. salivarius)发酵奶酒3.87±0.03+++LGG鼠李糖乳杆菌(L. rhamnosus)商业购买3.80±0.04++N49植物乳杆菌(L. plantarum)发酵泡菜3.94±0.02-
注:-,没有抑菌圈;++,抑菌圈为10~12 mm;+++,抑菌圈为12~15 mm
从表1数据可以看出,CCFM 1054的pH值为(3.87±0.03),表明其产酸能力较强。有文献显示,乳酸作为一种乳酸菌代谢生成的物质,能显著抑制Salmonella typhimurium的生长[16]。另外,乳酸菌代谢产生有机酸累积所导致的低pH环境,使得其代谢产物中某些非蛋白类物质及热稳定成分保持较强的活力,两者协同促进对病原菌的抑制[17]。从抑菌圈直径的大小来看,CCFM 1054具有明显的抑菌能力,显著高于LGG和N49,然而后两者的产酸能力,却和CCFM 1054没有明显的差异。结果表明,CCFM 1054具有明显体外拮抗空肠弯曲杆菌的功效,但其发挥抗菌作用不只局限于其产生的有机酸。
2.2 CCFM 1054 在模拟人工胃肠液中的耐受情况
乳酸菌,能够在胃肠道中存活,是其在宿主体内发挥益生功效的前提条件。人体胃液pH值在3.0左右,1~2 h通常为食物在其内的驻留时间,此时,胃蛋白酶原会被激活且具有一定的杀菌作用;当乳酸菌进入到小肠后,肠液中的各种酶和胆汁酸成分,也会对活菌造成损失[18-19]。本实验采用人工胃液和肠液模拟体内胃肠道环境,结果如表2所示。
表2 乳酸菌在模拟人工胃肠液中的耐受情况
Table 2 Effects of simulated gastric and simulated small intestinal juices on the viability of Lactobacillus strains
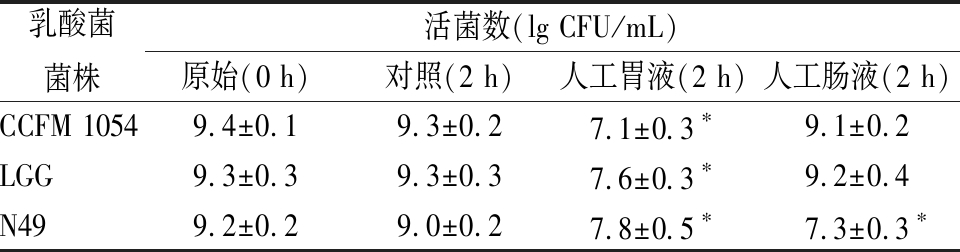
乳酸菌菌株活菌数(lg CFU/mL)原始(0 h)对照(2 h)人工胃液(2 h)人工肠液(2 h)CCFM 10549.4±0.19.3±0.27.1±0.3∗9.1±0.2LGG9.3±0.39.3±0.37.6±0.3∗9.2±0.4N499.2±0.29.0±0.27.8±0.5∗7.3±0.3∗
注:*表示为(P<0.05)
由表2可知,CCFM 1054在pH 2.0的人工胃液中培养2 h后,活菌数达到107 CFU/mL,虽下降约2个数量级,但存活率仍较高;在人工肠液中培养后,其活菌数变化不明显。从结果而言,CCFM 1054对人工胃液及人工肠液的良好耐受性使其具备了在真实人体胃肠道环境中存活的能力,拥有了对宿主发挥有益功能的潜质。赵煜等[20]发现,植物乳杆菌(Lactobacillus plantarum)N9以及ZL5对人工胃液和人工肠液的耐受能力良好,这2株菌在人工胃液中处理2 h以及人工肠液中处理2 h后,活菌存活的数量级和本研究类似。相比之下,LGG和CCFM 1054类似,对模拟人工胃肠液具有较好的耐受性,而N49的耐受效果却比较差。
2.3 CCFM 1054 与空肠弯曲杆菌共培养生长的测定
为了进一步证实CCFM 1054拮抗空肠弯曲杆菌的能力,进行了其与空肠弯曲杆菌共培养的测定,结果如图1所示。
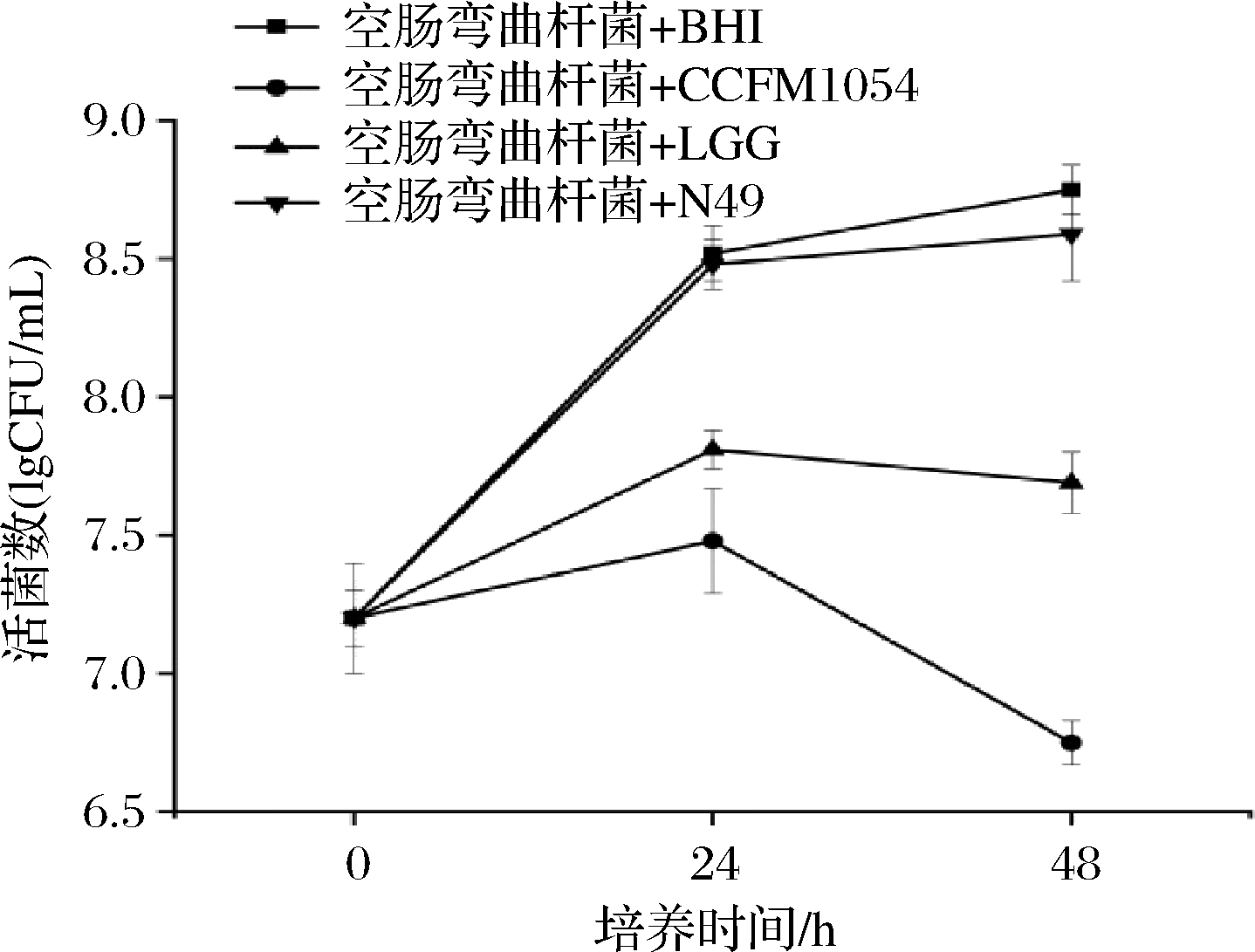
图1 乳酸菌活菌与空肠弯曲杆菌共培养下空肠弯曲杆菌的活菌数
Fig.1 Living cell counts of C. jejuni when co-cultured with Lactobacillus
由图1结果可知,空肠弯曲杆菌的活菌数在CCFM 1054与病原菌的共培养体系中逐步下降。共培养24 h后,空肠弯曲杆菌的活菌数未能超过3.5×107 CFU/mL;实验进行48 h后,空肠弯曲杆菌的活菌数下降到约4.5×106 CFU/mL。相比于CCFM 1054,市售的LGG能在48 h时使得空肠弯曲杆菌的活菌数与对照相比下降近1个数量级,而N49,在本实验中几乎对空肠弯曲杆菌的活菌数没有造成影响。
2.4 CCFM 1054对HT-29细胞的粘附及自身生物膜形成的能力
乳酸菌作用于宿主细胞,必须借助其良好的粘附性能。同样,优越的黏附性也为乳酸菌在宿主体内生长、定植和繁殖提供必要动力。乳酸菌黏附肠上皮细胞后,形成肠黏膜屏障,对致病菌而言,形成占位优势并抑制其粘附,从而修复肠道黏膜,调节免疫应答,抵御病原菌的侵袭[21-22]。HT-29细胞系属于人体结肠癌细胞,在细菌粘附中是使用最为广泛的体外模型[23]。本文所采用的对比菌株LGG,在HT-29细胞上拥有较高的黏附能力[24-25]。在某些环境下,乳酸菌的生长会伴随着生物膜的形成,具有该特性的乳酸菌有着更为强大的稳定特性和抗逆特性[26],更易于在人体中发挥有益作用。研究考察了CCFM 1054对HT-29细胞的粘附及自身生物膜形成的能力,如图2所示。
由图2可知,CCFM 1054有着比LGG更高的黏附指数,其数值可高达(16.98±1.36),ADAWI等[27]的研究显示,L. bulgaricus DSMZ 20080可以有效抑制病原菌粘附、侵袭Caco-2等细胞系,并使得由病原菌脂多糖引起的TNF-α表达大幅度减少。由此可见,CCFM 1054具有良好的黏附特性可能是其在体内竞争性结合肠上皮细胞粘附位点从而抑制病原菌粘附宿主细胞、降低病原菌感染的先决条件。同时,在595 nm处的吸光度代表了菌株自身生物膜的形成量,图2结果也表明,CCFM 1054具有着较强的自身成膜能力,而LGG和N49却几乎不具备生物膜的形成能力。
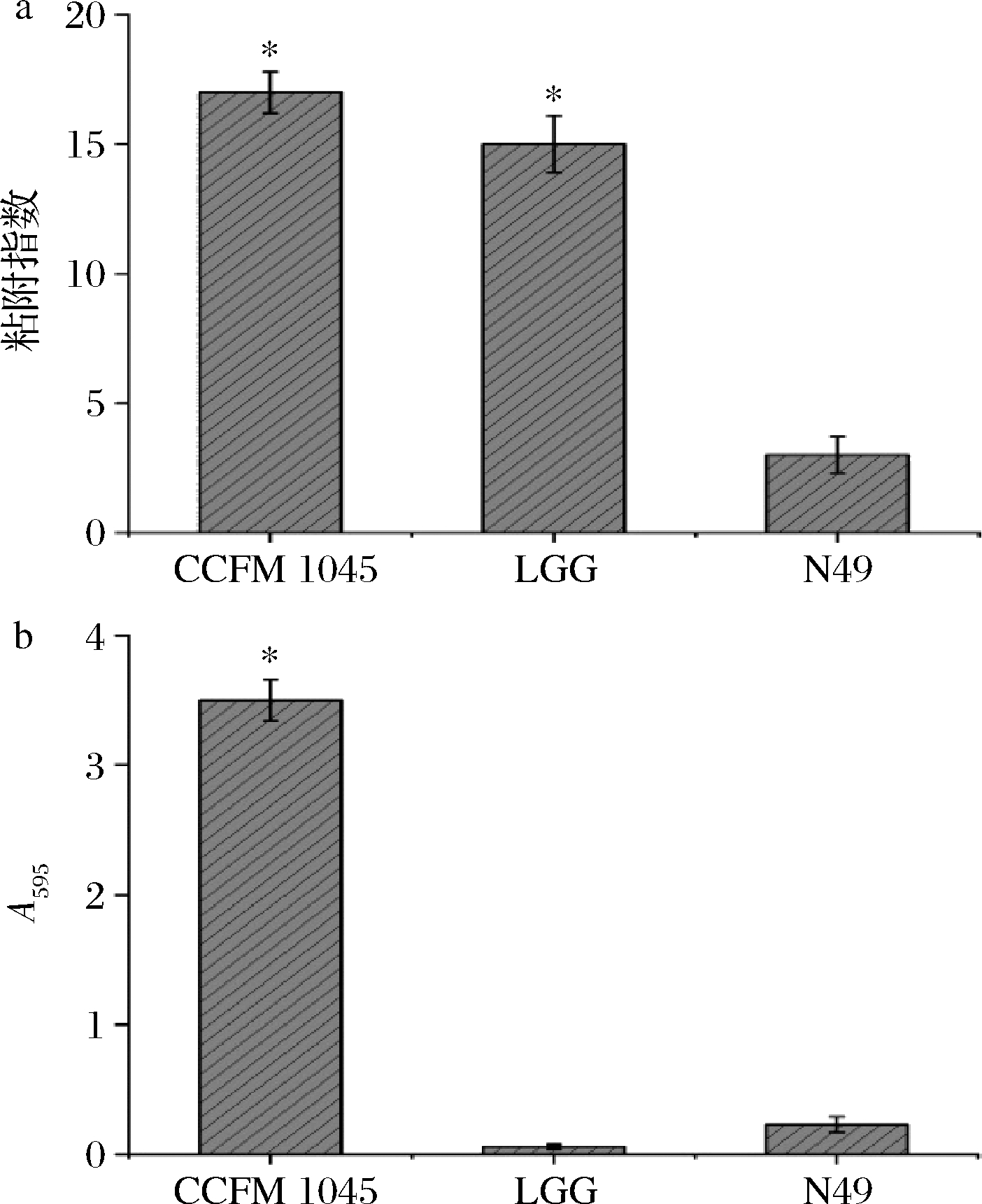
a-粘附指数;b-生物膜形成能力
图2 3株乳酸菌对HT-29细胞的粘附及其自身生物膜形成能力
Fig.2 Adhesion of 3 Lactobacillus strains to HT-29 cells in vitro and their biofilm formation
2.5 CCFM 1054 在弓形虫和空肠弯曲杆菌共同感染小鼠模型中对肠道菌群的影响
在普通健康小鼠体内,强大且稳定的肠道菌群已经形成,本文所研究的空肠弯曲杆菌NCTC 11168,由于其偏弱的致病性无法在肠道中大量定植并发挥毒力作用,因此小鼠几乎不会有患病的临床表现。因此,弓形虫感染模型被引入用于破坏健康小鼠的免疫力,从而使得空肠弯曲杆菌可以顺利入侵并在小鼠体内大量生长与定植[15]。3株乳酸菌干预灌胃后小鼠肠道菌群在门水平上的变化如图3所示。
从图3可知,当小鼠受到弓形虫和空肠弯曲杆菌共同感染后,厚壁菌门与拟杆菌门的比例出现下降,另外,包含着多种病原菌(例如侵袭性大肠杆菌、沙门氏菌和志贺氏菌)的变形菌门,它的丰度也得到了提高,这和WANG[15]所得到的结果是一致的。
当CCFM 1054干预后,厚壁菌门与拟杆菌门的比例得到了升高,变形菌门的丰度得到了降低。这意味着从门水平上来说,CCFM 1054的干预使得菌群在一定程度上得到了恢复。与此同时,3株乳酸菌干预灌胃后小鼠肠道菌群在种属水平上的变化也同样被分析,结果如图4所示。

图3 乳酸菌干预后小鼠肠道菌群在门水平上的变化
Fig.3 Changes of gut microbiota in mice at the phylum level after lactic acid bacteria intervention
在属水平上,针对表现出差异的部分种属制作了热图,且对具有显著差异的弯曲杆菌属、乳杆菌属、片球菌属、粪球菌属、分节丝状杆菌以及未命名的肠杆菌属进行了单独分析。由图4可知,CCFM 1054的干预使得弯曲杆菌属的丰度显著下降,而乳杆菌属的丰度得到了显著提高(P<0.05),这意味着CCFM 1054有可能通过改变肠道某些特定菌群的丰度来缓解空肠弯曲杆菌在体内的感染。据报道,乳杆菌和双歧杆菌,它们在肠道受到致病菌例如空肠弯曲杆菌感染后,通过外界的补充使其丰度升高,可修复肠道复杂的生态系统并提供特定的抗炎特性来修复肠道损伤[29-30]。PHILLIP等[31]也报道了利用乳杆菌和双歧杆菌治疗空肠弯曲杆菌感染免疫缺陷性小鼠的例子,随着弯曲杆菌属的减少,乳杆菌属和双歧杆菌属的丰度也达到了增强,菌群的变化使得小鼠的免疫系统得到了提高。此外,片球菌属、粪球菌属和分节丝状杆菌属在小鼠肠道中的丰度在受到CCFM 1054干预后,也得到了明显的提高(P<0.05)。片球菌属和粪球菌属在宿主肠道中丰度的提高,会引导机体调节B细胞的反应和IgA的产生[32]。分节丝状杆菌与宿主免疫有着密切的联系,可以促进肠道Th17细胞的分化和成熟,分节丝状杆菌属丰度的提高有助于机体免疫力的增强,且对肠道环境的稳定性有着巨大的贡献[33]。据报道,感染某些病原体会增加肠道中肠杆菌科的水平[34-35]。本文中感染模型组相比于空白组,未命名的肠杆菌属的增加已被证明是空肠弯曲杆菌感染的一种表现,另外,未命名的肠杆菌属丰度的提高会导致宿主免疫系统的下降[36]。而在本文中,CCFM 1054的干预也使得未命名的肠杆菌属的丰度得到了显著下降(P<0.05),这在某种程度上也暗示着机体免疫的恢复及空肠弯曲杆菌感染的缓解。

a-部分种属热图;b-弯曲杆菌属丰度变化;c-乳杆菌属丰度变化;d-片球菌属丰度变化;e-粪球菌属丰度变化;f-分节丝状杆菌属丰度变化;g-未命名的肠杆菌丰度变化
图4 乳酸菌干预后小鼠肠道菌群在属水平上的变化
Fig.4 Changes of gut microbiota of mice at the species level after lactic acid bacteria intervention
2.6 CCFM 1054 干预后小鼠体内空肠弯曲杆菌定植检测及肠道菌群和体内外指标的相关性分析
病原菌能够感染宿主,先决条件是其能在体内进行有效定植。本文研究了第9天不同乳酸菌干预组小鼠粪便中空肠弯曲杆菌的活菌数,与此同时,被挑选出的具有显著差异的种属也和乳酸菌拮抗空肠弯曲杆菌的相关体内外指标进行了相关性分析,结果如图5所示。
由图5可知,CCFM 1054干预后在第9天时空肠弯曲杆菌的活菌数下降到约为105 CFU/g,与感染模型组相比下降了4个数量级(P<0.05)。这表明CCFM 1054可以通过在小鼠体内显著降低空肠弯曲杆菌定植的方式,缓解空肠弯曲杆菌在小鼠体内的感染。数据也迎合了2.5中关于菌群变化影响空肠弯曲杆菌在体内感染的猜想。与我们结果类似的是,FORDER等[37]发现白羽鸡体内的不同肠道菌群会刺激产生黏蛋白基因MUC2,其能够抑制空肠弯曲杆菌粘附鸡小肠上皮细胞,减少空肠弯曲杆菌在宿主中的定植。此外,菌群变化和乳酸菌与拮抗空肠弯曲杆菌相关的体内外特性的相关性表明,CCFM 1054对细胞的高黏附性及其较强的生物膜形成能力与其在小鼠体内显著改变特定菌群丰度最为相关。如文献报道,肠道正常菌群粘附肠上皮细胞,可有效促进肠道组织的发育和成熟,包括黏膜免疫系统,从而抵御病原菌对肠道的侵袭[38]。ELSIA[39] 和NABIL[40]的研究也证实了乳酸菌生物膜形成具有一定的益生功能,可以有效抑制李斯特菌或者是其他食源性致病菌的生长,肠道中成膜能力较强菌株往往具备优良的稳定性与抗逆性,其丰度的上升使得肠上皮表面形成一道天然的屏障,提高肠道免疫系统,增强机体对致病菌的抵御能力。
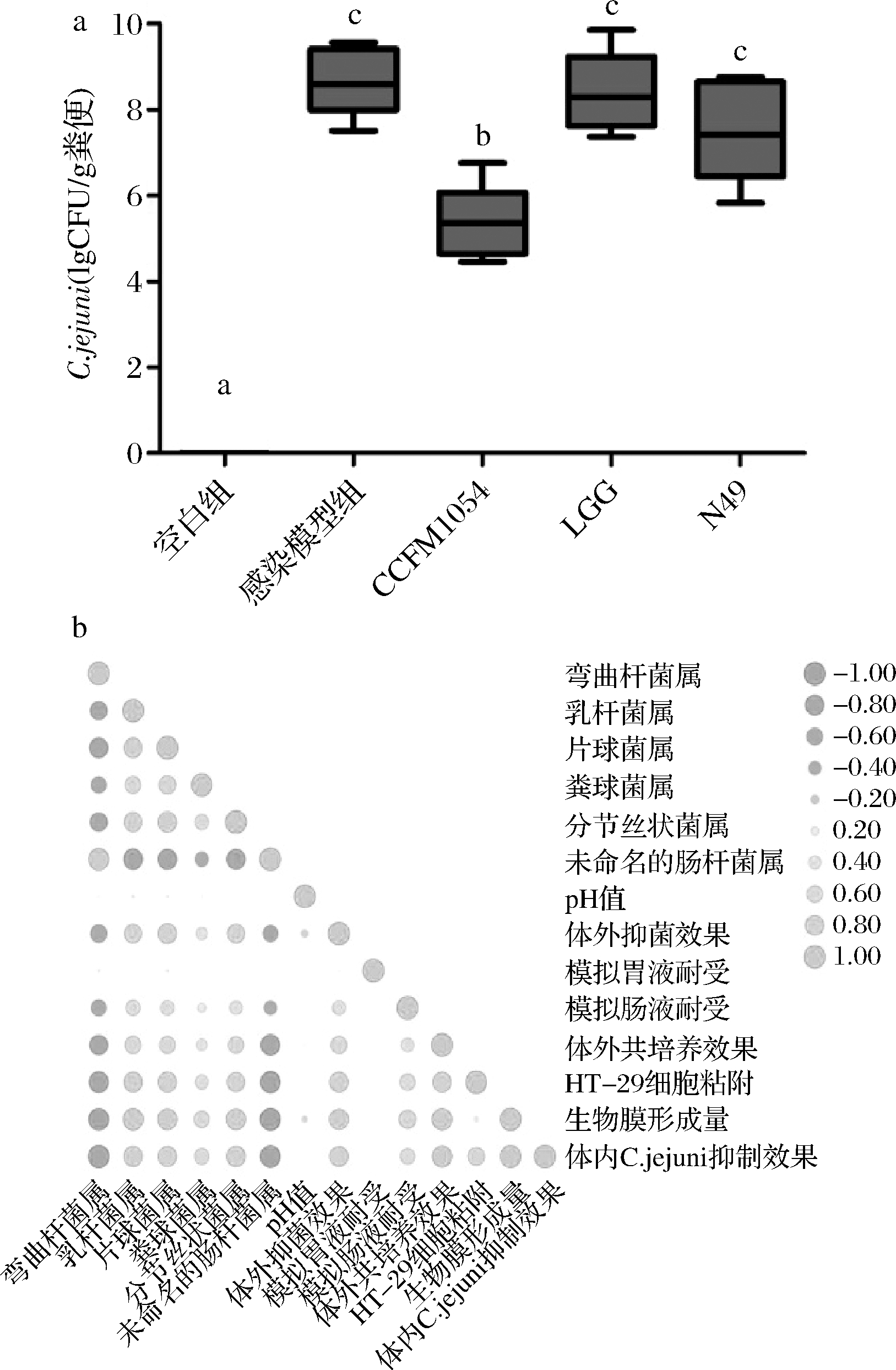
a-乳酸菌干预后小鼠体内空肠弯曲杆菌定植;b-肠道菌群和体内外指标的相关性分析
图5 乳酸菌干预后小鼠体内空肠弯曲杆菌定植检测及肠道菌群和体内外指标的相关性分析
Fig.5 Differential effects of Lactobacillus on C. jejuni load in mice infected by C. jejuni and correlation analysis between gut microbiota and characterizes of LAB in vivoand in vitro
3 结论
本研究考察了唾液乳杆菌L. salivarius CCFM 1054体外培养特性,发现其不仅能够在体外抑制空肠弯曲杆菌的生长,而且具有较强的粘附HT-29细胞的能力以及自身形成生物膜的能力。CCFM 1054干预灌胃于空肠弯曲杆菌和弓形虫复合感染的小鼠后,能显著改变肠道菌群的丰度组成,降低空肠弯曲杆菌在小鼠体内的定植进而缓解病原菌在体内的感染,结果证实CCFM 1054拥有预防人体及家禽空肠弯曲杆菌感染的潜力。
[1] JAVID I. DASTI, A. MALIK Tareen, et al. Campylobacter jejuni: A brief overview on pathogenicity-associated factors and disease-mediating mechanisms [J]. International Journal of Medical Microbiology, 2010, 300(4): 205-211.
[2] ELAINE S, ROBERT M H, FREDERICK J A, et al. Foodborne illness acquired in the united states—major pathogens [J]. Emerging Infectious Diseases, 2011, 1(17): 7-15.
[3] JINlIN Huang, XIAOQI Zang, WEIHUA Zhai, et al. Campylobacter spp. in chicken-slaughtering operations: A risk assessment of human campylobacteriosis in East China [J]. Food Control, 2018, 86: 249-256.
[4] KATE O P, CHRISTA L F, WALKER R E B. Quantifying the association between Campylobacter infection and guillain-barré syndrome: A systematic review [J]. J Health Popul Nutr, 2010, 28(6): 545-552.
[5] SAHIN O, KASSEM I, SHEN Z, et al. Campylobacter in poultry: ecology and potential interventions [J]. Avian Dis, 2015, 59:185-200.
[6] MOORE J E, BARTON M D, BLAIR I.S, et al. The epidemiology of antibiotic resistance in Campylobacter [J]. Microbes In-fect, 2006, 8(7): 1955-1966.
[7] PADUNGTON P, KANEENE J B. Campylobacter spp. in human, chickens, pigs and their antimicrobial resistance [J]. J Vet Med Sci,2003, 65(2): 161-170.
[8] SLUTSKER L, RIES A A, GREENE K D, et al. Escherichia coli O157: H7 diarrhea in the United States: clinical and epi-demiologic features[J]. Annals of Internal Medicine, 1997, 126: 505-513.
[9] NISHIYAMA K, SETO Y, YOSHIOKA K, et al. Lactobacillus gasseri SBT2055 reduces infection by and colonization of Campylobacter jejuni [J]. PLOS ONE, 2014, 9(9): 1-9.
[10] COLE K, FARNELL M B, DONOGHUE A M, et al. Bacteriocins reduce Campylobacter colonization and alter gut morphology in turkey poults [J]. Poultry Science, 2016, 85(9): 1 570-1 575.
[11] RYAN K A, DALY P, LI Y, et al. Strain-specific inhibition of Helicobacter pylori by Lactobacillus salivarius and other lactobacilli [J]. Journal of Antimicrobial Chemotherapy, 2008, 61(4): 831-834.
[12] SGOURAS D, MARAGKOUDAKIS P, PETRAKI K, et al. In vitro and in vivo inhibition of Helicobacter pylori by Lactobacillus casei strain Shirota [J]. Applied and Environmental Microbiology, 2004, 70(1):518-526.
[13] 姚沛琳. 乳酸菌抑制变异链球生物膜形成的研究 [D]. 无锡: 江南大学, 2015.
[14] 刘妍. 桦褐孔菌多糖对弓形虫感染小鼠病理学影响的研究 [D]. 延吉: 延边大学, 2011.
[15] WANG G, HE Y F, ZHOU Y H, et al. The effect of co-infection of food-borne pathogenic bacteria on the progression of Campylobacter jejuni infection in mice [J]. Frontiers in Microbiology, 2018, 9: 1-13.
[16] MAKRAS L, TRIANTAFYLLOU V, FAYLO Messaoudi D, et al. Kinetic analysis of the antibacterial activity of probiotic lactobacilli towards Salmonella enterica serovar typhimurium reveals a role for lactic acid and other inhibitory compounds [J]. Research in Microbiology, 2006, 157(3): 241-247.
[17] CHAVEERACH P, KEUZENKAMP D A, URLINGS H A, et al. In vitro study on the effect of organic acids on Campylobacter jejuni/coli populations in mixtures of water and feed [J]. Poultry Science, 2002, 81(5): 621-628.
[18] HUANG Y, ADAMS M C. In vitro assessment of the upper gastrointestinal tolerance of potential probiotic dairy propionibacteria [J]. International Journal of Food Microbiology, 2004, 91(3): 253-260.
[19] 辛羚, 郭本恒, 吴正钧,等. 3株乳杆菌在模拟消化环境中存活性能的研究 [J]. 中国乳品工业, 2005, 33(5): 15-17.
[20] 赵煜. 具有拮抗空肠弯曲杆菌功效的乳酸菌的研究[D]. 无锡: 江南大学, 2012.
[21] FIGUEIRA C P, CRODA J, CHOY H A, et al. Heterologous expression of pathogen-specific genes ligAand ligBin the saprophyte Leptospira biflexa confers enhanced adhesion to cultured cells and fibronectin [J]. BMC Microbiology, 2011, 11(1): 129-136.
[22] BURGAIN J, GAIANI C, FRANCIUS G, et al. In vitro interactions between probiotic bacteria and milk proteins probed by atomic force microscopy [J]. Colloids & Surfaces B Biointerfaces, 2013, 104: 153-159.
[23] ADLERBERTH I, AHRNE S, JOHANSSON M L, et al. A mannose-specific adherence mechanism in Lactobacillus plantarum conferring binding to the human colonic cell line HT-29 [J]. Applied and Environmental Microbiology, 1996, 62(7): 2 244-2 251.
[24] TUOMOLA E M, OUWEHAND A C, SALMINEN S J, et al. Adhesion of some probiotic and dairy Lactobacillus strains to Caco-2 cell cultures [J]. International Journal of Food Microbiology, 1999, 26(2): 137-142.
[25] TUOMOLA E M, SALMINEN S J. Adhesion of some probiotic and dairy Lactobacillus strains to Caco-2 cell cultures [J]. International Journal of Food Microbiology, 1998, 41(1): 45-51.
[26] 王坤, 闫颖娟, 姜梅, 等. 保加利亚乳杆菌和嗜热链球菌生物膜形成研究 [J]. 食品科学, 2011, 32(19): 184-187.
[27] EL-ADWI H, EL-SHEEKH M, KHALIL M, et al. Lactic acid bacterial extracts as anti-Helicobacter pylori: a molecular approach [J]. Irish Journal of Medical Science, 2013, 182(3): 439-452.
[28] HAAG L M, FISCHER A, OTTO B, et al. Intestinal microbiota shifts towards elevated commensal Escherichia coli loads abrogate colonization resistance against Campylobacter jejuni in mice [J]. PloS One, 2012, 7(5): 1-13.
[29] CHANG C, MILLER J F. Campylobacter jejuni colonization of mice with limited enteric flora [J]. Infect Immun, 2006, 74(9): 5 261-5 271.
[30] STAHL M, RIES J, VERMEULEN J, et al. A novel mouse model of Campylobacter jejuni gastroenteritis reveals key pro-inflammatory and tissue protective roles for toll-like receptor signaling during infection [J]. PLoS Pathog, 2014, 10(7): 1-16.
[31] PHILLIP T, KELSEY A, JULIA A, et al. Transplanted human fecal microbiota enhanced Guillain Barré syndrome autoantibody responses after Campylobacter jejuni infection in C57BL/6 mice [J]. Microbiome, 2017, 5: 1-22.
[32] HAGHIGHI H R, GONG J, GYLES C I, et al. Modulation of antibody-mediated immune response by probiotics in chickens [J]. Clin Diagn Lab Immunol, 2005, 12(12): 1387-1392.
[33] WANG W N, BEAI R K. Egional and global chan-ges in TCR αββ inlll repertoires in the gut are dependent upon the complexity of the enteric microflora [J]. Dev Comp Immunol, 2010, 34(4): 406-417.
[34] CORRIDONI D, PASTORELLI L, MATTIOLI B, et al. Probiotic bacteria regulate intestinal epithelial permeability in experimental ileitis by a TNF-dependent mechanism [J]. PloS One, 2012, 7(7): 1-10.
[35] DAVID L A, MATERNA A C, FRIDMAN J, et al. Host lifestyle affects human microbiota on daily timescales [J]. Genome Biol, 2014, 15: 1-15.
[36] SAKARIDIS I, ELLIS R J, CAWTHRAW S A, et al. Investigating the association between the caecal microbiomes of broilers and Campylobacter burden [J]. Frontiers in Microbiology, 2018, 9: 1-9.
[37] FORDER R E A, HOWARTH G S, TIVEY D R, et al. Bacterial modulation of small intestinal goblet cells and mucin composition during early post-hatch development of poulty [J]. Poult Sci, 2007, 86(11): 2 396-2 403.
[38] DERRIEN M, VAN P. Mucin-bacterial interactions in the human oral cavity and digestive tract [J]. Gut Microbes, 2010, 1(4): 254-268.
[39] GUERRIERI E, NIEDERHAUSERN S D, MESSI P, et al. Use of lactic acid bacteria (LAB) biofilms for the control of Listeria monocytogenes in a small-scale model [J]. Food Control, 2009, 20(9):861-865.
[40] OLNEY J W, ADAMO N J, RATHER A. Biofilms of Lactobacillus plantarum and Lactobacillus fermentum: Effect on stress responses, antagonistic effects on pathogen growth and immunomodulatory properties [J].Food Microbiology, 2016, 53(Pt A):51-59.