L-精氨酸具有多种独特的生理和药理作用,包括增强免疫力、促进蛋白质合成、降低分解代谢、保护胃肠黏膜等,在临床营养治疗中发挥着重要作用[1-3]。天然抗氧化物剂含有大量能清除过量自由基的抗氧化成分,具有辅助保护心血管、降血压、降血脂、降血糖,以及抑制神经退行性疾病等功能[4-5]。例如,银杏黄酮和知母宁对心脏缺血再灌注损伤有辅助治疗作用[6-9],山楂黄酮具有辅助缓解中风的效果[4],L-精氨酸、山楂提取物、知母提取物和虾青素按一定比例混合组成的配方对心肌梗塞和中风有明显的防治作用[10-11]、对老年痴呆症和帕金森病也有明显延缓作用[12]。
本文重点研究含L-精氨酸和抗氧化物质(山楂提取物、知母提取物和虾青素)组方对小鼠免疫功能的影响,以期为其临床应用及保健食品研发提供科学依据。
1 材料与方法
1.1 主要仪器、样品和试剂
1.1.1 实验仪器
二氧化碳培养箱,德国Memmert公司;DMIL显微镜,德国徕卡公司;微量注射器、BP211D电子天平,德国Sartorius公司;UV2550分光光度仪,日本SANYO公司;5702离心机,德国Eppendorf公司。
1.1.2 实验样品及试剂
组方样品由L-精氨酸(L-Arg)、山楂提取物、知母提取物和虾青素为原料,按质量1∶1∶2∶2比例制成。RPMI1640培养液、Hank’s液,赛默飞世尔生物化学公司;胎牛血清,浙江天航科技有限公司;绵羊红细胞(sheep red blood cell, SRBC)和鸡红细胞均由实验室临用制备;YAC-细胞,山东省医科院;乳酸锂、烟酰胺腺嘌呤二核苷酸(nicotinamade adenine dinucleotide, NAD)、碘硝基氯化四氮唑(iodonitrote trazolium, INT),阿拉丁试剂公司; 0.2 mol/L tris-HCl缓冲液和Triton试剂,Amresco公司;印度墨汁,索莱宝公司;甲醇、丙酮、盐酸和异丙醇,天津康科德技术有限公司。
1.2 动物饲养和处理
SPF级雄性ICR小鼠,体重18.11~21.99 g(济南朋悦实验动物繁育有限公司)饲养于屏障级动物房,温度20~26 ℃,相对湿度40~70%,照明时间12 h。共设4个免疫实验组,每个免疫实验组小鼠40只,分溶剂对照组和样品低、中、高3个剂量组,每组10只小鼠。免疫一组用于迟发变态反应(delayed type hypersensitivity, DTH)实验、血清溶血素测定、抗体生成细胞数测定;免疫二组用于小鼠腹腔巨噬细胞吞噬鸡红细胞实验;免疫三组用于碳廓清实验、脏器/体重比值的测定;免疫四组用于小鼠淋巴细胞转化实验和自然杀伤(natural killer, NK)细胞活性测定实验。
1.3 剂量选择及受试物给予方式
L-精氨酸和天然抗氧化剂配方对人体推荐量为1.6 g/60 kg·BW。动物受试物免疫功能实验剂量按人体推荐的5倍、10倍和30倍3个剂量,分别为0.133、0.267和0.800 g/kg·BW。称取样品,用5 g/L羧甲基纤维素钠(sodium carboxymethyl cellulose,CMC-Na)溶液配制,每次灌胃20 ml,对照组给与同等体积的5 g/L CMC-Na溶液。
1.4 试验方法
参照《保健食品检验与评价技术规范》(2003年版)中增强免疫力功能检验方法进行[13]。DTH采用SRBC诱导小鼠足跖增厚法;ConA诱导的小鼠脾淋巴细胞转化试验采用MTT法;抗体生成细胞检测采用Jeme改良玻片法;血清溶血素测定采用血凝法;小鼠碳廓清试验和小鼠腹腔巨噬细胞吞噬鸡红细胞试验采用半体内法:NK细胞活性测定采用乳酸脱氢酶(lactate dehydrogenase, LDH)测定法。
1.5 数据处理与分析
采用SPSS 19.0统计软件以X2检验进行数据处理,P<0.05差异显著,P<0.01差异极显著。
2 结果与分析
2.1 对小鼠体重和免疫器官比值的影响
实验前后各剂量组小鼠体重、脾脏/体重比值及胸腺/体重比值,与对照组比较无显著性差异(P>0.05),如表1所示。
表1 组方对小鼠免疫器官脏器/体重比值的影响![]()
Table 1 Effects of the formula on organ/body weight ![]()
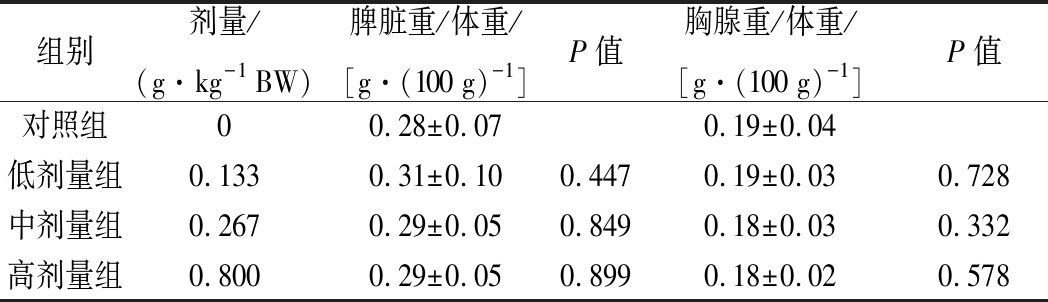
组别剂量/(g·kg-1 BW)脾脏重/体重/[g·(100 g)-1]P值胸腺重/体重/[g·(100 g)-1]P值对照组00.28±0.070.19±0.04低剂量组0.1330.31±0.100.4470.19±0.030.728中剂量组0.2670.29±0.050.8490.18±0.030.332高剂量组0.8000.29±0.050.8990.18±0.020.578
注:空白表示无P值(下同)
2.2 对小鼠细胞免疫功能的影响
如表2所示,中、高剂量组小鼠的淋巴细胞增殖能力与对照组比较均有显著性差异(P<0.01),低剂量组无显著性差异。而3个剂量组小鼠的足跖肿胀度与对照组相比,无显著性差异(P>0.05)。依据《保健食品检验与评价技术规范》(2003年版)评判标准,本组方对小鼠的细胞免疫功能有显著增强作用。
表2 组方对小鼠细胞免疫功能的影响![]()
Table 2 Effects of the formula on cellular immune ![]()
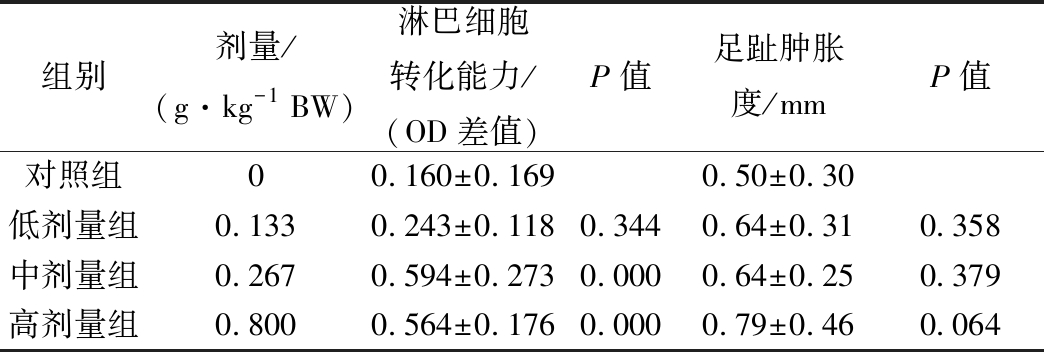
组别剂量/(g·kg-1 BW)淋巴细胞转化能力/(OD差值)P值足趾肿胀度/mmP值对照组00.160±0.1690.50±0.30低剂量组0.1330.243±0.1180.3440.64±0.310.358中剂量组0.2670.594±0.2730.0000.64±0.250.379高剂量组0.8000.564±0.1760.0000.79±0.460.064
2.3 对小鼠体液免疫功能的影响
3个剂量组小鼠的抗体生成细胞数(溶血空斑数)及血清溶血素(半数溶血值),与对照组比较,均无显著性差异(P>0.05),如表3所示。依据《保健食品检验与评价技术规范》(2003年版)评判标准,本组方对小鼠的体液免疫功能无明显效果。
表3 组方对小鼠体液免疫功能的影响![]()
Table 3 Effects of the formula on humoral immune ![]()
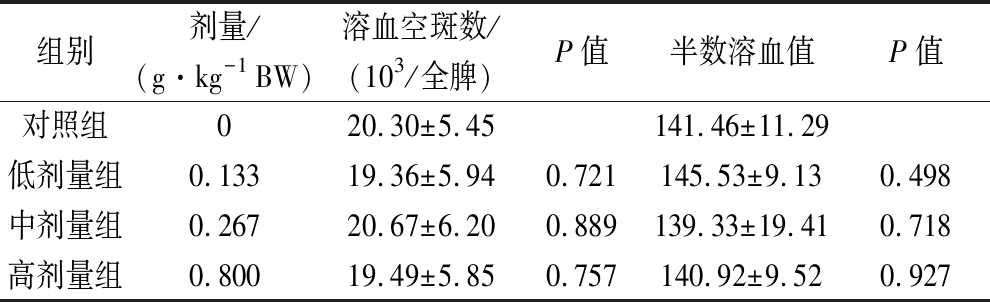
组别剂量/(g·kg-1 BW)溶血空斑数/(103/全脾)P值半数溶血值P值对照组020.30±5.45141.46±11.29低剂量组0.13319.36±5.940.721145.53±9.130.498中剂量组0.26720.67±6.200.889139.33±19.410.718高剂量组0.80019.49±5.850.757140.92±9.520.927
2.4 对小鼠单核-巨噬细胞吞噬功能的影响
3个剂量组小鼠的吞噬鸡红细胞的百分率和吞噬指数均显著高于对照组(P<0.01),但3个剂量组小鼠的碳廓清吞噬指数,与对照组无显著差异(见表4)。依据《保健食品检验与评价技术规范》(2003年版)评判标准,本组方对小鼠的单核-巨噬细胞功能有显著增强的作用。
表4 组方对小鼠单核-巨噬细胞吞噬功能的影响![]()
Table 4 Effects of the formula on monocyte-macrophages phagocytic function in ![]()

组别剂量/(g·kg-1 BW)鸡红细胞吞噬百分率/%P值鸡红细胞吞噬数P值碳廓清吞噬指数P值对照组018.80±6.480.30±0.146.15±0.60低剂量组0.13337.10±7.670.0000.69±0.210.0006.13±1.190.995中剂量组0.26735.00±6.060.0000.61±0.180.0026.11±0.830.929高剂量组0.80038.50±8.610.0000.74±0.250.0006.30±1.170.734
2.5 对小鼠NK细胞活性的影响
由表5可见,与对照组相比,中和高剂量组的NK细胞活性均显著提升(P<0.01),但低剂量组效果不显著。依据《保健食品检验与评价技术规范》(2003年版)评判标准,本组方对小鼠的NK细胞活性有显著增强的作用。
表5 组方对小鼠NK细胞活性的影响![]()
Table 5 Effects of the formula on NK cells activities ![]()
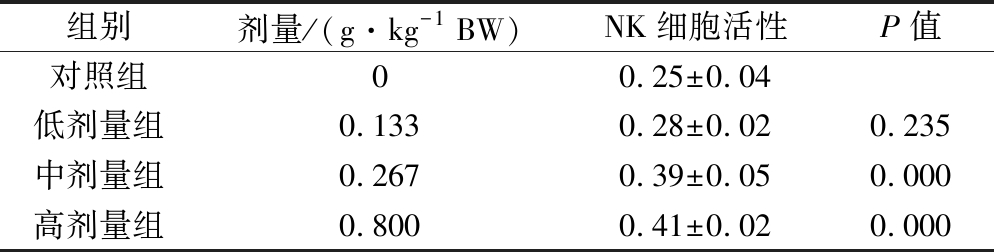
组别剂量/(g·kg-1 BW)NK细胞活性P值对照组00.25±0.04低剂量组0.1330.28±0.020.235中剂量组0.2670.39±0.050.000高剂量组0.8000.41±0.020.000
3 讨论
L-精氨酸具有重要的营养、代谢和免疫功能。精氨酸对免疫功能的调节作用,主要包括促进细胞免疫和体液免疫功能。精氨酸-NO的免疫调控是L-精氨酸发挥生理功能的重要作用机制之一。精氨酸通过两条代谢途径参与全身炎症反应:精氨酸酶I和酶Ⅱ途径,以及过氧化途径。L-精氨酸经一氧化氮合成酶催化生成具有生物活性的NO。NO在生物体内承担着重要的生物功能,包括抗炎、降血压、舒张血管等[14-17]。
山楂的果实、叶子、花都可入药,包含多种天然抗氧化物质,如黄酮类物质、原花青素类、三萜酸类和甾酮类等[18]。山楂提取物可通过抑制磷酸二酯酶活性,增加冠状动脉血液流量和心脏的血液输出,减少心脏的耗氧量,保护心脏免受缺血再灌注损伤[19]。它还可用于治疗早期充血性心衰、心绞痛、心律不齐、高血压和高脂血症[20-21]等。虾青素属类胡萝卜素,是存在于鱼、虾和藻类中的一种强抗氧化剂,其抗氧化活性为β-胡萝卜素的10倍以上、维生素E的100倍以上[22]。知母的有效成分为知母宁,是含有4个酚羟基的多酚类物质。知母宁具有清热泻火、滋阴润燥、退热消炎、抑菌杀菌、降血糖等作用[23-24]。知母宁具有很强清除自由基作用,可降低大鼠心肌缺血再灌注损伤过程产生的NO自由基和氧自由基,从而缓解心肌缺血再灌注造成的损伤 。
L-精氨酸和天然抗氧化剂有一定的协同作用,在细胞和组织体系中,既可以产生一定量的NO,又可以清除氧自由基。另外,NO和天然抗氧化剂对T-淋巴细胞免疫具有调节作用[21,25-29]。L-精氨酸和天然抗氧化剂的组方,既可以降低高脂食物喂养引起大鼠的血脂和血压的升高,又可以降低转基因小鼠血糖的升高,对心肌梗塞和中风有明显的防治作用[5,10],同时对老年痴呆症和帕金森病有明显的延缓作用[12]。这也为研制和开发保护血管、防治高血压、高血脂和高血糖的健康食品和药物提供了科学依据。
本组方由L-精氨酸和天然抗氧化物质(山楂提取物、知母提取物和虾青素)组成,研究结果显示该组方(中、高剂量)能显著提高淋巴细胞增殖能力和NK细胞活性(P<0.01),低、中、高剂量均能显著提高小鼠巨噬细胞吞噬鸡红细胞百分率及吞噬指数(P<0.01)。根据《保健食品检验与评价技术规范》(2003年版)判定标准,该组方对小鼠具有增强免疫功能的作用。
[1] GEIGER R, RIECKMANN J C, WOLF T, et al. L-Arginine modulates T cell metabolism and enhances survival and anti-tumor activity[J]. Cell, 2016, 167(3):829-842.
[2] XIONG L,TENG J L,BOTELHO M G,et al. Arginine metabolism in bacterial pathogenesis and cancer therapy[J].Int J Mol Sci,2016,17(3):363.
[3] 欧阳暂,姜雅慧,张剑波等.精氨酸强化的免疫营养支持对胃癌患者术后免疫功能影响的Meta分析[J].循证医学,2017,17(6):350-360.
[4] SHEN J G, LI M, XIN W J, et al. Effects of Chinonin on nitric oxide free radical, myocardial damage and arrhythmia in ischemia-reperfusion injury in vivo[J]. Appl Magn Reson,2000,19(1):9-19.
[5] ZHANG D L, ZHANG Y T, YIN J J,et al. Oral administration of Crataegus flavonoids protects against ischemia/reperfusion brain damage in gerbils[J]. J Neur Chem,2004,90(1):211-219.
[6] 杨波,迟小华,卢学春,等.免疫细胞衰老的研究进展[J].中国实验学杂志,2012,20(3):782-787.
[7] SHEN J G, WANG J, ZHAO B L, et al. Effects of EGb-761 on nitric oxide, oxygen free radicals, myocardial damage and arrhythmias in ischemia-reperfusion injury in vivo[J]. Biochim Biophys Acta,1998,1 406(3):228-236.
[8] ZHAO B L, SHEN J G, LI M, et al. Scavenging effect of Chinonin on NO and oxygen free radicals generated from ischemia reperfusion myocadium[J]. Biachem Biophys Acta, 1996,1315(2):131-137.
[9] SHEN J G, GUO X S, JIANG B, et al. Chinonin, a novel drug against cardiomyocyte apoptosis induced by hypoxia and reoxygenation[J]. Biochim Biophyscs Acta,2000,1500(2):217-226.
[10] 赵亚硕,李砚超,杜立波,等. L-精氨酸和天然抗氧化剂对缺血性脑卒中防治作用的细胞和动物模型研究[J]. 心脑血管病防治,2016,16(4):259-263。
[11] 冯润,王红云,赵保路,等,基于一氧化氮和天然抗氧化剂的新配方的心肌保护作用[J]。中国科学院大学学报,2016,33(5):625-631.
[12] ZHAO Y, ZHAO B. Natural antioxidants in prevention and management of Alzheimer’s disease[J]. Frontiers in Bioscience, 2012,4: 794-808.
[13] 中华人民共和国卫生部.保健食品检验与评价技术规范 (2003年版)[M].北京:中华人民共和国卫生部,2003.
[14] PALMER R M, FERRIGE A G, MONCADA S. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor[J]. Nature, 1987, 327(6 122): 524-526.
[15] FURCHGOTT R F, VANHOUTTE P M. Endothelium-derived relaxing and contracting factors[J]. FASEB J, 1989. 3(9): 2007-2018.
[16] 赵保路,一氧化氮自由基[M].2008,北京:科学出版社.
[17] 赵保路,一氧化氮自由基生物学和医学[M].2016,北京:科学出版社,北京.
[18] SHANTHI S, PARASAKTHY K, DEEPALAKSHMI P D, et al. Hypolipidemic activity of tincture of crataegus in rats[J]. Indian Journal of Biochemistry & Biophysics, 1994, 31(2): 143-146.
[19] WEIHMAYR T, ERNST E. Therapeutic effectiveness of Crataegus[J]. For-schritte der Medizin, 1996, 114: 27-29.
[20] LIN T, LU C, WANG S. Astaxanthin inhibits glutamate release in rat cerebral cortex nerve terminals via suppression of voltage-dependent Ca2+ entry and mitogen-activated protein kinase signaling pathway[J]. J Agric Food Chem, 2010, 58(14):8 271-8 278.
[21] NIEDBALA W,WEI XQ,PIEDRAFITA D,et al. Effects of nitric oxide on the induction and differentiation of Th1 cells[J]. Eur J Immunol,1999,29(8):2 498-2 505.
[22] HIGUERA-CIAPARA I, FELIX-VALENZUELA L, GOYCOOLEA F. Astaxanthin: a review of its chemistry and applications. Crit. Rev[J]. Food Sci Nutr 2006,46(2):185-196.
[23] WALKER A F, MARAKIS G, MORRIS A P,et al. Promising hypotensive effect of hawthorn extract: A randomized double-blind pilot study of mild, essential hypertension[J]. Phytotherapy Research: Ptr, 2002, 16(1): 48-54.
[24] PETKOV E, NIKOLOV N, UZUNOV P. Inhibitory effect of some flavonoids and falvonoid mixtures on cyclic amp phosphodiesterase activity of rat heart[J]. Planta Med, 1981, 43(2): 183-186.
[25] COLEMAN J W. Nitric oxide in immunity and inflammation[J]. Intern Immunopharm,2001,1(8):1 397-1 406.
[26] MALVEZI A D,CECCHINI R,SOUZA F,et al. Involvement of nitric oxide(NO)and TNF-α in the oxidativestress associated with anemia in experimental Trypanosoma cruzi infection[J]. FEMS Immun Med Microbiol,2004,41:69-77.
[27] VAN DER VEEN R C. Nitric oxide and T helper cell immunity[J]. Intern Immunopharm,2001,1(8):1 491-1 500.
[28] BIDRI M,FEGER F,VARADARADJALOU S,et al. Mast cells as a source and target for nitric oxide[J]. Int Immunopharmacol,2001,1(8):1 543-1 558.
[29] MIRANDA M S,SATO S,MANCINI-FILHO J. Antioxidant activity of the microalga Chlorella vulgaris cultured on special conditions[J]. Boll Chim Farm,2001,140:165-168.