柑橘加工过程中会产生近40%的果皮、果渣等废弃物,除小部分用于动物饲料和果胶等的制备外[1-2],大部分被丢弃,造成资源浪费和环境污染,因此提高柑橘加工废弃物的资源化利用水平具有重要的研究意义。王耸等[3]以柑橘加工副产物——柚皮为原料,对棘孢曲霉固态发酵柚苷酶的工艺进行研究,柚苷酶发酵酶活力达到8.19 IU/g干物质,比初始培养基产柚苷酶活力提高7.38 倍,表明可以利用柑橘加工废弃物为底物发酵生产柚苷酶;而杨颖等[4]采用橘渣水复配培养基发酵生产细菌纤维素(bacterial cellulose, BC),产量可达10.26 g/L,是不添加橘渣水培养基的2.27 倍,表明利用果渣进行液态发酵具有可行性,并能有效提高产量。将柑橘果渣应用到发酵工艺中是有效降低柚苷酶生产成本的潜在途径之一,并且对环境保护和资源高效利用具有积极作用。
柚苷酶(naringinase)是一种由α-L-鼠李糖苷酶(α-L-rhamnosidase)和β-D-葡萄糖苷酶(β-D-glucosidase)组成的复合酶[5],在柑橘类果汁的加工脱苦[6-7]、物质的分离制备、鼠李糖的工业制备、黄酮类物质的工业制备、抗生素的生产等方面具有重要的应用价值。游离状态的柚苷酶在使用过程中存在操作稳定性差、分离和回收困难等问题[8],而固定化柚苷酶在应用中可以有效解决上述问题[9]。固定化酶的制备方法主要包括载体固定化法和无载体固定化法,其中无载体固定化法如交联酶聚集体(cross-linked enzyme aggregates,CLEAs)技术,不需要提供任何载体,且具有催化效率高、操作简单、成本低廉等优点[10],是一种具有潜在应用和开发价值的无载体固定化酶技术。武仙山等[11]对交联酶聚集体技术进行了综述,就CLEAs的制备、在水溶液中的活性和稳定性、在有机溶剂中的活性和作用机理等方面进行了研究,结果显示其活性和稳定性可与交联酶晶体技术相媲美,且操作简便,更利于研究和应用的普及。
本研究以柑橘果渣浸出液为培养基基质,对实验室自主保藏的菌种黑曲霉FFCC uv-11进行发酵产酶研究,通过优化培养基组成提高柚苷酶发酵酶活,进一步制备出交联柚苷酶聚集体,并对其酶学性质进行探究。本研究为柑橘水果资源的深度开发提供了一种有效方式,以达到环境保护和资源高效利用的目的,并可进一步用于研究微生物发酵产酶过程,为生物产业的可持续发展提供基础数据和技术支持。
1 材料与方法
1.1 实验材料
菌株:黑曲霉FFCC uv-11,实验室自主保藏。
材料:蜜橘,产自江西新余;柚皮苷(≥98%),宝鸡市方晟生物开发有限公司;脱脂豆粉、麸皮粉,大连调味食品厂。其他化学试剂皆为分析纯。
仪器设备:PHS-3C pH计,上海比朗仪器制造公司;FD-1A-50真空冷冻干燥机,上海仪电科学仪器股份公司;Spectrum 10傅里叶红外光谱仪,美国PerkinElmer;JSM 7800F扫描电子显微镜,日本电子株式会社;SpectraMax Plus384酶标仪,美国Molecular Devices(MD)公司。
斜面培养基(g/L)[12]:NaNO3 3.0,FeSO4·7H2O 0.01,K2HPO4·12H2O 1.0,KH2PO4·2H2O 1.0,MgSO4·7H2O 0.5,KCl 0.5,蔗糖30.0,琼脂30.0,柚皮苷2.0,pH 6.0,121 ℃灭菌20 min。
初始发酵培养基(g/L)[12]:KH2PO4·2H2O 1.5,K2HPO4·12H2O 1.5,MgSO4·7H2O 0.5,(NH4)2SO4 4.0,ZnSO4·7H2O 0.09,CaCl2 0.1,酵母浸粉2.0,柚皮苷1.5,初始pH 6.0,121 ℃灭菌20 min。
1.2 实验方法
1.2.1 单孢子悬液的制备[12]
将黑曲霉菌种转接到斜面培养基上,于30 ℃恒温培养4 d得到成熟的孢子,然后用9 g/L无菌生理盐水冲洗孢子,倒入装有玻璃珠和无菌生理盐水的锥形瓶中,摇匀充分打散孢子,测定孢子悬液的OD600值,并用无菌生理盐水将其调整至OD600为0.18,即得单孢子悬液,备用。
1.2.2 果渣浸出液的制备
将蜜橘榨汁处理后产生的果渣与去离子水以适当比例混合后在50 ℃水浴中处理2 h,经纱布过滤后得到滤液,即为果渣浸出液,备用。
1.2.3 发酵液的制备
将孢子悬液以体积分数10%的接种量接种至装液量为30 mL的发酵培养基(250 mL三角瓶)中,在30 ℃,180 r/min的条件下培养5 d。
1.2.4 交联柚苷酶聚集体的制备[13]
取10 mL 柚苷酶发酵液于试管中,加入2.0 倍体积的叔丁醇溶液,置于4 ℃冰箱中沉淀30 min,接着向试管中加入体积分数为2.0%的戊二醛溶液,混匀后置于4 ℃冰箱中进行交联处理1.5 h。将反应液在4 000 r/min 条件下离心10 min,移去上清液,并用10 mmol/L pH 4.0 的柠檬酸-Na2HPO4缓冲液溶液清洗3 遍,最终得到的沉淀物即为交联柚苷酶聚集体,保存于4 ℃冰箱中,备用。
1.2.5 数据分析
每组实验均设置3个平行并重复3次,利用Origin 8.5 科学绘图软件进行分析和处理。
1.3 测定方法
1.3.1 柚苷酶活性的测定
采用改进的DAVIS法[14]:将0.8 mL的0.8 mg/mL柚皮苷溶液与0.2 mL粗酶液混合均匀,置于50 ℃恒温水浴中反应30 min。取0.1 mL反应液,加入5 mL一缩二乙二醇(φ=90%)和0.1 mL的NaOH溶液(4 mol/L),在室温下静置10 min,于波长420 nm处测定溶液的吸光值。
柚苷酶活力单位定义[15]:在pH 4.5,温度为50 ℃的条件下,1 min水解1 μg的柚皮苷所需的酶量为1个酶活性单位(U/mL或U/g)。
相对酶活力![]()
(1)
酶活回收率/%=
(2)
1.3.2 交联柚苷酶聚集体的表征
分别用扫描电子显微镜(scanning electron microscope, SEM)和红外光谱(fourier transform infrared, FTIR)对交联柚苷酶聚集体进行表征。
2 结果与讨论
2.1 渣水比对柚苷酶发酵酶活的影响
由图1可知,随着果渣浸出液制备过程中渣水比的提高,柚苷酶的发酵酶活先逐渐增加,在果渣与水比例为1∶8时,柚苷酶酶活达到最大值为430.19 U/mL,是未添加果渣进行发酵时柚苷酶酶活(77.21 U/mL)的5.57倍。而进一步提高渣水比,柚苷酶酶活迅速下降,这与文献报道的结果相一致。果渣浸出液太浓或太稀均不利于柚苷酶的生产[4],其原因可能是果渣浸出液浓度太低(即渣水比较高)时,所含营养物质[16]如糖类、氨基酸、微量元素,特别是黄酮类生物活性物质的浓度过低,对菌株生长的促进作用不明显,进而导致柚苷酶发酵酶活较低;而当果渣浸出液浓度较高(即渣水比较低)时,其中含有抑制黑曲霉uv-11菌株生长或者不利于柚苷酶积累的物质。有研究发现柑橘废弃物中所含的油脂对酵母和霉菌(例如枯草芽孢杆菌,酿酒酵母,曲霉菌)的生长具有抑制作用[17],因此选择合适的渣水比制备果汁浸出液能够有效提高柚苷酶发酵酶活。
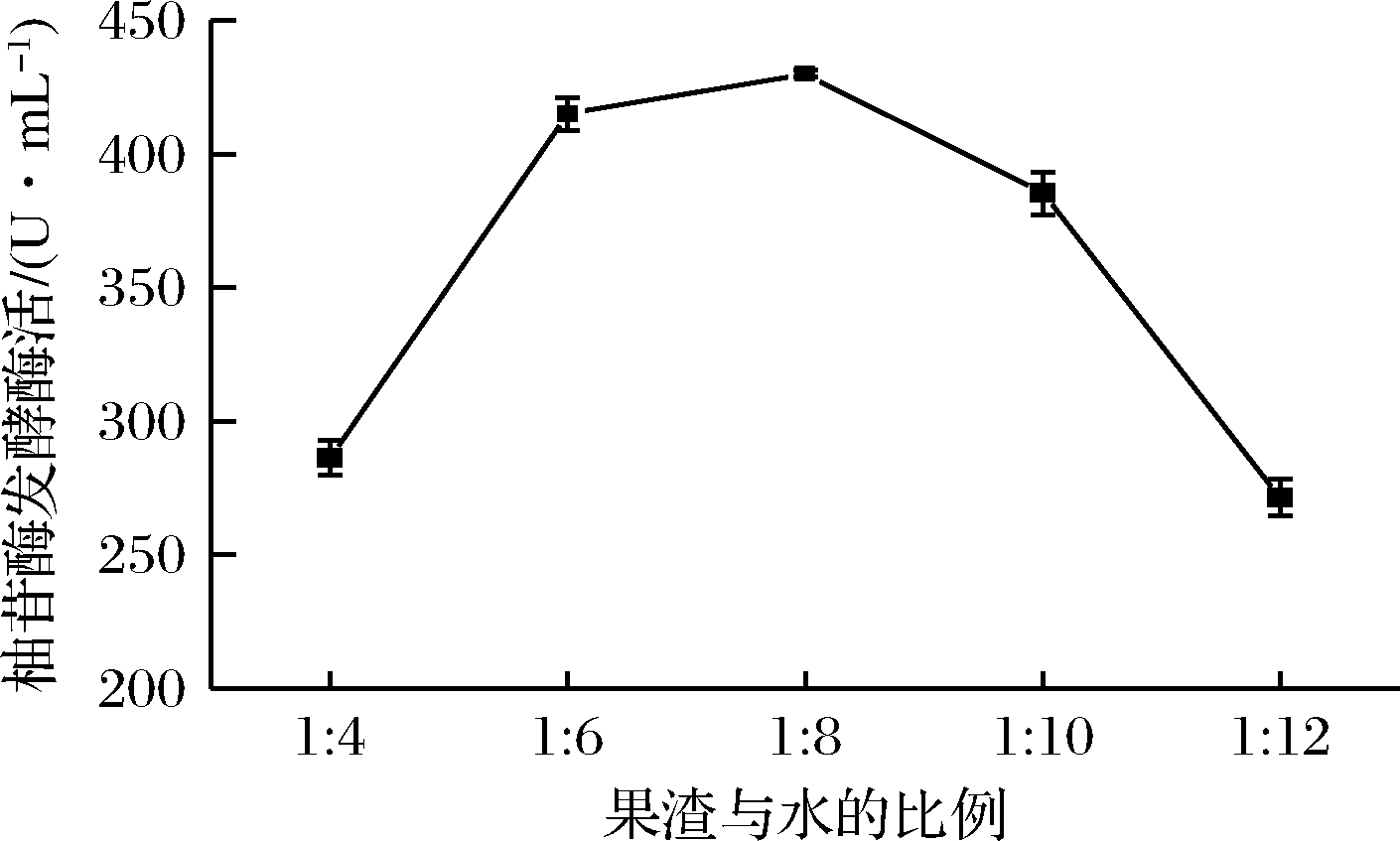
图1 渣水比对柚苷酶发酵酶活的影响
Fig.1 Effects of different ratios of citrus fruit residue to water on naringinase fermnetation activity
2.2 果渣浸出液发酵生产柚苷酶的工艺研究
2.2.1 碳源种类对柚苷酶发酵酶活的影响
将黑曲霉FFCC uv-11在以果渣浸出液为基质的培养基上发酵生产柚苷酶,研究不同碳源对柚苷酶发酵酶活的影响,实验结果如图2所示,以麸皮粉为碳源时,柚苷酶发酵酶活最高,可达650.37 U/mL,而以可溶性淀粉为碳源时,柚苷酶发酵酶活最低(109.34 U/mL)。麸皮对菌种产酶的影响主要从2方面考虑[18]:一方面是其为产酶提供必要的营养因子;另一方面,其含量增加又会降低培养基的蓬松程度,使通气量降低,从而影响产酶。且麸皮粉价格便宜,来源广泛,是柚苷酶发酵的优良碳源。

图2 碳源种类对柚苷酶发酵酶活的影响
Fig.2 Effects of various carbon sources on naringinase fermnetation activity
2.2.2 麸皮粉质量浓度对柚苷酶发酵酶活的影响
由图3可知,当麸皮粉质量浓度在1.5~5.5 g/L范围内时,随着麸皮粉浓度的增大,柚苷酶发酵酶活力逐渐提高,当麸皮粉质量浓度为5.5 g/L时,柚苷酶酶发酵酶活达到最高,为892.96 U/mL;而麸皮粉质量浓度继续增加时,柚苷酶酶发酵酶活逐渐降低。伍玉春等[19]利用黑曲霉SL2K发酵产柚苷酶时,发现当麸皮粉添加量在1%~3%时,随着麸皮粉添加量的增加,所产柚苷酶酶活力逐渐提高,而当麸皮粉添加量>3%时,柚苷酶酶活力逐渐降低。因此,本实验确定较优的麸皮粉质量浓度为5.5 g/L。
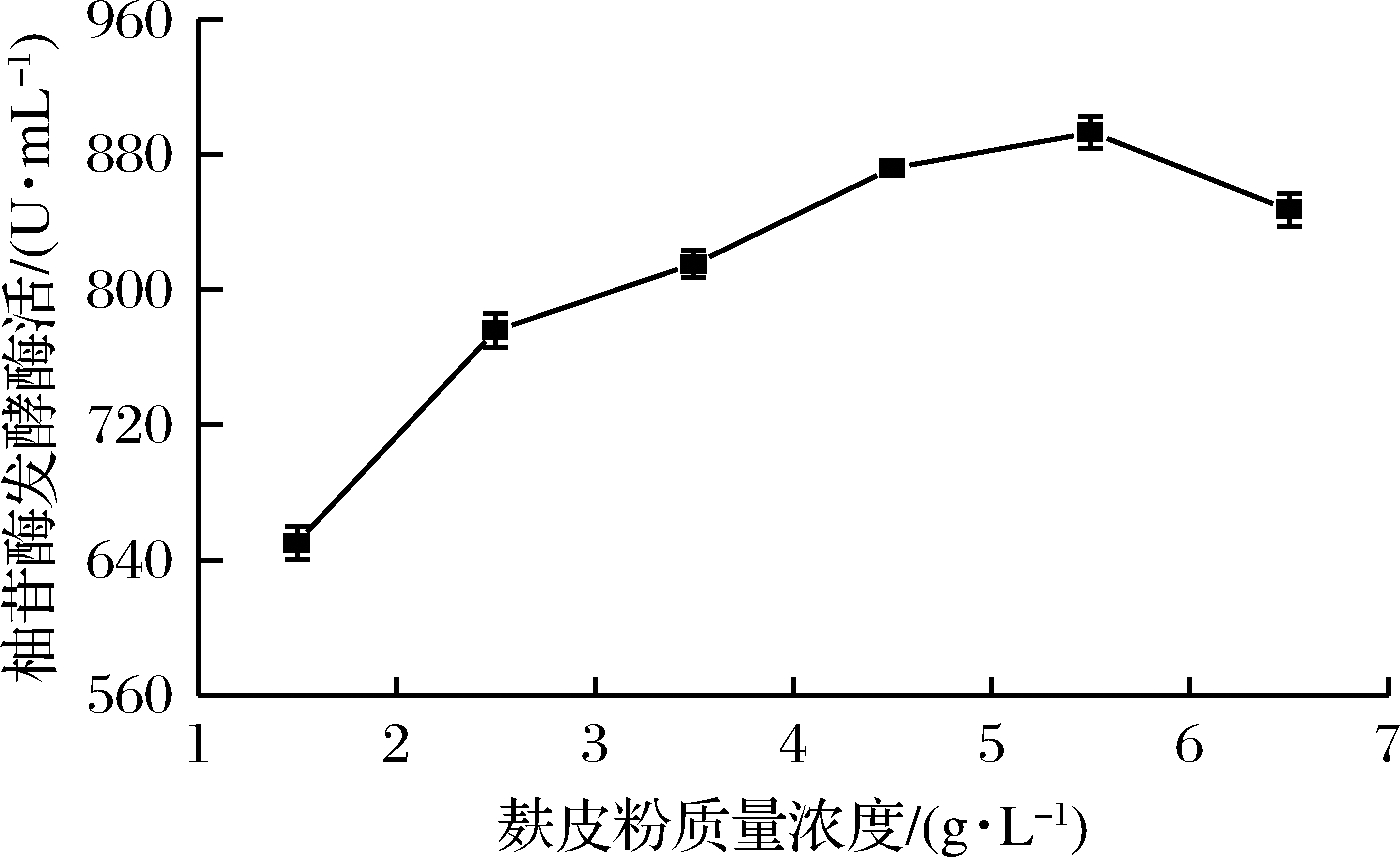
图3 麸皮粉质量浓度对柚苷酶发酵酶活力的影响
Fig.3 Effects of different mass concentration of bran powder on naringinase fermnetation activity
2.2.3 氮源种类对柚苷酶发酵酶活力的影响
微生物对不同氮源的利用能力不同,而不同种类的氮源对促进微生物生长和产酶的作用也不同,因此发酵过程中应选出合适的氮源种类,防止不适宜的氮源对菌体生长和发酵产酶造成不利的影响[20]。由图4可知,(NH4)2SO4更利于菌株发酵产酶,此时柚苷酶发酵酶活力(821.56 U/mL)达到最高,而有机氮源中加入酵母浸粉后柚苷酶发酵酶活(641.52 U/mL)较高,与文献报道一致。刘艳苓等[21]通过不同氮源的比较,最终选定酵母浸膏作为氮源,用于棘孢曲霉JMUdb058发酵产α-L-鼠李糖苷酶,使鼠李糖苷酶发酵酶活比初始培养基的酶活提高了84.67%。

图4 氮源种类对柚苷酶发酵酶活的影响
Fig.4 Effects of various nitrogen sources on naringinase fermnetation activity
2.2.4 不同质量比复合氮源对柚苷酶发酵酶活力的影响
无机氮源成分单一、质量稳定、可被菌体快速利用,而有机氮源中含有丰富的蛋白质、肽类、游离的氨基酸以及少量的生长因子、糖类和脂肪等,使得微生物表现出生长旺盛、菌体浓度增长迅速等特点。因此,文献也多采用无机氮源和有机氮源复配的方式[20, 22]。由图5可知,当(NH4)2SO4与酵母浸粉质量比为7∶3时,柚苷酶发酵酶活(1 180.15 U/mL)达到最高,显著高于单一无机氮源(NH4)2SO4或单一有机氮源酵母浸粉进行发酵时的柚苷酶发酵酶活力。如陈娜等[23]采用(NH4)2SO4与酵母浸粉作为氮源用于黑曲霉发酵产β-葡萄糖苷酶,其发酵酶活力较优化前提高了39.30%。

A-(NH4)2SO4;Y-酵母浸粉
图5 不同质量比复合氮源对柚苷酶发酵酶活力的影响
Fig.5 Effects of different weight ratios of inorganic nitrogen to organic nitrogen on naringinase fermnetation activity
利用果渣浸出液发酵黑曲霉得到的柚苷酶发酵酶活力高达1 180.15 U/mL,是初始条件下柚苷酶发酵酶活力的16.3倍。廉萌等[12]采用黑曲霉FFCC uv-11与根霉FFCC 3201共培养发酵生产柚苷酶,经优化后柚苷酶发酵酶活力可达733.19 U/mL,是未优化的2.22倍;袁文博等[24]通过诱变处理获得1株高产柚苷酶菌株 A. alternate SK.37002,进行培养基优化后柚苷酶发酵酶活力达到624.73 U/mL,发酵酶活力比优化前提高了90%。为提高柚苷酶发酵酶活力和探索柚苷酶发酵生产新工艺提供了思路。
2.3 交联柚苷酶聚集体的制备及酶学性质研究
2.3.1 交联柚苷酶聚集体的制备
为了提高柚苷酶的操作稳定性、简化分离和回收工艺,进一步将发酵所得柚苷酶制备成无载体固定化酶——交联酶聚集体,研究了不同种类沉淀剂、沉淀剂与发酵液体积比、交联剂浓度和交联时间对交联柚苷酶聚集体制备过程的影响。结果表明,以叔丁醇为沉淀剂,加入体积为2.0倍发酵液体积的叔丁醇对柚苷酶分子进行沉降聚集,然后加入体积分数为2.0% 的戊二醛作为双功能交联剂,在4 ℃条件下交联1.5 h,制备得到交联柚苷酶聚集体的酶活可达505.21 U/mL,酶活回收率可达73%以上。
2.3.2 交联柚苷酶聚集体的SEM表征
由图6交联柚苷酶聚集体的电镜扫描结果可知,其表面疏水性高,糖基化程度低,结构致密,呈网状结构,分子间相互接连,孔径分布均匀,利于酶分子与相应底物结合,从而推测酶活性表现良好,增加了与酶分子反应的有效面积,提高了酶的利用效率,相比较游离酶而言其温度酸碱稳定性随交联反应而提高。

图6 交联柚苷酶聚集体电镜照片
Fig.6 SEM photographs of cross-linked naringinase aggregates
2.3.3 交联柚苷酶聚集体的红外表征
对游离酶和交联柚苷酶聚集体进行红外光谱分析,其中1 100和1 400 cm-1是C—N键的伸缩振动区,1 500到1 600 cm-1是C![]() N键的伸缩振动区,3 300到3 400 cm-1是N—H的伸缩振动区。从图7可以看出,在1 400 cm-1处出现较多峰的分裂和增强,这说明柚苷酶在交联过程中形成了一定数量的C—N键。交联主要是双功能交联剂通过在相邻酶分子表面上与氨基酸残基的游离氨基发生反应,形成由分子间和分子内羟醛缩合产生的低聚物或聚合物,该过程涉及席夫碱反应和迈克尔加成反应[25]。而交联后1 500到1 600 cm-1处峰的增强也说明了交联过程中双功能交联剂戊二醛中的醛基与柚苷酶中氨基发生席夫碱反应形成一定数量的酰胺键,表明成功制备了交联柚苷酶聚集体。
N键的伸缩振动区,3 300到3 400 cm-1是N—H的伸缩振动区。从图7可以看出,在1 400 cm-1处出现较多峰的分裂和增强,这说明柚苷酶在交联过程中形成了一定数量的C—N键。交联主要是双功能交联剂通过在相邻酶分子表面上与氨基酸残基的游离氨基发生反应,形成由分子间和分子内羟醛缩合产生的低聚物或聚合物,该过程涉及席夫碱反应和迈克尔加成反应[25]。而交联后1 500到1 600 cm-1处峰的增强也说明了交联过程中双功能交联剂戊二醛中的醛基与柚苷酶中氨基发生席夫碱反应形成一定数量的酰胺键,表明成功制备了交联柚苷酶聚集体。
2.3.4 交联柚苷酶聚集体的酶学性质探究
交联柚苷酶聚集体与游离柚苷酶水解柚皮苷实验的最佳反应pH 及pH 稳定性的实验结果如图8所示。由图8-a可知,交联柚苷酶聚集体的最佳反应pH与游离柚苷酶的最佳反应pH一致,且在相同pH下交联柚苷酶聚集体相对酶活力更高。而图8-b表明,游离柚苷酶的相对酶活力随pH的增加迅速降低,而交联柚苷酶聚集体的相对酶活力在pH 2.5~8.5范围内较为稳定,均在85%以上。与朱必玉[13]制备的交联柚苷酶聚集体相比,本研究的交联柚苷酶聚集体在pH 3.5~5.5即最佳水解反应条件时,相对酶活力可达99%以上,而在碱性条件下即pH 7.5~8.5时,相对酶活力仍能达到85%左右,比朱必玉[13]的结果提高3倍以上,说明其具有较强的pH 稳定性。

图7 游离柚苷酶和交联柚苷酶聚集体红外光谱图
Fig.7 FTIR spectra of free naringinase and cross-linked naringinase aggregates
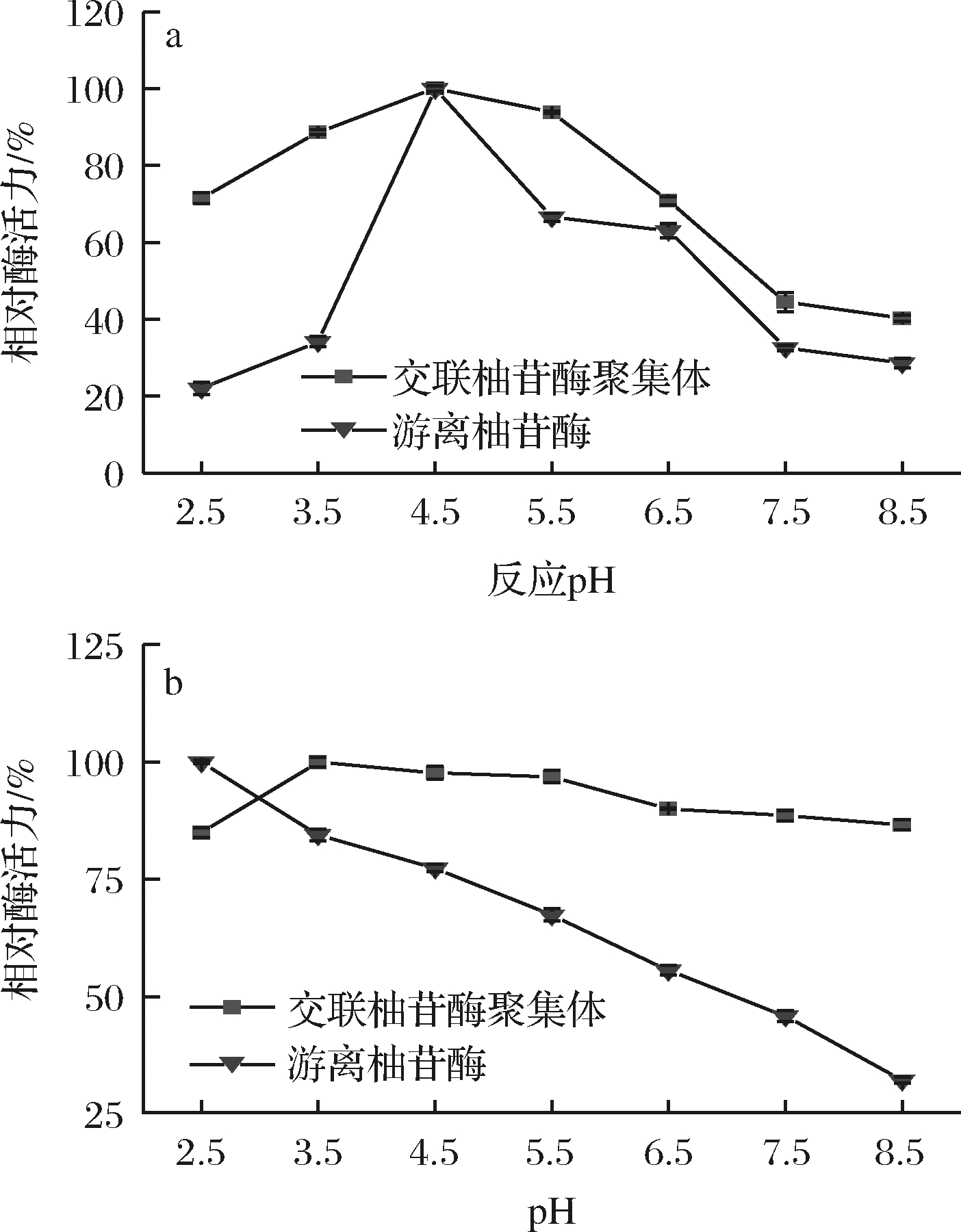
a-酶解柚皮苷反应的最适反应pH;b-酶解柚皮苷反应的pH稳定性
图8 交联柚苷酶聚集体与游离酶水解柚皮苷最适反应pH和pH稳定性
Fig.8 Reaction pH and pH stability of naringin hydrolysis by cross-linked naringinase aggregates and free naringinase
交联柚苷酶聚集体与游离柚苷酶水解柚皮苷实验的最佳反应温度及温度稳定性的实验结果如图9所示。由图9-a可知,交联柚苷酶聚集体的最佳反应温度与游离柚苷酶的最佳反应温度一致,在相同反应温度下交联柚苷酶聚集体的相对酶活力更高,这与徐杰等[15]的研究结果一致,并在一定程度上表明交联柚苷酶聚集体具有优良的温度稳定性。如图9-b所示,分别在40~70 ℃保藏6 h后,游离柚苷酶酶活力迅速下降,而交联柚苷酶聚集体仍能保持较高的酶活性,这与张双正等[26]采用羧基磁性纳米粒子制备杂化磁响应交联酶聚集体(M-CLEAs)的实验规律相同。同时,与游离柚苷酶相比,交联柚苷酶聚集体在 50~70 ℃的热稳定性均有大幅度提高,这主要是由于酶分子发生交联之后,分子之间连接更紧密,酶失活需要克服更多的非共价及共价作用力,同时酶分子内部基团的热振动减小,其发生热伸展变性的可能性变小,因而提高了其在高温条件下的稳定性[27]。

a-酶解柚皮苷反应的最适反应温度;b-酶解柚皮苷反应的温度稳定性
图9 交联柚苷酶聚集体与游离酶水解柚皮苷最适反应温度和温度稳定性
Fig.9 Reaction temperature and tmperature stability of hydrolysis of naringin by cross-linked naringinase aggregates and free naringinase
3 结论
本研究利用柑橘果渣浸出液为培养基基质,对实验室自主保藏的菌种黑曲霉FFCC uv-11进行发酵产酶研究,通过优化培养基组成提高柚苷酶发酵酶活,进一步制备出无载体固定化酶——交联柚苷酶聚集体,并对其酶学性质进行探究。结果表明,当果渣与水的比例为1∶8、以5.5 g/L麸皮粉为碳源、(NH4)2SO4与酵母浸粉(质量比为7∶3)为氮源时,柚苷酶发酵酶活可达1 180.15 U/mL,是未优化条件下柚苷酶发酵酶活的15.3倍。进一步以叔丁醇为沉淀剂,戊二醛(φ=2.0%)为双功能交联剂,在4 ℃条件下交联1.5 h,所得交联柚苷酶聚集体的酶活回收率可达73%以上,且具有良好的pH和温度稳定性。
[1] 程善燕, 刘国华, 于继英, 等. 柑橘渣饲用固体发酵研究进展[J]. 家畜生态学报, 2018,39(11):87-90.
[2] 陈倩茜, 张萌, 王海燕, 等. 高场强超声处理对柑橘果胶分子结构及其功能特性的影响[J]. 食品与发酵工业, 2019,45(2):87-94.
[3] 王耸, 刘艳苓, 姜泽东, 等. 棘孢曲霉固态发酵柚皮产柚苷酶的条件优化[J]. 微生物学通报, 2015,42(10):1 936-1 944.
[4] 杨颖, 唐伟敏, 邢建荣, 等. 以橘渣为原料间歇振荡法生产细菌纤维素[J]. 浙江农业学报, 2018,30(2):307-313.
[5] HALL D H. A new enzyme of the glycosidase type[J]. Nature, 1938,142(1):150.
[6] 励建荣, 梁新乐, 陈敏, 等. 酶法脱苦干型桔酒发酵工艺的研究[J]. 食品与发酵工业, 2001,27(1):81-83.
[7] 方修贵, 黄洪舸, 曹雪丹, 等. 柑橘加工常用技术(4)——柑橘果汁饮料及生产流程[J]. 浙江柑橘, 2019,36(1):35-40.
[8] 王建芝. 功能化磁性纳米材料的制备及其固定化酶的研究.[D]. 兰州:兰州大学, 2015.
[9] 韦克毅, 左晓琼, 刘晓敏, 等. 磁性中性蛋白酶的固定化研究[J]. 现代化工, 2018,38(2):75-78.
[10] 牟海霞. 腈水合酶交联酶聚集体的制备及应用[D]. 天津:河北工业大学生物化工, 2015.
[11] 武仙山, 何立千, 叶磊. 交联酶聚集体——一种无载体酶固定化方法[J]. 生物技术, 2005,15(2):90-92.
[12] 廉萌, 李佥, 田晶, 等. 真菌共培养强化柚苷酶生产的工艺优化[J]. 高校化学工程学报, 2017,31(2):394-400.
[13] 朱必玉. 交联柚苷酶聚集体的制备及其应用[D]. 芜湖:安徽工程大学, 2016.
[14] DAVIS W B. Determination of flavanones in citrus fruits.[J]. Industrial & Engineering Chemistry Analytical Edition, 1947,19(7):476-478.
[15] 徐杰, 孙西同, 李佥, 等. 磁性硅基壳聚糖微球固定化柚苷酶水解柚皮苷[J]. 精细化工, 2018,35(11):1 885-1 892.
[16] PUTNIK P, ![]() JAMBRAK A, et al. Innovative “Green” and novel strategies for the extraction of bioactive added value compounds from citrus wastes—A review[J]. Molecules, 2017,22(5):680.
JAMBRAK A, et al. Innovative “Green” and novel strategies for the extraction of bioactive added value compounds from citrus wastes—A review[J]. Molecules, 2017,22(5):680.
[17] SUBBA M S, SOUMITHRI T C, RAO R S. Antimicrobial action of citrus oils[J]. Journal of Food Science, 2006,32(2):225-227.
[18] 孙君社, 李雪, 董秀芹. 纤维素酶高产菌株的选育及产酶条件的研究[J]. 北京林业大学学报, 2002,24(2):83-85.
[19] 伍玉春, 陈显玲, 苏龙. 产柚苷酶黑曲霉SL2K发酵条件优化[J]. 中国酿造, 2018,37(6):125-130.
[20] 朱运平, 郗梦露, 李秀婷, 等. 高产柚苷酶菌株米曲霉的诱变育种及发酵条件优化[J]. 中国食品学报, 2018,18(8):115-124.
[21] 刘艳苓, 肖安风, 李利君, 等. 棘孢曲霉固态发酵α-L-鼠李糖苷酶调控机制及培养基优化[J]. 中国食品学报, 2015,15(7):10-17.
[22] 钱伟, 黄元杰, 王先锋, 等. 黑曲霉固态发酵产柚苷酶培养基的优化[J]. 安徽工程大学学报, 2016,31(1):16-20.
[23] 陈娜, 付传颖, 张玉新, 等. 黑曲霉高产β -葡萄糖苷酶菌株的诱变、筛选及发酵条件优化[J]. 基因组学与应用生物学, 2016,35(4):901-906.
[24] 袁文博, 江波, 张涛. 一株产柚苷酶菌株的ARTP诱变育种及培养基的优化[J]. 食品与生物技术学报, 2018,37(9):962-970.
[25] 陈翠翠, 何腊平, 郑佳, 等. 交联酶聚集体性能改善研究进展[J]. 食品工业科技, 2018,39(22):298-303; 308.
[26] 张双正, 陈国, 苏鹏飞. 磁响应交联糖化酶聚集体的制备及催化特性[J]. 化工学报, 2017,68(7):2 763-2 770.
[27] 陈海龙, 田耀旗, 李丹, 等. 脂肪酶交联聚集体的制备及其催化合成月桂酸淀粉酯的研究[J]. 食品与发酵工业, 2017,43(2):21-25.