青稞(Hordeum vulgare L. var. nudum Hook. f)是禾本科大麦属作物,主要分布在我国青藏高原地区[1]。作为一种重要的高原谷类作物,青稞中含有丰富的矿物质、氨基酸和维生素[2-3],此外,青稞中还含有5.25%左右的β-葡聚糖[2]。与其他谷物类作物相比较,青稞具有“三高两低”(高蛋白、高纤维、高维生素和低脂肪、低糖)的特点[3],具有降血脂及降血糖等功效[4],这些决定了青稞制品是糖尿病患者优选的优质谷物类食物。
尽管青稞作为糖尿病患者食品具有一定优势,但青稞中淀粉含量与一般谷物相近[5],具有高消化率,进入人体会导致血糖迅速升高[6],此特性限制了青稞在糖尿病专用食品开发方面的应用。通过缩短支链淀粉的支链长度,增加其支链密度,可有效增加淀粉的抗消化性[7]。目前降解淀粉的方法主要有3种:化学法、生物法、生物化学法,并以生物法中的酶法为主流方法[8-10]。而关于利用糖化菌的微生物降解法多运用于谷物类食品深加工及降解甘蔗渣等废料过程中[11-13]。
微生物法降解淀粉虽具有一定的优势,但必须具备优质的菌种才可保证其效率[14]。大曲作为酿造青稞酒的糖化剂、发酵剂和生香剂在酿造过程中起着至关重要的作用,其中霉菌是大曲在发酵过程中的糖化菌[15-16]。本试验以大曲为原料,从大曲中筛选出优势糖化菌,优化糖化菌降解青稞中淀粉的发酵条件,为采用生物法降解青稞淀粉提供理论依据,从而拓展青稞在糖尿病患者专用食品开发中的应用领域。
1 材料与方法
1.1 材料
1.1.1 材料及试剂
青稞酒大曲:青海青稞酒股份有限公司。
MgSO4,K2HPO4,NaOH,天津市河东区红岩试剂厂;察式琼脂培养基,北京奥博星生物技术有限责任公司;3,5-二硝基水杨酸,上海中秦化学试剂有限公司。
1.1.2 仪器
尼康E100型生物显微镜,北京佳缘兴业科技有限公司;UV-2600型紫外分光光度计,岛津企业管理有限公司;WDP-450型电热恒温培养箱,上海安亭科学仪器有限公司。
1.2 试验方法
1.2.1 糖化菌的筛选及鉴定
菌株分离:取青稞酒大曲,参考文献[17]平板划线分离直至获得具有典型形态的霉菌。
霉菌的形态鉴定:根据参考文献[18]对霉菌进行制片,在显微镜下观察其形态,对霉菌进行鉴定[19]。
糖化菌种的筛选:根据参考文献[20],以糖化力为指标,从典型霉菌中筛选最佳糖化菌。在以淀粉为唯一碳源的培养基中加入菌体,28 ℃条件下培养12 h后,测定还原糖质量。霉菌糖化力单位定义为:1 g菌体每小时降解淀粉生成还原糖的质量。
优势糖化菌的分子生物学鉴定:取斜面菌种送样。DNA提取、ITS鉴定均由生工生物工程(上海)股份有限公司完成。
1.2.2 优势糖化菌生长性能的测定
根据参考文献[21]的方法将糖化菌分别接种在霉菌液体培养基中,分别考察温度(31、34、37、40、43、46 ℃)、pH(3.0、4.0、5.0、6.0、7.0)、NaCl质量浓度(20、35、50、65、80 g/L)、发酵时间(1、2、3、4、5、6、7 d)对米曲霉生长性能的影响,发酵培养后,计算菌体干重[22],分析米曲霉的生长性能。
1.2.3 还原糖含量的测定
参考文献[23]采用DNS法测定青稞发酵液中还原糖的质量,计算单位质量青稞发酵降解成还原糖的质量。绘制标准曲线,其回归方程为:y=1.078x+0.016 3,R2=0.999 2。
1.2.4 多糖含量的测定
参考文献[24],采用苯酚-硫酸法测定发酵液中可溶性总糖的质量,计算单位质量青稞发酵降解成可溶性糖的质量。绘制标准曲线,其回归方程为:y=7.489 6x-0.028 3,R2=0.998 7。
1.2.5 降低青稞淀粉工艺及操作要点
工艺流程:菌种活化→种子液制备→发酵培养→水洗离心→收集固体→烘干→低糖青稞粉
菌种活化:将保存在-80 ℃的优势糖化菌菌株在察氏琼脂培养基上斜面接种,在28 ℃条件下培养3 d,重复2~3次,活化后的菌种保存至4 ℃冰箱待用。
种子液制备:在霉菌液体培养基中接入几株糖化菌,在28 ℃恒温振荡培养箱中扩大培养。
发酵培养:将80目以上的青稞粉与发酵液以料液毕1∶10(g∶mL)的比例在一定条件下发酵培养。
水洗离心:发酵结束后,将发酵液去除,离心得到的固体用蒸馏水洗涤并再次离心,重复2~3次。
烘干:将收集得到的固体放于60 ℃鼓风干燥箱中烘干。
1.2.6 利用糖化菌降解青稞淀粉工艺的单因素试验
取1 g青稞粉,加入10 mL发酵液,分别考察发酵时间(1、2、3、4、5 d)、发酵初始pH(3.0、4.0、5.0、6.0、7.0)、发酵温度(28、31、34、37、40 ℃)和菌种接种量(3%、6%、9%、12%、15%)对发酵过程的影响,测定发酵液中还原糖及总糖质量分数以确定各单因素适宜的条件。
1.2.7 微生物降解青稞淀粉的响应面试验
在单因素试验的基础上,选择对降解青稞淀粉影响较显著的3个因素,以发酵液中还原糖质量分数为响应值,采用3因素3水平中心组合设计(Box-behnken)[25-26],对霉菌降解青稞中糖类化合物的发酵工艺进行优化,确定最佳发酵工艺条件。响应面设计因素与水平见表1。
表1 响应面实验因素及水平表
Table 1 Factors and levels of Box-Behnken experimental

因素水平-101X1(时间)/d234X2(温度)/℃343740X3(接种量)/%369
1.3 数据处理
使用Excel 2010软件、Spss 20.0软件和Design-Expert 8.0.6.1软件进行数据统计分析。试验结果用“平均值±标准差”表示。
2 结果与分析
2.1 分离微生物的菌落形态特征
分离菌株MJ1、MJ2、MJ3经固体培养基培养48 h后菌落形态及特征如表2所示。
表2 不同霉菌菌株的菌落形态及特征
Table 2 Colony morphology and characteristics of different mold strains

菌种编号菌落形状菌落颜色培养基颜色渗出液表面生长速度MJ1短绒状乳白色淡黄色,边缘为白色无平滑,致密慢MJ2地毯状黄色至黄褐色,边缘为白色黄色偶见少量褐色渗出液致密,有同心环较快MJ3絮状前期白色,后期灰白色至灰黑色淡黄色无疏松生长迅速,2~3 d铺满平皿,无明显菌落界限
MJ1、MJ2、MJ3经10×光学显微镜下观察,记录的显微形态分别如图1所示。

a-MJ1显微图;b- MJ2显微图;c- MJ3显微图
图1 三株霉菌显微图(10×)
Fig.1 Micrograph of three strains of mold (10×)
用光学显微镜观察,3株霉菌形态学特征如表3所示。
表3 不同霉菌菌株的形态学特征
Table 3 Morphological characteristics of different mold strains

菌种编号形态学特征MJ1有横隔,分生孢子梗直立,分生孢子呈圆筒形,无色MJ2分生孢子较大,分生孢子头呈放射状,顶囊近球形,有横隔MJ3分生孢子头呈水滴形,无色,无横隔
2.2 优势糖化菌的筛选结果
MJ1、MJ2、MJ3菌株糖化力分别为(58.59±3.98)、(359.62±9.71)、(148.83±3.60)μg/(g·h),即菌株MJ2糖化力最高且明显高于MJ1和MJ3,具有明显降糖优势。
2.3 优势糖化菌分子生物学鉴定结果
将获得的优势糖化菌ITS基因序列在NCBI上进行blast比对,长度为529 bp。序列比对在99%以上的霉菌为丝衣霉属(Byssochlamys),踝节菌属(Talaromyces),拟青霉属(Paecilomyces),淡紫紫孢菌(Purpureocillium lilacinum),曲霉属(Aspergillus)。
结合表2及表3的鉴定结果,并依据其他参考文献[27]对优势糖化菌属种鉴定为:曲霉属,米曲霉。
2.4 优势糖化菌生长性能测定
由图2可知,糖化菌的最适生长温度在40 ℃左右,此时培养基中出现圆润的菌丝小球,在40 ℃附近,更适宜米曲霉菌丝体的形成;随着pH的降低,米曲霉的生长逐渐旺盛,pH为4时,具有最好的生长性能;pH为3时,生长速度稍有下降,表明米曲霉更适宜在酸性条件下生长,米曲霉在过低和过高浓度钠盐环境下,生长缓慢,而在3.5%~6.5%条件下,生长良好,一定浓度的钠离子可以辅助米曲霉的生长,钠离子浓度过大,不利于霉菌的生长,此结果表明筛选的糖化菌株具有一定的耐盐性;米曲霉生长曲线如图2-d所示,可初步判断0~3 d为米曲霉的生长迟滞期,3~5 d为对数期,6~7 d为稳定期。
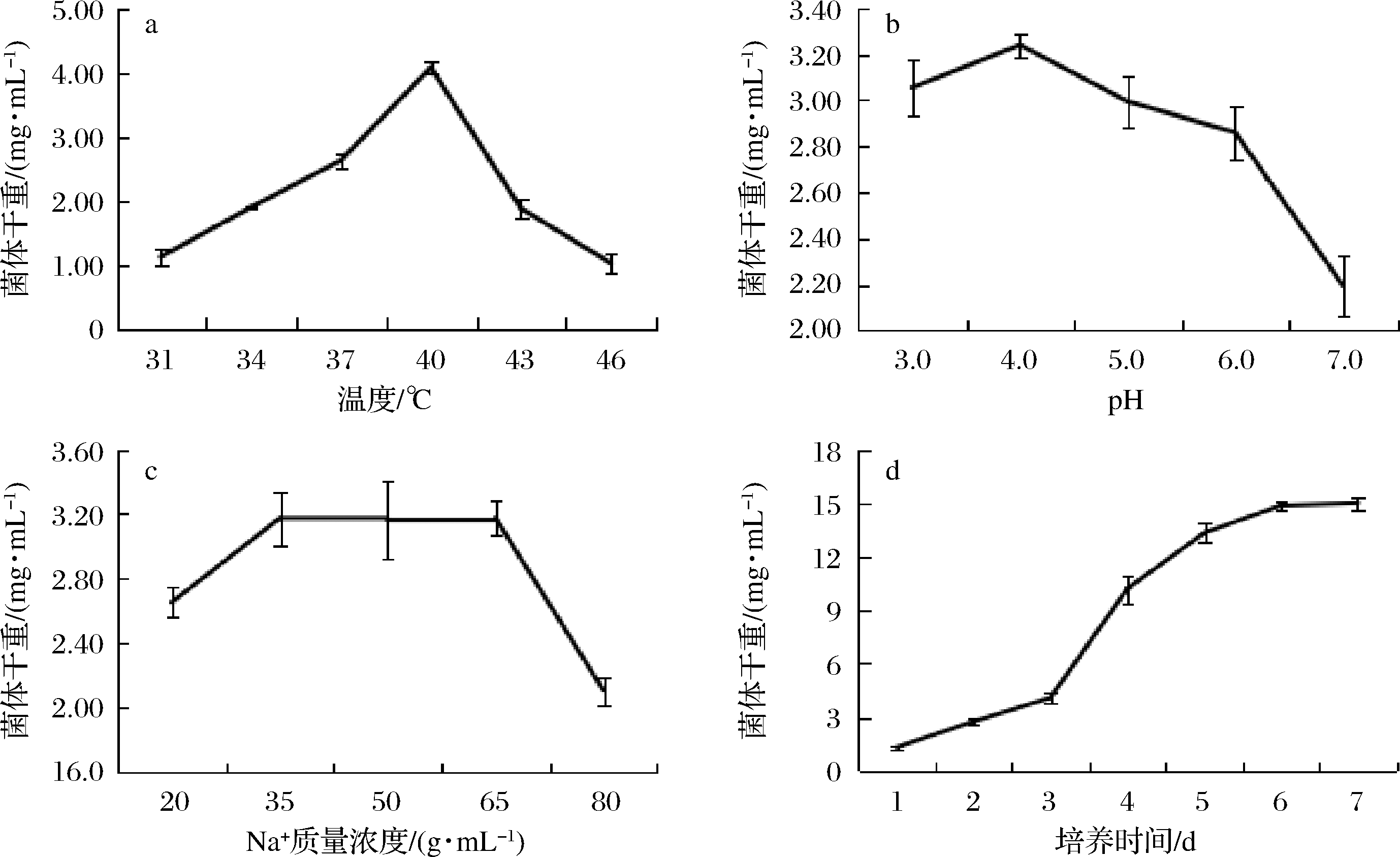
图2 优势糖化菌生长性能测定
Fig.2 Determination of growth performance of dominant saccharification fungus
2.5 微生物降解青稞淀粉工艺的单因素试验结果
发酵结束后,测定发酵液中糖的质量分数是衡量降解青稞淀粉效果的重要指标。由图3可知,发酵3 d时,糖质量分数最高,发酵过程中糖化作用致使糖质量分数增加,但积累至一定浓度会抑制降解过程,故随着发酵时间的延长,发酵液中糖的质量分数下降,故选取适宜的发酵时间为3 d;发酵液中糖质量分数随着起始pH的变化没有明显的规律性变化,发酵后发酵液的pH都呈酸性,起始pH为7的条件容易控制,故确定适宜的起始pH为7;温度为37 ℃时,糖的质量分数最大,温度过低抑制微生物的生长,过高的温度则使得微生物生长代谢受阻[26],从而降解淀粉能力减弱,故选取37 ℃为适宜的发酵温度;接种量为6%时,糖质量分数最高,接种量过小需要延长发酵时间,接种量过大时,菌体繁殖速度过快,糖化菌生长活力下降,故选取适宜接种量为6%。

图3 各因素对糖质量分数的影响
Fig.3 The influence of each factor on the sugar mass fraction
2.6 响应面试验结果
2.6.1 响应面试验结果及方差分析
响应面试验结果见表4;回归模型的方差分析见表5。
表4 响应面设计及结果
Table 4 Structured matrices and experiment results of Box-Behnken
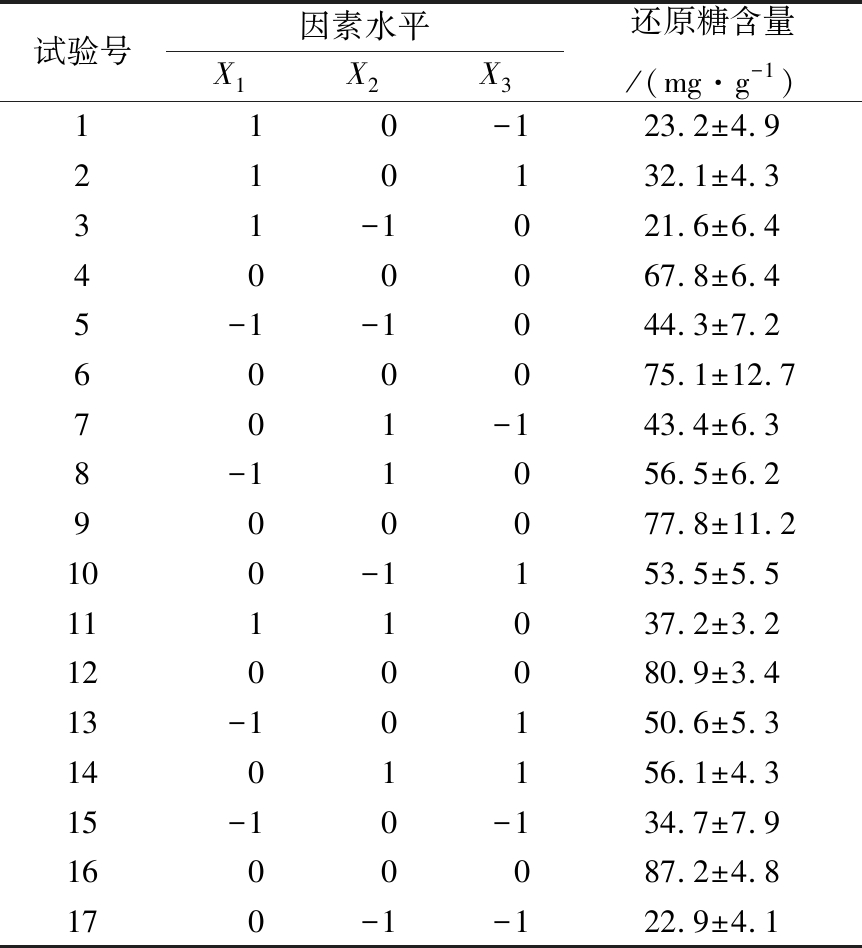
试验号因素水平X1X2X3还原糖含量/(mg·g-1)110-123.2±4.9210132.1±4.331-1021.6±6.4400067.8±6.45-1-1044.3±7.2600075.1±12.7701-143.4±6.38-11056.5±6.2900077.8±11.2100-1153.5±5.51111037.2±3.21200080.9±3.413-10150.6±5.31401156.1±4.315-10-134.7±7.91600087.2±4.8170-1-122.9±4.1
用Design-Expert 8.0.6.1 对表4中的试验数据进行回归分析,得到试验因素对还原糖质量分数的多元回归方程:
表5 二次回归模型方差分析结果
Table 5 Variance analysis of quadratic regression model of Box-Behnken
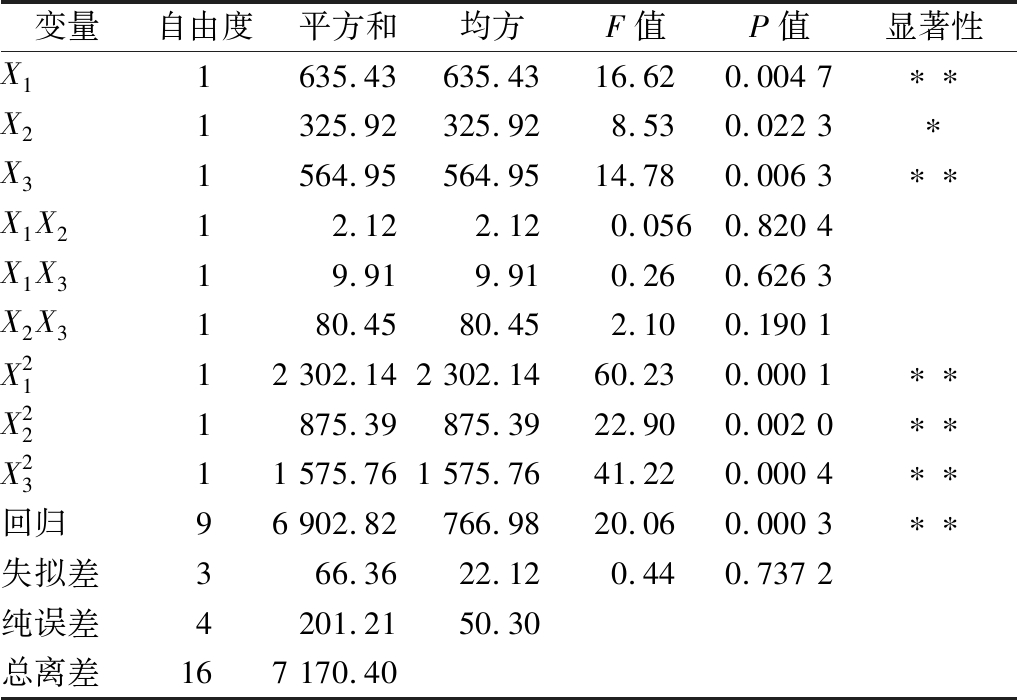
变量自由度平方和均方F值P值显著性X11635.43635.4316.620.004 7∗∗X21325.92325.928.530.022 3∗X31564.95564.9514.780.006 3∗∗X1X212.122.120.0560.820 4X1X319.919.910.260.626 3X2X3180.4580.452.100.190 1X2112 302.142 302.1460.230.000 1∗∗X221875.39875.3922.900.002 0∗∗X2311 575.761 575.7641.220.000 4∗∗回归96 902.82766.9820.060.000 3∗∗失拟差366.3622.120.440.737 2纯误差4201.2150.30总离差167 170.40
注:“**”表示差异极显著(P<0.01),“*”表示差异显著(P<0.05)
由表5可知,P=0.000 3<0.01,方程中![]() 对响应值有明显影响(P<0.01),X2对响应值也有影响(P<0.05),X1X2、X1X3、X2X3对响应值的影响不明显(P>0.05)。R2=0.962 7,该回归方程可以很好的描述各个因素与响应值之间的关系,可以确定工艺优化的最佳发酵条件。
对响应值有明显影响(P<0.01),X2对响应值也有影响(P<0.05),X1X2、X1X3、X2X3对响应值的影响不明显(P>0.05)。R2=0.962 7,该回归方程可以很好的描述各个因素与响应值之间的关系,可以确定工艺优化的最佳发酵条件。
2.6.2 响应面结果分析
由图4可知,还原糖质量分数最高时发酵时间应该在2.50~3.50 d之间,发酵温度应该在36~38 ℃之间,最佳接种量在6%~7%之间。

图4 因素交互作用对还原糖含量影响的响应面图
Fig.4 Response surface diagram of the effect of factor interaction on reducing sugar mass fraction
由图4可以看出,发酵时间对还原糖含量的影响大于发酵温度和接种量的影响,接种量对还原糖含量的影响大于发酵温度的影响,即各因素对还原糖含量的影响作用大小为:发酵时间>接种量>发酵温度,各因素两者的交互作用对青稞发酵液中还原糖含量的影响都较小。
2.6.3 验证试验
对分析所得的最佳条件进行验证试验,得到青稞发酵液中还原糖含量为(77.4±4.54)mg/g,分析所得的理论预测值为80.1 mg/g,相对误差为3.4%,与验证试验结果相符,所以基于响应面法所得的糖化菌发酵参数可靠,回归模拟方程预估发酵液中还原糖质量分数具有可行性。
3 结论
在青稞糖化菌的筛选试验中,以富含霉菌的大曲为原料,成功筛选出糖化力为(359.62±9.71)μg/(g·h)的优势糖化菌株,鉴定其为米曲霉。米曲霉的最适生长温度为40 ℃,最适生长pH为4,对钠离子具有一定的耐受性,其生长性能良好,具有较好的适应能力。经过发酵降解青稞淀粉工艺优化后,微生物降解青稞中糖类化合物的能力有所提高。在此试验中,为微生物法降解青稞淀粉提供了良好的菌种,为微生物法降解青稞淀粉提供了技术支持和理论依据。
[1] 张一鸣, 吴跃中, 杨士花, 等. 云南黑青稞多酚的提取及纯化工艺研究[J]. 食品科技, 2018, 43(5): 206-213.
[2] 罗静, 李玉锋, 胥霞. 青稞中的活性物质及功能研究进展[J]. 食品与发酵工业, 2018, 44(9): 300-304.
[3] 邓俊琳, 朱永清, 陈 建, 等. 青稞萌动过程中β-葡聚糖、γ-氨基丁酸和多酚的质量分数研究[J]. 中国粮油学报, 2018, 33(7): 19-25.
[4] 龚凌霄, 曹文燕, 张 英, 等. 青稞麸皮提取物抑制α-葡萄糖苷酶活性研究及成分分析[J]. 食品科学, 2017, 38(6): 179-184.
[5] 张文会. 西藏发展青稞加工产业的优势分析[J]. 现代农业科技, 2014(10): 320-321.
[6] 黄迪宇. 青稞酒糟饮料的制备及稳定性研究[D]. 无锡:江南大学, 2017.
[7] 安攀宇. 青稞慢性消化淀粉制备条件的优化研究[J]. 现代食品, 2016(13): 111-114.
[8] 邱文竹. 乙酰化淀粉的合成及其酶降解研究[D]. 大连:大连理工大学, 2015.
[9] 王 静, 翟 璐, 张销寒, 等. 融合淀粉酶AmyP-Clo对大米生淀粉的高效降解[J]. 微生物学报, 2017, 57(8): 1 301-1 307.
[10] ISABEL REYES, FRANCISCO CRUZ-SOSA, ANGELICA ROMAN-GUERRERO. Structural changes of corn starch during Saccharomyces cerevisiae fermentation[J]. Starch/Stärke, 2016, 68: 961-971.
[11] HE Junjun, LUO Ping, LI Qinfen, et al. Screening of starch-degrading strains in bagasse and identification of strains s2g5-1 and s3g4-8[J]. Agricultural Science & Technology, 2011, 12(1): 45-49.
[12] CRISTIANE DE OLIVEIRA LOPES, MARIA DE FA′TIMA P?′CCOLO BARCELOS, C?′NTIA NAYARA DE GOES VIEIRA, et al. Effects of sprouted and fermented quinoa (Chenopodium quinoa) on glycemic index of diet and biochemical parameters of blood of Wistar rats fed high carbohydrate diet[J]. Food Sci Technol, 2019, 56(1): 40-48.
[13] GAN Renyou, LI Huabin, ANILGUNARATNE, et al. Effects of fermented edible seeds and their products on human health:Bioactive components and bioactivities[J]. Compermention Review in Food Science and Food Safety. 2017, 16: 489-531.
[14] 袁亦舟, 张伟国, 徐建中. 青稞酒曲微生物多样性分析及米根霉制曲条件优化[J]. 食品与发酵工业, 2018, 44(5): 39-45.
[15] 班世栋, 王晓丹, 陈孟强, 等. 酱香型大曲中具产酶功能霉菌的分离筛选[J]. 酿酒, 2014, 41(4): 31-36.
[16] 李绍亮, 李学思, 侯小歌, 等. 宋河酒曲中主要霉菌的鉴定及其产酶特性的研究[J]. 酿酒, 2016, 43(6): 24-29.
[17] 滕巍, 李国莹, 刘小波, 等. 大曲中产酯化酶菌株的分离鉴定及固体发酵工艺优化[J]. 食品与生物技术学报, 2016, 35(9): 971-977.
[18] 刘国生. 微生物学实验技术[M]. 北京: 科学出版社, 2007.
[19] 魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979.
[20] 施思, 彭智辅, 乔宗伟, 等. 浓香型大曲贮藏过程中糖化力发酵力变化及真菌多样性分析[J]. 食品与发酵工业, 2017, 43(5): 76-79.
[21] 马丹, 王德宝, 靳志敏, 等. 内蒙古传统肉肠中乳酸菌的筛选及生长性能测定[J]. 食品科技, 2015, 40(3): 12-15.
[22] 马勇, 樊永军. 用OD值监测产油酵母培养过程中的菌体生物量变化[J]. 安徽农业科学, 2011, 39(12): 7 342-7 346.
[23] 程柳, 李静. 3,5-二硝基水杨酸法测定山楂片中还原糖和总糖质量分数[J]. 轻工科技, 2016, 32(3): 25-28.
[24] 杨俊杰, 严进, 陆兔林. 苯酚-硫酸法联合DNS法测定商陆多糖及响应面法优化超声波辅助提取研究[J]. 中国现代中药, 2017, 19(12): 1 743-1749;1753.
[25] C NTIA LADEIRA HANDAA, FERNANDO SANCHES DE LIMAA, MARCELA FERNANDA GETON GUELFIA, et al. Parameters of the fermentation of soybean flour by Monascus purpureus or Aspergillus oryzae on the production of bioactive compounds and antioxidant activity[J]. Food Chemistry, 2019, 271: 274-283.
NTIA LADEIRA HANDAA, FERNANDO SANCHES DE LIMAA, MARCELA FERNANDA GETON GUELFIA, et al. Parameters of the fermentation of soybean flour by Monascus purpureus or Aspergillus oryzae on the production of bioactive compounds and antioxidant activity[J]. Food Chemistry, 2019, 271: 274-283.
[26] 蒲立柠, 陈光静, 阚建全. 响应面试验优化青稞麸皮薏仁红曲霉发酵工艺[J]. 食品科学, 2017, 38(2): 264-270.
[27] 白飞荣, 姚粟, 凌空, 等. 黄曲霉和米曲霉的多相鉴定方法[J]. 微生物学通报, 2018, 45(1): 215-226.