益生菌为一类活的微生物,当足够的益生菌被摄取并根植于宿主时,具有一定保健功能[1]。益生菌可平衡肠道菌群,进而调节宿主的免疫反应、代谢过程和神经内分泌等[2-3],对疾病的防治具有重要功能。益生菌类活菌制剂也被广泛应用于乳制食品[4-5],但益生菌贮藏期间易受湿度、温度、氧气等影响,益生菌存活率低,产品货架期短[6],益生菌保护问题亟待解决。微胶囊技术可将益生菌包埋于合成或天然高分子成膜性材料中,有效降低外界不良环境因素的影响,提高稳定性,延长货架期[7-8]。益生菌微胶囊制备的主要技术有:挤压法、相分离法、喷雾干燥法、静电结合等[9-11]。复凝聚法属于相分离法的一种,反应条件温和、效率高,可大规模生产[12-14]。贺红军等[15]采用复凝聚法制备了包埋率为93.5%的嗜酸乳杆菌微胶囊,湿囊在-4和30 ℃下贮藏30 d后,仍保持82%和80%的存活率;DA SILVA等[16]使用复凝聚法制备嗜酸乳杆菌微胶囊,包埋率高达97.72%,经真空冷冻干燥后微胶囊储藏60 d后仍保持9.59 log CFU/g。复凝聚法作为一种高效的益生菌微胶囊制备方法,制备条件对包埋率的影响及湿囊的干燥方式尤为重要。
本研究以鼠李糖乳杆菌为模式益生菌,制备了鼠李糖乳杆菌微胶囊,全面的探究复凝聚法制备工艺条件;并对比喷雾干燥和真空冷冻干燥微胶囊性质,以期提高鼠李糖乳杆菌等益生菌的应用价值。
1.1.1 菌种
鼠李糖乳杆菌(ATCC 53013)(冻干粉),美国菌种保藏中心。
1.1.2 试剂
B型明胶(gelatin, GE)、阿拉伯胶(gum Arabic, GA),国药集团化学试剂有限公司;冰醋酸、Na2H(PO4)3、KH2(PO4)3,广东光华科技股份有限公司;NaOH,成都金山化学试剂有限公司;谷氨酰胺转氨酶(TG酶),泰兴市东胜食品科技有限公司;NaCl,西陇化工股份有限公司。
B-290小型喷雾干燥仪,瑞士Büchi实验室仪器公司;LKSC-B实验室电动搅拌器,金坛市大地实验仪器厂;PHS-25 pH计,上海仪电科学仪器股份有限公司;THZ-82气浴恒温摇床,上海力辰仪器科技有限公司;FD5-3真空冷冻干燥机,美国SIM公司;3K15离心机,德国Sigma公司;SK2009光学显微镜,深圳赛克数码科技有限公司;S-3000N扫描电子显微镜,日本HITACHI公司。
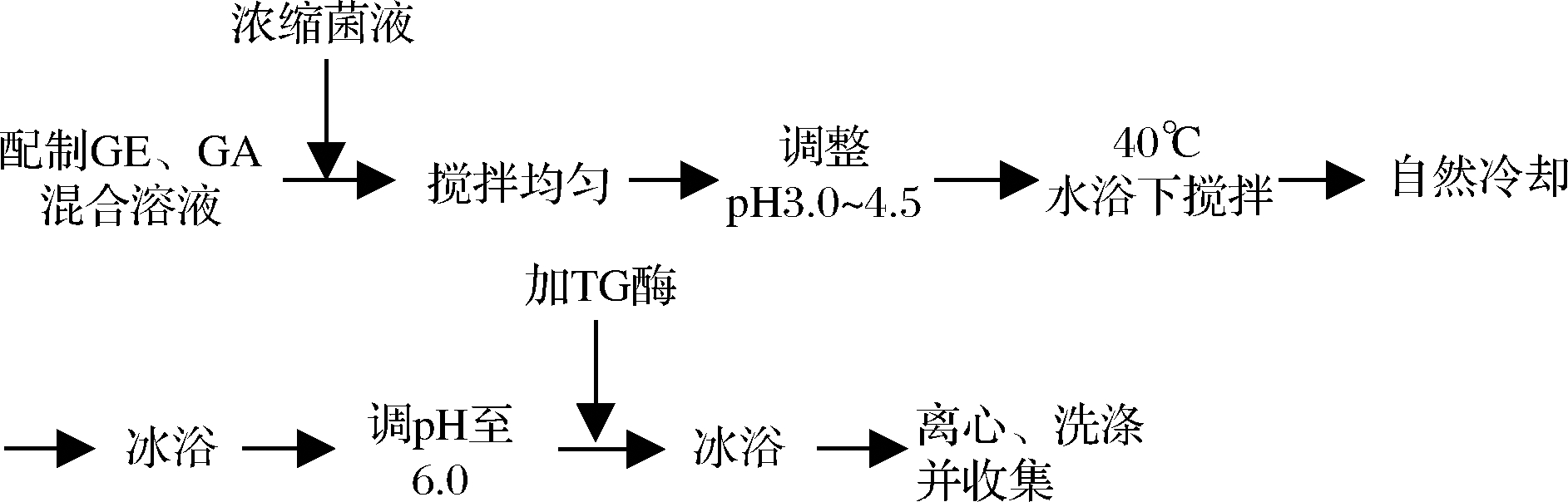
1.3.1 鼠李糖乳杆菌的制备
将鼠李糖乳杆菌冻干粉活化2次后用甘油保藏法保存。制微胶囊时,先将冷冻保藏的鼠李糖乳杆菌在MRS固体培养基上划线,37 ℃培养48 h,挑取单菌落置于MRS液体培养基中培养24 h,最后以0.1%的接种量接种于MRS液体培养基,在对数期离心收集菌体,无菌磷酸盐缓冲液(phosphate buffer saline, PBS)洗涤2次,重悬于无菌PBS得浓缩菌液(菌浓度约1010 CFU/mL)。
1.3.2 鼠李糖乳杆菌的微胶囊化工艺
基于朱晓丽等[17]的研究改进复凝聚法制备鼠李糖乳杆菌微胶囊。

(1)GE和GA(质量比1∶1)混合溶液为200 mL。
(2)TG酶添加量为25 U/g GE[18]。
1.3.3 复凝聚法制备鼠李糖乳杆菌微胶囊单因素试验
单因素试验以包埋率为指标,考察pH、壁材浓度、转速和菌添加量对复凝聚法微胶囊的影响。其中,初始条件为pH 3.50,壁材浓度1.5%,转速200 r/min,菌添加量109 CFU(试验中保持其他因素水平不变,仅改变相应因素水平)。
1.3.4 鼠李糖乳杆菌微胶囊制备工艺的优化
根据单因素试验结果,以pH、壁材浓度、转速和鼠李糖乳杆菌添加量为影响因素,包埋率为指标设计L9(34)正交试验,因素水平如表1所示。
表1 正交试验因素水平表
Table 1 Factors and levels for orthogonal array design
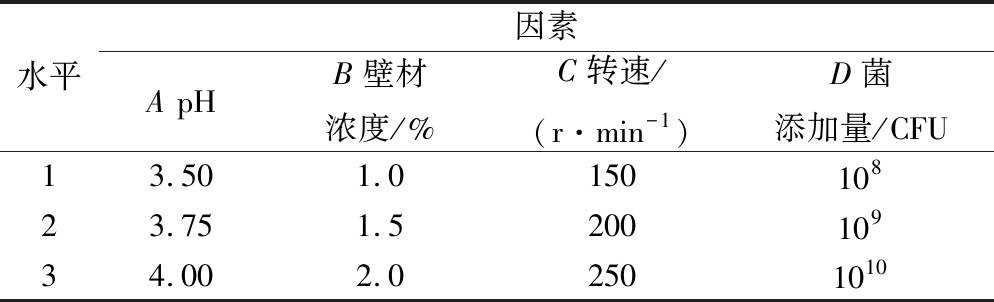
水平因素A pHB壁材浓度/%C转速/(r·min-1)D菌添加量/CFU13.501.015010823.751.520010934.002.02501010
1.3.5 鼠李糖乳杆菌微胶囊包埋率的测定
取1 mL湿囊于9 mL PBS中,37 ℃恒温振荡至完全溶解,用稀释梯度法涂布平板计数。微胶囊包埋率按公式(1)计算:
包埋率![]()
(1)
式中:N0,包埋前的原始活菌数;N,溶解后微胶囊中包埋的活菌数。
1.3.6 鼠李糖乳杆菌微胶囊湿囊粒径的测量
玻璃棒蘸取少量微胶囊涂于载玻片,盖上盖玻片。采用赛克显微镜自带图像采集系统拍照并使用自带软件S-EYE测量单个微胶囊的粒径,统计100个以上微胶囊的粒径,计算其平均粒径。
1.3.7 鼠李糖乳杆菌微胶囊的干燥
真空冷冻干燥:将上述复凝聚法最优工艺制备的湿微胶囊置于玻璃平皿中,在-20 ℃下预冻8 h,将其放入真空冷冻干燥机进行真空冷冻干燥(-60 ℃,48 h)。
喷雾干燥:将湿胶囊和一定体积的无菌水配成悬浮液进行喷雾干燥,参数为进风温度170 ℃,进料流量9 mL/min,进料浓度30%,出料温度约为80 ℃。在喷雾干燥期间,所有实验中参数保持恒定。
1.3.8 微胶囊扫描电子显微镜观察及含水率的测定
扫描电镜观察:取少量微胶囊粉末黏于导电双面胶表面,多余的粉末用吸耳球吹去,喷金处理90 s,将样品通过扫描电子显微镜获取图像,加速电压为15 kV。
含水率测定:参考GB5009. 3—2016《食品中水分的测定》直接干燥法[19]。
1.3.9 鼠李糖乳杆菌微胶囊贮藏性的测定
不同水分活度微胶囊的贮藏性:将鼠李糖乳杆菌微胶囊在常温下分别置于盛有饱和氯化锂、饱和氯化镁、饱和硝酸镁以及饱和氯化钠溶液的干燥器中,使其分别处于水分活度(water activity,aw)为 0.11、0.33、0.53、0.75[20]环境中保存4周,每隔1周计算活菌数。
不同温度微胶囊的贮藏性:将鼠李糖乳杆菌微胶囊分别置于25 ℃(常温)、4 ℃(冷藏)、-18 ℃(冷冻)条件下保存4周,每隔1周计算活菌数。
活菌数测定:每次取0.1 g微胶囊干粉置于10 mL 无菌PBS中,37 ℃恒温振荡至完全溶解,用稀释梯度法涂布平板计数。
利用GE两性电解质的特点,2种高分子电解质GE和GA溶于水后,调节溶液pH可使GE带上正电荷,与带负电荷的GA结合产生凝聚相。因此复凝聚法制备微胶囊的必要条件是调节溶液pH至GE的等电点以下。由图1可知,pH对复凝聚反应影响明显。凝聚体系pH为3.25和4.25时,包埋率都低于10%;pH 3.25时包埋率近于0,且微胶囊过于黏连无法测量粒径。此条件下溶液酸浓度过大,不利于鼠李糖乳杆菌生存,且复凝聚工艺时间长,长时间处于不良生存环境导致鼠李糖乳杆菌存活率近于0,并且pH 3.25体系中GE带正电荷多,形成的微胶囊相互黏连,可能也是包埋率低的原因。当pH为3.75时,平均粒径最大(65.31 μm)、包埋率最高(89.83%)。当复凝聚体系pH>3.75时,微胶囊平均粒径随pH增大而减小,包埋率也随之降低。pH 4.25接近GE等电点,包埋率为6.87%,大多数的菌没有被包埋。一方面是微胶囊粒径太小(34.89 μm);另一方面是所带正电荷较少,可能由于乳酸菌的弱负电性很难跟GE和GA共同组成微胶囊。因此复凝聚法制备鼠李糖乳杆菌微胶囊的合适pH为3.50~4.00。

图1 pH对微胶囊包埋率和粒径的影响
Fig.1 Effect of pH on microencapsulation efficiency and average diameter
由图2可知,壁材浓度对微胶囊包埋率和粒径有较大影响。随壁材浓度增加,平均粒径随之减小,包埋率先升高后降低。当壁材浓度为0.5%时,包埋率为42.67%,此时粒径最大69.78 μm。壁材浓度增大,复凝聚体系黏度逐渐增加,当壁材浓度为1.5%时,包埋率最高,为81.67%,此时平均粒径为56.24 μm。大于1.5%时,微胶囊开始黏连,且形状不规则;壁材浓度增至3.0%时,包埋率降至25%,无一圆整微胶囊,无法计算粒径。BURGESS等[21]认为复凝聚体系的黏度越大,微胶囊的结构越稳定。当壁材浓度较低(<1%)时,形成的微胶囊粒径大且壁薄,微胶囊不稳定,芯材易溢出,包埋率低;当壁材浓度增大时,黏度增大,微胶囊结构趋于稳定,当大于2.0%时,微胶囊的形状不规则,黏连在一起,机械分散困难,大量的壁材和芯材被凝滞在体系底部,包埋率迅速降低。因此适宜的壁材浓度为1.0%~2.0%。

图2 壁材浓度对微胶囊包埋率和形态的影响
Fig.2 Effect of wall material concentration on microencap- sulation efficiency and morphology
电动搅拌器的转速对复凝聚反应有一定的影响。由图3可知,随转速增大,粒径越小;且转速越低,标准偏差越大,粒径分布越不均匀。复凝聚法产生微胶囊的粒径由分散时液滴的粒径决定,而分散的液滴大小由搅拌速度(转速)控制,因此机械分散好,形成的微胶囊泡沫少且大小均一,复凝聚体系稳定[22]。当转速较低(100 r/min)时,包埋率为57.00%,粒径最大85.16 μm。此条件下GE与GA、壁材与芯材不能反应完全,复凝聚效果差,包埋率低。随转速增大,包埋率先升高后降低,粒径随之减少。转速为200 r/min时,包埋率达到最大81.67%。当转速为500 r/min时,包埋率降低至33.46%,原因可能为:一是此条件下的微胶囊体积太小,芯材装载量小,导致包埋率低;二是转速越大,导致复凝聚体系中泡沫增多从而凝聚物减少,降低包埋率。因此合适的转速为100~300 r/min左右。
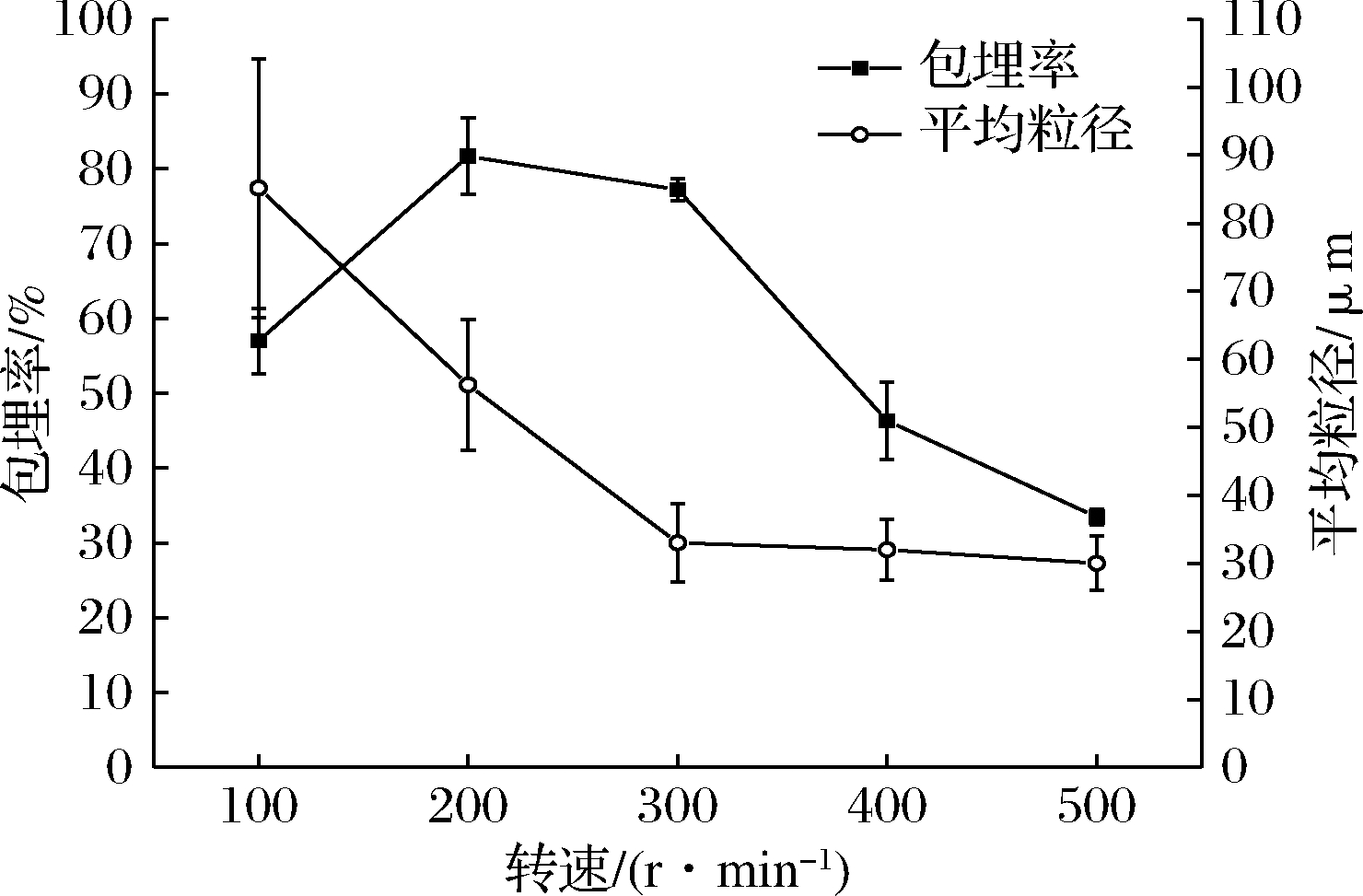
图3 转速对微胶囊包埋率和平均粒径的影响
Fig.3 Effect of stirring speed on microencapsulation efficiency and average diameter
菌添加量对微胶囊的形态和粒径没有太大的影响。由图4可知,当菌添加量较低时(106、107 CFU),在壁材浓度和总量不变的条件下,芯材较少,微胶囊包埋效果好,包埋率稳定在80%~90%,然而壁材利用率低,造成浪费。当菌添加量为1010 CFU时,包埋率下降至38.52%,此时壁材的包埋能力达到极限,多余的芯材不能被包埋。综合考虑,适宜的菌添加量为108~1010 CFU。

图4 菌添加量对微胶囊包埋率的影响
Fig.4 Effect of the added number of probiotics on microencapsulation efficiency
由表2可知,影响复凝聚法制备鼠李糖乳杆菌微胶囊的主次因素为A(pH)> D(菌添加量) >B(壁材浓度)>C(转速),最佳工艺条件组合为A2B2C2D1,即pH 3.75、壁材浓度1.5%、转速200 r/min、菌添加量108CFU。
表2 复凝聚法制备鼠李糖乳杆菌微胶囊正交试验
Table 2 Results of orthogonal test for L. rhamnosus GG microcapsules by complex coacervation

试验号A pHB壁材浓度/%C转速/(r·min-1)D菌添加量/CFU包埋率/%1111157.002122281.673133341.214212342.895223189.716231273.527313233.768321324.199332143.35k159.96044.55051.57063.353k268.70765.19055.97062.983k333.76752.69354.89336.097R34.94020.6404.40027.256
表中D1和D2的k值分别为63.353和62.983,相差较小,考虑到壁材利用率,菌添加量取D2,故最佳工艺条件为pH 3.75、壁材浓度1.5%、转速200 r/min、菌添加量109 CFU。进行验证实验,包埋率为(93.21±3.65)%,证实了最优实验的可行性。
将在最优条件下制备的湿微胶囊进行喷雾干燥和真空冷冻干燥。喷雾干燥微胶囊的扫描电镜图(图5-a)中,微胶囊粒径约15 μm,形状不规则,表面褶皱且凹陷较深,这是由于湿微胶囊在喷雾干燥过程中,微胶囊迅速脱水从而产生凹陷及褶皱,但微胶囊囊壁完整无裂痕。喷雾干燥后的微胶囊外观为白色,粉质细腻,分散性较好,含水率3.48%。

图5 喷雾干燥微胶囊(a)和真空冷冻干燥微胶囊(b)的微观形态和和宏观形态
Fig.5 Microscopic and macroscopic morphology of spray dried(a) and vacuum freeze dried(b) microcapsules
如图5-b所示,真空冷冻干燥微胶囊粒径约25 μm,比喷雾干燥的粒径大,这是因为喷雾干燥过程的高温导致微胶囊脱水程度大,而真空冷冻干燥相对温和;图5-b中微胶囊有些连结,大部分微胶囊呈不规则形状,但表面少有凹陷且光滑平整。真空冷冻干燥微胶囊呈絮状连结在一起,颜色稍黄,含水率2.75%。ALBADRAN等[23]报道益生菌微胶囊含水量小于10%时,有利于提高贮藏稳定性。2种方式干燥得到的微胶囊结构完整、无芯材溢出,且含水率低,说明复凝聚法制备的微胶囊在喷雾干燥和真空冷冻干燥后可很好地保护芯材。
第0周的活菌数为湿胶囊经喷雾干燥和真空冷冻干燥后的活菌数(表3、表4),由此可知,每克真空冷冻干燥微胶囊活菌数比喷雾干燥微胶囊高1.9个对数值。这可能是由于鼠李糖乳杆菌微胶囊在真空冷冻干燥时的条件相对温和,而在喷雾干燥时脱水和升温过程较快,使菌体在短时间内受到脱水胁迫、热胁迫、氧化胁迫等从而导致细胞膜等细胞结构受损[24],最终菌体死亡较多。在储藏期间,2种微胶囊在不同水分活度条件下的活菌数有不同程度的降低,并从第1周起,随水分活度升高,活菌数显著降低(P<0.05)。
每克喷雾干燥微胶囊在较低aw(0.11)下,活菌数第2周开始显著下降(P<0.05),4周内下降1.2个对数值,而真空冷冻干燥微胶囊第1周开始显著下降(P<0.05),4周内下降3.0个对数值,说明喷雾干燥微胶囊在较低aw时能保存较好的活性。
表3 不同环境对喷雾干燥微胶囊储藏稳定性的影响
Table 3 Effect of different conditions on the viability of spray dried microcapsules during storage

时间/周不同水分活度条件下的活菌数(lg CFU/mL)不同温度条件下的活菌数(lg CFU/mL)0.110.330.530.75常温4 ℃-18 ℃08.526±0.069aA8.526±0.069aA8.526±0.069aA8.526±0.069aA8.526±0.069aA8.526±0.069aA8.526±0.069aA18.468±0.018aA5.565±0.124bB5.632±0.216bB4.534±0.168cC8.279±0.016bA8.550±0.043aA8.865±0.499aA27.826±0.023bA4.866±0.373bC5.694±0.187bB4.962±0.165bC7.648±0.021cB8.485±0.076aA8.491±0.040aA37.462±0.021cA5.457±0.206bB3.604±0.027cC0.000±0.000dD7.679±0.016cB8.292±0.163aA8.497±0.165aA47.304±0.069dA2.426±0.566cB0.000±0.000dC0.000±0.000dC7.263±0.165dB7.254±0.110bB8.397±0.036aA
注:不同小写字母表示同一列差异显著(P<0.05),不同大写字母表示同一行差异显著(P<0.05)(下同)
表4 不同环境对真空冷冻干燥微胶囊储藏稳定性的影响
Table 4 Effect of different conditions on the viability of vacuum freeze dried microcapsules during storage

时间/周不同水活度条件下的活菌数(lg CFU/mL)不同温度条件下的活菌数(lg CFU/mL)0.110.330.530.75常温4 ℃-18 ℃010.457±0.059aA10.457±0.059aA10.457±0.059aA10.457±0.059aA10.457±0.059aA10.457±0.059abA10.457±0.059aA19.490±0.018bA7.856±0.140bB7.559±0.320bB6.027±0.388bC10.460±0.764aA10.799±0.285aA10.829±0.328aA28.314±0.119cA6.808±0.055cB5.068±0.074cC4.812±0.692cC9.419±0.151aA10.124±0.855abA10.510±0.395aA38.128±0.245cA5.332±0.043dB4.406±0.036dC2.279±0.365dD9.789±0.320aA9.880±0.243abA10.588±0.542aA47.489±0.059dA4.498±0.083eB4.479±0.299dB0.000±0.000eC9.473±0.344aB9.643±0.115bB10.743±0.376aA
原因可能是喷雾干燥微胶囊表面结构凹陷和皱缩且尺寸小,因而囊壁更厚,可减少氧的迫害(例如氧会加速细胞膜的脂质氧化),从而对菌体有较强的保护。高aw(0.75)喷雾干燥微胶囊在第3周失去活性,原因可能是喷雾干燥后存活菌体的受损程度比真空冷冻干燥的大,在高aw条件下,细胞膜在贮藏期间的被动渗透性较高[23],导致喷雾干燥微胶囊在短时间内全部失活。值得注意的是,第2周在aw为0.53的条件下,喷雾干燥微胶囊活菌数未下降,aw为0.75,第2周活菌数呈显著增长(P<0.05),这可能是鼠李糖乳杆菌在利用环境中的水分和养分(明胶为蛋白质,提供氮源;阿拉伯胶为多糖,提供碳源)从而实现了少量的增殖。与之相比,真空冷冻干燥微胶囊在高aw条件下,活菌数同样有所降低,但下降缓慢,在第4周时aw 0.75下微胶囊中的鼠李糖乳杆菌全部失活,在aw 0.53时仍能保持每克4.5个对数值的活性。
表3、表4中不同温度条件下的喷雾干燥和真空冷冻干燥微胶囊都保持了较稳定的活性。常温下,喷雾干燥微胶囊第4周时每克下降了1.3个对数值,真空冷冻干燥微胶囊下降了1个对数值;4 ℃条件下2种微胶囊在第4周时都开始明显下降(P<0.05),喷雾干燥微胶囊在第4周时每克下降了1.3个对数值,真空冷冻干燥微胶囊下降了0.8个对数值;-18 ℃条件下4周内的活菌数都没有显著差异(P>0.05),此温度下微胶囊储藏性最稳定。微胶囊在低温低水活度环境下能较长时间地保护鼠李糖乳杆菌,而真空冷冻干燥微胶囊体现了更好的储藏性。
本研究通过复凝聚法制备了鼠李糖乳杆菌微胶囊,并研究了pH、壁材浓度、转速和菌添加量对包埋率的影响,在此基础上采用正交试验优化了鼠李糖乳杆菌微胶囊的制备工艺,结果表明,鼠李糖乳杆菌微胶囊的复凝聚最佳工艺为:pH 3.75、壁材浓度1.5%、转速200 r/min、菌添加量109 CFU,此条件下的包埋率为93.21%。
考察复凝聚法制备的鼠李糖乳杆菌湿微胶囊干燥后的性质,结果显示每克真空冷冻干燥微胶囊的活菌数高于喷雾干燥微胶囊;储藏性实验表明干燥微胶囊在低温低水活度环境下能较长时间地保护鼠李糖乳杆菌,真空冷冻干燥微胶囊更具优势。
[1] FAO/WHO. Evaluation of health and nutritional properties of probiotics in food including powder milk and live lactic acid bacteria[R]. Argentina: FAO/WHO, 2001.
[2] QUIGLEY E M M. Prebiotics and probiotics in digestive health[J].Clinical Gastroenterology and Hepatology, 2019,17(2):333-344.
[3] ESPITIA P J P, BATISTA R A, AZAREDO H M C, et al. Probiotics and their potential applications in active edible films and coatings[J].Food Research International, 2016,90:42-52.
[4] TERPOU A, BEKATOROU A, KANELLAKI M, et al. Enhanced probiotic viability and aromatic profile of yogurts produced using wheat bran (Triticum aestivum) as cell immobilization carrier[J]. Process Biochemistry, 2017,55:1-10.
[5] 张灿, 吴彩娥, 范龚健, 等. 植物蛋白微胶囊对益生菌包埋的研究进展[J].食品工业科技, 2017,38(5):385-389.
[6] WU L, QIN W, HE Y, et al. Material distributions and functional structures in probiotic microcapsules[J].European Journal of Pharmaceutical Sciences, 2018,122:1-8.
[7] DE PRISCO A, MAURIELLO G. Probiotication of foods: A focus on microencapsulation tool[J].Trends in Food Science & Technology, 2016, 48:27-39.
[8] MARTIN M J, LARA-VILLOSLADA F, RUIZ M A, et al. Microencapsulation of bacteria: A review of different technologies and their impact on the probiotic effects[J].Innovative Food Science & Emerging Technologies, 2015,27:15-25.
[9] 田文静, 朱莹丹, 岳林芳, 等. 益生菌微胶囊化研究现状[J].中国食品学报, 2016,16(8):186-194.
[10] RAMOS P E, ABRUNHOSA L, PINHEIRO A, et al. Probiotic-loaded microcapsule system for human in situ folate production: Encapsulation and system validation[J].Food Research International, 2016,90:25-32.
[11] AREPALLY D, GOSWAMI T K. Effect of inlet air temperature and gum Arabic concentration on encapsulation of probiotics by spray drying[J].LWT-Food Science and Technology, 2019,99:583-593.
[12] EGHBAL N, CHOUDHARY R. Complex coacervation: Encapsulation and controlled release of active agents in food systems[J]. LWT-Food Science and Technology, 2018,90:254-264.
[13] ERATTE D, DOWLING K, BARROW C J, et al. Recent advances in the microencapsulation of omega-3 oil and probiotic bacteria through complex coacervation: A review[J].Trends in Food Science & Technology, 2018,71:121-131.
[14] TIMILSENA Y P, AKANBI T O, KHALID N, et al. Complex coacervation: Principles, mechanisms and applications in microencapsulation[J].International Journal of Biological Macromolecules, 2019,121:1 276-1 286.
[15] 贺红军, 李宜春, 张雪婷, 等. 微胶囊法提高益生菌抗逆性的研究[J].食品工业, 2017,38(2):188-193.
[16] DA SILVA T M, DE DEUS C, DE SOUZA FONSECA B, et al. The effect of enzymatic crosslinking on the viability of probiotic bacteria (Lactobacillus acidophilus) encapsulated by complex coacervation[J].Food Research International, 2019, 125:108 577.
[17] 朱晓丽, 顾相伶, 张志国, 等. 单凝聚与复凝聚法制备昆虫激素十二醇微胶囊及其释放行为[J].高分子学报, 2007(5):491-496.
[18] 郭阳, 包怡红, 赵楠. 复凝聚法制备松籽油微胶囊工艺优化及其氧化稳定性分析[J].食品科学, 2017, 38(18):229-236.
[19] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准食品中水分的测定:GB 5009.3—2016 [S].北京:中国标准出版社,2016.
[20] 严维凌, 赵俊虹. 食品水分活度测量不确定度的评定方法[J].食品与机械, 2009, 25(6):117-120.
[21] BURGESS D J, CARLESS J E. Microelectrophoretic studies of gelatin and acacia for the prediction of complex coacervation[J]. Journal of Colloid & Interface Science, 1984, 98(1):1-8.
[22] 李瑾, 郑明学, 钱锐, 等. 影响复凝聚法制备明胶缓释微囊的因素探讨[J].中国畜牧兽医, 2009,36(6):207-209.
[23] ALBADRAN H A, CHATZIFRAGKOU A, KHUTORYANSKIY V V, et al. Stability of probiotic Lactobacillus plantarum in dry microcapsules under accelerated storage conditions[J].Food Research International, 2015, 74:208-216.
[24] 刘斌. 喷雾干燥过程中益生菌菌活变化与细胞膜损伤历程研究[D].苏州:苏州大学,2017.