花青素是对人体健康有益的一种活性成分[1],具有抗氧化、抗辐射、抗炎、防衰老和降血脂等功效,在食品工业中有广阔的应用前景。花青素一般来源于颜色鲜艳的蔬菜或水果。一些浆果类植物也是花青素的良好来源,特别是黑枸杞,被称为花青素之王[2]。由于花青素的稳定性较差,导致在食品中的应用具有一定的局限性。花青素的稳定性受多种环境因素影响,如pH、光照、温度、氧和酶活性[3]。如何提高花青素在加工和贮藏过程中的稳定性,成为其在食品工业中应用的一项挑战。
目前提高花青素稳定性的方法有包封法、乳化法和冷冻干燥法。包封法是提高花青素稳定性的先进技术,其中最常用的封装技术是微胶囊化。微胶囊化是提高生物活性物质的利用度和稳定性、控制活性物质释放的有效途径[4]。微胶囊化的主要目的是保护核心材料不受环境影响,从而提高产品的货架期,促进核心材料的可控释放。微胶囊化技术有多种类型,如振动喷嘴、离心挤出、喷雾干燥和共结晶[5]等。喷雾干燥由于具有连续性好、成本低、时间短等优点,是目前最常用的微胶囊制备技术[6]。
喷雾干燥制备微胶囊的关键是壁材的选择,常用的壁材有明胶、麦芽糊精、阿拉伯树胶和淀粉[7]等。明胶是一种具有良好兼容性、易溶于水和易成膜等优点的水解蛋白。将淀粉作为微胶囊壁材具有价格低廉、来源广泛、可食用等优点。然而天然淀粉不溶于冷水,遇水加热后形成高黏度的糊状结构,会降低喷雾干燥效率,增加表面裂纹。限制了其在喷雾干燥法制备微胶囊中的应用。这些限制可以通过天然淀粉的改性来克服,但是将改性淀粉作为包封各种生物活性物质的壁材[8]的研究较少。复合壁材比单一壁材更能保护生物活性物质,提高其稳定性。通过实验室前期的壁材筛选,本研究以黑枸杞花青素为原料,采用改性淀粉和明胶作为复合壁材,经喷雾干燥法制备黑枸杞花青素微胶囊,同时以包埋率、DPPH清除活性、花青素含量和水分活度为评价指标对微胶囊喷雾干燥工艺进行了优化和验证,并对微胶囊化粉末的红外光谱、X射线衍射、热性能和形貌进行了研究分析。旨在通过微胶囊技术改善花青素稳定性,为花青素在食品工业中的应用提供基础数据和理论参考。
1 材料与方法
1.1 材料与试剂
黑枸杞花青素,青海秦仁堂商贸有限公司;糯米淀粉,重庆沁心食品有限公司;明胶,成都科龙化工试剂厂;DPPH,上海伊卡生物技术有限公司;盐酸、无水乙醇、正丁醇、NaHCO3、冰乙酸、甲醇、KCl、醋酸钠,均为分析纯。
1.2 仪器与设备
GP-P2000 喷雾干燥仪,上海顾信生物科技有限公司;X′Pert3 Powder X射线衍射,荷兰帕纳特公司;Phenom Pro 扫描电镜,Phenom World 公司;721G 紫外分光光度计,上海仪电分析仪器有限公司;Spectrun100 傅里叶红外光谱仪、DSC4000差示扫描量热仪,美国PerkinElmer公司。
1.3 实验方法
1.3.1 微胶囊的制备
1.3.1.1 改性淀粉的制备
根据DAS等[9]方法,对天然糯米淀粉进行改性。称取25 g糯米淀粉加入100 mL 正丁醇中,加入1 mL HCl(质量分数36%),在磁力搅拌器中于30 ℃条件下搅拌2 h。加入14 mL 1 mol/L NaHCO3终止反应,冰浴冷却15 min。5 000 r/min离心5 min,用体积分数50%乙醇洗涤沉淀4次,可脱除游离的正丁醇及NaCl,45 ℃干燥备用。
1.3.1.2 微胶囊的制备及工艺优化
以改性淀粉和明胶为壁材,黑枸杞花青素为芯材,对花青素提取物进行微胶囊化。在水中制备不同质量浓度(40~80 g/L)的壁材[m(改性淀粉)∶m(明胶)=2∶1]分散体,加入黑枸杞花青素[m(芯材)∶m(壁材)=1∶20],采用喷雾干燥机对花青素提取物进行包封。喷雾干燥时,入口空气温度为140~180 ℃,进样泵速为6%~14%。对微胶囊的制备工艺进行优化,优化试验的因素水平如表1所示。
表1 因素水平编码表
Table 1 Factor level coding table
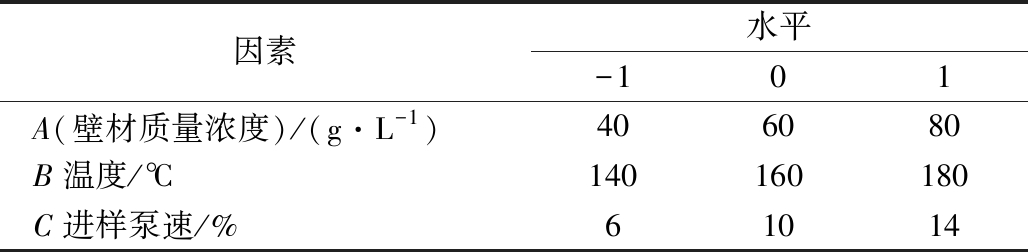
因素水平-101A(壁材质量浓度)/(g·L-1)406080B温度/℃140160180C进样泵速/%61014
1.3.2 包埋率测定
采用MAHDAVI等[7]描述的方法测定微胶囊的包埋率,计算如公式(1):
包埋率![]()
(1)
式中:TAC,总花青素含量,mg/L;SAC,表面花色苷含量,mg/L。
总花色苷(TAC)提取:1 mL蒸馏水加到100 mg样品研碎,加入10 mL乙醇提取5 min。20 ℃,5 000 r/min离心3 min,上清液用0.45 μm滤膜过滤测花色苷。
表面花色苷(SAC)提取:称取100 mg样品,加入10 mL乙醇漩涡10 s。20 ℃,5 000 r/min离心3 min,上清液用0.45 μm滤膜过滤测花色苷。
1.3.3 DPPH清除活性
称取30 mg微胶囊溶解于3 mL V(乙醇)∶V(乙酸)∶V(水)=50∶8∶42溶液中,混合物用0.45 μm的滤膜过滤,取上清液并用甲醇稀释,取200 μL滤液加入3.8 mL DPPH的甲醇溶液(6×10-5 mol/L),30 ℃保温避光静置40 min,在517 nm下测定吸光度。并做空白试验。根据公式(2)计算DPPH清除率[10]。
DPPH清除率![]()
(2)
式中:A0,空白吸光度;As,样品吸光度。
1.3.4 花青素含量测定
花青素含量用差示法进行测量,用KCl和CH3COONa分别配制成pH1.0和pH4.5的缓冲溶液,将待测液用乙醇定容至10 mL,缓冲液稀释10倍,分别于520 nm和700 nm下测吸光度。花色苷含量的计算见公式(3):
花青素含量/(mg·L-1)=
(3)
式中:MW,分子量,449.2 g/mol;DF,稀释倍数;ε,消光系数,26 900 L/(mol·cm);L,比色皿距离,1 cm。
1.3.5 水分活度
用水分活度计测量水分活度。测定条件:温度为20 ℃,时间为10 min。
1.3.6 黑枸杞花青素微胶囊理化性质分析
1.3.6.1 红外分析
分别称取2 mg黑枸杞花青素、改性淀粉、明胶、花青素微胶囊,加入100 mg溴化钾(105 ℃烘干)研磨压片,使用傅里叶红外光谱仪进行扫描并进行红外光谱分析。扫描范围4 000~400 cm-1,光谱分辨率1 cm-1,扫描次数32次。
1.3.6.2 X射线衍射
将2 g左右改性淀粉、明胶、微胶囊进行压片,用X射线衍射仪进行结构分析。扫描条件:扫描范围5~50°(2θ),扫描速率2 °/min。
1.3.6.3 微胶囊形貌
在样品架上贴一层导电胶带,将微胶囊均匀平铺在导电胶带上,喷洒一层薄金后用扫描电镜观察微胶囊的微观形貌。测量条件:电压15 KV,放大倍数10 000倍。
1.3.6.4 DSC测定
在铝坩埚中分别称取2~5 g左右改性淀粉、明胶、微胶囊,压片后用差示扫描量热仪进行测定。测定条件:测定范围30~250 ℃,升温速率为10 ℃/min。
2 结果与分析
2.1 响应面实验结果
2.1.1 二次回归模型及方差分析
采用响应面Box-Behnken Design对微胶囊进行优化,黑枸杞花青素微胶囊的实验设计及结果见表2。
表2 花青素微胶囊化实验设计
Table 2 Experimental design of anthocyanin microencapsulation

序列因素评价指标壁材浓度/(g·L-1)温度/℃进样泵速/%包埋率/%DPPH清除率/%花青素含量/(mg·L-1)水分活度1601401489.742.2661.470.54280160691.443.6256.010.463401601490.143.2960.620.534601601092.746.0162.970.50560180691.639.9455.920.476401401090.844.0760.940.537601601092.046.4964.440.528601601092.345.7762.120.499801601485.139.8057.940.5310601601093.445.2764.270.521140160692.143.9361.760.5012601601092.447.3964.680.52
续表2

序列因素评价指标壁材浓度/(g·L-1)温度/℃进样泵速/%包埋率/%DPPH清除率/%花青素含量/(mg·L-1)水分活度13801801086.238.7650.790.4814801401088.142.3657.120.511560140691.143.7361.470.5016401801089.840.7154.780.5117601801489.140.6256.240.53
采用BBD研究了壁材浓度、温度、进样泵速对花青素包埋率、花青素含量、DPPH清除活性、水分活度的影响。研究结果拟合得到二阶多项式方程的相关系数(R2)和修正相关系数![]() 并对模型系数进行方差分析。微胶囊包埋率、花青素含量、DPPH清除活性、水分活度的二次回归方程如下所示:
并对模型系数进行方差分析。微胶囊包埋率、花青素含量、DPPH清除活性、水分活度的二次回归方程如下所示:
包埋率![]()
DPPH清除率![]()
花青素含量![]()
水分活度![]()
从表3可以看出包埋率、DPPH清除活性、花青素含量、水分活度的二次回归模型显著(0.001 2, 0.000 6, <0.000 1, 0.008 2),失拟项不显著(0.104 7, 0.472 0, 0.943 0, 0.987 1),R2分别为0.945 5、0.956 6、0.978 8、0.902 3。证明二次回归方程可以较好的拟合壁材浓度、温度、进样泵速与微胶囊包埋率、花青素含量、DPPH清除活性、水分活度之间的关系。所以这4个二次回归模型可以用来预测花青素微胶囊的包埋率、花青素含量、DPPH清除活性和水分活度。
表3 拟合二次多项式模型的方差分析
Table 3 Analysis of variance of fitting quadratic polynomial model

项目包埋率DPPH清除率花青素含量水分活度模型0.001 2∗∗0.000 6∗∗<0.000 1∗∗0.008 2∗∗A-壁材浓度0.001 2∗∗0.013 7∗0.000 3∗∗0.022∗B-温度0.2310.001∗∗<0.000 1∗∗0.022∗C-进样泵速0.001 1∗∗0.055 10.665 70.000 3∗∗AB0.595 20.8860.924 90.659 1AC0.032 5∗0.089 60.121 20.108BC0.518 20.224 80.859 40.387 6A20.000 7∗∗0.002 2∗∗<0.000 1∗∗0.501 4B20.005 3∗∗0.000 2∗∗<0.000 1∗∗0.82C20.161 10.003 7∗∗0.078 60.82失拟项0.104 70.472 00.943 00.987 1R20.945 50.956 60.978 80.902 3R2Adj0.875 50.900 90.951 70.776 8
注:*表示差异显著(0.01<P<0.05),**表示差异极显著(P<0.01)
2.1.2 各因子间交互作用对响应值的影响
图1-a,图1-b描述了黑枸杞花青素微胶囊化过程中的制备参数与包埋率之间的关系。随着进气温度的升高,包埋率先升高后下降。喷雾干燥过程中,随着入口空气温度的升高,雾滴的干燥速度加快,快速形成外壳,包裹花青素并防止花青素浸出和渗透到液滴中。而随着温度持续升高,高温致使外壳爆裂,包裹住的花青素重新裸露在空气中,包埋率降低。随着壁材浓度的增加,花青素有更大的机会被壁材包裹,但过高的壁材浓度反而会降低微胶囊的包埋率。芯材的保留率在很大程度上取决于初始溶液的黏度。随着固体浓度的增加,黏度也随着增加,最终导致颗粒开裂,增加花青素从核向壁的扩散。
图1-c,图1-e描述了温度、壁材浓度的变化对花青素含量、DPPH清除率的影响。由于黑枸杞花青素是热敏性物质,所以当出口温度增加时花青素含量下降,DPPH清除率降低。壁材浓度的增加会导致溶液黏度的增加,限制了内部的流动和循环,致使花青素含量和DPPH清除率均增加。但当壁材浓度较高时,由于颗粒的开裂,部分花青素从核心转移到表面,造成花青素降解,并致使花青素含量和DPPH清除率均降低。而图1-d,图1-f中,随着进样速度增加,花青素在高温下会经历更短的时间,更大程度地避免了花青素的降解,所以花青素含量和DPPH都有所升高。而当进样泵速的过度加快,雾化后的雾滴增多,水分无法快速蒸发,不能很好的形成微胶囊,降低了微胶囊中花青素的保留率和DPPH的清除活性。

图1 壁材浓度、温度、进样泵速对花青素微胶囊的影响
Fig.1 Effect of wall material concentration, temperature and injection pump speed on anthocyanin microcapsules
图1-g,图1-h描述了黑枸杞花青素微胶囊制备工艺参数的变化对水分活度的影响。在高进口温度条件下,微胶囊化过程中的空气温度也随之增加,干燥加快,水分活度降低。溶液中固形物含量越多,总水分越少,颗粒的水分活度越低。进样泵速提高,雾化后的雾滴增多,并且颗粒在干燥室内的停留时间缩短,从而提高了微胶囊颗粒的水分活度。
2.1.3 优化与验证
本次实验的目的是找出微胶囊化喷雾干燥的最优参数,得到包埋率高、花青素含量高、DPPH清除活性高和低水分活度的微胶囊粉末。从而在优化过程中设定目标,达到最大包埋率、最大花青素含量、最高DPPH清除活性和最小的水分活度。根据优化分析后,最优工艺条件为:壁材浓度61.4 g/L、温度157.03 ℃、进样泵速6.10%,优化预测值为包埋率93.4%、DPPH清除率45.45%、花青素含量62.87 mg/L、水分活度0.49。Desirability值为0.824,接近1,证明有很好的可行性。考虑到实际操作的可行性,将最优工艺修正为:壁材浓度60 g/L、温度157 ℃、进样泵速6%。对修正参数进行3次重复测定,得到包埋率93.4%、DPPH清除率45.41%、花青素含量63.04、水分活度0.49,与预测值接近。
2.2 微胶囊红外光谱分析
黑枸杞花青素、改性淀粉、明胶和微胶囊的红外光谱如图2所示。
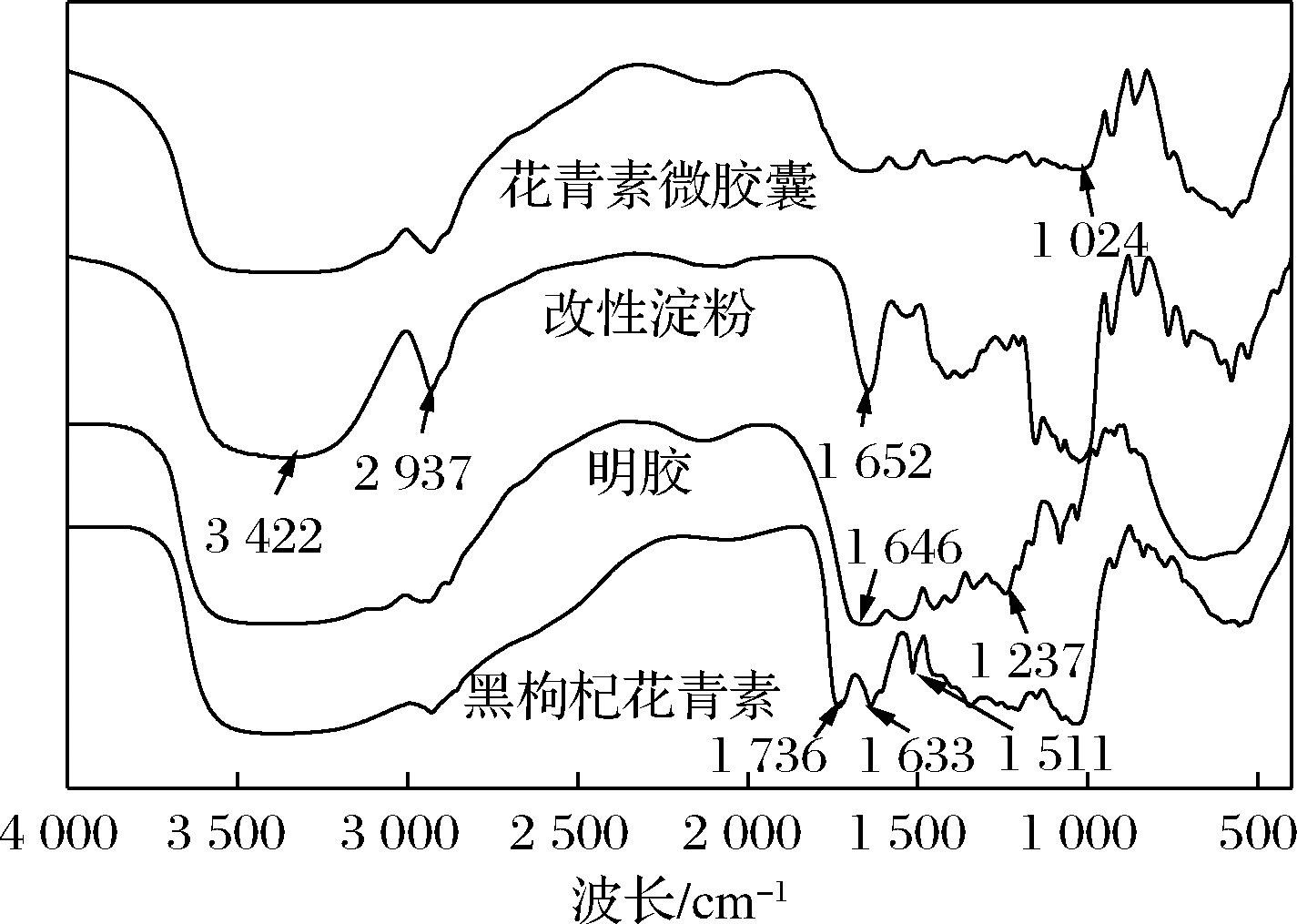
图2 花青素微胶囊红外光谱
Fig.2 Infrared spectrum of anthocyanin microcapsules
在800~1 500 cm-1(指纹图谱区)、1 500~2 000 cm-1(C—H拉伸区)和2 500~3 500 cm-1(O—H拉伸区)均有峰出现。在黑枸杞花青素的红外光谱中,1 736 cm-1密集带有可能是苯并吡喃环(C![]() O)的振动所引起的,而这属于花青素的骨架[11]。位于1 633 cm-1处对应苯环(C
O)的振动所引起的,而这属于花青素的骨架[11]。位于1 633 cm-1处对应苯环(C![]() C)的伸缩振动,1 511 cm-1的峰有可能是花青素中2个苯环的变形振动引起的。花青素粉末光谱中的这些峰是矢车菊素-3-葡萄糖苷和矢车菊-3-半乳糖苷的主要峰。1 024 cm-1的条带更多代表的是晶态样品,位于1 652 cm-1的主要峰也与C—C的拉伸有关,3 422 cm-1为OH的吸收带。在2 937 cm-1处有一个尖峰,这可能是由于C—H的拉伸振动引起的。明胶红外图谱中,1 646 cm-1处是酰胺Ⅰ,1 237 cm-1处是酰胺Ⅲ[12]。红外光谱法可通过比较芯材包埋前后在红外光谱区吸收的特征差异,来表征包埋物是否形成[13]。若形成包埋物,芯、壁材分子间的非共价键作用,如疏水作用、范德华力和氢键,其键能会减弱,相应基团的吸收强度会变小。由此来表征芯、壁材分子是否产生了包埋作用。花青素微胶囊红外图谱中花青素吸收峰强度有所减弱,这表明花青素进入了微胶囊内腔,证明包埋成功。
C)的伸缩振动,1 511 cm-1的峰有可能是花青素中2个苯环的变形振动引起的。花青素粉末光谱中的这些峰是矢车菊素-3-葡萄糖苷和矢车菊-3-半乳糖苷的主要峰。1 024 cm-1的条带更多代表的是晶态样品,位于1 652 cm-1的主要峰也与C—C的拉伸有关,3 422 cm-1为OH的吸收带。在2 937 cm-1处有一个尖峰,这可能是由于C—H的拉伸振动引起的。明胶红外图谱中,1 646 cm-1处是酰胺Ⅰ,1 237 cm-1处是酰胺Ⅲ[12]。红外光谱法可通过比较芯材包埋前后在红外光谱区吸收的特征差异,来表征包埋物是否形成[13]。若形成包埋物,芯、壁材分子间的非共价键作用,如疏水作用、范德华力和氢键,其键能会减弱,相应基团的吸收强度会变小。由此来表征芯、壁材分子是否产生了包埋作用。花青素微胶囊红外图谱中花青素吸收峰强度有所减弱,这表明花青素进入了微胶囊内腔,证明包埋成功。
2.3 微胶囊X射线衍射分析
图3是花青素微胶囊、改性淀粉、明胶的X射线衍射图。由改性淀粉的X射线衍射图可知,在15°附近观察到1个强衍射峰,这表明淀粉具有一定的结晶度,在17°和18°处存在1个双峰,23°有1个衍射峰,这些都是典型的淀粉衍射峰[14]。明胶的X射线衍射图可知,在8°和21°分别有1个衍射峰,这是明胶的典型衍射峰[15]。通过微胶囊的X射线衍射图可知,微囊化后淀粉峰和明胶峰都有一定程度的减弱或消失。因为糊化作用,微胶囊化粉末结晶度下降并表现出无定型性质。在20°观察到一个尖峰,这可能是由于形成了具有无定形结构的生物聚合物[16]。这个峰可能是花青素中的某些生物活性物质与直链淀粉或明胶形成的化合物[17-18]。除此之外,这个峰也有可能是喷雾干燥过程对花青素微胶囊的影响所致。
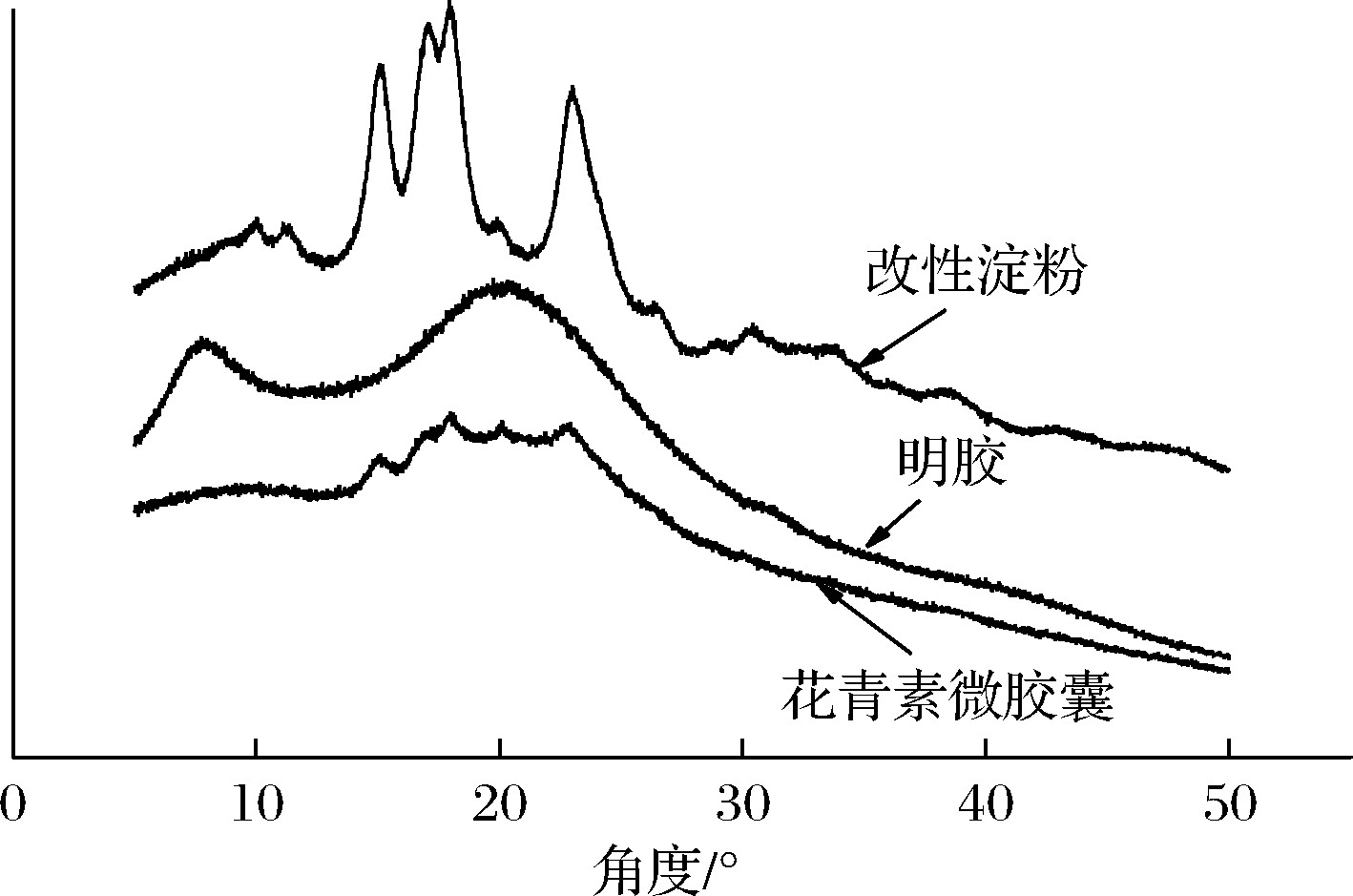
图3 X-射线衍射
Fig.3 X-ray diffraction
2.4 微胶囊形貌分析
对最佳喷雾干燥条件下得到的微胶囊化粉体进行了表面形貌观察,如图4所示。花青素是亲水性着色剂,特别适合与果胶、树胶等水基凝胶制剂和麦芽糊精、淀粉等作为极性固体基质的包覆材料相结合[7]。喷雾干燥后形成的花青素微胶囊为紫红色粉末(图4-a)。花青素微胶囊中未见颗粒聚集,呈现较多的圆球形微胶囊,表面均未发现裂纹或孔洞(图4-b)。KANAKDANDE等[19]建议微胶囊化粉末应呈微球形,壁面裂纹和孔洞最小,而黑枸杞花青素微胶囊与其建议的一致。粒径大约在2~20 μm左右。褶皱的壁是由喷雾干燥极具失水造成的,而较大颗粒的圆球形可能是多个改性淀粉颗粒共同被明胶包覆,形成了一层保护膜,对黑枸杞花青素起到了双层保护,更增加了花青素的稳定性。

a-微胶囊粉末;b-扫描电镜
图4 花青素微胶囊形貌
Fig.4 Anthocyanin microcapsule morphology
2.5 DSC分析
通过差示扫描量热法研究壁材和花青素微胶囊的热特性,并利用软件Trios对DSC曲线进行分析比较。由图5可知,黑枸杞花青素、改性淀粉、明胶和微胶囊热熔解的起始温度分别为67.26、88.71、94.51和98.71 ℃。花青素微胶囊化能够明显地改善天然花青素热熔解的起始温度,提高花青素的热稳定性。这是由于淀粉-酚类化合物-蛋白形成长链复合体,需要更高的温度才能打破,也可能是由于改性后的支链淀粉双螺旋比未水解支链淀粉分子长很多,双螺旋结构长度增加,稳定性也会随之增强。改性淀粉、明胶的吸热峰在133.40 ℃和123.88 ℃,花青素微胶囊在133.52 ℃处出现吸热峰。由于花青素微胶囊的热熔解温度较高,在食品工业中能够稳定存在,在常规的食品加工过程中不易受热而分解[20]。

图5 花青素微胶囊DSC分析
Fig.5 DSC analysis of anthocyanin microcapsules
热焓在一定程度上可以反映样品的稳定性。未包埋的花青素与微胶囊的热焓分别为183.16 J/g和274.03 J/g,微胶囊化后的热焓值显著提高,这说明其发生相变所需的热量变高,即黑枸杞花青素微胶囊的热稳定性较好。
3 结论
为获得最大包埋率、最大花青素含量、最高DPPH清除活性和最小水分活度的黑枸杞花青素微胶囊。最优工艺条件为:壁材浓度60 g/L、温度157 ℃、进样泵速6%。在此条件下的微胶囊包埋率为93.4%、DPPH清除率为45.41%、花青素含量为63.04 mg/L、水分活度为0.49。花青素微胶囊红外图谱中花青素吸收峰强度有所减弱,表明花青素进入了微胶囊内腔,证明包埋成功。微囊化后,微胶囊的X射线图谱并不是改性淀粉和明胶的简单相加,而是出现了新的衍射峰,形成了淀粉-花青素-蛋白的聚合体。微胶囊的形貌为圆球状,表面无孔洞和裂纹。热溶解的起始温度和峰值温度均有所增加,其热稳定性有所提高。
[1] MANDAVI S A,JAFARI S M,ASSADPOUR E,et al.Storage stability of encapsulated barberry′s anthocyanin and its application in jelly formulation[J].Journal of Food Engineering,2016,181,59-66.
[2] 杨萍,李哲.pH示差法测定黑枸杞花青素技术的研究[J].中国食品添加剂,2017(10):107-111.
[3] KUCK L S,WESOLOWSKI J L,ZAPATA NORENA C P.Effect of temperature and relative humidity on stability following simulated gastro-intestinal digestion of microcapsules of Bordo grape skin phenolic extract produced with different carrier agents[J].Food Chemistry,2017,230(2):57-64.
[4] HUANG Y,ZHOU W.Microencapsulation of anthocyanins through two-step emulsification and release characteristics during in vitro digestion[J].Food Chemistry,2019,278(3):57-63.
[5] ROBERT P,FREDES C.The encapsulation of anthocyanins from berry-type fruits.trends in foods[J]. Molecules,2015,20(4):5 875-5 888.
[6] SANTOS S S,RODRIGUES L M,COSTAL S C,et al.Antioxidant compounds from blackberry (Rubus fruticosus) pomace: Microencapsulation by spray-dryer and pH stability evaluation[J].Food Packaging and Shelf Life,2019,20:2 214-2 220.
[7] MAHDAVI S A,JAFARI S M,ASSADPOOR E,et al.Microencapsulation optimization of natural anthocyanins with maltodextrin,gum Arabic and gelatin[J].International Journal of Biological Macromolecules, 2016,85(3):79-85.
[8] HOYOS-LEYVA J D,BELLO-PEREZ L A,ALVAREZ-RAMIREZ J,et al. Microencapsulation using starch as wall material: A review[J].Food Reviews International,2018,34(2):148-161.
[9] DAS A B,GOUD V V,DAS C.Microencapsulation of anthocyanin extract from purple rice bran using modified rice starch and its effect on rice dough rheology[J].International Journal of Biological Macromolecules,2019,124(5):73-81.
[10] SANCHEZ M M,QUINTERO R A,AMAYA G C,et al.Effect of agave fructans as carrier on the encapsulation of blue corn anthocyanins by spray drying[J].Foods,2019,8(7):1-18.
[11] YANG F X,XU P,YANG J G,et al.Efficient separation and purification of anthocyanins from saskatoon berry by using low transition temperature mixtures[J].Rsc Advances,2016,6(106):104 582-104 590.
[12] 韩霜.大目金枪鱼皮明胶的提取过程及性质探究[D].重庆:西南大学,2017.
[13] 杨馥溪.深度共熔溶剂提取花青素及其抗氧化性能评估和微胶囊制备的研究[D].广州:华南理工大学,2017.
[14] ZHU L J,LIU Q Q,WILSON J D,et al.Digestibility and physicochemical properties of rice (Oryza sativa L.) flours and starches differing in amylose content[J].Carbohydrate Polymers,2011,86(4): 1 751-1 759.
[15] 陈丽.可食性狭鳕鱼皮明胶复合膜的制备、性质与应用研究[D].青岛:中国海洋大学,2009.
[16] KUMAR P,SENTHAMILSELVI S,GOVINDARAJU M.Phloroglucinol-encapsulated starch biopolymer: preparation, antioxidant and cytotoxic effects on HepG2 liver cancer cell lines[J].Rsc Advances,2014,4(51): 26 787-26 795.
[17] YANG L,ZHOU Y,WU Y,et al.Preparation and physicochemical properties of three types of modified glutinous rice starches[J].Carbohydrate Polymers,2016,137:305-313.
[18] REZAEI A,FATHI M,JAFARI S M.Nanoencapsulation of hydrophobic and low-soluble food bioactive compounds within different nanocarriers[J].Food Hydrocolloids,2019,88(1):46-62.
[19] KANAKDANDE D,BHOSALE R,SINGHAL R S.Stability of cumin oleoresin microencapsulated in different combination of gum arabic, maltodextrin and modified starch[J].Carbohydrate Polymers,2007,67(4): 536-541.
[20] 范方宇,常艳琼,董选刚,等.茶油微胶囊的性质[J].食品与发酵工业,2014,40(7):106-110.