牛蒡为菊科牛蒡属二年生草本植物[1],又名东洋参、大力子等,具有“蔬菜之王”的美称。牛蒡根中富含多糖、纤维素、胡萝卜素、多酚、钙、铁和氨基酸等成分,具有很高的营养价值[2]。研究表明,牛蒡多糖具有抗氧化、抗菌[3]、降血糖[4-5]、抑制癌细胞的生长[6]和增强机体的免疫功能等作用[7],故而引起了广泛关注,周浓等[8]优化了碱法提取牛蒡多糖工艺,并发现牛蒡多糖对![]() 和·OH均有较强的清除效果。贾小丽等[9]研究了牛蒡多糖热水回流提取的工艺条件,且牛蒡多糖清除·OH和
和·OH均有较强的清除效果。贾小丽等[9]研究了牛蒡多糖热水回流提取的工艺条件,且牛蒡多糖清除·OH和![]() 的IC50分别为3.99和1.03 mg/mL,此外也有报道采用酶法[10]、超声波提取法[11]、微波提取法[12]和高速剪切提取法[13]提取牛蒡多糖。但对于双水相提取技术用于牛蒡多糖的研究未见报道,双水相提取技术是利用物质在两相中不同的分配系数进行提取分离的方法,该技术条件温和、生物适应性广泛,因此可用于生物提取、天然产物分离等方面。刘晓飞等[14]探讨了超声波辅助(NH4)2SO4/PEG 6000双水相体系提取发芽糙米多糖的工艺条件,取得了良好的效果;李化等[15]研究表明K2HPO4/PEG6000双水相体系提取五味子多糖具有技术操作简便、成本低等特点;ZHANG等[16]建立了超声辅助双水相(乙醇/K2HPO4)提取百合多糖的有效方法;HUANG等[17]探讨了以乙醇/Na2HPO4体系为双水相体系,采用微波辅助萃取槐多糖的新方法,表明该方法具有快速、简便、能高效提取天然植物多糖。试验建立(NH4)2SO4/PEG双水相体系,并采用响应面优化超声波辅助提取牛蒡多糖的工艺条件,比较超声波辅助双水相法、超声法、热水法和酶法提取对牛蒡粗多糖提取率、主要成分及抗氧化活性的影响。以期建立一种绿色、简单、高效的牛蒡提取方法,并初步研究不同提取方法对牛蒡多糖抗氧化活性的影响。
的IC50分别为3.99和1.03 mg/mL,此外也有报道采用酶法[10]、超声波提取法[11]、微波提取法[12]和高速剪切提取法[13]提取牛蒡多糖。但对于双水相提取技术用于牛蒡多糖的研究未见报道,双水相提取技术是利用物质在两相中不同的分配系数进行提取分离的方法,该技术条件温和、生物适应性广泛,因此可用于生物提取、天然产物分离等方面。刘晓飞等[14]探讨了超声波辅助(NH4)2SO4/PEG 6000双水相体系提取发芽糙米多糖的工艺条件,取得了良好的效果;李化等[15]研究表明K2HPO4/PEG6000双水相体系提取五味子多糖具有技术操作简便、成本低等特点;ZHANG等[16]建立了超声辅助双水相(乙醇/K2HPO4)提取百合多糖的有效方法;HUANG等[17]探讨了以乙醇/Na2HPO4体系为双水相体系,采用微波辅助萃取槐多糖的新方法,表明该方法具有快速、简便、能高效提取天然植物多糖。试验建立(NH4)2SO4/PEG双水相体系,并采用响应面优化超声波辅助提取牛蒡多糖的工艺条件,比较超声波辅助双水相法、超声法、热水法和酶法提取对牛蒡粗多糖提取率、主要成分及抗氧化活性的影响。以期建立一种绿色、简单、高效的牛蒡提取方法,并初步研究不同提取方法对牛蒡多糖抗氧化活性的影响。
1 材料与方法
1.1 材料与试剂
牛蒡,农副产品市场;聚乙二醇(分子质量分别为2 000、4 000、6 000)、(NH4)2SO4、没食子酸、芦丁,上海源叶生物科技有限公司;DPPH,sigma公司;H2O2,Aladdin公司;溴化钾(光谱纯),美国PIKE公司;其余试剂均为分析纯。
1.2 仪器与设备
KQ3200E型超声波清洗器,昆山市超声仪器有限公司;R206旋转蒸发仪,上海申生科技有限公司;真空冷冻干燥机,德国CHRIST公司;TU-1810紫外分光光度计,北京普析通用有限公司;L550离心机,湖南湘仪实验室仪器开发有限公司;Nicolet iS10傅里叶红外光谱仪,美国Thermo fisher公司。
1.3 方法
1.3.1 牛蒡的预处理
筛选无腐烂发霉,表面颜色和形态正常的新鲜牛蒡,洗净后用切菜机切成厚薄均匀的小片,置于50 ℃鼓风干燥烘箱中烘干至水分含量<8%,烘干后用粉碎机粉碎,过80目筛后装在密封袋中,备用。
1.3.2 超声波辅助双水相提取牛蒡多糖的工艺研究
1.3.2.1 双水相体系的确定
参考孙诗清等的方法[18]。称取3种分子质量的聚乙二醇各1.00 g,用纯水溶解后,分别加入一定量的硫酸铵,使硫酸铵/聚乙二醇的质量比为0.5∶1、1.0∶1、1.5∶1、2.0∶1、2.5∶1和3.0∶1,转移至10 mL容量瓶中,定容,摇匀后转入离心管中,漩涡振荡均匀后于4 000 r/min离心10 min分相,分别测量上、下相的体积,计算相比并确定其与质量比的关系。
在双水相体系中加入一定的牛蒡粉,于50 ℃浸提3 h后超声提取30 min,过滤,将滤液离心分相,吸取适量上、下相溶液,并以对应的双水相体系为参比,测定其多糖含量,计算牛蒡多糖在不同体系中的分配系数。
1.3.2.2 料液比对牛蒡多糖得率的影响
取1.5、2.0、3.0、4.5、6.0和7.5 g牛蒡粉末,分别加入双水相体系中,在50 ℃中浸提3 h后超声提取30 min,过滤,将滤液离心分相。吸取适量下相溶液,并以对应的双水相体系为参比,测定其多糖含量,计算牛蒡多糖的得率。
1.3.2.3 浸提温度对牛蒡多糖得率的影响
称取4.5 g牛蒡粉末加入双水相体系中,分别在20、30、40、50、60和70 ℃中浸提3 h后超声提取30 min,过滤,将滤液离心分相。吸取适量下相溶液,并以对应的双水相体系为参比,测定其多糖含量,计算牛蒡多糖的得率。
1.3.2.4 浸提时间对牛蒡多糖得率的影响
称取4.5 g牛蒡粉末加入双水相体系中,在50 ℃中分别浸提1、1.5、2.0、2.5、3、3.5和4 h后超声提取30 min,过滤,将滤液离心分相。吸取适量下相溶液,并以对应的双水相体系为参比,测定其多糖含量,计算牛蒡多糖的得率。
1.3.2.5 超声时间对牛蒡多糖得率的影响
称取4.5 g牛蒡粉末加入双水相体系中,在50 ℃恒温水浴锅中浸提2.5 h,依次超声提取10、20、30、40、50和60 min,过滤,将滤液离心分相。吸取适量下相溶液,并以对应的双水相体系为参比,测定其多糖含量,计算牛蒡多糖的得率。
1.3.2.6 响应面优化设计
在单因素试验的基础上,以浸提时间(A)、浸提温度(B)、超声时间(C)、料液比(D)为自变量,牛蒡多糖得率为响应值,按照Box-Behnken设计试验,筛选出超声辅助双水相提取牛蒡多糖的最佳工艺参数,因素与水平设计见表1。
表1 响应面分析因素与水平
Table 1 Response surface analysis factors and levels
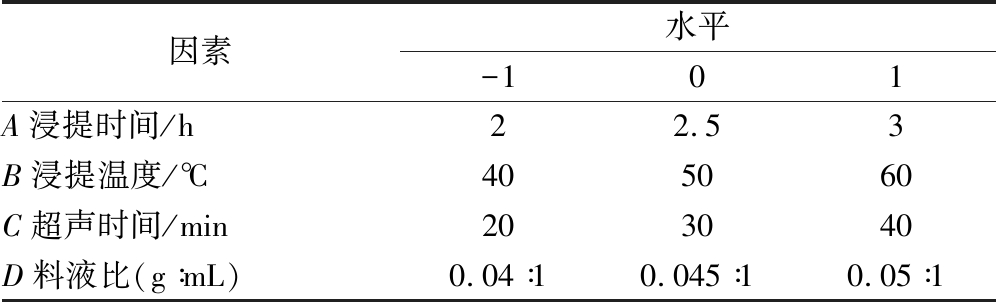
因素水平-101A浸提时间/h22.53B浸提温度/℃405060C超声时间/min203040D料液比(g∶mL)0.04∶10.045∶10.05∶1
1.3.3 牛蒡多糖的制备
参考喻俊[11]报道的超声法、贾小丽等[9]报道的热水浸提法和高明侠等[10]报道的酶法以及采用本试验优化得出的超声波辅助双水相法分别提取牛蒡多糖,分别经Sevage法去蛋白3次后减压蒸发至黏稠状,加入适量的纯水超声复溶后离心,收集上清液,并加入无水乙醇至醇浓度达到80%,搅拌均匀,于4 ℃冰箱中醇沉12 h,4 000 r/min离心10 min,收集沉淀,依次经乙醚和丙酮洗涤后,冷冻干燥,置于-20 ℃冰箱中保存待用。超声法、热水浸提法、酶法和超声波辅助双水相法制备的牛蒡多糖分别命名为UBPs、HBPs、EBPs和UATPBPs。
1.3.4 多糖含量的测定
采用苯酚-硫酸法[19]测定多糖含量。以D-葡萄糖为标准品,在质量浓度0.125~12.5 μg/mL范围内绘制标准曲线,获得回归方程y=0.057 6x+0.096 8,R2=0.997 8,计算多糖的含量和提取率。
1.3.5 蛋白质含量的测定
以牛血清白蛋白为标准品,采用考马斯亮蓝法[20]进行测定。在质量浓度1.67~15 μg/mL范围内,绘制标准曲线的回归方程为y=0.021 2x-0.023 7,R2=0.997 8。
1.3.6 多酚含量的测定
以没食子酸作为标准品,采用Folin-Ciocalteu比色法[21]。在质量浓度0.8 ~5.6 μg/mL范围内,绘制标准曲线所获得的回归方程为y=0.303 4x+0.145 1,R2=0.998 0。
1.3.7 黄酮含量的测定
黄酮含量的测定采用芦丁法[22]。在质量浓度7.5~60 μg/mL范围内,绘制标准曲线的线性回归方程为y=0.008x+0.022,R2=0.996 6。
1.3.8 糖醛酸含量的测定
采用间羟基联苯比色法[23]。在质量浓度1~10 μg/mL范围内绘制标准曲线的线性回归方程为y=0.073 7x+0.015 6,R2=0.997 0。
1.3.9 牛蒡多糖抗氧化活性研究
参考王希等[24]报道的方法测定牛蒡多糖对DPPH自由基的清除能力;参考阙斐等[25]报道的方法考察多糖对羟自由基的清除能力;参考CHOW等[26]的方法考察多糖的总还原能力。
1.3.10 牛蒡多糖的红外光谱分析
冷冻干燥后的牛蒡多糖粉末,与光谱纯KBr研磨混合后压片,扣除空气背景后用红外光谱仪在4 000~400 cm-1范围内扫描,分别率为4 cm-1。
2 结果与分析
2.1 超声波辅助双水相提取牛蒡多糖的条件确定
2.1.1 双水相体系的确定
PEG/(NH4)2SO4双水相相图如图1所示,其中曲线下方不分相,属于单相区;曲线上的每一个点为临界点;曲线上方为双相区。在双水相中,PEG大量存在于上相中,(NH4)2SO4大量存在于下相中。由图1可知,当PEG质量分数一定时,(NH4)2SO4质量分数过低会导致不能分相,过高则会导致其析出。而(NH4)2SO4质量分数一定时,相对分子量越大的PEG,其分相时所需PEG的质量分数越小,双水相体系越易形成。此相图为PEG/(NH4)2SO4双水相体系提取牛蒡多糖提供了理论依据。
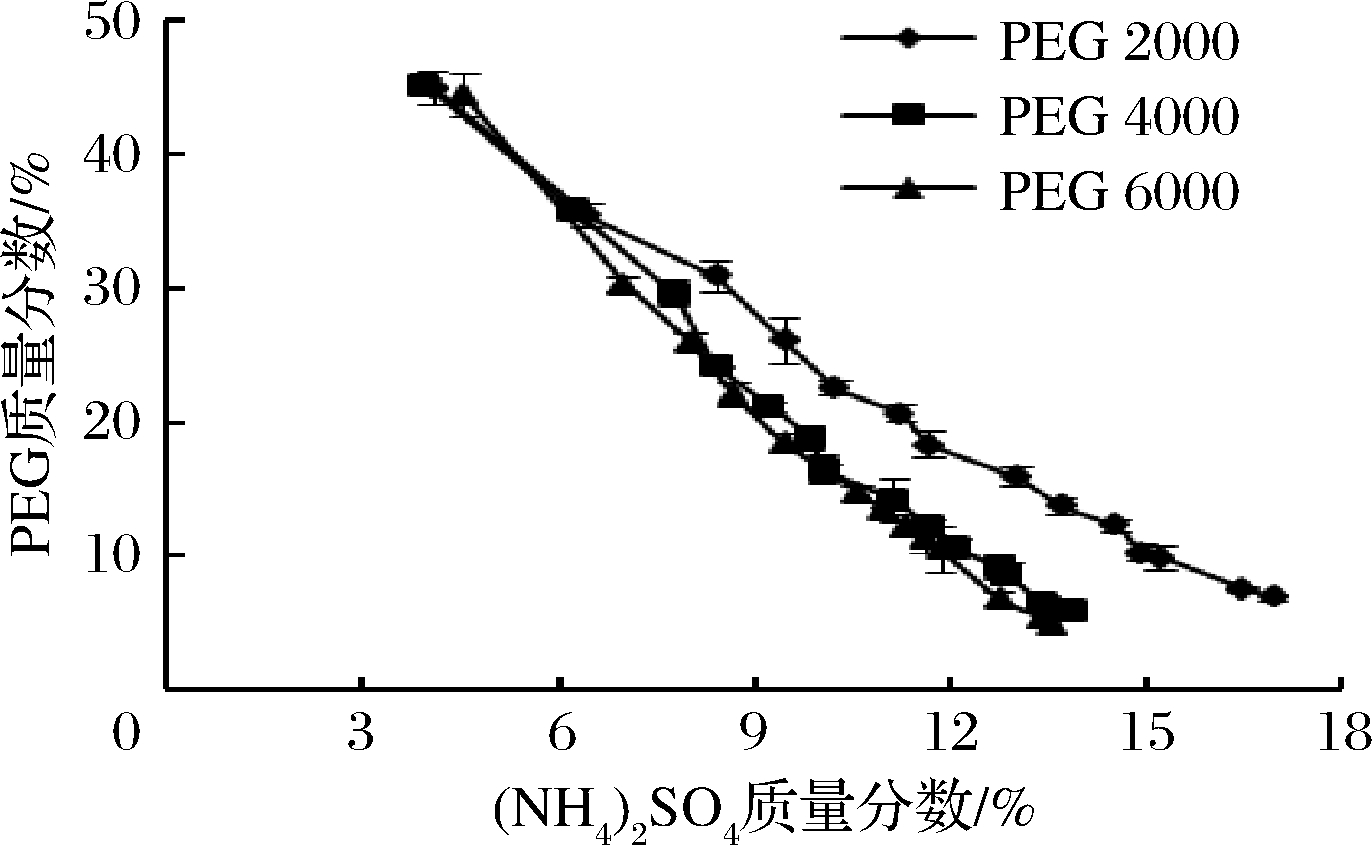
图1 PEG/(NH4)2SO4双水相体系相图
Fig.1 Phase diagram of PEG/(NH4)2SO4 aqueous two-phase system
(NH4)2SO4/PEG不同质量比对相比和牛蒡多糖分配效果的影响如图2与3所示。
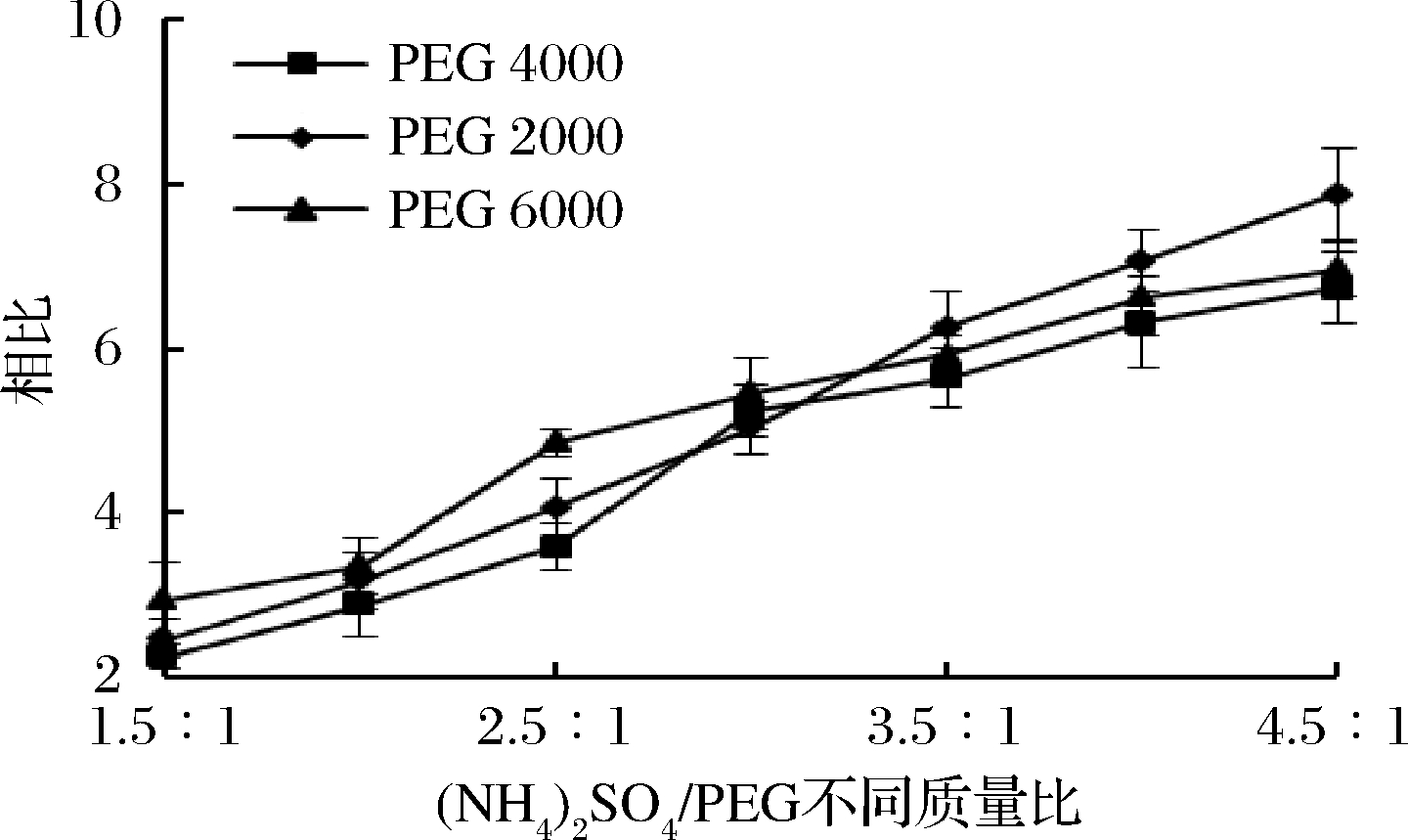
图2 双水相体系的分相结果
Fig.2 Phase separation results of a two-phase system

图3 不同双水相体系的分配系数
Fig.3 The partition coefficient of the two-phase system
由双水相体系的分相结果可知,在质量比1.5∶1~4.5∶1时,3种聚乙二醇都具有很好的分相能力,并且相比随着质量比的增大而增大;而(NH4)2SO4对不同分子量PEG的相比差别影响不大,特别是在质量比为3∶1时,基本无影响。但是3种聚乙二醇对牛蒡多糖的分配系数影响较大,其中PEG 6000的分配系数显著高于PEG 2000的。综合考虑,试验确定质量比为3∶1的(NH4)2SO4/PEG 6000体系作为牛蒡多糖提取的最佳双水相体系,试验结果与孙诗清等报道的结果相似[18]。
2.1.2 料液比的确定
如图4所示,当料液比(g∶mL)在0.010∶1~0.045∶1时,牛蒡多糖的得率随料液比的增大而提高;而当料液比(g∶mL)超过0.045∶1时,多糖的得率开始缓慢下降。说明随着溶剂的增加,溶剂溶解杂质增多,而多糖溶出已达到平衡。综合考虑,选择料液比(g∶mL)为0.045∶1进行响应面优化。
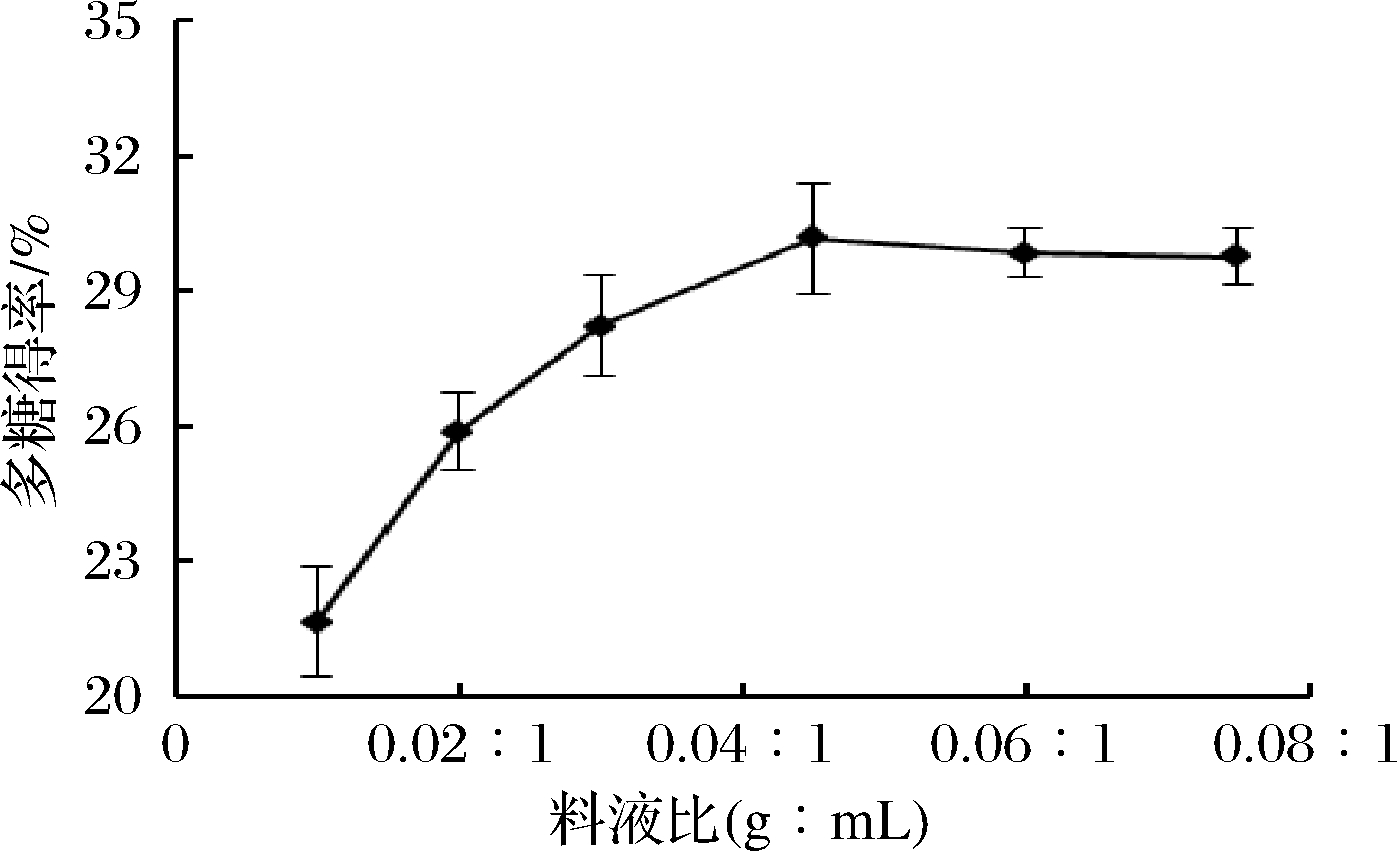
图4 料液比对牛蒡多糖得率的影响
Fig.4 Effect of ratio of material to liquid on the yield of burdock polysaccharide
2.1.3 浸提温度的确定
不同浸提温度对多糖得率的影响结果如图5所示。

图5 浸提温度对牛蒡多糖得率的影响
Fig.5 Effect of extraction temperature on the yield of burdock polysaccharide
从图5可以看出,当浸提温度小于50 ℃时,多糖得率随着温度的升高而显著提高,而超过50 ℃后,多糖得率开始缓慢下降。由于温度提高增加了多糖的溶解度,而温度过高时,导致部分多糖分解,因此选择浸提温度为50 ℃进行响应面优化,王全等[27]在优化玛咖多糖提取工艺时也得到了相似的结果。
2.1.4 浸提时间的确定
如图6所示,在浸提时间小于2.5 h时,牛蒡多糖能够充分溶解到双水相系统中,因此多糖得率随着浸提时间的延长不断增加,并且在2.5 h达到最大,但是浸提时间超过2.5 h时,多糖得率缓慢下降,但不显著。故选择浸提时间为2.5 h进行响应面优化。

图6 浸提时间对牛蒡多糖得率的影响
Fig.6 Effect of extraction time on the yield of burdock polysaccharide
2.1.5 超声时间的确定
如图7所示,在30 min之内,随着超声处理时间的延长,牛蒡多糖得率显著增加,可能是由于超声波的空穴效应促进溶质的传递,加速了多糖的溶出;超过30 min后,多糖得率下降,是因为多糖溶出率减小,同时超声波会导致部分多糖降解。因此选择超声时间为30 min左右进行响应面优化。

图7 超声时间对牛蒡多糖得率的影响
Fig.7 Effect of ultrasonic time on the yield of burdock polysaccharide
2.1.6 响应曲面优化超声辅助双水相提取牛蒡多糖的试验结果
2.1.6.1 回归模型分析
本实验共29组试验,响应面试验设计和结果见表2,试验模型方差分析见表3。软件拟合出的二次多项回归方程为:![]()
表2 响应面试验设计及结果
Table 2 Response surface test design and results

试验号ABCD多糖得率/%10-10-127.632000032.413010030.634-101024.055010124.176-10-1-126.587001027.378-100031.26910-1124.3110-110026.8311000032.2712100030.211300-1-124.271401-1124.5915101027.73160-11026.7217000032.2518110-128.7619-100026.832000-1124.2921-1-10030.1522000031.5423000130.32241-1-1024.49250-10129.8326000032.38271-10030.5128001124.0129011023.02
表3 二次响应面回归模型方差分析
Table 3 Analysis of variance of quadratic response surface regression model

方差来源平方和自由度均方F值P值显著性模型270.471419.32101.84<0.000 1∗∗A3.1413.1416.560.001 1∗∗B10.70110.7056.39<0.000 1∗∗C1.5911.598.390.011 7∗D11.84111.8462.42<0.000 1∗∗AB0.6210.623.250.093 1AC8.8518.8546.66<0.000 1∗∗AD5.1515.1527.160.000 1∗∗BC3.6113.6119.030.000 7∗∗BD18.75118.7598.84<0.000 1∗∗CD2.8612.8615.060.001 7∗∗A25.4415.4428.680.000 1∗∗B231.17131.17164.31<0.000 1∗∗C2191.221191.221 008.04<0.000 1∗∗D220.00120.00105.42<0.000 1∗∗残差2.66140.19失拟项2.14100.211.660.329 7纯度差0.5240.13总和273.1228R2=0.990 3R2Adj=0.980 6R2Pred=0.951 9Adeq Precisio29.216
注:**为差异极显著(P<0.01);*为差异显著(P<0.05)
由表3可知,因素B、D、AC、BD、B2、C2、D2对牛蒡多糖的提取率影响极显著(P<0.000 1),由F值可知,4个因素对牛蒡多糖提取率的影响大小的排序为:D>B>A>C。方程失拟项不显著(P=0.329 7>0.05),表明该方程不失拟,说明这个模型合理且适合拟合试验,方程模型极显著(P<0.000 1),说明能较好地拟合实验结果;模型的确定系数为R2=0.990 3,模型的调整确定系数为![]() 说明这个模型的相关性和解释度都很好,即此响应面模型与实际试验拟合很好。因此BBD试验可靠,该模型适用于超声波辅助双水相提取牛蒡多糖最佳工艺的理论预测和分析。
说明这个模型的相关性和解释度都很好,即此响应面模型与实际试验拟合很好。因此BBD试验可靠,该模型适用于超声波辅助双水相提取牛蒡多糖最佳工艺的理论预测和分析。
2.1.6.2 响应面交互作用分析
由图8可知,等高线图呈椭圆形且超声时间轴向等高线比超声功率轴向等高线密集,响应面图中超声时间曲线较陡,说明C(超声时间)对牛蒡多糖提取率的影响较大,AC之间的交互作用对牛蒡多糖提取率影响显著。

图8 超声时间和浸提时间的响应面和等高线图
Fig.8 Response surface and contour plot for ultrasonic time and extraction time
由图9可知,响应面图中料液比和浸提温度曲线都比较陡,而且BD的等高线呈椭圆形,说明B(浸提温度)和D(料液比)对牛蒡粗多糖提取率都有较大的影响,BD之间的交互作用对牛蒡多糖提取率的影响显著。

图9 料液比和浸提温度的响应面和等高线图
Fig.9 Response surface and contour plot of material to liquid ratio and extraction temperature
通过Design-Expert.V.8.0.5b软件预测得到最佳条件为:浸提时间2.62 h,浸提温度48.56 ℃,超声时间30.89 min, 料液比0.04∶1(g∶mL),牛蒡多糖提取率理论值为32.38%。根据最佳条件并考虑实际操作调整为料液比(g∶mL)0.04∶1,浸提温度49 ℃,浸提时间2.6 h,超声时间31 min,进行3次验证试验,在该条件下牛蒡多糖的实际提取率为(32.35±0.85)%。与预测值相差不大,因此认为优化条件可信,说明用BBD试验设计来优化超声波辅助双水相提取牛蒡多糖条件是可行的。
2.2 不同提取方法制备的牛蒡粗多糖提取率及主要成分比较
由表4可知,超声波辅助双水相法的提取率显著高于其他3种方法(P<0.05),其次为酶法提取的提取率,而热水浸提法的提取率显著低于其他方法,张倩等研究发现超声波处理能明显提高枸杞多糖的提取率[28];4种方法制备的粗多糖中,纯度最高的是超声波辅助双水相法(P<0.05)。粗多糖中含有一定的多酚、黄酮和蛋白质类物质,这些成分可能是与糖类基团紧密相连而在提取和醇沉过程中混入到样品中[29]。UBPs和UATPBPs中的多酚、黄酮和蛋白质的质量分数要显著高于其他方法(P<0.05),可能是由于超声波的空化、机械和热效应能更大强度的破坏牛蒡细胞壁结构,导致更多的非多糖成分被释放出来,实验结果与苏平等报道的一致[29]。酶法和热水提取的粗多糖中糖醛酸含量高于其他两者。4种粗多糖中蛋白质含量都较少,说明Sevage法去蛋白效果较好。
表4 牛蒡粗多糖提取率及主要成分的含量
Table 4 Extraction rate and content of main components of crude burdock
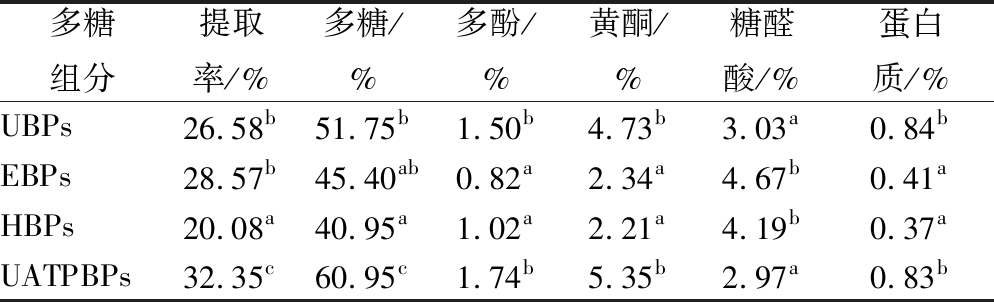
多糖组分提取率/%多糖/%多酚/%黄酮/%糖醛酸/%蛋白质/%UBPs26.58b51.75b1.50b4.73b3.03a0.84bEBPs28.57b45.40ab0.82a2.34a4.67b0.41aHBPs20.08a40.95a1.02a2.21a4.19b0.37aUATPBPs32.35c60.95c1.74b5.35b2.97a0.83b
注:同一列中不同字母表示有显著相关。
2.3 牛蒡多糖抗氧化能力测定的结果分析
由图10~图12和表5可知,4种方法制备的牛蒡多糖都具有较好的DPPH·、·OH的清除率和总还原能力,并且在一定浓度范围内呈现出极好的量效关系,表明其牛蒡多糖具有较好的抗氧化活性,结果与喻俊等[32]、周浓等[8]的研究结论一致。

图10 牛蒡多糖对DPPH·的清除率
Fig.10 DPPH· Clearance of burdock polysaccharide
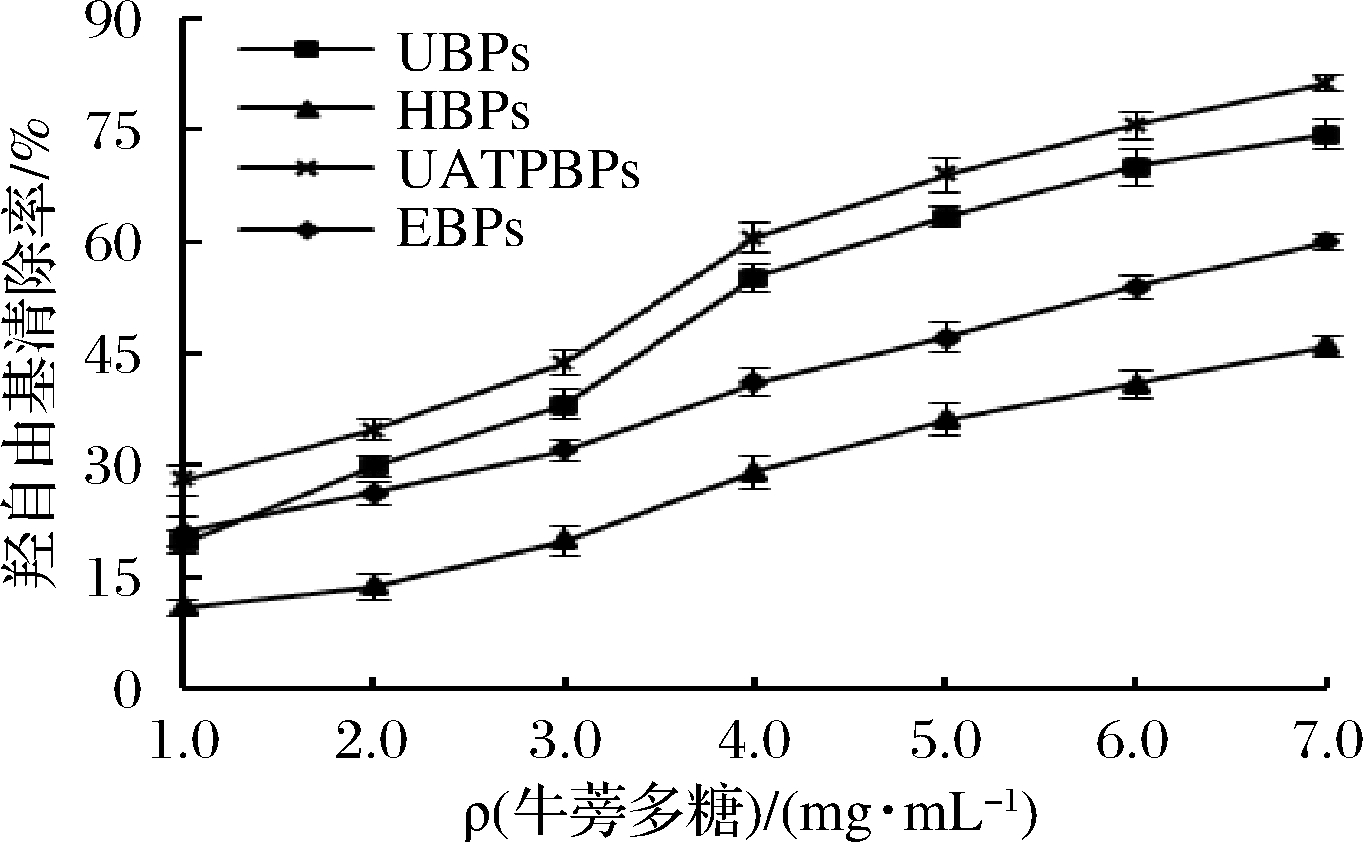
图11 牛蒡多糖对羟自由基的清除率
Fig.11 ·OH scavenging of burdock polysaccharide
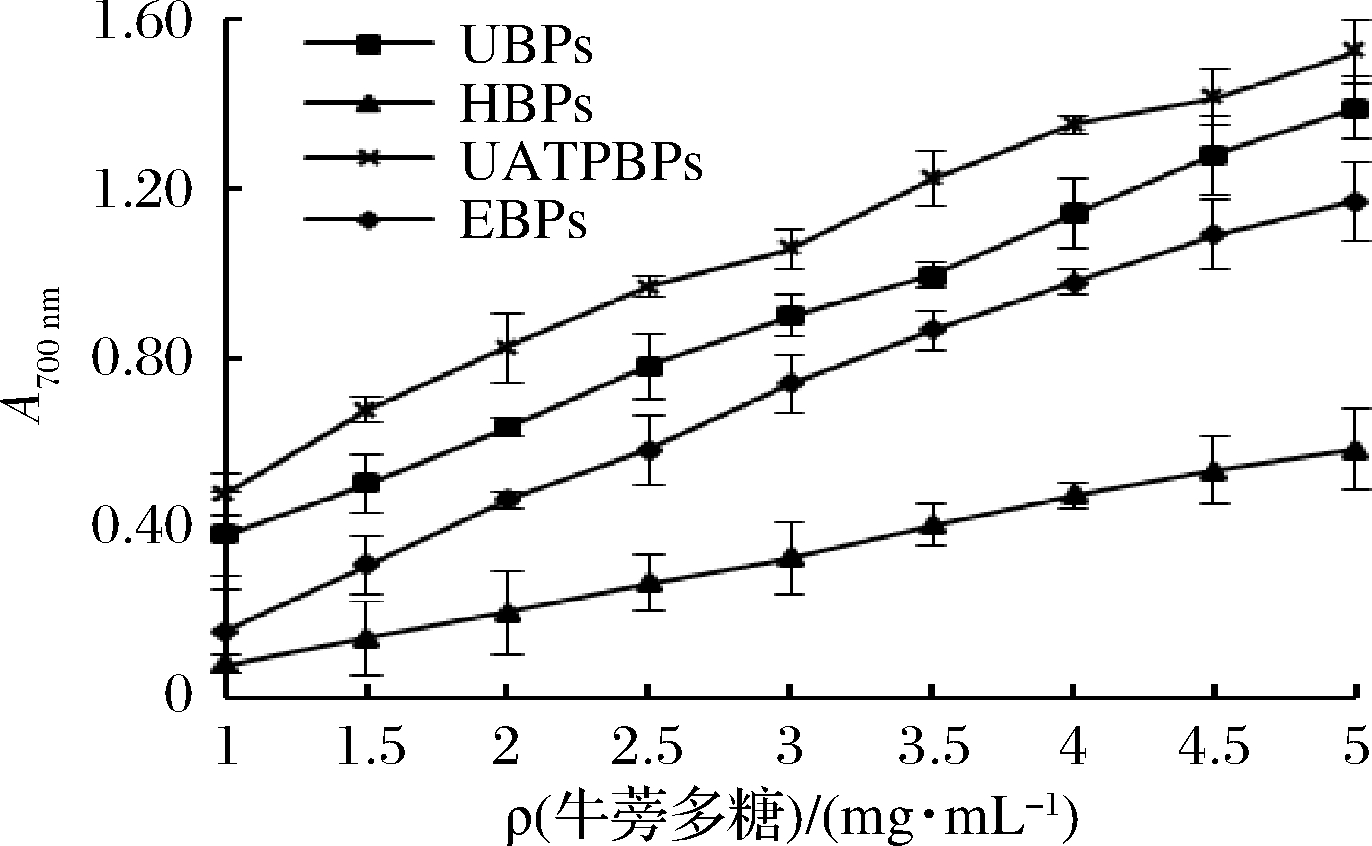
图12 牛蒡多糖的总还原力
Fig.12 Total reducing power of burdock polysaccharide
表5 牛蒡多糖的抗氧化能力分析[IC50值/(mg·mL-1)]
Table 5 The antioxidant capacity of burdock polysaccharide

多糖组分UBPsHBPsUATPBPsEBPsDPPH·清除率0.784 3a1.650 1c0.619 9a1.082 4b·OH清除率3.282 3a5.408 1c2.900 8a4.184 1b总还原力1.486 6a4.249 2c1.187 1a2.386 5b
注:同一行中不同字母表示有显著性差异(P<0.05)
总体而言,UATPBPs的抗氧化能力最好,其次是UBPs,二者都显著高于EBPs和HBPs(P<0.05)。苏平等[29]研究表明超声辅助提取的黄秋葵花多糖的抗氧化能力要强于热水、酸法和酶法所制备的多糖;LI等[33]研究显示超声提取的骏枣多糖的还原力高于热水法提取的多糖;SHEN等[34]在研究不同提取方法对油茶饼多糖抗氧化能力的影响时也发现相较于酶法、碱法、热水提取的多糖,超声波所制备的多糖具有最强的还原能力;YAN等[35]研究表明超声处理对多糖生物活性有一定的积极影响,能提高多糖的抗氧化活性;这些研究结果与本结论相似。研究表明,多糖的抗氧化活性与其分子质量大小、糖醛酸含量、单糖组成和主链结构密切相关[36-37],超声处理过程中可能会使得更多的生物活性物质溶出或者使多糖的结构发生一定的降解,相对分子质量减小,更多的活性基团暴露,使其抗氧化活性提高[38-40]。而试验中UATPBPs的抗氧化能力要高于UBPs,可能是由于超声提取的时间太长引起牛蒡多糖过度降解而引起的,具有原因有待进一步研究。
2.4 牛蒡多糖的红外光谱分析
图13是UATPBPs的红外光谱图,在3 292.25 cm-1有较强吸收峰,是O—H的伸缩振动吸收峰;2 933.54 cm -1是糖类 C—H 键伸缩振动引起的峰;1 056.30 cm -1 是糖环中 C—O—C伸缩和变角振动引起的峰,也表明其含有吡喃糖环[41];上述3 个吸收峰是糖类化合物典型的特征峰,峰值越强,表明多糖含量越高[42]。1 656.05 cm-1是糖醛酸中羰基C![]() O振动,1 415.02 cm-1 是糖醛酸中羰基C—O伸缩振动,这表明UATPBPs含有糖醛酸;1 575.23 cm-1是仲酰胺C—N—H弯曲振动引起的,1 332.78 cm-1附近的小峰为仲酰胺C—N伸缩振动与N—H弯曲振动引起的混合峰,表明多糖中含有一定的蛋白质,与上述组分分析结果一致。871、823 cm-1附近有弱吸收峰,提示该多糖中含有α型糖苷键和β型糖苷键[43]。686.24 cm-1是醇或酚的O—H 键面外弯曲振动引起的峰[44]。据此可推断,UATPBPs是吡喃型多糖类化合物。
O振动,1 415.02 cm-1 是糖醛酸中羰基C—O伸缩振动,这表明UATPBPs含有糖醛酸;1 575.23 cm-1是仲酰胺C—N—H弯曲振动引起的,1 332.78 cm-1附近的小峰为仲酰胺C—N伸缩振动与N—H弯曲振动引起的混合峰,表明多糖中含有一定的蛋白质,与上述组分分析结果一致。871、823 cm-1附近有弱吸收峰,提示该多糖中含有α型糖苷键和β型糖苷键[43]。686.24 cm-1是醇或酚的O—H 键面外弯曲振动引起的峰[44]。据此可推断,UATPBPs是吡喃型多糖类化合物。

图13 UATPBPs的红外光谱图
Fig.13 Infrared spectra of UATPBPs
3 结论
试验探讨响应面优化超声波辅助双水相法提取牛蒡多糖。试验结果表明(NH4)2SO4/PEG 6000的质量比为3∶1时,双水相体系最佳,超声波辅助双水相提取牛蒡多糖的最佳条件为料液比(g∶mL)0.04∶1,在浸提温度为49 ℃浸提2.6 h后,超声处理31 min,牛蒡多糖的最大得率达到(32.35±0.85)%。比较超声法、热水浸提法、超声波辅助双水相法和酶法提取的牛蒡粗多糖的提取率、主要成分及抗氧化活性,结果表明UATPBPs的提取率和含量最高,4种粗多糖都含有一定的多酚、黄酮和糖醛酸,并含有少量的蛋白质。红外光谱分析表明牛蒡多糖为吡喃型多糖;抗氧化试验表明,4种方法制备的牛蒡粗多糖都具有较好的抗氧化性,并且呈现良好的量效关系。其中,UATPBPs的抗氧化能力最好,对DPPH·、 ·OH清除率和还原能力的IC50值分别为0.619 9、2.900 8和1.187 1 mg/mL,提示超声波辅助双水相技术可以结合超声波和双水相技术的优点,制备出具有较高生物活性的牛蒡多糖。不同提取方法制备的牛蒡多糖的抗氧化活性差异可能是由于提取技术对多糖结构、化学组成、分支度、相对分子质量和立体构象的影响而造成的[45],下一步可探讨不同提取方法对牛蒡多糖结构、组成、分子量等的影响,并研究结构与抗氧化等生物活性之间的关联。
[1] 曹旭, 曹剑锋, 陈靠山. 牛蒡根总黄酮抗氧化活性研究[J]. 食品工业科技, 2012, 33(19):138-146.
[2] 唐仕荣, 宋慧, 刘全德, 等. 牛蒡多糖的分离纯化及其抗氧化活性研究[J]. 徐州工程学院学报(自然科学版), 2014(2):30-35.
[3] 娄在祥. 牛蒡功能性成分及其抗氧化、抗菌活性研究[D]. 无锡:江南大学, 2010.
[4] 王佳佳, 刘玮, 朱静, 等. 牛蒡多糖的降血糖活性[J]. 中国药科大学学报, 2013, 44(5):455-459.
[5] 袁平川. 牛蒡根多糖对STZ引起的高血糖大鼠的降血糖效应[D]. 芜湖:皖南医学院, 2018.
[6] 孟宇, 吕俊, 齐世美. 牛蒡多糖对K562细胞增殖的抑制及其机制的探讨[J]. 右江民族医学院学报, 2014, 36(1):10-11.
[7] 宋子敬, 张春凤. 牛蒡多糖对免疫低下小鼠增强免疫及抗氧化作用研究[J]. 海峡药学, 2016, 28(5):25-27.
[8] 周浓, 刘亚, 解万翠, 等. 牛蒡多糖提取工艺及其体外抗氧化活性的研究[J]. 食品研究与开发, 2015(16):44-48.
[9] 贾小丽, 程烨, 孙艳辉, 等. 牛蒡多糖的提取工艺及抗氧化性分析[J]. 粮食与食品工业, 2015, 22(6):51-56.
[10] 高明侠, 苗敬芝, 曹泽虹, 等. 双酶法提取牛蒡多糖的研究[J]. 食品科学, 2008, 29(9):260-263.
[11] 喻俊. 牛蒡多糖的分离纯化、理化性质及生物活性研究[D]. 雅安:四川农业大学, 2016.
[12] 唐仕荣, 刘全德, 苗敬芝, 等. 两种微波辅助萃取法萃取牛蒡多糖[J]. 食品科学, 2009,30(18): 102-105.
[13] 李超. 牛蒡根活性成分的高速剪切辅助提取及其对牛肉丸储藏稳定性的影响[J]. 中国食品添加剂, 2017(9):151-159.
[14] 刘晓飞, 王鑫, 孟庆虹, 等. 发芽糙米多糖双水相萃取工艺优化及其抗氧化活性[J]. 食品与机械, 2017(7):149-154.
[15] 李化, 柯华香, 李发洁, 等. Box-Behnken响应面法优选五味子多糖双水相提取工艺[J]. 中药材, 2016, 39(3):593-597.
[16] ZHANG X F, TENG G X, ZHANG J. Ethanol/salt aqueous two-phase system based ultrasonically assisted extraction of polysaccharides from, Lilium davidii var. unicolor, Salisb: Physicochemical characterization and antiglycation properties[J]. Journal of Molecular Liquids, 2018, 256:497-506.
[17] HUANG Y X, WU X H, ZHOU S Y, et al. Biphasic extraction of different polysaccharides from, Radix Sophorae tonkinensis, by microwave-assisted aqueous two-phase extraction: Process optimization, structural characterization and mechanism exploration[J]. Separation and Purification Technology, 2018, 207:187-198.
[18] 孙诗清, 王玉洁, 朱长俊, 等. 超声波辅助双水相提取虫草多糖的工艺研究[J]. 安徽农业科学, 2012,25(4):10-14.
[19] 巫永华, 刘恩岐, 张建萍, 等. 超声微波协同酶法提取黄精多糖与抗氧化特性分析[J]. 食品工业, 2019,40(5):171-176.
[20] 漆倩涯, 贠建民, 黄玉琴, 等. 超声破碎辅助蜗牛酶提取杏鲍菇蛋白工艺优化[J]. 食品科学, 2016, 37(22):85-91.
[21] 巫永华, 刘恩岐, 张建萍, 等. 黄精多酚的闪式提取及抗氧化活性研究[J]. 食品科技, 2017(8):231-236.
[22] 刘景煜, 李晨, 高锦明, 等. 枸杞子总黄酮含量检测方法优化[J]. 食品工业科技, 2016, 37(13): 304-308.
[23] 赵鹤鹏, 许秋达, 周鸿立. 玉米须多糖中糖醛酸含量的测定及抗氧化作用的研究[J]. 河南工业大学学报(自然科学版), 2017, 38(4): 81-85.
[24] 王希, 朱攀宇, 蒋荣娜, 等. 超声细胞破碎辅助提取永香菇多糖工艺及其抗氧化活性研究[J]. 食品研究与开发, 2019, 40(8):120-125.
[25] 阙斐, 黄涵年, 赵粼. 香蕉酵素发酵过程中的组分及抗氧化性变化研究[J]. 食品工业科技, 2019,41(11):6-10.
[26] CHOW S T, CHAO W W, CHUNG Y C. Antioxidative activity and safety of 50% ethaolicred extract[J].Journal of Food Science, 2003, 68(1): 21-25.
[27] 王全, 李红亚, 李术娜,等. Box-Behnken设计响应面法优化超声波辅助双水相法提取玛咖多糖[J]. 河北大学学报(自然科学版), 2016, 36(4):387-395.
[28] 张倩, 李书启. 不同提取方法对枸杞多糖提取率及抗氧化活性的影响[J]. 江苏农业科学, 2019, 47(3):169-173.
[29] 苏平, 孙昕, 宋思圆, 等. 提取方法对黄秋葵花多糖的结构组成及抗氧化活性的影响[J]. 食品科学, 2018,39(15):93-100.
[30] 胡位荣, 孙茹, 李昭露, 等. 霸王花水溶性多糖提取工艺及其对羟自由基的清除作用[J]. 食品科学, 2013, 34(14):104-107.
[31] 周方, 赵宏飞, 杨洋, 等. 高丛蓝莓品种花青素含量与抗氧化能力比较[J]. 西南林业大学学报, 2011, 31(5): 53-57.
[32] 喻俊, 王涛, 贾春红, 等. 响应面优化牛蒡子多糖的提取及其抗氧化活性研究[J]. 食品与发酵工业, 2015, 41(6):207-212.
[33] LI J W, AI L Z, HANG F, et al. Composition and antioxidant activity of polysaccharides from jujuba by classical and ultrasound extraction[J]. International Journal of Biological Macromolecules, 2014, 63:150-153.
[34] SHEN S, CHENG H R, LI X, et al. Effects of extraction methods on antioxidant activities of polysaccharides from camellia seed cake[J]. European Food Research and Technology, 2014, 238(6):1 015-1 021.
[35] YAN J K, WANG Y Y, MA H L, et al. Ultrasonic effects on the degradation kinetics, preliminary characterization and antioxidant activities of polysaccharides from Phellinus linteus mycelia[J]. Ultrasonics Sonochemistry, 2016, 29:251-257.
[36] WANG J Q, HU S Z, NIE S P, et al. Reviews on mechanisms of in vitro antioxidant activity of polysaccharides[J]. Oxidative Medicine and, Cellular Iongevity, 2016, 2016(64):1-13.
[37] 王美菊, 陆文娟, 喻晨, 等. 不同提取方法对姬菇多糖抗氧化活性的影响[J]. 南京师大学报(自然科学版), 2016(4): 65-70.
[38] FU L L, CHEN H X, DONG P, et al. Effects of ultrasonic treatment on the physicochemical properties and DPPH radical scavenging activity of polysaccharides from mushroom Inonotus obliquus[J]. Journal of Food Science, 2010, 75(4): C322-C327.
[39] 夏强. 超声波降解对大粒车前子多糖流变性质、溶液构象及生物活性的影响[D]. 南昌:南昌大学, 2016.
[40] 黄越, 周春晖, 黄惠华. 不同提取方法猴头菇粗多糖的表征及其抗氧化活性的比较[J]. 食品工业科技, 2017,39(3):38-44.
[41] DUAN G L, YU X B. Isolation, purification, characterization, and antioxidant activity of low-molecular-weight polysaccharides from Sparassis latifolia[J]. International Journal of Biological Macromolecules, 2019,137:1 112-1 120.
[42] 蔡铭, 陈思, 骆少磊, 等. 膜分离与醇沉技术纯化猴头菇粗多糖的比较[J]. 食品科学, 2019, 40(9):91-98.
[43] 刘瑶, 王新然, 赵悦, 等. 荞麦皮多糖组成及其抗氧化特性分析[J]. 食品与发酵工业, 2019,45(13):134-140.
[44] 杨文丽, 杨波, 杨光. 纳豆多糖的理化性质及结构分析[J]. 食品与发酵工业,2019,45(20):132-137.
[45] 高行恩, 王洪新. 不同提取方法对山药多糖含量及其体外抗氧化活性的影响[J]. 食品与发酵工业, 2015, 41(7):256-262.