姜黄素(双-α,β-不饱和β-二酮)是一种来自植物姜黄(Curcuma longa L.)根茎的黄橙色多酚,已被广泛用作食品的天然着色剂,具有很高的消费接受度[1-2]。由于其已知的抗癌、抗氧化、抗炎、抗微生物和抗病毒等活性[3-5],已成为研究热点。姜黄素主链为不饱和脂族及芳香族基团,结构式如图1所示[2],由于内部氢键结合,其在水性介质中溶解度非常低,是造成生物利用上的主要障碍[6],也存在稳定性差,利用率低的问题。因此,合适的姜黄素缓释载体是增加稳定性、提高其生物利用率的重要手段。近年来,姜黄素缓释载体的研究逐渐受到重视[7-9],如合成聚合物生育酚聚乙二醇1000琥珀酸酯(TPG)和聚乙二醇-聚己内酯等用于制备负载姜黄素的纳米胶束[10],天然聚合物如改性菊粉和透明质酸,安全且可生物降解[11],被认为更有利于递送姜黄素。
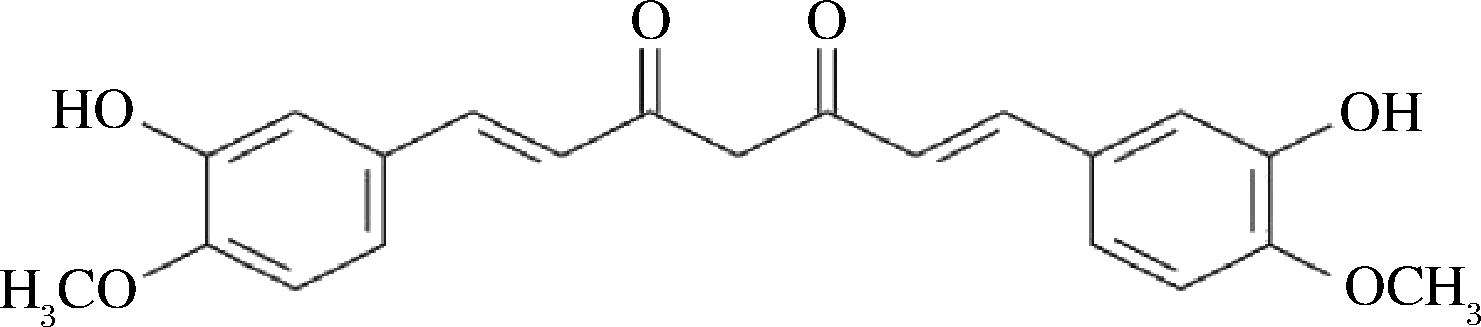
图1 姜黄素结构式[2]
Fig.1 Curcumin structure[2]
淀粉来源广泛,生物安全性强,具有很好的应用前景。多孔淀粉(porous starch,PS)是用物理法、生物和化学法使淀粉颗粒由表面至内部形成孔洞的变性淀粉[12],其表面到中心丰富的微孔,增加了比表面积,改善了其作为壁材的性能[13],可用作香料、调味剂、多种功能性物质及药物的保护载体[14-16]。BELINGHERI等研究显示了多孔淀粉作为调味剂、香料载体的潜在适用性[17]。WANG等研究结果表明,当使用明胶和多孔淀粉的混合物作为壁材料将叶黄素包埋在网状结构中时,其溶解度增加,并且可以直接溶解在水中[18]。MEER等研究发现用溶剂交换法制备的多孔淀粉可用作卡马西平低水溶性药物及各种其他候选药物的增溶剂和载体[13]。溶剂交换法是较广泛使用的多孔淀粉制造方法,在此过程中通过乙醇交换产生微孔,孔容易形成,溶剂可以完全从介质中除去[19]。多孔淀粉内部的洞孔和孔隙分布密集,具有良好的吸附性能。因此,作为载体保护目的物,多孔淀粉是很好的选择。
尽管多孔淀粉可为功能性物质生产提供很大的可能性,但迄今为止还没有关于溶剂交换法制备多孔淀粉对姜黄素吸附后性质的研究。本实验以溶剂交换法制备的多孔淀粉为材料,对姜黄素进行吸附,表征吸附能力及稳定性,并通过在模拟肠液和胃液中的释放来评估其生物利用度,为姜黄素的缓释和生物利用提供依据。
1 材料与方法
1.1 材料
马铃薯淀粉(BR)、姜黄素(纯度95%)、1,1-二苯基-2-苦基肼基(DPPH)、NaCl、HCl(36%质量分数)、吐温80、KH2PO4、NaOH,无水乙醇及所有其他试剂和溶剂均为分析级,实验用水均为蒸馏水。
1.2 仪器设备
DHG-9070鼓风干燥箱,上海一恒科学仪器有限公司;JA2603B电子天平,上海精科电子天平;Telstar-LYOQUEST-85冻干机,奥然科技有限公司;18系列紫外可见分光光度计,北京普析通用仪器有限责任公司;HH-4A恒温磁力搅拌水浴锅,常州金坛恒丰仪器制造有限公司;JY92-2DN超声波细胞粉碎机,上海比朗仪器有限公司;PHS-3C pH计,郑州宝晶电子科技有限公司;JSM-6701F扫描电子显微镜,上海立泛机电设备技术有限公司;H-1850R冷冻离心机,长沙湘仪离心机仪器有限公司;FTIR-650变换红外光谱仪,天津港东公司;Bettersize2600激光粒度分布仪,丹东市皓宇科技有限公司;DSC25差示扫描量热仪,深圳市广润自动化设备有限公司。
1.3 实验方法
1.3.1 多孔淀粉的制备
参考CHANG的方法并略作修改[20]。5 g马铃薯淀粉加入100 mL蒸馏水中,将混合物在40 ℃条件下持续搅拌20 min后升温至90 ℃保温0.5 h,以使淀粉完全糊化。然后在5 ℃储存48 h以获得淀粉凝胶。将凝胶切成约1 cm3立方体,并在-10 ℃下冷冻48 h。将冷冻的淀粉凝胶立方体在室温下浸入无水乙醇3次,每次约1 h,取出后在50 ℃下干燥6 h,在105 ℃加热2 h以除去乙醇和水,获得白色固体研磨以备用。
1.3.2 姜黄素与多孔淀粉微胶囊的制备
参考LI的方法并作修改[21]。姜黄素以4 mg/mL的浓度溶解在无水乙醇中,过0.4 μm过滤器除去未溶解晶体;多孔淀粉以5 mg/mL的浓度溶解在蒸馏水中,超声处理使其体系分布稳定;在搅拌下将一定体积的姜黄素乙醇溶液缓慢移液到多孔淀粉溶液中,制备成姜黄素质量分数分别为0.1%,0.2%,0.3%,0.4%和0.5%的5种复合样品(Cur@PS),适度加热样品溶液除去乙醇。为了提高姜黄素的吸附能力并减小颗粒的尺寸,将制备的样品溶液在冰浴中以20%的额定功率输出进行超声处理5 min。样品用冻干机干燥(真空度0.07 mBar,抽真空18 h,干燥时间约为30 h),制得具有姜黄素的特征黄色样品,在-20 ℃保存备用。
1.3.3 姜黄素标准曲线的绘制
参考高凤苑等方法[22],准确称取25.0 mg 姜黄素置于烧杯中,用无水乙醇溶解后转移到250 mL容量瓶中,再用无水乙醇进行定容,得到100 μg/mL的储备液。分别精密移取2、3、4、5、6 mL 储备液到100 mL的容量瓶中,用无水乙醇进行定容,制成2~6 μg/mL系列标准溶液。用无水乙醇做空白对照,分别在425 nm处测定其吸光度。以浓度(C,μg/mL)为横坐标,吸光度(A)为纵坐标,绘制标准曲线。
1.3.4 吸附能力的确定
将制备的样品以0.2 mg/mL的浓度添加到乙醇中,并在超声波中处理30 min,离心(3 000 r/min,10 min)2次,取上清液合并测定425 nm处吸光值,根据标准曲线,计算吸附能力。
吸附能力(AC)计算为姜黄素与多孔淀粉的质量比,如公式(1)所示:
(1)
式中:mcur,姜黄素质量;mps,多孔淀粉的质量。
1.3.5 扫描电子显微镜(SEM)形态学研究
扫描电子显微镜用于研究多孔淀粉及Cur@PS的微观形态。以15 kV的加速电压通过扫描电子显微镜观察表面形态。在观察之前,用金溅射涂覆微球2 h。
1.3.6 傅立叶变换红外(FTIR)光谱测定
FT-IR光谱技术用于分析样品粉末的化学结构。在该实验中,使用FTIR-KBr纯化合物在20 MPa下压制5 min,获得备用片剂。扫描范围500~4 000 cm-1。
1.3.7 差示扫描量热(DSC)测定
通过差示扫描量热仪测量样品热转变性质。称量样品粉末(约2.0 mg)并密封在铝DSC盘中。以10 ℃/ min的加热速率从20至250 ℃进行DSC扫描,空盘作为参考。
1.3.8 粒度分布测定
使用激光粒度分布仪湿法测量姜黄素、多孔淀粉及Cur@PS的粒度分布。将少量粉末分散在蒸馏水中,搅拌混合物以获得适当的遮光度,粒度表示为平均体积尺寸D [4,3](De Brouckere平均直径),即具有相同体积的球体的平均直径,并进行分析。
1.3.9 自由基清除活性测定
根据KIM等[23]方法,使用2,2-二苯基-1-苦基肼基(DPPH)测定制备样品的自由基清除活性。通过将DPPH试剂以0.1 mmol/L的浓度(称取0.003 94 g DPPH,用无水乙醇溶解定容到100 mL容量瓶)溶解在乙醇中来制备DPPH工作溶液。向4 mL上述工作溶液中加入1 mL姜黄素乙醇溶液或样品水溶液。摇动混合物并在室温下避光保持30 min。在UV-vis分光光度计上记录525 nm处的吸光值。在DPPH测定中,使用浓度为12.5、25、50、125和250 μg/mL的姜黄素乙醇溶液作为对照,同时将Cur@PS材料溶解于水中,浓度分别为0.5、1、2、5和 10 mg/mL。
根据公式(2)估算DPPH自由基清除活性:
(2)
式中:A空白和A样品分别是525 nm波长时加入蒸馏水和样品溶液的DPPH溶液的吸光值。
1.3.10 模拟胃液(SGF)和模拟肠液(SIF)中姜黄素释放曲线以及释放特性
根据EFSTATHIA等[24],PEREIRA等[25]方法略作修改。用2.0 g NaCl,7.0 mL HCl(36%质量分数)和1 g吐温80溶解在1 L蒸馏水中制备SGF,调节pH至1.2。用6.8 g KH2PO4,0.616 g NaOH和1 g吐温80溶解在1 L蒸馏水中制备SIF,调节pH至7.8。秤量约50.0 mg Cur@PS样品至玻璃小瓶中,向其中加入800 mL预热的SIF或SGF。将玻璃小瓶转移至设定为37 ℃,130 r/min摇动的水浴中进行释放测量。在425 nm下于5 h内监测姜黄素的释放。
(3)
式中:m1,释放姜黄素的质量;m2,总姜黄素的质量。
1.3.11 水溶性的测定
为了检测水溶性,通过温和搅拌将30 mg Cur@PS溶于3mL蒸馏水中30 min。观察样品是否完全溶解,在4 ℃冰箱中储存24 h,离心并观察是否有沉淀物。同样将姜黄素溶解在水中,观察Cur@PS和原始姜黄素在水中的不同溶解情况。
1.4 统计分析
该研究中的所有数据测试重复3次,所有数据均表示为平均值和标准偏差(平均值±SD),采用Origin软件进行作图和数据处理分析。
2 结果与讨论
2.1 SEM形态结构分析
实验分析了马铃薯原淀粉、溶剂交换法制备的多孔淀粉及最佳吸附量0.4%Cur@PS的样品SEM(图2)。由图2-a可以观察到马铃薯原淀粉颗粒大小不均,多为卵形,表面光滑,颗粒完整[26];与原淀粉相比较,多孔淀粉丧失了其原有结构,表面粗糙,颗粒形态结构发生明显变化,布满了大量细小的孔洞,孔的分布广泛但不均匀,各孔的大小也有差异(图2-b),孔的存在导致更多的结合位点,使吸附性增强。孔的产生是因为采用溶剂交换法制备时,在90 ℃糊化过程中淀粉颗粒被破坏,大量的水分子被吸附在淀粉糊中,冷冻过程中将水变成冰晶被固定在凝胶中,随后乙醇将冰晶交换出来从而形成了多孔结构[27];由图2-c可以看出,大部分孔被姜黄素填充,表明多孔淀粉具有很好的吸附姜黄素的能力,可以作为姜黄素的载体材料使用。

a-马铃薯原淀粉;b-马铃薯多孔淀粉;c-0.4%Cur@PS
图2 三种样品的扫描电镜图
Fig.2 SEM of three samples
2.2 FTIR分析
为了解姜黄素与多孔淀粉之间可能存在的相互作用,对吸附前后的物质进行了FTIR表征。从图3可以看出,姜黄素大约在3 520 cm-1处的特征吸收峰是由苯环上的—OH拉伸引起的,而约1 629 cm-1处是由C![]() C和C
C和C![]() O的混合振动引起的特征吸收峰引起的,约1 602 cm-1处是由于苯环的拉伸振动引起的;约1 508 cm-1处是由于C—O和C—C振动引起的,约1 281 cm-1处为芳香C—O拉伸振动,约1 027 cm-1处为C—O—C拉伸振动[28]。
O的混合振动引起的特征吸收峰引起的,约1 602 cm-1处是由于苯环的拉伸振动引起的;约1 508 cm-1处是由于C—O和C—C振动引起的,约1 281 cm-1处为芳香C—O拉伸振动,约1 027 cm-1处为C—O—C拉伸振动[28]。

图3 姜黄素、多孔淀粉及Cur@PS红外光谱图
Fig.3 Curcumin, porous starch and Cur@PS FTIR
对比姜黄素和多孔淀粉的特征光谱,Cur@PS大约在3 520 cm-1处的姜黄素—OH拉伸峰消失, 约3 325 cm-1处淀粉—OH拉伸宽峰随姜黄素负载量的增加而增大。而在约1 628 cm-1和约1 514 cm-1处检测到与姜黄素相关的弱峰,峰值信号在1 019 cm-1左右,对应于C—O—C葡萄糖单位振动。另外,淀粉的复杂指纹信号轻微移动到较高的波数,这归因于与姜黄素的相互作用[29]。在先前的研究中,氢键被认为是酚类化合物与聚合物壁材料之间的主要相互作用,姜黄素的羟基和葡萄糖单位的羟基可能参与氢键的形成[21]。由FT-IR光谱可以得出,多孔淀粉对姜黄素的吸附作用可能是化学吸附。
2.3 DSC分析
通过DSC对姜黄素、多孔淀粉以及Cur@PS进行热力学分析,由图4可以看出,试验样品总体呈放热效应。180 ℃为姜黄素放热效应的最大温度点,出现结晶现象。而多孔淀粉及Cur@PS放热效应最大温度点在85 ℃左右,出现结晶现象并发生热容变化[30]。多孔淀粉并没有显示出特定的吸热峰,而从约60到120 ℃的宽热转变归因于游离水和结合水的蒸发[31]。在约180 ℃时0.1%、0.3%Cur@PS姜黄素晶体熔化的放热峰消失,表明在加入多孔淀粉载体后姜黄素失去其结晶状态[21],但0.5%Cur@PS的吸附后出现了一个弱的放热峰,这与吸附能力的结果一致,可能是由于“吸附动态平衡”的存在所导致的,有部分姜黄素与多孔淀粉为物理混合。通过DSC分析得出,多孔淀粉吸附后的姜黄素更利于被分解利用。

图4 姜黄素、多孔淀粉及Cur@PS DSC
Fig.4 Curcumin, porous starch and Cur@PS DSC
2.4 粒度分布
样品的粒度分布如图5所示,吸附后的样品均显示单峰分布,表明样品具有良好的粉末均匀性。如表1所示,Cur@PS的D[4,3]为248.4~376.1 μm,其中0.4%Cur@PS的粒径分布相对较小,说明0.4%Cur@PS做壁材效果较好,在表1中给出跨度值,TONON等研究表明,较高的跨度值是较宽的粒度分布的标志,反之亦然[32]。由表1及图5可知,吸附后样品的Span值粒度分布结果一致,且吸附后样品的比表面积均减少,其中0.4%Cur@PS为20.27 m2/kg。通过以上结果可以表明多孔淀粉可作壁材吸附姜黄素。
表1 姜黄素与多孔淀粉及Cur@PS粒径分析
Table 1 Curcumin and porous starch and Cur@PS particle size analysis
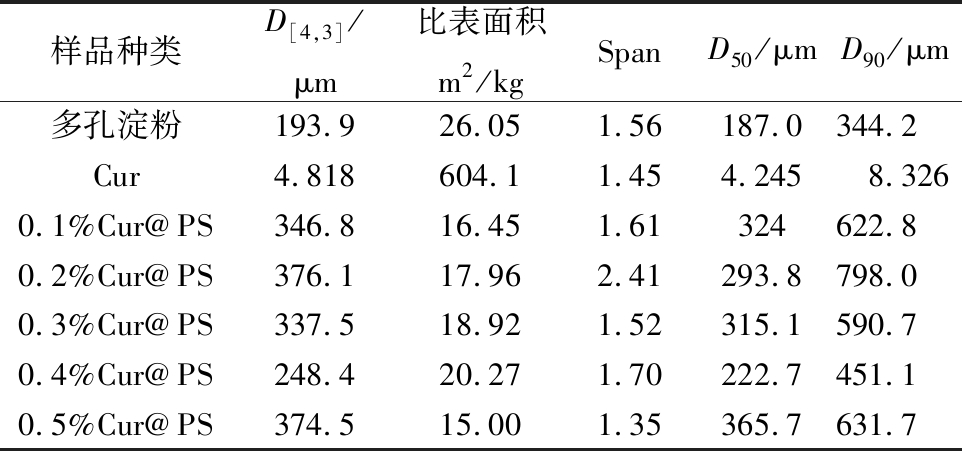
样品种类D[4,3]/μm比表面积m2/kgSpanD50/μmD90/μm多孔淀粉193.926.051.56 187.0344.2Cur4.818604.11.454.2458.3260.1%Cur@PS346.816.451.61324622.80.2%Cur@PS376.117.962.41293.8798.00.3%Cur@PS337.518.921.52315.1590.70.4%Cur@PS248.420.271.70222.7451.10.5%Cur@PS374.515.001.35365.7631.7
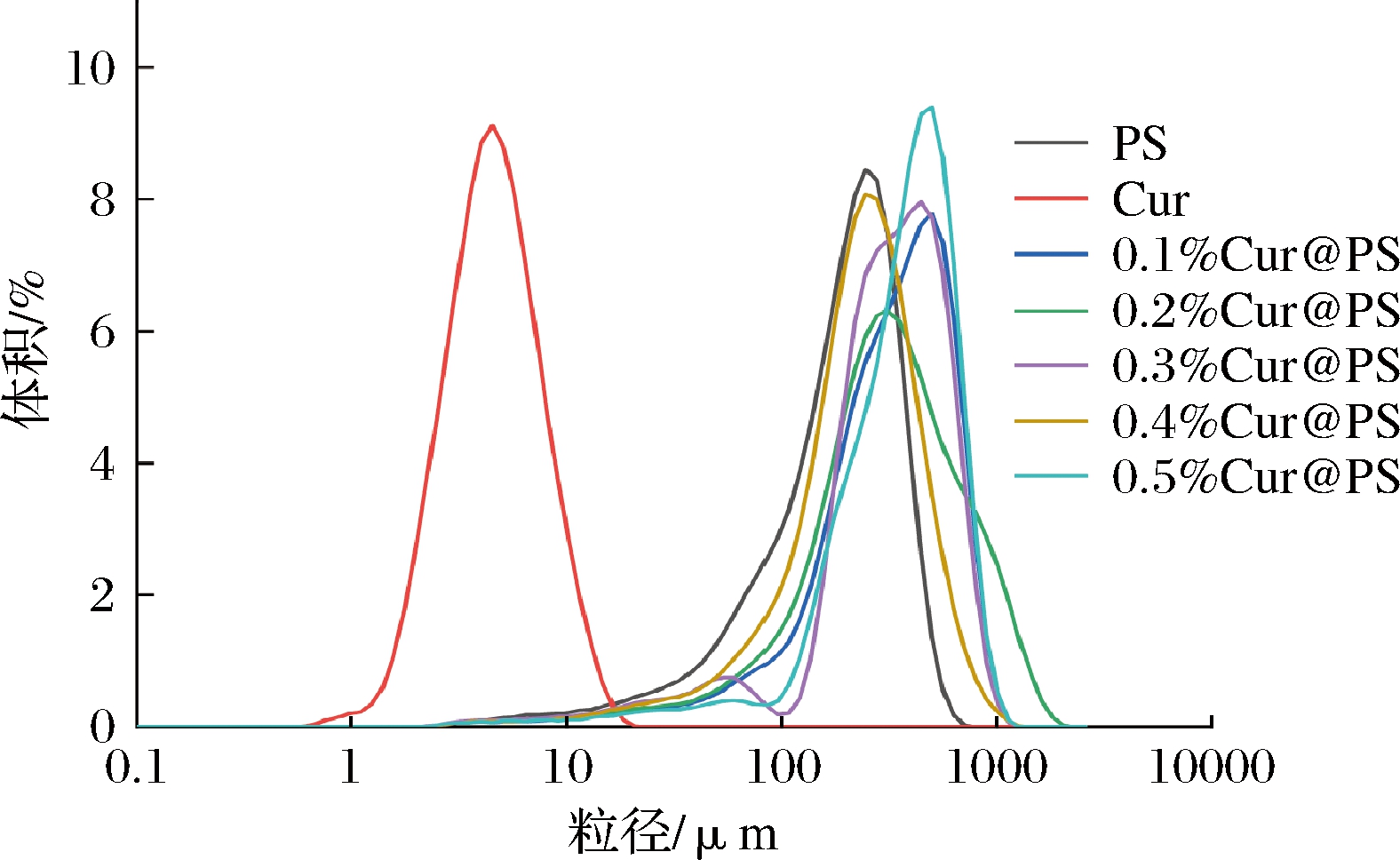
图5 姜黄素与多孔淀粉及Cur@PS粒径分布
Fig.5 Curcumin and porous starch and Cur@PS particle size distribution
2.5 姜黄素标准曲线
将配制的 2~6 μg/mL的姜黄素溶液在425 nm处分别测定其吸光度,结果如图6所示。姜黄素溶液在427 nm处的回归方程为y=0.204 6x-0.001 9,R2=0.998 3>0.99,由标准曲线可知,姜黄素在2~6 μg/mL范围内具有可行度和良好的线性关系。
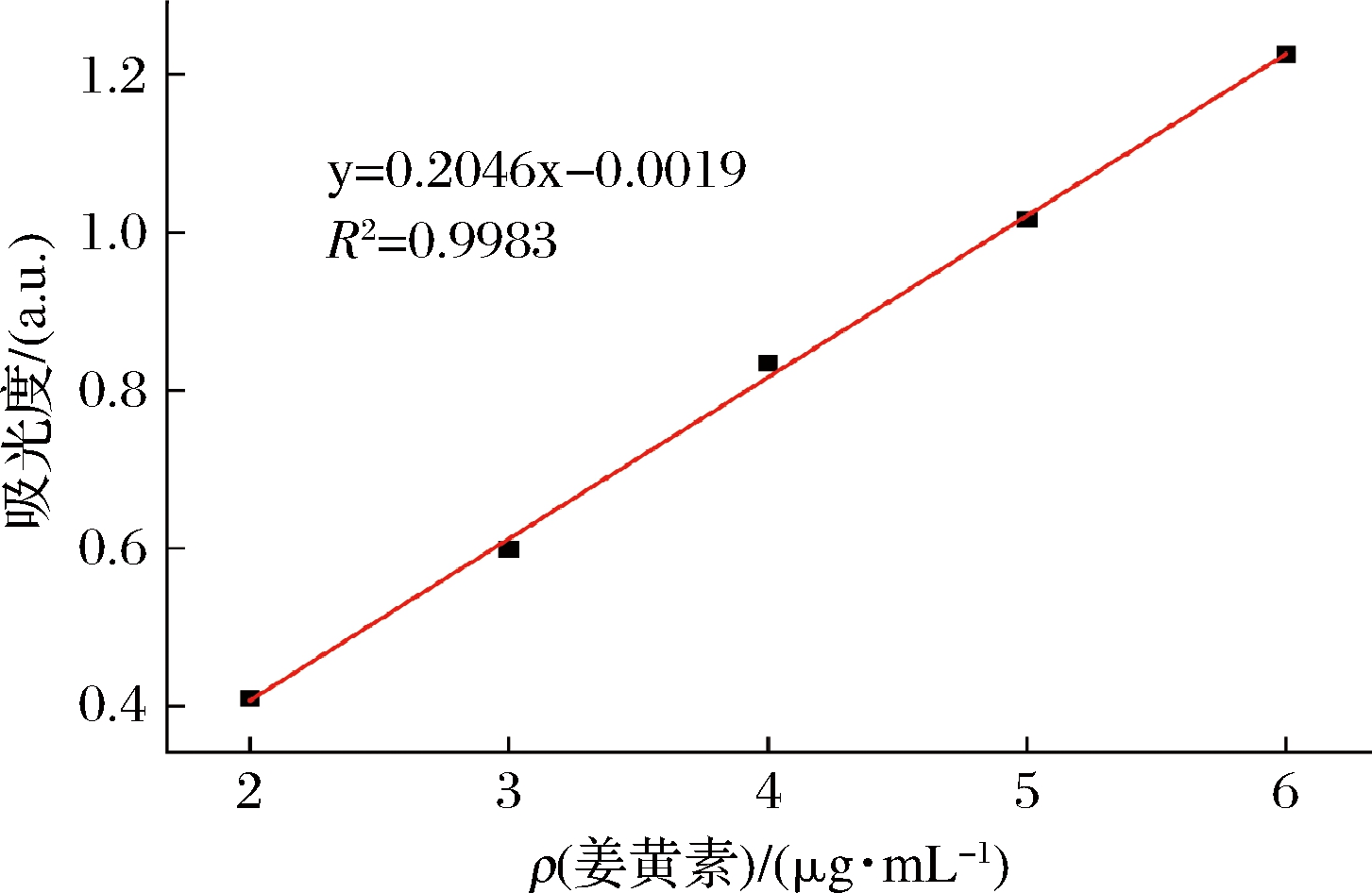
图6 姜黄素标准曲线
Fig.6 Standard curve of curcumin
2.6 姜黄素吸附能力
从SEM图中可以直观看到多孔淀粉对姜黄素的吸附,为了进一步考察吸附量,实验设置了不同浓度Cur@PS的吸附试验。如图7所示,随着姜黄素含量的增加,多孔淀粉的吸附量也在增加,姜黄素量为0.4%时,吸附量达到最大(3.67 mg/g),较0.3%吸附量(1.06 mg/g)增加3.46倍(图7),这归因于多孔淀粉的蜂窝结构可以提高材料的吸收性和黏合性[33]。当姜黄素质量分数为0.4%与0.5%时实现了较高的吸附能力;质量分数超过0.4%后,吸附能力不再继续升高反而开始降低,可能由于“吸附动态平衡”的存在,使过多的姜黄素无法完全填充到孔隙中,从而使其吸附能力降低。
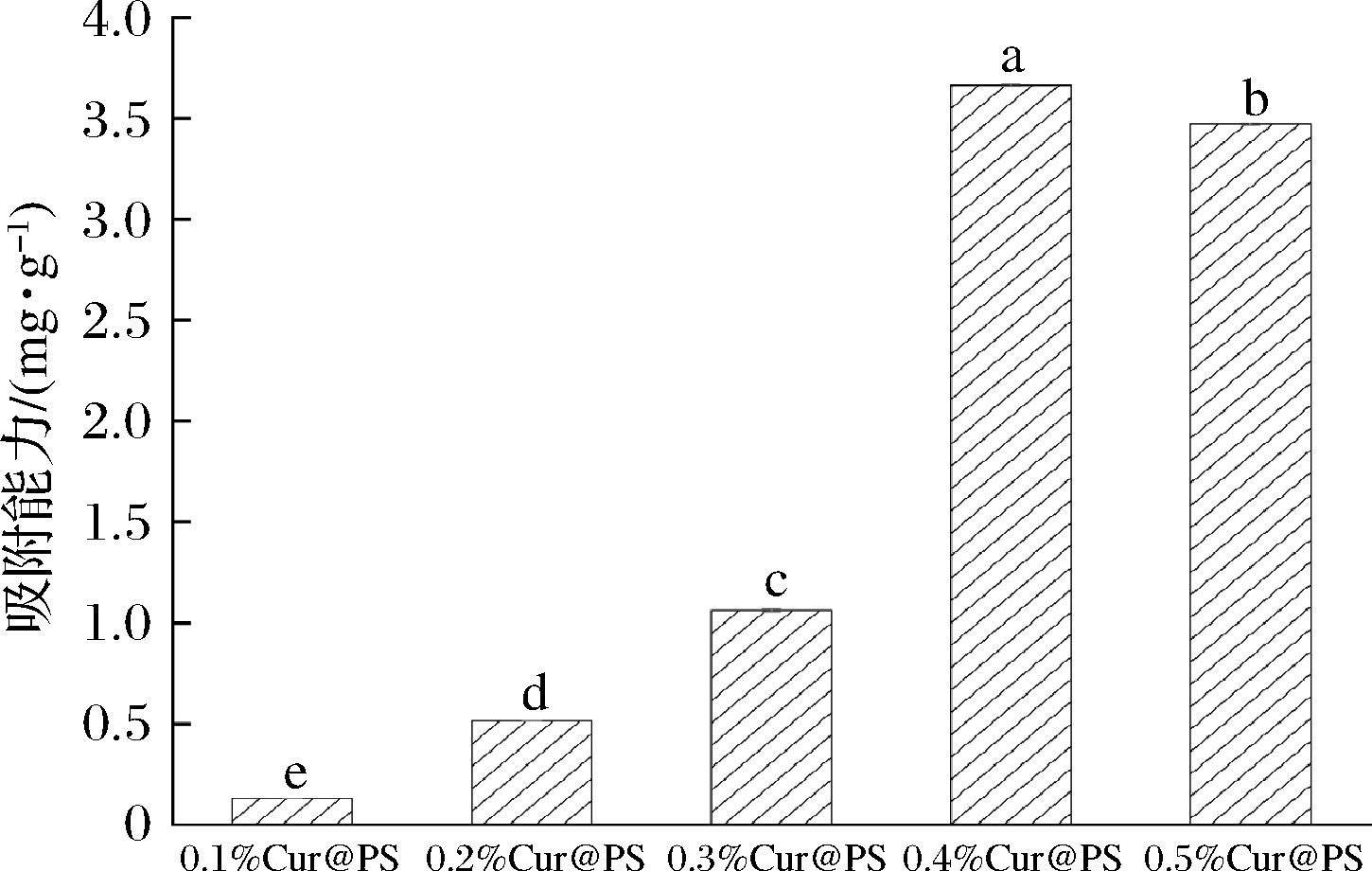
图7 Cur@PS吸附结果
Fig.7 Cur@PS adsorption result
2.7 DPPH自由基清除能力测定
姜黄素具有很强的抗氧化能力,能有效清除DPPH自由基。对于Cur@PS材料来说,保持抗氧化能力并有效释放姜黄素以减少自由基是至关重要的[31]。从图8可以看出,随着姜黄素吸附量的增加,清除自由基的能力也在增强,姜黄素吸附量在0.4%Cur@PS时,清除自由基的能力最高达到85.1%,较0.1%Cur@PS(59.2%)提高约1.4倍,其次为0.5%Cur@PS达到82.9%,0.3%Cur@PS为70.3%,0.2%Cur@PS为68.7%。这与多孔淀粉对姜黄素的吸附能力一致,说明多孔淀粉不但能吸附姜黄素,而且能较好的保留大部分抗氧化能力。

图8 姜黄素及Cur@PS DPPH自由基清除能力
Fig.8 Curcumin and Cur@PS DPPH-based scavenging ability
2.8 体外释放试验
为进一步确定Cur@PS的释放行为,试验设计了0.4%Cur@PS在SGF和SIF中的姜黄素释放试验,结果显示,姜黄素在SIF和SGF中表现出“爆发释放”(图9),这是因为在冷冻干燥除去水分子的方式使样品具有多孔性,易于溶解在溶液中[34]。SIF中的释放较SGF中的快,不同pH值可能是释放速度存在差异的原因,因为姜黄素和淀粉之间的H键很大程度上受环境pH值的影响[35],但在酸性环境中复合物是否更稳定还需进一步研究。在SGF和SIF中,部分姜黄素被吸附在多孔淀粉孔隙中,因此即使延长释放时间也未观察到姜黄素的完全释放,姜黄素与多孔淀粉的结合方式还需更进一步研究。
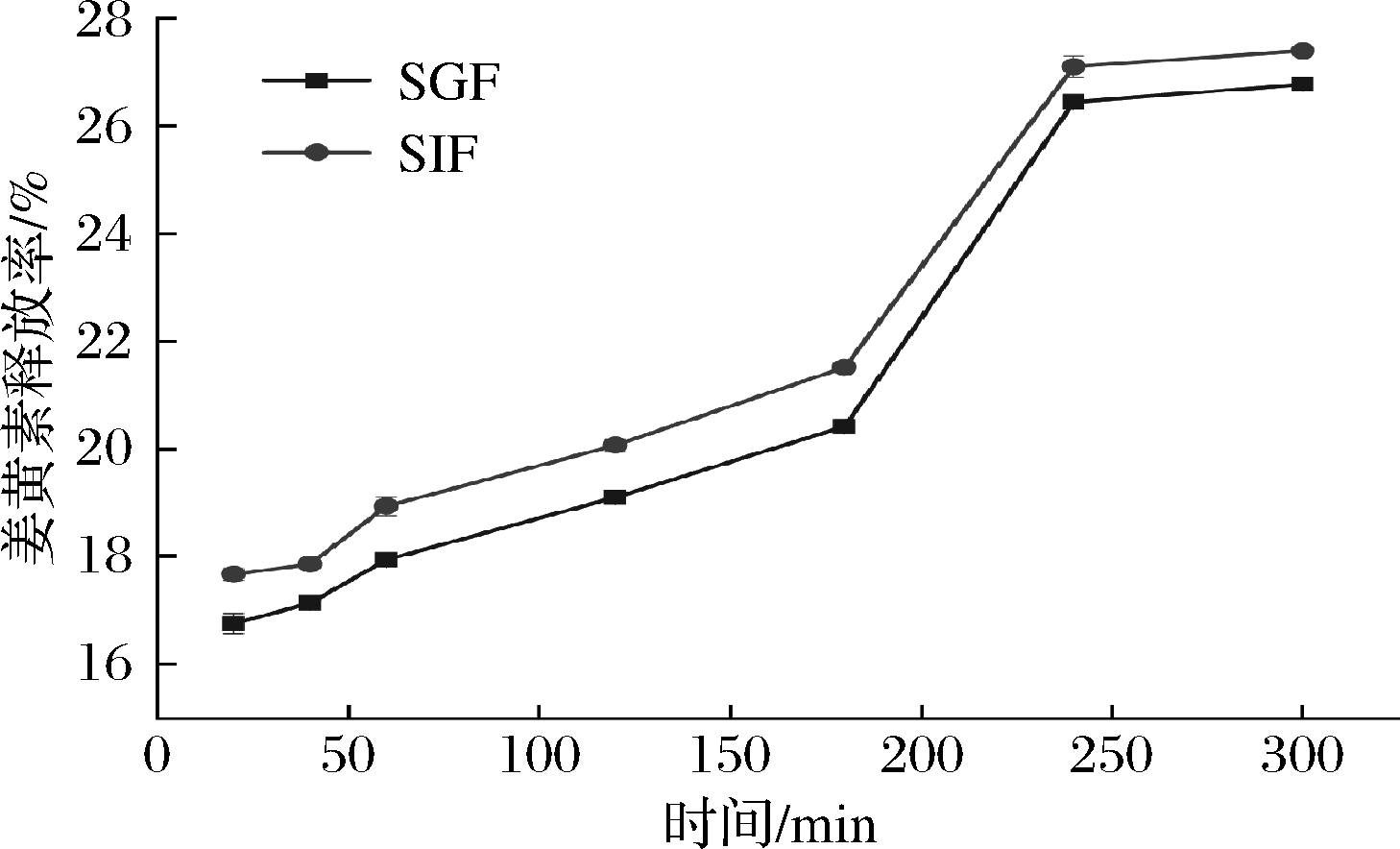
图9 0.4%Cur@PS在SGF和SIF中的释放
Fig.9 Release of 0.4% Cur@PS in SGF and SIF
2.9 水溶性
由于内部氢键的结合,姜黄素在水性介质中具有非常低的溶解度[5]。由图10可知,通过多孔淀粉对姜黄素进行吸附后,其水溶性得到了明显改善,与纯姜黄素相比,Cur@PS水溶性得到了大大的提高。综上,用于姜黄素的多孔淀粉颗粒有望用于食品和相关领域应用。

图10 姜黄素及Cur@PS水溶性检测
Fig.10 Curcumin and Cur@PS water solubility test
3 结论
马铃薯多孔淀粉能较好地吸附姜黄素,吸附量随姜黄素占比而增加,姜黄素吸附量在0.4%Cur@PS时,吸附量达到最大值;姜黄素充填在多孔淀粉的孔隙中及吸附在其表面,使粒径增大,比表面积减小,复合物的水溶性显著提高,也较姜黄素更容易被热分解,能较好地保持抗氧化能力,有利于姜黄素的利用,但在模拟胃液(SGF)和肠液(SIF)中释放效率较低。
[1] ESATBEYOGLU TUBA,HUEBBE PATRICIA,ERNST INSA M A,et al.Rimbach gerald curcumin-from molecule to biological function.[J]. Angewandte Chemie (International Edition),2012,51(22):5 308-5 332.
[2] LEONARDO ACEVEDO-GUEVARA,LEONARDO NIETO-SUAZA,LEIDY T,et al. Development of native and modified banana starch nanoparticles as vehicles for curcumin[J]. International Journal of Biological Macromolecules,2018,111:498-504.
[3] KUNNUMAKKARA A B, ANAND P, AGGARWAL B B. Curcumin inhibits proliferation, invasion, angiogenesis and metastasis of difierent cancers through interaction with multiple cell signaling proteins[J]. Cancer Letters, 2008,269(2):199-225.
[4] ANAND P, KUNNUMAKKARA A B, NEWMAN R A, et al. Bioavailability of curcumin: problems and promises[J]. Mol Ecular Pharmaceutics, 2007,4(6):807-818.
[5] HEGER M, VAN GOLEN R F, BROEKGAARDEN M, et al. The molecular basis for the pharmacokinetics and pharmacodynamics of curcumin and its metabolites in relation to cancers[J]. Pharmacological Reviews, 2014,66(1): 222-307.
[6] ANAND P, KUNNUMAKKARA A B, NEWMAN R A. Bioavailability of curcumin: problems and promises [J]. Molecular Pharmaceutics, 2007,4(6): 807-818.
[7] 李帅,宋少婷,张振显,等.姜黄素缓释载体研究进展[J].上海中医药杂志,2018,52(7):102-104.
[8] 高振珅,王兰. 姜黄素羟丙基-β-环糊精包合物的制备及其性质研究[J].中草药,2012(10):1 951-1 956.
[9] 朱雯洁,黄莉君,叶曾联,等.姜黄素微球制备工艺研究[J].广州化工,2017(23):66-68.
[10] GAO Y, LI Z G,SUN M, et al. Preparation, characterization, pharmacokinetics, and tissue distribution of curcumin nanosuspension with TPGS as stabilizer[J]. Drug Development and Industrial Pharmacy, 2010,36(10):1 225-1 234.
[11] LI J, LEE I W, SHIN G H, et al. Curcumin-Eudragit® E PO solid dispersion: A simple and potent method to solve the problems of curcumin[J]. European Journal of Pharmaceutics and Biopharmaceutics,2015,94:322-332.
[12] ZHANG B, CUI D, LIU M, et al. Corn porous starch: Preparation, characterization and adsorption property[J]. International Journal of Biological Macromolecules, 2012, 50: 250-256.
[13] MEER TARIQUE ALI,RITESH FULE,AJAY SAV,et al. Porous starch: a novel carrier for solubility enhancement of carbamazepine[J]. AAps PharmSciTech,2013,14(3):919-926.
[14] BELINGHERI C, GIUSSANI B, RODRIGUEZ-ESTRADA M T, et al. Oxidative stability of high-oleic sunflower oil in a porous starch carrier[J]. Food Chemistry, 2015, 166: 346-351.
[15] LUO Z, CHENG W, CHEN H, et al. Preparation and properties of enzyme-modified cassava starch-zinc complexes[J]. Journal of Agricultural and Food Chemistry, 2013, 61(19): 4 631-4 638.
[16] MAJZOOBI M, HEDAYATI S, FARAHNAKY A. Functional properties of microporous wheat starch produced by α-amylase and sonication[J]. Food Bioscience, 2015, 11: 79-84.
[17] BELINGHERI CLAUDIA,CURTI ELENA,FERRILLO ANTONIO,et al. Evaluation of porous starch as a flavour carrier[J]. Food & Function,2011,3(3):255-261.
[18] WANG Yufeng,YE Hong,ZHOU Chunhong,et al. Study on the spray-drying encapsulation of lutein in the porous starch and gelatin mixture[J]. European Food Research and Technology,2012,234(1):157-163.
[19] CAI Y. Porous microsphere and its applications[J]. International Journal of Nanomedicine,2013, 8:1 111-1 120.
[20] CHANG P R, YU J G, MA X F. Preparation of porous starch and its use as a structure-directing agent for production of porous zinc oxide[J]. Carbohydrate Polymers, 2011,83: 1 016-1 019.
[21] LI Jinglei,GYE HWA SHIN,IL WOO LEE,et al. Soluble starch formulated nanocomposite increases water solubility and stability of curcumin[J]. Food Hydrocolloids,2016,56:41-49.
[22] 高凤苑,关欣,韩良亮,等.木薯淀粉水凝胶负载姜黄素及缓释性能研究[J].食品与发酵工业,2019,45(11):204-210.
[23] KIM J K, SRINIVASAN P, KIM J H, et al. Structural andantioxidant properties of gamma irradiated hyaluronic acid[J]. Food Chemistry, 2008,109(4): 763-770.
[24] EFSTATHIA I PARAMERA, SPYROS J K. Yeast cells and yeast-based materials for microenca psulation [J].Microencapsulation in the Food Industry,2014,4(23):267-281.
[25] PEREIRA A G B, FAJARDO A R, NOCCHI S, et al.Starch-based microspheres for sustained-release of curcumin: Preparation and cytotoxic effect on tumor cells[J]. Carbohydrate Polymers, 2013,98(1): 711-720.
[26] 张攀峰. 不同品种马铃薯淀粉结构与性质的研究[D].广州:华南理工大学,2012
[27] PETER R CHANG,YU Jiugao,MA Xiaofei. Preparation of porous starch and its use as a structure-directing agent for production of porous zinc oxide[J]. Carbohydrate Polymers,2010,83(2):1 016-1 019.
[28] MOHAN P R K, SREELAKSHMI G, MURALEEDHARAN C V, et al. Water soluble complexes of curcumin with cyclodextrins: Characterization by FT-Raman spectroscopy[J]. Vibrational Spectroscopy, 2012,62: 77-84.
[29] OLGA G, STYLIANI C, IOANNIS R G. Coencapsulation of Ferulic and Gallic acid in hp-b-cyclodextrin[J]. Food Chemistry, 2015,185: 33-40.
[30] 宋菲,王挥,陈卫军,等.差示扫描量热法(DSC)在油脂分析中的应用[J]. 热带农业科学,2014(6):85-88;93.
[31] NEO Y P, RAY S, JIN J, et al. Encapsulation of food grade antioxidant in natural biopolymer by electrospinning technique:A physicochemical study based on zein-gallic acid system[J]. Food Chemistry, 2013,136(2): 1 013-1 021.
[32] TONON R V, PEDRO R B, GROSSO C R, et al. Microencapsulation of flaxseed oil by spray drying: Effect of oil load and type of wall material[J]. Drying Technology, 2012,30: 1 491-1 501.
[33] QIAN Dayan,PETER R, MA Xiaofei. Preparation of controllable porous starch with different starch concentrations by the single or dual freezing process[J]. Carbohydrate Polymers,2011,86(3):1 181-1 186.
[34] O′TOOLE M G, HENDERSON R M, SOUCY P A, et al. Curcumin encapsulation in submicrometer spray-dried chitosan/Tween 20 particles[J]. Biomacromolecules, 2012,13(8): 2 309-2 314.
[35] JIN S P, LIU M Z, ZHANG F, et al. Synthesis and characterization of pH-sensitivity semi-IPN hydrogel based on hydrogen bond between poly(N-vinylpyrrolidone) and poly(acrylic acid)[J]. Polymer, 2006,47(5): 1 526-1 532.