对保健食品中非法添加物的检测,已经从单一化合物检测,逐步发展为多种功效成分同时定性定量分析,并且涉及的非法添加化合物的品种呈递增趋势。与低分辨的三重四极杆质谱不同,高分辨飞行时间质谱能够获得高分辨率的一级质谱信息,以及特征的二级质谱图,目标化合物数量不受限制。利用二级质谱信息建立私人数据库,扩展性强,无需标准品即可实现对多种未知非法添加物的筛查。此外,高分辨质谱数据还可进行回溯研究,实现样品一针进样,样品信息全部记录,后期可依据不同数据库筛选更多目标物质。
常见的化学添加物主要有二甲双胍类降糖药、胰岛素增敏剂、那非类药物等[1-3]。国家市场监督管理总局(原食品药品监督管理局)发布的《保健食品中75种非法添加化学药物的检测》[2017年第138号][4]、《食品中那非类物质的测定》[2018年第14号][5]等相关标准及补充检验方法,覆盖了市面上主要的非法添加药物种类。对于中成药、保健品中的非法添加药物的定性检测,已有相关的文献报道[6-9]。液相色谱-串联质谱法是一种主流的检测手段[10-11],此外,液相色谱法、核磁[12-13]、气质联用法[14]等也被广泛用于非法添加物的定性分析。但是,以上方法需要大量的标准品、或者制备出纯度较高的样品,分析成本高、研究延续性不强,无法应对日益增加的非法添加品种。也有研究采用液相色谱-高分辨质谱法对保健品中的非法添加物进行分析[15-19]。于泓等[19]建立了食品中多种那非类化合物的高分辨质谱定性方法,但灵敏度低、没有建立二级质谱库,方法通用性不强。依据未知峰的高分辨质荷比及同位素丰度比,可获得化合物元素组成信息。对于未知化合物结构信息,可根据其二级质谱进一步判断或进行数据库检索。常见的公共数据库,如Chemspider,包含多达7 000余种化合物的分子式、结构等信息,分子式检索结果多,命中率低,无法借助二级质谱信息缩小筛选范围。因此,自建二级质谱图库,可有效应对同类化合物、同样前处理方式的指定范围的筛查,尤其适用于非法添加的定性分析。
本文基于超高效液相色谱-四极杆飞行时间质谱技术,建立了一种高通量定性检测26种降糖或抗疲劳药物非法添加物的方法,创建了相应的二级质谱库。并将该方法应用于保健品的快速筛查,方法学指标满足相关法规要求。
1 材料与方法
1.1 材料与试剂
甲醇、乙腈,均为色谱纯,德国MERCK公司;甲酸(色谱纯),天津Dikma公司;乙酸铵(色谱纯),美国Sigma-Aldrich公司;超纯水(18.2 MΩ·cm),法国Millipore制水机制备。
盐酸丁二胍、盐酸苯乙双胍、马来酸罗格列酮、盐酸吡格列酮、格列吡嗪、甲苯磺丁脲、瑞格列奈、格列齐特、格列波脲、格列本脲、格列美脲、格列喹酮,美国Sigma-Aldrich公司,纯度均>95%;去甲基卡波地那非、盐酸伐地那非、那红地那非、红地那非、枸橼酸羟基豪莫西地那非、枸橼酸西地那非、豪莫西地那非、丙氧基艾地那非、氨基他达那非、羟丙基去甲基他达那非、N-乙基他达那非、伪伐地那非、那末西地那非、N-去甲基西地那非,德国Dr. Ehrenstorfer公司,纯度均>95%。
1.2 仪器与设备
Nexera超高效液相色谱仪系统—LCMS-9030四极杆飞行时间质谱仪(配备ESI电离源和LabSolutions Ver 5.96色谱工作站),日本岛津公司;涡旋混合仪,美国VORTEX GENIE公司;Beckman 高速冷冻离心机,美国贝克曼公司。
1.3 方法
1.3.1 标准溶液的配制
分别称取26种对照品约10.0 mg,用甲醇定容至10 mL,配制成0.289 9~1.254 6 mg/mL的单标贮备液。以乙腈为溶剂,将26种单标贮备液稀释为1 000倍,即得0.289 9~1.254 6 mg/L的混合标准工作溶液。将上述混合标准工作液用乙腈逐级稀释,系列标准工作溶液浓度分别为L1(0.002 3~0.009 8 mg/L)、L2(0.004 5~0.019 6 mg/L)、L3(0.009 1~0.039 2 mg/L)、L4(0.018 1~0.078 4 mg/L)、L5(0.036 2~0.156 8 mg/L)、L6(0.072 5~0.313 7 mg/L)、L7(0.145 0~0.627 3 mg/L)和L8(0.289 9~1.254 6 mg/L)。
1.3.2 前处理方法
称取0.1 g保健品(片剂研磨粉碎),用1 mL超纯水溶解,振摇1 min,静置10 min,加入4 mL乙腈,超声10 min,12 000 r/min离心5 min,取1 mL上清液,0.22 μm聚四氟乙烯滤膜过滤后进样分析。
1.3.3 液相色谱—质谱条件
色谱条件:流动相:A相为体积分数0.1%甲酸水溶液,B相为体积分数0.1%甲酸乙腈溶液;流速0.4 mL/min;色谱柱:Phenomenex Kinetex C18(2.1 mm I.D. ×100 mm L, 2.6 μm);柱温40℃;洗脱方式为梯度洗脱,B相初始浓度为10%(0~0.3 min),40%~95%(4.0~5.5 min),95%(7.5 min),10%(7.6~10 min),进样体积2 μL。
质谱条件:离子源:ESI(+);接口电压4.5 kV;雾化气3.0 L/min;加热气流量10.0 L/min;干燥气流量10.0 L/min;接口温度300 ℃;DL管温度250 ℃;加热块温度400 ℃;校准方法:外标法校准质量数(调谐液为NaI,质量浓度400 mg/L),分辨率>30 000,质量误差<2×10-6;扫描模式:MS全扫描m/z 100~600、MS/MS(DDA)采集m/z 50~600。
1.3.4 线性范围及检出限、定量限的确定
对系列标准工作溶液进行分析,以一级提取离子流色谱图峰面积(Y)对浓度(X)做标准曲线,并使用LabSolutions软件进行线性拟合,记录标准曲线的方程及线性相关系数。以信噪比S/N=3、S/N=10分别计算方法的检出限、定量限。依据测定结果确定线性范围。
1.3.5 准确度和精密度试验
以标准曲线浓度L6(0.072 5~0.313 7 mg/L)点连续分析6次,考察仪器条件的重复性,并记录保留时间及峰面积的相对标准偏差(relative standard deviations, RSD)。
以阿卡波糖片为空白样品,添加适量的单标贮备液,配制成浓度与标准曲线L5(0.036 2~0.156 8 mg/L)和L7(0.145 0~0.627 3 mg/L)相同的加标样品,按照1.3.2制备,每个样品平行6份。标准曲线法计算空白添加样品的浓度,并以此计算加标回收率及精密度。
1.3.6 数据库的建立
在上述色谱分离条件下对26种非法添加化合物标准溶液进行分析,获得26种化合物的保留时间、精确分子质量以及离子化方式。采集不同碰撞能量(10、20、30、40和50 V)下的目标化合物的二级质谱图,在ACD Labs/2012软件中输入每种化合物的名称、分子式、CAS号、精确相对分子质量和保留时间以及二级质谱图,建立二级质谱库,用于未知物二级质谱图相似度评分。
1.3.7 方法的实际应用
选用市售3份保健品或中成药,其样品前处理和检测方法参照1.3.2和1.3.3,以此评价该方法的实际应用效果。
利用本文建立的前处理和色谱、质谱条件,对3份市售的保健品及中成药(保健品2份,中成药1份)进行分析。
2 结果与分析
2.1 定性分析
根据待测化合物的结构特征,选择正离子模式进行质谱参数的优化。格列苯脲等26种非法添加化合物均能形成[M+H]+准分子离子峰。26种化合物的分子式、精确质荷比等信息如表1所示,其中伪伐地那非与那末西地那非互为同分异构体,经过单标确认,伪伐地那非、那末西地那非保留时间分别为5.52、5.98 min,可实现色谱基线分离。盐酸伐地那非在溶液中呈现离子状态,脱掉了盐酸基团,与豪莫西地那非互为同分异构体,一级精确质荷比均为489.227 85,伐地那非和豪莫西地那非保留时间分别为3.46 min和4.05 min,实现了完全的基线分离。通过精确分子量软件计算26种目标化合物的理论[M+H]+峰,实测质荷比与理论值的偏差均小于2×10-6,优于定性的一般要求(<5×10-6)。26种目标化合物的一级提取离子流图(extracted ion chromatogram,XIC)如图1所示,26种降糖或抗疲劳类化合物分离度良好,通道无干扰。
表1 26种非法添加化合物保留时间、理论质量数、实测质量数和质量数偏差
Table 1 Retention time, theoretical mass, measured mass and mass error of the 26 illegal additives

编号名称分子式CAS号保留时间/min理论[M+H]+实测[M+H]+误差/10-61格列本脲C23H28ClN3O5S10238-21-85.76494.151 10494.150 93-0.342盐酸苯乙双胍C10H15N5834-28-61.55206.140 02206.139 80-1.073盐酸丁二胍C6H15N51190-53-00.79158.140 02158.139 74-1.784马来酸罗格列酮C18H19N3O3S155141-29-03.02358.121 99358.122 351.015格列齐特C15H21N3O3S21187-98-45.55324.137 64324.137 730.296格列喹酮C27H33N3O6S33342-05-15.98528.216 28528.216 09-0.387格列美脲C24H34N4O5S93479-97-15.84491.232 27491.231 98-0.588盐酸吡格列酮C19H20N2O3S112529-15-43.54357.126 74357.126 72-0.059格列吡嗪C21H27N5O4S29094-61-95.29446.185 65446.185 21-1.0010甲苯磺丁脲C12H18N2O3S64-77-75.29271.111 09271.110 70-1.4611格列波脲C18H26N2O4S26944-48-95.65367.168 61367.168 40-0.5712瑞格列奈C27H36N2O4135062-02-15.33453.274 79453.275 210.9313枸橼酸西地那非C22H30N6O4S171599-83-04.03475.212 20475.212 200.0114枸橼酸羟基豪莫西地那非C23H32N6O5S/3.98505.222 77505.222 66-0.2115伪伐地那非C22H29N5O4S224788-34-55.52460.201 30460.201 710.8916氨基他达那非C21H18N4O4385769-84-64.79391.140 08391.139 61-1.2017那红地那非C24H32N6O3949091-38-73.63453.260 87453.260 20-1.4818豪莫西地那非C23H32N6O4S642928-07-24.05489.227 85489.227 63-0.4619那末西地那非C22H29N5O4S371959-09-05.98460.201 30460.201 350.1120红地那非C25H34N6O3831217-01-73.75467.276 52467.276 11-0.8621盐酸伐地那非C23H32N6O4S224785-91-53.46489.227 85489.227 15-1.4422N-去甲基西地那非C21H28N6O4S139755-82-16.01461.196 55461.196 47-0.1823丙氧基艾地那非C24H34N6O4S1391053-82-94.57503.243 50503.243 17-0.6624羟丙基去甲基他达那非C24H23N3O51353020-85-55.08434.171 05434.170 77-0.6525去甲基卡波地那非C23H30N6O3147676-79-73.37439.245 22439.244 52-1.5926N-乙基他达那非C23H21N3O41609405-34-65.38404.160 48404.160 11-0.93

1-盐酸丁二胍;2-盐酸苯乙双胍;3-马来酸罗格列酮;4-去甲基卡波地那非;5-盐酸伐地那非;6-盐酸吡格列酮;7-那红地那非;8-红地那非;9-枸橼酸羟基豪莫西地那非;10-枸橼酸西地那非;11-豪莫西地那非;12-丙氧基艾地那非;13-氨基他达那非;14-羟丙基去甲基他达那非;15-格列吡嗪;16-甲苯磺丁脲;17-瑞格列奈;18-N-乙基他达那非;19-伪伐地那非;20-格列齐特;21-格列波脲;22-格列本脲;23-格列美脲;24-那末西地那非;25-格列喹酮;26-N-去甲基西地那非
图1 26种化合物的提取离子流图
Fig.1 Extracted ion chromatograms of the 26 compounds
通过以上条件的确认,建立了26种非法添加化合物的定性方法。Formula Predictor分子式预测软件可以实现基于一级精确质荷比、同位素丰度比的匹配定性,得分在70分以上,可以判定为疑似非法添加物。以格列喹酮为例,设定Formula Predictor软件的误差范围为5×10-6,元素组成为C、H、O、N、S以及元素数量分别为300、150、12、12、1,加和模式为[M+H]+。结果显示,C27H33N3O6S评分第一,匹配得分95.60,与格列喹酮的元素组成一致。图2为格列喹酮的XIC图。

图2 格列喹酮一级提取离子流图
Fig.2 Extracted ion chromatogram of gliquidone
按照“1.3.6数据库的建立”项下的条件,建立26种化合物的二级质谱图库。将样品的碎片离子信息与二级质谱图库中的碎片离子信息进行匹配,ACD Labs/2012软件根据匹配结果,给出相似度得分。通常,二级匹配得分大于60的非法添加物可判定为目标物。图3为格列喹酮的二级质谱匹配结果,样品主要的特征碎片与谱库中二级质谱图匹配良好,格列喹酮二级匹配得分为70.38。因此,可以确定样品中含有格列喹酮。根据欧盟SANTE/11945/2015指导文件[20],当使用高分辨质谱时,每个离子可以获得2个定性得分。本实验通过全扫描+数据依赖碎片扫描模式获得了一级的精确质荷比和丰富的二级碎片离子信息,格列喹酮二级质谱有16个定性得分,可实现精准确证。
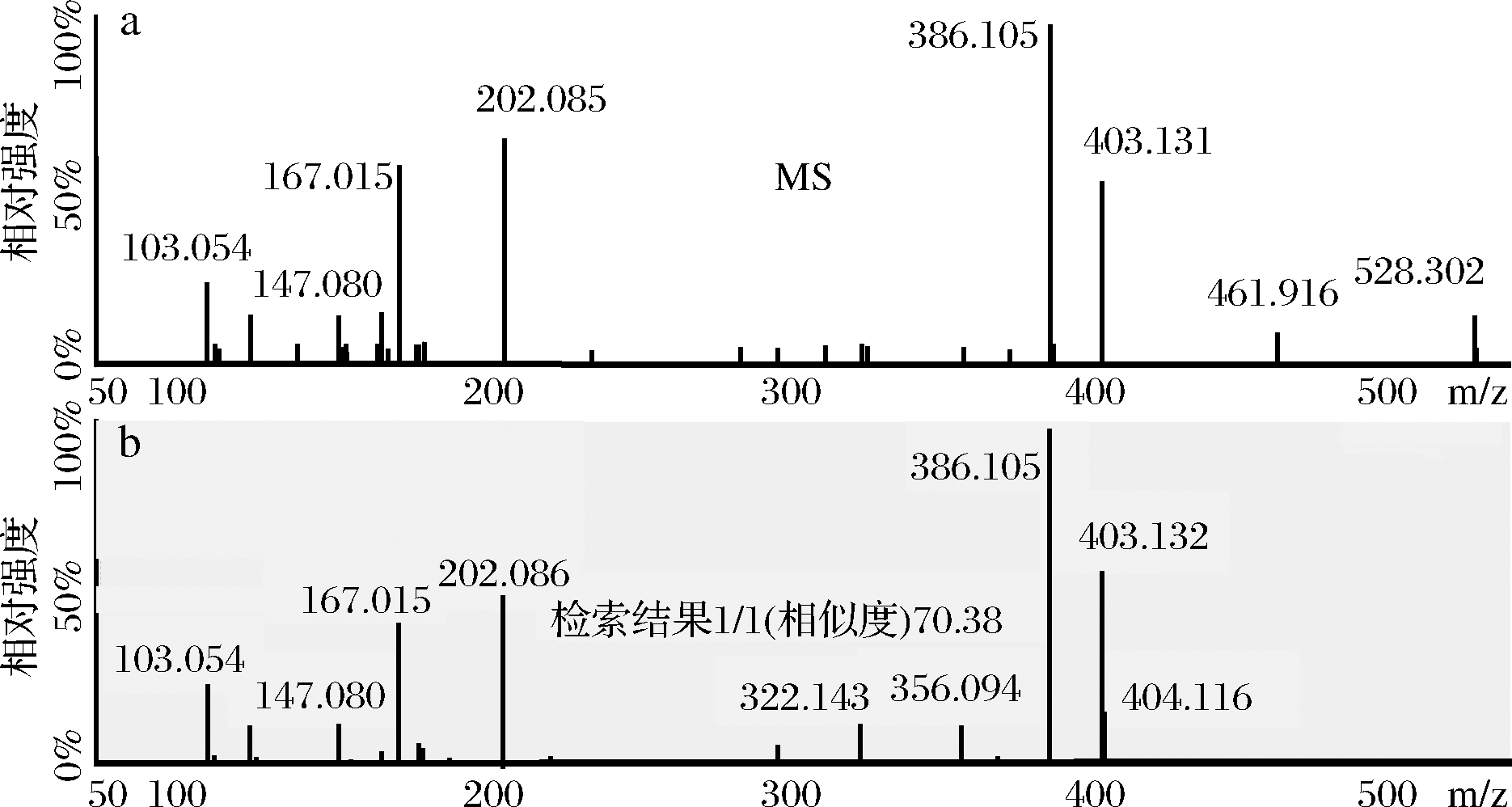
a-样品二级质谱;b-二级质谱库格列喹酮
图3 格列喹酮的二级质谱库检索结果
Fig.3 Search result of gliquidone by fragment ions mass spectrum database
2.2 线性范围、标准曲线、检出限和定量限
本试验采用外标法绘制标准曲线,26种标准物质的线性方程、相关系数、检测限和定量限见表2。
表2 26种非法添加化合物的校准曲线、线性范围、相关系数、检出限及定量限
Table 2 Linear equations, linear ranges, correlation coefficients(r), limits of detection(LOD) and limits of quantification (LOQ) of the 26 illegal additives

名称线性方程线性范围/(mg·L-1)线性相关系数(r)检出限/(mg·L-1)定量限/(mg·L-1)格列本脲Y=127 577X-3 246.920.008 0~1.026 00.999 00.002 60.008 5盐酸苯乙双胍Y=(1.247 40e6)X+6 861.640.008 5~1.087 50.999 40.000 40.001 3盐酸丁二胍Y=420 338X+8 902.940.008 3~1.058 00.997 30.000 10.000 4马来酸罗格列酮Y=(2359 86e6)X+43 425.90.008 5~0.544 10.994 20.000 10.000 4格列齐特Y=820 275X+15 841.90.008 7~1.107 70.996 50.000 10.000 3格列喹酮Y=232 757X-2 294.260.007 4~0.944 40.999 80.000 80.002 5格列美脲Y=71 031.3X-3 142.470.019 6~1.254 60.998 60.007 90.026 2盐酸吡格列酮Y=(3.040 98e6)X+12 422.50.008 0~0.255 60.998 00.000 10.000 4格列吡嗪Y=178 298X-3 075.830.008 4~1.075 40.999 80.001 60.005 3甲苯磺丁脲Y=373 754X+3 157.700.008 8~1.124 80.998 40.000 40.001 4格列波脲Y=634 501X-4 994.640.007 7~0.493 50.999 90.000 60.001 9瑞格列奈Y=(2.764 61e6)X+51 262.20.008 3~0.533 80.991 50.000 10.000 2枸橼酸西地那非Y=206 052X-4 344.840.015 3~0.244 10.995 70.004 40.014 6枸橼酸羟基豪莫西地那非Y=20 008.3X-2 601.210.128 7~1.029 90.994 00.010 90.036 1伪伐地那非Y=(2.535 27e6)X+8 896.530.005 5~0.352 30.998 50.000 00.000 1氨基他达那非Y=305 600X-6 606.660.016 0~1.021 60.999 80.001 60.005 3那红地那非Y=539 834X-2 375.430.008 6~0.547 70.999 50.000 70.002 3豪莫西地那非Y=740 037X-6 431.580.007 0~0.900 40.999 90.000 40.001 3那末西地那非Y=(1.451 20e6)X+16 732.70.006 1~0.775 70.996 60.000 10.000 2红地那非Y=730 542X+485.2430.004 9~0.628 20.999 00.000 30.001盐酸伐地那非Y=310 957X-218.1650.004 0~0.510 40.997 60.000 80.002 5N-去甲基西地那非Y=864 945X-2 598.040.003 1~0.395 60.999 90.000 40.001 4丙氧基艾地那非Y=203 136X-3 623.760.009 1~0.289 90.996 60.008 30.027 5羟丙基去甲基他达那非Y=245 975X-5 543.240.013 2~0.422 40.998 00.006 50.021 6去甲基卡波地那非Y=410 408X-6 828.310.010 8~0.344 60.998 40.001 70.005 6N-乙基他达那非Y=272 124X+432.9480.006 4~0.411 10.994 90.000 40.001 4
在各自线性范围内,26种目标化合物线性关系良好,相关系数r均达到0.99以上,检出限为0.000 1~0.010 9 mg/L,定量限为0.000 1~0.036 1 mg/L。
2.3 重复性实验
标准曲线浓度L6(0.072 5~0.313 7 mg/L)点按照1.3.3条件重复进样6次,结果显示,面积的RSD小于5%(表3),除了二甲双胍类降糖药保留较弱,出现了一些保留时间漂移,其余化合物保留时间的RSD均小于1.6%。
表3 26种非法添加化合物的保留时间及峰面积的相对标准偏差(n=6)
Table 3 RSDs of retention times and peak areas of the 26 illegal additives (n=6)

名称保留时间/min保留时间RSD/%面积RSD/%格列本脲5.7600.222.15盐酸苯乙双胍1.5463.831.16盐酸丁二胍0.7903.531.59马来酸罗格列酮3.0201.540.90格列齐特5.5540.241.68格列喹酮5.9780.200.81格列美脲5.8410.213.47盐酸吡格列酮3.5411.060.50格列吡嗪5.2910.241.55甲苯磺丁脲5.2910.273.00格列波脲5.6520.231.39瑞格列奈5.3290.231.54枸橼酸西地那非4.0300.603.78枸橼酸羟基豪莫西地那非3.9790.583.95伪伐地那非5.5200.231.69氨基他达那非4.7930.570.92那红地那非3.6250.861.54豪莫西地那非4.0450.620.67那末西地那非5.9760.200.65红地那非3.7450.761.21盐酸伐地那非3.4550.933.35N-去甲基西地那非6.0120.200.83丙氧基艾地那非4.5740.603.21羟丙基去甲基他达那非5.0840.374.54去甲基卡波地那非3.3671.081.28N-乙基他达那非5.3770.221.97
2.4 回收率及精密度实验
将不同质量浓度的标准液添加至阿卡波糖片中,制备不同添加浓度的样品,采用UHPLC-Q-TOF-MS法检测样品中26种目标物的回收率及RSD,每个浓度平行测定6次。结果显示,26种目标物的回收率为75.8%~128.4%之间,6份平行样品浓度的RSD均小于4%,具体结果见表4。
2.5 方法的实际应用
为证实本方法的实际应用价值,选用3份样品为研究对象,其中2份阴性对照和1份阳性对照作为本试验的质量控制样品。试验结果(图4)表明,阳性样品中m/z 475.2122通道色谱峰保留时间为3.979 min,初步判断含有西地那非。二级质谱库检索,与西地那非相似度得分77.13,匹配度较高,说明该阳性对照检出西地那非。
表4 空白加标的回收率及相对标准偏差
Table 4 Recoveries and RSDs of spiked samples

名称L5回收率/%浓度RSD/%L7回收率/%浓度RSD/%格列本脲97.80.597.70.5盐酸苯乙双胍110.31.093.71.2盐酸丁二胍98.30.71000.7马来酸罗格列酮96.20.7100.41.4格列齐特92.80.796.80.4格列喹酮98.30.898.7 0.5格列美脲103.10.9101.90.6盐酸吡格列酮96.40.795.41.8格列吡嗪95.90.4100.80.8甲苯磺丁脲97.51.2101.80.7格列波脲105.30.798.30.8瑞格列奈970.397.50.6枸橼酸西地那非75.82.2128.41.2枸橼酸羟基豪莫西地那非78.73.987.11.3伪伐地那非92.10.795.50.6氨基他达那非100.51.31031.3那红地那非87.21.491.90.7豪莫西地那非91.91.2970.4那末西地那非93.70.796.60.5红地那非92.60.9960.9盐酸伐地那非87.22.795.51.3N-去甲基西地那非93.40.795.10.8丙氧基艾地那非91.91.797.30.7羟丙基去甲基他达那非109.40.4109.50.8去甲基卡波地那非110.41.7111.90.9N-乙基他达那非881.293.10.5

图4 m/z为475.212 2的样品提取离子流图
Fig.4 Extract ion chromatogram of m/z 475.212 2
3 结论
本研究采用UHPLC-Q-TOF-MS技术,建立了26种降糖及抗疲劳药物的筛查方法。结果表明,26种降糖或抗疲劳类化合物分离度良好,通道无干扰。在各自线性范围内,相关系数r均达到0.99以上,检出限为0.000 1~0.010 9 mg/L,定量限为0.000 1~0.036 1 mg/L。回收率为75.8%~128.4%之间,6份平行样品浓度的RSD均小于4%,确认了目标化合物一级精确质荷比、保留时间、同位素丰度比等信息,建立了二级谱库,并应用于实际样品的分析。该方法回收率高、精密度良好、准确度高,可以满足降糖和抗疲劳类中成药和保健食品的非法添加物的筛查。本方法对于中成药和保健食品的质量安全控制具有重要意义。
[1] 陈斌,胡昭君,余岳林,等.中成药和保健食品中非法添加西药成分检测方法的探索[J].药物分析杂志,2009,29(10): 1 677-1 680.
[2] 李丹,文红梅,崔福春,等.LC-MS/MS法快速测定中成药、保健食品中非法添加的36种化学成分[J].药物分析杂志,2010,30(8):1 527-1 532.
[3] 李锐,陈国彪.UPLC-Q-TOF-MS法快速检测补肾壮阳类中成药中11个PDE5型抑制剂类药物[J].药物分析杂志,2014,34(5):879-884.
[4] 国家食品药品监督管理总局. 总局关于发布《保健食品中75种非法添加化学药物的检测》等3项食品补充检验方法的公告[EB/OL].(2017-11-24). http://samr.cfda.gov.cn/WS01/CL1975/222129.html.
[5] 市场监管总局.市场监管总局关于发布《食品中那非类物质的测定》食品补充检验方法的公告[2018年第14号][J].中国食品卫生杂志,2018,30(4):90.
[6] 郑文燕,李哲,陈梅,等.LC-MS/MS法检测中成药及保健品中减肥和降糖类的非法添加药物[J].沈阳药科大学学报,2018,35(1):58-66.
[7] 严爱花,李贤良,郗存显,等.液相色谱-串级质谱法同时检测中成药及保健食品中非法添加的22种苯二氮卓类药物[J].分析化学,2013,41(4):509-516.
[8] 许凤,冯钰,付双,等.薄层色谱-显微红外光谱(TLC-Micro IR)联用技术检测减肥保健食品中非法添加盐酸芬氟拉明[J].中国医院药学杂志,2016,36(5):358-361.
[9] 张建丽,王占良,张亦农.LC-MS/MS法定性检测保健品中非法添加的降糖药[J].质谱学报,2009,30(5):271-274.
[10] 汪鑫,陈蓉.液相色谱-串联质谱法同时检测膏霜类化妆品中的41种禁用抗感染药物[J].中国药师,2018,21(8):1 388-1 392.
[11] 张建丽,王小兵.LC/MS和LC-MS/MS定性检测保健品中非法添加的伐地那非[J].质谱学报,2009,30(4):219-222.
[12] 仇镇武,叶汝汉,柳亚玲,等.一种新西地那非类似物的结构确证[J].分析测试学报,2013,32(4):488-493.
[13] 张志强,王丽娟,安东各,等.保健食品中壮阳类西药成分的核磁共振氢谱定量分析[J].分析测试学报,2017,36(2):257-261.
[14] 林芳,王一欣,李涛,等.安神类保健食品中新型非法添加药物的检测研究[J].食品安全质量检测学报,2016,7(4):1 631-1 636.
[15] 王骏,宿书芳,胡梅,等.超高效液相色谱-四极杆/飞行时间质谱筛查水果罐头中37种食品添加剂[J].食品与发酵工业,2017,43(11):212-219.
[16] 胡莉,雷绍荣,郭灵安,等.液相色谱-离子阱-飞行时间质谱法定性分析未知着色剂[J].分析化学,2013,41(1):110-114.
[17] 于泓,胡青,孙健.等.超高效液相色谱-四极杆-飞行时间质谱法定性筛查保健食品中西地那非及其相关功效类非法添加化合物[J].色谱,2018,36(10):1 005-1 017.
[18] 郭晶晶,朱克卫,郑思珩,等.进口葡萄酒相关农药污染物的筛查及其本底值的定量分析[J].食品与发酵工业,2017,43(1):196-202.
[19] 于泓,胡青,孙健.等.超高效液相色谱-四极杆-飞行时间质谱法定性筛查保健食品中西地那非及其相关功效类非法添加化合物[J].色谱,2018,36(10):1 005-1 017.
[20] European Commission Decision. SANTE/11945/2015 implementing Council Directive Supersedes SANCO/12571/2013 concerning guidance document on analytical quality control and method validation procedures for pesticides residues analysis in food and feed, April 2016, http://ec.europa.eu/food/plant/docs/plant pesticides mrl guidelines wrkdoc_11945_en.pdf.