食品添加剂分为化学合成物质和天然物质两大类,合成添加剂的毒性大于天然添加剂,尤其在添加剂本身质量不纯,混有有害物质或超量使用时很容易对人体造成危害,而食品业使用的绝大多数添加剂是化学合成物质,甜蜜素就是人工合成的一种甜味添加剂,它的甜度为蔗糖的30~50 倍,现被广泛用于糕点、饮料及其他食品中。由于过度使用甜蜜素,会对人体造成一定危害,如引起人体病变,出现畸形、癌症、损坏肾功能等,因此,我国食品安全标准GB 2760 中对甜蜜素在食品中的使用范围和使用限量作了明确规定,如面包和糕点中甜蜜素不得大于1.6 g/kg,饼干和饮料中甜蜜素不得大于0.65 g/kg,尽管如此,食品业的超限量、超范围违规使用仍时有发生。目前,国内外对食品中甜蜜素的研究方法主要有:高效液相色谱法[1-4]、气相色谱法[5-7]、分光光度法[8-9]、电化学法[10-13]、液-质联用法[14-19] 及气-质联用[20] 等。我国食品安全国家标准GB 1886.37—2015对甜蜜素的检测方法为高氯酸滴定法,此法所用的部分试剂具有毒性或腐蚀性,所用的溶剂冰乙酸就是一种酸性腐蚀性物质,有强烈的刺激性,对人体健康有一定危害;而滴定剂高氯酸不仅具有毒性、强的腐蚀性,还具有燃烧爆炸的危险性。而现在研究较多的高效液相色谱法、气相色谱法及液-质、气质联用等对样品的前处理工作较为繁琐、尤其是净化处理耗时较多。分光光度法虽操作简便,有较高的准确度和精密度,但灵敏度和选择性欠佳。电化学法的条件要求较为苛刻。基于此,研究简便、快速、灵敏的甜蜜素检测方法很有必要。本实验采用高灵敏共振光散射技术,借维多利亚蓝B 与甜蜜素反应生成离子缔合物,使显著增强的共振光散射信号与甜蜜素的质量浓度呈线性关系,建立了测定低脂、低蛋白类焙烤食品及饮料中甜味添加剂——甜蜜素的检测方法,该方法目前尚未见文献报道。
1 材料与方法
1.1 材料与试剂
甜蜜素(cyclamate)标准物质:GBW(E)100066,99.3%,中国食品药品检定研究院;维多利亚蓝B(victoria blue B):99%,武汉易泰科技有限公司上海分公司;三羟甲基氨基甲烷(tris):99.9%,上海吉至生化科技有限公司;盐酸:AR级,重庆川东(化工)集团有限公司;样品:面包(1#)、饼干(2#)、果味饮料(3#)、可乐型碳酸饮料(4#),市售。
甜蜜素标准溶液:贮备液为1.00×10-3 mol/L水溶液,操作液由贮备液稀释配制成1.00×10-5 mol/L水溶液,冰箱4 ℃保存。维多利亚蓝B溶液:贮备液为1.00×10-3 mol/L水溶液,操作液由贮备液稀释配制成1.00×10-4 mol/L水溶液;Tris-HCl 溶液:由Tris 溶液和HCl 溶液混合,用pH 计测定,配成pH 3.0~9.8的系列溶液。
1.2 仪器与设备
F-2500型荧光分光光度计,日本日立公司;EL104型电子天平,上海精密仪器仪表有限公司;TD5A-WS 型离心机,湖南湘仪离心机仪器有限公司;KQ-200VDE 超声波清洗机,昆山市超声仪器有限公司;pHS-3C 型精密酸度计,上海虹益仪器仪表有限公司。
1.3 样品处理
准确称取已粉碎、混匀的低脂、低蛋白面包及饼干样品各2~3 g(精确至±0.000 1 g),加适量水,搅拌、浸提10 min,再超声20 min、离心(4 500 r/min)5~10 min,上清液用水定容至100 mL,得到待测液1# 和2#。
准确移取3#和4#饮料各10.00 mL,在温热水浴中超声20 min,用水定容至500 mL,得到待测液3#和4#。
1.4 实验方法
于10 mL 具塞比色管中,准确加入2.50 mL 维多利亚蓝B 操作液、1.50 mL pH 9.27 Tris-HCl 溶液及0.00~2.00 mL 甜蜜素标准操作液,用水稀释至刻度,摇匀。静置20 min 后,在荧光分光光度计上设λex=λem=220 nm,狭缝5 nm,扫描共振光散射光谱,在光谱曲线的特征峰369 nm 处测定体系溶液的共振光散射强度IRLS及试剂空白的共振光散射强度I0,再由IRLS - I0 求得体系溶液的共振光散射增强强度ΔIRLS。
2 结果与讨论
2.1 甜蜜素与维多利亚蓝B 的RLS 光谱特征
从图1可知,单独的甜蜜素标准操作液的RLS 信号非常微弱,如曲线1所示。

1-1.00×10-6 mol/L 甜蜜素; 2-2.50×10-5 mol/L 维多利亚蓝B; 3~7-0.00、0.50×10-6、1.00×10-6、1.50×10-6、2.00×10-6 mol/L 甜蜜素,2.50×10-5 mol/L 维多利亚蓝B,pH 9.27混合液
图1 甜蜜素与维多利亚蓝B 的共振光散射光谱
Fig.1 The resonance light scattering spectra of cyclamate and victoria blue B
单独的维多利亚蓝B 操作液的RLS 信号较弱,在400 nm 处有一最大散射峰,如曲线2所示。当在维多利亚蓝B 操作液中加入Tris-HCl(pH 9.27)溶液后,RLS 信号显著增强,如曲线3所示。在曲线3 溶液的基础上加入0.00~2.00 mL 的甜蜜素标准操作液,从曲线3~7可知,光谱曲线在369 nm 处有一最大特征散射峰,此峰与单独的维多利亚蓝B 相比较,红移31 nm。在体系溶液的特征峰处,一定浓度范围的甜蜜素的质量浓度(或物质的量浓度)与体系溶液的共振光散射增强强度ΔIRLS呈线性关系。故选择369 nm 作为测定波长,用于甜蜜素的定量分析。
2.2 适宜条件的选择
2.2.1 反应酸度
取甜蜜素标准操作液1.00 mL、维多利亚蓝B操作液2.00 mL时,按1.4 节方法考察1.00 mL pH 3.0~9.8 范围的Tris-HCl 溶液对甜蜜素-维多利亚蓝B 体系ΔIRLS 的影响,结果见图2。从ΔIRLS-pH 曲线可知,甜蜜素与维多利亚蓝B 反应所需加入的Tris-HCl溶液的pH为9.27,当加入的溶液的pH>9.27或<9.27时,体系的ΔIRLS 均有不同程度降低,pH 9.27 时,体系的ΔIRLS较大,灵敏度较高。故实验选用pH 9.27 Tris-HCl 溶液来控制该反应的酸度。
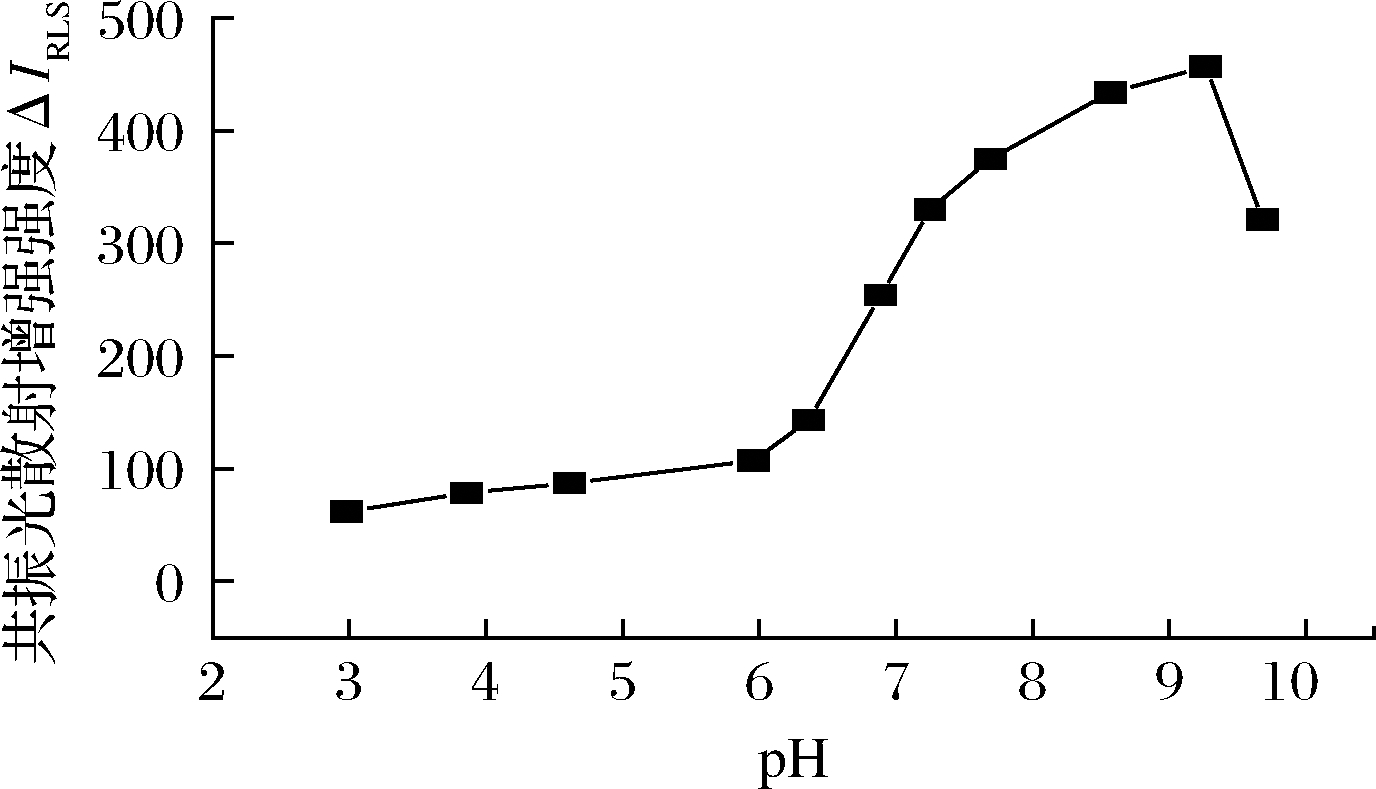
图2 Tris-HCl 溶液酸度对ΔIRLS的影响
Fig.2 Effect of Tris-HCl solution acidity on ΔIRLS
2.2.2 Tris-HCl 溶液(pH 9.27)的用量
取甜蜜素标准操作液1.00 mL、维多利亚蓝B操作液2.00 mL,按1.4 节方法考察0.50~3.00 mL 范围的pH 9.27 Tris-HCl 溶液对甜蜜素-维多利亚蓝B 体系ΔIRLS 的影响,结果见图3。
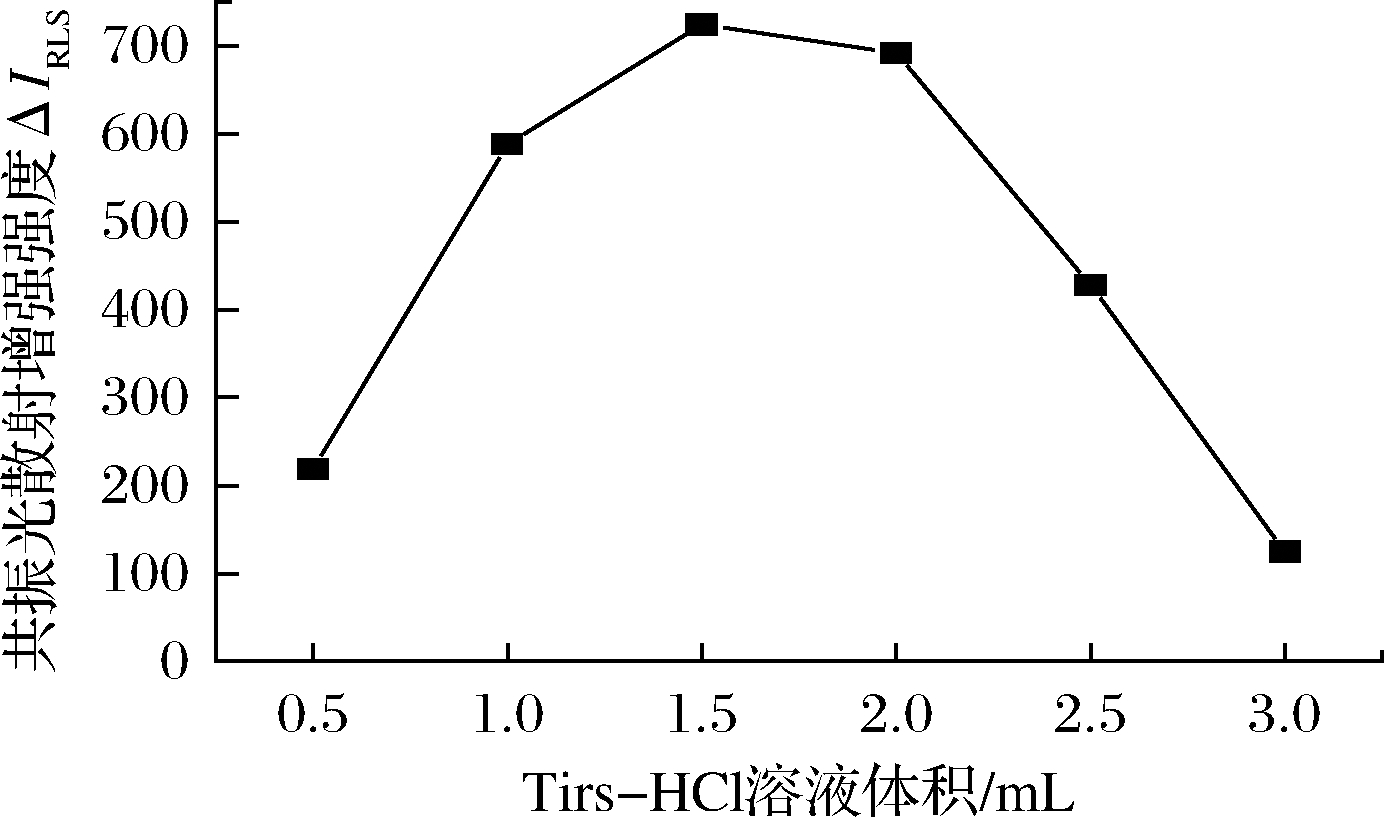
图3 Tris-HCl(pH 9.27)用量对ΔIRLS的影响
Fig.3 Effect of pH 9.27 Tris-HCl on ΔIRLS
从ΔIRLS-VpH 9.27 曲线可知,甜蜜素与维多利亚蓝B 反应所需加入Tris-HCl溶液(pH 9.27)的最适用量为1.50 mL,溶液用量大于或小于1.50 mL,体系的ΔIRLS 均有不同程度下降。故实验选择体系灵敏度最大时的Tris-HCl(pH 9.27)溶液用量为1.50 mL。
2.2.3 维多利亚蓝B 浓度
取甜蜜素标准操作液1.00 mL、pH 9.27 Tris-HCl 溶液1.50 mL,按1.4 节方法考察0.50~3.00 mL 范围的维多利亚蓝B 操作液对甜蜜素-维多利亚蓝B 体系ΔIRLS 的影响,结果见图4。从ΔIRLS-c维多利亚蓝B 曲线可知,维多利亚蓝B 的最适浓度为2.50×10-5 mol/L(即维多利亚蓝B 操作液的最适用量为2.50 mL),当维多利亚蓝B 浓度大于或小于该值时,体系ΔIRLS 均有不同程度下降,当<2.50×10-5 mol/L 时,维多利亚蓝B 用量不够,与甜蜜素反应不完全;当>2.50×10-5 mol/L 时,又因维多利亚蓝B 过量使自身聚集作用增强从而影响与甜蜜素间的反应,灵敏度随之下降。故实验选择体系灵敏度最大时的维多利亚蓝B 溶液的浓度即2.50×10-5 mol/L。

图4 维多利亚蓝B 浓度对ΔIRLS 的影响
Fig.4 Effect of victoria blue B concentration on ΔIRLS
2.2.4 试剂加入顺序
取甜蜜素标准操作液1.00 mL、pH 9.27 Tris-HCl 溶液1.50 mL、维多利亚蓝B 操作液2.50 mL,按1.4 节方法考察这几种物质在加入顺序不同时对体系ΔIRLS 的影响。结果显示,这几种物质加入的先后顺序对甜蜜素与维多利亚蓝B 反应的ΔIRLS有一定影响。当加入顺序为维多利亚蓝B 溶液、Tris-HCl 溶液、甜蜜素溶液时,体系的ΔIRLS=1315(相对于其他加入顺序,该顺序的ΔIRLS 最大),灵敏度相对其他顺序最高。故实验选择此最佳顺序加入各物质。
2.2.5 反应时间及稳定性
按上述选定的最佳条件,考察甜蜜素与维多利亚蓝B 的反应在5~100 min 范围内对体系ΔIRLS的影响。结果显示,反应从开始至20 min 时,随着反应时间的增加,体系ΔIRLS逐渐增大,表明此时间段的反应并未完全;当反应至20~70 min 范围,随着反应时间的增加,体系的ΔIRLS 不再增大,基本处于稳定状态,表明此时间段内反应已完全,并可稳定50 min;当反应至70 min 后,体系的ΔIRLS随时间的增加而逐渐下降,表明生成的新物质在此段时间已不再稳定。故测定时间选在新物质稳定时间段内进行。
2.3 工作曲线及相关参数
按1.4 节的实验方法,配制0.00、0.50、1.00、1.50、2.00 mL 甜蜜素标准操作液的标准系列溶液,扫描RLS 光谱,作甜蜜素的标准曲线,见图5。该方法的一元线性回归方程为ΔIRLS=14.20+7 038 ρ,相关系数r=0.999 7,线性范围为0.004~0.4 mg/L,检出限为0.003 5 mg/L,面包和饼干的定量限为2.69 mg/100 g,饮料的定量限为29.2 mg/L。

图5 甜蜜素的标准曲线
Fig.5 Standard curve of cyclamate
2.4 离子强度的影响
室温下,考察了不同质量浓度的NaCl 溶液对体系ΔIRLS 的影响。结果显示,7 400 倍的NaCl 溶液对甜蜜素的测定无影响。故离子强度不影响甜蜜素的测定。
2.5 共存物质的影响
室温下,考察了某些外来物质对测定0.201 mg/L 甜蜜素的影响。结果显示,相对误差≤±5%时,500 倍的![]() 组氨酸、L-谷氨酸、L-丙氨酸、L-色氨酸、葡萄糖、麦芽糖、蔗糖、柠檬酸三钠,200 倍的L-赖氨酸、L-白氨酸、L-亮氨酸、甘氨酸、L-异亮氨酸、乳糖
组氨酸、L-谷氨酸、L-丙氨酸、L-色氨酸、葡萄糖、麦芽糖、蔗糖、柠檬酸三钠,200 倍的L-赖氨酸、L-白氨酸、L-亮氨酸、甘氨酸、L-异亮氨酸、乳糖![]() 倍的柠檬酸、苹果酸、山梨酸、酒石酸、尿素、淀粉、维生素B12、安赛蜜
倍的柠檬酸、苹果酸、山梨酸、酒石酸、尿素、淀粉、维生素B12、安赛蜜![]() 等不干扰测定。故本法有很好的选择性。
等不干扰测定。故本法有很好的选择性。
2.6 样品分析
准确移取各待测液0.20 mL 代替1.4节实验方法中的甜蜜素标准操作液,加入最佳条件下的维多利亚蓝B 和Tris-HCl 溶液,用水定容至10 mL。按实验方法测定面包、饼干及饮料中的甜蜜素含量,并与GB 1886.37—2015比较。从表1数据可知,测定结果与GB法基本一致,统计学检验结果表明新方法具有可靠性。
表1 面包、饼干及饮料的分析结果
Table 1 Analysis results of bread, biscuit and beverage samples

样品测得值×104/mg测得样品平均值(n=5)RSD/%国标法测得值(n=5)显著性检验F检验t检验定量限1#6.75156 mg/kg1.3154 mg/kg 2.89
加标回收试验:准确称取1#和2#已粉碎、混匀的面包、饼干样品各3份,每份2~3 g(精确至±0.000 1 g),分别置于小烧杯中;准确移取3#和4#饮料各3份,每份10.00 mL,分别置于小烧杯中。在1#~4#的小烧杯样液中,分别往同一样液的3份烧杯中加入0.50、1.50和3.00 mL甜蜜素贮备液,后续操作按1.3节样品处理方法进行,制得各待测液。取各待测液0.20 mL,按实验方法测定各待测液中甜蜜素的含量(n=5),求回收率,以判断方法的准确度。结果见表2。表2中加标回收率和相对标准偏差表明新方法有较高的准确度和精密度。
表2 面包、饼干及饮料的回收试验(n=5)
Table 2 Recovery test of bread, biscuit and beverage samples (n=5)

样品本底值×104/mg加标量×104/mg测得平均值×104/mg平均回收率/%相对标准偏差/%1#6.752.016.0412.18.8112.919.21021021031.82.22.02#1.982.016.0412.13.947.8913.897.597.897.72.52.32.33#4.882.016.0412.16.8510.816.898.098.098.52.22.62.54#3.512.016.0412.15.509.5015.599.099.299.11.82.12.0
3 结论
维多利亚蓝B-甜蜜素体系用于食品中甜蜜素的测定,该方法具有操作简单、灵敏度高、选择性好等优点,准确度和精密度满足定量分析要求,并有较宽的线性范围。测定结果的准确度与国标法相比无显著性差异。本方法适用于焙烤食品中低脂低蛋白的面包、饼干及饮料中甜蜜素的快速测定。
[1] LI J J, LIU Y, LIU Q P, et al. On-cartridge derivatisation using matrix solid phase dispersion for the determination of cyclamate in foods [J]. Analytica Chimica Acta, 2017,972:46-53.
[2] 刘刚,雷激,钟红霞,等.高效液相色谱蒸发光散射法测定白酒中8种甜味剂的研究[J].食品科技,2017,42(7):300-304.
[3] LIU T H, JIANG Z T, LI R, et al. Simultaneous determination of cyclamate, acesulfame, and aspartame in beverages by titania-based RP-HPLC [J]. Food Analytical Methods, 2014,7(7):1 400-1 406.
[4] EDGAR Y O, JOSE B Q, ROSARIO R, et al. Determination of artificial sweeteners in sewage sludge samples using pressurised liquid extraction and liquid chromatography-tandem mass spectrometry [J]. Journal of Chromatography A, 2013, 1 320: 10-16.
[5] 程春梅,苏建国.气相色谱内标法测定蜜饯中的甜蜜素含量[J].食品研究与开发,2019,40(5):182-185.
[6] YU S B, ZHU B H, LV F, et al. Rapid analysis of cyclamate in foods and beverages by gas chromatography-electron capture detector (GC-ECD) [J]. Food Chemistry, 2012,134(4):2 424-2 429.
[7] MAHDI H, ALI H, NARGES J. Determination of cyclamate in artificial sweeteners and beverages using headspace single-drop microextraction and gas chromatography flame-ionisation detection [J]. Food Chemistry, 2010,124(3):1 258-1 263.
[8] KARINA A A, KARLA I D J F, ELIZABETH C L, et al. Determination of cyclamate by a cheap and simple spectrophotometric method [J]. Journal of Food Measurement and Characterization, 2017,11(2):879-886.
[9] 王秀玲,叶升锋,桑华春.食品中甜蜜素的快速测定[J].食品研究与开发,2015,36(7):98-99;114.
[10] YANG L R, ZHOU S J, XIAO Y Z, et al. Sensitive simultaneous determination of three sulfanilamide artificial sweeters by capillary electrophoresis with on-line preconcentration and contactless conductivity detection [J]. Food Chemistry, 2015,188:446-451.
[11] JACQUELINE P V, MARESSA D D, LUCIANO V, et al. Sub-minute method for simultaneous determination of aspartame, cyclamate, acesulfame-K and saccharin in food and pharmaceutical samples by capillary zone electrophoresis [J]. Journal of Chromatography A, 2015,1396:148-152.
[12] MARKO S, THANH D M, PETER C H. Determination of artificial sweeteners by capillary electrophoresis with contactless conductivity detection optimized by hydrodynamic pumping [J]. Analytica Chimica Acta, 2013,787:254-259.
[13] PIERINI G D, LLAMAS N E, FRAGOSO W D, et al. Simultaneous determination of acesulfame-K and aspartame using linear sweep voltammetry and multivariate calibration [J]. Microchemical Journal, 2013, 106: 347-350.
[14] DAIMON T, SAITO K, TAKAHASHI K, et al. Validation study of rapid analytical method for determination of cyclamate in various kinds of foods by LC-MS/MS [J]. Shokuhin Eiseigaku Zasshi. 2019,60(3):68-72.
[15] TANG J W, YUAN L J, XIAO Y, et al. Simultaneous determination of nine artificial sweeteners in food by solid-phase extraction coupled with high performance liquid chromatography-tandem mass spectrometry [J]. Chinese Journal of Chromatography, 2019,37(6):619-625.
[16] PAWEL K, JACEK N, ANDRZEJ W. Comparison of hydrophilic interaction and reversed phase liquid chromatography coupled with tandem mass spectrometry for the determination of eight artificial sweeteners and common steviol glycosides in popular beverages [J]. Journal of Pharmaceutical and Biomedical Analysis, 2016,127:184-192.
[17] KUBICA P, NAMIESNIK J, WASIK A. Determination of eight artificial sweeteners and common Stevia rebaudiana glycosides in non-alcoholic and alcoholic beverages by reversed-phase liquid chromatography coupled with tandem mass spectrometry [J]. Analytical and Bioanalytical Chemistry, 2015,407(5):1 505-1 512.
[18] 唐吉旺,袁列江,肖泳,等.固相萃取-高效液相色谱-质谱联用法同时测定食品中 9 种人工合成甜味剂[J].色谱,2019,37(6):619-625.
[19] 于慧娟,惠芸华,顾润润,等.液相色谱-串联质谱法测定水产加工品中的甜蜜素[J].分析试验室,2016,35(7):809-812.
[20] 江改青.GC-MS 法测定食品中甜蜜素定性定量分析的探讨[J].现代食品, 2017(15):119-122.