酵素是微生物及相关代谢活性物质的微生态整体[1-2],是以果蔬、菌菇、谷物及中草药等为原料,经过乳酸菌、酵母菌和醋酸菌等多菌种复合发酵后,形成富含多种生物活性成分、矿物质、酶、有机酸和少量乙醇等产物的可食用液态或固态食品[3-4]。随着酵素产业的发展,酵素中相关代谢产物的分析研究成为热点,如MARISA等[5]从诺丽酵素中检测到乙酸,抗坏血酸,琥珀酸和酒石酸等有机酸。陆雨[6]从诺丽酵素中分析鉴定出27个化合物,同时发现诺丽酵素具有良好的抗氧化活性。李云姣等[7]对水果酵素中的理化成分进行了分析,并发现水果酵素具有良好的抗氧化效果和潜在的降血糖功效。
黑果枸杞(Lycium ruthenicum Murr.)作为青藏高原的特色浆果资源,富含花青素等多种营养物质与活性成分,具备多种生物活性,如抗氧化、抗疲劳、延缓衰老、预防癌症等[8]。因此,利用黑果枸杞结合青海特色浆果资源制备黑果枸杞酵素,在一定程度上可以延缓加工过程中花青素的降解[9],丰富黑果枸杞系列产品,进一步强化黑果枸杞在功能性食品领域的应用。
目前对于黑果枸杞酵素的研究鲜有报道,为了比较与分析不同原料配比黑果枸杞酵素发酵完成后的成分差异及体外抗氧化性能,本研究以黑果枸杞为主要原料,结合其他特色植物资源,经过90 d自然发酵,制备4种黑果枸杞酵素,测定发酵前后4种酵素中理化成分、营养活性成分及有机酸种类和含量,并对其体外抗氧化活性进行了研究,这对高附加值黑果枸杞酵素产品的研发具有一定意义。
1 材料与方法
1.1 主要试验材料及仪器
黑果枸杞鲜果采摘于青海省格尔木市(36°25’ N,94°53’ E,海拔2 800 m),保存于干冰保温箱中,运回实验室-20 ℃保藏。黑果枸杞干果、枸杞、玛卡、蕨麻、沙棘粉等由青海千平万安农业科技有限公司提供。
SOD试剂盒、淀粉酶试剂盒、考马斯亮蓝试剂盒,南京建成生物工程研究所;芦丁和没食子酸标准品,成都德思特生物技术有限公司;冰乙酸标准品,上海吉至生化科技有限公司;乳酸、酒石酸和琥珀酸等12种有机酸标准品、福林酚、总抗氧化能力检测试剂盒、羟自由基清除能力检测试剂盒,北京索莱宝科技有限公司;DPPH自由基,东京化成工业株式会社。
UV-1780紫外可见分光光度计,岛津仪器(苏州)有限公司;H/T16MM台式离心机,湖南赫西仪器装备有限公司;Multiskan Sky全波长酶标仪,美国Thermo Fisher;UltiMate3000高效液相色谱仪,美国Thermo Scientific。
1.2 研究内容及实验方法
1.2.1 黑果枸杞酵素生产
制备4种自然发酵黑果枸杞酵素。
(1)黑果枸杞鲜果单一酵素:称取黑果枸杞鲜果2 000 g,打浆处理,转至灭菌坛(121 ℃,15 min),密封,编号为XD。
(2)黑果枸杞干果单一酵素:称取黑果枸杞干果400 g,与1 600 mL无菌水按质量比1∶4进行复水30 min,打浆处理,转至灭菌坛(121 ℃,15 min),密封,编号为GD。
(3)黑果枸杞鲜果复合酵素:称取黑果枸杞鲜果1 200 g、枸杞160 g、蕨麻100 g、玛咖60 g、沙棘粉20 g、红糖100 g和无菌水640 mL,将枸杞用无菌水冲洗后按质量比1∶4与无菌水复水30 min,同时把玛咖和蕨麻清洗后水煮60 min至变软,将全部原料打浆处理,转至灭菌坛(121 ℃,15 min),密封,编号为XF。
(4)黑果枸杞干果复合酵素:称取黑果枸杞干果240 g、枸杞160 g、蕨麻100 g、玛咖60 g、沙棘粉20 g、红糖100 g和无菌水1 600 mL,将黑果枸杞和枸杞用无菌水冲洗后按质量比1∶4分别与无菌水进行复水30 min,同时把玛咖和蕨麻清洗后水煮60 min至变软,将全部原料打浆处理,转至灭菌坛(121 ℃,15 min),密封,编号为GF。
所有操作均在超净工作台进行,所有发酵坛置于28 ℃培养箱中避光发酵,分别于未发酵前和自然发酵90 d后取样,平行3次,经4层纱布过滤后,3 000 r/min离心10 min,取上清液,置于-80 ℃冰箱中待测。
1.2.2 理化成分的测定
可滴定酸测定(以乳酸计):按照GB/T 12456—2008《食品中总酸的测定》测定[10]。pH值测定:采用pH计测定。总糖测定:取样品0.1 mL,稀释至不同倍数,采用蒽酮-硫酸法,参考文献[11]中的步骤,在波长625 nm处测定吸光值,计算总糖含量,以葡萄糖为标准品,制作总糖标准曲线y=7.356 7x-0.012(mg/mL,R2=0.990 6)。还原糖测定:取样品0.1 mL,稀释至不同倍数,采用3,5-二硝基水杨酸显色法,参考文献[12]中的步骤,在波长485 nm处测定吸光值,计算还原糖含量,以葡萄糖为标准品,制作还原糖标准曲线y=2.159 3x-0.007 4(mg/mL,R2=0.995 8)。
1.2.3 营养及活性成分测定
总蛋白测定:取50 μL样品,采用考马斯亮蓝试剂盒测定。花青素含量测定:取样品0.1 mL,采用pH示差法[13],分别在535 nm和700 nm处测定吸光值,计算花青素含量。总黄酮测定:取样品0.5 mL,稀释至不同倍数,采用硝酸铝比色法,参考文献[14]中的方法,于502 nm波长处测定吸光值,计算总黄酮含量,以芦丁为标准品,制作芦丁标准曲线y=11.403x+0.018 2(mg/mL,R2=0.996 8)。总酚测定:取样品0.5 mL,稀释至不同倍数,采用福林酚法,参考文献[14]中的方法,在760 nm处测吸光值,计算总酚含量,以没食子酸为标准品,制作没食子酸标准曲线y=0.101 4x+0.044 4(μg/mL,R2=0.999 4)。SOD酶活力测定:取50 μL样品,采用SOD试剂盒测定。淀粉酶活力测定:取50 μL样品,采用淀粉酶试剂盒测定。
1.2.4 有机酸种类及含量测定
色谱条件:参考GB/T 5009.157—2016《食品中有机酸的测定》中的方法[15],并有所改进。具体条件如下:色谱柱:CAPECELLPAK MGS5C18柱,4.6 mm×250 mm,5 μm;流动相:体积分数0.1%磷酸溶液;液相条件:等梯度洗脱30 min;流速0.7 mL/min;柱温40 ℃;进样量50 μL;检测波长210 nm。
准确称取乳酸8.5 mg,用超纯水溶于10 mL棕色容量瓶,摇匀,即为0.85 mg/mL乳酸标准溶液,以相同的方法配制没食子酸、延胡索酸、山梨酸、抗坏血酸、琥珀酸、草酸、醋酸、莽草酸、苹果酸、柠檬酸、酒石酸和γ-氨基丁酸标准溶液,其质量浓度分别为0.009 8、0.011 6、1、0.108、1.07、0.107 6、1.63、0.017 15、0.135、0.029 8、0.100 9和1.131 mg/mL,以质量(μg)为横坐标,峰面积为纵坐标绘制标准曲线。样品用超纯水稀释一定倍数,用0.22 μm滤膜过滤后直接进样。13种有机酸标准品的标准曲线结果见表1。
表1 十三种有机酸标准品的标准曲线
Table 1 Standard curve results of 13 organic acid standards
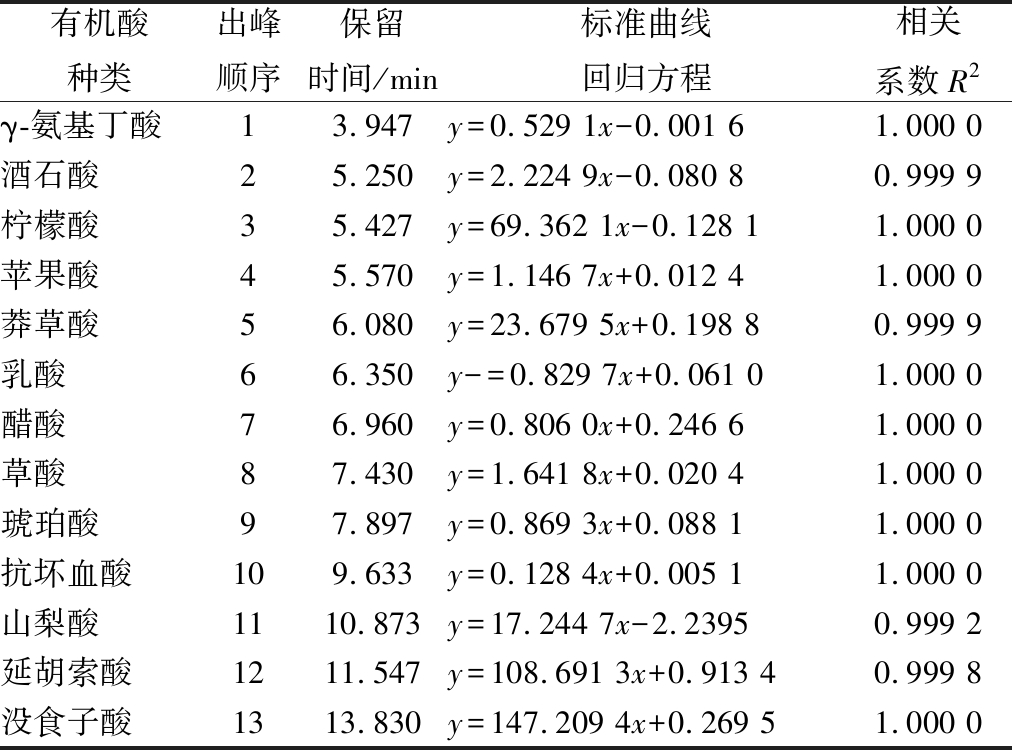
有机酸种类出峰顺序保留时间/min标准曲线回归方程相关系数R2γ-氨基丁酸13.947y=0.529 1x-0.001 61.000 0酒石酸25.250y=2.224 9x-0.080 80.999 9柠檬酸35.427y=69.362 1x-0.128 11.000 0苹果酸45.570y=1.146 7x+0.012 41.000 0莽草酸56.080y=23.679 5x+0.198 80.999 9乳酸66.350y-=0.829 7x+0.061 01.000 0醋酸76.960y=0.806 0x+0.246 61.000 0草酸87.430y=1.641 8x+0.020 41.000 0琥珀酸97.897y=0.869 3x+0.088 11.000 0抗坏血酸109.633y=0.128 4x+0.005 11.000 0山梨酸1110.873y=17.244 7x-2.23950.999 2延胡索酸1211.547y=108.691 3x+0.913 40.999 8没食子酸1313.830y=147.209 4x+0.269 51.000 0
1.2.5 体外抗氧化活性测定
DPPH自由基清除能力测定:分别取2 mL不同体积分数的样品,参考文献[16]中的方法,以蒸馏水为参比,以不同浓度的Vc溶液作对照,在517 nm 处测定吸光值,利用SPSS软件计算半抑制浓度(half maximal inhibitory concentration,IC50)。
DPPH自由基清除率![]()
式中:A1,样品吸光值;A2,用无水乙醇代替DPPH 时测得对应浓度的本底吸光值;A0,空白吸光值。
总抗氧化能力的测定:分别取6 μL不同体积分数的样品,按总抗氧化能力检测试剂盒中的方法测定。以不同浓度的Vc溶液作对照。
羟自由基清除能力的测定:分别取75 μL不同体积分数的样品,按羟自由基清除能力检测试剂盒中的方法测定。以不同浓度的Vc溶液作对照,利用SPSS软件计算IC50。
还原力的测定:分别取1 mL不同浓度的样品,参考文献[17]中的方法测定,以蒸馏水为参比,以不同浓度的Vc溶液作对照。在700 nm处测定吸光值。吸光值越高,还原力越强,利用SPSS软件计算IC50。
1.2.6 数据处理与分析
利用Excel 2007、SPSS Statistics 20.0等统计软件进行数据分析,结果以![]() 表示。
表示。
2 结果与分析
2.1 四种黑果枸杞酵素理化成分测定
经过90 d发酵,4种黑果枸杞酵素的理化成分测定结果见表2。由表2可知,经过90 d发酵,XD、GD、XF和GF可滴定酸含量均有增加,分别增加了109.73%、122.05%、166.67%和125.52%;总糖含量均有所减少,分别减少了94.90%、83.52%、55.16%和85.58%;还原糖含量均有减少,分别减少了97.51%、84.79%、73.30%和93.19%;pH值均下降,分别下降了0.810、1.200、0.950和1.100。90 d发酵完成后,4种酵素的pH值基本无差别,XF中可滴定酸含量显著高于XD和GD(P<0.05),且高于GF(P>0.05),XF中总糖和还原糖含量均显著高于XD、GD和GF(P<0.05),XD中可滴定酸、总糖和还原糖含量均显著低于GD、XF和GF(P<0.05)。
表2 理化成分测定结果
Table 2 Measurement results of physicochemical composition
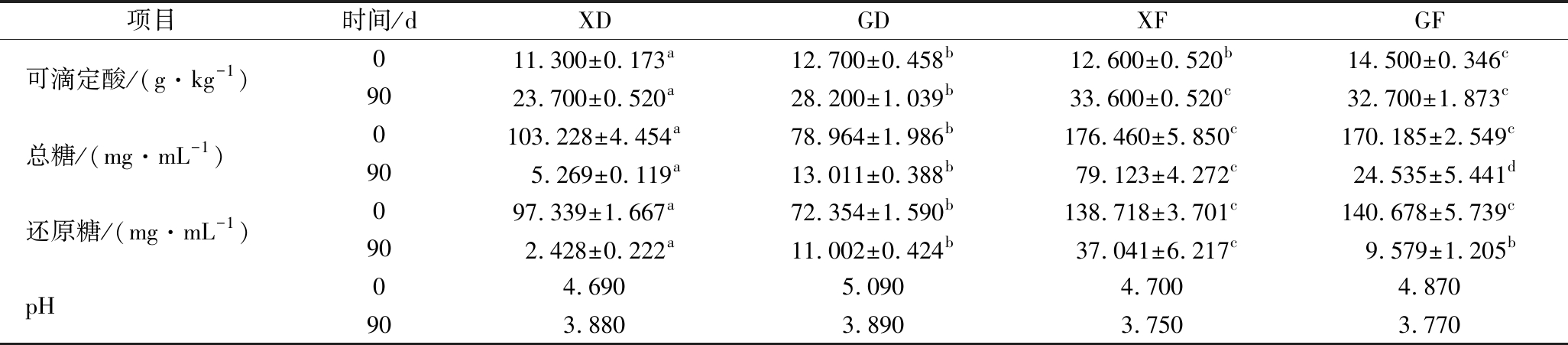
项目时间/dXDGDXFGF可滴定酸/(g·kg-1)011.300±0.173a12.700±0.458b12.600±0.520b14.500±0.346c9023.700±0.520a28.200±1.039b33.600±0.520c32.700±1.873c总糖/(mg·mL-1)0103.228±4.454a78.964±1.986b176.460±5.850c170.185±2.549c905.269±0.119a13.011±0.388b79.123±4.272c24.535±5.441d还原糖/(mg·mL-1)097.339±1.667a72.354±1.590b138.718±3.701c140.678±5.739c902.428±0.222a11.002±0.424b37.041±6.217c9.579±1.205bpH04.6905.0904.7004.870903.8803.8903.7503.770
注:同行相同字母表示差异不显著(P>0.05),不同字母表示差异显著(P<0.05)(下同)
通过比较发现,4种酵素未发酵前各成分含量的高低与发酵90 d后的成分含量高低不一致,同时,利用鲜果制作的2种酵素(XD和XF)中理化成分含量差异显著(P<0.05),利用干果制作的2种酵素(GD和GF)中理化成分含量(除发酵90 d后的还原糖)差异显著(P<0.05),说明4种酵素发酵过程中糖酸类物质的消耗与积累主要是由于自然发酵方式产生的微生物菌群的代谢作用不同导致。
2.2 四种黑果枸杞酵素活性成分测定
测定结果见表3。
表3 活性成分测定结果
Table 3 Measurement results of active ingredients

项目时间/dXDGDXFGF总蛋白/(mg·mL-1)03.298±0.069a3.929±0.285b1.668±0.056c1.790±0.065c901.169±0.006a1.910±0.044b0.515±0.023c0.785±0.055d花青素/(mg·mL-1)03.266±0.166a4.900±0.088b1.506±0.029c1.530±0.122c901.301±0.054a1.989±0.055b0.124±0.002c0.202±0.009d总黄酮/(mg·mL-1)06.737±0.423a7.922±0.586b3.373±0.130c3.582±0.090c908.082±0.146a10.042±0.213b4.799±0.162c6.965±0.585d总酚/(mg·mL-1)06.073±0.141a8.161±0.234b4.301±0.185c5.132±0.087d907.095±0.455a10.229±0.111b6.195±0.153c7.185±0.379aSOD酶/(U·mL-1)0663.595±7.204a576.824±6.494b615.665±10.028c574.345±10.155b90670.413±10.939a640.296±7.158b747.011±12.087c702.317±12.023d淀粉酶/(U·mL-1)01.056±0.194a0.810±0.379ab0.463±0.037b0.483±0.086b901.161±0.170a1.052±0.100a0.471±0.010b0.143±0.015c
由表3可知,经过90 d发酵,XD、GD、XF和GF总蛋白含量均减少,分别减少了64.55%、51.39%、69.12%和56.15%,可能与微生物利用氮源物质有关,或者是由于样品经过离心处理后,微生物菌体蛋白被沉淀除去,导致总蛋白的检测含量较低。花青素含量均有所减少,分别减少了60.17%、59.41%、91.77%和86.80%,主要是由于花青素极不稳定,导致花青素含量有所下降。总黄酮含量均增加,分别增加了19.96%、26.76%、42.28%和94.44%,总酚含量均增加,分别增加了16.83%、25.34%、44.04%和40.00%,主要是因为在微生物产生的酶类及有机酸的作用下,总酚和总黄酮溶出并呈游离态,大分子物质分解为简单的小分子物质[18],从而引起总酚和总黄酮含量增加。SOD酶活性均升高,分别升高了1.03%、11.00%、21.33%和22.28%,XD、GD和XF中淀粉酶活性均升高,分别升高了9.94%、29.88%和1.73%,而GF中淀粉酶活性下降了70.39%,SOD酶和淀粉酶活性的变化主要是由微生物的代谢活动引起的,而SOD酶含量升高不明显,可能与酵素体系中的pH值有关[19]。
经过90 d发酵之后,GD的总蛋白、花青素、总黄酮和总酚含量均显著高于XD、XF和GF(P<0.05),XF的总蛋白、花青素、总黄酮和总酚含量均显著低于XD、GD和GF(P<0.05);XF的SOD酶含量相对最高(P<0.05),GD的SOD酶含量相对最低(P<0.05);XD的淀粉酶含量显著高于XF和GF(P<0.05),且高于GD(P>0.05),GF的淀粉酶含量相对最低(P<0.05)。综合发酵之后的各项活性成分指标来看,GD的质量水平较好。
2.3 四种黑果枸杞酵素有机酸种类及含量分析
13种有机酸标准品及发酵90 d后的XD中有机酸的HPLC色谱图见图1。
4种黑果枸杞酵素中的有机酸种类及含量检测结果见表4。
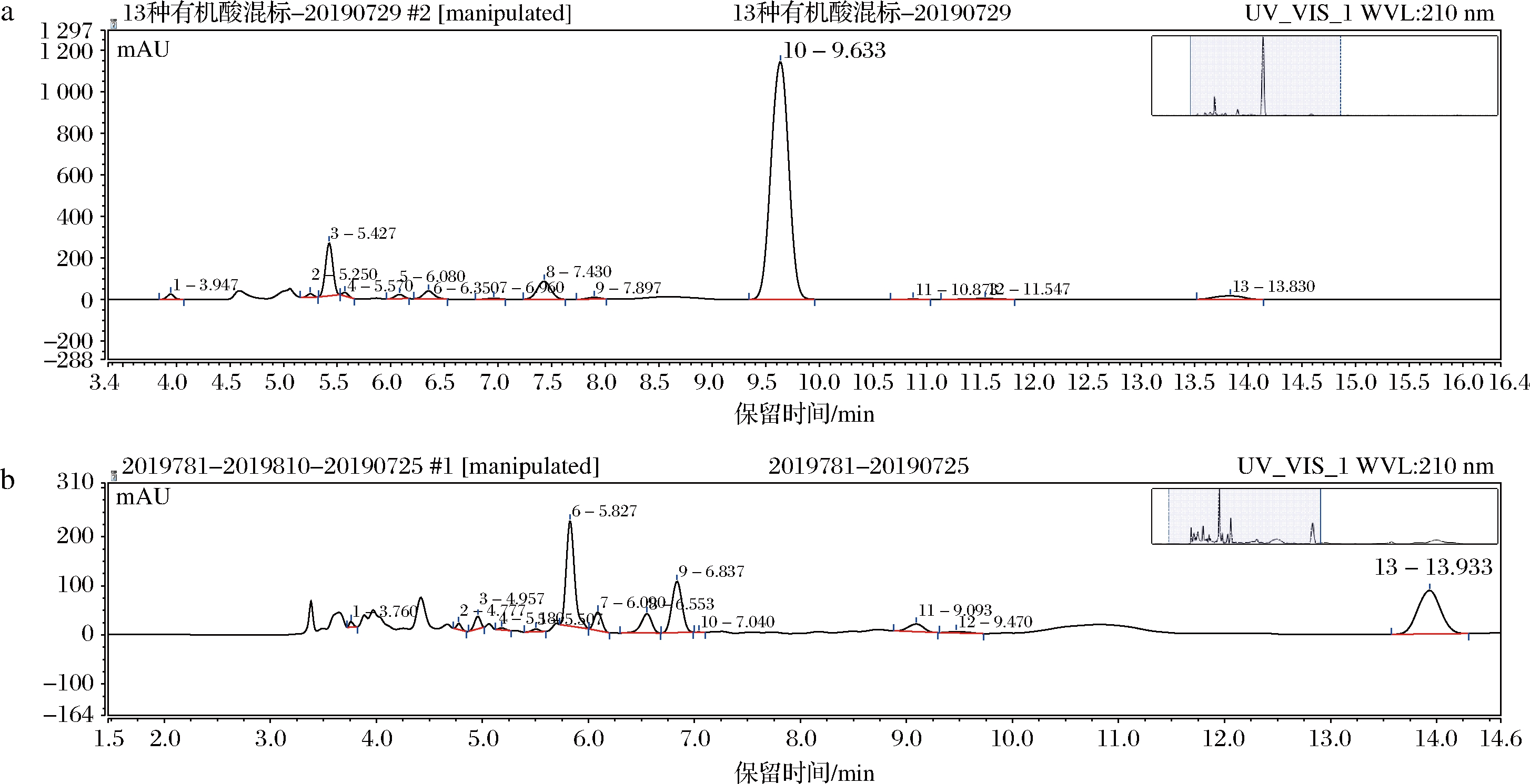
a-13种有机酸标准品的HPLC色谱图;b-XD中有机酸的HPLC色谱图;1-γ-氨基丁酸;2-酒石酸;3-柠檬酸;4-苹果酸;5-莽草酸;6-乳酸; 7-醋酸;8-草酸;9-琥珀酸;10-抗坏血酸;11-山梨酸;12-延胡索酸;13-没食子酸
图1 十三种有机酸标准品(a)和发酵90 d后的XD(b)中有机酸的HPLC色谱图
Fig.1 HPLC chromatogram of 13 organic acid standards(a) and organic acid from XD (b) after 90 days fermentation
表4 四种黑果枸杞酵素中有机酸种类及含量分析
Table 4 Analysis of types and contents for organic acids from four Lycium ruthenicum Murr. Jiaosu
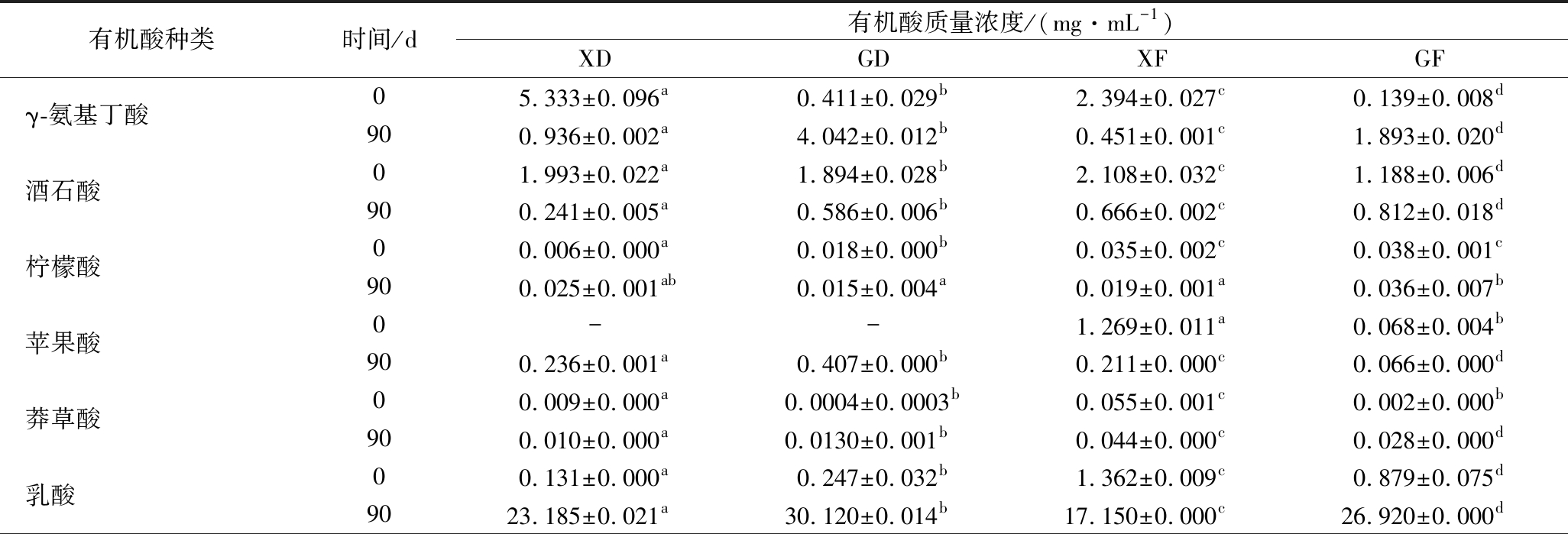
有机酸种类时间/d有机酸质量浓度/(mg·mL-1)XDGDXFGFγ-氨基丁酸05.333±0.096a0.411±0.029b2.394±0.027c0.139±0.008d900.936±0.002a4.042±0.012b0.451±0.001c1.893±0.020d酒石酸01.993±0.022a1.894±0.028b2.108±0.032c1.188±0.006d900.241±0.005a0.586±0.006b0.666±0.002c0.812±0.018d柠檬酸00.006±0.000a0.018±0.000b0.035±0.002c0.038±0.001c900.025±0.001ab0.015±0.004a0.019±0.001a0.036±0.007b苹果酸0--1.269±0.011a0.068±0.004b900.236±0.001a0.407±0.000b0.211±0.000c0.066±0.000d莽草酸00.009±0.000a0.0004±0.0003b0.055±0.001c0.002±0.000b900.010±0.000a0.0130±0.001b0.044±0.000c0.028±0.000d乳酸00.131±0.000a0.247±0.032b1.362±0.009c0.879±0.075d9023.185±0.021a30.120±0.014b17.150±0.000c26.920±0.000d
续表4
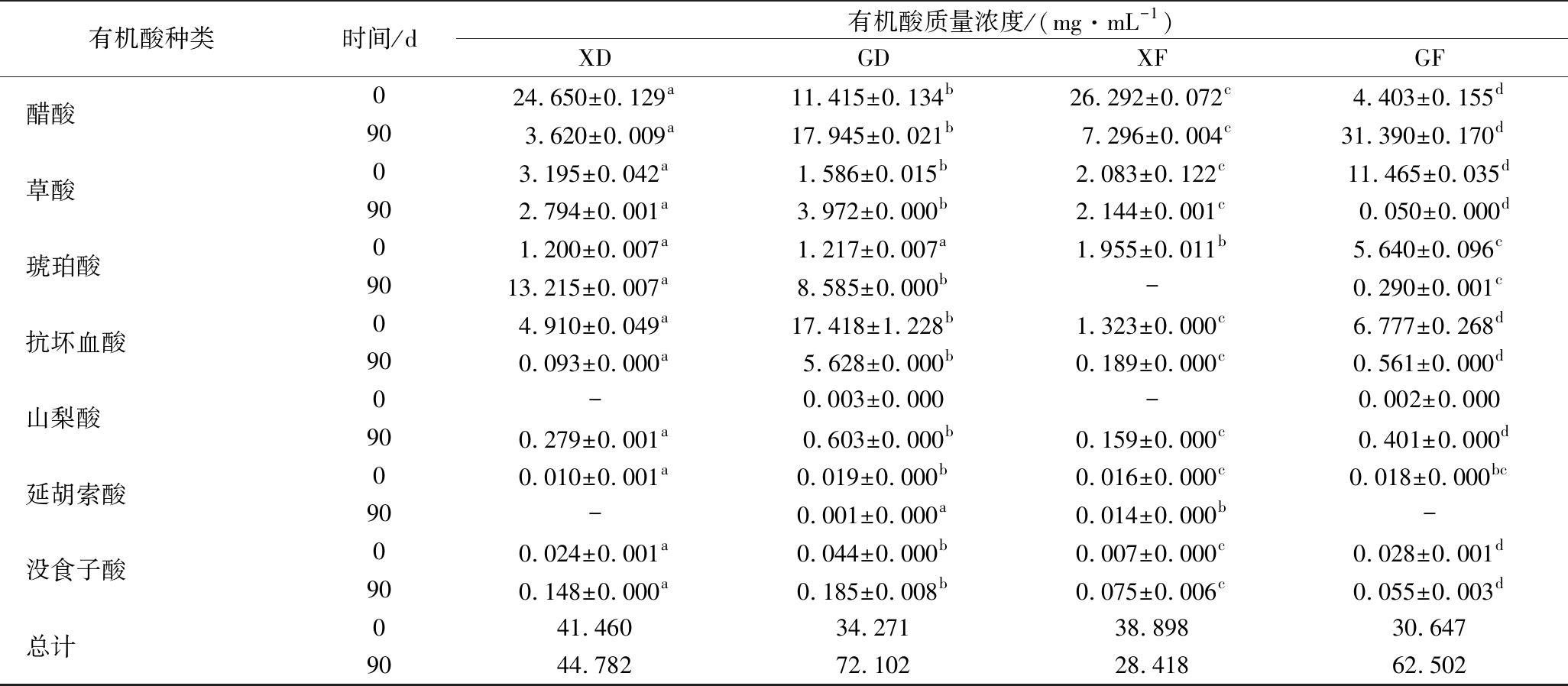
有机酸种类时间/d有机酸质量浓度/(mg·mL-1)XDGDXFGF醋酸024.650±0.129a11.415±0.134b26.292±0.072c4.403±0.155d903.620±0.009a17.945±0.021b7.296±0.004c31.390±0.170d草酸03.195±0.042a1.586±0.015b2.083±0.122c11.465±0.035d902.794±0.001a3.972±0.000b2.144±0.001c0.050±0.000d琥珀酸01.200±0.007a1.217±0.007a1.955±0.011b5.640±0.096c9013.215±0.007a8.585±0.000b-0.290±0.001c抗坏血酸04.910±0.049a17.418±1.228b1.323±0.000c6.777±0.268d900.093±0.000a5.628±0.000b0.189±0.000c0.561±0.000d山梨酸0-0.003±0.000-0.002±0.000900.279±0.001a0.603±0.000b0.159±0.000c0.401±0.000d延胡索酸00.010±0.001a0.019±0.000b0.016±0.000c0.018±0.000bc90-0.001±0.000a0.014±0.000b-没食子酸00.024±0.001a0.044±0.000b0.007±0.000c0.028±0.001d900.148±0.000a0.185±0.008b0.075±0.006c0.055±0.003d总计041.46034.27138.89830.6479044.78272.10228.41862.502
注:“—”表示未检出
由表4可知,由于原料配比不同,4种酵素中的有机酸种类及含量有所不同。在XD中,未发酵前检测到11种有机酸,总量为41.460 mg/mL,主要以醋酸为主,未检测到苹果酸和山梨酸,90 d发酵后检测到12种有机酸,总量为44.782 mg/mL,比未发酵前增加了8.01%,主要以乳酸和琥珀酸为主,未检测出延胡索酸。在GD中,未发酵前检测到12种有机酸,总量为34.271 mg/mL,主要以醋酸和抗坏血酸为主,未检测到苹果酸,90 d发酵后检测到13种有机酸,总量为72.102 mg/mL,比未发酵前增加了110.39%,主要以乳酸、醋酸和琥珀酸为主。在XF中,未发酵前检测到12种有机酸,总量为38.898 mg/mL,主要以醋酸为主,未检测到山梨酸,90 d发酵后检测到12种有机酸,总量为28.418 mg/mL,比未发酵前减少了26.94%,主要以乳酸和醋酸为主,未检测出琥珀酸。在GF中,未发酵前检测到13种有机酸,总量为30.647 mg/mL,主要以草酸和抗坏血酸为主,90 d发酵后检测到12种有机酸,总量为62.502 mg/mL,比未发酵前增加了103.94%,主要以醋酸和乳酸为主,未检测出延胡索酸。根据以上结果可知,经过90 d发酵完成后,以黑果枸杞鲜果或干果为原料的单一酵素(XD和GD)中有机酸主要以乳酸、醋酸和琥珀酸为主。以黑果枸杞鲜果或干果+其他辅料为原料的复合酵素(XF和GF)中有机酸主要以乳酸和醋酸为主,其中,GD有机酸含量最高,且种类最全。
由表4可以发现,4种酵素的有机酸组成及含量各有不同,通过发酵,以黑果枸杞鲜果为原料制作的酵素(XD和XF)中,醋酸被大量消耗,乳酸被大量积累。以黑果枸杞干果为原料制作的酵素(GD和GF)中,乳酸和醋酸被大量积累。自然发酵过程就是利用原料本身的混菌复合发酵的过程,因此,由于原料本身及表面微生物的不同,必定会出现不同的生长代谢活动及各物质间相互转化的情况[20],比如醋酸的消耗可能是由于某些细菌(如光合细菌)的乙醛酸循环作用,使得醋酸被大量消耗[21];乳酸的形成可能是由于乳酸菌代谢及苹果酸-乳酸发酵作用[19];醋酸的生成可能是由于乳酸菌降解乳酸产生醋酸[22],从而导致4种酵素中的主要呈味物质—有机酸会不尽相同。而XF自发酵后,有机酸含量比未发酵前减少了26.94%,且XD中有机酸含量增幅偏小,猜测原因为以黑果枸杞鲜果制作的酵素在发酵过程中转化生成了其他种类的有机酸,不在检测的13种有机酸类型当中。
2.4 四种黑果枸杞酵素对DPPH自由基清除能力的测定
由图2可知,XD、GD、XF、GF对DPPH自由基的清除能力在一定体积分数范围(0.02%~0.75%)内呈现剂量依赖效应,DPPH自由基清除率分别从20.61%、24.88%、14.51%、15.56%上升到91.98%、91.76%、92.43%、92.99%。VC在0.02~0.12 mg/mL范围内,清除率从41.44%上升到63.98%。经SPSS软件计算,4种酵素的IC50为0.049 mg VC/mL,且XD、GD、XF、GF的IC50分别为0.071%、0.055%、0.082%、0.066%,其中,GD的IC50最低,说明在一定体积分数范围内,GD清除DPPH自由基的能力相对较强。
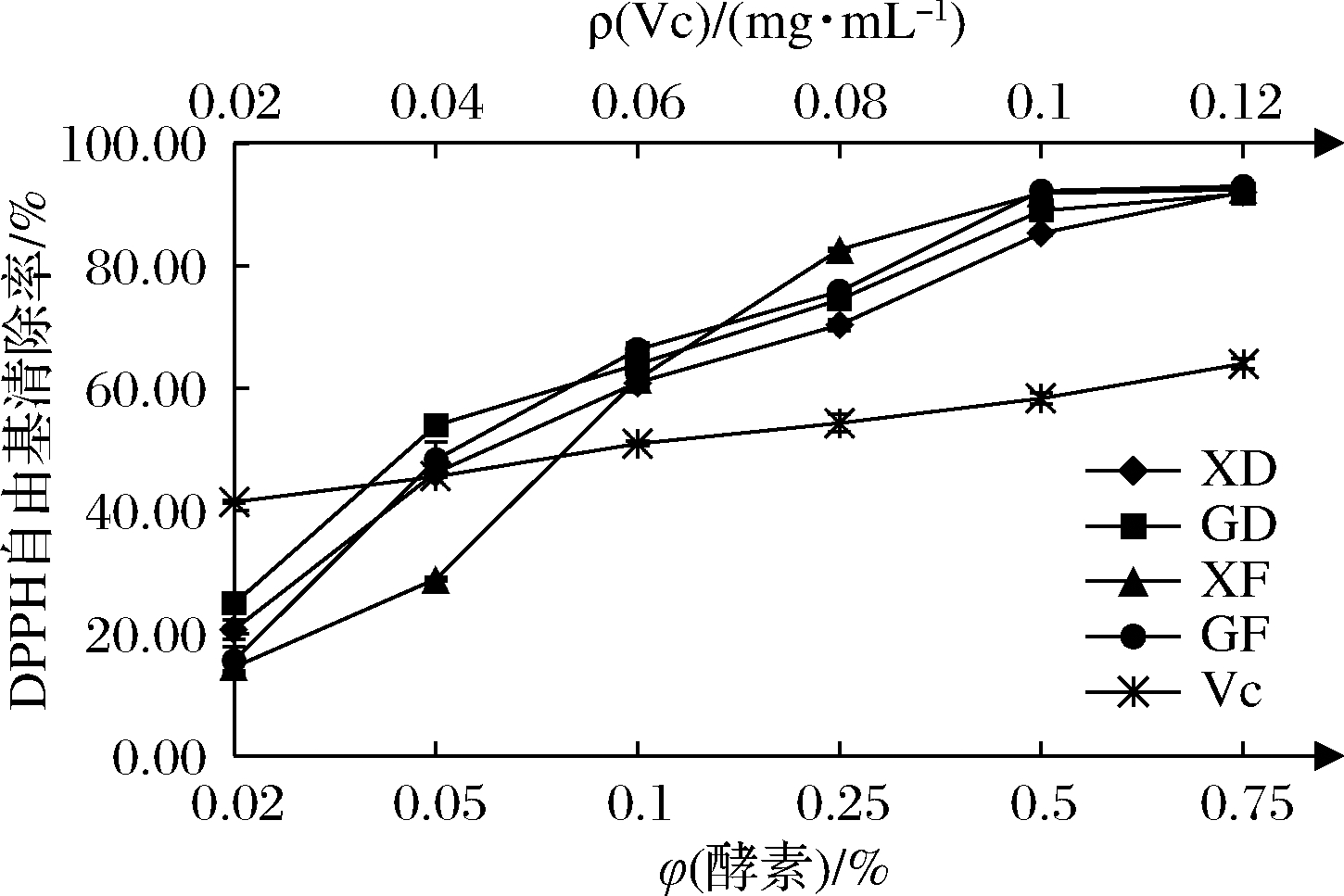
图2 四种黑果枸杞酵素的DPPH自由基清除能力
Fig.2 DPPH free radical scavenging ability of four Lycium ruthenicum Murr. Jiaosu
2.5 四种黑果枸杞酵素总抗氧化能力的测定
由图3可知,XD、GD、XF、GF的总抗氧化能力在一定体积分数范围(0.25%~1.5%)内呈现剂量依赖效应,总抗氧化能力分别从0.230、0.300、0.156、0.190 U/mL上升到1.485、1.548、0.682、1.085 U/mL,VC在0.02~0.2 mg/mL范围内,总抗氧化能力从0.253 U/mL上升到2.264 U/mL。体积分数为1.5%的XD和GD与0.12 mg/mL VC溶液(1.516 U/mL)总抗氧化能力相当,体积分数为1.25%的XF(0.571 U/mL)与0.04 mg/mL VC溶液(0.537 U/mL)总抗氧化能力相当,体积分数为1.5%的GF(1.085 U/mL)与0.08 mg/mL VC溶液(0.999 U/mL)总抗氧化能力相当。综合以上结果可知,在一定浓度范围内,GD的总抗氧化能力相对较强。
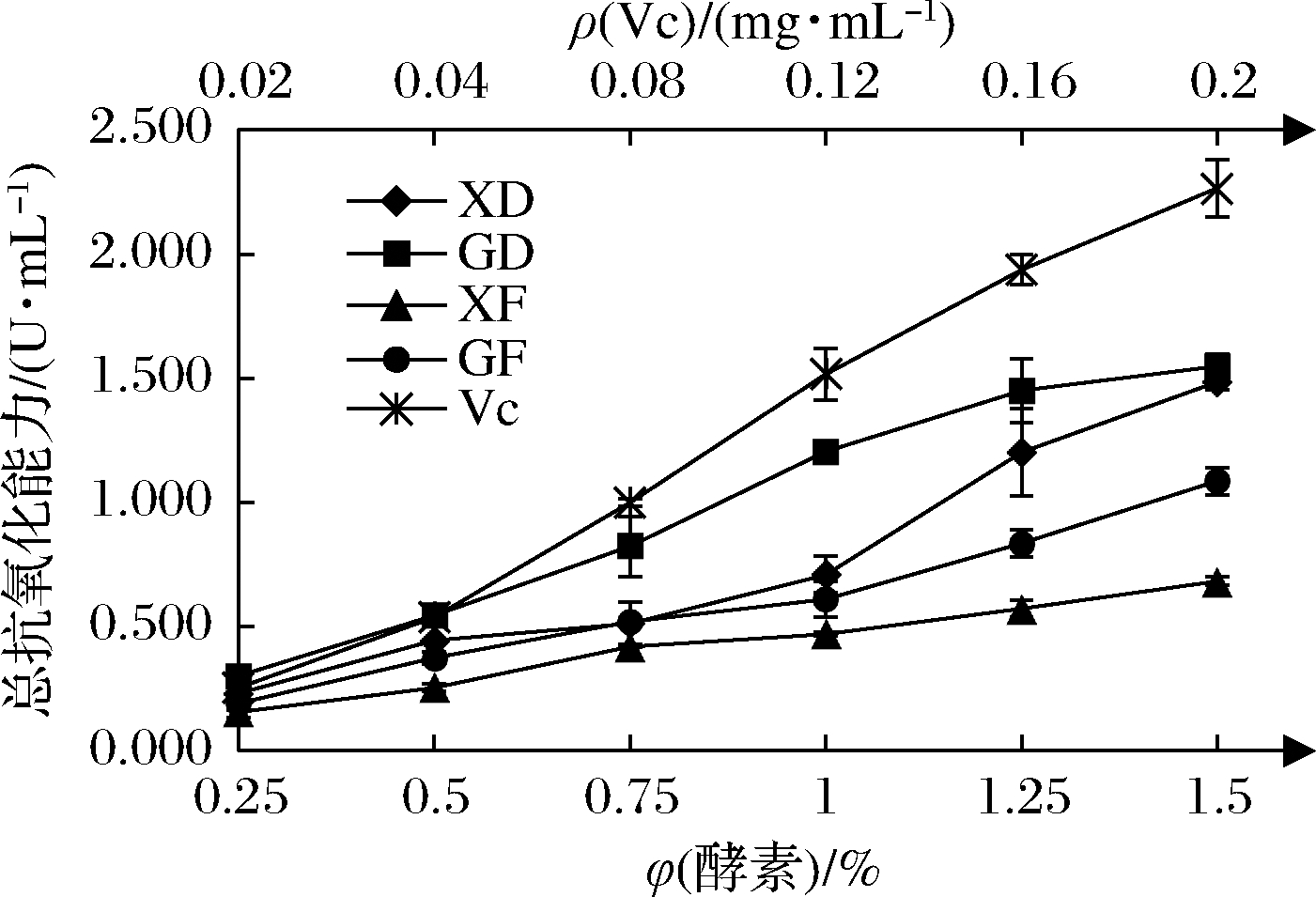
图3 四种黑果枸杞酵素的总抗氧化能力
Fig.3 Total antioxidant capacity of four Lycium ruthenicumMurr. Jiaosu
2.6 四种黑果枸杞酵素对羟自由基清除能力的测定
由图4可知,XD、GD、XF、GF对羟自由基的清除能力在一定体积分数范围(0.5%~2.5%)内呈现剂量依赖效应,羟自由基清除率分别从52.37%、45.25%、54.45%、49.85%上升到79.23%、90.95%、85.01%、87.09%。VC在0.02~0.2 mg/mL范围内,清除率从56.68%升到97.92%。经SPSS软件计算,4种酵素的IC50为0.017 mg VC/mL,且XD、GD、XF、GF的IC50分别为0.536%、0.738%、0.488%、0.606%,其中,XF的IC50最低,说明在一定浓度范围内,XF清除羟自由基的能力相对较强。
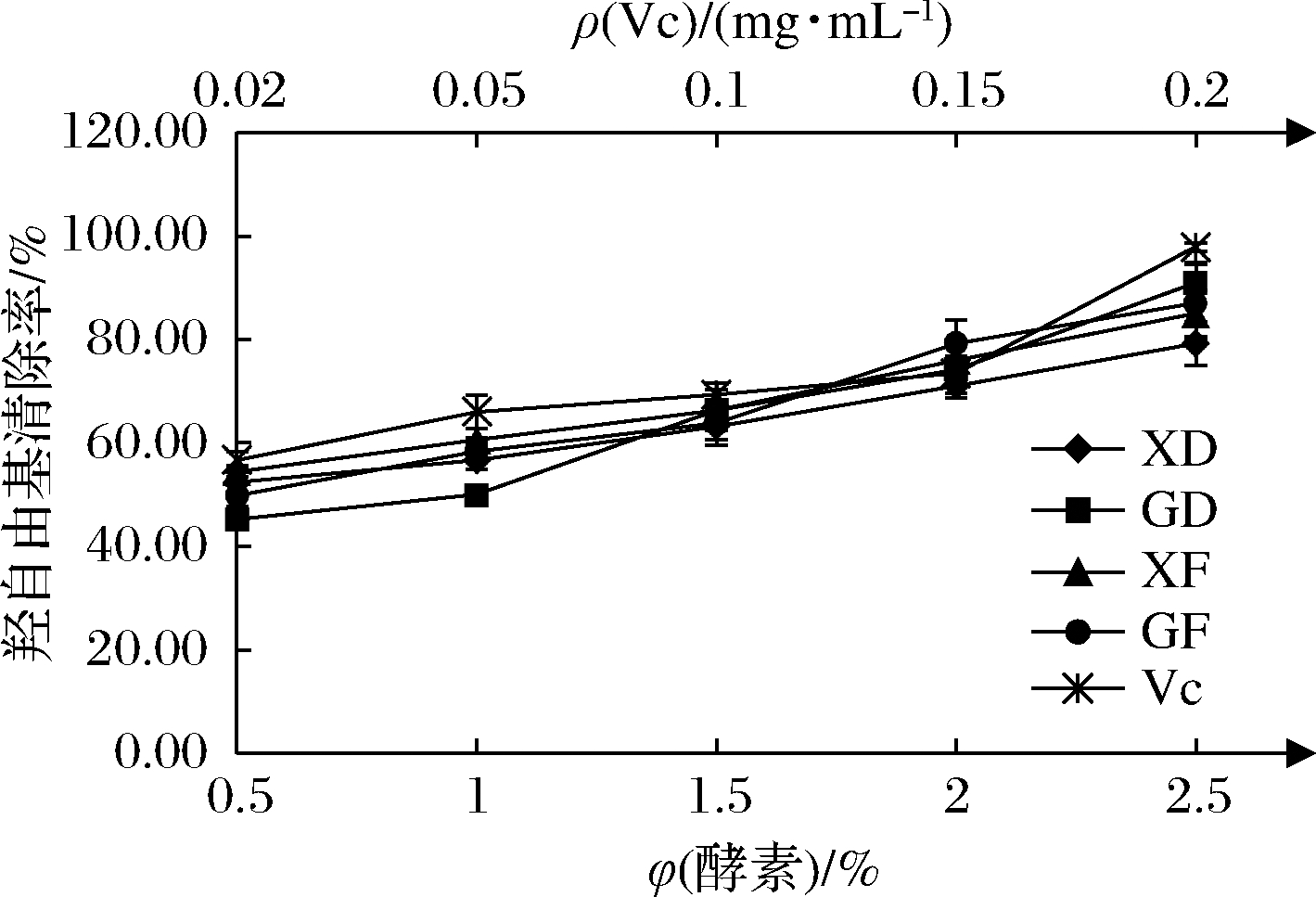
图4 四种黑果枸杞酵素的羟自由基清除能力
Fig.4 Hydroxyl free radical scavenging capacity of fourLycium ruthenicum Murr. Jiaosu
2.7 四种黑果枸杞酵素还原力的测定
由图5可以看出,XD、GD、XF、GF的还原力在一定体积分数范围(0.25%~1.5%)内呈现剂量依赖效应,还原力分别从0.098、0.180、0.116、0.176上升到0.615、1.090、0.814、1.142。VC在0.02~0.12 mg/mL范围内,还原力从0.114升到0.799。经SPSS软件计算,4种酵素的IC50为0.071 mg VC/mL,且XD、GD、XF、GF的IC50分别为1.251%、0.596%、0.938%、0.640%,其中,GD的IC50最低,说明在一定浓度范围内,GD的还原能力相对较强。

图5 四种黑果枸杞酵素的还原力
Fig.5 Reducing power of four Lycium ruthenicumMurr. Jiaosu
2.8 代谢物质及抗氧化能力的相关性分析
采用Pearson法对4种黑果枸杞酵素中的相关代谢物质及抗氧化能力进行相关性分析,结果见表5。
表5 相关性分析结果
Table 5 The results of correlation analysis
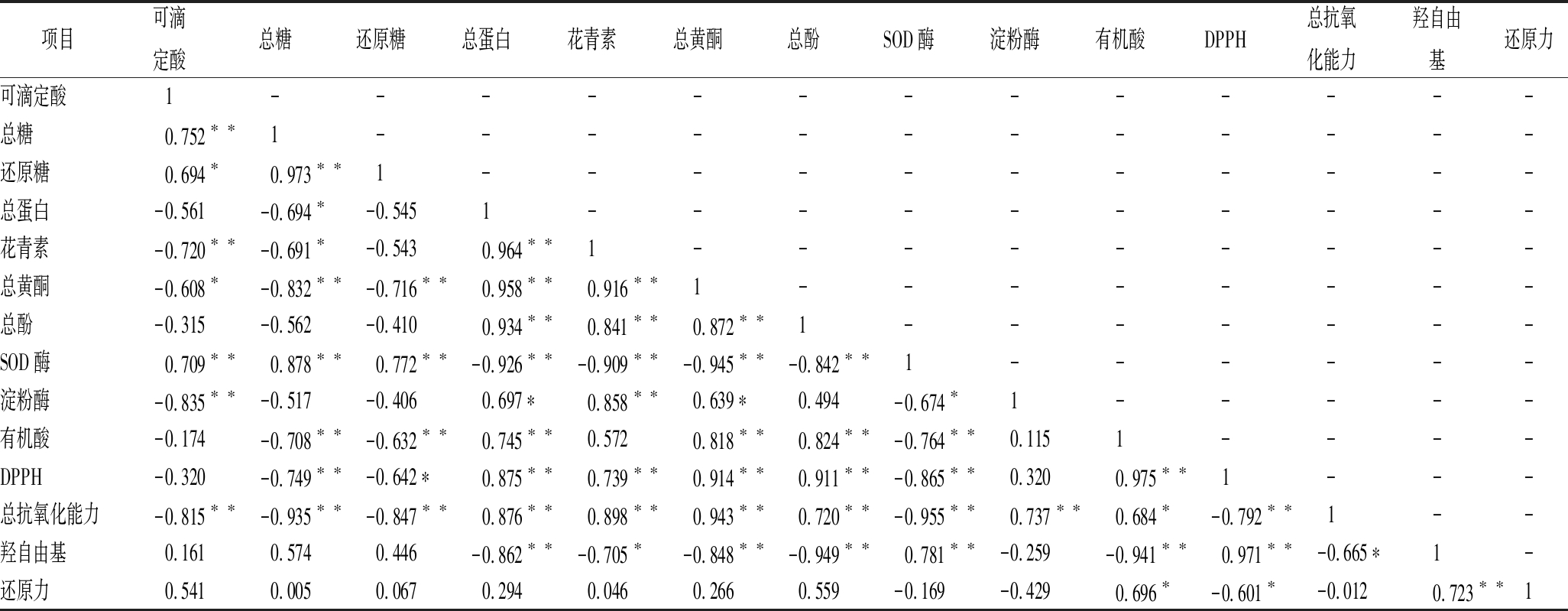
项目可滴定酸总糖还原糖总蛋白花青素总黄酮总酚SOD酶淀粉酶有机酸DPPH总抗氧化能力羟自由基还原力可滴定酸1-------------总糖0.752∗∗1------------还原糖0.694∗0.973∗∗1-----------总蛋白-0.561-0.694∗-0.5451----------花青素-0.720∗∗-0.691∗-0.5430.964∗∗1---------总黄酮-0.608∗-0.832∗∗-0.716∗∗0.958∗∗0.916∗∗1--------总酚-0.315-0.562-0.4100.934∗∗0.841∗∗0.872∗∗1-------SOD酶0.709∗∗0.878∗∗0.772∗∗-0.926∗∗-0.909∗∗-0.945∗∗-0.842∗∗1------淀粉酶-0.835∗∗-0.517-0.4060.697∗0.858∗∗0.639∗0.494-0.674∗1-----有机酸-0.174-0.708∗∗-0.632∗∗0.745∗∗0.5720.818∗∗0.824∗∗-0.764∗∗0.1151----DPPH-0.320-0.749∗∗-0.642∗0.875∗∗0.739∗∗0.914∗∗0.911∗∗-0.865∗∗0.3200.975∗∗1---总抗氧化能力-0.815∗∗-0.935∗∗-0.847∗∗0.876∗∗0.898∗∗0.943∗∗0.720∗∗-0.955∗∗0.737∗∗0.684∗-0.792∗∗1--羟自由基0.1610.5740.446-0.862∗∗-0.705∗-0.848∗∗-0.949∗∗0.781∗∗-0.259-0.941∗∗0.971∗∗-0.665∗1-还原力0.5410.0050.0670.2940.0460.2660.559-0.169-0.4290.696∗-0.601∗-0.0120.723∗∗1
注:*表示差异显著(P<0.05),**表示差异极显著(P<0.01)
由表5可知,DPPH自由基清除与总蛋白、花青素、总黄酮、总酚及有机酸均呈极显著正相关(P<0.01),说明DPPH自由基清除主要受总蛋白、花青素、总黄酮、总酚及有机酸的影响。总抗氧化能力与总蛋白、花青素、总黄酮、总酚及淀粉酶均呈极显著正相关(P<0.01),与有机酸呈显著正相关(P<0.05),说明总抗氧化能力主要受总蛋白、花青素、总黄酮、总酚、淀粉酶及有机酸的影响。羟自由基清除与SOD酶呈极显著正相关(P<0.01),说明羟自由基清除主要受SOD酶的影响。还原力与有机酸呈显著正相关(P<0.05),说明还原力主要受有机酸的影响。
3 讨论
通过比较4种酵素发酵完成后的活性成分含量差异发现(表3),除了微生物代谢作用这一主要变化因素之外,XD和GD的成分含量分别高于XF和GF(除SOD酶外),说明由于黑果枸杞的极高营养价值,导致了单一酵素的质量水平比复合酵素相对较好,而SOD酶活性差异,可能是由于其他辅料添加而导致的。GD和GF的成分含量分别高于XD和XF(除SOD酶和淀粉酶外),可能是由于干果与水比例偏大,导致干果酵素质量水平高于鲜果酵素,而SOD酶和淀粉酶活性差异,猜测原因为黑果枸杞在干制过程中多种酶活性被破坏所致。
4种酵素在一定的试验浓度范围内,具有良好的体外抗氧化效果,且呈剂量依赖效应,这与程勇杰等[23]研究结果类似。经过SPSS计算IC50后,GD在清除DPPH自由基、总抗氧化能力和还原力方面相对较强,同时根据相关性分析结果(表5),分析原因主要是由于GD中花青素、总黄酮、总酚、维生素和有机酸含量相对较高,这些物质的作用取决于其分子质量、芳香环的多少及羟基取代基等相关性质[24],尤其会受有机酸的影响[25]。XF在羟自由基清除能力方面相对较强,根据相关性分析结果(表5),推测原因可能是XF中SOD酶含量较高或者存在高效清除羟自由基的活性物质[26]。
4 结论
本文针对黑果枸杞酵素中主要成分的变化情况及清除自由基能力的强弱进行分析,结果发现,黑果枸杞酵素经自然发酵之后,品质良好,并具有很好的抗氧化活性,同时由于鲜果受季节性和贮藏条件的影响,以干果为主要原料制备酵素(GD和GF)能够相对较好地适用于企业生产加工。但是由于自然发酵方式不能完全准确地调控菌群结构,可能会导致杂菌污染,因此,从自然发酵酵素中分离出优势菌种,再用于酵素接种发酵加工生产中,将对酵素的产业化发展起到推动作用。
[1] 陈丹. 浅论食用酵素[J]. 食品研究与开发, 2016, 37(12): 210-214.
[2] ZHAI F H, WANG Q, HAN J R. Nutritional components and antioxidant properties of seven kinds of cereals fermented by the basidiomycota Agaricus blazei[J]. Journalof Cereal Science, 2015, 65: 202-208.
[3] T/CBFIA 08003—2017, 食用植物酵素[S]. 北京: 中国标准出版社, 2017.
[4] 赵芳芳, 莫雅雯, 蒋增良, 等. 功能性微生物酵素产品的研究进展[J]. 食品与发酵工业, 2016, 42(7): 283-287.
[5] WALL M M, NISHIJIMA K A, SARNOSKI P, et al. Postharvest ripening of noni fruit (Morinda citrifolia) and the microbial and chemical properties of its fermented juice[J]. Journal of Herbs Spices & Medicinal Plants, 2015, 21(3): 294-307.
[6] 陆雨. 诺丽酵素的化学成分及生物活性研究[D]. 杭州: 浙江工业大学, 2018.
[7] 李云姣, 李琪, 杜佳峰, 等. 水果酵素体外抗氧化及抑制α-淀粉酶和α-葡萄糖苷酶活性的研究[J]. 中国食品学报, 2019, 19(4): 79-84.
[8] 陈虎. 改性β-葡聚糖提高黑果枸杞花青素稳定性的技术及功能性评价[D]. 西宁: 青海大学, 2018.
[9] 陈莎莎, 索有瑞, 白波, 等. 青藏高原黑果枸杞花青素稳定性评价[J]. 天然产物研究与开发, 2017, 29(2): 322-328.
[10] GB/T 12456—2008, 食品中总酸的测定[S]. 北京: 中国标准出版社, 2008.
[11] SUN G L, LIN X, SHEN L, et al. Mono-PEGylated radix ophiopogonis polysaccharide for the treatment of myocardial ischemia[J]. European Journal of Pharmaceutical Sciences, 2013, 49(4): 629-636.
[12] ZHANG X J, WANG W N, TAN L L, et al. Effects of curing means on starch content and amylase activity in flue-cured tobacco[J]. Tobacco Science and Technology, 2015, 48(5): 57-60;79.
[13] LEE J, DURST R W, WROLSTAD R E. Determination of total monomeric anthocyanin pigment content of fruit juices, beverages, natural colorants, and wines by the pH differential method: collaborative study[J]. Journal of Aoac International, 2005, 88(5): 1 269-1 278.
[14] ZHAO C Q, ZHAO X X, ZHANG J, et al. Screening of Bacillus strains from sun vinegar for efficient production of flavonoid and phenol[J]. Indian Journal of Microbiology, 2016, 56(4): 498-503.
[15] GB/T 5009.157—2016, 食品中有机酸的测定[S]. 北京: 中国标准出版社, 2016.
[16] ISLAM F, QUADERY T M, CHOWDHURY S R, et al. Antioxidant and cytotoxic activities of Mussaenda macrophylla[J]. Bangladesh Pharm J, 2012, 15(1): 69-71.
[17] YILDIRIM A, MAVI A, KARA A A. Determination of antioxidant and antimicrobial activities of Rumex crispus L. extracts[J]. Journal of Agricultural & Food Chemistry, 2001, 49(8): 4 083-4 089.
[18] KUNTAL G, MOUSUMI R, ATANU A, et al. Role of probiotic Lactobacillus fermentum KKL1 in the preparation of a rice based fermented beverage[J]. Bioresource Technology, 2015, 188: 161-168.
[19] 韦仕静, 刘涛, 葛亚中, 等. 西兰花酵素在发酵过程中生化指标变化及其抗氧化活性研究[J]. 现代食品科技, 2017, 33(8): 123-129.
[20] 樊秋元, 朱丹, 牛广财, 等. 黑加仑酵素有机酸分析及其体外抗氧化性能研究[J]. 中国酿造, 2019, 38(5): 159-163.
[21] 谢娟娟. 深古菌乙酸代谢和光合作用特殊基因的起源[D]. 上海: 上海交通大学, 2017.
[22] ZHAO H F, ZHOU F, DZIUGAN P, et al. Development of organic acids and volatile compounds in cider during malolactic fermentation[J]. Czech Journal of Food Science, 2014, 32(1): 69-76.
[23] 程勇杰, 陈小伟, 王珍珍, 等. 树莓酵素与蓝莓酵素有机酸分析及其体外抗氧化性能[J]. 食品工业科技, 2017, 38(20): 141-145.
[24] NAGENDRA P K, YANG B, DONG X H, et al. Flavonoid contents and antioxidant activities from Cinnamomum species[J]. Innovative Food Science and Emerging Technologies, 2009, 10(4): 627-632.
[25] COELHO E M, AZEV DO L C, CORR
DO L C, CORR A L C, et al. Phenolic profile, organic acids and antioxidant activity of frozen pulp and juice of the jambolan (Syzygium cumini)[J]. Journal of Food Biochemistry, 2016, 40(2): 211-219.
A L C, et al. Phenolic profile, organic acids and antioxidant activity of frozen pulp and juice of the jambolan (Syzygium cumini)[J]. Journal of Food Biochemistry, 2016, 40(2): 211-219.
[26] 蒋增良, 刘晓庆, 王珍珍, 等. 葡萄酵素有机酸分析及其体外抗氧化性能[J]. 中国食品学报, 2017, 17(5): 255-262.