甜橙是产量最高的柑橘栽培品种,果皮精油是其最重要的加工产品之一。作为天然香料,甜橙油被广泛应用于食品、香精香料、医药和化妆品等行业,它具有舒缓镇静、抗氧化、降血压、祛痰止咳、平喘等多种功能活性[1-3],具有重要的开发利用价值。
重庆地处国家“长江上中游柑橘优势带”的核心区域,是我国主要的甜橙产地和加工省份。近年来重庆大力推进柑橘晚熟产业的发展,晚熟甜橙种植面积不断扩大[4]。不同于普通甜橙集中在冬季上市,晚熟甜橙一般于翌年3~5月成熟,对于改善柑桔品种结构和调节市场供应有重要的价值。其中,奥林达夏橙和五月红甜橙具有丰产优质、大小适中等特性,晚熟血橙保留了塔罗科血橙肉质细嫩、风味独特的品质,现已成为主栽的晚熟良种。虽然晚橙的推广带来了显著的经济效益,然而柑橘产业发展仍未摆脱鲜销为主、商品化处理相对薄弱的困境;同时,橙汁加工过程中产生的皮渣和皮油水通常经简单处理后填埋或丢弃,精深加工比例低,造成资源浪费和环境问题。对于晚熟甜橙精油的开发能够在一定程度上减轻上述压力,并提升晚熟甜橙的产品附加值。
不同产区、品种和制备方法会对柑橘精油的品质和各组分含量产生重要影响。NJOROGE等[5]研究发现β-水芹烯、(Z)-橙花叔醇、香橙烯等物质可作为区分伏令夏橙和华盛顿脐橙精油的关键物质。在前期研究中发现瓦伦西亚橘烯是重庆产伏令夏橙皮油中含量最高的倍半萜类物质,而根据文献[5]报道,在肯尼亚伏令夏橙皮油中α-金合欢烯在倍半萜类物质中含量最高,且未检测到瓦伦西亚橘烯。在精油制备的各类方法中,冷磨(榨)法是生产高品质甜橙精油的主要方法[6],然而目前还未见对重庆地区晚熟甜橙冷磨精油(cold-pressed oil, CPO)的挥发性成分进行系统分析和研究的报导。
一般认为,样品所有的挥发性物质中仅有一小部分参与构建其香气的主体[7]。BUTTERY等[8]认为含量高且阈值低的香气物质很可能是果品的特征香气或主体香气成分。香气化合物的浓度与感受阈值的比值被定义为香气活度值(odor activity values, OAV),是一种分析香气贡献度的常用方法,通常认为OAV>1的物质对样品香气有显著贡献[9]。
本研究通过顶空固相微萃取-气相色谱-质谱联用技术(headspace solid-phase micro-extraction-gas chromatography-mass spectrometry, HS-SPME-GC-MS)对重庆地区的奥林达、五月红和晚熟血橙的冷磨果皮精油中挥发性成分进行定性和内标法定量分析,比较其挥发性物质的种类、组成及含量,并结合OAV探究各品种CPO中的主体香气成分对整体香气特征的贡献,从而为本地区晚熟甜橙精油资源的开发利用提供前期数据支撑。
1 材料与方法
1.1 材料与试剂
成熟奥林达夏橙、五月红甜橙和晚熟血橙果实均采于中国农业科学院柑桔研究所资源圃;环己酮(>99.5%),Aladdin公司;乙酸辛酯(>99.5%),源叶生物公司;C5-C25正构烷烃(色谱级),Honeywell公司。
1.2 仪器与设备
9N50型碟片式分离机,青海农牧机械制造有限公司;Sorvall ST 16R高速冷冻离心机,美国Thermo公司;Agilent 7890 GC-5977 MSD气相色谱-质谱联用仪,美国Agilent公司;85 μm,CAR/PDMS固相微萃取装置,美国Supelco公司;0-40-70-100酒精密度计,同辉仪表厂。
1.3 试验方法
1.3.1 冷磨橙皮精油的制备
冷磨橙皮油的制备参考MATTHEWS[10]的方法并稍作修改,具体步骤为:分别称取各品种甜橙果实3.3 kg,量取1.4 L自来水于玻璃容器中,在水中用不锈钢锉板对果实表皮进行适度锉磨,使油胞破裂释放其中的皮精油;皮精油在水中逐渐积累,达到并超过其饱和溶解量。为减少皮油成分的挥发损失,容器全程置于冰水浴中。所得皮油乳液经200目纱布过滤去除大部分不溶性皮渣后,采用碟片式分离机进行第一级离心,循环多次获得浓缩皮油乳液,再于4 ℃高速冷冻离心机中以8 000 r/min进行二级离心,收集上层澄清精油,而后置于-18 ℃充氮密闭冻藏备用。
1.3.2 顶空固相微萃取
取50 μL精制冷磨油于18 mL顶空瓶中。用待测油样将环己酮和乙酸辛酯分别稀释至0.19 μmol/mL和0.20 μmol/mL,取2.5 μL稀释液作为内标加入瓶中,充入氮气后密闭。样品于40 ℃水浴中平衡30 min,静态顶空固相微萃取吸附15 s,立刻进行GC-MS检测。
1.3.3 GC-MS检测条件
气相条件:DB-5 MS毛细管柱(30 m×0.25 mm×0.25 μm),进样口温度230 ℃,不分流;升温程序: 35 ℃保持3 min,以6 ℃/min升温至203 ℃,再以10 ℃/min升温至243 ℃并保持3 min。载气为高纯氦气,气体流速:1.2 mL/min。
质谱条件:电子轰击离子源,70 eV;离子源温度230 ℃;质量扫描范围m/z:40~350。
1.4 数据分析与统计
定性分析:采用Wiley 2010版和Nist 2014版整合谱库做质谱检索匹配,结合DB-5 MS色谱柱的保留指数进行定性。
保留指数(retention index, RI):将C5-C25正构烷烃混合标准品按1.3.3条件进样,确定各物质保留时间,根据公式(1)进行计算:
(1)
式中:t′(i)、t′(z)、t′(z+1)分别代表待测组分及碳数为z、z+1正构烷烃的调整保留时间,min。
内标法定量分析:以环己酮和乙酸辛酯为内标物质,环己酮用于D-柠檬烯及其之前出峰物质的定量分析,乙酸辛酯用于D-柠檬烯之后物质的定量分析。待测组分在精油中的物质的量浓度X(μmol/mL)根据公式(2)计算:
(2)
式中:Ai,待测组分峰面积;ns,内标物物质的量(μmol);As,内标物的峰面积;V,顶空瓶中样品体积,mL;f,摩尔相对校正因子。在70 eV电子轰击条件下,可近似认为等摩尔的各目标物质和内标物的离子化效率相同或相近,其质谱响应(TIC峰面积)也相近,故以摩尔相对校正因子约等于1进行定量计算。
所有实验均测定3组平行样品,实验结果用平均值±标准偏差表示。
1.5 香气活度值分析
香气活度值通过公式(3)计算:
OAV=挥发性成分浓度÷香气阈值
(3)
其中各物质香气阈值由查阅相关文献[11-12]得到。
2 结果与分析
2.1 冷磨精油中挥发性物质的定性和定量分析
经SPME富集的3个品种甜橙CPO挥发性物质的总离子流图如图1所示。

a-奥林达;b- 五月红;c-晚熟血橙
图1 三个晚熟品种甜橙冷磨精油的总离子流图
Fig.1 Total ion chromatogram of volatile compounds in three varieties of late-maturing sweet orange CPO
注:图中标注高响应物质的色谱峰,编号见表1;IS1,内标物质1,环己酮;IS2,内标物质2,乙酸辛酯;0~5 min和22.5~38 min内只有极少数物质流出,浓度极低,予以略去。
通过对色谱峰进行谱库检索及保留指数对比[13-14],从3个CPO中初步鉴定出68种挥发性成分,其中63个物质经两个质谱库检索和RI值双重定性确认,5个物质未检索到对应RI值,但两个质谱库检索匹配度均高于93%。奥林达、五月红和晚熟血橙中分别含有53、54和52种挥发性物质,占各自总离子响应的98.93%、99.58%及99.16%。各挥发性物质的名称、性质及浓度信息见表1。
表1 三个晚熟品种甜橙冷磨精油中的挥发性物质
Table 1 Volatile compounds contained in three varieties of late-maturing sweet orange CPO

序号物质名称质谱库匹配度/%RI文献值RI计算值奥林达五月红血橙挥发性物质浓度/(μmol·mL-1)奥林达五月红血橙定性方法分类12-甲基-2-丙醇2-Methyl-2-propanol95NA-524520-0.02±0.000.02±0.00MS∗醇类2己醛 Hexanal977968018018010.43±0.110.35±0.071.16±0.23MS、RI醛类32,4-二甲基-1-庚烯2,4-Dimethyl-1-heptene96NA8398398390.06±0.010.1±0.010.08±0.00MS其他4(E)-2-己烯醛(E)-2-Hexenal848508548548540.10±0.030.01±0.000.43±0.05MS、RI醛类5α-侧柏烯 α-Thujene989309279279271.15±0.031.78±0.032.74±0.00MS、RI单萜类6α-蒎烯 α-Pinene9893993693693614.82±0.0317.53±1.1420.16±0.25MS、RI单萜类7(-)-β-香茅烯(-)-β-Citronellene97950--944--0.03±0.01MS、RI单萜类8莰烯 Camphene939539529529520.07±0.000.09±0.010.12±0.01MS、RI单萜类9桧烯 Sabinen989769759759756.79±0.299.81±0.6415.03±0.21MS、RI单萜类10β-蒎烯 β-Pinene969809809809800.87±0.202.16±0.321.57±0.04MS、RI单萜类113-薄荷烯 3-Menthene96988987987-0.07±0.014.88±0.38-MS、RI单萜类12β-月桂烯 β-Myrcene9799199299199135.48±1.8036.69±2.3839.04±1.36MS、RI单萜类13辛醛 Octanal921 0021 0051 0061 0111.88±0.281.73±0.132.88±0.49MS、RI醛类14α-萜品烯 α-Terpinene971 018--1 022--0.05±0.00MS、RI单萜类15D-柠檬烯 D-Limonene981 0311 0481 0521 055493.96±3.77540.81±5.33460.39±26.78MS、RI单萜类16γ-萜品烯 γ-Terpinene991 0711 0691 0701 06825.30±0.9550.73±4.7956.95±4.01MS、RI单萜类171-辛醇 1-Octanol941 068-1 075--1.42±0.05-MS、RI醇类18对-薄荷-3,8-二烯p-Mentha-3,8-diene 951 0731 0791 0791 0785.89±0.4315.53±2.0515.62±0.11MS、RI单萜类19异萜品油烯Isoterpinolene931 0881 0881 0881 0870.40±0.010.18±0.010.83±0.04MS、RI单萜类20α-萜品油烯α-Terpinolene991 0911 0921 0931 09292.76±1.27198.57±20.74190.49±6.51MS、RI单萜类21对伞花烃 p-Cymenene971 0911 0961 0961 09634.27±0.6345.06±4.2456.45±2.75MS、RI单萜类22芳樟醇 Linalool981 1001 1031 1031 10347.2±3.4743.23±0.8932.49±0.94MS、RI醇类23壬醛 Nonanal941 1031 1081 1081 1077.81±0.845.01±0.331.94±0.75MS、RI醛类243,5-二甲基苯甲醇3,5-Dimethylbenzenemethanol 96NA1 1121 112-0.29±0.020.29±0.04-MS醇类251,3,8-对-薄荷三烯1,3,8-p-Menthatriene941 1151 1181 1181 1181.85±0.492.54±0.902.74±0.32MS、RI单萜类26β-罗勒烯 β-Ocimene981 1341 1311 1341 1334.29±0.461.50±0.162.90±0.54MS、RI单萜类27顺式-氧化柠檬烯cis-Limonene oxide931 1321 1381 1391 1380.79±0.220.75±0.181.12±0.19MS、RI单萜类28别罗勒烯Neo-allo-ocimene951 0441 1431 1431 1439.27±0.584.74±0.1610.38±0.82MS、RI单萜类29香茅醛 Citronellal961 1521 1551 155-15.8±1.0214.73±0.55-MS、RI醛类30顺式-薄荷酮cis-Menthone851 163-1 162--0.15±0.03-MS、RI酮类31新异胡薄荷醇Neoisopulegol891 1501 1651 165-0.62±0.100.53±0.02-MS、RI醇类32异胡薄荷醇iso-pulegol831 150-1 1721 165-0.35±0.050.58±0.01MS、RI醇类33松油烯-4-醇 Terpinen-4-ol841 1821 1861 1861 1860.51±0.050.58±0.190.61±0.13MS、RI醇类34顺式-对-薄荷-1(7),8-烯-2-醇cis-p-Mentha-1(7),8-dien-2-ol811 1891 1921 1921 1910.50±0.241.30±0.211.35±0.30MS、RI醇类35α-松油醇 α-Terpineol941 1931 2001 2001 2003.34±0.313.88±0.051.36±0.44MS、RI醇类36顺式-二氢香芹酮cis-Dihydrocarvone881 2001 2031 2031 2030.57±0.123.36±0.521.68±0.17MS、RI酮类37癸醛 Decanal991 2031 2081 2081 20819.74±2.919.91±1.796.8±2.17MS、RI醛类38反式-二氢香芹酮 trans-Dihydrocarvone961 201-1 2101 210-2.15±1.112.28±0.14MS、RI酮类39反式-香芹醇 trans-Carveol841 2171 2231 2231 2231.75±0.413.87±0.762.91±0.47MS、RI醇类40对-薄荷-1-烯-9-醛p-Menth-1-en-9-al95NA1 2251 2251 2251.27±0.083.44±0.501.82±0.79MS醛类41香茅醇 Citronellol941 2241 227-1 2270.74±0.08-1.69±0.48MS、RI醇类42异香芹醇iso-carveol931 2311 233--0.26±0.01--MS、RI醇类43顺式-香芹醇 cis-Carveol841 2291 2361 2361 2360.33±0.090.68±0.230.58±0.09MS、RI醇类44橙花醛 Neral931 2411 2411 241-2.06±0.141.49±0.20-MS、RI醛类45香芹酮 (-)-Carvone811 2491 2491 2491 2491.46±0.213.28±0.712.44±0.33MS、RI酮类
续表1

序号物质名称质谱库匹配度/%RI文献值RI计算值奥林达五月红血橙挥发性物质浓度/(μmol·mL-1)奥林达五月红血橙定性方法分类46胡椒酮 Piperitone911 253--1 254--0.24±0.02MS、RI酮类47香芹鞣酮 (+)-Carvotanacetone921 247-1 254--0.33±0.16-MS、RI酮类48香芹烯酮 Carvenone951 258-1 2621 262-1.23±0.050.56±0.09MS、RI酮类49香叶醛 Geranial941 2701 2691 2691 2701.63±0.101.12±0.310.22±0.01MS、RI醛类50紫苏醛 Perillaldehyde931 2791 2811 2811 2811.17±0.160.87±0.030.63±0.18MS、RI醛类51百里酚m-Thymol891 290-1 2901 290-0.49±0.060.41±0.02MS、RI酚类52香芹酚 Carvacrol861 2991 3001 2981 2980.36±0.021.83±0.510.63±0.09MS、RI酚类537-甲基-1-十一碳烯 7-Methyl-1-undecene93NA-1 318--0.45±0.01-MS其他54α-毕澄茄烯 α-Cubebene821 3511 352--0.21±0.00--MS、RI倍半萜类55古巴烯 Copaene921 3761 3831 3821 3830.72±0.030.44±0.020.5±0.02MS、RI倍半萜类56β-榄香烯 β-Elemene821 3911 394--0.27±0.01--MS、RI倍半萜类57十二醛 Dodecanal841 4071 4101 410-0.47±0.040.09±0.03-MS、RI醛类58反式-石竹烯 trans-Caryophyllene851 4321 4291 4291 4290.26±0.030.10±0.010.21±0.01MS、RI倍半萜类59β-古巴烯 β-Copaene931 432--1 438--0.17±0.02MS、RI倍半萜类60蛇麻烯 Humulene851 4401 438-0.29±0.01--MS、RI倍半萜类61α-姜黄烯 α-Curcumene811 4811 4841 4841 4840.16±0.04tr0.18±0.00MS、RI倍半萜类62β-蛇床烯β-Selinene911 4901 492--0.15±0.03--MS、RI倍半萜类63γ-古芸烯γ-Gurjunene891 477-1 493--0.18±0.00-MS、RI倍半萜类64β-花柏烯 β-Chamigrene931 478--1 492--0.25±0.02MS、RI倍半萜类65瓦伦西亚橘烯 Valencene931 5061 5001 5001 5002.28±0.251.37±0.063.85±0.26MS、RI倍半萜类66δ-杜松萜烯 δ-Cadinene841 5241 5241 5231 5230.27±0.020.13±0.010.19±0.00MS、RI倍半萜类67顺式-去氢白菖烯 cis-Calamenene881 5211 5281 5281 5280.79±0.140.80±0.170.97±0.06MS、RI倍半萜类68卡达烯 Cadalene871 6771 6881 6891 688trtrtrMS、RI倍半萜类
注:MS,质谱定性;RI,保留指数定性;NA 未在文献中找到对应RI;* 初步鉴定;- 未检出;tr 检测到痕量但无法准确定量分析
2.2 不同品种精油中挥发性物质的分类比较
对精油样品中的挥发性成分按结构归类,各类别化合物数量的分布情况如图2所示。

图2 三个晚熟品种甜橙冷磨精油中挥发性物质种类及其所含化合物数量
Fig.2 Category and quantity of volatile compounds in three varieties of late-maturing sweet orange CPO
注:柱状图上方数字表示各类挥发性物质的数量
3个品种CPO共同含有40个可定量成分,约占各品种CPO挥发性物质总数的2/3,包括:单萜类15个、倍半萜类7个、醇类7个、醛酮类10个及其他化合物1个,这些共有成分形成了甜橙冷磨精油挥发性物质的基本组成构架。在这些物质中,单萜类的D-柠檬烯浓度最高(见表1),但其在精油中的含量均远低于80%。天然柑橘精油商品化过程中常会进行脱萜处理,即通过精馏将D-柠檬烯部分乃至全部脱除,从而提高其他挥发性成分及主要香气物质的浓度[15]。本研究中,3个重庆主栽晚熟甜橙CPO中D-柠檬烯含量较低,对其脱萜所用能耗也更低,因而适用于加工浓缩(高倍)精油。除D-柠檬烯外的各类挥发性物质在3个品种甜橙CPO中的物质的量浓度信息如表2所示。
表2 三个晚熟品种甜橙冷磨精油中除D-柠檬烯外各类挥发性物质的总浓度 单位:μmol/mL
Table 2 Total concentration of volatile compounds, excluding D-limonene, in each structural category in three varieties of late-maturing sweet orange CPO
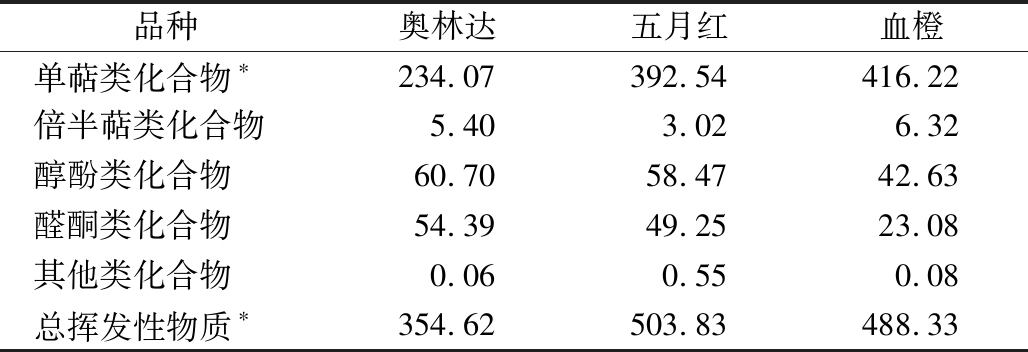
品种奥林达五月红血橙单萜类化合物∗234.07392.54416.22倍半萜类化合物5.403.026.32醇酚类化合物60.7058.4742.63醛酮类化合物54.3949.2523.08其他类化合物0.060.550.08总挥发性物质∗354.62503.83488.33
注:“*”不包括D-柠檬烯
单萜类化合物是甜橙冷磨精油的主要成分。从奥林达、五月红、晚熟血橙中分别鉴定出17、17和18种单萜类化合物,其中β-月桂烯(3.5%~4.2%)、α-蒎烯(1.7%~2.1%)和桧烯(0.8%~1.6%)等物质的量最高。γ-萜品烯在甜橙中鲜有报道[16],本研究的3种样品中,其占单萜类成分的比例均大于2%。3种精油在单萜类上的组成差异体现在一些浓度极低的物质上,如(-)-β-香茅烯与α-萜品烯仅在晚熟血橙中鉴定出,而3-薄荷烯仅在奥林达和五月红中鉴定出。
倍半萜类化合物于3种CPO中浓度都较低,与文献报道一致[17]。在奥林达、五月红和晚熟血橙中其总浓度分别为5.40、3.02和6.32 μmol/mL。瓦伦西亚橘烯在所有样品中均是浓度最高的倍半萜类物质,其中晚熟血橙CPO所含瓦伦西亚橘烯占其倍半萜类物质总量的60.91%。倍半萜类成分在3个品种CPO中的分布差异显著(P<0.05),α-毕澄茄烯、β-榄香烯、蛇麻烯、β-蛇床烯仅在奥林达CPO中发现,γ-古芸烯仅在五月红CPO中检出,而β-古巴烯、β-花柏烯仅见于晚熟血橙CPO中。这些物质或可成为区别各品种CPO的特征挥发性成分。
在奥林达、五月红和晚熟血橙CPO中分别检测出11、13和11个醇/酚类物质,其中芳樟醇在3个品种中均为最高;其他共有物质包括松油烯-4-醇、α-松油醇、反式-香芹醇、顺式-香芹醇和香芹酚。异香芹醇仅在奥林达CPO中检出,在其他2种CPO中未检出;五月红CPO中未检出香茅醇,但其所含1-辛醇未在其他品种中发现。
多种醛酮被认为是柑橘精油的重要呈香物质[18],一般由醇类氧化或是酸还原所得。辛醛、癸醛、壬醛、己醛、对-薄荷-1-烯-9-醛及香芹酮是3个CPO中共有的主要醛酮类物质,占其物质总量的70%以上。香茅醛是一种阈值很低(油中为0.1 μg/g)的呈现花香味的挥发性物质[9],其在奥林达和五月红CPO中的浓度较高,分别为15.80 μmol/mL和14.73 μmol/mL,但在晚熟血橙中并未检出。
在3种晚熟甜橙CPO中未发现能被准确定性的酯类物质,此外还检出2种其他类别物质,主要为脂肪烃类化合物。它们不被认为是柑橘精油的呈香物质[6, 19-20]。
2.3 不同品种精油的香气活度分析与香气特征比较
不同的挥发性物质由于自身香气阈值以及在各品种CPO中的浓度不同,导致它们对整体香气的贡献存在差异。测得奥林达、五月红和晚熟血橙3个品种的CPO密度分别为0.84、0.84和0.85 g/mL,利用文献记载的香气阈值计算3个CPO中各挥发性物质的OAV,根据OAV>1的标准整理出对精油香气有显著贡献的香气物质共30个,并依据数据库[13-14]和文献资料[17, 21-24]按各物质香气特征归纳其主体香气类别,结果如表3所示。
表3 三个晚熟品种甜橙冷磨精油中主体香气物质的香气活度值和香气特征描述
Table 3 Odor activity values (OAVs) and aroma characteristics of principal aroma volatile components in three varieties of late-maturing sweet orange CPO

物质名称香气阈值/(μg·mg-1)香气活度值(OAVs)奥林达五月红血橙香气特征描述己醛 Hexanal0.073a496 403 1 353 [A] 青草香α-蒎烯 α-Pinene2.082b815 964 1 121 [B] 松香桧烯 Sabinen0.98a793 1 145 1 776 [H] 草本香β-蒎烯 β-Pinene1.5a66 165 121 [B] 松香β-月桂烯 β-Myrcene0.915b4 437 4 589 4 941 [D] 油脂香辛醛 Octanal0.248b816 751 1 266 [D] 油脂香[23]α-萜品烯 α-Terpinene0.08b--72 [E] 柑橘香D-柠檬烯 D-Limonene3.5b16 151 17 683 15 233 [E] 柑橘香γ-萜品烯 γ-Terpinene2.89b1 002 2 009 2 282 [H] 草本香[23]1-辛醇 1-Octanol0.1b-1 553 -[A] 青草香[23]α-萜品油烯 α-Terpinolene0.041a258 898 554 220 537 997 [E] 柑橘香对伞花烃 p-Cymenene0.1a38 638 50 803 64 402 [E] 柑橘香芳樟醇 Linalool1.082b5 652 5 177 3 937 [F] 花香壬醛 Nonanal0.26b3 589 2 302 902 [G] 甜香[21] β-罗勒烯 β-Ocimene0.034a14 440 5 049 9 877 [A] 青草香顺式-氧化柠檬烯 cis-Limonene oxide0.3b337 320 483 [E] 柑橘香香茅醛 Citronellal0.1b20 471 19 084 -[F] 花香松油烯-4-醇 Terpinen-4-ol4.37b15 17 18 [C] 木香α-松油醇 α-Terpineol6.8b64 74 26 [F] 花香
续表3

物质名称香气阈值/(μg·mg-1)香气活度值(OAVs)奥林达五月红血橙香气特征描述癸醛 Decanal0.245b10 576 5 309 3 686 [D] 油脂香香茅醇 Citronellol0.04a2 428 -5 612 [F] 花香顺式-香芹醇 cis-Carveol0.25a169 348 300 [H] 香菜香橙花醛 Neral0.888b297 215 -[E] 柑橘香香芹酮 (-)-Carvone0.1a1 842 4 139 3 116 [H] 薄荷香香叶醛 Geranial0.41b508 349 69 [E] 柑橘香[22]紫苏醛 Perillaldehyde0.29b509 379 277 [H] 草本香[23]百里酚 m-Thymol0.188a-329 278 [C] 木香 香芹酚 Carvacrol0.07a649 3 299 1 149 [H] 香菜香十二醛 Dodecanal0.063b1 155 221 -[E] 柑橘香[24]反式-石竹烯 trans-Caryophyllene0.15a298 114 243 [C] 木香
注:a,物质在水中的阈值;b,物质在油中的阈值;-,未检出;[A~H] 分别代表:青香、松香、木香、油脂香、柑橘香、花香、甜香及草本香等8个香气属性类别
由表3可知,3个CPO中OAV较高的物质包括辛醛、癸醛、D-柠檬烯、芳樟醇、壬醛、对伞花烃、α-萜品油烯、己醛、α-蒎烯、β-月桂烯等,该结果与相关文献[10, 25]报道中的甜橙精油主要香味贡献成分一致。D-柠檬烯对于柑橘类产品香气的作用目前尚存争议[26, 27],有学者通过下调柠檬烯合成酶表达使其在橙皮中的浓度降低90倍,感官评价却发现处理组与对照组间并无显著差异[28],而另有研究认为D-柠檬烯存在与柑橘其他气味成分的协同作用[29]。鉴于表3中D-柠檬烯所呈现的高OAV,本文依旧将其纳入CPO的主体香气成分内。
通过表3中挥发性物质所对应香气描述词,将30个挥发性物质归为柑橘香韵(citrusy)、油脂香韵(fatty)、花香韵(flower)、青草香韵(green)、草本香韵(herb)、甜香韵(sweet)、松香韵(piney)及木香韵(woody)共8种香气属性。分别计算3个CPO中8种主体香气属性各自的总香气活度值,结果如图3所示。

图3 各主体香气属性的总香气活度值在3个晚熟品种 甜橙CPO中的分布差异
Fig.3 Total odor activity values (OAVs) distribution of each principal aroma attribute in three varieties of late-maturing orange CPO
由图3可知,3个CPO中橘香、花香和脂香属性的总OAV最高,木香和松香属性相对较低。花香、脂香和甜香的总OAV在奥林达CPO中最高,在晚熟血橙CPO中最低。芳樟醇被认为是橙皮油的三大主要香气成分之一,具有明确的花香气味[30];血橙CPO中芳樟醇仅为奥林达和五月红CPO中的68.8%和75.2%,同时还缺失了香茅醛,因而花香属性较弱。与之相对,晚熟血橙CPO中松香和木香成分的总香气活度最高,而奥林达CPO中最低,α-蒎烯和百里酚的含量差异或是其中的主要因素。
3 结论
通过HS-SPME-GC-MS分析从3个重庆主栽晚熟甜橙品种的果皮冷磨精油中共鉴定出68种挥发性物质,主要类别包括单萜、倍半萜、醇酚类以及醛酮等类,3个品种的D-柠檬烯含量均较低。奥林达夏橙、五月红甜橙和晚熟血橙CPO中分别鉴定出53、54和52种挥发性物质,通过香气活度值分析,发现3个品种CPO的主要香气贡献物质为对伞花烃、辛醛、己醛、壬醛、癸醛、芳樟醇、D-柠檬烯、α-萜品油烯、α-蒎烯、β-月桂烯等,形成了橘香、脂香、青香、松香、花香、甜香、木香和草本香等8种主体香气属性,其中橘香、花香和脂香是3个品种精油共同的主体香韵。花香、脂香及甜香总OAV在奥林达夏橙CPO中较高,而松香和木香总OAV在晚熟血橙CPO中较高。可充分利用不同晚熟甜橙CPO的主体香气特征开发细分产品,实现对晚熟甜橙资源的综合利用,进一步提升其经济价值。
[1] IM S J, KIM J H, KIM M Y. Evaluation of bioactive components and antioxidant and anticancer properties of citrus wastes generated during bioethanol production[J]. Natural Product Communications, 2014, 9(4):483-486.
[2] VAIO D C, GRAZIANI G, GASPARI A, et al. Essential oils content and antioxidant properties of peel ethanol extract in 18 lemon cultivars[J]. Scientia Horticulturae(Amsterdam), 2010, 126(1):50-55.
[3] LI G, WANG G J, CHENG Y, et al. Prophylactic effects of polymethoxyflavone-rich orange peel oil on Nω-nitro-L-arginine-induced hypertensive rats[J]. Applied Sciences, 2018, 8(5):752-767.
[4] 杨蕾,洪林,李勋兰,等.重庆市柑桔产业发展现状及问题分析[J]. 中国果业信息, 2018, 35(11):13-16.
[5] NJOROGE S M, KOAZE H, KARANJA P N, et al. Essential oil constituents of three varieties of Kenyan sweet oranges (Citrus sinensis)[J]. Flavour & Fragrance Journal, 2010, 20(1):80-85.
[6] 谢练武, 郭亚平, 周春山, 等. 压榨法与蒸馏法提取柑橘香精油的比较研究[J]. 化学与生物工程, 2005, 22(5):15-17.
[7] SONG H, CADWALLADER K R, SINGH T K. Odor-active compounds of Jinhua ham[J]. Flavor & Fragrance Journal, 2005, 23(1):1-6.
[8] BUTTERY R G, SEIFERT R M, GUADAGNI D G, et al. Characterization of additional volatile components of tomato[J]. Journal of Agricultural and Food Chemistry, 1971, 19(3):524-529.
[9] 洪鹏, 陈峰, 杨远帆, 等. 三种柚子精油的香味特征及挥发性成分[J]. 现代食品科技, 2014,30(10): 274-281.
[10] MATTHEWS R F, BRADDOCK R J. Recovery and applications of essential oil from orange[J]. Food Technology, 1987, 41(1):57-61.
[11] MOOKDASANIT J, HIROTOSHI T, TAKUMI Y, et al. Trace volatile components in essential oil of citrus sudachi by means of modified solvent extraction method [J]. Food Science and Technology Research, 2003,9(1): 54-61.
[12] TAMURA H, FUKUDA Y, PADRAYUTTAWAT A. Characterization of citrus aroma quality by odor threshold values[J]. Biotechnology for Improved Foods and Flavors, 1996, 637:282-294.
[13] Flavor database [DB/OL]. Florda State, USA: Citrus Research and Education Center, University of Florida, 2002 [2012-12-7] http: //www.crec.ifas.ufl.edu/crec_websites/Rouseff/Website2002/Subpages/database_f_Frameset.html.
[14] Flavor net and human odor space [DB/OL]. Geneva, NewYork, USA: Cornell University, 2004 [2012-12-07]. http://www.flavornet.org/flavornet.html.
[15] 杨颖, 施迎春, 陈剑兵, 等. 分子蒸馏精制对葡萄柚精油理化性质及赋香性能的影响[J]. 中国食品学报, 2013, 13(3): 208-213.
[16] SAWAMURA M. Volatile components of essential oils of the citrus genus[J]. Recent Research Developments in Agricultural & Food Chemistry, 2000, 4(3-4):S32-S33.
[17] MOSHONAS M G, SHAW P E. Compounds new to essential orange oil from fruit treated with abscission chemicals[J]. Journal of Agricultural & Food Chemistry, 1978, 26(6):1 288-1 293.
[18] ROJAS L, JENNIFER P I, PERE A, et al. Obtencion of essential oils and pectins from by-products of citrus juice[J]. Vitae -revista De La Facultad De Quimica Parmaceutica, 2009, 16(1): 110-115.
[19] 肖作兵, 马胜涛, 牛云蔚, 等. 感官评价和GC-MS结合偏最小二乘回归法分析甜橙油中的风味物质[J].中国食品学报, 2017, 17(7): 284-290.
[20] 乔宇. 柑橘汁香气活性化合物的鉴定及其在加工和储藏中的变化[D]. 武汉:华中农业大学, 2008.
[21] CICCHETTI, ESMÉRALDA, DUROURE L, et al. Characterization of odoractive compounds in Timur (Zanthoxylum armatum DC.) fruits from Nepal [J]. Flavor and Fragrance Journal, 2017, 32(5):317-329.
[22] 牛云蔚, 姚征民, 肖作兵, 等. AEDA结合OAVs分析两种薰衣草精油中特征性香气成分[J]. 食品工业, 2016,37(12): 264-268.
[23] CHOI H S. Character impact odorants of Citrus Hallabong [(C. unshiu Marcov × C. sinensis Osbeck)×C. reticulata Blanco] cold-pressed peel oil[J]. Journal of Agricultural and Food Chemistry, 2003, 51(9):2 687-2 692.
[24] SRIWICHAI T. Aromatic profiling of Zanthoxylum myriacanthum (makwhaen) essential oils from dried fruits using different initial drying techniques[J]. Industrial Crops and Products, 2019, 133:284-291.
[25] GONZ LEZ-MAS M C, RAMBLA J L, L
LEZ-MAS M C, RAMBLA J L, L PEZ-GRESA M P, et al. Volatile compounds in Citrus essential oils: A comprehensive review[J]. Frontiers in Plant Science, 2019, 10:1-12.
PEZ-GRESA M P, et al. Volatile compounds in Citrus essential oils: A comprehensive review[J]. Frontiers in Plant Science, 2019, 10:1-12.
[26] BUETTNER A, SCHIEBERLE P. Evaluation of aroma differences between hand-squeezed juices from Valencia Late and Navel Oranges by quantitation of key odorants and flavor reconstitution experiments[J]. Journal of Agricultural and Food Chemistry, 2001, 49(5):2 387-2 394.
[27] BAXTER I A, EASTON K, SCHNEEBELI K, et al. High pressure processing of Australian navel orange juices: Sensory analysis and volatile flavor profiling[J]. Innovative Food Science and Emerging Technologies, 2005, 6(4):372-387.
[28] RODR GUEZ A, PERIS J E, REDONDO A, et al. Impact of D-limonene synthase up- or down-regulation on sweet orange fruit and juice odor perception[J]. Food Chemistry, 2017, 217:139-150.
GUEZ A, PERIS J E, REDONDO A, et al. Impact of D-limonene synthase up- or down-regulation on sweet orange fruit and juice odor perception[J]. Food Chemistry, 2017, 217:139-150.
[29] PLOTTO A, CARLOS A, MARGAR A, et al. Odour and flavour thresholds for key aroma components in an orange juice matrix: terpenes and aldehydes[J]. Flavour and Fragrance Journal, 2004, 19(6):491-498.
A, et al. Odour and flavour thresholds for key aroma components in an orange juice matrix: terpenes and aldehydes[J]. Flavour and Fragrance Journal, 2004, 19(6):491-498.
[30] MACLEOD A J, MACLEOD G, SUBRAMANIAN G. Volatile aroma constituents of orange[J]. Phytochemistry, 1988, 27(7): 2 185-2 188.