环糊精葡萄糖基转移酶(cyclodextrin glycosyltransferase, CGTase)是一种多功能型酶,能催化4种不同的反应:3种转糖基反应(歧化反应、环化反应和偶合反应)和水解反应。现阶段,歧化、偶合反应主要用于制备甜菊糖苷[1]、葡萄糖苷[2]、L-抗坏血酸[3],环化活力主要应用于生产环糊精(cyclodextrin, CD)。根据反应初期产物中主要CD的类型[4],将CGTase分为α-CGTase、β-CGTase、γ-CGTase。由于γ-CGTase的主产物γ-CD存在分子空腔大、溶解性好及安全性高的独特优势,以及在小肠中γ-CD可被淀粉酶作用后降解吸收而α-CD、β-CD不能被降解[5],使得γ-CD在医药、食品、材料、环境、化妆品等领域有着特殊应用[6-9]。因此,γ-CGTase作为γ-CD生产中的关键酶制剂,对其进行筛选、改造及其生产γ-CD工艺条件的优化一直是研究热点。
γ-CGTase作用淀粉或其衍生物的产物为α-CD、β-CD、γ-CD的混合物,只在特定反应阶段中单一CD含量较高。目前已报道的γ-CGTase共有8种,来源于Bacillus sp. G-825-6[10]的γ-CGTase产物中γ-CD占总CD比例高且不产生α-CD,但淀粉转化率极低;来源于Bacillus clarkii 7364[11]的γ-CGTase产物中γ-CD比例高,但体系中存在的α-CD因溶解度高给γ-CD实际纯化带来不便。为此,国内外研究者在改变产物特异性方面进行了相关研究。王磊[12]在来源于Bacillus clarkii 7364的γ-CGTase作用淀粉反应体系中,加入5%(m/V)环十二酮来提高γ-CD产率;王宁[13]也利用同样的γ-CGTase,在反应体系中添加2%(m/V)甘草酸改变γ-CGTase产物比例;李林林[14]以Bacillus sp. G-825-6 γ-CGTase为基础,通过将211位酪氨酸突变为亮氨酸来改变产物特异性,产物专一性提高了40.94%。
总体而言,国内外现有的γ-CGTase菌株较少,且γ-CGTase产物特异性较差。为此,本研究将γ-CGTase共有保守区域及特有氨基酸作为判断指标,在美国国家生物信息中心(National Center for Biotechnology Information, NCBI)数据库中,通过序列比对及生物信息学分析,筛选出一种新型基因,并将其克隆表达后得到γ-CGTase;通过反应时间、淀粉质量浓度及乙醇浓度来改变γ-CGTase产物特异性,以期提供一种新型γ-CGTase以及为改变γ-CGTase产物特异性提供基础。
1 材料与方法
1.1 实验材料
1.1.1 实验试剂
α-CD、β-CD、γ-CD,上海阿拉丁生化科技股份有限公司;可溶性淀粉,国药集团化学试剂有限公司;溴甲酚绿,上海麦克林生化科技有限公司;BCA试剂盒,上海碧云天生物技术有限公司;蛋白上样缓冲液,上海生工生物工程股份有限公司;预染蛋白分子量标准,南京生兴生物技术有限公司;乙腈,美国TEDIA有限公司。化学试剂均为分析纯,国药集团化学试剂有限公司。
1.1.2 仪器与设备
蛋白电泳系统、凝胶成像系统,中国天能有限公司;超声波清洗器,上海声谱超声设备厂;高速冷冻离心机5804R,艾本德国贸易有限公司;酶标仪,美国Molecular Devices公司;超声波细胞破碎仪,宁波新芝生物科技股份有限公司;pH计,Mettler Toledo公司;电子天平,Mettler Toledo公司;高效液相色谱,日本岛津公司;Milli-Q-超纯水制备仪,默克有限公司;超高效液相色谱-质谱联用,美国waters公司。
1.2 实验方法
1.2.1 基因挖掘及序列分析
在NCBI数据库中,以目前报道的γ-CGTase为模板,进行序列相似性比较,选择比对结果中相似度在30% ~ 90%的序列进一步分析。以6个保守区域、3个关键氨基酸为CGTase的基本判断指标,-3亚位点47位氨基酸Thr、-3亚位点序列HP_G(E)GF_、-7亚位点 (145-152) D-----I区域为γ-CGTase特征鉴定依据,最终筛选得到来自于Bacillus sp. FJAT-44876的一段基因序列。利用MEGA6软件的Muscle模式和现有α-、β-、γ-CGTase进行序列比对,并绘制γ-CGTase保守区域及关键序列比对图。
1.2.2 酶的克隆表达
在北京华大基因公司合成来自于Bacillus sp. FJAT-44876的基因序列(NCBI登录号:WP 096185680),以pET-15b为载体,转至E. coli BL21(DE3)进行表达。将E. coli BL21(DE3)置于含100 μg/mL氨苄青霉素的LB肉汤培养基中,在37 ℃、200 r/min条件下摇床培养直至OD600达到0.4~0.6。随后,加入终浓度为40 μmol/L的IPTG进行诱导表达,于18 ℃、160 r/min条件下培养24 h。在4 ℃、10 000 r/min的条件下离心8 min获得菌体,随后用20 mmol/L Tris-HCl (250 mmol/L NaCl, pH 7.5)溶液洗涤2次并采用上述条件离心。将离心后的菌体置于冰水混合物中超声破碎20 min,最终4 ℃、10 000 r/min的条件下离心30 min获得粗酶液。
1.2.3 酶的分离纯化
首先利用去离子水和20 mmol/L Tris-HCl (250 mmol/L NaCl, pH 7.5)对镍亲和凝胶进行清洗和平衡,上样粗酶液,重力流穿后再依次利用含不同摩尔浓度咪唑溶液的20 mmol/L Tris-HCl (250 mmol/L NaCl, pH 7.5)进行洗脱,并收集洗脱液,最后对镍亲和凝胶进行平衡及保存,以上操作均在冰水浴条件下进行。随后采用聚丙烯酰胺凝胶电泳(SDS-PAGE)测定酶分子量和Bradford法测定酶浓度。
1.2.4 酶活力测定方法
参考FUWA [15]溴甲酚绿 (BCG)法并稍作改进,对上述步骤制得CGTase的环化活力进行测定。将900 μL 15 mg/mL可溶性淀粉和100 μL CGTase在50 ℃、pH 10.0条件下保温10 min,沸水浴10 min灭酶,再向上述体系中加入50 μL 1 mol/L HCl,100 μL 5 mol/L BCG以及2 mL 0.2 mol/L柠檬酸缓冲液 (pH 4.2),将反应混合物在室温下放置20 min后于630 nm处测定吸光值,其中空白不添加酶液。
酶活力单位定义为:每分钟生成1 mg γ-CD所需加酶量为1个酶活力单位 (U)。
1.2.5 γ-CGTase最适温度测定
将900 μL 15 mg/mL可溶性淀粉和100 μL (0.09 U) γ-CGTase混合,分别将反应温度设置在30~70 ℃范围内,间隔10 ℃,在pH 10.0条件下保温10 min,沸水浴10 min灭酶,测定不同温度下γ-CGTase酶活力。将最大酶活力者定义为100%,计算相对酶活力。以温度为横坐标,相对酶活力为纵坐标绘制温度-相对酶活力曲线。
1.2.6 γ-CGTase最适pH测定
配制20 mmol/L pH 3.0~12.0的缓冲溶液(pH 3.0~5.0醋酸盐缓冲液,6.0~8.0磷酸盐缓冲液,8.5~12.0甘氨酸-氢氧化钠缓冲液),使用该缓冲溶液配制不同pH下的15 mg/mL可溶性淀粉,取900 μL上述可溶性淀粉与100 μL (0.09 U) γ-CGTase混合,在50 ℃下保温10 min,沸水浴10 min灭酶,测定不同pH下γ-CGTase酶活。将最大酶活力者定义为100%,计算相对酶活力。以pH为横坐标,相对酶活力为纵坐标绘制pH-相对酶活力曲线。
1.2.7 动力学参数测定
以1、2、5、7.5、10、15、18、20 mg/mL不同质量浓度的可溶性淀粉作底物,在最适温度50 ℃、最适pH 10.0的条件下反应,测定酶学动力学参数。
1.2.8 有机溶剂对γ-CGTase酶活影响
将最终体积分数为1%的甲醇、乙醇、异丙醇、正丁醇、环己烷、十二醇加入到γ-CGTase中,4 ℃条件下放置1 h,测定不同有机溶剂作用下残余酶活力,将未添加有机溶剂的γ-CGTase酶活力定义为100%。
1.2.9 不同反应时间对γ-CGTase产物特异性影响
将15 mg/mL可溶性淀粉和γ-CGTase (5.23 U/g干基淀粉) 按比例混合,在pH 10.0、50 ℃的条件下保温2、4、6、8、10、15、20、30、40、50、60、90、120、150、180、240、300、360、420 min,利用HPLC测定不同时间下产物的生成。
1.2.10 不同淀粉浓度对γ-CGTase产物特异性影响
将10、15、30、50、70、100 mg/mL可溶性淀粉和γ-CGTase (5.23 U/g干基淀粉) 按比例混合,在pH 10.0、50 ℃的条件下反应6 h,利用HPLC测定最终产物。
1.2.11 不同乙醇体积分数数对γ-CGTase产物特异性的影响
以50 mg/mL可溶性淀粉为底物,添加γ-CGTase (5.23 U/g干基淀粉) 和最终体积分数为1%、1.5%、3%、5%、7%、10%的乙醇,在最适温度50 ℃、最适pH 10.0的条件下反应6 h,利用HPLC测定最终产物。
1.2.12 高效液相色谱(HPLC)法测定
参考JI[16]的方法并稍作修改。HPLC色谱条件为:XBridge Amide (4.6 mm × 250 mm, 5 μm) 分析柱;流动相为V(乙腈)∶V(水)=65∶35;柱温30 ℃;流速0.8 mL/min;进样量20 μL。
1.2.13 超高效液相色谱-质谱联用(UPLC-MS)测定
UPLC使用条件为:Waters-Acquity UPLC色谱仪;BEH Aminde (2.1 mm×100 mm, 1.7 μm)分析柱;流动相为纯乙腈(A液),0.1%氨水(B液);洗脱条件为75% A液与25% B液平衡5 min后洗脱15 min,65% A液与35% B液洗脱15 min,50% A液与50% B液洗脱15 min,最终使用100% A液保存柱子;柱温40 ℃;流速0.3 mL/min;进样量1 μL。MS使用条件:ESI-离子方式;毛细管电压3.0 V;离子源温度100 ℃;碰撞能量6 V;质谱范围(m/z)100~3 000。
1.2.14 数据处理方法
实验结果为3次数据的平均值,以其标准偏差表示误差线,利用Origin软件进行数据分析及作图。
2 结果与分析
2.1 γ-CGTase生物信息学分析
采用MEGA6软件将NCBI数据库中Bacillus sp. FJAT-44876的蛋白序列与已知表达α-CD、β-CD和γ-CD的CGTase序列进行比对,结果如图1-A所示。来源于Bacillus sp. FJAT-44876的蛋白序列共有5个结构域(数据未体现)[17]、6个保守区域、3个关键氨基酸,保守区Ⅲ、Ⅴ的Asp和保守区Ⅳ的Glu是 CGTase参与催化的保守残基[18],其中保守区Ⅲ的Asp为亲核基团,可作为稳定中间体,保守区Ⅳ的Glu 为可能的质子供体,保守区Ⅴ的Asp为底物结合位点。研究表明,CGTase在-3、-7亚位点特有氨基酸的差异将导致产物特异性不同[19],来源于Bacillus sp. FJAT-44876的蛋白序列与已知CGTase特有序列比对结果如图1-B所示。-3亚位点47位氨基酸是区分α-、β-、γ-CGTase的关键位点,来源于Bacillus sp. FJAT-44876的蛋白序列在该位点存在γ-CGTase特有氨基酸Thr,而α-、β-CGTase在相应位点主要为Lys或Arg,表明47位氨基酸在CGTase产物特异性中扮演着重要角色[20],同时,相比于α-、β-CGTase,γ-CGTase为具备更多空间结合糖基链以形成CD8,在-3亚位点存在序列HP_G(E)GF_,而α-、β-CGTase拥有序列INYSGVN(N)[21]。此外,为了拥有更大的空间,γ-CGTase在-7亚位点(145-152)缺失6个氨基酸形成D------I区域,以便促使γ-CD环的形成,而α-、β-CGTase分别为SSTDPSFA、SSDQPSFA。将基因序列与NCBI数据库序列进行BLAST比较,发现该序列与已知的γ-CGTase:Bacillus sp. G-825-6和 Bacillus clarki 7364相似度均为70%,依据生物信息学分析结果,初步判断克隆表达的酶为γ-CGTase。
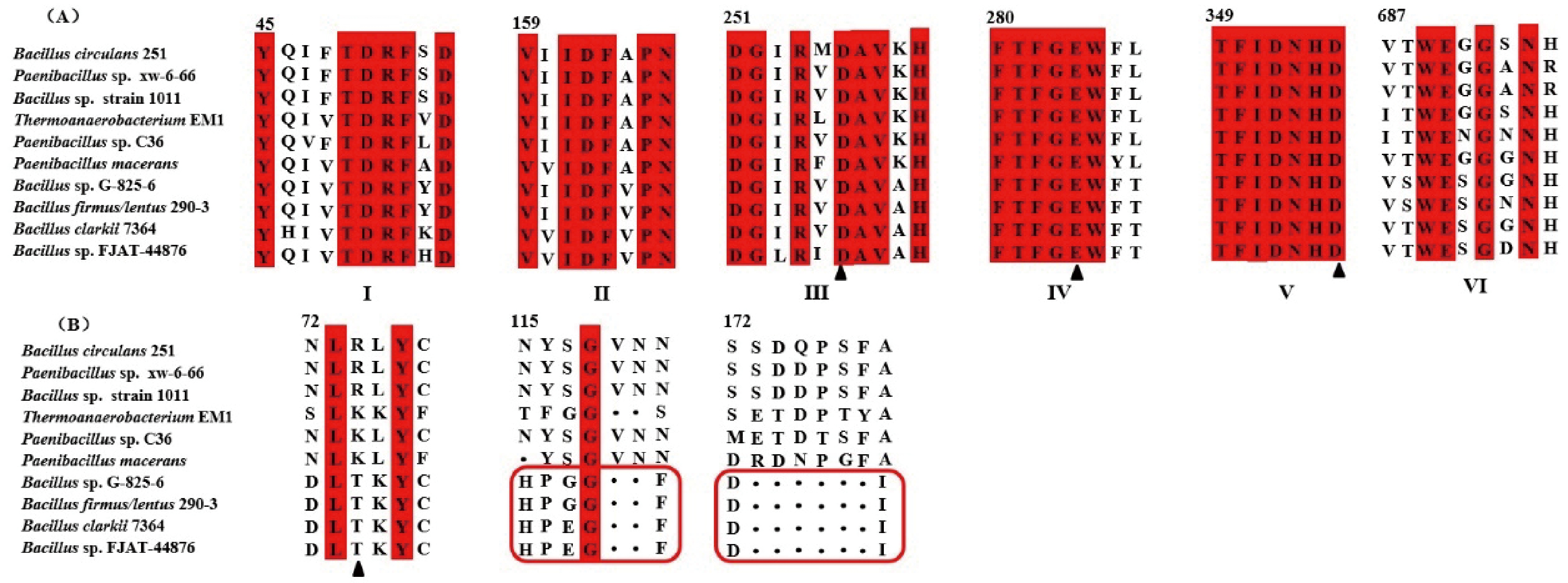
图1 γ-CGTase保守区域及关键序列分析
Fig.1 Conserved regions and the key amino acid sequence of γ-CGTase
注:(A)图中▲表示催化关键氨基酸;(B)图中▲表示α-、β-、γ-CGTase 47位特有氨基酸,□表示γ-CGTase-3、-7亚位点特有序列。α-、β-、γ-CGTase NCBI登录号为: Bacillus circulans 251 (GenBank P43379); Paenibacillus sp. xw-6-66 (GenBank AGG09664); Bacillus sp. strain 1001 (GenBank BAB18101); Thermoanaerobacterium EM1 (GenBank P26827); Paenibacillus sp. C36 (GenBank CAP72286); Paenibacillus macerans (AGT95840.1); Bacillus sp. G-825-6 (GenBank BAE87038); Bacillus firmus/lentus 290-3 (GenBank CAA01436); Bacillus clarkii 7364 (Gen- Bank BAB91217); Bacillus sp. FJAT-44876 (GenBank WP 096185680)
2.2 重组蛋白质的分离纯化
利用SDS-PAGE对镍亲和凝胶纯化后的γ-CGTase进行分子量测定。来源于Bacillus sp. FJAT-44876编码的蛋白质由711个氨基酸组成,氨基酸序列计算的理论分子量为80.039 kDa。SDS-PAGE结果显示目的条带分子量大约为80 kDa(图2),与理论值相近,表明重组酶成功表达。
2.3 γ-CGTase定性分析

图2 纯化后γ-CGTase的SDS-PAGE分析
Fig.2 SDS-PAGE analysis of γ-CGTase from purification
以900 μL 15 mg/mL可溶性淀粉为底物,加入γ-CGTase (0.09 U) 在50 ℃、pH 10.0条件下反应2 h,利用HPLC对产物进行定性分析,结果如图3所示。HPLC图谱显示,反应2 h时主要产物为γ-CD;此外,利用UPLC-MS (图4) 进一步验证,保留时间为8.370的质谱表明,此物质的[M-H]-=1 295.5,则其相对分子质量为1 297,与γ-CD标准品出峰位置及相对分子质量一致(数据未显示),确定该物质为γ-CD。由于CGTase种类依据反应初期其主产物类型进行判断[4],故进一步确定该酶为γ-CGTase。
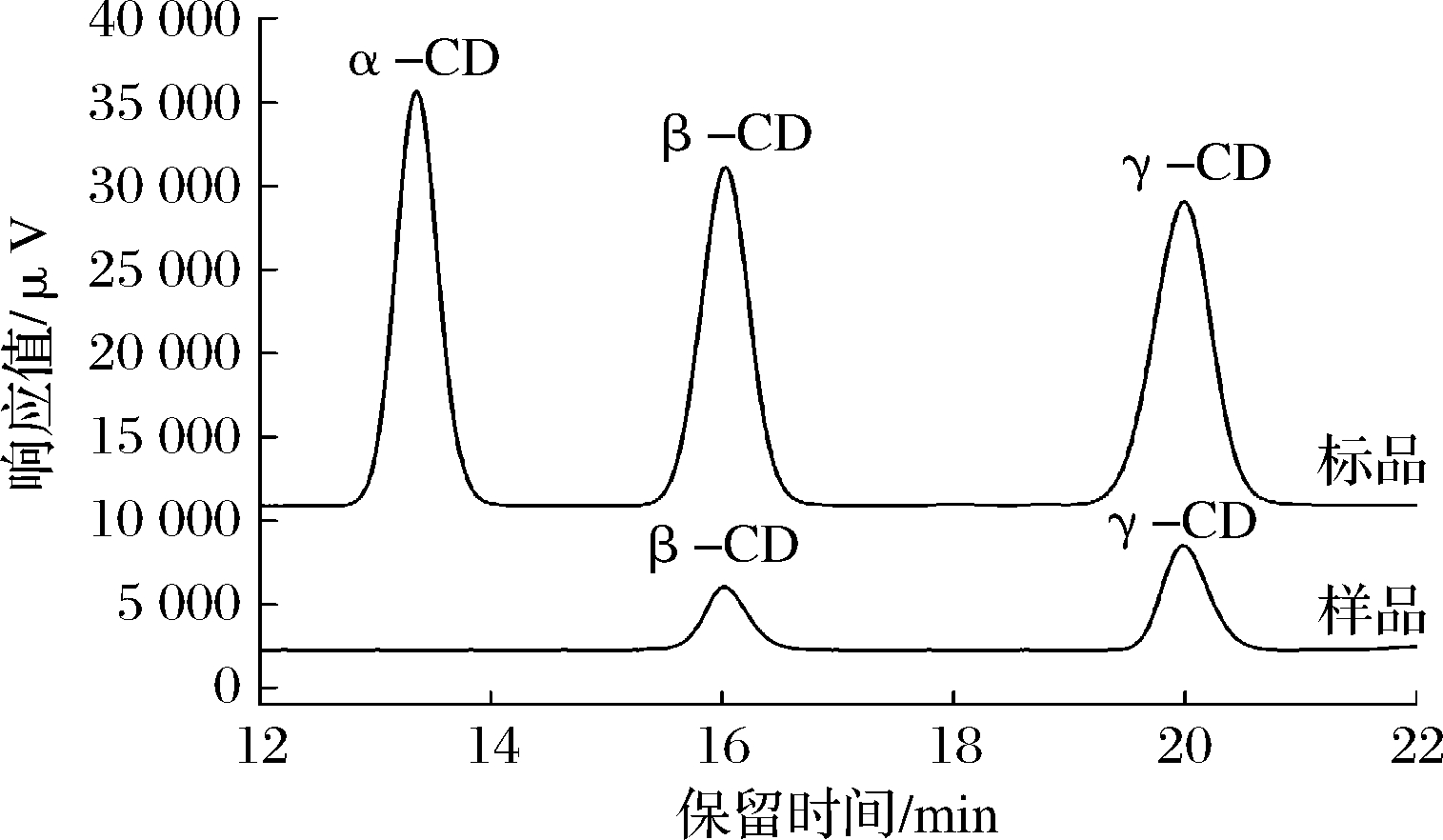
图3 γ-CGTase产物高效液相色谱图
Fig.3 HPLC analysis of the products formed by γ-CGTase
注:α-、β-、γ-CD标品浓度均为8 mg/mL

图4 γ-CGTase产物的超高效液相色谱-质谱联用图
Fig.4 UPLC-MS analysis of the products formed by γ-CGTase
2.4 γ-CGTase的最适温度
温度是影响酶催化作用的一个重要因素,在最适温度下,酶催化活性最强,酶促反应速率最大,当反应温度高于或低于最适温度时,酶活力均会降低进而影响酶促反应速率。由图5可知,γ-CGTase的最适温度为50 ℃,与现有报道的γ-CGTase最适温度40~65 ℃接近[22-23]。γ-CGTase酶活力随反应温度的升高而呈上升趋势,当温度达到50 ℃时,其酶活力最大,酶促反应速率最快,随后,温度的不断升高导致酶活力持续下降,最直接原因是高温使酶空间结构破坏,酶活力降低。
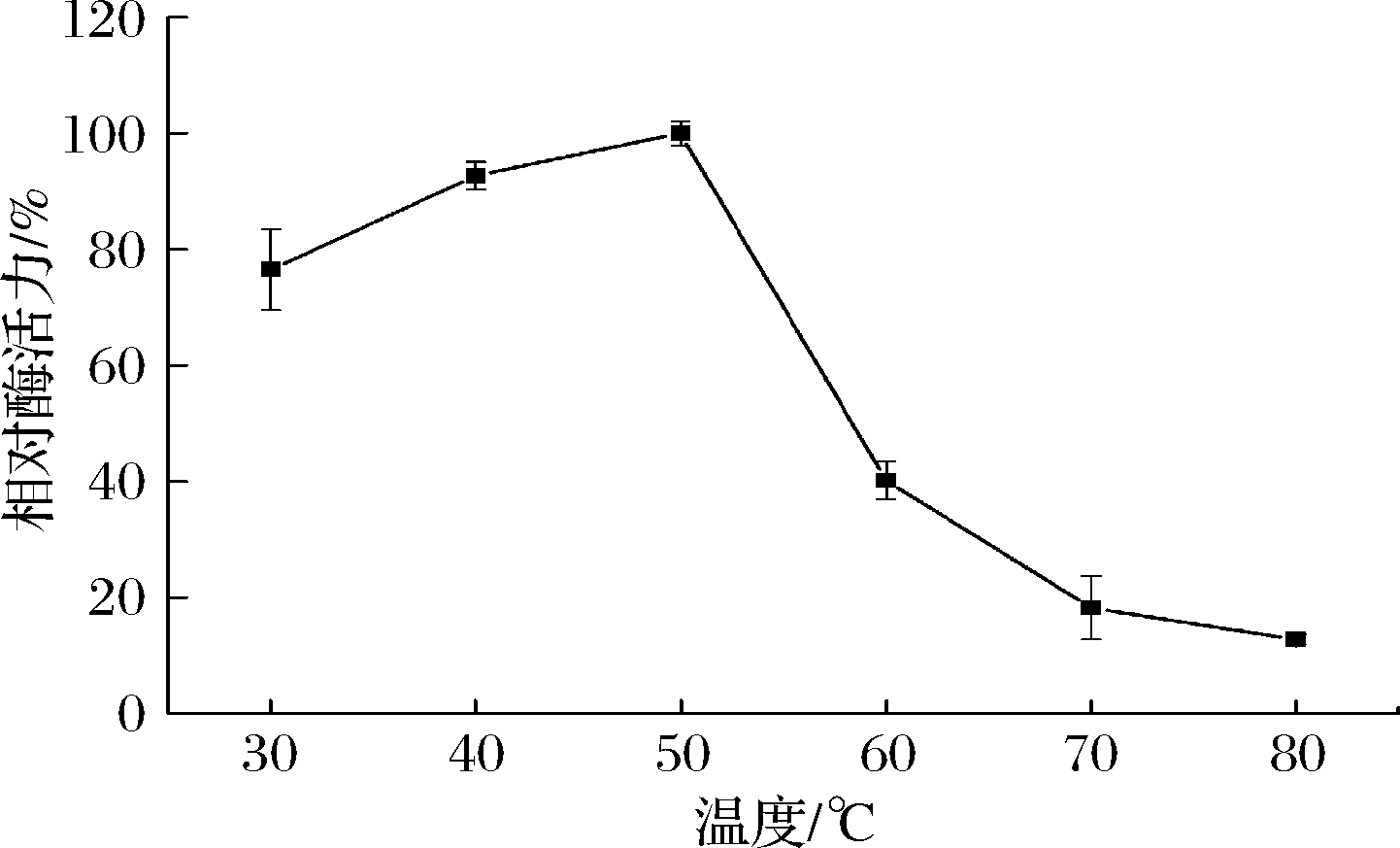
图5 温度对γ-CGTase酶活力的影响
Fig.5 Effect of temperature on the activity of γ-CGTase
2.5 γ-CGTase的最适pH
pH是影响酶催化活性的另一个重要因素,主要原因是不同pH环境可影响酶活性中心构象,使其发生轻微变化最终导致酶催化活性改变[24],由图6可知,γ-CGTase最适pH为10.0,同时在7.0~11.0范围内有80%以上的相对酶活力,表明γ-CGTase在碱性条件下酶活力较高,与其来源于碱性芽孢杆菌属有关。就目前报道而言,γ-CGTase最适pH与Bacillus sp. G-825-6[10]、Bacillus clarkii 7364[11]相近,而比Bacillus sp. AL-6[22]、Bacillus firmus/lentus 290-3[23]最适pH值更高,这有利于高浓度淀粉底物的糊化。此外,γ-CGTase在pH 6~11范围内,残余酶活力均大于70%,最适pH范围较广,与CGTase相关报道一致[25-26]。
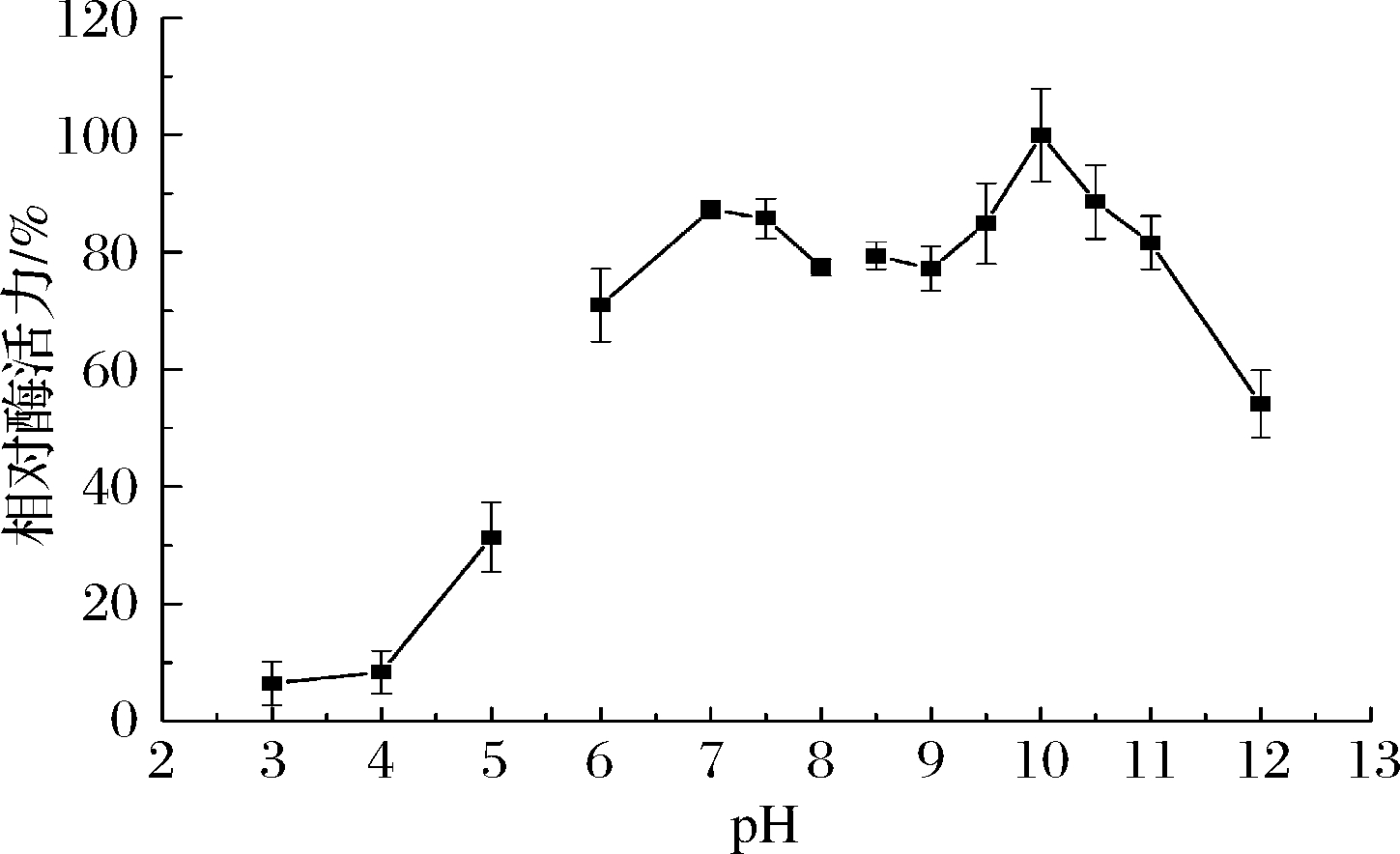
图6 pH对γ-CGTase酶活力的影响
Fig.6 Effect of pH on the activity of γ-CGTase
2.6 γ-CGTase动力学参数测定
酶促反应动力学参数可表征一个酶的基本性质,米氏常数(Km)、转化数(kcat)及最大反应速率(Vmax)不仅可判断酶的最适底物、酶与底物亲和力大小,还能确定酶促反应速率,结果如表1所示。与王磊[12]报道的来源于Bacillus clarkii 7364的γ-CGTase动力学参数相比,kcat值较高,说明γ-CGTase与可溶性淀粉亲和力较高。
表1 γ-CGTase的动力学参数
Table 1 The kinetic parameters of γ-CGTase
Vmax/[mg·(mL·min)-1]Km/(mg·mL-1)kcat/s-10.294.5339.64
2.7 有机溶剂对γ-CGTase酶活力的影响
有机溶剂在当前环糊精生产中必不可少,其不仅可改变产物比例,还对CGTase酶活力产生一定影响。如图7所示,甲醇、乙醇、环己烷、十二醇对γ-CGTase酶活力有一定的提高作用,相对而言,乙醇对γ-CGTase酶活力提高效果更为明显,而异丙醇和正丁醇使γ-CGTase酶活力降低,主要原因是不同CGTase对有机溶剂具有不同耐受性,蛋白质结构改变程度不同,进而导致酶活力不同。

图7 有机溶剂对γ-CGTase酶活力的影响
Fig.7 Effect of organic solvents on the activity of γ-CGTase
2.8 反应时间及淀粉浓度对γ-CGTase产物特异性影响
在实际反应过程中,因CGTase还存在偶合、水解、歧化活力,使生成的CD可被作为底物继续反应,导致不同反应时间、不同淀粉浓度下的产物比例不同。如图8-A所示,在0~6 h内,γ-CGTase反应体系中主产物为γ-CD且γ-CD产量呈上升趋势,β-CD含量缓慢增加。6~7 h,γ-CD含量减少,而β-CD仍在增加,产物比例发生明显变化,主要原因[27]可能是在环化反应进行的同时,γ-CGTase将反应生成的CD和麦芽低聚糖作为底物,通过偶合反应使CD生成线性麦芽低聚糖,而γ-CD比β-CD更适合作为γ-CGTase偶合反应底物,最终导致6~7 h内,γ-CD含量减少而β-CD含量增加。图8-B的结果表明,高浓度淀粉反应的产物中γ-CD含量小于β-CD,而相同反应条件下,低浓度淀粉产物中γ-CD含量远大于β-CD,主要因为反应体积一定时,高浓度淀粉分子与酶相互碰撞几率增大,反应速率加快,生成较多的麦芽低聚糖;产物中麦芽低聚糖可进一步与CD发生偶合反应,由于γ-CD偶合速率比β-CD快,使得高浓度淀粉反应体系中生成的γ-CD含量小于β-CD。
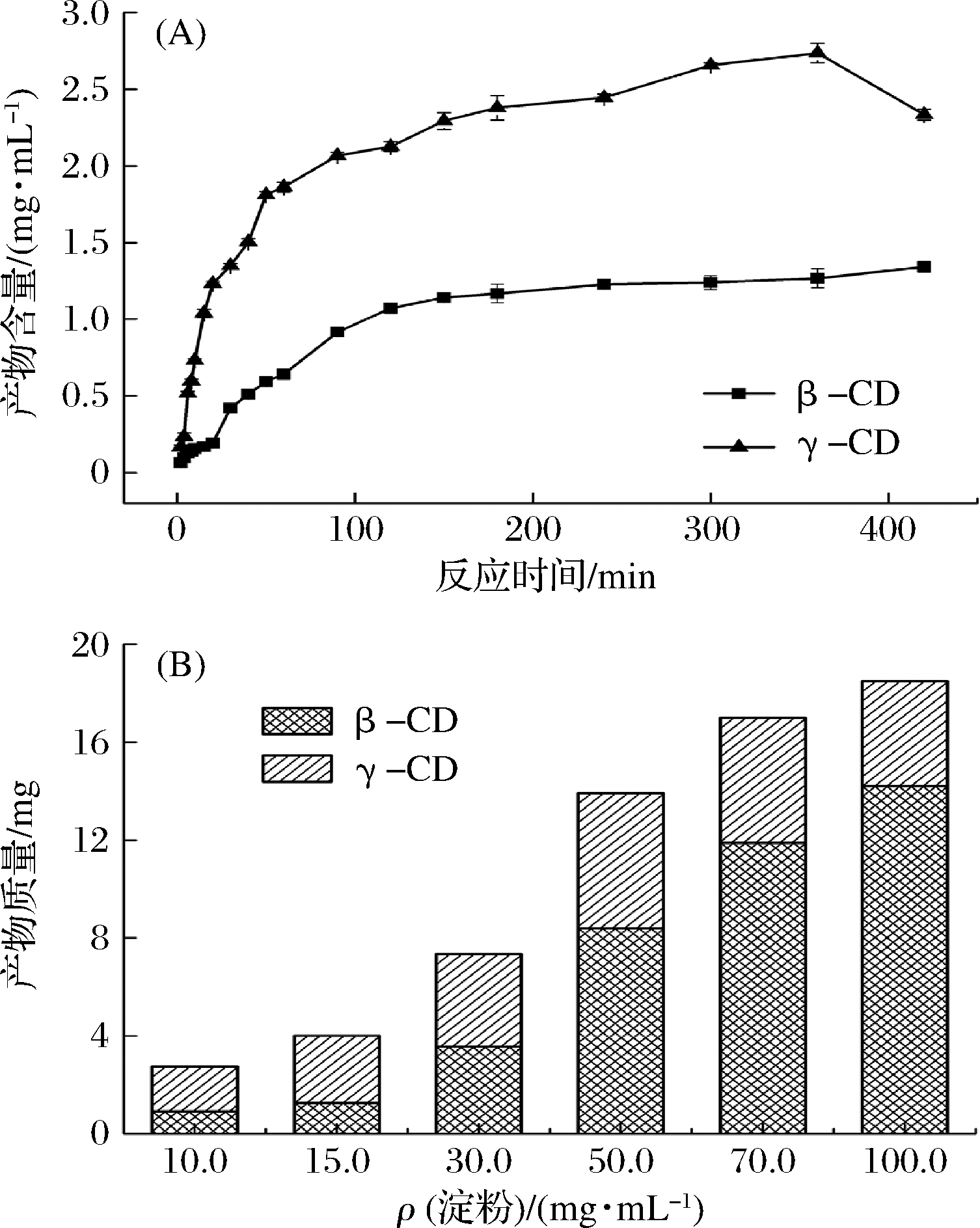
图8 反应时间(A)、淀粉浓度(B)对γ-CGTase产物特异性影响
Fig.8 Effect of reaction time(A) and concentration of starch(B) on the product specificity of γ-CGTase
2.9 不同乙醇体积分数对γ-CGTase产物特异性影响
乙醇因其危害性低、挥发性良好且抑菌性效果明显,在改变CGTase产物特异性中得到广泛应用[28]。为了更好地探究乙醇对改变产物特异性的效果,选择生成β-CD含量相对较高的淀粉浓度作为底物,最终以50 mg/mL淀粉为研究对象。如图9所示,对照组中γ-CGTase反应6 h后β-CD比γ-CD含量更多,主要因为γ-CGTase的偶合作用使γ-CD含量减少;与对照组相比,乙醇的添加明显使γ-CD得到有效保留,原因可能是极性较高的乙醇会排除水分子进入γ-CGTase活性中心,减弱水解反应,从而减少麦芽低聚糖的产生[29],以及乙醇与麦芽低聚糖结合减弱γ-CGTase偶合作用[30],使γ-CD比例提高。总体来看,γ-CD含量随乙醇最终体积分数的增加呈上升趋势,当乙醇最终体积分数大于5%时,γ-CD含量有微弱减少,主要因为高浓度乙醇环境中,γ-CGTase酶活损失和淀粉底物利用度降低。此外,由表2可知,与对照组相比,添加乙醇后γ-CD占总CD的比例明显增大,尤其是在10%的乙醇最终体积分数下,该比例由40.11%增加至78.20%,专一性提高了94.96%,表明乙醇在改变γ-CGTase产物特异性方面具有广泛前景。
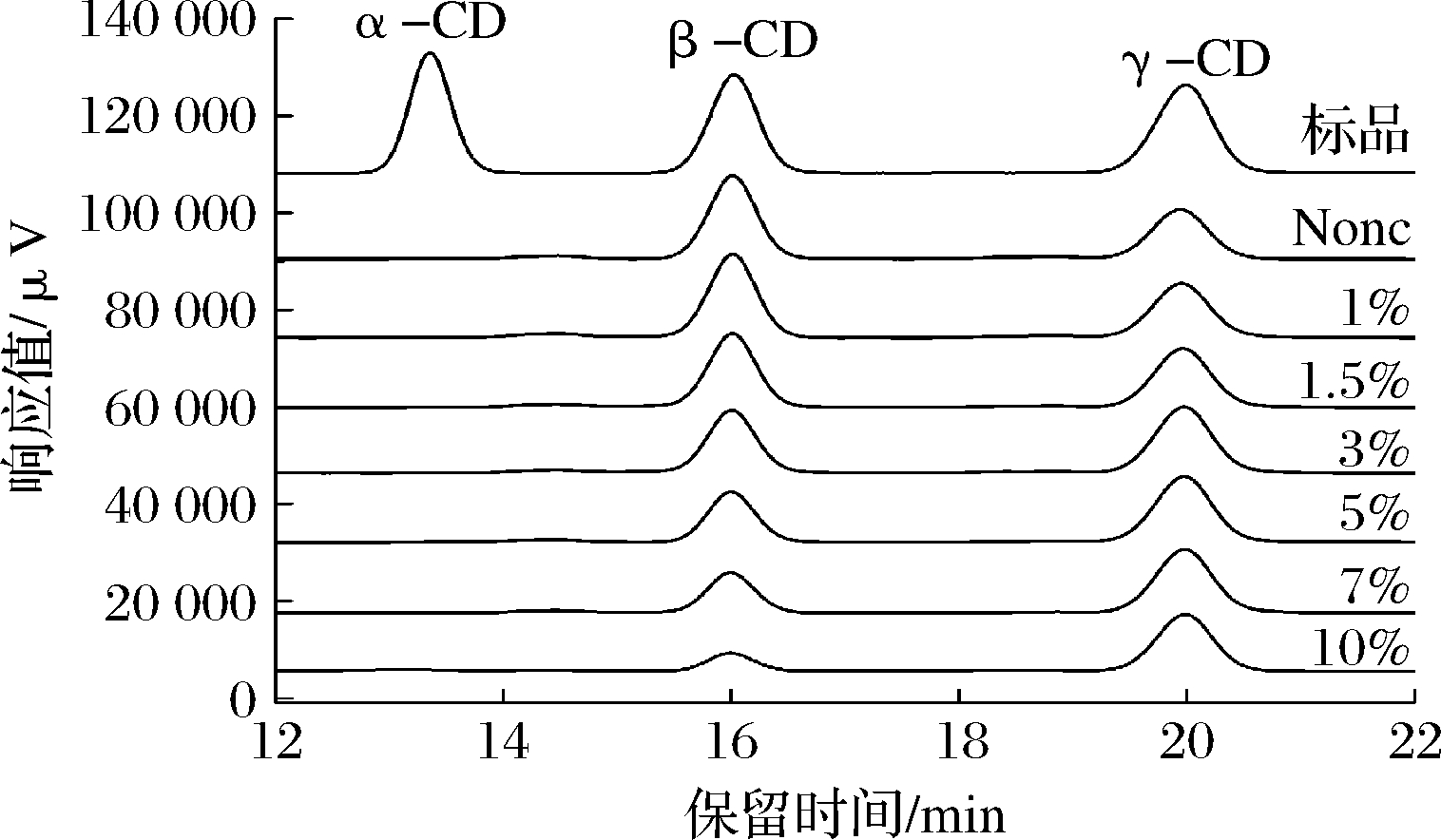
图9 不同乙醇体积分数对γ-CGTase产物特异性影响
Fig.9 Effect of different concentration of ethanol on the product specificity of γ-CGTase
表2 不同体积分数乙醇作用下γ-CGTase产物比例
Table 2 The proportion of γ-CGTase products under different concentration of ethanol
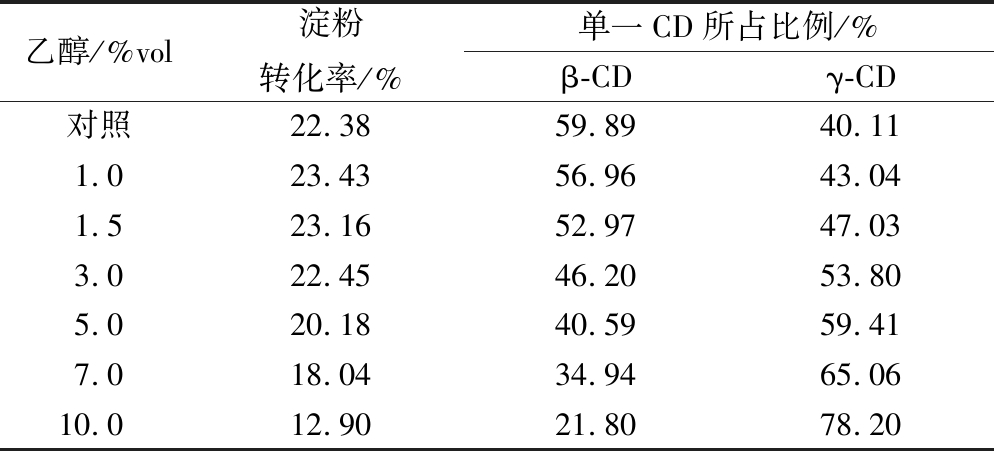
乙醇/%vol淀粉转化率/%单一CD所占比例/%β-CDγ-CD对照22.3859.8940.111.023.4356.9643.041.523.1652.9747.033.022.4546.2053.805.020.1840.5959.417.018.0434.9465.0610.012.9021.8078.20
3 结论
将来源于Bacillus sp. FJAT-44876的一段基因进行克隆,并在E. coli BL21(DE3)异源表达,经镍柱纯化后,对γ-CGTase进行酶学性质测定及产物特异性影响因素研究。该酶分子质量大约为80 kDa,最适温度50 ℃,最适pH 10.0。反应时间、淀粉质量浓度及乙醇浓度均对γ-CGTase产物特异性有影响,其中乙醇影响效果显著。与对照组相比,10%乙醇最终体积分数下,γ-CGTase作用生成的CD中γ-CD所占比例由40.11%增加至78.20%,专一性提高了94.96%。这将为γ-CD生产提供一种新型γ-CGTase,并为改变γ-CGTase产物特异性提供基础。
[1] LU T, XIA Y M. Transglycosylation specificity of glycosyl donors in transglycosylation of stevioside catalysed by cyclodextrin glucanotransferase[J]. Food Chemistry, 2014, 159(15):151-156.
[2] GONZALEZ-ALFONSO J L, LEEMANS L, POVEDA A, et al. Efficient α-glucosylation of epigallocatechin gallate catalyzed by cyclodextrin glucanotransferase from Thermoanaerobacter Species[J]. Journal of Agricultural and Food Chemistry, 2018, 66(28):7 402-7 408.
[3] TAO X M, WANG T, SU L Q, et al. Enhanced 2-O-α-D-glucopyranosyl-L-ascorbic acid synthesis through iterative saturation mutagenesis of acceptor subsite residues in Bacillus stearothermophilus NO2 cyclodextrin glycosyltransferase[J]. Journal of Agricultural and Food Chemistry, 2018, 66(34):9 052-9 060.
[4] PENNINGA D, STROKOPYTOV B, ROZEBOOM H J, et al. Site-directed mutations in tyrosine 195 of cyclodextrin glycosyltransferase from Bacillus circulans strain 251 affect activity and product specificity[J]. Biochemistry, 1995, 34(10):3 368-3 376.
[5] MUNRO I C, NEWBERNE P M, YOUNG V R, et al. Safety assessment of gamma-cyclodextrin[J]. Regulatory Toxicology and Pharmacology, 2004, 39:S3-S13.
[6] 张昊, 李雅兴, 张毅, 等. γ-环糊精固载淀粉的制备及其对废水中染料去除性能研究[J]. 化工新型材料, 2019(6):257-262.
[7] 李丹. γ-环糊精包合甜菊苷水解产物的研究[D]. 无锡: 江南大学, 2017.
[8] 杨李霞, 魏静, 张晓梅. γ-环糊精对槲皮素和扁桃酸的包结[J]. 云南化工, 2016. 43(1):19-23.
[9] 隋小宇, 刘畅, 王钧, 等. 辅酶Q10-γ-环糊精纳晶混悬物的制备及其性质研究[J]. 中国药学杂志, 2015. 50(16):1 412-1 418.
[10] HIRANO K, ISHIHARA T, OGASAWARA S, et al. Molecular cloning and characterization of a novel γ-CGTase from alkalophilic Bacillus sp.[J]. Applied Microbiology and Biotechnology, 2006, 70(2):193-201.
[11] TAKADA M, NAKAGAWA Y, YAMAMOTO M, et al. Biochemical and genetic analyses of a novel gamma-cyclodextrin glucanotransferase from an alkalophilic Bacillus clarkii 7364[J]. Journal of Biochemistry, 2003, 133(3):317-324.
[12] 王磊. Bacillus clarkii 7364 γ-环糊精葡萄糖基转移酶的重组表达及其应用[D]. 无锡: 江南大学, 2013.
[13] 王宁. α-环糊精以及γ-环糊精的酶转化工艺研究[D]. 无锡: 江南大学, 2010.
[14] 李林林. Bacillus sp.G-825-6 γ-CGT酶的性质、应用及其突变研究[D]. 无锡: 江南大学,2016.
[15] FUWA H. A new method for microdetermination of amylase activity by the use of amylose as the substrate[J]. Journal of Biochemistry, 2008, 41(5):583-603.
[16] JI H Y, BAI Y X, LI X X, et al. Preparation of malto-oligosaccharides with specific degree of polymerization by a novel cyclodextrinase from Palaeococcus pacificus[J]. Carbohydrate Polymers, 2019, 210:64-72.
[17] VEEN B A V D, UITDEHAAG J C M, DIJKSTRA B W, et al. Engineering of cyclodextrin glycosyltransferase reaction and product specificity[J]. Biochimica et Biophysica Acta, 2001, 1543(2): 336-360.
[18] STROKOPYTOV B, PENNINGA D, ROZEBOOM H J, et al. X-ray structure of cyclodextrin glycosyltransferase complexed with acarbose. Implications for the catalytic mechanism of glycosidases[J]. Biochemistry, 1995, 34(7):2 234-2 240.
[19] QI Q S, ZIMMERMANN W. Cyclodextrin glucanotransferase: from gene to applications[J]. Applied Microbiology and Biotechnology, 2005, 66(5):475-485.
[20] VEEN B A V D, UITDEHAAG J C M, DIJKSTRA B W, et al. The role of arginine 47 in the cyclization and coupling reactions of cyclodextrin glycosyltransferase from Bacillus circulans strain 251: Implications for product inhibition and product specificity [J]. FEBS Journal, 2000, 267(12):3 432-3 441.
[21] UITDEHAAG J C M, KALK K H, VEEN BART A V D, et al. The cyclization mechanism of cyclodextrin glycosyltransferase (CGTase) as revealed by a gamma-cyclodextrin-CGTase complex at 1.8-Å resolution[ ]. Journal of Biological Chemistry, 1999, 274(49):34 868-34 876.
]. Journal of Biological Chemistry, 1999, 274(49):34 868-34 876.
[22] FUJITA Y, TSUBOUCHI H, INAGI Y, et al. Purification and properties of cyclodextrin glycosyltransferase from Bacillus sp. AL-6[J]. Journal of Fermentation and Bioengineering, 1990, 70(3):150-154.
[23] SCHMID G. γ-CGTase[P]. US Patent, 5409824,1995-04-25.
[24] ATANASOVA N, KITAYSKA T, BOJADJIEVA I, et al. A novel cyclodextrin glucanotransferase from alkaliphilic Bacillus pseudalcaliphilus 20RF: Purification and properties[J]. Process Biochemistry, 2011, 46(1):116-122.
[25] GAWANDE B N, PATKAR A Y. Purification and properties of a novel raw starch degrading-cyclodextrin glycosyltransferase from Klebsiella pneumoniae AS- 22[J]. Enzyme and Microbial Technology, 2001, 28(9-10):735-743.
[26] WIND R D, UITDEHAAG J C M, BUITELAAR R M, et al. Engineering of cyclodextrin product specificity and pH optima of the thermostable cyclodextrin glycosyltransferase from Thermoanaerobacterium thermosulfurigenes EM1[J]. Journal of Biological Chemistry, 1998, 273(10):5 771-5 779.
[27] MORI S, GOTO M, MASE T, et al. Reaction conditions for the production of γ-cyclodextrin by cyclodextrin glucanotransferase from Brevibacterium sp. No. 9605[J]. Bioscience Biotechnology and Biochemistry, 1995, 59(6):1 012-1 015.
[28] FENELON V C, AGUIAR M F A, MIYOSHI J H, et al. Ultrafiltration system for cyclodextrin production in repetitive batches by CGTase from Bacillus firmus strain 37[J]. Bioprocess and Biosystems Engineering, 2015, 38(7):1 291-1 301.
[29] CALSAVARA L P V, CUNHA A R D, BALBINO T A, et al. Production of cyclodextrins from cornstarch granules in a sequential batch mode and in the presence of ethanol[J]. Applied Biochemistry and Biotechnology, 2011, 165(7-8):1 485-1 493.
[30] 洪雁, 靳蓉, 周炜. β-环糊精合成中不同助剂以及小分子糖对转化率的影响[J]. 食品科学, 2011, 32(24):102-105.