马乳自古以来就被认为是具有特殊的营养和治疗功能的食品。当今,在蒙古和俄罗斯的游牧民族聚集地区,以及在欧洲的一些地方越来越受欢迎。马乳中含有丰富的多不饱和脂肪酸、维生素以及最接近人乳的组成比,且脂肪和胆固醇较低,具有较高的营养价值[1]。发酵后的马乳乳糖含量降低,微生素含量上升,蛋白质和脂肪等其他营养成分基本不变。同时,在发酵过程中乳酸菌、酵母菌等益生菌以及微生物代谢产物,如肽类、乳酸、醇类、芳香化合物和抗菌素等,使发酵马乳具有特殊的营养价值和医疗保健作用[2]。俄罗斯和蒙古已将发酵马乳用于消化道和心血管疾病的治疗[3]。
发酵乳基中的小分子蛋白功能活性肽因具有促进激素调节、增强免疫、降血糖和降血压等生理活性,一直以来都是生物活性肽的研究重点。该研究通过解析内蒙古锡盟地区传统发酵马乳的相应理化指标和小分子乳肽,为蒙古族传统发酵马乳的营养及功能性研究提供数据和理论基础。
1 材料与方法
1.1 乳品样本
将中国内蒙古锡林郭勒盟蒙古族聚居不同牧区具有相同乳源的新鲜马乳以及自然发酵24 h后的发酵马乳采集500 g,分别收集到无菌的自封袋中,封好立即置于冰上,-20 ℃保存。
1.2 试剂与耗材
甲酸、乙腈(色谱纯),美国Fluka公司;三氟乙酸(分析纯),德国Merck公司;相对分子质量矫正曲线标准品:细胞色素C(M12500)、抑肽酶(M6500)、杆菌酶(M1450)、乙氨酸-乙氨酸-酪氨酸-精氨酸(M451)、乙氨酸-乙氨酸-乙氨酸(M189),美国Sigma公司;其他化学分子试剂均为分析纯,购自国内公司。
1.3 仪器与设备
Nexera X2超高效液相色谱仪、三重四极杆质谱仪联用系统,日本岛津公司;LC-20 AD高效液相色谱仪,日本岛津公司;XBridge BEH130 C18色谱柱(4.6 mm×250 mm),美国Waters公司;TSK gel G2000 SWXL凝胶过滤柱(7.8 mm×300 mm),日本TOSOH公司;FOSS Kjeltec8400全自动凯氏定氮仪、TecatorTMDigestor2006消化仪,丹麦FOSS公司。
1.4 实验方法
1.4.1 基础理化指标测定
蛋白质含量参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》;脂肪含量参照GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》;乳糖含量参照GB 5413.5—2010《食品安全国家标准 婴幼儿食品和乳品中乳糖、蔗糖的测定》;酸度含量参照GB 5009.239—2016《食品安全国家标准 食品酸度的测定(第三法)》;酒精度参照GB 5009.225—2016《食品安全国家标准 酒中乙醇浓度的测定(第三法)》;氨基酸含量参照GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》。
1.4.2 分子量分布测定
参照GB 22729—2008《食品安全国家标准 海洋鱼低聚肽粉附录A》,采用高效凝胶过滤色谱法进行测定。即以多孔性填料为固定相,依据样本组分分子体积大小的差别进行分离,流动相为:V(乙腈)∶V(水)∶V(三氟乙酸)=45∶55∶0.1,紫外检测波长为UV 220 nm,流速为0.5 mL/min,柱温为30 ℃。称取10 mL样品,用流动相定容至25 mL,超声振荡10 min后,用孔径为0.2~0.5 μm聚四氟乙烯膜过滤后,上机进样分析,使用凝胶色谱图及其数据进行处理,得到蛋白质水解物的相对分子质量大小及分布范围,将样品的色谱数据纳入校正曲线方程中,以计算样品中肽的相对分子质量及其分布范围。用峰面积归一化计算不同相对分子质量蛋白质水解物(包括寡肽和少量游离氨基酸)的峰面积相对百分比之和。
1.4.3 肽组分及含量测定
参照王雨晴等[4]利用测定肌肽含量的分析条件,调整并优化液相色谱条件和定量MRM参数。
样品处理:用纯水将样品稀释100倍,离心处理后(10 000 r/min离心10 min)取上清液,用孔径为0.22 μm尼龙过滤膜过滤后,对待测样品进行前处理。
首先,利用C18色谱柱对发酵马乳进行液相色谱分离,随后,利用电喷雾串联三重四极杆质谱对分离的产物进行产物离子扫描,利用特征离子对样品中存在的肽段序列进行定性推算。结合定性结果,对肽段结构进行定量分析。液相色谱条件:色谱柱:Inertsil ODS-3(2.1 mm×250 mm,5 μm);流动相:A为体积分数为0.1%的甲酸水溶液,B为体积分数为0.1%的甲酸乙腈溶液;梯度洗脱程序:0~15 min,B(0%~50%);15~20 min,B(50%~100%);20~25 min,B(100%);25.1~35 min,B(0%);流速:0.2 mL/min;进样体积:10 μL;柱温:40 ℃。
质谱条件:离子化模式:ESI,正离子模式;离子喷雾电压:+4.5 kV;雾化气流速:氮气3.0 L/min;加热气流速:氮气 10 L/min;干燥气流速:氮气10 L/min;DL温度:250 ℃;加热模块温度:400 ℃;离子源温度:300 ℃;扫描模式:多反应监测(multiple reaction monitoring, MRM);驻留时间:100 ms;延迟时间:3 ms;MRM参数见表1。
表1 化合物的MRM优化参数
Table 1 MRM optimization parameters of compounds
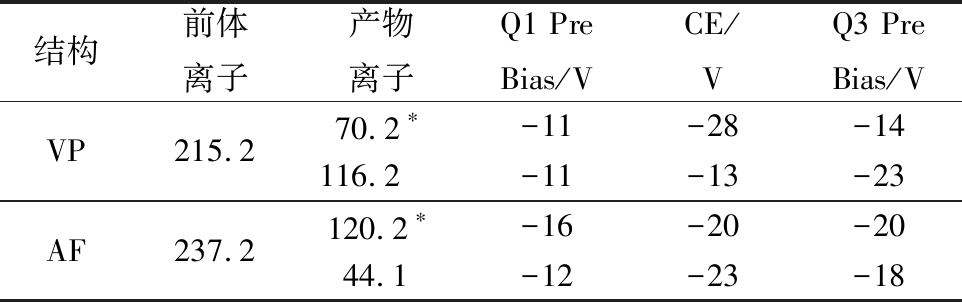
结构前体离子产物离子Q1 PreBias/VCE/VQ3 PreBias/VVP215.270.2∗-11-28-14116.2-11-13-23AF237.2120.2∗-16-20-2044.1-12-23-18
注:*表示定量离子;未标*的产物离子用于定性
1.5 数据分析
采用SPSS 23.0分析处理数据,所有实验数据为至少3个平行试验的平均值,用平均值±标准误(SE)表示;图表由Origin 9.0绘制。
2 结果与讨论
2.1 马乳与发酵马乳理化指标分析
表2中DW.Y.1、WU.Y.1、XW.Y.1为新鲜马乳样品,DW.C.1、WU.C.1、XW.C.1为发酵24 h后的马乳样品。结果表明,发酵前3种马乳的蛋白质、脂肪、乳糖、酸度、酒精度、pH和氨基酸含量均无显著性差异(P>0.05)。发酵后3个马乳样本的乳糖、酒精度、pH均与发酵前呈显著性差异(P<0.05),酸度与发酵前呈极显著性差异(P<0.01)。蛋白质、脂肪和氨基酸含量发酵前后则均无显著性差异(P>0.05)。
表2 马乳与发酵马乳理化指标结果![]()
Table 2 Physical and chemical indexes of horse milk and fermented house milk
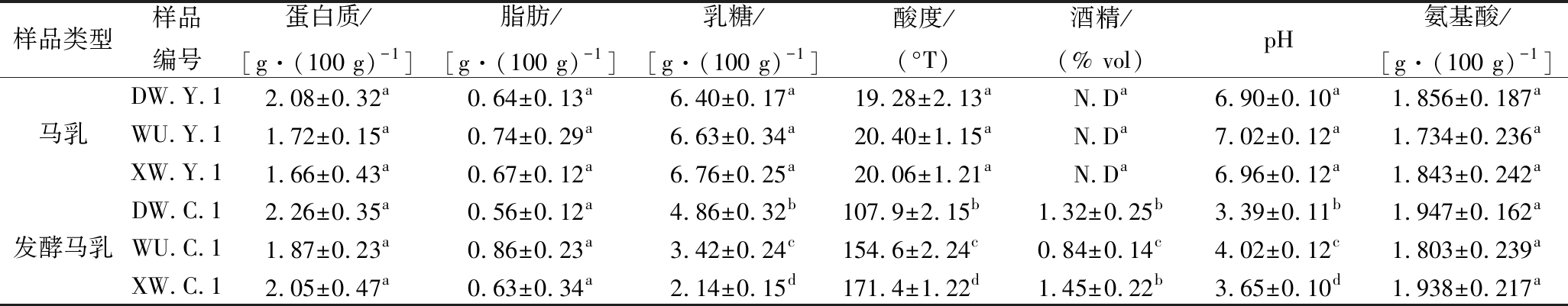
样品类型样品编号蛋白质/[g·(100 g)-1]脂肪/[g·(100 g)-1]乳糖/[g·(100 g)-1]酸度/(°T)酒精/(% vol)pH氨基酸/[g·(100 g)-1]DW.Y.12.08±0.32a0.64±0.13a6.40±0.17a19.28±2.13aN.Da6.90±0.10a1.856±0.187a马乳WU.Y.11.72±0.15a0.74±0.29a6.63±0.34a20.40±1.15aN.Da7.02±0.12a1.734±0.236aXW.Y.11.66±0.43a0.67±0.12a6.76±0.25a20.06±1.21aN.Da6.96±0.12a1.843±0.242aDW.C.12.26±0.35a0.56±0.12a4.86±0.32b107.9±2.15b1.32±0.25b3.39±0.11b1.947±0.162a发酵马乳WU.C.11.87±0.23a0.86±0.23a3.42±0.24c154.6±2.24c0.84±0.14c4.02±0.12c1.803±0.239aXW.C.12.05±0.47a0.63±0.34a2.14±0.15d171.4±1.22d1.45±0.22b3.65±0.10d1.938±0.217a
注:同列数据上标不同小写字母表示在P<0.05时有显著性差异;N.D表示未检出
本实验所用原马乳样本采集自锡林郭勒不同牧区主要种属的马匹乳源泌乳中期。前期研究发现,来源于锡林郭勒主要种属马匹相同泌乳期乳源的原马乳样本在理化特性和营养成分并无显著性差异,此研究结果与已有的文献报道较为接近[5]。发酵后马乳样本理化特性与发酵前马乳样本差异显著,推测马乳发酵前后化学指标的变化可能与其所在环境的发酵菌群有关。马乳在无氧发酵过程中,乳中的葡糖被乳酸菌和酵母菌分别转换成乳酸和酒精,导致发酵后酸乳的乳糖含量与pH降低,酸度和酒精含量增加[6]。
2.2 蛋白质水解物分子量分布
乳品在发酵过程中,大分子蛋白质会被微生物产生的蛋白水解酶类分解成大小不等的肽段和单个氨基酸[7],不同微生物由于产生蛋白水解酶的能力不同,使最终蛋白质水解产物的分子质量呈现差异。为了验证发酵微生物对蛋白质水解产物的影响,采用高效凝胶过滤色谱技术对马乳及发酵马乳样品中蛋白质水解物的分子质量分布进行分析(图1)。
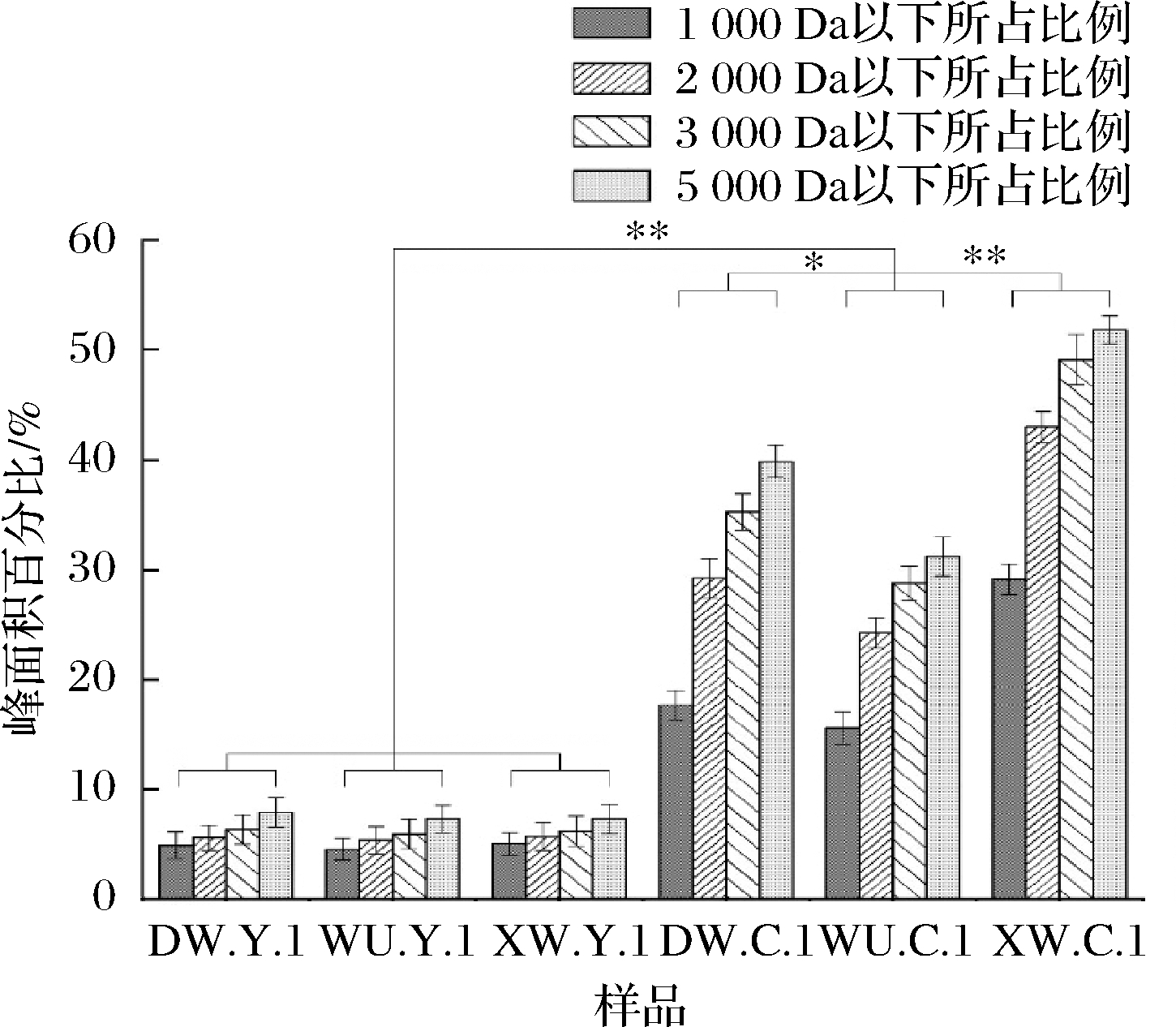
图1 样品中相对分子质量蛋白质水解物所占比例分布
Fig.1 The relative molecular mass distribution of protein hydrolysate in samples
注:*表示在P<0.05时有显著性差异,**表示在P<0.05时有极显著性差异
结果表明,马乳在发酵前蛋白质水解物不同分子质量的分布均无显著差异(P>0.05)。发酵后,3种发酵马乳蛋白水解物分子量分布与发酵前比有极显著性差异(P<0.01)。以相对分子质量<1 000 Da的蛋白质水解物所占比例为例,马乳经发酵后,DW.C.1相对分子质量<1 000 Da的蛋白质水解物所占比例由(4.866±0.95)%增加为(17.667±0.86)%,WU.C.1由(4.498±1.14)%增加为(15.531±1.03)%,XW.C.1由(5.043±0.98)%增加为(29.109±1.26)%。值得注意的是,发酵马乳WU.C.1相对分子质量<1 000 Da的蛋白质水解物所占比例(15.531±1.03)%与DW.C.1(17.667±0.86)%呈显著性差异(P<0.05),与XW.C.1(29.109±1.26)%呈极显著性差异(P<0.01)。
本实验研究发酵马乳的样本的发酵方式均为蒙古族传统自然发酵模式,研究样本分别采集自中国内蒙古锡林郭勒盟蒙古族聚居的不同牧区,地理环境的差异影响当地的微生物种群构成,前期在郭梁等[8]研究中已证实。本实验研究马乳发酵前后的蛋白质与氨基酸含量无显著性差异(P>0.05)(表2),通过测定蛋白质水解物的分子质量分布,进一步分析其不同相对分子质量蛋白质水解物所占比例分布呈极显著性差异(P<0.01)(图1),推测马乳发酵前后蛋白质水解物分子质量的分布变化可能与其发酵菌群有关。
2.3 发酵马乳中肽谱分析
生物活性肽是指对生物机体的生命活动有益或是具有生理作用的蛋白质片段[9]。这些生物活性肽通常相对分子质量<6 000 Da,具有多种生物学功能如抗高血压、抗菌、抗氧化等[10]。而相对分子质量<1 000 Da的蛋白水解物(包括低聚肽和少量游离氨基酸),由于含有的肽段体积小,更容易被人体直接吸收,发挥生理功能[11]。肽段的生物活性功能与其氨基酸种类和组成结构有一定的关系,其中二肽为最基础的活性肽[12]。高效凝胶过滤色谱法研究结果发现,发酵马乳样品中相对分子质量<1 000 Da的肽段所占比例较发酵前增加了10 %,如图1所示,故进一步对发酵马乳中特征二肽序列进行分析。
本实验共鉴定出24条(组)肽段,分析DW.C.1、WU.C.1、XW.C.1中所有肽段的总含量,分别为(99.012±0.150)、(17.066±0.096)、(196.772±0.128)g/mL,其中,XW.C.1肽段总含量最高。在XW.C.1中,发现有4条独有肽段,分别为SR、LM、FV、ST。而在DW.C.1与WU.C.1中,分别各有IR、TI与LV、IY 2条独有肽段。发酵马乳样品XW.C.1不仅鉴定到的肽段数量最多,且独有肽段的数量同样最多。3种样品对肽段的定量结果与前期小分子蛋白水解物所占比例分析结果(图1)较为一致。3种发酵马乳鉴定的肽段中,标记含量较高且有功能活性的肽段为特征肽段,分别为VP、AF(图2)。
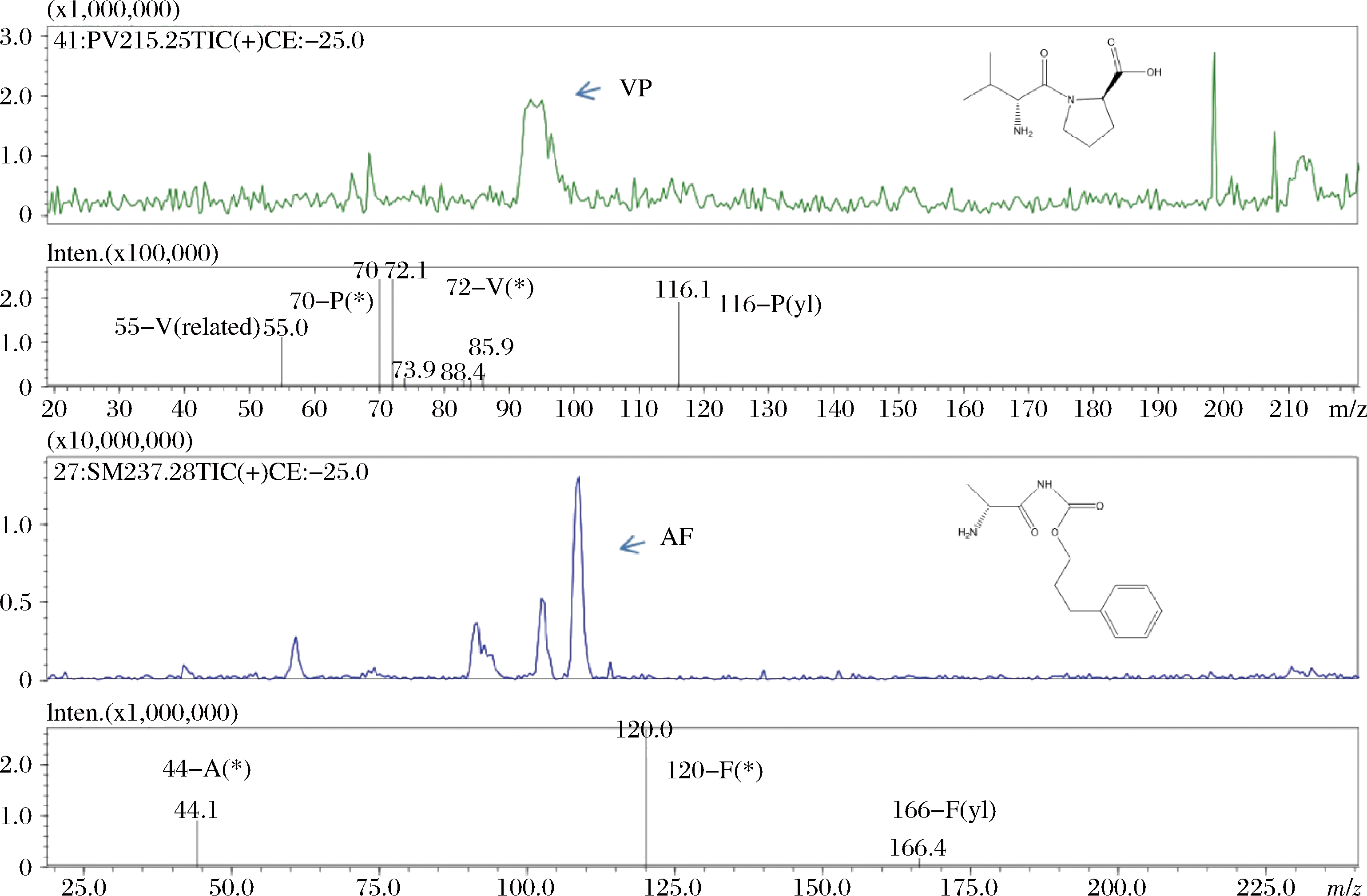
图2 样品中特征肽段的谱图
Fig.2 Spectra of characteristic peptides in samples
其中,肽段VP在3个样品中含量较高分别为(21.271±0.134)、(1.076±0.214)与(11.947±0.125)g/mL。AF在样品XW.C.1含量最高为(14.986±0.121)g/mL。结合文献中的相关ACE抑制肽的半抑制率(表3),C端氨基酸为Pro,N末端氨基酸为Ile和Val时具有较高的ACE抑制率。
部分肽段已被证实在不同的pH和ACE抑制率下存在相对稳定的状态[13-16],具有降血压功能(表3)。ACE是一种含锌二肽羧肽酶,主要存在于哺乳动物体细胞以及雄性生殖细胞内,通过肾素-血管紧张素系统(renin-angiotensin system,RAS)和激肽释放酶-激肽系统(kallikrein-kinin system,KKS)发挥作用,从而导致血压升高[17]。ACE抑制肽可通过与ACE活性位点结合,竞争性地抑制ACE的活性,调节RAS和KKS达到降低血压的目的。目前研究表明,ACE抑制肽的分子质量、氨基酸序列以及立体构象等都会影响其抑制能力[18]。CHEUNG等[19]研究发现ACE抑制肽C端氨基酸为芳香族氨基酸(Trp、Tyr、Phe)或Pro时其降血压效果较好。另外,N端为疏水性氨基酸,如Val、Leu、Ile等时表现出较强的ACE抑制活性。KHMURA、JANG等[20-21]做了更深入地研究发现,C末端氨基酸为芳香族氨基酸(Trp、Tyr、Phe)和脂肪族氨基酸(Ile、Ala、Leu、Met),或C末端倒数第2个氨基酸为脂肪族氨基酸、芳香族氨基酸和碱性氨基酸(Arg、Asp)时,具有更高的ACE抑制活性。WU等[22]通过构建大量二肽、三肽数据库研究其构效关系发现,带有芳香环或疏水性氨基酸残基的二肽具有较高的抑制活性。对于三肽,C末端为芳香氨基酸,C末端倒数第2个氨基酸为带正电荷的氨基酸,以及N末端为疏水性氨基酸时ACE的抑制活性最高。
综上所述,抑制肽中疏水性氨基酸的含量,或者说肽段的疏水性决定了其是否具有较高的ACE抑制活性。目前一些含有ACE抑制肽的功能性食品已被商业化,如日本的Calpis和芬兰的Evolus中含有的VPP和IPP已被证实具有良好的抗高血压的能力[23]。
表3 发酵马乳样品中鉴定的部分肽段
Table 3 Peptides of samples
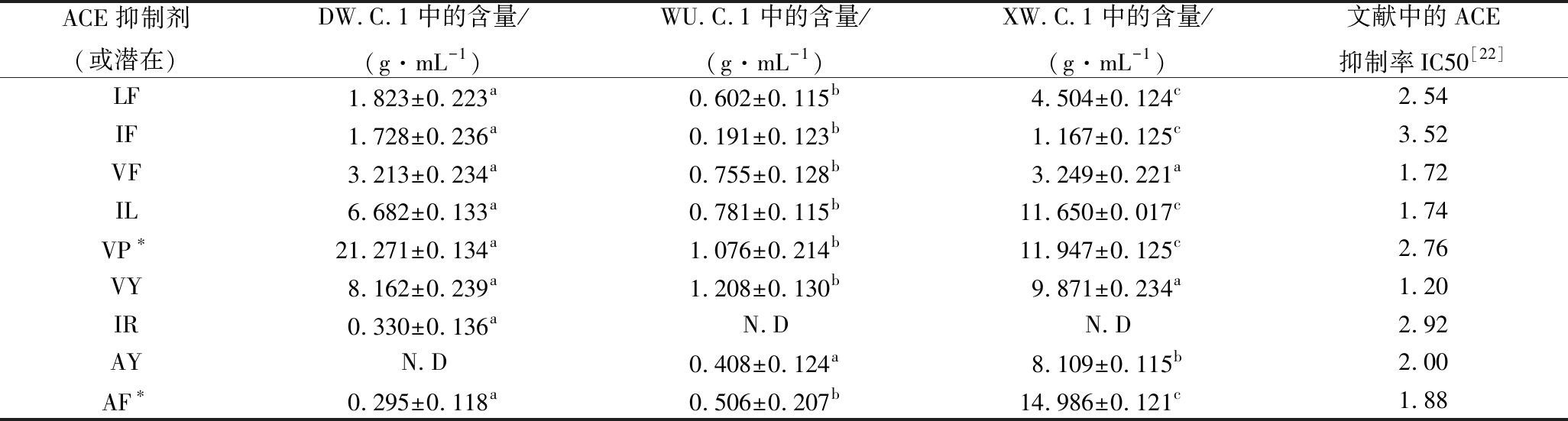
ACE抑制剂(或潜在)DW.C.1中的含量/(g·mL-1)WU.C.1中的含量/(g·mL-1)XW.C.1中的含量/(g·mL-1)文献中的ACE抑制率IC50[22]LF1.823±0.223a0.602±0.115b4.504±0.124c2.54IF1.728±0.236a0.191±0.123b1.167±0.125c3.52VF3.213±0.234a0.755±0.128b3.249±0.221a1.72IL6.682±0.133a0.781±0.115b11.650±0.017c1.74VP∗21.271±0.134a1.076±0.214b11.947±0.125c2.76VY8.162±0.239a1.208±0.130b9.871±0.234a1.20IR0.330±0.136aN.DN.D2.92AYN.D0.408±0.124a8.109±0.115b2.00AF∗0.295±0.118a0.506±0.207b14.986±0.121c1.88
注:同列数据尾注不同字母表示在P<0.05时有显著性差异;N.D表示未检出;*为样品特征肽段
近几年发现,瑞士乳杆菌、乳酸乳球菌等已确定具有水解VPP和IPP等ACE抑制肽的功能[14,24]。JUILLARD、DOEVEN、BARS、闫彬等[25-27,6]研究发现,发酵乳中球菌、杆菌和酵母菌的共生和拮抗作用可以提高酸乳菌群的多样性水平,同时促进乳肽的产生。此外,已有研究分别从乳酸乳杆菌属、乳酸乳球菌属、嗜热链球菌属、酿酒酵母属发酵的酸乳样品中分离出了二肽YP、三肽VPP等小分子活性肽段,说明这些菌属可能是具有高蛋白水解性能和释放活性肽段能力的重要菌属[28]。因此,针对锡盟地区发酵马乳中小分子功能乳肽的生物合成与转化机制,需结合发酵马乳中微生物群落的多样性的研究结果进行更深入地探讨。
3 结论
近几年来,我国对少数民族特色传统发酵乳制品的研究逐年增多,而发酵马乳具有提高免疫能力、调节血压、血糖及机体生理代谢的功能,研究价值不容小觑。该研究采集了锡盟地区的马乳及发酵马乳样本,通过测定马乳的基础理化指标,结合高效凝胶过滤色谱与超高效液相色谱-电喷雾串联三重四极杆质谱,分析马乳发酵前后蛋白水解的相关指标及发酵后的主要功能肽段。发酵马乳XW.C.1鉴定出的总肽段与独有肽段最多,具有潜在的ACE抑制肽含量最多,且特征肽段VP、AF含量最高。经理化指标和发酵后相对分子质量蛋白质水解物所占比例综合分析,表明发酵马乳的菌种组成可能影响其功能肽段的含量。未来的研究中,需要结合马乳发酵前后的菌群变化及马乳中存在的小分子肽段的ACE抑制活性对其生物转化机制进行更为深入地分析,以期从天然马乳发酵微生物中挖掘制备相关功能肽的优良菌剂。
[1] 丁瑞雪,王一然,乌日娜,等.发酵乳调控人体肠道营养健康的研究进展[J].食品与发酵工业,2018,44(12):281-287.
[2] PIESZKA M, ![]() J, ZAMACHOWSKA, et al. Is mare milk an appropriate food for people?-a review[J]. Annals of Animal Science,2016,16(1):33-51.
J, ZAMACHOWSKA, et al. Is mare milk an appropriate food for people?-a review[J]. Annals of Animal Science,2016,16(1):33-51.
[3] 王豪, 刘振民, 章慧.酸马奶和维利的研究进展[J].食品科学,2016,37(3):247-252.
[4] 王雨晴,陈亮,贾福怀,等.UHPLC-ESI-MS/MS法测定动物源食物提取物中肌肽与鹅肌肽的含量[J].分析测试学报,2018,37(11):1 328-1 333.
[5] 郭元晟,雅梅,钱俊平,等.锡林郭勒地区生鲜马乳质量研究[J].中国饲料,2019(21):45-50.
[6] 闫彬,贺银凤.酸马奶中乳酸菌与酵母菌的共生发酵特性[J].食品科学,2012,33(7):131-137.
[7] 霍小琰,李少英,郭荣荣.酸马奶中乳酸菌的鉴定及生物学特性的研究[J].微生物学通报,2012,39(7):940-948.
[8] GUO Liang, YA Mei, GUO Yuansheng, et al. Study of bacterial and fungal community structures in traditional koumiss from Inner Mongolia[J]. Journal of Dairy Science, 2018, 102:1 972-1 984.
[9] KORHONEN H, PIHLANTO A. Bioactive peptides: Production and functionality[J]. International Dairy Journal,2006,16(9):945-960.
[10] WADA Y, BO L. Bioactive peptides derived from human milk proteins mechanisms of action[J]. Journal of Nutritional Biochemistry,2014,25(5):503-514.
[11] KARAMI Z, AKBARI-ADERGANI B. Bioactive food derived peptides: a review on correlation between structure of bioactive peptides and their functional properties[J]. Journal of Food Science and Technology,2019,56(2):535-547.
[12] 刘文颖,林峰,谷瑞增,等.海洋胶原低聚肽的血管舒张和降胆固醇作用[J].食品与发酵工业,2013,39(12):7-12.
[13] CHEN Y, WANG Z, CHEN X, et al. Identification of angiotensin I-converting enzyme inhibitory peptides from koumiss, a traditional fermented mare’s milk[J]. Journal of Dairy Science, 2010, 93(3):884-892.
[14] FITZGERALD R J, MURRAY B A. Bioactive peptides and lactic fermentations[J]. International Journal of Dairy Technology,2006,59(2):118-125.
[15] FAN Mengzhu, GUO Tingting, LI Wanru, et al. Isolation and identification of novel casein-derived bioactive peptides and potential functions in fermented casein with Lactobacillus helveticus[J]. Food Science and Human Wellness,2019,8(2):156-176.
[16] BOUNOUALA F Z,ROUDJ S, KARAM N E, et al. Casein Hydrolysates by Lactobacillus brevis and Lactococcus lactis Proteases: Peptide Profile Discriminates Strain-Dependent Enzyme Specificity[J]. Journal of Agricultural and Food Chemistry,2017,65(42):9 324-9 332.
[17] 管骁,刘静,苏淅娜,等.血管紧张素转化酶抑制二肽抑制ACE作用的柔性分子对接[J].食品科学,2015,36(5):1-6.
[18] 胡志和,夏磊,孙振刚,等.酪蛋白水解物中ACE抑制肽分离及氨基酸序列分析[J].食品科学,2015,36(24):156-163.
[19] CHEUNG H S, WANG F L, ONDETTI M A, et al. Binding of peptide substrates and inhibitors of angiotensin-converting enzyme. Importance of the COOH-terminal dipeptide sequence[J]. The Journal of Biological Chemistry,1980,255(2):401-407.
[20] KOHMURA M, NIO N, KUBO K, et al. Inhibition of angiotensin-converting enzyme by synthetic peptides of human β-casein[J]. Agricultural and Biological Chemistry,1989,53(8):2 107-2 114.
[21] JANG A, JO C, KANG K S, et al. Antimicrobial and human cancer cell cytotoxic effect of synthetic angiotensin-converting enzyme (ACE) inhibitory peptides[J]. Food Chemistry,2008,107(1):327-336.
[22] WU J P, ALUKO R E, NAKAI S. Structural requirements of angiotensin Ⅰ-converting enzyme inhibitory peptides: quantitative structure-activity relationship study of di-and tripeptides[J]. Journal of Agricultural and Food Chemistry,2006,54(3):732-738.
[23] SEPPO L, JAUHIAINEN T, POUSSA T, et al. Fermented milk high in bioactive peptides has a blood pressure-lowering effect in hypertensive subjects[J]. The American journal of clinical nutrition,2003,77(2):326-330.
[24] RONG Jingjing, ZHENG Houfeng, LIU Ming, et al. Probiotic and anti-inflammatory attributes of an isolate Lactobacillus helveticus NS8 from Mongolian fermented koumiss[J]. BMC Microbiology, 2015, 15(1):196.
[25] JUILLARD V, GUILLOT A, DOMINIQUE L B, et al. Specificity of milk peptide utilization by Lactococcus lactis[J]. Applied and Environmental Microbiology,1998,64(4):1 230-1 236.
[26] DOEVEN M K, KOK J. Specificity and selectivity determinants of peptide transport in Lactococcus lactis and other microorganisms[J]. Molecular Microbiology,2005,57(3):640-649.
[27] BARS D L, KUNJI E R, KONINGS W N, et al. Oligopeptides are the main source of nitrogen for Lactococcus lactis during growth in milk[J].Applied and Environmental Microbiology,1995,61(8):3 024-3 030.
[28] TIM N M L, ANDR
N M L, ANDR S A I, OTTE J, et al. Antioxidant peptides (<3 kDa) identified on hard cow milk cheese with rennet from different origin[J]. Food Research International,2018,120:643-649.
S A I, OTTE J, et al. Antioxidant peptides (<3 kDa) identified on hard cow milk cheese with rennet from different origin[J]. Food Research International,2018,120:643-649.