鲊辣椒,又称鲊海椒、鲊广椒、酢辣椒、包谷酸辣子等,是我国西南地区的一种传统特色发酵食品。鲊辣椒是以鲜辣椒、玉米粉或大米粉为主要原料,添加生姜、食盐等辅料,经破碎混匀后于密闭容器中进行自然发酵而成。
风味物质分为挥发性和非挥发性风味物质,非挥发性风味是能引起酸、甜、咸、苦、鲜等味觉感受的物质。发酵辣椒中的有机酸主要为乳酸菌发酵所产生,以乳酸含量最高[1]。辣椒素类为辣椒本身所含有,赋予了鲊辣椒的辣味[2]。氨基酸类来源于辣椒发酵过程中产生的微生物,通过发酵产生,是鲊辣椒鲜味的来源。挥发性风味物质是能被嗅觉所感触到的呈香物质,包括醛类、内酯、酮类以及萜烯类等[3]。微生物在发酵过程中对风味物质的产生起到关键作用,PANG等[4]发现清香型白酒中的耐酸乳杆菌与短链酯类物质呈正相关,短乳杆菌与长链酯类物质呈正相关。XIE等[5]研究表明,不同腐乳中乳酸乳球菌、鞘氨醇杆菌属、发酵毕赤酵母、奥默柯达酵母和鲁氏酵母是潜在的产香微生物。
目前,小米辣鲊辣椒的独特风味物质和微生物多样性变化规律在发酵过程中的变化未见报道。因此,本研究以不同发酵阶段的小米辣鲊辣椒为研究对象,对发酵过程中的有机酸、氨基酸含量和风味物质变化进行分析,并采用MiSeq高通量测序研究小米辣鲊辣椒中微生物的多样性,揭示小米辣鲊辣椒中风味物质和微生物的变化,为小米辣鲊辣椒发酵过程中风味品质的评价和微生物多样性的变化提供理论依据。
1 材料与方法
1.1 材料与试剂
样品:按传统工艺制作[6]。取发酵时间为0、7、15、22、30、45、60、90 d的小米椒鲊辣椒,编号为A1~A8。
试剂:草酸、乙酸、苹果酸、酒石酸、乳酸、柠檬酸、琥珀酸(标准品),索莱宝生物科技有限公司;磷酸、5-磺基水杨酸、甲醇(分析纯),成都科龙化工试剂厂。
1.2 仪器与设备
GCMS-2010气相色谱质谱联用仪、LC-20高效液相色谱仪,日本岛津公司;100 μm PDMS固相微萃取(SPME)装置,美国supelco公司;HH-6数显恒温水浴锅,金坛市富华仪器有限公司;L-8900全自动氨基酸分析仪,日本日立公司;JA2003分析天平,上海精密科学仪器有限公司。
1.3 实验方法
1.3.1 挥发性成分的测定
(1)萃取方法[7]:称取5 g样品于20 mL顶空进样瓶中,再加入10 μL 2-辛醇(500 mg/L)标准品作为内标,加盖密封。在50 ℃恒温水浴平衡30 min后,将老化后的萃取头(100 μm PDMS)插入顶空进样瓶中,顶空吸附40 min,然后在GC-MS进样器中解析5 min,同时启动仪器。
(2)测定条件:色谱和质谱条件参考尹小庆等[8]的方法。
(3)定性及定量分析:采用NIST05、NIST08等谱库检索(匹配度<80的化合物)和保留指数结合进行定性分析。样品中各挥发性组分的绝对含量按公式(1)计算[9]:
绝对含量![]()
(1)
式中:ρ,内标的质量浓度,μg/μL;V,内标物体积,μL;Ai,各挥发性组分的峰面积;A,内标物质的峰面积;m,样品的质量,kg。
1.3.2 有机酸含量的测定[10]
(1)标准曲线绘制:将质量浓度范围为0.02~4.08 g/L的有机酸混合标准液经0.45 μm滤膜过滤后上机分析,以质量浓度X(g/L)对峰面积Y做图,绘制标准曲线,求回归方程及相关系数。
表1 有机酸的保留时间与回归方程
Table 1 Regression analysis and retention time of organic acids

有机酸保留时间/min线性方程相关系数(R2)线性范围/(g·L-1)草酸2.376Y=3×107X+28 9740.999 20.02~0.84酒石酸2.795Y=5×106X+9 4880.999 90.02~2.01苹果酸3.733Y=2×106X-1 3160.999 00.02~2.02乳酸4.529Y=2×106X+1 6160.999 50.02~4.08乙酸4.910Y=2×106X-8 8400.999 90.02~2.04柠檬酸8.034Y=3×106X+6 1550.999 60.02~4.08琥珀酸9.386Y=2×106X-7 9300.999 20.02~2.02
(2)色谱条件:使用AgilentC18(4.6 mm×150 mm,5 μm)色谱柱;流动相为体积分数1%甲醇:0.06 mol/L的KH2PO4 (用H3PO4调pH至2.50);流速0.6 mL/min;进样量15 μL;柱温28 ℃;检测波长210 nm。
(3)样品前处理及定性定量分析:称取 2.5 g左右样品,加纯水于75 ℃水浴20 min,冷却后定容至50 mL,8 000 r/min离心20 min,上清液经0.45 μm滤膜过滤后上机分析。采用保留时间定性,以峰面积外标法定量。
1.3.3 游离氨基酸的测定[11]
(1)样品前处理:称取0.2 g左右样品,然后加入2 mL 40 g/L的磺基水杨酸充分振荡,在4 ℃冰箱放置过夜,8 000 r/min离心10 min,上清液经0.45 μm滤膜过滤后上机检测。
(2)测定条件:柱温50 ℃;反应器温度135 ℃;进样量20 μL;泵1流速0.4 mL/min;泵2流速0.35 mL/min。
1.3.4 微生物群落结构的测定
(1)基因组DNA提取:参照E.Z.N.A Soil DNA kit说明书,提取鲊辣椒中总基因组DNA。然后用1%琼脂糖凝胶电泳检测抽提的基因组DNA。
(2)PCR扩增:对细菌16S rDNA 的V3-V4可变区进行扩增,对真菌的 ITS1-ITS2可变区进行扩增,具体引物见表2。优化PCR体系和反应条件,将所有样品的微生物宏基因组在此条件下进行 PCR 反应。
表2 细菌和真菌的PCR扩增引物设计
Table 2 Primers of bacteria and fungi for PCR

测序区域引物名称引物序列细菌V3-V4区338F5’ -ACTCCTACGGGAGGCAGCAG-3’806R5’-GGACTACHVGGGTWTCTAAT-3’真菌ITS1-ITS2区ITS1F5’-CTTGGTCATTTA GAGGAAGTAA-3’ITS2R5’-GCTGCGTTCTTCATCGATGC-3’
细菌PCR反应体系:5×FastPfu Buffer 4 μL,2.5 mmol/L dNTPs 2 μL,5 μmol/L上游引物和下游引物各0.8 μL,4 μL FastPfu Polymerase,0.2 μL BSA, 模板DNA 10 ng,补ddH2O至20 μL。细菌PCR反应条件:95 ℃预变性3 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s(27 个循环),最后72 ℃延伸10 min,10 ℃保温。
真菌PCR反应体系:10×Buffer 2 μL,2.5 mmol/L dNTPs 2 μL,5 μmol/L上游引物和下游引物各0.8 μL,0.2 μL rTaq Polymerase,0.2 μL BSA, 10 ng模板DNA,补ddH2O至20 μL。真菌PCR反应条件:95 ℃预变性3 min,95 ℃变性30 s,55 ℃退火 30 s,72 ℃延伸45 s(35 个循环),最后72 ℃延伸10 min,10 ℃保温。
扩增后的PCR产物用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒切胶回收PCR产物,Tris-HCl洗脱,2%琼脂糖电泳检测。
(3)MiSeq高通量测序:将PCR产物纯化后定量,并按照每个样本测序量的要求进行相应比例的混合,构建文库,然后进行MiSeq测序。
(4)生物信息学分析:Illumina平台测序得到的是双端序列数据,需对所得序列进行拼接及质控过滤。根据条码将序列确定到每个样品,并将条码、载体序列和引物序列去除,去掉长度<200 bp、单碱基重复>6个、含2个以上错配的引物碱基以及含模糊碱基的序列,得到有效的序列文件[12]。在97%的相似水平下对所有序列进行操作分类单位(operational taxonomic unit, OTU)划分并与 Silva、Unite等数据库进行比对,利用Mothur软件进行OTU分布统计以及分类学分析等。
2 结果与分析
2.1 小米辣鲊辣椒中挥发性成分的分析
小米辣鲊辣椒发酵过程中挥发性成分的种类及含量见表3所示,共检出66种挥发性成分,其中酯类28种,萜类17种,烷烃类13种,醇类和醛类各3种,酸类和吡嗪类各1种。总挥发成分的含量呈现先增加后减少的趋势,各类挥发性化合物的含量变化趋势与总挥发性含量大致相同。在发酵45 d时挥发性物质的种类和含量均达到最大值。小米辣鲊辣椒发酵过程中香气活度值(odor activity value, OAV)>1的挥发性成分共19种,见表4所示。其中,酯类13种、萜类4种、醇类和吡嗪类各1种。在不同的发酵阶段,小米鲊辣椒的主要特征风味物质差异较大。
酯类化合物主要赋予食品特殊的水果香味[13]。直链酯类是以脂肪酸为前体物质,经脂肪酸的氧化代谢而形成的香气物质,支链酯类香气物质主要来源于氨基酸的代谢,而芳香环类香气物质则由苯丙氨酸经莽草酸途径合成[14-15]。在发酵0 d 时,酯类化合物共16种,其中己酸乙酯、乙酸己酯、庚酸乙酯、异丁酸己酯、苯甲酸乙酯、己酸己酯和(Z)-4-癸烯酸乙酯的OAV>1,说明它们对鲜小米辣的香气有一定贡献。发酵22 d后,OAV>1的物质有11种,己酸乙酯、乙酸己酯、庚酸乙酯等OVA值相对较高。小米辣鲊辣椒中酯类化合物的种类和含量在发酵45 d时达最大值。发酵45~60 d的小米辣检出13种对风味有贡献的酯类化合物,其中丁酸乙酯具有强烈的菠萝香气,己酸乙酯有强烈的甜果香,乙酸己酯具有青香和果香[16],且这3种酯类OAV>100,是鲊辣椒特征香气成分。
萜类化合物对天然风味有一定的贡献。小米辣鲊辣椒发酵前15 d仅检出(Z)-β-罗勒烯、芳樟醇、(-)-α-荜澄茄油烯、β-榄香烯、α-雪松烯和β-石竹烯,而α-柏木烯和α-姜黄烯在发酵15 d后生成,其余萜类物质直至发酵30 d后才检出。小米辣鲊辣椒在发酵45 d时萜类化合物的种类和含量最高,发酵45~60 d时OAV>1的萜类化合物有4种。其中芳樟醇具有浆果和玫瑰香气,是小米辣鲊辣椒发酵 45~60 d时共有的特征香气物质。
表3 小米辣鲊辣椒发酵过程中挥发性成分的变化
Table 3 Changes of volatile compounds in Xiaomila Zhalajiao during fermentation

序号物质保留指数挥发性物质含量/(μg·kg-1)0 d7 d15 d22 d30 d45 d60 d90 d1丙酸乙酯721ndndndnd110.64259.551 038.80219.662丁酸乙酯769ndndndnd145.431 563.681 968.9779.843乙酸戊酯881ndndndnd949.702 726.012 638.39415.654戊酸乙酯904ndndndnd28.76309.47180.2137.115异己酸乙酯967ndndndnd72.01220.19175.8232.006己酸乙酯99789.67219.26283.20408.14477.551905.681 771.45230.947乙酸己酯1 01026.4492.9380.20125.76602.311081.20551.20155.978庚酸乙酯1 0959.5015.3028.9330.8168.99166.14164.7750.089异戊酸异戊酯1 10317.829.8523.7130.9249.90317.22369.9836.0010异丁酸己酯1 110205.48208.62237.05349.03343.67930.101 179.81172.01112-甲基丁酸戊酯1 137ndndndnd47.6079.5494.7621.8212苯甲酸乙酯1 17983.36198.3473.73100.10115.23370.53330.3959.0613辛酸乙酯1 19484.11158.24169.05229.29285.68771.41863.17133.2914异戊酸己酯1 2101 173.831 425.191 097.421 644.191 627.014 813.014 509.95863.7715己酸异戊酯1 21935.1765.0825.3935.7859.42144.91171.6929.5516正戊酸己酯1 27575.90101.9559.2083.70143.61474.4270.7121.8717(Z)-4-癸烯酸乙酯1 359336.69629.23701.201 002.981 093.273 468.293 254.73466.7618己酸己酯1 37090.76109.5486.48139.55133.96373.37411.3964.1319癸酸乙酯1 39278.53305.49125.48196.78228.10621.94572.7169.2620十一酸乙酯1 45531.4879.0761.6595.87182.91479.55522.9155.2921月桂酸乙酯1 592ndnd109.41172.47298.61939.87791.99103.8622癸酸异戊酯1 607ndnd42.0475.28195.14391.22350.9873.6223十四酸乙酯1 792415.62755.91835.271357.411337.105428.823701.09351.3624十五酸乙酯1 883ndndndnd232.27935.03885.739.53259-十六碳烯酸乙酯1 987ndndndnd55.44477.24215.4422.4526棕榈酸乙酯1 992860.101246.941161.782 232.071 877.319 279.475 027.17515.2427油酸乙酯2 173ndnd66.89176.62219.291 834.37607.4190.2828亚油酸乙酯2 190ndnd156.94224.16484.543 430.611 087.48181.6829正戊醇754ndndndnd345.59147.6692.7841.2330正己醇854ndndndnd144.63163.90159.4858.4231苯乙醇1 13791.12160.21309.87382.15783.49953.73114.7380.5932反式-2-壬醛1 166ndndndnd21.0891.71120.0825.0833十五醛1 714ndndndnd109.21315.71279.7181.9234十六醛1 819ndndndnd26.28166.8232.3427.2435L-亮氨酸1 076ndndndnd181.86609.73184.3837.4336(+)-柠檬烯1 033ndndndnd37.31954.75705.8239.7937β-罗勒烯1 059184.94266.18167.22261.98266.701 174.191 499.72180.8338芳樟醇1 100187.63166.86170.81257.83326.751 044.091 193.14218.8739α-荜澄茄油烯1 37659.2284.45153.57254.87304.11271.79896.87142.6140β-榄香烯1 39635.45226.9289.41124.56179.46351.67475.8858.4041香树烯1 411ndndndnd143.66265.99430.9028.9042α-柏木烯1 427ndnd76.38130.71265.72742.99856.94105.8243β-倍半水芹烯1 435ndndndnd157.02302.87961.5270.5544佛术烯1 447ndndndnd42.3835.99121.9011.4745(E)- β-金合欢烯1 451ndndndnd164.18448.12621.0361.4746α-菖蒲二烯1 472ndndndnd59.3287.0173.1640.06
续表3

序号物质保留指数挥发性物质含量/(μg·kg-1)0 d7 d15 d22 d30 d45 d60 d90 d47α-雪松烯1 48830.90282.043 464.154 943.835 750.4715 750.4110 810.482 658.4748β-石竹烯1 49274.2993.54175.70313.72555.991 237.392413.45102.2849α-愈创木烯1 507ndndnd87.97499.431 271.6885.9324.5850β-雪松烯1 511ndndnd51.38499.43981.441 852.1156.6451α-姜黄烯1 519ndnd176.95316.95430.131 233.911 253.53143.4652柏木脑1 617ndndndnd603.231 141.21960.03236.38532-甲氧基-3-异丁基吡嗪1 199ndndndnd21.9486.24102.2720.19543-甲基十一烷1 175ndndndnd59.31295.76237.1562.62552-甲基十三烷1 3611 097.461 267.85990.771 679.401 567.204 634.804 603.24693.0156正十四烷1 402171.74441.77165.57244.14296.21771.05825.53164.40572-甲基四癸烷1 4621 168.221 455.161 156.001 891.702 039.834 015.097 239.40740.5758正十五烷1 505500.57827.82255.41429.90533.801 271.681 352.67256.79592-甲基十五烷1 544ndndndnd89.18161.09131.2241.3660正十六烷1 603ndnd275.47460.35531.741 258.491 275.29303.2661姥鲛烷1 646ndndndnd134.54255.68308.86174.51622-甲基二六烷1 663263.351 545.9879.85139.98222.95566.76511.82104.8663正十七烷1 700ndnd198.77329.06432.131 186.671 217.65238.5264植烷1 742ndndndnd73.67350.62141.0360.85653-甲基十七烷1 771ndndndnd52.4355.9889.9252.5566正十八烷1 806ndnd55.0591.68103.67262.29230.7582.93
注:nd表示未检出(下同)
表4 小米辣鲊辣椒中主要成分的OAV
Table 4 The OAVs of major volatile compounds in Xiaomila Zhalajiao
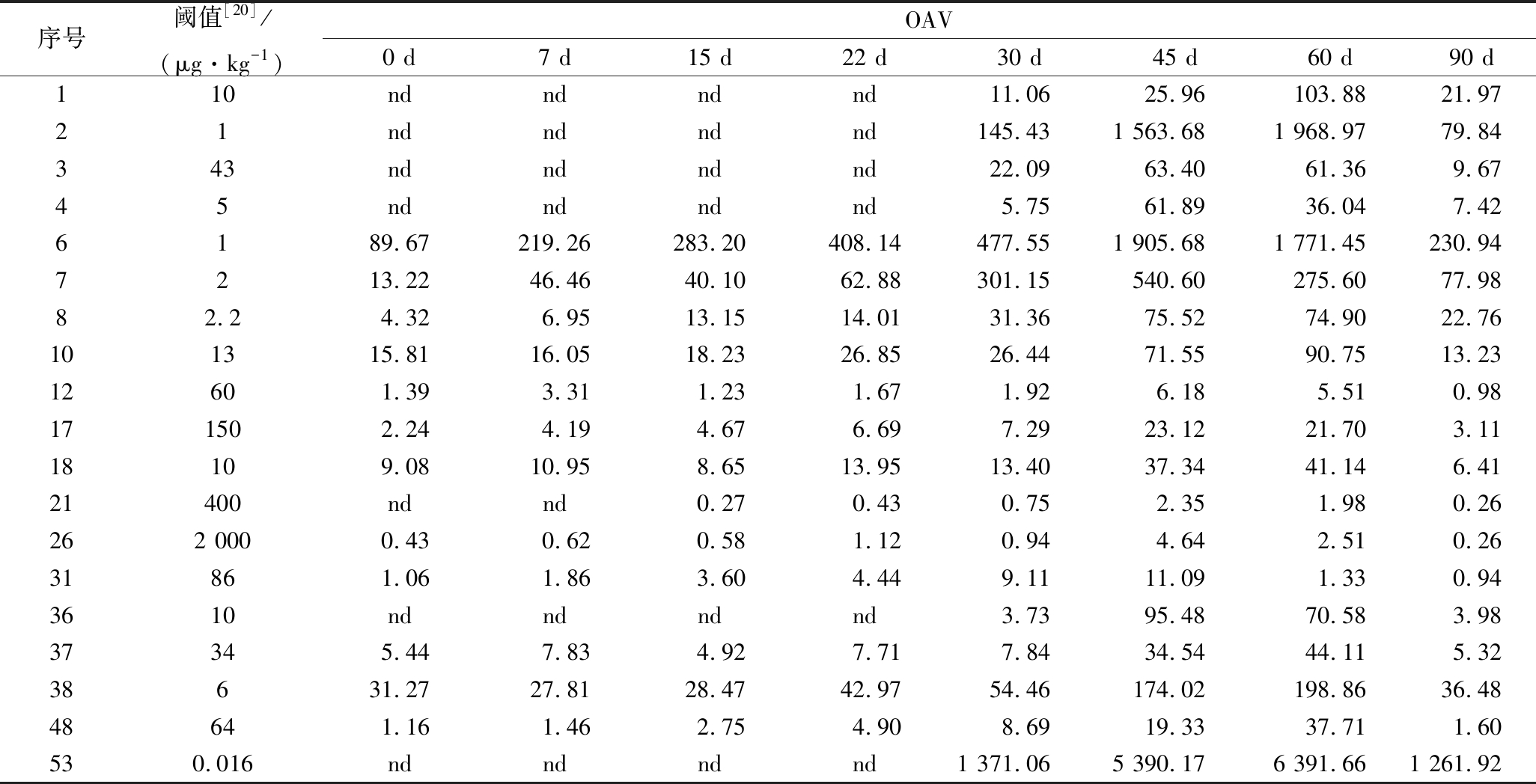
序号阈值[20]/(μg·kg-1)OAV0 d7 d15 d22 d30 d45 d60 d90 d110ndndndnd11.0625.96103.8821.9721ndndndnd145.431 563.681 968.9779.84343ndndndnd22.0963.4061.369.6745ndndndnd5.7561.8936.047.426189.67219.26283.20408.14477.551 905.681 771.45230.947213.2246.4640.1062.88301.15540.60275.6077.9882.24.326.9513.1514.0131.3675.5274.9022.76101315.8116.0518.2326.8526.4471.5590.7513.2312601.393.311.231.671.926.185.510.98171502.244.194.676.697.2923.1221.703.1118 109.0810.958.6513.9513.4037.3441.146.4121400ndnd0.270.430.752.351.980.26262 0000.430.620.581.120.944.642.510.2631861.061.863.604.449.1111.091.330.943610ndndndnd3.7395.4870.583.9837345.447.834.927.717.8434.5444.115.3238631.2727.8128.4742.9754.46174.02198.8636.4848641.161.462.754.908.6919.3337.711.60530.016ndndndnd1 371.065 390.176 391.661 261.92
注:表4中序号与表3中序号相对应
醇类、醛类、酸类和吡嗪类化合物均在发酵30 d后生成,且含量较低。2-甲氧基-3-异丁基吡嗪具有类似胡椒和咖啡的香气,是青辣椒的主要香气成分[17]。虽然其含量低,但由于阈值仅为0.016 μg/kg,且OAV>1 000,所以是小米辣鲊辣椒发酵30 d后的特征香气成分。研究表明,辣椒变红后2-甲氧基-3-异丁基吡嗪含量降低[18],这可能是鲊辣椒发酵前22 d未检测到2-甲氧基-3-异丁基吡嗪的原因。而在发酵后期能检测到这种物质是因为发生strecker反应,生成吡嗪类物质[19]。
烃类化合物的风味阈值高,对小米辣鲊辣椒的风味贡献小,所以烃类化合物不是鲊辣椒的特征香气成分。发酵前7 d,小米辣鲊辣椒中主要是酯类和烷烃类化合物,分别占总含量的45%左右。发酵15 d后,各类化合物含量增加但比例发生了变化,萜类化合物上升至30%以上,烷烃类化合物下降在到20%左右,酯类维持在40%左右。随着发酵的进行,烷烃化合物在向萜类物质转化,酯类和萜类逐渐成为小米辣鲊辣椒的主要香气成分。
2.2 小米辣鲊辣椒中有机酸的动态变化
由表5可知,小米辣鲊辣椒发酵过程中有机酸的总量呈先上升后下降的趋势,发酵22 d时有机酸总含量最高,为14.56 g/kg。酸味是鲊辣椒的一个非常重要的滋味品质,但不同的有机酸有不同的酸味特征[21]。苹果酸具有温和的酸味,酒石酸具有葡萄和白柠檬的香气,这2种酸在发酵过程中逐渐增加,在第30天达到最大值,分别为1.14和1.98 g/kg,然后基本保持不变。乳酸的酸味柔和,有后酸味。在发酵前22 d,乳酸含量不断增加,而22 d后,乳酸含量略微下降后保持相对稳定。琥珀酸有豆酱类的风味,在发酵22 d后含量大幅度减少直至低于检测限。而乙酸的酸味有刺激性,但苹果酸、柠檬酸、琥珀酸能够中和乙酸的刺激性,使酸味更加柔和、醇厚[22]。在发酵22 d后,乙酸含量急剧减少,推测乙酸与醇类等物质发生酯化反应[23],进而增加了鲊辣椒的风味。
表5 小米辣鲊辣椒发酵过程中有机酸含量的变化
Table 5 Changes of organic acids in Xiaomila Zhalajiao during fermentation
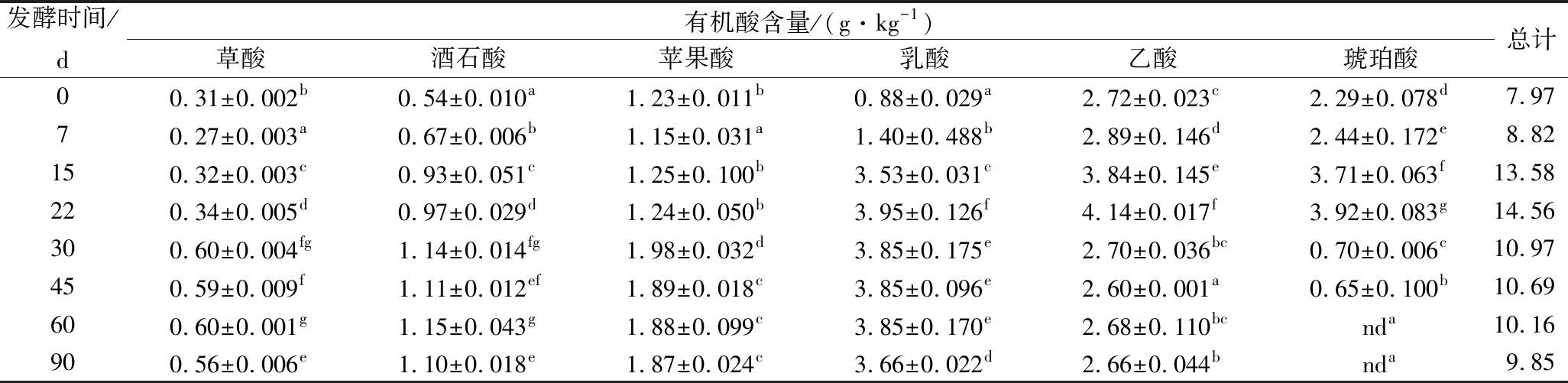
发酵时间/d有机酸含量/(g·kg-1)草酸酒石酸苹果酸乳酸乙酸琥珀酸总计00.31±0.002b0.54±0.010a1.23±0.011b0.88±0.029a2.72±0.023c2.29±0.078d7.9770.27±0.003a0.67±0.006b1.15±0.031a1.40±0.488b2.89±0.146d2.44±0.172e8.82150.32±0.003c0.93±0.051c1.25±0.100b3.53±0.031c3.84±0.145e3.71±0.063f13.58220.34±0.005d0.97±0.029d1.24±0.050b3.95±0.126f4.14±0.017f3.92±0.083g14.56300.60±0.004fg1.14±0.014fg1.98±0.032d3.85±0.175e2.70±0.036bc0.70±0.006c10.97450.59±0.009f1.11±0.012ef1.89±0.018c3.85±0.096e2.60±0.001a0.65±0.100b10.69600.60±0.001g1.15±0.043g1.88±0.099c3.85±0.170e2.68±0.110bcnda10.16900.56±0.006e1.10±0.018e1.87±0.024c3.66±0.022d2.66±0.044bnda9.85
注:同列不同小写字母表示差异显著(P<0.05)(下同)
2.3 小米辣鲊辣椒中游离氨基酸的分析
氨基酸不仅具有营养功能,而且还是重要的呈味物质。如Asp和Glu是鲜味氨基酸,His、Leu和Tyr味道微苦。这些氨基酸不仅可以组成不同形式的滋味相关肽,还可能对醇、酯等芳香成分产生一定影响[24]。由表6可知,发酵0 d时,小米辣鲊辣椒的总氨基酸含量为8.31 g/kg,苦味、甜味、鲜味和无味氨基酸分别占总含量的14.4%、78.03%、3.37%和4.2%,必需氨基酸占比11.9%。随着发酵的进行,总氨基酸和甜味氨基酸含量降低,苦味、鲜味、无味和必需氨基酸含量增加。其中His、Arg、Ser和Cys含量降低,其余氨基酸含量逐渐增加。发酵45 d时,小米辣鲊辣椒的总氨基酸含量下降到3.33 g/kg,必需氨基酸占比为上升到46.21%。苦味、甜味、鲜味和无味氨基酸分别占总含量的43.27%、28.03%、15.32%和13.38%,可见氨基酸的滋味逐渐丰富。在整个发酵过程中,7种必需氨基酸含量不断增加,发酵45 d后必需氨基酸的含量占总含量的45%以上,说明小米辣鲊辣椒发酵45 d后营养价值较高。
表6 小米辣鲊辣椒发酵过程中游离氨基酸含量的变化
Table 6 Changes of free amino acids in Xiaomila Zhalajiao during fermentation
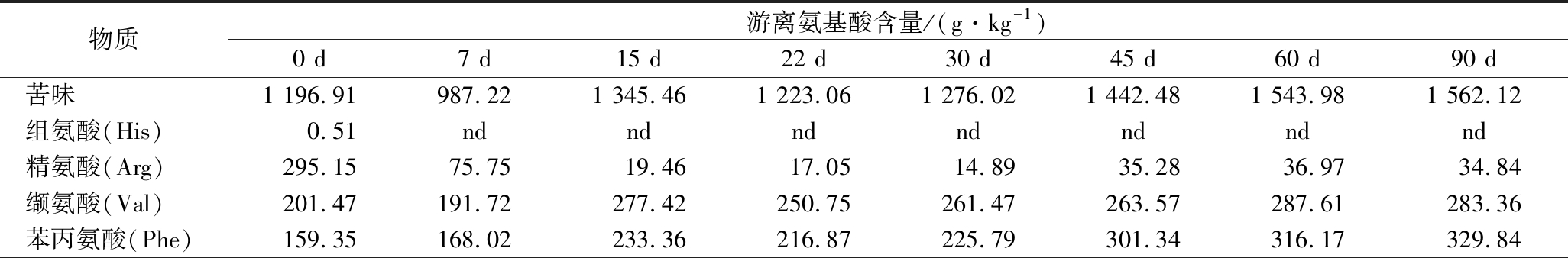
物质游离氨基酸含量/(g·kg-1)0 d7 d15 d22 d30 d45 d60 d90 d苦味1 196.91 987.22 1 345.46 1 223.06 1 276.02 1 442.48 1 543.98 1 562.12 组氨酸(His)0.51 nd ndndndndndnd精氨酸(Arg)295.15 75.75 19.46 17.05 14.89 35.28 36.97 34.84 缬氨酸(Val)201.47 191.72 277.42 250.75 261.47 263.57 287.61 283.36 苯丙氨酸(Phe)159.35 168.02 233.36 216.87 225.79 301.34 316.17 329.84
续表6

物质游离氨基酸含量/(g·kg-1)0 d7 d15 d22 d30 d45 d60 d90 d亮氨酸(Leu)241.17 240.46 375.91 343.99 357.57 356.24 388.86 392.39异亮氨酸(Ile)96.73 95.44 145.20 136.24 143.35 166.21 181.73 182.32 甲硫氨酸(Met)68.53 68.67 98.31 91.18 94.79 97.77 104.76 106.54 酪氨酸(Tyr)133.99 147.16 195.81 166.98 178.16 222.07 227.89 232.82 甜味6 486.84 5 350.57 4 171.95 2 994.26 2 064.73 934.38 1 034.95 1 016.73 丝氨酸(Ser)5 977.01 4 820.69 3 458.68 2 330.70 1 388.62 238.37 262.66 262.44 苏氨酸(Thr)87.66 78.29 115.65 99.36 103.52 133.44 144.82 140.02 甘氨酸(Gly)93.12 96.92 135.53 117.30 124.13 131.82 143.33 143.08 丙氨酸(Ala)329.05 354.66 462.08 446.89 448.46 430.75 484.14 471.19 鲜味280.17 291.37 411.19 364.44 393.17 510.84 540.67 550.56 天冬氨酸(Asp)33.00 39.84 55.47 64.32 78.87 131.80 128.27 133.77 谷氨酸(Glu)247.17 251.52 355.72 300.12 314.30 379.03 412.40 416.79 无味349.09 337.85 485.56 412.51 433.20 446.14 482.79 478.43 赖氨酸(Lys)163.96 147.39 207.77 187.51 197.33 208.04 229.34 227.09 半胱氨酸(Cys)9.61 9.13 7.17 12.04 12.49 6.21 7.50 7.29 脯氨酸(Pro)175.52 181.33 270.63 212.96 223.38 231.88 245.95 244.05 必需氨基酸988.91 989.75 1 441.65 1 305.36 1 364.66 1 540.64 1 651.84 1 667.30 总计8 313.00 6 967.00 6 414.16 4 994.26 4 167.13 3 333.83 3 602.39 3 607.85
2.4 小米辣鲊辣椒中微生物多样性的分析
2.4.1 发酵过程中细菌群落结构分析
小米辣鲊辣椒发酵过程中共鉴定出30种不同属的细菌,如图1所示。

图1 小米辣鲊辣椒发酵过程中细菌在属水平上的群落热图
Fig.1 Bacterial community heatmap of Xiaomila Zhalajiao during fermentation at the genus level
相对丰度>0.1%的有11种,如乳杆菌属(Lactobacillus)、蓝细菌(Cyanobacteria norank)、葡萄球菌属(Staphylococcus)、片球菌属(Pediococcus)、假单胞菌属(Pseudomonas)等。随着发酵的进行,Lactobacillus的相对丰度呈先增加后减少的趋势,这与乳酸含量在发酵过程中的变化趋势基本一致。发酵15 d后乳杆菌属丰度迅速增加到64.69%,发酵30~60 d,Lactobacillus的丰度保持在80%左右。尽管在发酵90 d后,Lactobacillus含量降低到57.47%,也依然是小米辣鲊辣椒中的优势菌群。周俊良[25]分离鉴定了辣椒制品中10种乳酸菌,其中7种为乳杆菌。韩俊燕等[26]发酵辣椒细菌多样性的研究也表明乳杆菌是发酵辣椒的主要菌属。发酵90 d后仍有26个细菌属参与发酵,其中约20个细菌属参与了整个发酵过程。可见,在小米辣鲊辣椒在发酵过程中保持了细菌的多样性。
2.4.2 发酵过程中真菌群落结构分析
小米辣鲊辣椒发酵过程中共鉴定出36种不同属的真菌,如图2所示。发酵0 d时,其中相对丰度>0.1%的菌属有Candida(97.44%)、Aspergillus(0.44%)、unclassified Colletotrichum(0.34%)、Meyerozyma(0.26%)、Colletotrichum(0.24%)、Fusarium(0.19%)、Gibberella(0.15%)、Meyerozyma(0.11%)、Monographella(0.10%)、unclassified Davidiellaceae(0.1%)。假丝酵母属(Candida)在整个发酵过程中的相对丰度>97%,为小米辣鲊辣椒发酵过程中的优势真菌。刘丽娜[27]研究发现石柱辣椒表面的酵母菌以假丝酵母居多,与本实验结果相类似。发酵7 d后真菌属的种类锐减到10个左右,可能是因为乳酸菌在厌氧发酵过程中产生乳酸,高酸性环境影响了一些真菌正常的生长代谢。且除Candida以外,其他真菌属的含量均低于0.1%。推测Meyerozyma、Kazachstania参与了鲊辣椒整个发酵过程。

图2 小米辣鲊辣椒发酵过程中真菌在属水平上的群落热图
Fig.2 Fungal community heatmap of Xiaomila Zhalajiao during fermentation at the genus level
2.5 风味物质与微生物相关性分析
为研究微生物与挥发性成分之间的关系,分析了小米辣鲊辣椒不同发酵阶段微生物(相对丰度>1%)群落的相对丰度与66种挥发性成分含量之间的相关性。由表7可知,Lactobacillus与47种挥发性化合物显著相关(P<0.05),其中包括13种小米辣鲊辣椒在发酵过程中的特征香气成分,酯类10种、萜类2种、吡嗪类1种。并且Lactobacillus与其中21种挥发性化合物相关性极显著(P<0.01),其中乙酸己酯、庚酸乙酯、异丁酸乙酯、(Z)-4-癸烯酸乙酯、月桂酸乙酯、芳樟醇、β-石竹烯为小米辣鲊辣椒在发酵过程中的特征香气成分。Candida与27种化合物显著相关(P<0.05),包括酯类14种、萜类6种、醇类2种、醛、酸类各1种、烷烃类3种,其中乙酸戊酯、己酸乙酯、乙酸己酯、庚酸乙酯、(Z)-4-癸烯酸乙酯、月桂酸乙酯、(Z)-4-癸烯酸乙酯、β-石竹烯小米辣鲊辣椒在发酵过程中的特征香气成分。乳杆菌属和Candida均与特征香气成分乙酸戊酯、己酸乙酯、庚酸乙酯、(Z)-4-癸烯酸乙酯、β-石竹烯有显著相关性。可见,Lactobacillus和Candida对小米辣鲊辣椒香气形成起重要作用。
3 结论
小米辣鲊辣椒在整个发酵过程中,挥发性风味物质、有机酸和游离氨基酸在不同发酵阶段差异较大。小米辣鲊辣椒在发酵过程中共检出 66 种挥发性化合物,各类挥发性物质含量均先增加后减少,其中醇类在发酵30 d时达最大值,酯、萜、醛及酸类物质在发酵45 d时达最大值,吡嗪和烷烃类在发酵60 d时达最大值。丁酸乙酯、己酸乙酯、乙酸己酯、芳樟醇和2-甲氧基-3-异丁基吡嗪是小米辣鲊辣椒发酵45~60 d时的特征香气成分。小米辣鲊辣椒中共检测出 6 种有机酸,琥珀酸和乙酸含量先升高后降低,其余有机酸含量先增加后基本保持稳定。小米辣鲊辣椒中共检测出 18种氨基酸,其总量不断降低,但人体必需氨基酸含量由11.9%增加至46.21%。小米辣鲊辣椒在发酵中共鉴定出30个细菌属、36个真菌属,其中Lactobacillu和Candida为发酵过程中的优势菌群。Lactobacillus与47种挥发性成分显著相关(P<0.05),且与特征香气成分乙酸己酯、庚酸乙酯、异丁酸乙酯、(Z)-4-癸烯酸乙酯、月桂酸乙酯、芳樟醇、β-石竹烯相关性极显著(P<0.01)。Candida与27种化合物显著相关(P<0.05),包括酯类14种、萜类6种、醇类2种、醛、酸类各1种、烷烃类3种。该结果将为小米辣鲊辣椒发酵过程中风味品质的评价和微生物多样性的变化提供理论依据。
表7 小米辣鲊辣椒中微生物与挥发性物质的Spearman相关系数
Table 7 Spearman correlation coefficients between microes and corresponding associated with volatile compounds in Xiaomila Zhalajiao
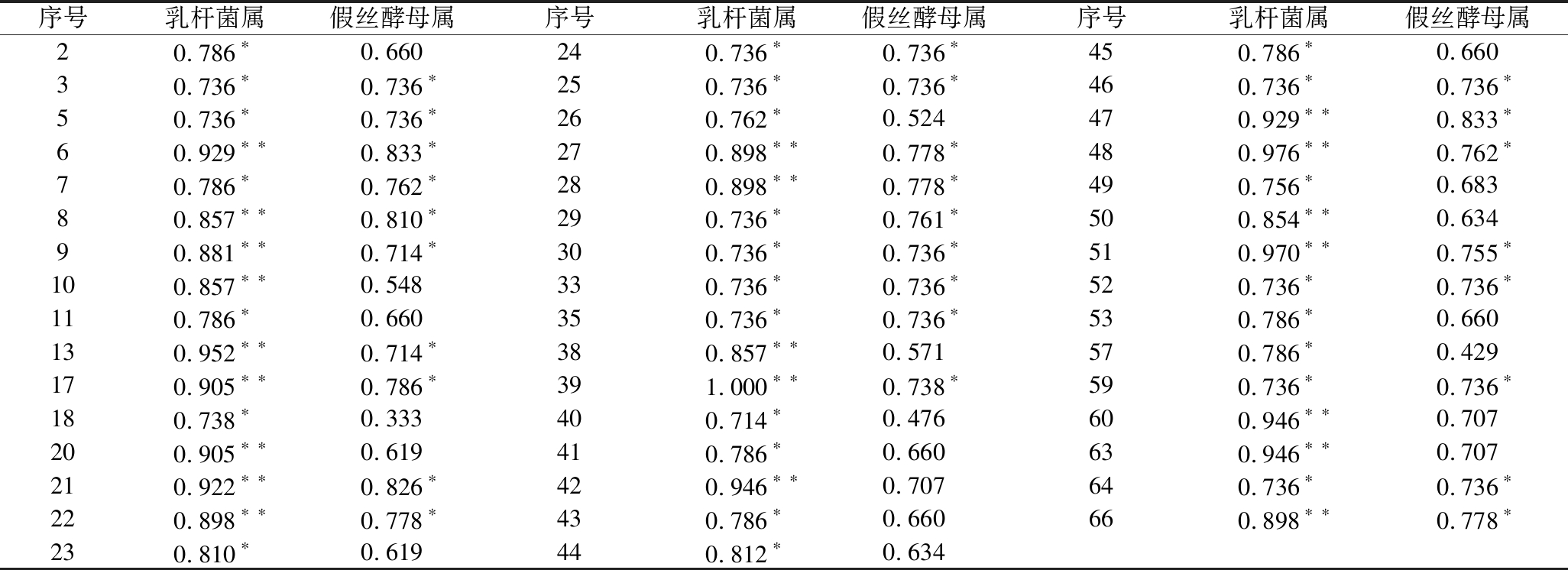
序号乳杆菌属假丝酵母属序号乳杆菌属假丝酵母属序号乳杆菌属假丝酵母属20.786∗0.660240.736∗0.736∗450.786∗0.66030.736∗0.736∗250.736∗0.736∗460.736∗0.736∗50.736∗0.736∗260.762∗0.524470.929∗∗0.833∗60.929∗∗0.833∗270.898∗∗0.778∗480.976∗∗0.762∗70.786∗0.762∗280.898∗∗0.778∗490.756∗0.68380.857∗∗0.810∗290.736∗0.761∗500.854∗∗0.63490.881∗∗0.714∗300.736∗0.736∗510.970∗∗0.755∗100.857∗∗0.548330.736∗0.736∗520.736∗0.736∗110.786∗0.660350.736∗0.736∗530.786∗0.660130.952∗∗0.714∗380.857∗∗0.571570.786∗0.429170.905∗∗0.786∗391.000∗∗0.738∗590.736∗0.736∗180.738∗0.333400.714∗0.476600.946∗∗0.707200.905∗∗0.619410.786∗0.660630.946∗∗0.707210.922∗∗0.826∗420.946∗∗0.707640.736∗0.736∗220.898∗∗0.778∗430.786∗0.660660.898∗∗0.778∗230.810∗0.619440.812∗0.634
注:表7中序号与表3中序号相对应。*表示相关性显著(P<0.05);**表示相关性极显著(P<0.01)
[1] 刘子菱, 李影, 韩立杰, 等. 韩国传统辣椒酱的功能性[J]. 食品科技, 2014, 39(3): 254-260.
[2] XAVIER A A O, PEREZ-GALVEZ A. Peppers and chilies[J]. Encyclopedia of Food and Health, 2016, 301: 305.
[3] 王永华. 食品风味化学[M]. 北京: 中国轻工业出版社, 2015.
[4] PANG X N, HAN B Z, HUANG X N, et al. Effect of the environment microbiota on the flavour of light-flavour Baijiu during spontaneous fermentation[J]. Scientific Reports, 2018, 8(1): 3 396.
[5] XIE C, ZENG H, WANG C, et al. Volatile flavor components, microbiota and their correlations in different sufu, a Chinese fermented soybean food[J]. Journal of Applied Microbiology, 2018, 125(6): 1 761-1 773.
[6] 白娟, 张瑶, 汪雪瑞, 等.响应面法优化鲊辣椒的发酵工艺[J]. 中国酿造, 2018, 37(10): 106-110.
[7] 王巧碧, 王丹, 赵欠, 等. SDE和SPME法对鲊海椒发酵中香气组成的比较分析[J]. 食品科学, 2016, 37(4): 108-114.
[8] 尹小庆, 汤艳燕, 杜木英, 等. 两种鲊辣椒发酵过程中香气特征及其差异分析[J]. 食品与发酵工业, 2019,45(16): 266-274;285.
[9] 陈光静, 郑炯, 丁涌波, 等. 顶空-固相微萃取-气相色谱-质谱联用结合嗅闻法分析异味薏米的异味成分[J]. 食品与发酵工业, 2018, 44(1): 230-237.
[10] 赵欠, 葛平珍, 王丹, 等. 不同淀粉配料制备鲊海椒酸味形成及其酸味特性的研究[J]. 食品与发酵工业, 2016, 42(10): 134-141.
[11] WU R, YU M, LIU X, et al. Changes in flavour and microbial diversity during natural fermentation of suan-cai, a traditional food made in Northeast China[J]. International Journal of Food Microbiology, 2015, 211: 23-31.
[12] MIAO L, WANG S, LI B, et al. Effect of carbon source type on intracellular stored polymers during endogenous denitritation (ED) treating landfill leachate[J]. Water Research, 2016, 100: 405-412.
[13] 张伟建, 范文来, 徐岩, 等. 沂蒙老区浓香型白酒香气成分分析[J]. 食品与发酵工业, 2019, 45(10): 188-193.
[14] 韩江雪, 丁筑红, 李仲军, 等. 不同乳酸菌强化接种发酵辣椒挥发性风味成分分析[J]. 食品科学, 2012, 33(10): 179-183.
[15] 周俊良. 发酵辣椒制品优势菌群鉴别筛选及其载体研究[D]. 贵阳: 贵州大学, 2008.
[16] ZHAO L, LI Y, JIANG L, et al. Determination of fungal community diversity in fresh and traditional Chinese fermented pepper by pyrosequencing[J]. FEMS Microbiology Letters, 2016, 363(24): fnw273.
[17] 牛琛, 奚印慈, Takuya Yanagisawa, 等. 基于HS-SPME-GC/MS和感官分析沙拉酱对青椒风味的影响[J].山东农业大学学报(自然科学版), 2019, 50(4): 692-696.
[18] JEUN J, KIM S, CHO S Y, et al. Hypocholesterolemic effects of Lactobacillus plantarum KCTC3928 by increased bile acid excretion in C57BL/6 mice[J]. Nutrition, 2010, 26(3): 321-330.
[19] WANG Y, XU N, XI A, et al. Effects of Lactobacillus plantarum MA2 isolated from Tibet kefir on lipid metabolism and intestinal microflora of rats fed on high-cholesterol diet[J]. Applied Microbiology and Biotechnology, 2009, 84(2): 341-347.
[20] 斯波. 辣椒香味物质的提取分离及其应用[J]. 中国调味品, 2012, 37(6): 27-30.
[21] 李曦, 陈倩, 唐伟, 等. 苹果醋饮料中的有机酸分析[J]. 食品与发酵工业, 2017, 43(2): 220-225.
[22] 叶陵, 王晶晶, 王蓉蓉, 等. 剁辣椒发酵过程中菌群与有机酸变化规律分析[J]. 食品科学, 2018, 39(6): 116-121.
[23] XIONG T, LI J, LIANG F, et al. Effects of salt concentration on Chinese sauerkraut fermentation[J]. LWT-Food Science and Technology, 2016, 69: 169-174.
[24] 赵大云, 丁霄霖. 雪里蕻腌菜风味物质的研究(I)雪里蕻腌菜氨基酸及有机酸成分检测与分析[J]. 中国调味品, 2000, 12: 13-16.
[25] 周俊良. 发酵辣椒制品优势菌群鉴别筛选及其载体研究[D]. 贵阳: 贵州大学, 2008.
[26] 韩俊燕, 赵国忠, 赵建新, 等. 发酵辣椒细菌多样性的16S rDNA测序分析[J]. 中国食品学报, 2018, 18(5): 246-251.
[27] 刘丽娜. 辣椒表面微生物区系的研究[D]. 重庆: 西南大学, 2007.