豆类营养价值丰富,是主要的植物性蛋白来源,在人们的生活和国民经济发展中占有重要的地位。豆类不仅含有脂肪、纤维素、糖类和矿质元素等[1],同时包含一些益于人类健康的次生代谢产物,即生物活性物质[2]。主要豆类有绿豆、大豆、红豆、豌豆、蚕豆、小扁豆、芸豆、鹰嘴豆等。黑豆具有高蛋白、低热量的特性,其蛋白质含量相当于肉类的2倍,被誉为“植物蛋白肉”,同时含有黑豆色素和异黄酮等植物化学物质[3]。红豆含有淀粉、蛋白质和较少的脂肪,具有通肠、利小便、消热解毒等保健作用,对于调理血压和血糖也有良好的效果[4]。豌豆含有多糖、微量营养元素、胡萝卜素、维生素B1和B2等,营养价值全面而均衡,是重要的粮食、蔬菜、饲料、绿肥和养地作物[5]。
芽苗菜是指利用植物种子或其他营养储存器官,在黑暗或者光照条件下直接生长出可供食用的嫩芽、芽苗、幼梢或幼茎[6],其生产周期短、成本低、生物效率高,且富含对人类有益的生物活性物质,因而受到消费者的普遍欢迎。芽苗菜能分解抗营养因子[7],提高蛋白质的利用率,促进人体对蛋白质的吸收和利用,平衡膳食结构。研究发现,黑豆芽苗菜清香爽口,富含矿物质及多种维生素、糖类,具有补肝名目、清热消肿等食疗功效。豌豆苗中富含水溶性维生素P、维生素C和维生素E,可以促进人体新陈代谢,提高免疫力。红小豆苗富含优质蛋白、8种人体必需氨基酸,还含有丰富的维生素B1和铁、磷等矿物质,经常食用能保持人体血液的酸碱平衡[6]。
目前关于豆类及其萌发以后的营养成分变化多集中在绿豆芽和大豆芽上[8-9],或是同一个豆类不同品种之间的比较[10-11],对于不同豆类及其芽苗菜的功能性成分报道较少。本研究选择了黑大豆、红小豆和豌豆,研究其种子及萌发后形成芽苗菜的生长特性、营养品质、功能性成分及抗氧化性,旨在为豆类及其芽苗菜的开发利用提供理论依据。
1 材料与方法
1.1 试验材料
黑大豆、豌豆,郑州新农村蔬菜食品有限公司;红小豆白红3号,吉林省白城农科院。
1.2 仪器与设备
RADWAG万分之一天平,波兰瑞德威公司;PRX-450C人工气候箱、冷冻干燥机,上海比朗仪器制造有限公司;Centrifuge 5810 R冷冻离心机,德国Eppendorf公司;UV-1600PC紫外分光光度计,上海美谱达仪器有限公司;Multiskan GO全波长酶标仪,美国Thermo 公司;EYG-1000W超声清洗机,北京宇翔超声工业设备有限公司;鼓风干燥箱,上海一恒科学仪器有限公司;KDY-9810凯氏定氮仪,北京翌康百方科技有限公司。
1.3 试验方法
1.3.1 芽苗菜的培育
挑选大小均匀、整齐一致、成熟饱满的黑大豆、豌豆和红小豆种子各300粒,浸种24 h,待种子充分吸水膨胀以后,均匀播种于带有湿润发芽纸的育苗盘中,并置于温度(25±2)℃、相对湿度80%的人工气候培养箱中[12],黑暗条件下催芽,待苗长长到2 cm左右时开始见光,每天光照12 h,浇水3~4次,生长第6天进行取样,将鲜样用液氮速冻置于-40 ℃冰箱待用。部分样品经过冷冻干燥处理后,磨粉过60目筛,用于酚类物质的提取,以测定总酚、总黄酮含量及抗氧化性。
1.3.2 取样与测定
于生长第6天测定3个豆类芽苗菜的生长指标,包括苗长、总质量、可食部分鲜重、可食率和含水量。可溶性糖含量的测定采用苯酚法[13],以蔗糖作为标样;粗蛋白含量的测定采用凯氏定氮法[14],每个样品重复3次。
采用超声波辅助法[15]提取3个豆类种子及其芽苗菜的酚类物质,总酚含量的测定采用福林-酚试剂法[16],以没食子酸为标样建立标准曲线,结果以每克干燥样品中没食子酸的质量(mg/g DW)表示;总黄酮含量的测定采用氯化铝的方法[17],以芦丁为标样建立标准曲线,结果以每克干燥样品中的芦丁质量(mg/g DW)表示。每个样品重复3次。
DPPH自由基清除力测定采用YANG等[18]的方法;ABTS自由基清除力的测定参照WANG等[19]的方法,以水溶性维生素E做标准样品,结果以与每克干燥样品相当的水溶性维生素E物质的量(μmol/g DW)表示;FRAP亚铁还原力按照MÜLLER等[20]的方法测定,用FeSO4做标样,结果以与每克干燥样品相当的Fe2+物质的量(mmol/g DW)表示。每个样品重复3次。
1.3.4 数据分析
运用Excel 2013整理各指标的测定结果,采用SPSS 20.0的Duncan′s新复极差法进行差异显著性分析(P<0.05),皮尔森相关性检测来分析各变量之间的相关性,每个处理重复3次,图表中各结果用平均值±标准差表示。
2 结果与分析
2.1 不同豆类种子营养成分、功能性成分及抗氧化性
对黑大豆、红小豆和豌豆分别进行了营养成分、功能性成分及抗氧化性的测定,结果如表1所示。研究发现,3个豆类种子的可溶性糖含量在2.81~5.80 mg/g范围内,其中黑大豆的可溶性糖含量最高,红小豆的最低。粗蛋白含量范围为0.23~0.40 g/g,黑大豆粗蛋白含量最高,与红小豆、豌豆差异显著。总酚含量为2.38~6.48 mg/g DW,各豆类种子的总酚含量差异显著。总黄酮含量在1.80~8.17 mg/g DW范围内,含量最高的是黑大豆,最低的是豌豆。在抗氧化性方面,DPPH自由基清除力最强的是黑大豆,达到17.4 μmol/g DW,显著高于其他2个豆类。ABTS自由基清除力的为45.08~115.94 μmol/g DW,其中黑大豆的ABTS自由基清除力最强。FRAP亚铁还原力的在15.30~128.61 mmol/g DW,还原力最强的是黑大豆。综上所述,黑大豆无论是在营养成分,还是功能性成分、抗氧化性方面均显著高于红小豆和豌豆,是良好的膳食补充剂,有开发成益于人类健康的功能性食品的潜力。
表1 不同豆类种子营养成分、功能性成分及抗氧化性
Table 1 Nutritional quality, functional components and antioxidant properties of different legume seeds
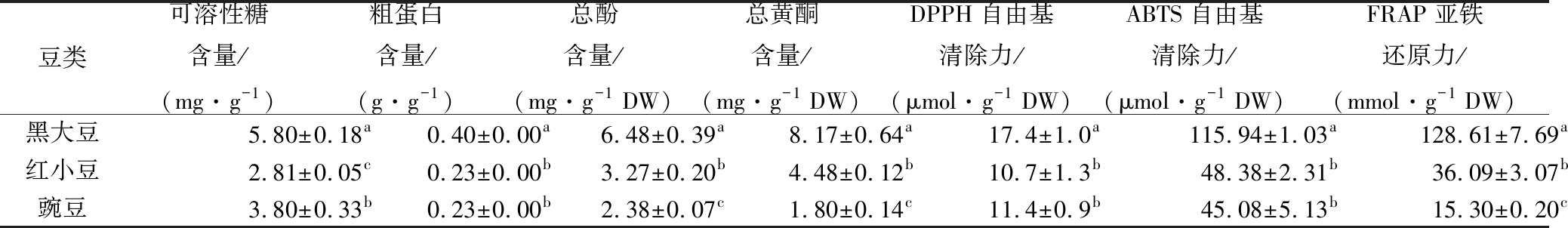
豆类可溶性糖含量/(mg·g-1)粗蛋白含量/(g·g-1)总酚含量/(mg·g-1 DW)总黄酮含量/(mg·g-1 DW)DPPH自由基清除力/(μmol·g-1 DW)ABTS自由基清除力/(μmol·g-1 DW)FRAP亚铁还原力/(mmol·g-1 DW)黑大豆5.80±0.18a0.40±0.00a6.48±0.39a8.17±0.64a17.4±1.0a115.94±1.03a128.61±7.69a红小豆2.81±0.05c0.23±0.00b3.27±0.20b4.48±0.12b10.7±1.3b 48.38±2.31b 36.09±3.07b豌豆3.80±0.33b0.23±0.00b2.38±0.07c1.80±0.14c11.4±0.9b 45.08±5.13b 15.30±0.20c
注:不同小写字母表示同一列值间差异显著(P<0.05)(下同)
2.2 不同豆类芽苗菜生长特性
于黑大豆苗、红小豆苗、豌豆苗生长第6天取样,分别测定其生长指标,结果见表2所示。由表2可知,3个豆类芽苗菜总质量、可食部分鲜重和可食率均差异显著,其中总质量为6.16~12.83 g,豌豆苗最高,红小豆苗最轻。3个豆类芽苗菜可食部分鲜重和干重的变化范围分别为2.45~5.87、0.20~0.68 g,黑豆苗最重,红小豆苗最轻;可食率在32.11%~71.03%,其中最高的是黑豆苗,最低的是豌豆苗。此外,豌豆苗的苗长和含水量在3个芽苗菜中均是最高的,黑豆苗是最低的,并且与其他两个芽苗菜差异显著。
表2 不同豆类芽苗菜生长特性
Table 2 The growth characteristics of different legume sprouts

芽苗菜总质量(10株)/g可食部分鲜重(10株)/g可食部分干重(10株)/g 可食率/%苗长/cm含水量/%黑大豆苗 8.27±0.19b5.87±0.19a0.68±0.12a71.03±0.76a14.32±0.24b88.34±2.33b红小豆苗 6.16±0.67c2.45±0.28c0.20±0.04b39.99±4.39b14.97±0.52b91.97±0.73a豌豆苗12.83±0.83a4.12±0.26b0.25±0.01b32.11±0.69c16.02±0.43a93.82±0.18a
2.3 不同豆类芽苗菜营养成分、功能性成分及抗氧化性
3个豆类芽苗菜营养成分、功能性成分及抗氧化性测定结果见表3。由表3可知,3个豆类芽苗菜的可溶性糖含量为0.34~0.75 mg/g,各芽苗菜可溶性糖含量差异显著,其中含量最高的是豌豆苗。粗蛋白含量在0.40~0.53 g/g DW之间,无显著性差异。3个豆类芽苗菜中,黑豆苗的总酚含量最高,达到4.28 mg/g DW,最低的为豌豆苗,为3.00 mg/g DW。总黄酮含量最高的是豌豆苗,为7.09 mg/g DW,最低的为红小豆苗。DPPH自由基清除力最高的是黑大豆苗,但是与豌豆苗的清除力没有显著性差异,最低的为红小豆苗。ABTS自由基清除力最强的也是黑大豆苗,达到110.39 μmol/g DW,最低的是豌豆苗为70.52 μmol/g DW。豆类芽苗菜的FRAP亚铁还原力变化范围为57.92~75.52 mmol/g DW,黑大豆苗的还原力最强,其次是豌豆苗,红小豆苗的最弱。
表3 不同豆类芽苗菜营养成分、功能性成分及抗氧化性
Table 3 Nutritional quality, functional components and antioxidant properties of different legume sprouts
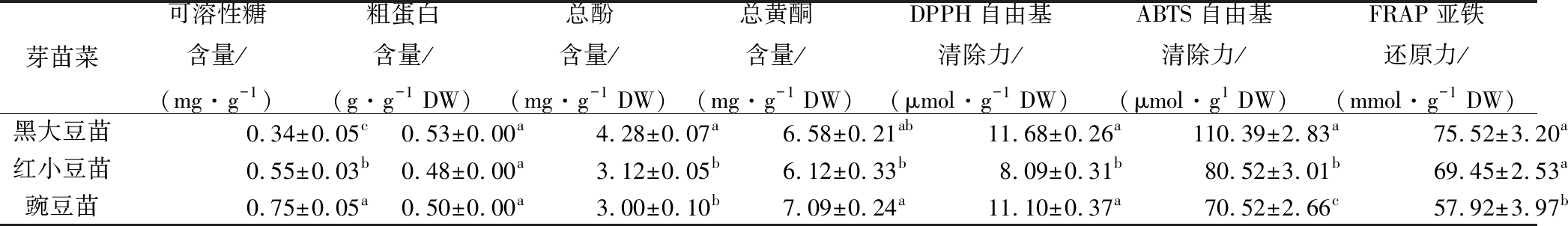
芽苗菜可溶性糖含量/(mg·g-1)粗蛋白含量/(g·g-1 DW)总酚含量/(mg·g-1 DW)总黄酮含量/(mg·g-1 DW)DPPH自由基清除力/(μmol·g-1 DW)ABTS自由基清除力/(μmol·g1 DW)FRAP亚铁还原力/(mmol·g-1 DW)黑大豆苗0.34±0.05c0.53±0.00a4.28±0.07a6.58±0.21ab11.68±0.26a110.39±2.83a75.52±3.20a红小豆苗0.55±0.03b0.48±0.00a3.12±0.05b6.12±0.33b 8.09±0.31b80.52±3.01b69.45±2.53a豌豆苗0.75±0.05a0.50±0.00a3.00±0.10b7.09±0.24a11.10±0.37a70.52±2.66c57.92±3.97b
2.4 豆类种子及其芽苗菜营养成分、功能性成分及抗氧化性比较
黑大豆、红小豆、豌豆10粒种子的质量分别为1.10、1.06、2.48 g,由表2可知,萌发以后3个豆类芽苗菜的可食部分鲜重比其种子质量提高了5.35、2.31和1.66倍,3个豆类种子质量比其芽苗菜的可食部分干重分别增长了1.61、5.36、9.75倍。在此基础上,对豆类种子及其萌发以后形成的芽苗菜进行了营养成分、功能性成分及抗氧化性的测定,结果见图1。从图1-A可知,3个豆类种子中含有丰富的可溶性糖,但其萌发以后,显著降低了可溶性糖的含量,黑大豆、红小豆和豌豆可溶性糖含量分别是其芽苗菜含量的16.89、5.07、5.11倍。图1-B表示的是豆类种子及其芽苗菜的粗蛋白含量,如图所示,相对于种子而言,萌发显著提高了粗蛋白含量,黑大豆苗、红小豆苗和豌豆苗的粗蛋白含量分别提高了32.77%、109.63%和118.36%。这可能是由于发芽开始需要消耗部分蛋白质,随着发芽时间的延长,豆中的总糖、脂肪等成分在发芽过程中不断消耗,使得最终豆苗中蛋白质的含量增加[10]。
图2-A显示了豆类种子及其芽苗菜总酚含量的变化。由图2-A可知,黑大豆种子在萌发以后,其总酚含量显著降低了51.56%;豌豆芽苗菜较豌豆种子而言其总酚含量显著提高了26.07%;而红小豆种子和苗的总酚含量没有显著性变化。豆类种子及其芽苗菜总黄酮含量见图2-B,如图2-B所示,黑大豆萌发以后总黄酮含量降低了24.14%,而红小豆和豌豆萌发以后总黄酮含量分别提高了36.66%和294.30%。
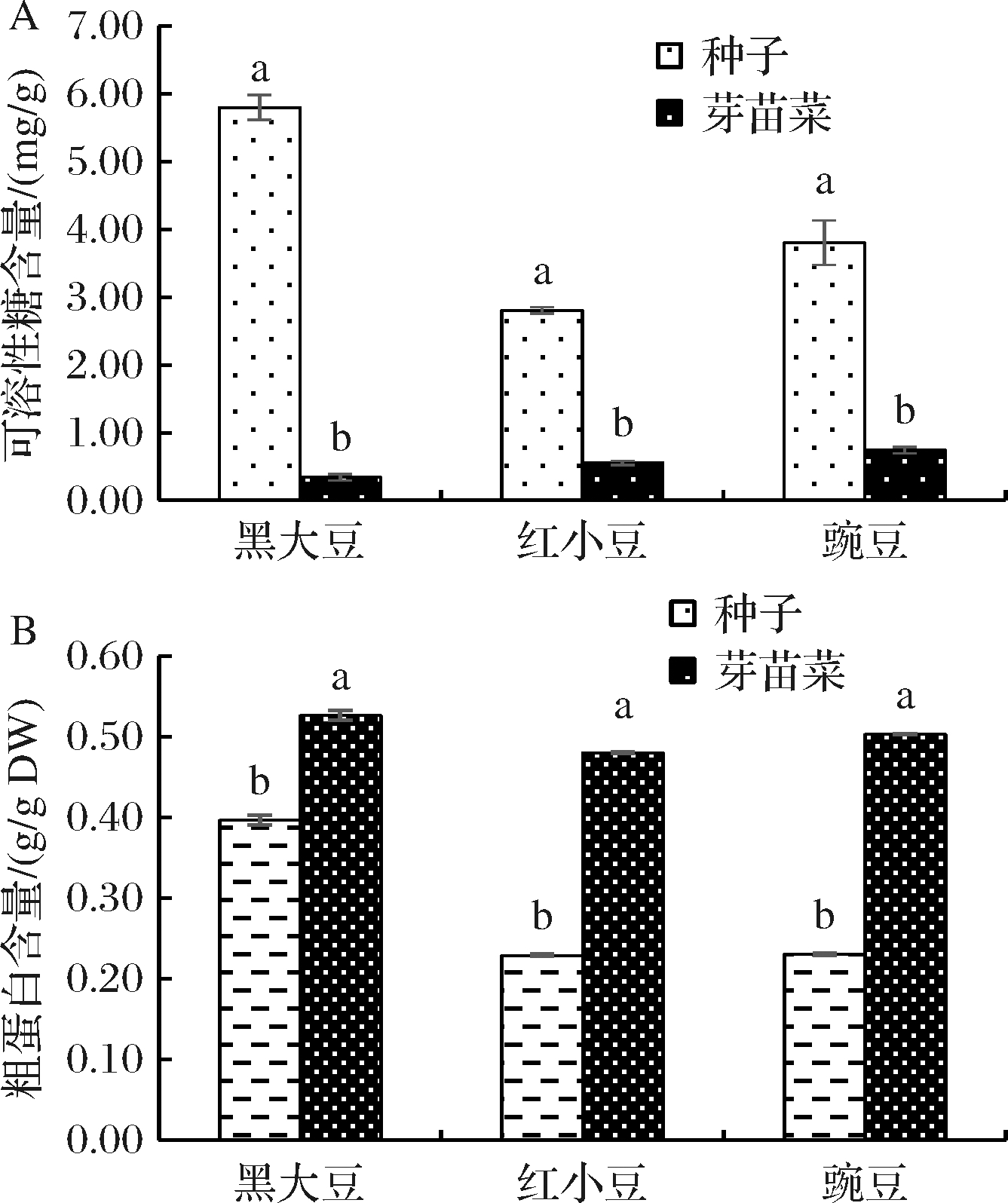
A-可溶性糖含量;B-粗蛋白含量
图1 豆类种子及其芽苗菜营养品质
Fig.1 Nutritional quality in seeds and sprouts of legume
注:不同小写字母表示差异显著(P<0.05)(下同)
图2-C所示的是豆类种子及其芽苗菜的DPPH自由基清除力。研究发现,黑大豆和红小豆萌发以后DPPH自由基清除力分别降低了48.54%和32.02%,豌豆和豌豆芽苗菜DPPH自由基清除力无显著性差异。3个豆类种子及其芽苗菜的ABTS自由基清除力见图2-D,结果发现,黑大豆萌发后,ABTS自由基清除力降低了5.02%,而红小豆和豌豆萌发后的ABTS自由基清除力分别增加了66.43%和56.42%。3种豆类种子及其芽苗菜FRAP亚铁还原力如图2-E所示。由图2-E可知,黑大豆苗的FRAP亚铁还原力显著低于其种子的,降低了77.34%;红小豆和豌豆萌发后,其FRAP亚铁还原力显著提高,分别提高了92.43%和278.58%。综上所述,与种子相比,苗中的酚类含量更高,这归因于内源酶的活化和种子在萌发期间复杂的生化代谢,包括酚类物质的从头合成和转化[17, 21],而抗氧化性增强与抗氧化剂化合物(多酚、花青素等)含量的增加有关[22]。
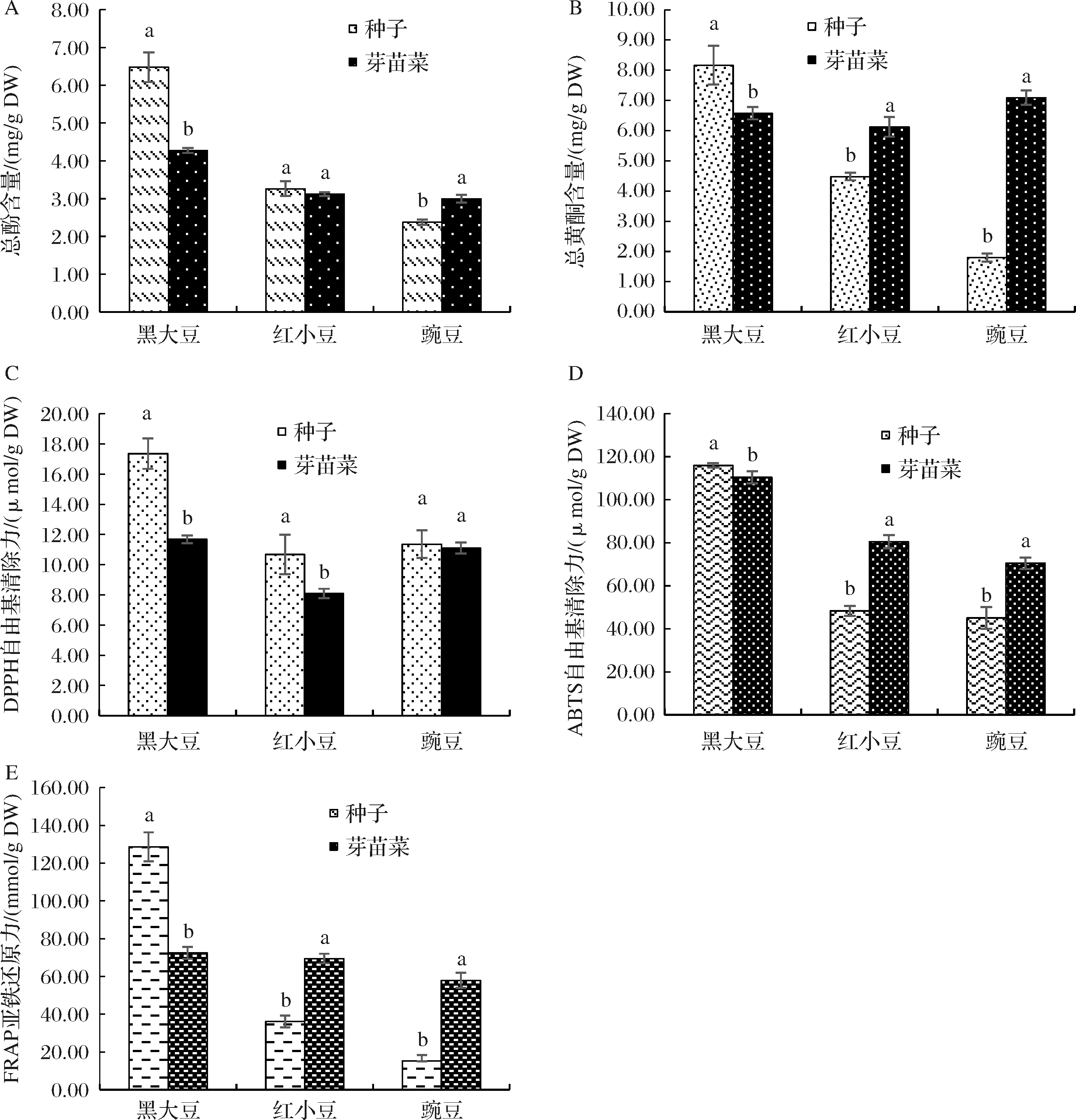
A-总酚含量;B-总黄酮含量;C-DPPH自由基清除力;D-ABTS自由基清除力;E-FRAP亚铁还原力
图2 豆类及其芽苗菜酚类含量及抗氧化性
Fig.2 Total phenolic, flavonoids content and antioxidant aetivities in seeds and sprouts of legume
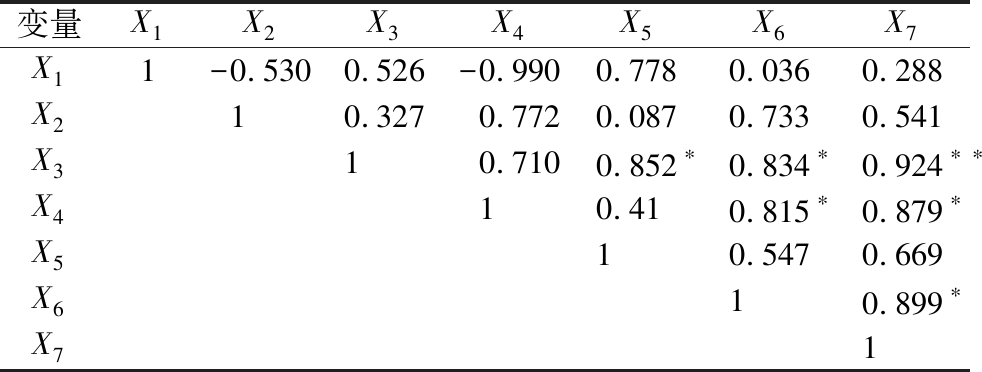
2.5 相关性分析
对豆类种子及其芽苗菜的可溶性糖含量、粗蛋白含量、总酚含量、总黄酮含量、DPPH自由基清除力、ABTS自由基清除力和FRAP亚铁还原力进行了相关性分析,结果见表4所示。从表4可知,总酚含量与DPPH自由基清除力(r=0.852,P<0.01)、ABTS自由基清除力(r=0.834,P<0.01)和FRAP亚铁还原力(r=0.924,P<0.01)之间呈显著正相关性;总黄酮含量与ABTS自由基清除力(r=0.815,P<0.01)和FRAP亚铁还原力(r=0.879,P<0.01)之间存在显著性正相关;此外,ABTS自由基清除力与FRAP亚铁还原力(r=0.899,P<0.01)之间呈显著正相关。因此,酚类物质是天然的抗氧化剂。
表4 相关性分析
Table 4 Correlation analysis
变量X1X2X3X4X5X6X7X11-0.5300.526-0.9900.7780.0360.288X210.3270.7720.0870.7330.541X310.710 0.852∗ 0.834∗0.924∗∗X410.41 0.815∗ 0.879∗X510.547 0.669X610.899∗X71
注:X1:可溶性糖含量,mg/g;X2:粗蛋白含量,g/g DW;X3:总酚含量,mg/g DW;X4:总黄酮含量,mg/g DW;X5:DPPH自由基清除力,μmol/g DW;X6:ABTS自由基清除力,μmol/g DW;X7:FRAP亚铁还原力,mmol/g DW;*和**分别表示5%和1%水平上的显著性差异
3 讨论
3.1 豆类种子的营养品质、功能性成分和抗氧化性
豆类是优质蛋白、膳食纤维等的重要来源,在世界各地的传统饮食中占据着重要的地位[23]。研究发现,黑大豆的蛋白质含量高达45%~55%,其优质蛋白大约比大豆高出1/4,本研究中黑大豆的粗蛋白含量是显著高于豌豆和红小豆的。糖类可以减少蛋白质的消耗,机能需要产生热源时若糖摄取量充足可以减少蛋白质的消耗,利于蛋白质发挥更重要的功能[24]。
豆类中含有的酚类化合物,被认为是天然的抗氧化剂[25-26],可以防止动脉硬化,降低患冠心病、糖尿病和肥胖的风险[27]。研究发现,黑大豆中含有花青素,主要成分是飞燕草素-3-葡萄糖苷和矢车菊素-3-葡萄糖苷等,具有清除自由基、螯合金属离子的作用[28];红小豆中的总黄酮提取物主要有槲皮素、杨梅素、儿茶素及其糖苷结合物等,具有较强的抗氧化作用[29]。本研究中除了DPPH自由基清除力以外,3种豆类种子的酚类含量和抗氧化性大小排序均为黑大豆>红小豆>豌豆,这与BAI等[30]和任顺成等[31]的研究结果一致。深色种皮的种子因富含花青素而具有较强的抗氧化性,更有利于抵抗与慢性疾病有关的氧化应激反应,是潜在的健康食品[32-33]。本研究采用体外抗氧化评价方法,反映豆类对于各种氧化物的直接清除力,在后续试验中将结合细胞培养技术,进一步研究豆类酚类物质在细胞水平上的抗氧化性[34]。综上所述,3个豆类种子的营养价值丰富、酚类含量较高且具有较强的抗氧化性,其中黑大豆无论是在营养品质还是功能性成分方面,都显著优于红小豆和豌豆,具有开发成功能性保健品的潜力。
3.2 豆类芽苗菜生长特性、营养品质及功能性成分
豆类种子萌发形成的芽苗菜营养价值丰富,是蔬菜供应淡季的重要蔬菜来源[35]。本研究中,3种豆类芽苗菜生长特性差异显著:由于黑大豆苗是子叶出土型,故其可食部分鲜重最重,可食率也最高;豌豆苗的种子百粒重较大,同时收获期的苗长高于其他2个芽苗菜,因此其总质量是最高的。3种豆类芽苗菜的生长特性均良好。
豆类种子萌发后发生生理代谢变化,其蛋白质、碳水化合物、脂肪等营养物质会分解成小分子化合物,同时能积累生物活性物质,如酚类物质、维生素、γ-氨基丁酸等[36]。本研究结果显示,3个芽苗菜的可溶性糖含量以豌豆苗最高,粗蛋白含量最高的是黑大豆,但与其他2个芽苗菜没有显著性差异。KHANG等[37]对萌发5 d后的黑大豆苗、豌豆苗和红小豆苗的总酚含量、DPPH自由基清除力进行研究,发现其排序为豌豆苗>红小豆苗>黑大豆苗,而本研究中黑大豆苗的总酚含量及自由基清除力、亚铁还原力均高于红小豆苗和豌豆苗,这可能是因为试验中所用黑大豆种子含有丰富的酚类物质,萌发后转化的酚类含量也较多。在发芽的早期阶段,碳水化合物和蛋白质被降解,伴随着单糖和游离氨基酸的增加,因此,与细胞壁成分结合的酚类物质也被释放[38]。随着发芽时间的增加,新的植物细胞增殖,形成新的细胞壁,合成的可溶性酚类物质可以分泌到细胞壁中形成新的结合酚类物质,从而总的酚类含量增加[34]。此外,芽苗菜酚类化合物的含量及成分是由许多因素造成的,如生长的气候条件、农业环境、芽苗菜贮藏条件、成熟度和品种等[39]。因此,研究不同品种豆类的营养品质及生物活性,针对其特性进行相应的加工,可满足不断扩大的市场需求。
3.3 豆类种子及其芽苗菜营养品质及功能性成分的比较
豆类发芽过程中由于呼吸作用的增强,脂类、碳水化合物等会大量降解,蛋白酶被激活而将贮藏蛋白分解成供胚发育的氨基酸,促进游离氨基酸的增加,氨基酸转运到胚的生长部位,以不同方式结合起来,形成各种性质的蛋白质,从而使蛋白质的含量增加[40]。本研究结果显示,与未萌发的种子相比,萌发显著提高了3个豆类的粗蛋白含量,降低了其可溶性糖含量,这与其他学者关于大豆、山毛豆和绿豆[37]萌发以后营养品质的研究结果一致。
种子萌发过程中,随着新陈代谢的增强,内源酶被激活,酶的种类和数量会逐渐增加,苯丙氨酸裂解酶就是其中之一,它是合成酚类化合物的关键酶[41],因此,萌发可显著提高植物酚类含量及其相关抗氧化性。本研究中,红小豆和豌豆芽苗菜的总黄酮含量、ABTS自由基清除力和FRAP亚铁还原力较其未萌发种子均有显著性提高,这与前人关于豇豆、刀豆、扁豆、山黧豆[42]、鹰嘴豆[43]、绿豆、萝卜、西兰花和向日葵等[17]的研究结果相一致。L PEZ-AMOR
PEZ-AMOR S等[44]研究发现小扁豆萌发以后的酚类含量和抗氧化性显著下降,这与本文中关于黑大豆萌发以后功能性成分及抗氧化的研究结果一致,这可能是由于品种的基因型差异及种植地区的气候条件、栽培管理措施等造成的,有待进一步研究。此外,研究发现酚类物质含量与抗氧化性之间存在着显著的正相关性,这与其他学者在小扁豆[45]、大豆和绿豆[35]等方面的研究结果相一致。今后可从代谢组的角度,进一步研究豆类及其芽苗菜的具体酚类物质及其优势酚类单体,开发其内在的潜力。
S等[44]研究发现小扁豆萌发以后的酚类含量和抗氧化性显著下降,这与本文中关于黑大豆萌发以后功能性成分及抗氧化的研究结果一致,这可能是由于品种的基因型差异及种植地区的气候条件、栽培管理措施等造成的,有待进一步研究。此外,研究发现酚类物质含量与抗氧化性之间存在着显著的正相关性,这与其他学者在小扁豆[45]、大豆和绿豆[35]等方面的研究结果相一致。今后可从代谢组的角度,进一步研究豆类及其芽苗菜的具体酚类物质及其优势酚类单体,开发其内在的潜力。
4 结论
3个豆类中,以黑大豆的营养价值和功能性成分最为丰富。豆类芽苗菜中黑大豆苗具有更丰富的总酚含量及抗氧化能力,而豌豆苗的可溶性糖含量和总黄酮含量较高。萌发降低了黑大豆的总酚、总黄酮含量和抗氧化性,但却显著提高了豌豆和红小豆的酚类含量及其抗氧化能力。因此,黑大豆种子、萌发的豌豆及红小豆是一种珍贵的天然抗氧化资源,冻干的豌豆和红小豆芽苗菜可以作为功能性食品的原料。
[1] 陈振, 康玉凡. 豆类种子及萌发过程中功效性成分研究概述[J]. 中国食物与营养, 2012, 18(10): 27-32.
[2] 李松玉. 食用豆科作物籽粒和芽苗菜营养功能成分的研究[D]. 福州: 福建农林大学, 2012.
[3] 孙平, 于雅婷. 舌尖上的豆类食物[M]. 江苏:江苏科学技术出版社, 2014.
[4] 张姚瑶, 邓源喜, 董晓雪,等. 红豆营养保健价值及在饮料工业中的应用进展[J]. 安徽农学通报, 2017, 23(12): 153-156.
[5] HAGENBLAD J, BOSTROM E, NYGARDS L, et al. Genetic diversity in local cultivars of garden pea (Pisum sativum L.) conserved ‘on farm’ and in historical collections[J]. Genetic Resources and Crop Evolution, 2014, 61(2): 413-422.
[6] 康玉凡, 程须珍. 豆类芽菜学[M]. 北京: 高等教育出版社, 2013.
[7] SHI H L, NAM P K, MA Y F. Comprehensive profiling of isoflavones, phytosterols, tocopherols, minerals, crude protein, lipid, and sugar during soybean (Glycine max) germination[J]. Journal of Agricultural and Food Chemistry, 2010, 58(8): 4 970-4 976.
[8] HUANG X Y, CAI W X, XU B J. Kinetic changes of nutrients and antioxidant capacities of germinated soybean (Glycine max L.) and mung bean (Vigna radiata L.) with germination time[J]. Food Chemistry, 2014, 143: 268-276.
[9] 王莘, 王艳梅, 闵卫红,等. 大豆萌发期功能性营养成分测定与分析[J]. 中国粮油学报, 2003, 18(4): 30-32.
[10] 汪洪涛, 陈成, 余芳,等. 3种大豆发芽过程中营养成分变化规律研究[J]. 食品与机械, 2015, 31(1): 30-32; 163.
[11] 吴蓓, 谭兰晶, 曾浩祥,等. 荷兰豆芽苗菜营养成分分析与食用价值评价[J]. 广东农业科学, 2014, 41(15): 25-28.
[12] 王德槟, 张德纯. 芽苗菜及栽培技术[M]. 北京: 中国农业大学出版社, 1998.
[13] 王学奎. 物生物生化实验原理和技术[M]. 北京: 高等教育出版社, 2006.
[14] WOLF B. A comprehensive system of leaf analysis and its use for diagnosing crop nutrient status[J]. Communications in Soil Science and Plant Analysis, 1982, 13(12): 1 035-1 059.
[15] XU B J, CHANG S K C. A comparative study on phenolic profiles and antioxidant activities of legumes as affected by extraction solvents[J]. Journal of Food Science, 2007, 72(2): 159-166.
[16] SINGLETON V L, ORTHOFER R, LAMUELA-RAVENTóS R M. Analysis of total phenols and other oxidation substrates and antioxidants by means of folin-ciocalteu reagent[J]. Methods Enzymol, 1999, 299: 152-178.
[17] PAJAK P, SOCHA R, GALKOWSKA D, et al. Phenolic profile and antioxidant activity in selected seeds and sprouts[J]. Food Chemistry, 2014, 143: 300-306.
[18] YANG M, SHEN Q, LI L Q, et al. Phytochemical profiles, antioxidant activities of functional herb Abrus cantoniensis and Abrus mollis[J]. Food Chemistry, 2015, 177: 304-312.
[19] WANG X, XIE K L, ZHUNG H N, et al. Volatile flavor compounds, total polyphenolic contents and antioxidant activities of a China gingko wine[J]. Food Chemistry, 2015, 182: 41-46.
[20] MÜLLER L, FRÖHLICH K, BÖHM V. Comparative antioxidant activities of carotenoids measured by ferric reducing antioxidant power (FRAP), ABTS bleaching assay (αTEAC), DPPH assay and peroxyl radical scavenging assay[J]. Food Chemistry, 2011, 129(1): 139-148.
[21] TANG D Y, DONG Y M, GUO N, et al. Metabolomic analysis of the polyphenols in germinating mung beans (Vigna radiata) seeds and sprouts[J]. Journal of the Science of Food and Agriculture, 2014, 94: 1 639-1 647.
[22] DUE AS M, HERN
AS M, HERN NDEZ T, ESTERLLA I, et al. Germination as a process to increase the polyphenol content and antioxidant activity of lupin seeds (Lupinus angustifolius L.) [J]. Food Chemistry, 2009, 117: 599-607.
NDEZ T, ESTERLLA I, et al. Germination as a process to increase the polyphenol content and antioxidant activity of lupin seeds (Lupinus angustifolius L.) [J]. Food Chemistry, 2009, 117: 599-607.
[23] LUO J Q, CAI W X, WU T, et al. Phytochemical distribution in hull and cotyledon of adzuki bean (Vigna angularis L.) and mung bean (Vigna radiate L.), and their contribution to antioxidant, anti-inflammatory and anti-diabetic activities[J]. Food Chemistry, 2016, 201: 350-360.
[24] 王慧. 大豆品种及发芽时间对豆芽营养成分与产量的影响[D]. 哈尔滨: 东北农业大学, 2014.
[25] DUE AS M, HERN
AS M, HERN NDEZ T, ESTRELLA I. Phenolic composition of the cotyledon and the seed coat of lentils (Lens culinaris L.) [J]. European Food Research and Technology, 2002, 215(6): 478-483.
NDEZ T, ESTRELLA I. Phenolic composition of the cotyledon and the seed coat of lentils (Lens culinaris L.) [J]. European Food Research and Technology, 2002, 215(6): 478-483.
[26] TROSZY SKA, ESTRELLA I, L
SKA, ESTRELLA I, L PEZ-AM
PEZ-AM RES M L, et al. Antioxidant activity of pea (Pisum sativum L.) seed coat acetone extract[J]. LWT - Food Science and Technology, 2002, 35(2): 158-164.
RES M L, et al. Antioxidant activity of pea (Pisum sativum L.) seed coat acetone extract[J]. LWT - Food Science and Technology, 2002, 35(2): 158-164.
[27] FORMICA J V, REGELSO N W. Review of the biology of quercetin and related bioflavonoids[J]. Food and Chemical Toxicology, 1995, 33(12): 1 061-1 080.
[28] 王鹏, 任顺成, 王国良. 常见食用豆类的营养特点及功能特性[J]. 食品研究与开发, 2009, 30(12): 171-174.
[29] ZHONG Y, PRIEBE M G, VONK R J, et al. The role of colonic microbiota in lactose intolerance[J]. Digestive Diseases and Sciences, 2004, 49(1): 78-83.
[30] BAI Y, XU Y, WANG B Y, et al. Comparison of phenolic compounds, antioxidant and antidiabetic activities between selected edible beans and their different growth periods leaves[J]. Journal of Functional Foods, 2017, 35: 694-702.
[31] 任顺成, 王鹏, 王国良,等. 常见食用豆类中黄酮类化合物含量的测定[J]. 中国粮油学报, 2009, 24(7): 132-137.
[32] GAN R Y, LUI W Y, CORKE H. Sword bean (Canavalia gladiata) as a source of antioxidant phenolics[J]. International Journal of Food Science and Technology, 2016, 51(1): 156-162.
[33] LIN P Y, LAI H M. Bioactive compounds in legumes and their germinated products[J]. Journal of Agricultural and Food Chemistry, 2006, 54(11): 3 807-3 814.
[34] 张昊琳, 邓媛媛, 雷广军,等. 5种食用豆及其配比组合抗氧化性研究[J]. 北京农学院学报, 2014, 29(3): 21-25; 41.
[35] SHOHAG M J I, WEI Y Y, YANG X E. Changes of folate and other potential health-promoting phytochemicals in legume seeds as affected by germination[J]. Journal of Agricultural and Food Chemistry, 2012, 60(36): 9 137-9 143.
[36] GAN R Y, LUI W Y, WU K, et al. Bioactive compounds and bioactivities of germinated edible seeds and sprouts: An updated review[J]. Trends in Food Science and Technology, 2017, 59: 1-14.
[37] KHANG D, DUNG T, ELZAAWEIY A, et al. Phenolic profiles and antioxidant activity of germinated legumes[J]. Foods, 2016, 5(2): 27-36.
[38] LIU B G, GUO X N, ZHU K X, et al. Nutritional evaluation and antioxidant activity of sesame sprouts[J]. Food Chemistry, 2011, 129: 799-803.
[39] CEVALLOS-CASALS B A, CISNEROSL-ZEVALLOS L. Impact of germination on phenolic content and antioxidant activity of 13 edible seed species[J]. Food Chemistry, 2010, 119(4): 1 485-1 490.
[40] 于立梅, 于新, 曾晓房,等. 不同豆类发芽过程中营养成分的变化[J]. 食品与发酵工业, 2010, 36(7): 23-26.
[41] RADGHIR R, LIN Y, SHETTY K. Stimulation of phenolics, antioxidant and antimicrobial activities in dark germinated mung bean sprouts in response to peptide and phytochemical elicitors[J]. Process Biochemistry, 2004, 39(5): 637-646.
[42] AGUIERA Y, DIAZ M F, JIMENEZ T, et al. Changes in nonnutritional factors and antioxidant activity during germination of nonconventional legumes[J]. Journal of Agricultural and Food Chemistry, 2013, 61(34): 8 120-8 125.
[43] WU Z Y, SONG L X, FENG S B, et al. Germination dramatically increases isoflavonoid content and diversity in chickpea (Cicer arietinum L.) seeds[J]. Journal of Agricultural and Food Chemistry, 2012, 60(35): 8 606-8 615.
[44] L PEZ-AMOR
PEZ-AMOR S M L, HERN
S M L, HERN NDEZ T, ESTRELLA I. Effect of germination on legume phenolic compounds and their antioxidant activity[J]. Journal of Food Composition and Analysis, 2006, 19: 277-283.
NDEZ T, ESTRELLA I. Effect of germination on legume phenolic compounds and their antioxidant activity[J]. Journal of Food Composition and Analysis, 2006, 19: 277-283.
[45] ZHANG B, DENG Z Y, RAMDATH D D, et al. Phenolic profiles of 20 Canadian lentil cultivars and their contribution to antioxidant activity and inhibitory effects on α-glucosidase and pancreatic lipase[J]. Food Chemistry, 2015, 172: 862-872.