随着人们对食品安全的重视,防腐剂的安全性越来越受到人们关注。生物防腐剂为来源于动物、植物、微生物等生物的一类防腐剂,因具有较化学防腐剂更高的安全性而受到人们青睐。其中,微生物源防腐剂因生产周期短、发酵成本低等原因成为目前生物防腐剂开发的重点。微生物抗菌肽是由微生物如乳酸菌、芽孢杆菌、链霉菌等代谢产生的一种具有抑菌活性的小分子肽[1],目前已经商品化生产且得以广泛应用的抗菌肽为乳酸链球菌素。然而乳酸链球菌素在使用中存在一定的局限性,如仅对革兰氏阳性细菌抑制效果好,对革兰氏阴性菌却难以抑制。因此有必要寻求广谱、高效抑菌的抗菌肽以减少防腐剂的使用种类。本实验室前期从土壤中筛选到1株能够高产抗菌肽brevilaterin的侧孢短芽孢杆菌(Brevibacillus laterosporus)S62-9[2],前期研究发现brevilaterin具有抑菌谱广、抑菌活性高、酸热稳定性好等优点,在食品防腐中具有较高的应用潜力[3]。但brevilaterin存在于成分复杂的微生物发酵液中,需要提取纯化才能进一步开发应用。因此,本研究拟开发brevilaterin绿色高效提取技术,以期为brevilaterin的工业化生产提供技术支持。
近年来,大孔树脂吸附技术因产物提取效率高、溶剂损耗小、树脂再生处理方便等优点被广泛用于天然产物的提取,如从蜂蜜中提取黄酮、甜叶菊中提取糖类、霉菌中提取生物碱等[4-7]。本研究采用大孔树脂提取侧孢短芽孢杆菌发酵液中的抗菌肽brevilaterin,首先以树脂对brevilaterin的吸附解吸附能力为评价指标,从8种大孔树脂中筛选了一种吸附效率好、解吸附率高、回收效果好的树脂,然后优化了其吸附-解吸附的工艺条件,最后进行了吸附机理的探究。本研究为发酵液中抗菌肽的提取提供了技术支持。
1 材料与方法
1.1 材料与试剂
Brevibacillus laterosporus S62-9和Staphylococcus aureus ATCC 25923为河北科技大学食品生物技术与安全实验室保藏[8];HPD722、HPD600、HPD5000树脂,分析纯,北京索莱宝有限公司;NKA-Ⅱ、AB-8、D4020、XAD7HP、XAD1180树脂,分析纯,杭州全丰有限公司。树脂相关参数如表1所示。
表1 大孔吸附树脂性质
Table 1 Properties of macroporous resins
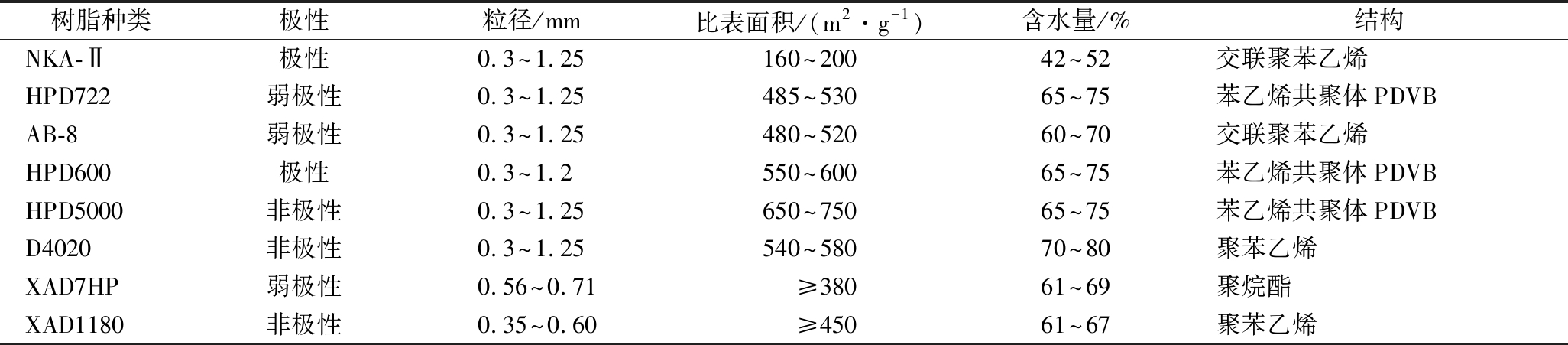
树脂种类极性粒径/mm比表面积/(m2·g-1)含水量/%结构NKA-Ⅱ极性0.3~1.25160~20042~52交联聚苯乙烯HPD722弱极性0.3~1.25485~53065~75苯乙烯共聚体PDVBAB-8弱极性0.3~1.25480~52060~70交联聚苯乙烯HPD600极性0.3~1.2550~60065~75苯乙烯共聚体PDVBHPD5000非极性0.3~1.25650~75065~75苯乙烯共聚体PDVBD4020非极性0.3~1.25540~58070~80聚苯乙烯XAD7HP弱极性0.56~0.71≥38061~69聚烷酯XAD1180非极性0.35~0.60≥45061~67聚苯乙烯
1.2 仪器与设备
UV2300Ⅱ紫外分光光度计,上海天美科学仪器有限公司;3-18K高速冷冻离心机,德国Sigma公司;BIOTECH-5BG-7000 5 L发酵罐,上海保兴生物设备工程有限公司;Scan1700全自动菌落计数仪,法国Interscience公司。
1.3 方法
1.3.1 种子菌悬液及发酵液制备
将B. laterosporus从甘油管中接入营养肉汤培养基中,于32 ℃,240 r/min的转速培养24 h,然后按照体积分数3%的接种量接入营养肉汤培养基制备B. laterosporus种子液。将种子菌悬液按接种量体积分数5%接种到发酵培养基中(液糖6%,鱼蛋白胨1.2%,无水CaCl2 1.38 g/L,ZnCl2 8.16 mg/L,Tween-20 0.2%,pH 7.0),于转速300 r/min、温度32 ℃条件下在5 L发酵罐中发酵24 h。发酵结束后,将发酵液高压灭菌20 min,然后冷冻离心去除菌体,收集上清液置于4 ℃备用。
1.3.2 抗菌肽brevilaterin抑菌活性的测定
将灭菌后冷却至50 ℃左右的营养琼脂培养基倒入添加有S. aureus菌悬液(体积分数3%)的平皿中,摇匀并静置凝固后,将牛津杯置于营养琼脂表面,加入50 μL待测抗菌肽brevilaterin样品,于4 ℃冰箱中预扩散10 h,然后放入37 ℃恒温培养箱中培养12 h,用全自动菌落计数仪测量待测样品的抑菌圈直径。
采用二倍稀释法测定brevilaterin的抑菌效价,参考HÉCHARD等[9]的实验方法进行适当修改。将样品用生理盐水进行二倍稀释,然后用牛津杯法测定抑菌圈大小,将第1个不出现肉眼可见抑菌圈的稀释液的效价定义为1 AU/mL。根据效价计算公式(1)可以得到样品对S. aureus的抑菌效价:
效价/(AU·mL-1)=2n×(1 000 μL÷50 μL)
(1)
式中:n,第1个不出现肉眼可见抑菌圈的稀释液二倍稀释的次数。
1.3.3 大孔树脂筛选与工艺条件优化
大孔树脂均采用无水乙醇浸泡24 h后,用去离子水洗至无乙醇味,除去多余水分备用。向盛有30 mL同一批次brevilaterin发酵液的250 mL锥形瓶中加入不同种类的大孔树脂0.9 g,分别于37 ℃条件下200 r/min振荡90 min。然后将上述吸附有抗菌肽的大孔树脂加入250 mL锥形瓶中,加入50∶1(乙醇体积∶树脂质量)的乙醇溶液(体积分数分别为70%、75%、80%、85%、90%、95%),在37 ℃下200 r/min振荡24 h进行抗菌肽解吸附。然后抽滤收集滤液,旋转蒸发去除乙醇得到brevilaterin浓缩液。测定brevilaterin浓缩液效价,并根据公式(2)和公式(3)计算吸附量与吸附率,筛选吸附效率高的大孔树脂用于后续研究。
以筛选的高吸附率大孔树脂为吸附剂,研究吸附时间(10~180 min)、吸附温度(20~40 ℃)、大孔树脂添加量(10~50 g/L)和发酵液pH值(4~8)对抗菌肽吸附率的影响;基于上述优化条件,考察乙醇浓度(70%~95%)、乙醇体积/树脂质量(10∶1、20∶1、30∶1、50∶1、70∶1)、解吸附温度(20~40 ℃)与时间(20~120 min)对解吸附率的影响,最终综合吸附量、吸附率和回收率3个指标选取最佳提取条件。
根据以下公式计算吸附量Qt、吸附率A、解吸附率D与回收率R。
(2)
(3)
(4)
(5)
式中:C0,brevilaterin发酵液初始效价,AU/mL;Ce,吸附平衡后上清液的效价,AU/mL;Vi,加入brevilaterin发酵液的体积,mL;m,加入大孔树脂的干重,g;Cd,树脂解吸附后旋蒸液的效价,AU/mL;Vd,大孔树脂解吸附后旋蒸液的体积,mL。
1.3.4 吸附等温线与吸附热力学
在25、30、35 ℃温度下,分别用大孔树脂XAD-7HP(30 g/L)吸附效价为4 200、4 000、3 600、3 300、3 000 AU/mL的brevilaterin溶液,200 r/min振荡吸附3 h,收集上清液并测定效价,计算吸附量Qe和平衡浓度。以吸附量Qe对抗菌肽吸附平衡浓度作图,得到等温吸附曲线,采用Langmuir模型与Freundlich模型拟合。吸附等温线与热力学方程如公式(6)~(11)所示:
(6)
(7)
(8)
(9)
ΔG=-nRT
(10)
(11)
式中:Qe,单位质量吸附剂对吸附物的吸附量,AU/g;Qmax,单位质量吸附剂对吸附物的最大吸附量,AU/g;RL,无量纲因子;KL,Langmuir方程的吸附常数(mL/AU,与结合位点、亲和力有关);Ce,吸附后上清中被吸附物的浓度,AU/mL;C0,初始吸附物浓度,AU/mL;KF、1/n,Freundlich方程的吸附常数;K,Langmuir方程的吸附平衡常数,KL;R与T分别为理想气体常数,8.314 J/(mol·K)和绝对温度(K);A、ΔH、ΔS与ΔG分别为常数、焓变(kJ/mol)、吉布斯自由能(kJ/mol)与熵变(J/mol·k)。
1.3.5 吸附动力学
在35 ℃下,采用大孔树脂XAD-7HP(30 g/L)吸附效价分别为2 200、2 400、2 600、2 800、3 000 AU/mL的brevilaterin溶液,吸附不同时间(2、4、6、8、10、15、20、25、30、40、50、60、90、120、180 min)后,收集上清液测定效价。对拟一级动力学方程、拟二级动力学方程、Elovich方程和粒子扩散方程进行非线性拟合[10-11]。
吸附动力学方程如公式(12)~(15)所示:
ln(Qe-Qt )=lnQe-K1t
(12)
(13)
(14)
(15)
式中:Qt,t时刻吸附剂对吸附物的吸附量,AU/g;K1,吸附速率常数,min-1;K2,吸附速率常数,min-1;a,初始吸附速率[AU/(g·min)];b,解吸常数,g/AU;C,截距,AU/g;Kt,颗粒内扩散速率常数,[AU/(g·min0.5)]。
2 结果与分析
2.1 大孔树脂的筛选
大孔树脂的结构与特性(如孔径、表面积)是决定树脂吸附能力的关键因素[12-13],因此选取8种不同树脂考察对抗菌肽brevilaterin的吸附解吸附能力,结果如图1所示。

A-大孔树脂种类对brevilaterin吸附率的影响;B-乙醇浓度对大孔树脂提取brevilaterin解吸附率的影响;C-解吸附时间对大孔树脂提取brevilaterin回收率的影响
图1 大孔树脂种类对brevilaterin提取率的影响
Fig.1 Effect of microporous resins on the extraction rate of brevilaterin
从图1-A中可知,树脂D4020的吸附率最高,达到了95.64%;其次是HPD722、XAD-7HP和XAD1180分别是94.43%、94.09%和92.81%;其中吸附率最低的是树脂NKA-Ⅱ为31.79%。由表1可知,NKA-Ⅱ与HPD600均为极性树脂,然而两者吸附能力差异极显著,表明brevilaterin吸附率与大孔树脂极性不相关,推测可能与树脂比表面积有关[14]。
不同树脂对抗菌肽brevilaterin的解吸附能力不同,会影响brevilaterin的回收率,因此进一步通过解吸附率筛选对抗菌肽提取率高的大孔树脂(图1-B)。结果显示乙醇浓度对解吸附率影响较大,乙醇浓度增大反而不利于brevilaterin的解吸附;树脂类型可影响解吸附率,其中D4020树脂解吸附率较低,推测brevilaterin与该种树脂结合较强,因此brevilaterin难以解吸附下来[15]。根据回收率选取了在70%乙醇浓度下回收率较高的4种树脂HPD722、XAD-7HP、HPD5000和XAD1180进行解吸附时间比较。由图1-C可以看出树脂XAD1180的回收率低于其他树脂,而树脂XAD-7HP(2 h)与HPD5000(2 h)达到了80%以上,再根据树脂的吸附能力,最终选择XAD-7HP大孔树脂进行brevilaterin的提取。
2.2 大孔树脂提取brevilaterin的工艺条件优化
2.2.1 大孔树脂吸附brevilaterin的工艺条件优化
首先考察了大孔树脂XAD-7HP吸附时间对brevilaterin吸附率的影响(图2-A),结果表明初始10 min吸附较快,吸附率达到40.5%;随着吸附量的增加,吸附速率减缓,在90 min时吸附率达到94%,之后继续延长吸附时间吸附率增加不显著,因此选择树脂吸附时间为90 min。其次,考察了吸附温度对brevilaterin吸附率的影响(图2-B),发现温度对吸附率影响显著,升高温度有利于brevilaterin的提取。吸附温度增加到35 ℃时,吸附率达到95%,之后增加温度对吸附率提高不显著。综合考虑提取效率与能耗,选取35 ℃进行后续研究。然后,考察了大孔树脂添加量对brevilaterin吸附率的影响(图2-C),结果显示大孔树脂的最佳添加量为30 g/L,此时brevilaterin的吸附率达到了94.4%,吸附量为43 394 AU/g。最后,研究了发酵液pH对brevilaterin吸附率的影响(图2-D),结果发现发酵液pH值对brevilaterin吸附率无影响,无需调节发酵液pH值即可提取brevilaterin。

A-吸附时间对吸附率的影响;B-吸附温度对吸附率的影响;C-树脂添加量对吸附率及吸附量的影响;D-发酵液pH值对吸附率的影响
图2 大孔树脂XAD-7HP吸附抗菌肽brevilaterin工艺优化
Fig.2 Optimization of absorption process of brevilaterin by microporous XAD-7HP
2.2.2 大孔树脂解吸附brevilaterin的工艺条件优化
在上述大孔树脂筛选得到的解吸附工艺条件基础上,进而考察了解吸附温度(图3-A)与乙醇用量(图3-B)对brevilaterin解吸附率的影响,研究发现解吸附效率随温度升高先升高后降低,在25与30 ℃时效率最好,选择室温25 ℃进行brevilaterin解吸附。此外,研究了乙醇用量对brevilaterin解吸附效率的影响,发现乙醇用量对解吸附效率有显著影响,当乙醇与大孔树脂液料比为50∶1(mL∶g)时,解吸附效率最好,因此选取乙醇大孔树脂液料比为50∶1。
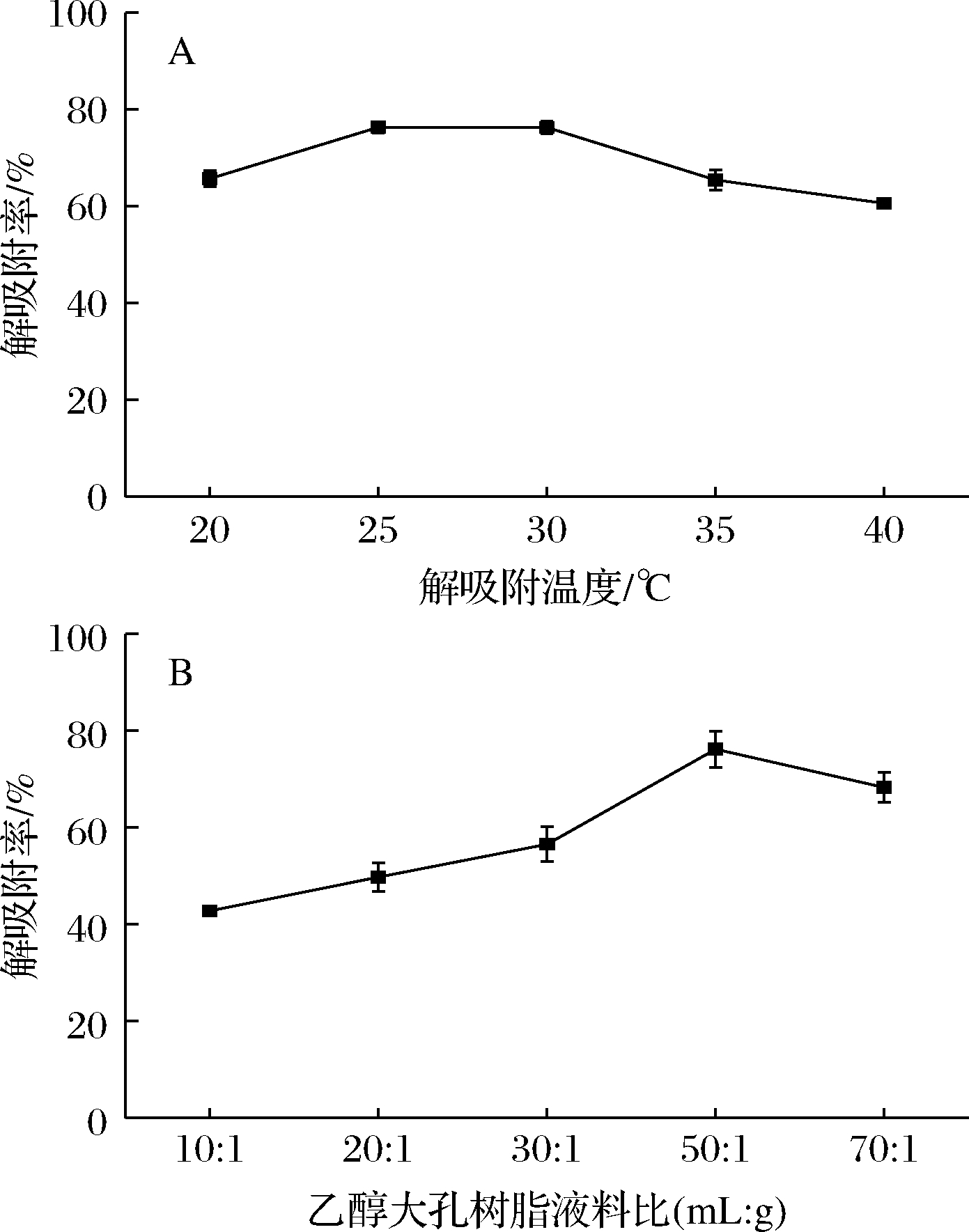
A-解吸附温度对brevilaterin解吸附率的影响;B-乙醇与大孔树脂比例对brevilaterin解吸附率的影响
图3 大孔树脂XAD-7HP解吸附brevilaterin工艺优化
Fig.3 Optimization of desorption of brevilaterin by microporous XAD-7HP
2.3 大孔树脂吸附brevilaterin机理研究
2.3.1 吸附等温线与吸附热力学
采用Langmuir与Freundlich模型对树脂XAD-7HP吸附brevilaterin的实验数据进行拟合,结果如图4所示。从表2可以看出Langmuir与Freundlich模型拟合的R2都大于0.90,表明大孔树脂XAD-7HP对brevilaterin的吸附符合单分子层模型[16]。其次,由Langmuir参数可求出表示吸附剂与被吸附物质之间亲和性的无量纲因子RL:当0<RL<1时有利于吸附;当RL>1时不利于吸附;当RL=1时是线性吸附;当RL=0时是不可逆吸附[17-19]。由图3-C可知,RL值小于0.05,且随着C0的增加逐渐趋近于0,表明brevilaterin有利于大孔树脂吸附[20]。此外,实验数据与Freundlich方程的拟合度也较好(R2>0.92),方程中1/n表示吸附能力:1/n在0.1~0.5范围时吸附容易发生,1/n>1时表示吸附发生困难[21]。Freundlich方程的1/n在0.1~0.5之间,说明XAD-7HP对brevilaterin的吸附易发生。
热力学参数可以提供吸附过程中能量变化信息[22],根据公式(9~11)计算不同温度下的ΔH、ΔG与ΔS(表2),结果显示ΔH>0,说明树脂XAD-7HP吸附brevilaterin的过程为吸热过程,与吸附工艺条件优化结果提高温度可以增加吸附率结果一致。不同温度下ΔG<0,说明吸附过程是自发的。ΔH<TΔS说明吸附是由熵驱动的,ΔS为正值说明固液表面的自由度增加了。
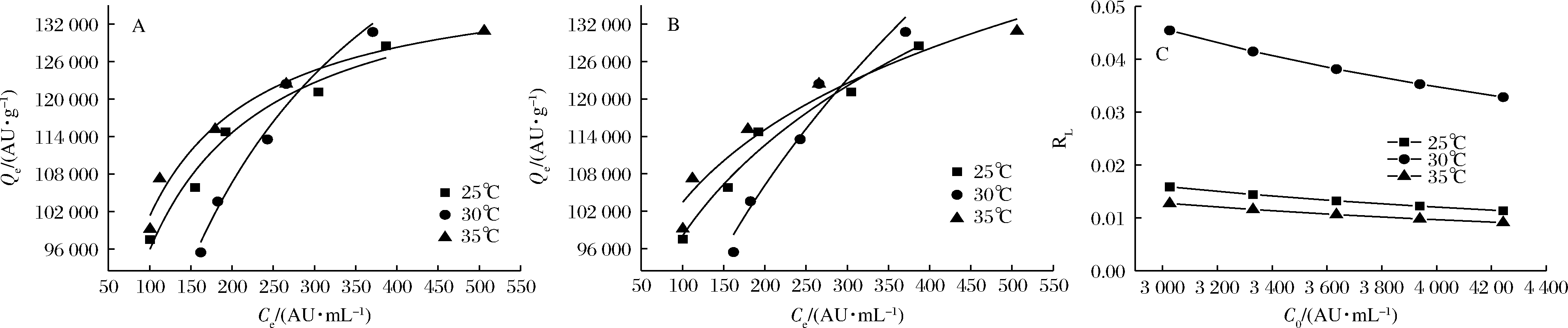
A-Langmuir等温线模型拟合结果;B-Freundlich等温线拟合结果;C-无量纲因子RL随抗菌肽初始浓度变化的曲线
图4 大孔树脂XAD-7HP对brevilaterin的吸附等温线
Fig.4 Adsorption isotherm of brevilaterin by the macroporous resin XAD-7HP
表2 大孔树脂XAD-7HP吸附brevilaterin的热力学参数
Table 2 Thermodynamic parameters of the adsorption of brevilaterin by the macroporous resin XAD-7HP
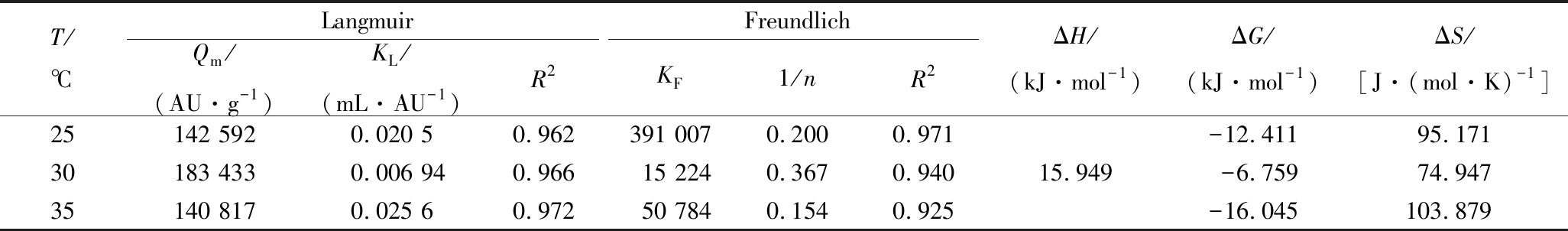
T/℃LangmuirFreundlichQm/(AU·g-1)KL/(mL·AU-1)R2KF1/nR2ΔH/(kJ·mol-1)ΔG/(kJ·mol-1)ΔS/[J·(mol·K)-1]25142 5920.020 50.962391 0070.2000.971-12.41195.17130183 4330.006 940.96615 2240.3670.94015.949-6.75974.94735140 8170.025 60.97250 7840.1540.925-16.045103.879
2.3.2 吸附动力学
吸附动力学研究主要涉及底物在大孔吸附树脂表面吸附过程中的扩散行为模式,研究分别采用拟一级动力学、拟二级动力学、Elovich方程与粒子扩散模型对大孔树脂XAD-7HP吸附brevilaterin的实验数据进行拟合(图5),相关动力学参数如表3所示。由时间吸附曲线(图5-A)可以看出吸附分3个阶段,即0~30 min快速吸附、30~60 min缓慢吸附、60 min后吸附逐渐达到平衡,因此树脂XAD-7HP吸附brevilaterin属于快速吸附[23]。拟一级动力学通常适用于吸附过程的初始阶段,拟二级动力学模型假设限速步骤为化学吸附,并可以预测整个吸附过程的行为[24]。依据表3数据可知(以抗菌肽2 200 AU/mL为准),拟二级动力学R2(0.997)优于拟一级动力学R2(0.946),且拟二级动力学模型Qe计算值为75 208 AU/g与Qe实验值73 157 AU/g接近,表明XAD-7HP吸附brevilaterin符合拟二级动力学[25],主要吸附机制为化学吸附。上述大孔树脂XAD-7HP对brevilaterin的吸附机制与树脂D301对重金属粒子以及XAD-16树脂对黄酮类化合物的吸附机理相似,吸附过程均符合拟二级动力学模型,以化学吸附为主[22,26]。
Elovich方程描述了非均质表面的化学吸附,通常用于证实化学吸附机理[27]。Elovich方程的相关参数如表3所示,该方程的R2为0.92,再次表明化学吸附是主要的吸附机制。粒子扩散方程虽然不能代表整个吸附过程,但可以用来给出一个明确的吸附机制[24]。粒子扩散方程评估膜扩散或内部扩散对扩散过程的控制。根据文献,如果粒子扩散方程图为直线且经过零点,则说明粒子内扩散是控制吸附的重要因素,若方程曲线未经过零点,则说明边界扩散与粒子内扩散是主要的控速步骤[28]。如图5-E所示,拟合为弱线性,因此整个过程分为3个阶段,这表明树脂XAD-7HP吸附抗菌肽可能包含多个过程:第1阶段(0~30 min)属于边界层扩散,第2阶段(30~60 min)描述了吸附过程中颗粒内扩散速率加快的过程,第3阶段(>60 min)属于最终平衡阶段。拟合直线没有经过原点(R2=0.90),说明边界层扩散与颗粒内扩散是主要的控速步骤[29]。
3 结论
通过吸附-解吸附实验从8种大孔树脂中筛选了可高效提取brevilaterin的大孔树脂XAD-7HP,经过pH、温度、乙醇浓度等关键工艺条件优化,brevilaterin的回收率达到82%。吸附等温线方程显示树脂XAD-7HP吸附brevilaterin与Langmuir和Freundlich模型拟合较好,吸附动力学研究显示吸附过程符合拟二级动力学模型,因此推测XAD-7HP对brevilaterin的吸附属于单分子层的化学吸附;Elovich方程拟合结果表明吸附过程主要分为3个阶段:边界层扩散、颗粒内扩散、最终平衡。总之,大孔树脂XAD-7HP可以通过单分子层化学吸附方式提取brevilaterin,该工艺绿色环保、提取效率高,具有较高的工业化生产潜力。
表3 大孔树脂XAD-7HP吸附brevilaterin的动力学参数
Table 3 Dynamic parameters of the adsorption of brevilaterin by macroporous resin XAD-7HP

Brevilaterin/(AU·mL-1)拟一级动力学方程拟二级动力学方程Elovich离子扩散方程Qe/(AU·g-1)k1/min-1R2Qe/(AU·g-1)k2/[g·(AU·min)-1]R2A/[AU·(g·min)-1]B/(g·AU-1)R2C/(AU·g-1)kt/[AU·(g·min0.5)-1]R22 20038 0410.029 40.94675 2081.872×10-60.997124 2111.035×10-40.88134 8653 4880.8272 40061 0230.033 10.97284 7599.441×10-70.99616 5396.106×10-50.92818 6365 7030.8052 60041 9890.025 60.96886 2401.740×10-60.997307 0211.023×10-40.93443 8113 5660.8962 80049 2050.033 10.90292 7131.491×10-60.9921435 9271.150×10-40.94553 5493 1450.8913 00043 4100.015 80.86989 3081.923×10-60.994871 1081.104×10-40.92550 5613 3340.906
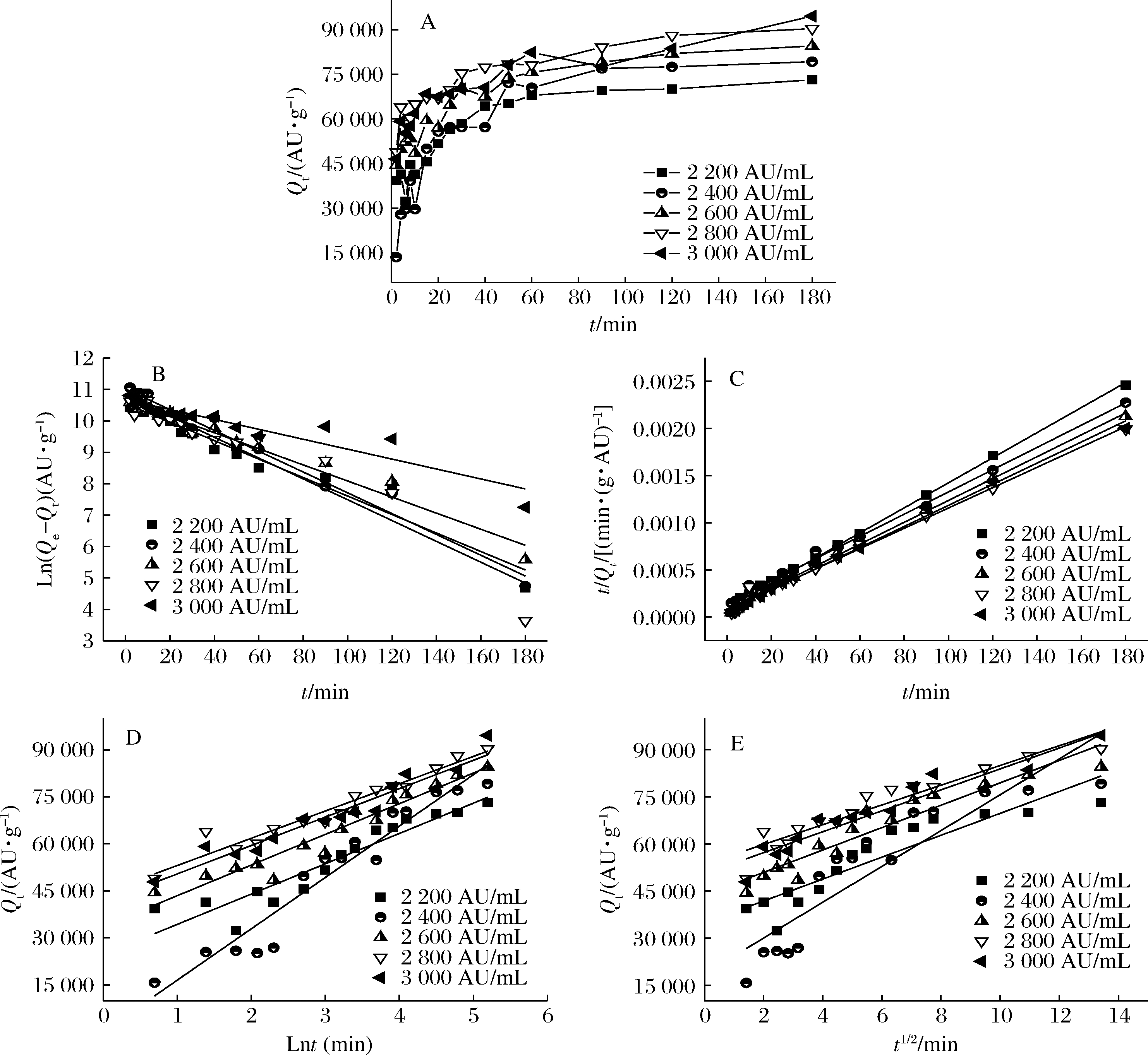
A-动力学时间吸附曲线;B-拟一级动力学拟合结果;C-拟二级动力学拟合结果;D-Elovich方程拟合结果;E-粒子扩散方程拟合结果
图5 大孔树脂XAD-7HP对brevilaterin的吸附动力学
Fig.5 Adsorption kinetics of brevilaterin by the macroporous resin XAD-7HP
[1] 李冠楠, 夏雪娟, 隆耀航, 等. 抗菌肽的研究进展及其应用[J]. 动物营养学报, 2014, 26(1): 17-25.
[2] 剧建格, 于宏伟, 韩军, 等. 广谱高效抑菌物质产生菌的筛选及鉴定[J]. 微生物学通报, 2009, 36(5): 689-693.
[3] 马俊美, 宁亚维, 王志新, 等. 侧孢短芽孢杆菌抗菌肽的结构与性质[J]. 食品与生物技术学报, 2016, 35(6): 629-634.
[4] LV Cheng, YANG Jie, LIU Rui, et al. A comparative study on the adsorption and desorption characteristics of flavonoids from honey by six resins[J]. Food Chemistry, 2018, 268: 424-430.
[5] LIU Yaxian, HUA Xiao, WANG Mingming, et al. Purification of the mother liquor sugar from industrial stevia production through one-step adsorption by non-polar macroporous resin[J]. Food Chemistry, 2019, 274: 337-344.
[6] LIU Changqing, JIAO Ruihua, YAO Lingyun, et al. Adsorption characteristics and preparative separation of chaetominine from Aspergillus fumigatus mycelia by macroporous resin[J]. Journal of Chromatography B, 2016, 1 015-1 016: 135-141.
[7] YANG Huirong, ZONG Xuyan, Cui Chun, et al. Wheat gluten hydrolysates separated by macroporous resins enhance the stress tolerance in brewer’s yeast[J]. Food Chemistry, 2018, 268: 162-170.
[8] 王广贤. 侧孢短芽孢杆菌产抗菌肽发酵条件的优化以及抑菌性质的初步研究[D]. 石家庄: 河北科技大学, 2011.
[9] HECHARD Y, DERIJARD B, LETELLIER F, et al. Characterization and purification of mesentericin Y105, an anti-Listeria bacteriocin from Leuconostoc mesenteroides [J]. Journal of General Microbiology, 1992, 138(12): 2 725-2 731.
[10] AKSAKAL O, UCUN H. Equilibrium, kinetic and thermodynamic studies of the biosorption of textile dye (Reactive Red 195) onto Pinus sylvestris L.[J]. Journal of Hazardous Materials, 2010, 181(1-3): 666-672.
[11] KIM M R, KIM W C, LEE D Y, et al. Recovery of narirutin by adsorption on a non-ionic polar resin from a water-extract of Citrus unshiu peels[J]. Journal of Food Engineering, 2007, 78(1):27-32.
[12] JIA Guantao, LU Xiuyang. Enrichment and purification of madecassoside and asiaticoside from Centella asiatica extracts with macroporous resins[J]. Journal of Chromatography A, 2008, 1 193(1-2): 136-141.
[13] XU Zhaoyi, ZHANG Quanxing, CHEN Jinlong, et al. Adsorption of naphthalene derivatives on hypercrosslinked polymeric adsorbents[J]. Chemosphere, 1999, 38(9): 2 003-2 011.
[14] CHANDRASEKHAR J, MADHUSUDHAN M C, RAGHAVARAO K S M S. Extraction of anthocyanins from red cabbage and purification using adsorption[J]. Food and Bioproducts Processing, 2012, 90(4): 615-623.
[15] LI Bing, WANG Chunlan, CHEN Xiaomei, et al. Highly specific separation for antitumor Spiropreussione A from endophytic fungal [Preussia sp.] fermentation broth by one-step macroporous resins AB-8 treatment[J]. Journal of Chromatography B, 2013, 938: 1-7.
[16] BRUNA F, CELIS R, PAVLOVIC I, et al. Layered double hydroxides as adsorbents and carriers of the herbicide (4-chloro-2-methylphenoxy) acetic acid (MCPA): Systems Mg-Al, Mg-Fe and Mg-Al-Fe[J]. Journal of Hazardous Materials, 2009, 168(2-3): 1 476-1 481.
[17] ZHENG Hong, WANG Yang, ZHENG Yan, et al. Equilibrium, kinetic and thermodynamic studies on the sorption of 4-hydroxyphenol on Cr-bentonite[J]. Chemical Engineering Journal, 2008, 143(1-3): 117-123
[18] SALTALI K, SARI A, AYDIN M. Removal of ammonium ion from aqueous solution by natural Turkish (Y ld
ld zeli) zeolite for environmental quality[J]. Journal of Hazardous Materials, 2007, 141(1): 258-263.
zeli) zeolite for environmental quality[J]. Journal of Hazardous Materials, 2007, 141(1): 258-263.
[19] HO Y S, HUANG C T, HUANG H E. Equilibrium sorption isotherm for metal ions on tree fern[J]. Process Biochemistry, 2002, 37(12):1 421-1 430.
[20] ZHENG Hong, LIU Donghong, ZHENG Yan, et al. Sorption isotherm and kinetic modeling of aniline on Cr-bentonite[J]. Journal of Hazardous Materials, 2009, 167(1-3): 141-147.
[21] GARC A-ZUBIRI I X, GONZ
A-ZUBIRI I X, GONZ LEZ-GAITANO G, ISASI J R. Sorption models in cyclodextrin polymers: Langmuir, Freundlich, and a dual-mode approach[J]. Journal of Colloid and Interface Science, 2009, 337(1): 11-18.
LEZ-GAITANO G, ISASI J R. Sorption models in cyclodextrin polymers: Langmuir, Freundlich, and a dual-mode approach[J]. Journal of Colloid and Interface Science, 2009, 337(1): 11-18.
[22] AN Fuqiang, WU Ruiyan, LI Min, et al. Adsorption of heavy metal ions by iminodiacetic acid functionalized D301 resin: Kinetics, isotherms and thermodynamics[J]. Reactive and Functional Polymers, 2017, 118: 42-50.
[23] LIU Yongfeng, DI Duolong, BAI Qingqing, et al. Preparative separation and purification of rebaudioside a from steviol glycosides using mixed-mode macroporous adsorption resins[J]. Journal of Agricultural and Food Chemistry, 2011, 59(17): 9 629-9 636.
[24] CHANG Xiulian, WANG Dong, CHEN Biyun, et al. Adsorption and desorption properties of macroporous resins for anthocyanins from the calyx extract of roselle (Hibiscus sabdariffa L.)[J]. Journal of Agricultural and Food Chemistry, 2012, 60(9): 2 368-2 376.
[25] YANG Qingyun, ZHAO Mouming, LIN Lianzhu. Adsorption and desorption characteristics of adlay bran free phenolics on macroporous resins[J]. Food Chemistry, 2016, 194: 900-907.
[26] DONG Yi, ZHAO Mouming, SUN-WATERHOUSE D, et al. Absorption and desorption behaviour of the flavonoids from Glycyrrhiza glabra L. leaf on macroporous adsorption resins[J]. Food Chemistry, 2015, 168: 538-545.
[27] CHIEN S H, CLAYTON W R. Application of elovich equation to the kinetics of phosphate release and sorption in soils[J]. Soil Science Society of America Journal, 1980, 44(2): 265-268.
[28] HO Y S, MCKAY G. The kinetics of sorption of divalent metal ions onto sphagnum moss peat[J]. Water Research, 2000, 34(3): 735-742.
[29] LORENC-GREBOWSKE E, GRYGLEWICZ G. Adsorption of lignite-derived humic acids on coal-based mesoporous activated carbons[J]. Journal of Colloid and Interface Science, 2005, 284(2): 416-423.