茶多酚是茶叶中多羟基酚类化合物的统称,作为茶叶中具有保健功能的主要化学成分[1-2],是茶叶深加工的主要产物[3]。随着欧盟、美国和日本等发达国家对食品及农产品进口的农药残留标准的要求日趋严格[4],茶多酚中的农药残留也成为了茶叶深加工过程中面临的主要问题之一,不仅会影响茶多酚产品的质量、损害消费者健康[5],而且会损害厂家的品牌声誉,影响我国茶叶深加工产品的出口。
吡虫啉和啶虫脒是茶叶种植过程中常用的高效氯烟碱类杀虫剂[6],在水和有机溶剂中具有良好的溶解性,因此在茶多酚产品中容易残留。目前,农药残留的去除方法主要有物理法、化学法[7-8]和生物法[9]。其中,化学法和生物法由于安全性的问题[10-11],并不适用于茶多酚中农药的去除。在物理方法中,NEZAMADDIN等[12]研究了颗粒状活性炭对吡虫啉的吸附性能,发现吸附行为符合Freundlich等温吸附模型。ZHAO等[13]将花生壳生物炭用于吸附吡虫啉,吸附量达到6 mg/g,且等温吸附数据与Langmuir和Freundlich模型高度相关。然而,他们去除农残的作用并不是特异性的。为了达到最大限度地脱除农残并最大限度的保留产品的活性成分,探索一种对吡虫啉和啶虫脒具有高选择性的材料十分必要。
分子印迹技术(molecularly imprinted technique, MIT)是一种结合高分子化学、生物化学等学科发展起来的,具备特异性识别功能的新兴技术[14-15]。通过MIT人工合成的具有高稳定性、高选择性等特点的功能性识别材料被称为分子印迹聚合物(molecularly imprinted polymer, MIP)。迄今为止,MIP已在许多研究中被用于去除有害物质。例如,S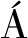 NCHEZ-POLO[16]成功地合成了能够从水中脱除四环素的MIP。同样地,一种用于吸附钍(Th,IV)的分子印迹固相萃取材料也被研究出来[17]。在吡虫啉和啶虫脒的分子印迹研究方面,FAROOQ等[18]合成了用于检测苹果汁中吡虫啉的磁性表面分子印迹材料,材料对样品的回收率为77.66%~96.57%,显示了良好的分析性能。KUMAR等[19]将合成的磁性分子印迹材料应用于分离蜂蜜和蔬菜样品中的吡虫啉,在茄子和蜂蜜样品中对吡虫啉的回收率达到(87.1±5.0)%和(90.6±5.6)%。对于啶虫脒的分子印迹材料则多见应用于电化学传感器[20]。然而,这些研究都以检测为目的进行材料的制备和性能研究;其次,目前还没有应用MIP同时吸附吡虫啉和啶虫脒的研究。虚拟模板分子印迹是一种能够有效避免模板泄漏的技术[21-22],在实际样品应用中,模板泄漏会在分离过程中造成严重的污染。烟酰胺是吡虫啉和啶虫脒的结构类似物,具有抗炎作用,常作为食品添加剂、化妆品以及药物使用,被广泛认为安全性较高[23]。选择烟酰胺作为虚拟模板,不仅可以同时对吡虫啉和啶虫脒进行脱除,还能避免模板泄漏造成的农药污染,提高材料的安全性。本研究以低毒的烟酰胺作为虚拟模板分子,采用分子印迹技术制备了基于硅胶的虚拟模板表面分子印迹聚合物(dummy template surface molecularly imprinted polymers, DMIP),并对材料进行优化,通过吸附实验考察了其吸附能力,最终成功地应用于去除茶多酚溶液中的吡虫啉和啶虫脒,为茶提取物中农药残留的脱除提供了一种新的思路和方法。
NCHEZ-POLO[16]成功地合成了能够从水中脱除四环素的MIP。同样地,一种用于吸附钍(Th,IV)的分子印迹固相萃取材料也被研究出来[17]。在吡虫啉和啶虫脒的分子印迹研究方面,FAROOQ等[18]合成了用于检测苹果汁中吡虫啉的磁性表面分子印迹材料,材料对样品的回收率为77.66%~96.57%,显示了良好的分析性能。KUMAR等[19]将合成的磁性分子印迹材料应用于分离蜂蜜和蔬菜样品中的吡虫啉,在茄子和蜂蜜样品中对吡虫啉的回收率达到(87.1±5.0)%和(90.6±5.6)%。对于啶虫脒的分子印迹材料则多见应用于电化学传感器[20]。然而,这些研究都以检测为目的进行材料的制备和性能研究;其次,目前还没有应用MIP同时吸附吡虫啉和啶虫脒的研究。虚拟模板分子印迹是一种能够有效避免模板泄漏的技术[21-22],在实际样品应用中,模板泄漏会在分离过程中造成严重的污染。烟酰胺是吡虫啉和啶虫脒的结构类似物,具有抗炎作用,常作为食品添加剂、化妆品以及药物使用,被广泛认为安全性较高[23]。选择烟酰胺作为虚拟模板,不仅可以同时对吡虫啉和啶虫脒进行脱除,还能避免模板泄漏造成的农药污染,提高材料的安全性。本研究以低毒的烟酰胺作为虚拟模板分子,采用分子印迹技术制备了基于硅胶的虚拟模板表面分子印迹聚合物(dummy template surface molecularly imprinted polymers, DMIP),并对材料进行优化,通过吸附实验考察了其吸附能力,最终成功地应用于去除茶多酚溶液中的吡虫啉和啶虫脒,为茶提取物中农药残留的脱除提供了一种新的思路和方法。
1 材料与方法
1.1 材料与试剂
吡虫啉、啶虫脒、烟酰胺标准品,阿拉丁试剂公司;茶多酚,遵义陆圣康源科技有限公司;乙腈(色谱纯),国药集团化学试剂有限公司;甲醇(色谱纯),上海泰坦科技股份有限公司;甲基丙烯酸、乙二醇二甲基丙烯酸酯、偶氮二异丁腈(分析纯),阿拉丁试剂公司;冰醋酸、甲苯、无水Na2SO4、福林酚、Na2CO3、没食子酸(分析纯),国药集团化学试剂有限公司。
1.2 仪器与设备
Su1510型扫描电子显微镜,日本日立公司;UV-2450型紫外可见分光光度计,日本岛津公司;Waters Acquity UPLC超高效液相色谱仪、Waters Quattro Premier XE质谱仪,美国沃特世公司;YQ型超声波清洗机,上海易净超声波仪器有限公司;HH-4型数显搅拌水浴锅,常州赛普实验仪器厂。
1.3 实验方法
1.3.1 改性硅胶的合成
改性硅胶的合成根据已有的文献[24]进行了一定的改进。将4 g硅胶浸入100 mL的10 mol/L HCl溶液中搅拌24 h,过滤后用去离子水洗涤至中性并干燥。将干燥后的硅胶与50 mL甲苯混合,逐滴滴加6 mL APTS和适量吡啶,在氮气保护下搅拌20 min。将反应体系控制在373 K,回流24 h,然后用甲苯、丙酮、乙醚、甲醇对所得混合物进行洗涤,最后在真空烘箱中干燥8 h,制备得到氨基改性硅胶。
将4 g氨基改性硅胶与50 mL甲苯混合,在氮气保护下加入8 mL丙烯酰氯,磁力搅拌10 min后逐滴滴加适量的三乙胺,然后在室温下搅拌24 h。所得化合物经甲苯、丙酮、乙醚和甲醇过滤洗涤后,在真空烘箱中干燥8 h,制备得到酰基改性硅胶。
1.3.2 分子印迹的合成
称取123.4 mg(约1 mmoL)烟酰胺置于250 mL圆底烧瓶中,以 80 mL不同比例甲醇-水混合溶解。然后加入适量酰基改性硅胶与0.34 mL MAA(4 mmol)并超声30 min,待充分溶解分散后避光放置4 h,使模板分子与功能单体充分作用。将适量EGDMA和AIBN(40 mg)加入到该混合物中,通高纯氮气20 min,使得瓶内保持惰性氛围,在氮气保护下将烧瓶密封,在333 K水浴下热引发聚合24 h。以V(甲醇)∶V(乙酸)=9∶1为溶剂,通过索氏提取法除去模板。所得材料以甲醇洗涤至中性,在323 K下真空干燥6 h,制备得到DMIP。作为对照,在相同条件下不添加模板分子制备了非印迹聚合物(DNIP)。
1.3.3 虚拟模板表面分子印迹制备条件的优化
1.3.3.1 单因素优化实验
考察交联剂和功能单体用量的摩尔比、酰基硅胶的用量以及溶剂的配比3个因素对DMIP印迹效果的影响,得到单因素的最佳制备条件。
准确称取10 mg制备得到的DMIP和DNIP并分别置于25 mL锥形瓶中,然后分别加入8 mL质量浓度为0.2 mg/mL的吡虫啉和0.2 mg/mL啶虫脒混合水溶液。在室温下摇晃20 h后,离心取上清液,并用去离子水稀释至4 mL。采用HPLC-MS-MS法测定上清液中的吡虫啉和啶虫脒的浓度,计算吸附容量Q(mg/g)和特异因子α,计算方法如公式(1)和公式(2)所示:
(1)
(2)
式中:ρ0,初始质量浓度,g/mL;ρt,平衡质量浓度,g/mL; V,溶液体积,mL;m,材料质量,mg。Qm,DMIP的吸附容量,mg/g;Qn,DNIP的吸附容量,mg/g。
最终的QDMIP为 DMIP对吡虫啉和啶虫脒吸附容量的平均值。
1.3.3.2 分子印迹聚合物制备条件响应面优化实验
根据单因素优化实验的结果,以交联剂和功能单体用量的摩尔比(A)、酰基硅胶的用量(B)、溶剂的配比(C)为实验因素,以虚拟模板表面分子印迹的吸附容量QDMIP (mg/g)和特异因子α为响应值,利用软件Design-Expert对实验结果进行分析。
1.3.4 分子印迹的扫描电镜表征
称取DMIP和DNIP粉末适量,粘于导电胶上并镀金,用扫描电镜观察样品形态。
1.3.5 分子印迹的吸附性能研究
准确称取200 mg的DMIP和DNIP分别置于250 mL锥形瓶中,然后分别加入50 mL的0.2 mg/mL吡虫啉和0.2 mg/mL啶虫脒混合水溶液。在室温下摇动5、30、90、150、210、270、330和390 min后,取0.15 mL混合溶液离心并取上清液,用去离子水稀释至4 mL。采用HPLC-MS-MS法测定上清液中吡虫啉和啶虫脒的浓度,计算吸附容量。
1.3.6 分子印迹应用于脱除茶多酚中的吡虫啉和啶虫脒
将100 mg DMIP通过湿法装柱填充到固相萃取柱中,加入10 mL甲醇进行活化备用。将50 mL的20 mg/mL茶多酚溶液中添加10 μg/mL吡虫啉和啶虫脒,作为上样液进行固相萃取,样液的流速控制在1.25 mL/min。之后,用10 mL去离子水洗去弱保留化合物,合并洗脱液,用HPLC-MS-MS测定洗脱液中茶多酚、吡虫啉和啶虫脒的浓度。
2 结果与讨论
2.1 虚拟模板表面分子印迹制备条件的优化
2.1.1 交联剂和功能单体用量的摩尔比对分子印迹材料印迹效果的影响
交联剂和功能单体用量的摩尔比能够影响分子特异性吸附位点的数量,从而影响其吸附效果。将QDMIP和α作为指标,对交联剂和功能单体用量的摩尔比对分子印迹效果的影响进行考察,结果如表1所示。
表1 交联剂和功能单体用量的摩尔比对分子印迹效果的影响
Table 1 Effect of molar ratio of crosslinking agent and functional monomer on DMIP

n(EGDMA)∶n(MAA)QDMIP/(mg·g-1)QDNIP/(mg·g-1)α5∶120.89±0.3714.31±0.731.46±0.076∶123.12±0.8214.82±0.911.56±0.167∶132.42±0.7516.05±0.482.16±0.138∶126.50±0.2916.16±0.631.64±0.099∶124.13±0.8619.78±0.381.22±0.10
由结果可知,若要QDMIP和α达到最优的条件,交联剂与功能单体用量的摩尔比为7∶1。这可能是因为在交联剂的添加量较少时,分子印迹聚合物的交联度较低,以至于不能够充分固定功能单体和模板分子,难以形成足够的排列有序的空间位点;而当交联剂的添加量太多时,分子印迹聚合物的交联度较高,单位质量的聚合物中产生的特异性识别孔穴较少,因此也会对材料的印迹效果造成影响。
2.1.2 酰基硅胶的用量对分子印迹材料印迹效果的影响
改性硅胶的用量会对分子印迹聚合物的吸附效果产生很大的影响。若改性硅胶的用量过少,则会导致有一部分的模板分子和功能单体不能在改性硅胶的表面聚合,从而使得印迹层的厚度较大,影响特异性吸附效果;当改性硅胶的用量过多时,不仅会导致硅胶颗粒发生团聚,而且会使得硅胶表面的印迹层过薄,从而使得单位质量聚合物中的有效印迹位点减少。将QDMIP和α作为指标,对酰基硅胶的用量对分子印迹效果的影响进行考察,结果如表2所示。实验结果显示,酰基改性硅胶的最佳用量是0.9 g,此时QDMIP和α达到最优。
表2 酰基硅胶的用量对分子印迹效果的影响
Table 2 Effect of acyl silica gel content on DMIP

酰基硅胶的用量/gQDMIP/(mg·g-1)QDNIP/(mg·g-1)α0.530.72±0.6228.63±0.721.15±0.140.730.00±0.2918.07±0.181.66±0.080.932.42±0.4316.05±0.932.16±0.031.128.30±0.6322.54±0.951.25±0.131.322.42±0.2519.53±0.261.21±0.04
2.1.3 溶剂的配比对分子印迹材料印迹效果的影响
含水体系的极性溶剂可以有效地增加分子印迹聚合物在水相中的识别性能。将QDMIP和α作为指标,对溶剂中甲醇和水的配比对分子印迹效果的影响进行考察,结果如表3所示。
表3 溶剂的配比对分子印迹效果的影响
Table 3 effect of solvent ratio on DMIP
v(甲醇)∶v(水)QDMIP/(mg·g-1)QDNIP/(mg·g-1)α100∶027.02±0.3517.55±0.831.54±0.0790∶1031.95±0.8621.31±0.692.18±0.0980∶2028.36±0.3716.78±0.361.69±0.1670∶3019.83±0.4415.49±0.841.28±0.2160∶4014.41±0.2512.32±0.261.17±0.04
结果显示,当溶剂中甲醇与水的配比为90∶10时,QDMIP和α达到最优。这可能是因为添加适量的水可以增加MAA与模板分子静电和疏水作用,从而增强其在水相中的特异性识别能力;然而当溶剂中水的含量过多时,则会严重干扰模板分子和功能单体之间氢键的形成。
2.1.4 响应面试验设计及结果
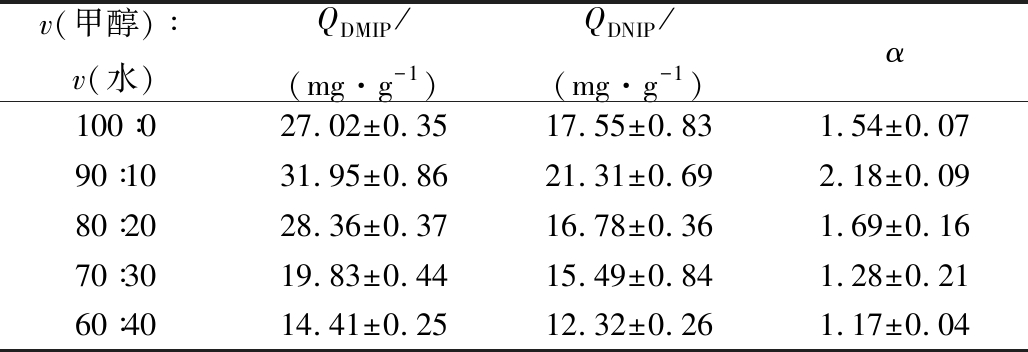
虚拟模板表面分子印迹制备优化的响应面分析结果见表4。采用Design-Expert对实验结果进行回归分析,方差分析的结果见表5及表6。
表4 响应面试验设计及结果
Table 4 Experimental design and results for response surface analysis
试验号(A)交联剂和功能单体用量的摩尔比(B)酰基硅胶的用量/g(C)溶剂的配比QDMIP/(mg·g-1)α11∶70.99∶132.422.1621∶71.110∶027.871.5331∶60.910∶021.251.0741∶70.710∶020.421.0151∶70.99∶132.482.1261∶81.19∶125.181.2371∶71.18∶222.871.1481∶61.19∶121.421.0891∶80.98∶223.071.21101∶60.79∶121.921.09111∶80.910∶023.781.24121∶60.98∶223.51.21131∶80.79∶120.981.05141∶70.99∶131.952.18151∶70.99∶132.512.22161∶70.99∶132.472.13171∶70.78∶225.911.31
经过分析,二次回归方程分别为Q=32.37+0.615 0A+1.01B+0.253 8C+1.18AB-0.740 0AC-2.62BC-5.68A2-4.31B2-3.79C2和α=2.16-0.035 0A+0.065 0B+0.002 5C+0.047 0AB-0.042 5AC-0.172 5BC-0.557 3A2。结果表明,2个模型中P<0.001,表明2个二次方程模型极显著,失拟项P>0.05,失拟均不显著。第一个模型回归方程中相关系数![]() 第二个模型回归方程中
第二个模型回归方程中![]() 说明2个方程实际值与预测值拟合较好。
说明2个方程实际值与预测值拟合较好。
结合2个回归模型方程,采用Design-Expert 8.0绘制了响应面分析图,见图1。结果表明,交联剂与功能单体用量比和酰基硅胶用量、改性硅胶用量和溶剂配比3个因素互相的交互作用都会对DMIP的吸附容量QDMIP以及选择因子α产生明显的影响。结合2个模型,通过软件分析,最终得到DMIP的最佳制备条件为:交联剂和功能单体用量的摩尔7.05∶1,改性硅胶用量0.919 mg, 溶剂中甲醇/水的体积比为90.13∶9.87。
表5 回归模型各项方差分析(QDMIP为响应值)
Table 5 Analysis of variance for the fitted quadratic polynomial regression model (QDMIP as response value)

来源平方和自由度均方F值P值显著性模型352.39939.15563.78<0.000 1极显著A-交联剂的用量3.0313.0343.570.000 3B-改性硅胶的用量8.2218.22118.38<0.000 1C-溶剂中水的比例0.515110.51517.420.029 6AB5.5215.5279.52<0.000 1AC2.1912.1931.540.000 8BC27.51127.51396.12<0.000 1A2135.811135.811 955.47<0.000 1B278.28178.281 127.13<0.000 1C260.38160.38869.36<0.000 1残差0.486 170.069 4失拟0.265 630.088 51.610.321 3不显著纯误差0.220 540.055 1总和352.8716
表6 回归模型各项方差分析(α为响应值)
Table 6 Analysis of variance for the fitted quadratic polynomial regression model (α as response value)

来源平方和自由度均方F值P值显著性模型3.6190.401 5175.86<0.000 1极显著A-交联剂的用量0.009 810.009 84.290.077 0B-改性硅胶的用量0.033 810.033 814.810.006 3C-溶剂中水的比例0.000 010.000 00.021 90.886 5AB0.009 010.009 03.950.087 1AC0.007 210.007 23.160.118 5BC0.119 010.119 052.140.000 2A21.3111.31572.74<0.000 1B21.0211.02446.92<0.000 1C20.750 710.750 7328.85<0.000 1残差0.016 070.002 3失拟0.009 530.003 21.950.262 8不显著纯误差0.006 540.001 6总和3.6316
2.2 分子印迹的扫描电镜表征
图2为DMIP和DNIP的扫描电镜图像。将图2-a、图2-b与图2-c、图2-d相比,可以明显看出DMIP呈现网络状的分支结构,与DNIP相比更加的疏松多孔,且有明显的结块现象。这是由于DMIP在制备的过程中加入了烟酰胺作为虚拟模板分子,模板分子被洗脱之后留下了与对应结构互补的空间结构,这些空间结构使得DMIP看起来更加粗糙蓬松。在DNIP表面镶嵌有硅胶颗粒,这也说明材料的聚合过程是在硅胶的表面进行的。
2.3 分子印迹的吸附性能研究
如图3所示,DMIP和DNIP对吡虫啉和啶虫脒的吸附量皆随着吸附时间的增加而增加。在前90 min,DMIP和DNIP对吡虫啉和啶虫脒的吸附速率较快,在210 min之后基本达到吸附平衡,说明该表面印迹材料对吡虫啉和啶虫脒具有较大的吸附动力学。这是由于所制备的表面分子印迹的吸附位点基本位于材料表面,在吸附过程中能够更加快速高效地和底物接触。与此同时可以发现,虽然具有相似的吸附趋势,但是DMIP吡虫啉和啶虫脒的吸附量比DNIP大得多,这是由于虚拟模板分子在DMIP表面上产生了特异性吸附位点,使得吡虫啉和啶虫脒更容易进入。

图1 各因素的交互作用对QDMIP和α的响应面分析图
Fig.1 The response surface of interaction among three factors on QDMIP and α

放大倍数(a,c)15 000,(b,d)5 000
图2 DMIP(a,b)和DNIP(c,d)的扫描电镜图
Fig.2 SEM images of DMIP (a and b), DNIP (c and d)
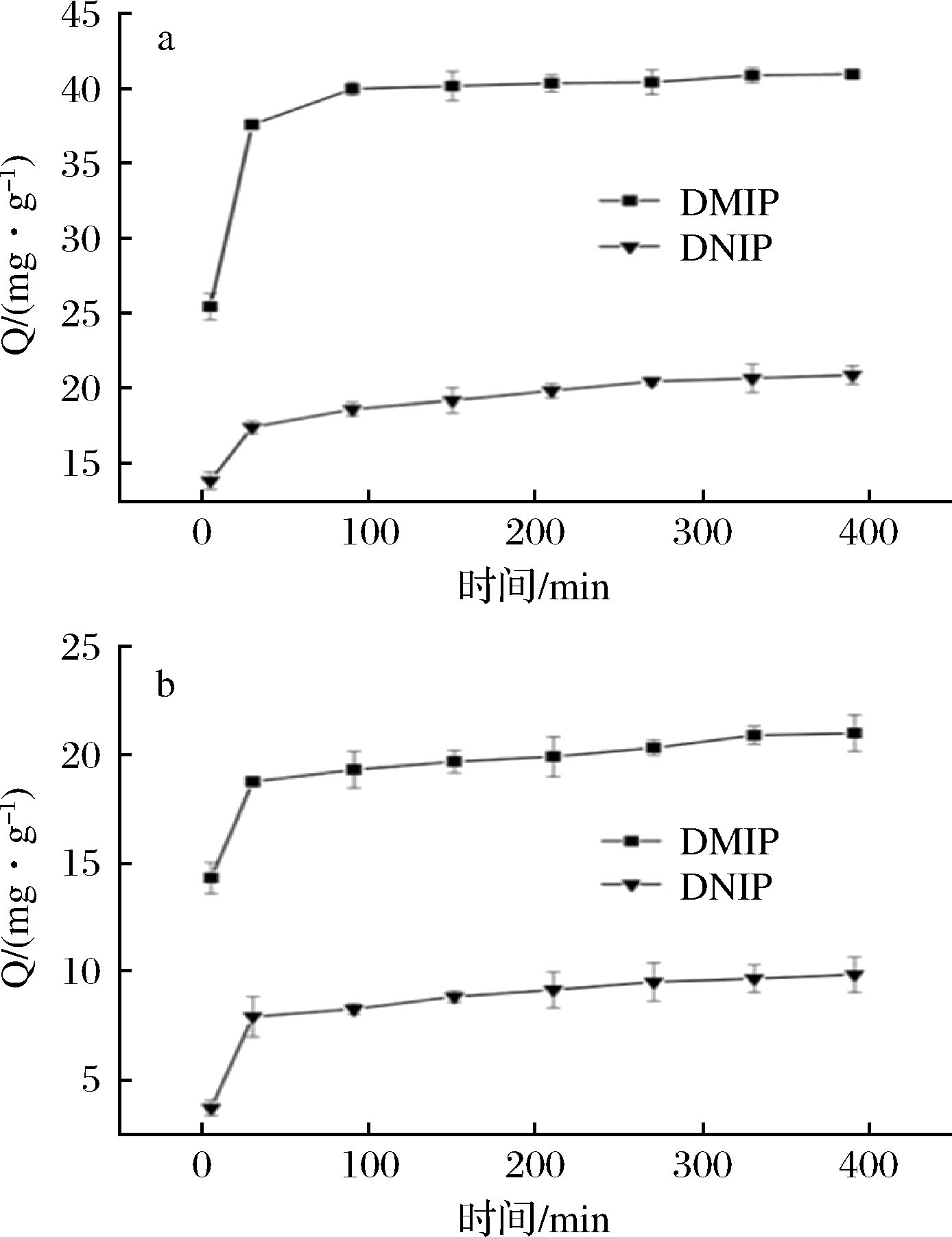
a-吡虫啉;b-啶虫脒
图3 DMIP和DNIP对吡虫啉和啶虫脒的吸附曲线
Fig.3 Adsorption curves of the DMIP and DNIP toward imidacloprid and acetamiprid
2.4 分子印迹脱除茶多酚中的吡虫啉和啶虫脒
将所制备的DMIP材料用于从茶多酚中去除吡虫啉和啶虫脒。将50 mL上样溶液经过DMIP柱,再用10 mL去离子水过柱,合并流出液。采用高效液相色谱-质谱联用仪(HPLC-MS-MS)和紫外可见分光光度计(UV-visible)分别测定了2种农药和茶多酚的含量。结果表明,经过DMIP柱后,上样液中吡虫啉和啶虫脒的浓度均显著下降。通过3个平行实验测定可知,该柱对吡虫啉和啶虫脒的去除率分别为96.2%和95.6%,而对茶多酚的吸附率仅为3.7%,远低于2种农药的吸附率。结果表明,DMIP材料对茶多酚溶液中的吡虫啉和啶虫脒具有选择性吸附能力,有望应用于在茶多酚生产工艺中去除残留的吡虫啉和啶虫脒。
3 结论
本实验以硅胶为基底、烟酰胺为虚拟模板分子,采用表面印迹法制备了能够特异性吸附吡虫啉和啶虫脒的表面分子印迹聚合物。选用无毒的烟酰胺作为虚拟模板,不仅避免模板渗漏和污染,而且可以为吡虫啉和啶虫脒提供吸附位点。通过单因素实验,采用响应面分析法对DMIP的制备条件进行优化,得到DMIP的最佳制备条件为:交联剂和功能单体用量的摩尔比为7.05∶1,改性硅胶用量0.919 mg, 溶剂中甲醇/水的体积比90.13∶9.87,并且对优化后DMIP的吸附性能进行评价。结果表明,优化后的DMIP对吡虫啉和啶虫脒具有良好的吸附性能和选择性,对吡虫啉和啶虫脒的最大吸附量分别为41.73和21.95 mg/g,与其他种类的分子印迹材料相比具有一定的优势[18-19],适合作为吸附材料使用。此外,该聚合物还成功地作为柱填料同时去除茶多酚中的吡虫啉和啶虫脒,对吡虫啉和啶虫脒的脱除率分别达到96.2%和95.6%,对茶多酚的吸附率仅为3.7%。因此,该材料有望用于茶提取物中吡虫啉和啶虫脒的脱除中,可以进一步研究DMIP的结构稳定性及重复利用性,以期更好地用于工业化生产。
[1] 陈淑珍,甄永苏.茶多酚的分子作用靶点及其在抗肿瘤药物实验治疗中的作用[J].药学学报,2013,48(1):1-7.
[2] AHMAD N,MUKHTAR H.Green tea polyphenols and cancer: biologic mechanisms and practical implications[J].Nutrition Reviews,1999,57(3):78-83.
[3] 陈贞纯,刘晓慧,吴媛媛,等.茶多酚提取分离技术研究进展[J].中国茶叶,2013,35(1):9-12.
[4] 徐广伟.我国食品安全体系的发展——以农药残留标准为例[J].食品安全导刊, 2016, 27:86-88.
[5] LOZOWICKA B,KACZYNSKI P,PARITOVA А Е,et al.Pesticide residues in grain from Kazakhstan and potential health risks associated with exposure to detected pesticides[J]. Food & Chemical Toxicology,2014,64(2):238-248.
[6] GUPTA M,SHANKER A.Evaluation of imidacloprid and acetamiprid against Toxoptera aurantii Boyer in tea[J].Pesticide Research Journal,2009,21(2):162-165.
[7] KUSVURAN E,YILDIRIM D,MAVRUK F,et al.Removal of chloropyrifos ethyl, tetradifon and chlorothalonil pesticide residues from citrus by using ozone[J].Journal of Hazardous Materials,2012,241(4):287-300.
[8] AFFAM A C,CHAUDHURI M. Degradation of pesticides chlorpyrifos, cypermethrin and chlorothalonil in aqueous solution by TiO2 photocatalysis[J].J Environ Mange, 2013,130(1):160-165.
[9] FERRARIO C,PITTINO F,TAGLIAFERRI I,et al.Bacteria contribute to pesticide degradation in cryoconite holes in an Alpine glacier[J].Environmental Pollution,2017,230:919-926.
[10] 郭佳婧,李高阳,刘咏红.化学氧化剂降解果蔬农残研究进展[J].食品与机械,2014,30(3):249-251;256.
[11] 万阳芳,李慧颖,刘俊果,等.农产品中农药残留化学降解方法研究进展[J]. 河北工业科技,2014,31(2):48-51.
[12] NEZAMADDIN D,SOHEIL A,ALI K,et al. Investigation of adsorption kinetics and isotherms of imidacloprid as a pollutant from aqueous solution by adsorption onto industrial granular activated carbon[J]. Journal of Food Agriculture and Environment,2015,5(3-4):425-429.
[13] ZHAO R,MA X,XU J. Removal of the pesticide imidacloprid from aqueous solution by biochar derived from peanut shell[J]. Bioresources,2018,13(3):5 656-5 669.
[14] 王颖,李楠.分子印迹技术及其应用[J].化工进展,2010,29(12):2 315-2 323.
[15] 史瑞雪,郭成海,邹小红,等.分子印迹技术研究进展[J].化学进展,2002,14(3):182-191.
[16] S NCHEZ-POLO M,VELO-GALA I,L
NCHEZ-POLO M,VELO-GALA I,L PEZ-PE
PEZ-PE ALVER J J,et al. Molecular imprinted polymer to remove tetracycline from aqueous solutions[J].Microporous and Mesoporous Materials,2015,203(203):32-40.
ALVER J J,et al. Molecular imprinted polymer to remove tetracycline from aqueous solutions[J].Microporous and Mesoporous Materials,2015,203(203):32-40.
[17] JI X Z,LIU H J,WANG L L,et al.Study on adsorption of Th(IV) using surface modified dibenzoylmethane molecular imprinted polymer[J].Journal of Radioanalytical & Nuclear Chemistry,2013,295(1):265-270.
[18] FAROOQ S,NIE J,CHENG Y,et al. Synthesis of core-shell magnetic molecularly imprinted polymer for the selective determination of imidacloprid in apple samples[J].Journal of Seperation Science,2019,42(14):2 455-2 465.
[19] KUMAR N,NARAYANAN N,GUPTA S. Application of magnetic molecularly imprinted polymers for extraction of imidacloprid from eggplant and honey[J].Food Chemistry,2019,255:81-88.
[20] 郭明,谭贤,梁东军,等.吡虫啉分子印迹电化学传感器的制备及电学传感机理分析[J].农药学学报,2014, 16(5):559-569.
[21] TANG P,HUO J,ZHANG H,et al.Surface plasmon resonance-based inhibitive immunoassay coupled with dummy template molecularly imprinted polymer solid phase extraction for on-line analysis of trace clenbuterol[J].Journal of the Chinese Chemical Society,2014,61(12):1 357-1 364.
[22] SONG Y P,LI N, ZHANG H,et al.Dummy template molecularly imprinted polymer for solid phase extraction of phenothiazines in meat based on computational simulation[J].Food Chemistry,2017,233:422-428.
[23] ATTIA E A, HASSAN A A.Uremic pruritus pathogenesis, revisited[J].Arab J Nephrol Transplant,2014,7(2):91-96.
[24] 冀峰,赵利霞,冯钦忠,等.硅胶表面扑灭津分子印迹材料的制备及性能表征[J].分析化学,2008,36(7):920-924.