山药蛋白肽对免疫能力低下小鼠的免疫调节作用
樊乃境1,王冬梅2,高悦1,郭亚男1,程天赋2,房庆喜1,范志军2*
1(东北农业大学,黑龙江 哈尔滨,150030)2(黑龙江省北大荒绿色健康食品有限责任公司,黑龙江 佳木斯,154000)
摘 要 该文研究山药蛋白肽对免疫能力低下小鼠的免疫调节作用。试验采用环磷酰胺(cyclophospamide,CY)皮下注射构建免疫功能低下小鼠模型,通过口腔灌胃低、中、高不同剂量的山药蛋白肽,并与空白对照组、阴性对照组相比较,通过免疫器官、免疫细胞、免疫活性物质三方面探讨山药蛋白肽对免疫能力低下小鼠的免疫调控作用和作用机制。结果表明,山药蛋白肽含有极其丰富的疏水性氨基酸和碱性氨基酸;在小鼠免疫器官方面,CY构建免疫能力低下小鼠模型的免疫器官指数指标显著降低,脾脏发生明显的病理学变化,山药蛋白肽能促进免疫器官指数的提高,并且对脾脏病理学变化有显著改善作用;在小鼠免疫细胞方面, CY阴性对照组的乳酸脱氧酶(lactic dehydrogenase,LDH)和酸性磷酸酶(acid phosphatase,ACPase)活性、淋巴细胞增殖能力显著下降,山药蛋白肽能显著提高LDH、ACPase酶活性和淋巴细胞增殖能力;在小鼠免疫活性物质方面,CY阴性对照组的细胞因子(IL-1α、IL-6、IFN-γ)和免疫球蛋白(IgG、IgM)水平均显著低于正常组,山药蛋白肽能显著提升IL-1α、IL-6、IFN-γ水平和IgG、IgM水平,这表明山药蛋白肽能通过激活和保护免疫系统中的免疫器官、免疫细胞和免疫活性物质发挥免疫调节作用,进而增强机体的免疫防御能力。
关键词 山药蛋白肽;免疫能力低下;免疫器官;免疫细胞;免疫活性物质
DOI:10.13995/j.cnki.11-1802/ts.021716
引用格式:樊乃境,王冬梅,高悦,等.山药蛋白肽对免疫能力低下小鼠的免疫调节作用[J].食品与发酵工业,2020,46(6):101-107.FAN Naijing,WANG Dongmei,GAO Yue, et al. Immunomodulatory effects of the iron yam peptides on mice with immunocompromised[J].Food and Fermentation Industries,2020,46(6):101-107.
第一作者:硕士研究生(范志军副高级工程师为通讯作者,E-mail:1254026010@qq.com)
基金项目:黑龙江省应用技术研究与开发技术重大项目(GA17B002);山东省重点研发计划(医用食品专项计划)项目(2018YYSP026);山东省泰山产业领军人才工程项目(LJNY201607)
收稿日期:2019-07-18,改回日期:2019-10-14
Immunomodulatory effects of the iron yam peptides on mice with immunocompromised
FAN Naijing1,WANG Dongmei2,GAO Yue1, GUO Yanan1,CHENG Tianfu2, FANG Qingxi1,FAN Zhijun2*
1(Northeast Agricultural University, Harbin 150030, China)2(Heilongjiang Province Beidahuang Green Health Food Co.,Ltd., Jiamusi 150036, China)
ABSTRACT The immunomodulatory effect of the iron yam peptides (IYPs) on immunocompromised mice and its mechanism of action were studied. In this study, cyclophosphamide (CY) was used to establish immunocompromised mouse model. The iron yam peptides were given orally by gavage and cyclophosphamide was injected subcutaneously every other day. The immunomodulatory effects of iron yam peptides on CY-immunized mice were investigated from the body's immune system. The results showed that IYPs contained abundant hydrophobic and essential amino acids. In the immune organs of mice, the immune organ index of CY-immunized mouse model was significantly decreased and the pathological changes of spleen occurred. The phaseolus vulgaris peptides also could promote the index of immune organs and pathology of spleen. The improvement was significant, which indicated that iron yam peptides could promote the development of immune organs in mice with immunocompromised. In mouse immune cells, LDH and ACPase activities, lymphocyte proliferation was significantly decreased in CY-immunized control group. The iron yam peptides significantly increased LDH, ACPase activity and lymphocyte proliferation. In the mouse immunosuppressive substances, the cytokines (IL-1α, IL-6, IFN-γ) and immunoglobulin (IgG, IgM) levels in the CY-immunized group were significantly lower than the normal group. The iron yam peptides significantly increased IL-1α, IL-6, IFN-γ levels and IgG, IgM levels. The iron yam peptides can exert immunomodulatory effects by activating and protecting immune organs, immune cells and immune active substances, thereby enhancing immune ability.
Key words iron yam peptides;immune deficiency;immune organs; immune cells; immunoactive substances
免疫能力低下是一种暂时性或永久性免疫功能障碍状态,并且由于免疫系统遭到破坏,机体对病原体和外界刺激更加敏感,极大地危害人体健康。因此,通过一些切实可行的措施,提高机体免疫力,增强机体免疫功能,是营养学家和医务工作者目前面临的且急需解决的重大课题。目前,常采用免疫增强剂进行调节机体免疫能力,如左旋咪唑、卡介苗、糖皮质激素等。但此类药物具有毒副作用强和生产成本高的缺陷,并且大多数免疫调节药物并不适用于慢性或预防性的用途[1]。科学家们正在积极寻求和研究天然、安全的保证身体健康以及调节人体疲劳、增强免疫力的保健功能食品。在众多的保健功能食品研究中,蛋白肽不乏是重点研究对象之一,尤其是在水解形成多肽后的保健效果已被科学家广泛确认。
免疫活性肽是一类能促进和激活人体免疫能力的小分子活性肽,随着人们对免疫活性肽研究的关注和深入,其发挥免疫功效的机理和结构与功能的关系将被揭开。目前已经在临床上将免疫活性肽研发成免疫调节剂,用于治疗免疫缺陷疾病或者是自身免疫性疾病等[2-3],具有广阔的应用前景。目前,从谷物蛋白[4]、豆类蛋白[5]、牛奶蛋白[6]、鱼蛋白[7]、小麦蛋白[8]和贝类蛋白[9]中分离的肽已用于改善免疫功能低下的动物和患者的免疫功能。研究表明,食源性免疫活性肽对特异性和非特异性免疫应答均能发挥免疫调节作用,但是关于免疫活性肽对免疫系统组织学基础的调控作用缺乏系统的研究[2,4-7]。
山药是一种药食同源的食材,具有免疫调节、抗氧化、抗衰老、调节血脂血压和体内酸碱平衡等功效[10]。目前,对山药功能因子的研究多集中在山药多糖和糖蛋白的提取纯化[11-13]及其生物活性[14],如分离出的糖蛋白组分CYG1和CYG2具有α-葡萄糖苷酶抑制剂的作用[14]。但山药蛋白质中的氨基酸种类极为丰富,含有人体所必需的8种氨基酸且占总量25.32%,氨基酸评分、化学评分、营养指数等指标也均高于大豆分离蛋白和玉米蛋白,这些均说明了山药蛋白是一种营养价值极高的优质植物蛋白源[15]。目前关于山药蛋白的研究较少,关于山药蛋白肽的研究仅限于水解工艺的优化[16-18]及山药多肽啤酒[15]的制备工艺。因此,本实验采用隔天皮下注射环磷酰胺构建免疫能力低下小鼠模型,通过口腔灌胃低、中、高不同剂量的山药蛋白肽,并与空白对照组、阴性对照组相比较,从机体免疫系统(免疫器官、免疫细胞和免疫活性物质)进行探讨山药蛋白肽对免疫能力低下小鼠的免疫调节作用,以期为山药蛋白肽免疫活性的深入研究及深度开发利用提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 实验动物
SPF(Specitic pathogen tree)级昆明种小鼠,雌雄各半,体重(25±2)g。
1.1.2 试剂
山药蛋白肽,实验室自制,水解度42.5%;山药蛋白,实验室自制,蛋白纯度93.2%;铁棍山药,产地河南焦作;注射用环磷酰胺(cyclophos phamide,CY),江苏盛迪医药有限公司,国药准字H32020857;盐酸左旋咪唑片(LH),广西南国药业有限公司;胎牛血清,Hyclone;DMEM培养基、胰酶,Gibco;青霉素-链霉素溶液,碧云天生物技术有限公司;PBS,索莱宝生物科技有限公司;LPS,Biosharp;切片用石蜡,山东宝丽来有限公司;苏木精染色素,上海蓝季科技发展有限公司;伊红染色素,上海蓝季科技发展有限公司;乳酸脱氢酶测定试剂盒,南京建成生物工程研究所;酸性磷酸酶测定试剂盒,南京建成生物工程研究所;无水碳酸钠,汕头市西陇化工厂有限公司;亚硝酸钠,衡阳市凯信化工试剂有限公司;钠石灰,上海纳辉干燥试剂厂;小鼠IL-1α、IL-6、IFN-γ、IgG、IgM ELISA试剂盒,上海酶联生物科技有限公司。
1.1.3 仪器与设备
HF-90 CO2恒温培养箱,上海力申科学仪器有限公司;AE31倒置显微镜,麦克奥迪实业集团有限公司;SW-CJ-IF 型超净工作台,北京东联哈尔仪器制造有限公司;MEK-7222血细胞分析仪,北京东联哈尔仪器制造有限公司;MULTISKAN MK3型酶标仪,美国Thermo公司;LEICA RM2235 石蜡切片机,德国徕卡有限公司;101-1型电热鼓风恒温干燥箱,上海东星建材实验设备有限公司;BD-326型卧式冷冻冰柜,青岛海尔冷冻总公司。
1.2 实验方法
1.2.1 山药蛋白肽的制备
山药蛋白肽制备工艺:
山药蛋白→加水(底物浓度为7%)→加热处理(95 ℃、10 min)→冷却→调 pH 10,温度50 ℃→加7%胰蛋白酶→恒温恒pH水解4.5 h→灭酶(95 ℃、10 min)→冷却→调 pH 9,温度60 ℃→加7%碱性蛋白酶→恒温恒pH水解3 h→灭酶(95 ℃、10 min)透析脱盐12 h→冷冻干燥→山药蛋白肽(水解度为42.48%)
1.2.2 山药蛋白肽的氨基酸组成分析
称取一定质量的山药蛋白肽置于水解管中,加入6 mol/L 10 mL盐酸溶液,重复抽取真空充NL后封口,置于110 ℃恒温干燥箱内水解24 h,取出冷却后过滤,将滤液定容至50 mL,准确吸取1 mL,于50 ℃真空干燥后采用蒸馏水溶解过滤,采用氨基酸自动分析仪测定其氨基酸组成。
1.2.3 动物分组及给药
将小鼠随机分为6组,具体给药方法如表1所示。每组每天灌胃(ig)给药,连续灌胃给药10 d,同时,除正常对照组外,其余各组隔天皮下注射(Sc)环磷酰胺制造免疫能力低下小鼠模型。
表1 动物实验分组及给药情况
Table 1 Grouping and administration of animal experiments

分组给药方法及剂量正常对照组ig NS 0.2 mL/10 g环磷酰胺阴性模型组(CY)Sc CY 30 mg/kg q.o.d左旋咪唑阳性对照组(LH)ig LH 80 mg/(kg·d),10 d+Sc CY 30 mg/kg q.o.d山药蛋白肽低剂量组(IYPs-L)ig IYPs 200 mg/(kg·d),10 d+Sc CY 30 mg/kg q.o.d山药蛋白肽中剂量组(IYPs -M)ig IYPs 400 mg/(kg·d),10 d+Sc CY 30 mg/kg q.o.d山药蛋白肽高剂量组(IYPs -H)ig IYPs 600 mg/(kg·d),10 d+Sc CY 30 mg/kg q.o.d
1.2.4 山药蛋白肽对免疫能力低下小鼠免疫器官的影响
1.2.4.1 体重及免疫器官指数测定
末次给药后予小鼠禁食12 h,宰杀前进行称体重并记录,颈椎脱臼法处死,分别取胸腺和脾脏称湿重,如公式(1)、公式(2)所示计算小鼠胸腺、脾脏指数:
胸腺指数
(1)
脾脏指数
(2)
1.2.4.2 脾脏病理学切片测定
取完好无损的同一部位脾脏用PBS缓冲液洗净,储存于10%中性多聚甲醛溶液中固定,横切一块脾脏组织,不同浓度乙醇常规脱水后石蜡包埋,切3 mm切片于温水浴中展平,平铺于载玻片上置于37 ℃恒温箱过夜后在4 ℃冰箱内保存,HE染色镜检观察。
1.2.5 山药蛋白肽对免疫能力低下小鼠免疫细胞的影响
1.2.5.1 腹腔巨噬细胞中乳酸脱氢酶(lactic dehtdrogenase,LDH)及酸性磷酸酶(acid phosphatase,ACPase)活性的测定
将小鼠脾脏器官采用4 ℃的生理盐水冲洗干净,置于15 mL的离心管中,并加入相当于小鼠脾脏19倍重量的生理盐水,在4 ℃下将离心管充分匀浆,制成5%脾脏组织液,3 000 r/min离心10 min,取上清液备用,按照说明书方法进行检测LDH、ACPase酶活性。
1.2.5.2 对免疫能力低下小鼠淋巴细胞增殖能力的影响
末次给药1 h后处死动物,75%酒精浸泡5 min,无菌环境中取出脾脏,剪碎后过200目医用纱布,收集得到脾细胞悬液,1 000 r/min离心5 min,取细胞沉淀,加4 mL红细胞裂解液吹打均匀,室温静置5 min后,1 000 r/min离心5 min,取沉淀采用4 mL PBS洗涤3遍,重悬中含10 %胎牛血清的高糖DMEM培养基中,置于37 ℃、5% CO2培养箱中培养2 h,去除贴壁细胞,悬浮的细胞为脾淋巴细胞,然后按5×106/孔密度接种于6孔板进行培养。将处于对数生长期的脾细胞按照1×104/孔密度接种于96孔板,按照试验分组进行培养12 h后,按照说明书采用WST-1法检测细胞增殖率。
1.2.6 山药蛋白肽对免疫能力低下小鼠免疫活性物质的影响
1.2.6.1 对免疫能力低下小鼠血清IL-1α、IL-6、IFN-γ含量的影响
末次给药后,小鼠禁食12 h,小鼠眼框采取50 μL,采用ELISA法进行检测IL-1α、IL-6、IFN-γ含量。
1.2.6.2 对免疫能力低下小鼠血清IgM、IgG含量的影响
末次给药后,小鼠禁食12h,小鼠眼框采取50 μL,采用ELISA法进行检测IgM、IgG含量。
1.2.7 数据处理方法
每组实验平行测定至少3次,实验结果表示为均值±标准差,利用SPSS软件对数据结果进行方差分析,并采用Duncan法进行组间比较,P<0.05表示差异显著,采用Origin 8.5 对数据结果作图。
2 结果与分析
2.1 山药蛋白肽的氨基酸组成分析
山药蛋白肽的氨基酸组成分析见表2。
由表2可知,山药蛋白肽(iron yam peptides,IYPs)的氨基酸组成中谷氨酸含量最高可达18.73%,其次是天冬氨酸和亮氨酸,且疏水性氨基酸(37.6%)和碱性氨基酸(17.6%)共占55.2%。这表明山药蛋白肽含有极其丰富的疏水性氨基酸和极性氨基酸。
表2 山药蛋白肽的氨基酸组成分析
Table 2 Amino acid composition analysis of IYPs
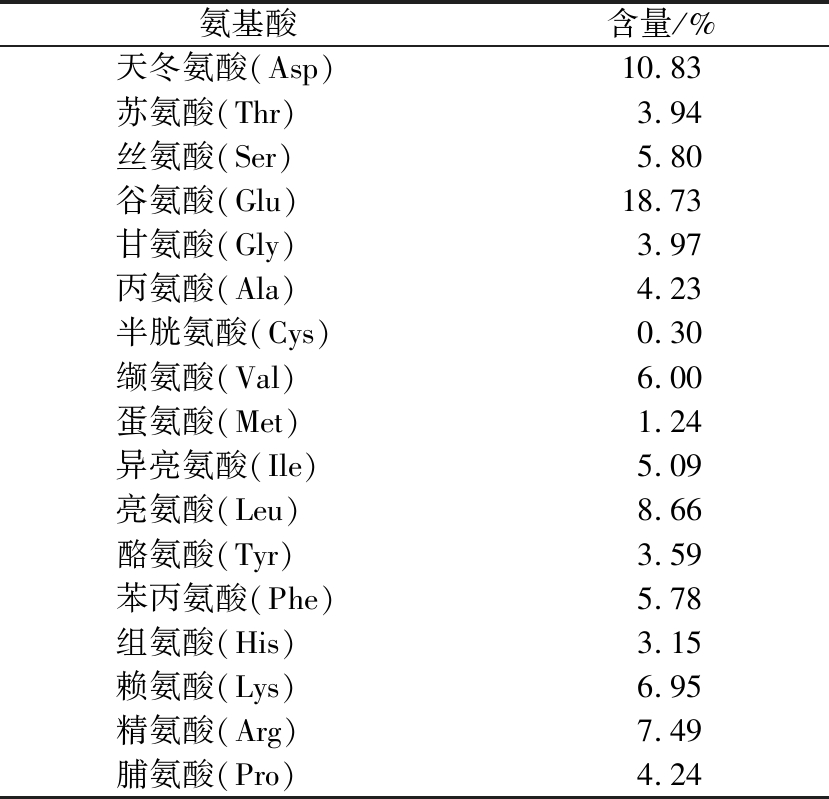
氨基酸含量/%天冬氨酸(Asp)10.83 苏氨酸(Thr)3.94 丝氨酸(Ser)5.80 谷氨酸(Glu)18.73 甘氨酸(Gly)3.97 丙氨酸(Ala)4.23 半胱氨酸(Cys)0.30 缬氨酸(Val)6.00 蛋氨酸(Met)1.24 异亮氨酸(Ile)5.09 亮氨酸(Leu)8.66 酪氨酸(Tyr)3.59 苯丙氨酸(Phe)5.78 组氨酸(His)3.15 赖氨酸(Lys)6.95 精氨酸(Arg)7.49 脯氨酸(Pro)4.24
2.2 山药蛋白肽对免疫能力低下小鼠体重增长率和免疫器官的影响
2.2.1 山药蛋白肽对免疫能力低下小鼠体重的影响
山药蛋白肽对各组小鼠体重增长率的影响结果见表3。
表3 山药蛋白肽对免疫能力低下小鼠体重的影响
Table 3 Effect of IYPs on body weight of immunocompromised mice
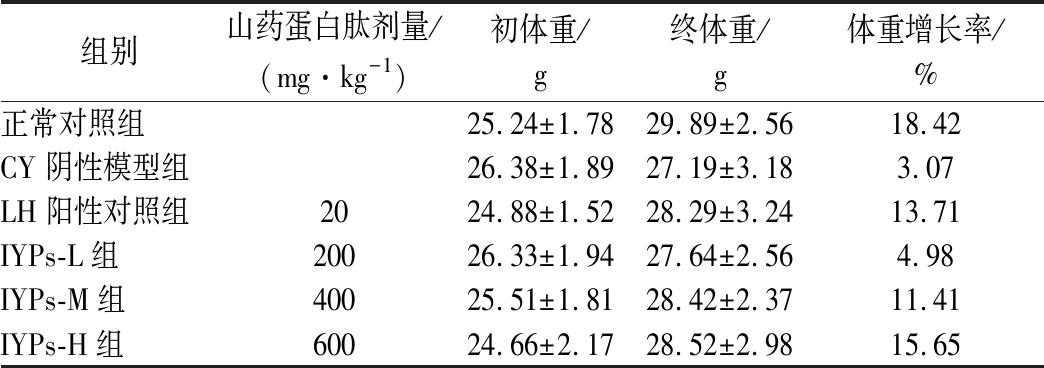
组别山药蛋白肽剂量/(mg·kg-1)初体重/g终体重/g体重增长率/%正常对照组25.24±1.7829.89±2.5618.42 CY阴性模型组26.38±1.8927.19±3.183.07 LH阳性对照组2024.88±1.5228.29±3.2413.71 IYPs-L组20026.33±1.9427.64±2.564.98 IYPs-M组40025.51±1.8128.42±2.3711.41 IYPs-H组60024.66±2.1728.52±2.9815.65
体重增长率能直接或间接反映出机体健康状况。小鼠体重增长率的下降也是免疫能力低下模型造模成功的标志[19-20]。由表3可知,与正常组相比,其他组别的体重增长率均有不同程度的下降,这表明免疫能力低下小鼠模型构建成功;山药蛋白肽低、中、高剂量组较阴性模型组的体重增长率均有所上升,且呈现量效关系。这说明山药蛋白肽对CY所导致的体重下降具有一定的恢复作用,可以改善免疫能力低下引起的体重下降。
2.2.2 山药蛋白肽对免疫能力低下小鼠免疫器官的影响
山药蛋白肽对各组小鼠免疫器官指数的影响结果见表4。
表4 山药蛋白肽对免疫能力低下小鼠的免疫器官指数影响
Table 4 Effect of IYPs on immune organ index in the immunocompromised mice
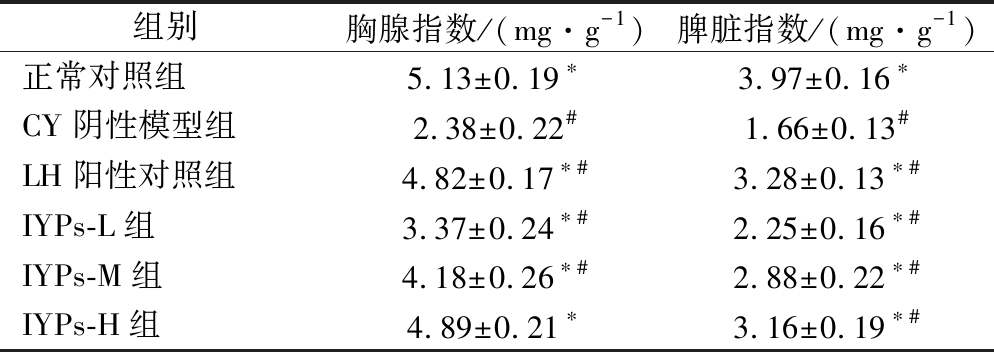
组别胸腺指数/(mg·g-1)脾脏指数/(mg·g-1)正常对照组5.13±0.19∗3.97±0.16∗CY阴性模型组2.38±0.22#1.66±0.13#LH阳性对照组4.82±0.17∗#3.28±0.13∗#IYPs-L组3.37±0.24∗#2.25±0.16∗#IYPs-M组4.18±0.26∗#2.88±0.22∗#IYPs-H组4.89±0.21∗3.16±0.19∗#
注:*为与阴性对照组差异显著,且P<0.05;#为与正常对照组差异显著,且P<0.05(下同)
机体免疫器官的发育和状态直接决定着免疫系统的应答能力[21-22]。目前,免疫器官指数是反映和评价机体免疫系统和免疫状态的重要指标之一[23]。由表4可知,与正常组相比,模型组的胸腺指数和脾脏指数显著下降,说明CY能抑制小鼠免疫器官的发育并诱发免疫器官发生萎缩;与CY阴性对照组相比,山药蛋白肽低、中、高剂量组的小鼠胸腺指数和脾脏指数均有不同程度的改善,且呈现量效关系,山药蛋白肽高剂量组和正常组的胸腺指数并无显著性差异(P>0.05)。这表明山药蛋白肽能明显缓解CY构建的免疫能力低下小鼠免疫器官的萎缩,并促进其发育,增强免疫能力。
2.2.3 山药蛋白肽对免疫能力低下小鼠脾脏病理学切片的影响
脾脏是机体最大的淋巴器官,也是血液循环中的过滤器官,按组织结构可分为白髓和红髓两部分[24]。白髓是T、B淋巴细胞的集中之处,主要发挥防御外界微生物感染的作用。红髓位于白髓周围,由脾索和脾窦组成,能够发挥过滤血液、清除凋亡细胞和吞噬病原体的功能[25]。脾脏发挥生物功能的基础是完整、正常的网状组织结构。研究结果显示正常组脾脏结构中的红髓和白髓的界限明显,脾索所形成的网状结构均匀,所围成的脾窦分布均匀,在光镜下无肉眼可见的病理变化;阴性对照组脾脏结构的红髓和白髓界限消失,脾索所围成的网状结构遭到严重破坏,几乎变成了单一的组织细胞,脾窦明显变大;与阴性对照组相比,山药蛋白肽低剂量组的脾脏网状结构有所恢复,但是仍存在脾窦增大,红髓白髓界限明显;山药蛋白肽中剂量组的脾脏网状结构较为明显,脾窦变窄,红髓白髓界限清晰;山药蛋白肽高剂量组的脾脏结构中红髓白髓界限清晰,脾索所形成的网状结构较为质密均匀,脾窦分布较为均匀。结果表明山药蛋白肽对环磷酰胺导致的小鼠脾脏的病理变化有显著的改善作用,并呈现量效关系。
2.3 山药蛋白肽对免疫能力低下小鼠免疫细胞的影响
2.3.1 山药蛋白肽对免疫能力低下小鼠腹腔巨噬细胞活力的影响
山药蛋白肽对小鼠腹腔巨噬细胞中LDH和ACPase酶活性的影响结果见表5。
表5 山药蛋白肽对免疫能力低下小鼠脾脏LDH、ACPase活性的影响
Table 5 Effect of IYPs on LDH、ACPase activity in the spleen of mice with impaired immunity
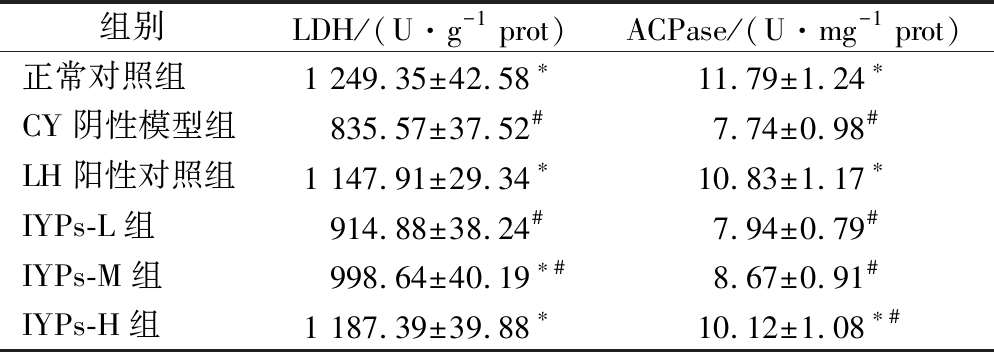
组别LDH/(U·g-1 prot)ACPase/(U·mg-1 prot)正常对照组1 249.35±42.58∗11.79±1.24∗CY阴性模型组835.57±37.52#7.74±0.98#LH阳性对照组1 147.91±29.34∗10.83±1.17∗IYPs-L组914.88±38.24#7.94±0.79#IYPs-M组998.64±40.19∗#8.67±0.91#IYPs-H组1 187.39±39.88∗10.12±1.08∗#
乳酸脱氢酶活性直接影响机体胞内细胞糖酵解释放能量的速率[26]。巨噬细胞吞噬作用所需的能量也来源于糖酵解,并且LDH催化糖酵解的过程中会产生大量的乳酸,从而引起巨噬细胞胞内pH值下降,有利于巨噬细胞胞内免疫活性物质和免疫功能的应答[27]。酸性磷酸酶是高等动物巨噬细胞中溶酶体酶系的标志酶之一[28]。当外界病原体入侵机体时,巨噬细胞能发挥识别功能并启动免疫应答机制吞噬病原体进行胞内裂解,而以ACPase为主的溶菌体酶是发挥胞内裂解的主要物质[29]。因此,LDH和ACPase酶是巨噬细胞活力的标志酶,其活性反映了巨噬细胞的活化能力和非特异性免疫水平。由表5可知,与正常组相比,阴性对照组的LDH、ACPase酶活性显著降低(P<0.05),表明环磷酰胺对腹腔巨噬细胞中的LDH、ACPase酶活性有显著的抑制作用;与模型组相比,山药蛋白肽中、高剂量组均可显著提高脾脏中LDH酶活性(P<0.05),并且山药蛋白肽高剂量组的脾脏LDH酶活力和正常组无显著性差异(P>0.05);山药蛋白肽高剂量组可显著提高脾脏中ACPase酶活性(P<0.05)。结果表明山药蛋白肽可以在一定程度上缓解免疫能力低下小鼠脾脏中LDH、ACPase酶活性的降低,提高巨噬细胞活力,从而增强免疫能力。
2.3.2 山药蛋白肽对免疫能力低下小鼠淋巴细胞增殖的影响
山药蛋白肽对免疫能力低下小鼠淋巴细胞增殖能力的影响结果见图1。
淋巴细胞增殖是细胞免疫和体液免疫级联反应中的重要环节。淋巴细胞的增殖能力在一定程度上反映了淋巴细胞功能的高低,也一定程度体现了机体体液免疫的能力[30]。由图1可知,与正常组相比,CY阴性对照组的淋巴细胞增殖能力显著下降(P<0.05);与CY阴性对照组相比,山药蛋白肽低、中、高剂量组可以显著提升淋巴细胞增殖能力(P<0.05),并且山药蛋白肽高剂量组和正常组差异不显著(P>0.05)。结果表明山药蛋白肽可以显著缓解CY导致的免疫能力低下小鼠脾脏淋巴细胞增殖能力的降低,且呈现量效关系。
2.4 山药蛋白肽对免疫能力低下小鼠免疫活性物质的影响
2.4.1 山药蛋白肽对免疫能力低下小鼠白介素水平的影响
山药蛋白肽对免疫能力低下小鼠血清白介素水平的影响结果见表6。
表6 山药蛋白肽对免疫能力低下小鼠血清白介素水平的影响
Table 6 Effect of IYPs on serum interleukin in the immunocompromised mice
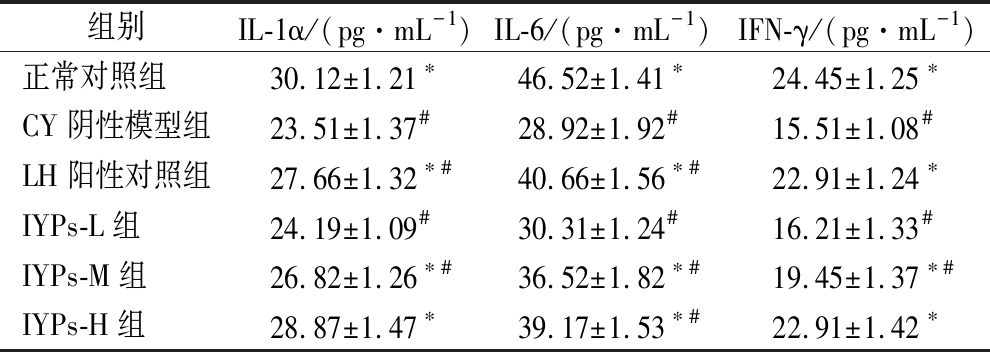
组别IL-1α/(pg·mL-1)IL-6/(pg·mL-1)IFN-γ/(pg·mL-1)正常对照组30.12±1.21∗46.52±1.41∗24.45±1.25∗CY阴性模型组23.51±1.37#28.92±1.92#15.51±1.08#LH阳性对照组27.66±1.32∗#40.66±1.56∗#22.91±1.24∗IYPs-L组24.19±1.09#30.31±1.24#16.21±1.33#IYPs-M组26.82±1.26∗#36.52±1.82∗#19.45±1.37∗#IYPs-H组28.87±1.47∗39.17±1.53∗#22.91±1.42∗
IL-1α是IL-1家族中的典型代表之一,又称淋巴细胞活化因子,在免疫和炎症反应及机体生长代谢方面有着不可或缺的功能[31]。IL-6是由机体多种免疫细胞产生的一种糖蛋白,主要作用的靶细胞是B淋巴细胞,又称为B细胞刺激因子。IFN-γ是特异性免疫的调节剂,能诱导Th0型细胞分化成Th1型细胞,并且能激活巨噬细胞、细胞毒性T细胞和清除胞内病原体[32]。由表6可知,与正常组相比,CY阴性对照组的血清IL-1α、IL-6、IFN-γ均显著下降(P<0.05),这表明CY可引起机体白介素水平的显著下降,降低机体免疫防御能力;与阴性对照组相比,山药蛋白肽中、高剂量组可以显著提升IL-1α、IL-6、IFN-γ水平(P<0.05),且高剂量组IL-1α和IFN-γ水平和正常组无显著性差异(P>0.05)。结果表明山药蛋白肽可以显著缓解CY导致的免疫能力低下小鼠体内白介素水平的降低,且呈现量效关系。
2.4.2 山药蛋白肽对免疫能力低下小鼠免疫球蛋白的影响
表7 山药蛋白肽对免疫能力低下小鼠血清IgG、IgM的影响
Table 7 Effect of IYPs on serum IgG、IgM in the immunocompromised mice

组别IgG/(pg·mL-1)IgM/(pg·mL-1)正常对照组14.56±0.44∗1.94±0.08∗CY阴性模型组8.62±0.31#1.19±0.07#LH阳性对照组11.39±0.24∗#1.74±0.06∗#IYPs-L组9.67±0.41∗#1.31±0.14∗#IYPs-M组10.28±0.19∗#1.44±0.07∗#IYPs-H组11.14±0.37∗#1.79±0.11∗
IgG是体液免疫应答所产生的主要抗体,约占血清中抗体总量的80%,具有抗菌、中和病毒及免疫调节等生物活性[33]。IgM是机体初次免疫应答中分泌最早的抗体,在抵御原发性感染的过程中发挥着重要作用[34]。由表7可知,与正常组相比,CY阴性对照组的IgG水平显著下降(P<0.05),这说明CY可以抑制机体IgG、IgM的分泌和表达;与CY阴性对照组相比,山药蛋白肽低、中、高剂量组可以显著提升IgG、IgM水平(P<0.05),且山药蛋白肽高剂量组IgM水平和正常组无显著性差异(P>0.05)。结果表明山药蛋白肽可以显著缓解CY导致的免疫能力低下小鼠体内免疫球蛋白水平的降低,且呈现量效关系。
食源性肽的免疫活性受肽的氨基酸组成、序列、长度、电荷和结构[35]所影响。AHN[36]和HE[37]的研究表明,肽的免疫学活性与其包含丰富的疏水性氨基酸有关,这是因为疏水基团可以和细胞膜相互作用,促使其免疫活性增强,且具有免疫活性的肽末端多是碱性的氨基酸。同时VO等[38]的研究表明当肽链的氨基酸残基上具有一个或多个谷氨酰胺、谷氨酸、酪氨酸、色氨酸、半胱氨酸和天冬氨酸等时,能促进食源性肽的免疫调节活性。因此,疏水性氨基酸和碱性氨基酸的含量高低对免疫活性具有重要的作用。通过氨基酸组成分析发现山药蛋白肽含有极其丰富的疏水性氨基酸和碱性氨基酸,且谷氨酸和天冬氨酸含量较高。这可能是山药蛋白肽具有极佳免疫活性的构效原因之一。
3 结论
本课题采用隔天皮下注射CY制造免疫功能低下小鼠模型,通过口腔灌胃不同剂量的山药蛋白肽,并与空白对照组、阴性对照组相比较,测定山药蛋白肽的氨基酸组成及其对机体免疫系统(免疫器官、免疫细胞和免疫活性物质)的影响。结果表明,山药蛋白肽含有极其丰富的疏水性氨基酸和碱性氨基酸;且能提高CY诱导免疫能力低下小鼠的体重生长率、免疫器官指数和改善脾脏病理学变化;提高免疫能力低下小鼠体内LDH酶、ACPase酶活性和脾脏淋巴细胞增殖能力;同时能提高免疫能力低下小鼠的细胞因子(IL-1α、IL-6、IFN-γ)和免疫球蛋白(IgG、IgM)的水平,且呈现量效关系。这表明山药蛋白肽可以通过促进免疫能力低下小鼠的中枢和外周免疫器官的发育、改善机体免疫细胞状态、调节体内免疫活性物质的分泌表达,提高机体免疫能力,发挥其免疫活性。
参考文献
[1] ZHAO T, YUN F, JING L, et al. Schisandra polysaccharide evokes immunomodulatory activity through TLR 4-mediated activation of macrophages [J]. International Journal of Biological Macromolecules, 2014, 65(5):33-40.
[2] TOOPCHAM T, MES J J, WICHERS H J, et al. Immunomodulatory activity of protein hydrolysates derived from Virgibacillus halodenitrificans, SK1-3-7 proteinase[J]. Food Chemistry, 2017, 224:320-328.
[3] NONGONIERMA A B, PAOLELLA S, MRDGIL P, et al. Identification of novel dipeptidyl peptidase IV (DPP-IV) inhibitory peptides in camel milk protein hydrolysates[J]. Food Chemistry, 2018, 244:340-348.
[4] VANEGAS S M, MEYDANI M, BARNETT J B, et al. Substituting whole grains for refined grains in a 6-wk randomized trial has a modest effect on gut microbiota and immune and inflammatory markers of healthy adults[J]. American Journal of Clinical Nutrition, 2017, 105(3):635-650.
[5] NDIAYE F, VUONG T, DUARTE J, et al. Anti-oxidant, anti-inflammatory and immunomodulating properties of an enzymatic protein hydrolysate from yellow field pea seeds[J]. European Journal of Nutrition, 2012, 51(1):29-37.
[6] GAUTHIER S F, POULIOT Y, SAINTSAUVEUR D. Immunomodulatory peptides obtained by the enzymatic hydrolysis of whey proteins[J]. International Dairy Journal, 2006, 16(11):1 315-1 323.
[7] YANG R Y, ZHANG Z F, PEI X R, et al. Immunomodulatory effects of marine oligopeptide preparation from Chum Salmon (Oncorhynchus keta) in mice[J]. Food Chemistry, 2009, 113(2):464-470.
[8] HORIGUCHI N, HORIGUCHI H, SUZUKI Y. Effect of wheat gluten hydrolysate on the immune system in healthy human subjects[J]. Bioscience Biotechnology & Biochemistry, 2005, 69(12):2 445-2 449.
[9] KIM E K, KIM Y S, HWANG J W, et al. Purification of a novel nitric oxide inhibitory peptide derived from enzymatic hydrolysates of Mytilus coruscus[J]. Fish & Shellfish Immunology, 2013, 34(6):1 416-1 420.
[10] NAGAI T, SUZUKI N, TANOUE Y, et al. Antioxidant and antihypertensive activities of autolysate and enzymatic hydrolysates from yam (Dioscorea opposita Thunb.) ichyoimo tubers[J]. Journal of Food Agriculture & Environment, 2007, 5(3):64-68.
[11] YANG W, WANG Y, LI X, et al. Purification and structural characterization of Chinese yam polysaccharide and its activities[J]. Carbohydrate Polymers, 2015, 117:1 021-1 027.
[12] 叶春苗. 山药多糖提取、分离与纯化工艺研究[J]. 农业科技与装备, 2017, 282(12):30-32.
[13] 姬泓巍, 郭会芹, 张晶,等. 山药多糖提取分离工艺的研究[J]. 中国海洋大学学报(自然科学版), 2010, 40(7):89-92.
[14] 杨蕊, 韩涛, 王富贵, 等. 山药糖蛋白对α-葡萄糖苷酶的体外抑制作用研究[J]. 中国食品学报, 2012, 12(2):30-34.
[15] 李小强. 山药蛋白酶解多肽液及多肽酒制备工艺研究[D].武汉:湖北工业大学,2012:5-10.
[16] 饶铖乐. 怀山药多肽的制备及性质研究[D].武汉:湖北工业大学,2013:6-12.
[17] 朱玉端,李小强,董怀灿, 等. 双酶法酶解制备怀山药多肽的研究[J].食品工业,2012,33(9):80-82.
[18] 徐梦辰,丁轲,吕莹, 等.山药蛋白酶解条件及其响应面法的优化[J].中国粮油学报,2015,30(12):27-32.
[19] 陈文超, 钟森, 黄骏, 等. 鱼王浆对免疫功能低下模型小鼠体重及胸腺的影响[J]. 湖北中医药大学学报, 2011, 13(6):11-12.
[20] 高敏. 不同条件环磷酰胺建立小鼠免疫力低下模型的比较及偏最小二乘法(PLS)数学建模分析[J]. 中国比较医学杂志, 2015, 25(9):62-69.
[21] MAURER N, FENSKE D B, CULLIS P R. Developments in liposomal drug delivery systems[J]. Expert Opinion on Biological Therapy, 2001, 1(6):923-947.
[22] MENG F, XU P, WANG X, et al. Investigation on the immunomodulatory activities of Sarcodon imbricatus extracts in a cyclophosphamide (CTX)-induced immunosuppressanted mouse model[J]. Saudi Pharmaceutical Journal, 2017, 25(4):460-463.
[23] 帅学宏, 胡庭俊, 曾芸, 等. 山豆根多糖对免疫抑制模型小鼠免疫器官指数和自由基相关酶活性的影响[J]. 南京农业大学学报, 2009, 32(2):170-172.
[24] 王燕娟, 曹建平. 脾脏白髓结构特征以及维持其完整性的分子机制[J]. 国际医学寄生虫病杂志, 2011, 38(2):80-84.
[25] 李平乐. 非洲鸵鸟主要免疫器官的解剖组织学观察及生理功能的初步研究[D]. 郑州:河南农业大学, 2009:4-5.
[26] ROGATZKI M J, FERGUSON B S, GOODWIN M L, et al. Lactate is always the end product of glycolysis[J]. Frontiers in Neuroscience, 2015, 9:22.
[27] 张树华. 抑制糖酵解途径对胰腺癌细胞PANC-1生物学特性的影响及其机制的研究[D]. 武汉:华中科技大学, 2009:10-14.
[28] OU B, ABE K, CHEN H B, et al. Acid phosphatase localization in accumulated membranous organelles of optic nerve axons following acute elevation of intraocular pressure[J]. Japanese Journal of Ophthalmology, 1998, 42(5):373.
[29] 魏炜, 张洪渊, 石安静. 育珠蚌酸性磷酸酶活力与免疫反应关系的研究[J]. 水生生物学报, 2001, 25(4):413-415.
[30] 聂健, 王冀邯. 运动对大鼠脾脏T淋巴细胞增殖及T细胞亚群的影响研究[J]. 中国免疫学杂志, 2015(4):477-479.
[31] 张胤晟. 入核型IL-1α propiece分子调控机制研究[D]. 苏州:苏州大学,2016:1-10.
[32] 相慧. 番鸭白细胞介素-6基因的克隆与序列分析[D]. 福州:福建农林大学, 2011:8-12.
[33] 王骏俊. 鸡血清IgG的纯化及其单抗制备与鉴定[D]. 合肥:安徽农业大学, 2010:2-12.
[34] 张婧,章萍萍,祁培培, 等.人IgMμ链恒定区各肽段的基因合成原核表达及免疫原性分析[J].安徽医科大学学报,2013,48(9):995-1 000.
[35] KIEWIET M, FAAS M, VOS P D. Immunomodulatory Protein Hydrolysates and Their Application[J]. Nutrients, 2018, 10(7):904.
[36] AHN C B, CHO Y S, JE J Y. Purification and anti-inflammatory action of tripeptide from salmon pectoral fin byproduct protein hydrolysate[J]. Food Chemistry, 2015, 168:151-156.
[37] HE X Q, CAO W H, PAN G K, et al. Enzymatic hydrolysis optimization of Paphia undulata and lymphocyte proliferation activity of the isolated peptide fractions[J]. Journal of the Science of Food & Agriculture, 2015, 95(7):1 544-1 553.
[38] VO T S, RYU B M, KIM S K. Purification of novel anti-inflammatory peptides from enzymatic hydrolysate of the edible microalgal Spirulina maxima[J]. Journal of Functional Foods, 2013, 5(3):1 336-1 346.







