玫瑰香葡萄,甜中带酸,玫瑰香味浓郁,深受人们的喜爱。因其果皮较薄、果汁含量较高导致贮藏时间较短[1],给采后新鲜葡萄的贮运和延长售卖时间带来困难,造成很大的经济损失[2-3]。
目前,国际上葡萄商业化贮藏普遍采用向冷库中通SO2的方式进行葡萄保鲜,一般这种方法可使葡萄贮藏期在2~3个月[4]。传统的玫瑰香葡萄保鲜方式为SO2化学保鲜剂,关筱歆等[5]采用冰温和CT保鲜剂贮藏玫瑰香葡萄,降低了葡萄的MDA含量,减缓了果实的衰老。朱志强等[6]发现8 g CT2保鲜剂+1 g CT5保鲜剂处理对玫瑰香葡萄保鲜效果最好。刘丽青等[7]发现SO2保鲜剂不仅能够延长玫瑰香葡萄的贮藏时间,提高葡萄花色苷的含量。但化学保鲜剂释放SO2浓度控制难度大,在贮藏过程中果梗容易出现褐变及果实表面有少量漂白现象,残留的SO2会对食品安全造成隐患[8-17]。研究学者一直在探究确定葡萄贮藏中SO2最佳使用剂量,以防止使用SO2而引起的药害[18-22]。探讨减少或取代SO2制剂的绿色方法、技术和产品,研发新的葡萄保鲜模式是亟待解决的问题。因此,本实验在SO2保鲜剂的基础上结合了绿色的保鲜方式(1-MCP,O3、ClO2)的保鲜处理,不仅减少了对化学保鲜剂的使用,而且能更好地保证玫瑰香原有的风味和色泽,减少玫瑰香葡萄的营养损失。
供试材料为充分成熟的玫瑰香葡萄,采自山东平度大泽山。内衬PE保鲜袋包装后放入筐内(每筐重3.5 kg),采用冷藏车(4 ℃,80%相对湿度) 于2018年9月10日运至国家农产品保鲜工程技术研究中心后,打开袋口放入温度为-0.5~-0.2 ℃的条件下预冷16 h,预冷至0~-1 ℃后用保鲜剂进行处理。实验所用葡萄保鲜剂、PE保鲜袋均为国家农产品保鲜工程技术研究中心生产或研制。
主要试剂:NaOH、葡萄糖、酒石酸钾钠、邻苯二酚、聚乙烯吡咯烷酮、聚乙二醇6000、Triton X-100、冰醋酸、无水醋酸钠、乙二胺四乙酸(EDTA)、愈创木酚,均为分析纯。
FA1004上皿电子天平,上海荆轲天平;PBI Dan-sensor残氧仪,丹麦丹圣公司;TA- XT plus质构仪,英国SMS 公司;TA- XT plus酸度计,北京金科利达电子科技有限公司;PAL-1手持式糖度计,日本ATAGO公司;DK-98-IIA电热恒温水浴锅,天津市泰斯特仪器有限公司;3-30K 高速冷冻离心机,德国Sigma 公司;UV-1780紫外可见分光光度计,岛津仪器(苏州)有限公司。
将预冷好的玫瑰香葡萄随机分成4组,每组200 kg,重新装入内衬20 μmP E袋 里后放入筐内,分别用4种不同的方式 处理,然后扎口,放入(-0.5±0.5)℃冷库中贮藏。4种处理分别如下:CT+O3 10.72 mg/m3、1 h;记作:CT +O3;CT+ClO2 32.16 mg/m3、1 h,记作:CT+ClO2;CT+1-MCP、24 h,记作:CT+1-MCP;对照组CT(CT2 10包+CT5 4包)。处理组中CT为CT2 5包+CT5 2包,比传统使用方法药量减少50%。
在玫瑰香葡萄保鲜处理之前进行初值指标测定,之后每隔15 d对每个处理的玫瑰香葡萄分别取样测相关指标,每个实验指标进行3次生物学重复,实验进行5个周期(不含初值实验)。每个周期的实验材料有新鲜样品和冻样(冻样指用液氮冷冻后放冰箱备用的样品)。
1.3.1 腐烂率、落粒率、漂白率
每次随机取8 kg葡萄对腐烂率、落粒率、漂白率进行观测,如公式(1)~公式(3)所示:
腐烂率![]()
(1)
落粒率![]()
(2)
漂白率![]()
(3)
1.3.2 呼吸强度
分别将4种处理的葡萄各取300 g左右于2 000 mL罐中,然后盖上盖子密封(盖子需有小孔,用胶带封住小孔方便测气体)4 h后,用残氧仪测罐中CO2和O2浓度,呼吸强度计算如公式(4)所示:
(4)
式中:Q,呼吸强度,mg CO2 /(kg·h);V,CO2百分含量;V1:瓶的体积;ρ,样品的密度,g/cm3;m,样品质量,g;t,闷罐时间,h。
1.3.3 硬度
每个处理,分别从不同果穗上随机取20粒,用物性测定仪测定[23],单位以“N”表示,测取平均值。
1.3.4 果梗耐拉力
在整串葡萄的中部选取果粒形态大小均匀的果粒,用NK10指针式推拉力计测定果梗耐拉力,单位以“N”表示。4种处理分别选取15个果粒,并分别求取平均值。
1.3.5 可溶性固形物
每个处理分别需20粒葡萄,榨汁后经纱布过滤,用手持式糖度计测定滤液中可溶性固形物含量,重复做3次,算出平均值,单位用“%”表示。每次测值前都应用蒸馏水将糖度计调零。
1.3.6 可滴定酸
每个处理分别取30粒葡萄,打浆,用纱布过滤,分别取1.37 mL滤液3次,分别加入3个盛有30 mL蒸馏水的小瓶中,加盖后摇匀。用酸度计对酒石酸进行测定,每个小瓶测1次,共测3次,取平均值,单位以“%”表示。
1.3.7 还原糖[23]
还原糖的测定:称取冻样5 g于研钵中磨细,借助蒸馏水移入100 mL烧杯中于80 ℃水浴中加热20 min,冷却后用蒸馏水定容至200 mL,然后用脱脂棉过滤,将此样品注入滴定管中,于250 mL三角瓶中,添加加斐林试剂A、B各5 mL后混入20 mL蒸馏水, 将样品滤液预先滴加到A、B混合液中,加热到沸腾1.5 min后,加入2滴次甲基蓝指示剂,隔半分钟继续滴加样品滤液,直至混合液呈砖红色为止,计算如公式(5)所示:
(5)
式中:K,每毫升斐林试剂混合液相当于葡萄糖克数;G,葡萄糖质量,g;T,葡萄糖消耗的体积,mL;W,葡萄糖定容体积,mL;10,吸取斐林试剂A、B的总毫升数。
1.3.8 过氧化物酶(POD)活性
参考曹建康等[23]的方法测定,过氧化物酶活性每分钟反应体系在波长470 nm出吸光度值读数变化增加1所需的酶量为1个活性单位,U/g。
1.3.9 抗坏血酸过氧化物酶(APX)活性
参考曹建康等[23]的方法测定,每克果蔬样品(鲜重)在波长290 nm处吸光度值降低0.01为1个酶活单位,U/g。
1.3.10 多酚氧化酶(PPO)活性
参考曹建康等[23]的方法测定,每克果蔬样品(鲜重)每分钟吸光度变化值1为1个活性单位,U/g。
采用Microsoft Office Excel 2016 进行统计、绘图;用SPSS 18.0 软件进行LSD显著性分析。
在葡萄贮藏期间主要靠呼吸作用维持正常的生理代谢,是对其进行采后生理研究的重要指标。如图1所示,玫瑰香葡萄4种处理在0~15 d时呼吸强度都有所升高,这个时期CT处理的化学保鲜剂在保鲜初期还没有释放出最佳的浓度抑制葡萄的呼吸作用,CT+O3、CT+ClO2、CT+1-MCP三种处理的化学保鲜剂与添加的O3、ClO2、1-MCP没有达到最优结合来抑制葡萄的呼吸作用。15~45 d时,保鲜剂开始发挥作用,开始有效地抑制了葡萄的呼吸。由于葡萄属于呼吸非跃变形果蔬,在第60天时果梗的衰老造成呼吸高峰。由图1可看出,只添加化学保鲜剂的CT处理在达到呼吸高峰之前,也就是45 d时,呼吸强度最大,为7.24 mg CO2/(kg·h),而化学保鲜剂结合ClO2的CT+ClO2处理在30~75 d最有效抑制了葡萄的呼吸强度,能更有效地对玫瑰香葡萄发挥保鲜作用。

图1 不同保鲜处理对玫瑰香葡萄呼吸强度的影响
Fig.1 Effects of different fresh-keeping treatments on respiration intensity of Muscat Hamburg grapes
硬度是反应葡萄在受外力的作用下,由弹性形变到被压破,所承受力大小的一个重要指标。由图2可以看出,4种玫瑰香葡萄的硬度均有所下降,其中CT+ClO2处理的玫瑰香葡萄硬度始终高于其他3种处理,在贮藏15 d时,已有明显差异。贮藏处理后期CT处理的玫瑰香葡萄一直处于下降趋势,CT+O3处理组一直处于较低水平,CT+1-MCP处理组在贮藏30 d后下降速度较快,虽然整体波动起伏较大,贮藏75 d差异显著(P<0.05):CT+ClO2>CT+1-MCP>CT+O3>CT。整个试验过程,CT+ClO2较其他3种处理更好地维持了果实硬度。这可能是呼吸强度升高,代谢增强,固形物分解为可溶性固形物及果胶果胶降解导致的。CHEN等[24]发现草莓果实硬度与果胶降解酶蛋白和能量代谢蛋白有关,能量代谢蛋白和果胶代谢相关酶表达量越低,其硬度越高。张哲等[25]也发现,随着贮藏时间的延长,葡萄原果胶减少,可溶性果胶增加,导致果实变软腐败。
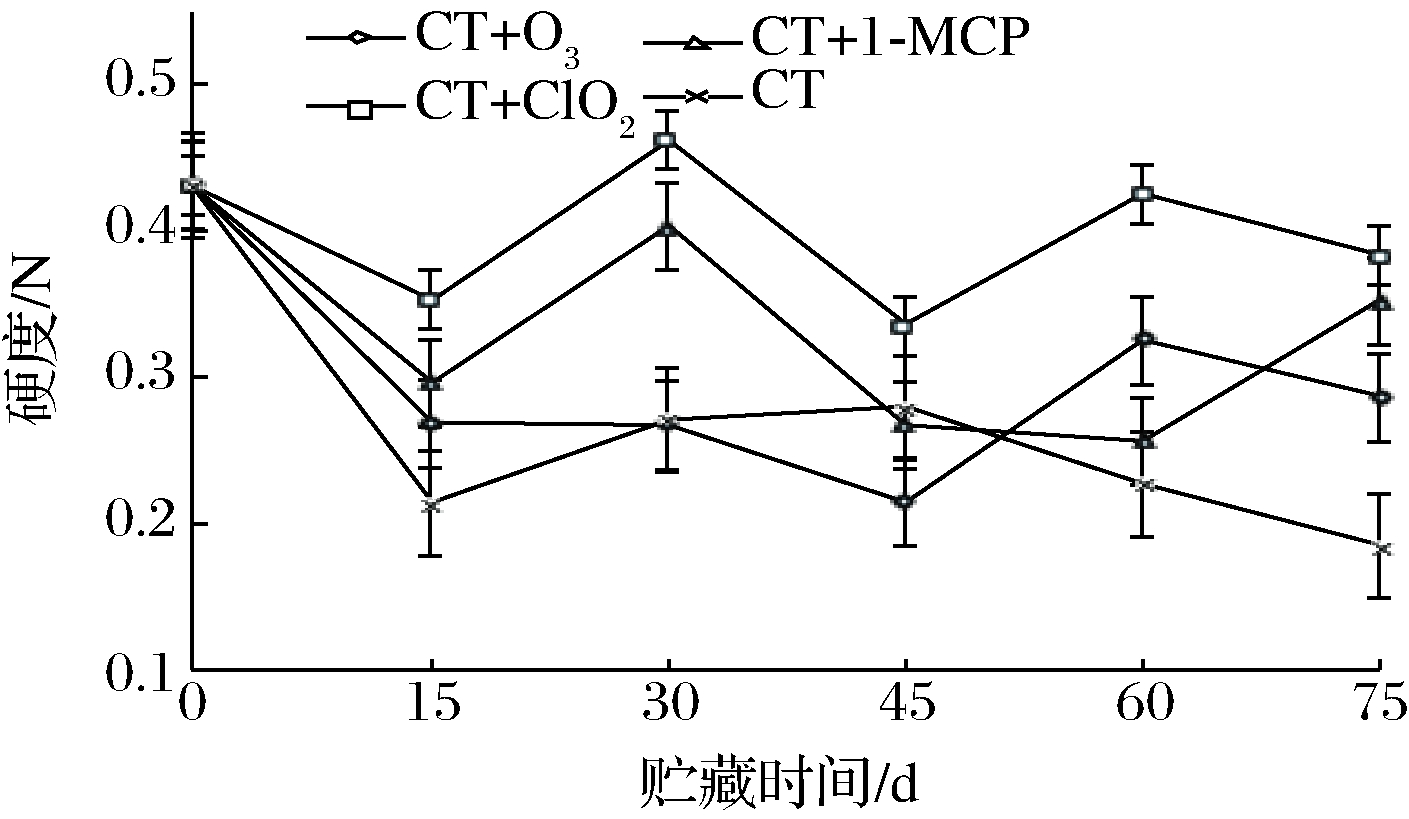
图2 不同保鲜处理对玫瑰香葡萄硬度的影响
Fig.2 Effects of different fresh-keeping treatments on the hardness of Muscat Hamburg grapes
果梗耐拉力是衡量葡萄果实与果梗连接强弱,葡萄是否容易脱粒的重要因素,是检验葡萄果实衰老的一个重要指标。图3中整体均处于下降趋势,CT+ClO2处理组先上升随后在15 d时呈下降趋势,CT组在贮藏期前30 d下降速度较快,随后虽缓慢上升,但在贮藏75 d时拉力值最低为1.41 N,CT+1-MCP处理组在前30 d拉力保持较好,在30 d后下降速度较快,在贮藏75 d是拉力值为1.48 N,而CT+O3拉力值在贮藏期间一直保持较低水平,因此结果表明CT+O3、CT+1-MCP与CT处理组对保持葡萄拉力值效果并不理想,CT+ClO2处理的耐拉力高于其他处理,75 d时果梗耐拉力还较60 d时有所上升。由此可看出CT+ClO2处理能有效地减缓果实的衰老。
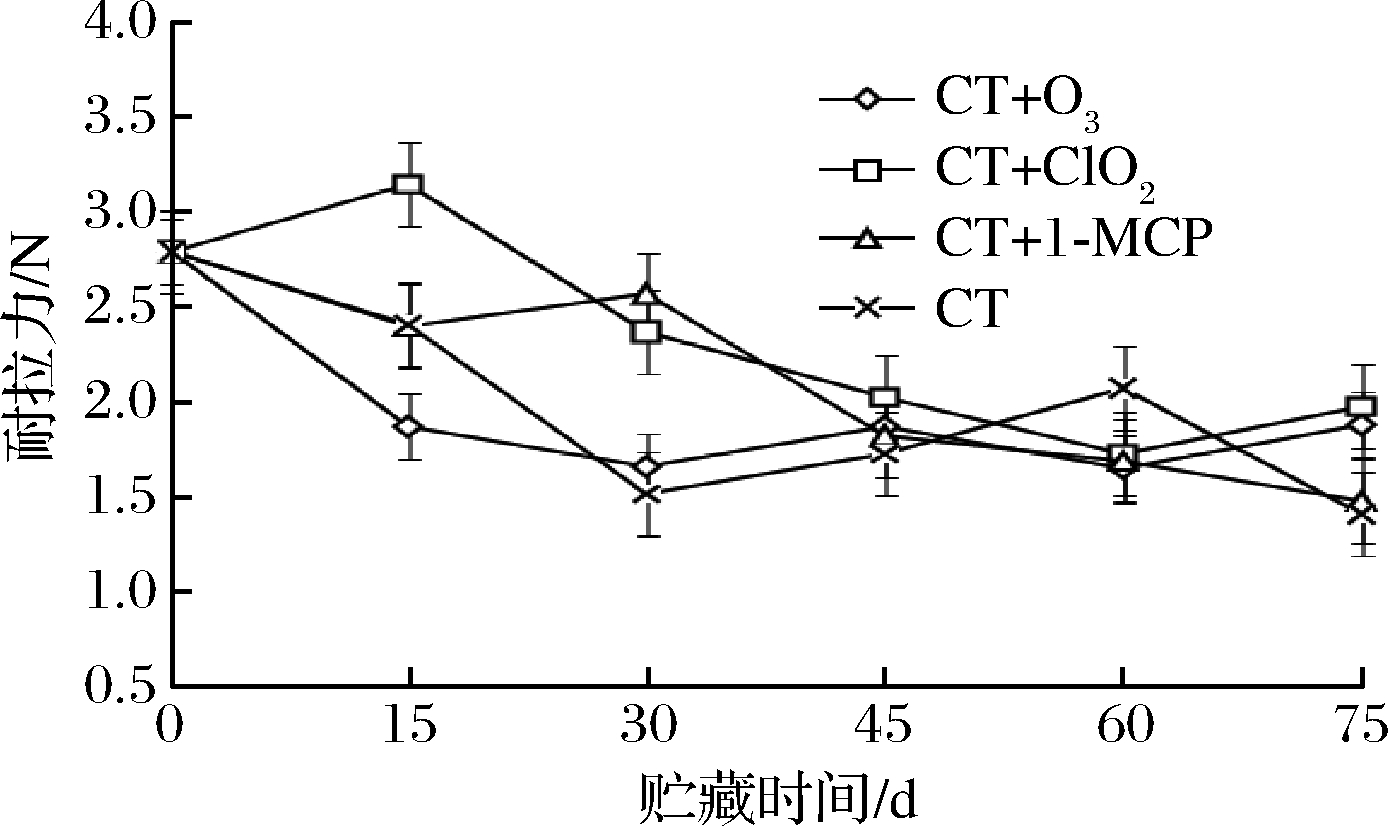
图3 不同保鲜处理对玫瑰香葡萄果梗耐拉力的影响
Fig.3 Effects of different fresh-keeping treatments on the tensile strength of Muscat Hamburg grapes
由图4可知4种处理玫瑰香可溶性固形物(total soluble solids,TSS)下降趋势都较小,CT组在贮藏前45 d变化趋势平缓,但在45 d后急剧下降,并不利于葡萄的长期贮藏,在处理后期的45~75 d,CT+ClO2处理的TSS值,一直明显高于其他处理组,差异显著(P<0.05)。在75 d时,CT+ClO2>CT+1-MCP>CT+O3>CT,说明CT+ClO2处理有利于玫瑰香葡萄TSS值维持在较高水平。

图4 不同保鲜处理对玫瑰香葡萄TSS的影响
Fig.4 Effects of different storage temperature on soluble solids contents of Muscat Hamburg grapes
可滴定酸(titratable acid,TA)值对于玫瑰香葡萄的口感和风味都有一定程度的影响。如图5所示,4种处理都处于先下降后上升的趋势,在60 d时都突然上升,可能由于化学保鲜剂SO2的释放速率不稳定所致,SO2释放量的升高导致酒石酸含量上升。由于CT+1-MCP处理的个体差异原因,整体趋势来看CT+1-MCP处理的TA值波动较大。CT+ClO2处理在30 d后急剧下降,在60 d时达到最低值为0.47%,虽在 60 d后有上升趋势,但TA值仍处于较低值效果并不理想。在第75天时,CT+O3的TA值较高于其他3种,但4种处理的TA值差异并不明显。

图5 不同保鲜处理对玫瑰香葡萄TA的影响
Fig.5 Effects of different storage temperature on titratable acid of Muscat Hamburg grapes
由图6可知,各种保鲜处理对于还原糖含量的影响并不大,整体还原糖含量呈上升趋势,可能由于贮藏后期玫瑰香葡萄水分的下降或淀粉类有机物物质转化成还原糖等因素有关,导致玫瑰香葡萄中还原糖含量的增加[26],CT处理在贮藏前30 d还原糖含量上升最快,但在贮藏30 d后急剧下降,第75天达到最低值为15.5%,贮藏效果并不理想,而CT+O3和CT+1-MCP处理在30 d后差异不显著(P>0.05),在贮藏30~60 d时优于CT+ClO2组,后期又稍微下降,说明已处于衰老状态。CT+ClO2组在15~60 d是一直处于下降趋势,第60天达到最低值15.2%,随后上升,第75天还原糖含量达到17.0%,因此CT+1-MCP在整个贮藏期间下降趋势较缓,有利于保持还原糖含量。
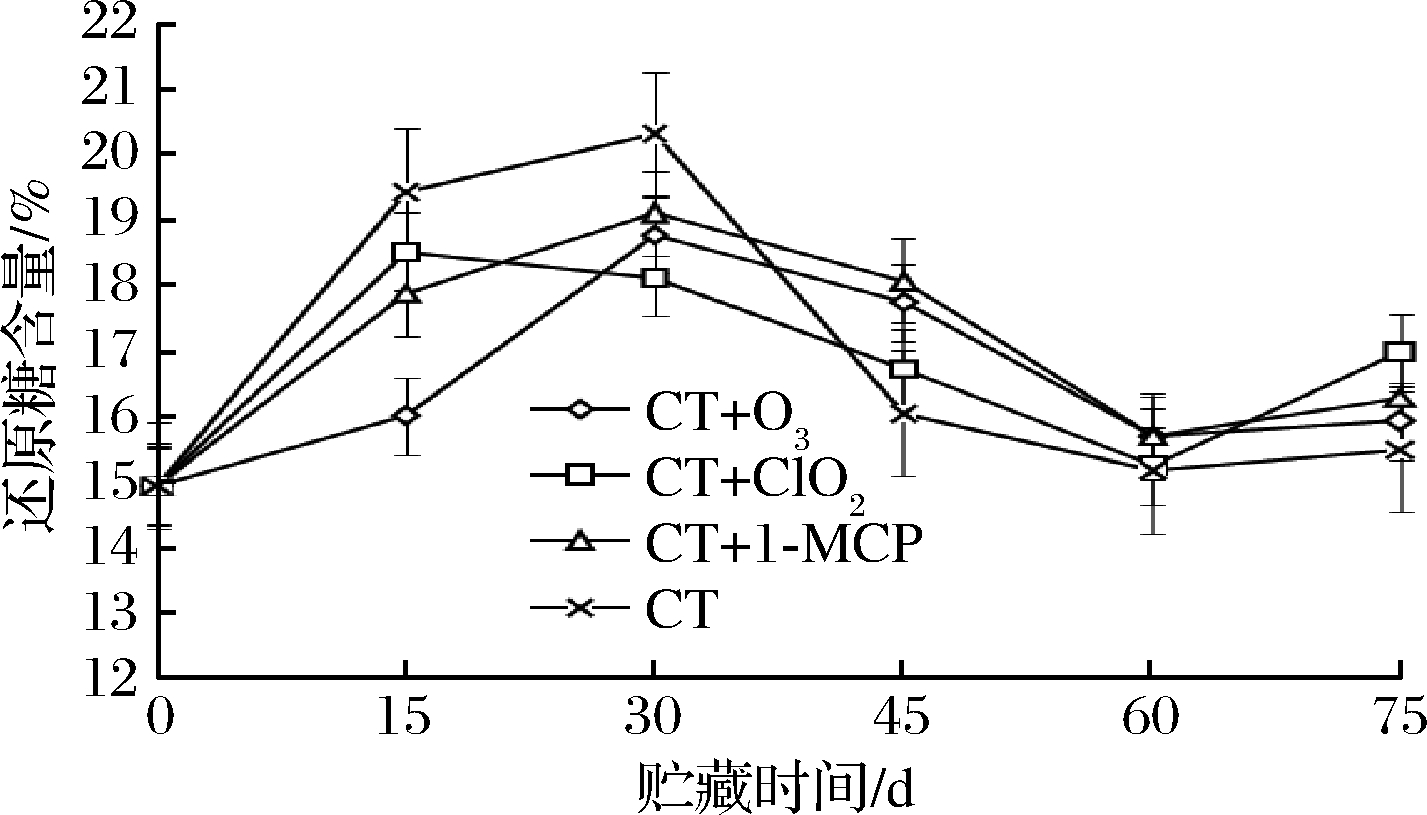
图6 不同保鲜处理对玫瑰香葡萄还原糖含量的影响
Fig.6 Effects of different fresh-keeping treatments on reducing sugar content of Muscat Hamburg grapes
POD是玫瑰香葡萄中H2O2的主要清除酶之一,可将H2O2降解为H2O和![]() 由于其不仅具有清除ROS(活性氧)的能力,还参与果蔬酶促褐变,可以催化酚类物质、谷胱甘肽、抗坏血酸的氧化,使果皮变色,在果蔬的生长发育和衰老等过程中POD活性不断变化[28]。由图7可以看出,各个处理的POD值都处于不断上升的趋势,其中CT+ClO2和CT+1-MCP在15 d时上升趋势明显大于CT+O3和CT。在30~75 d,CT+O3、CT+1-MCP、CT波动较大,CT+ClO2上升趋势较为平缓。贮藏后期45~75 d,CT+ClO2处理的POD明显优于其他处理组(P<0.05)。75 d时,CT+ClO2>CT+O3>CT+1-MCP>CT。由此可看出,从POD的发展趋势看,CT+ClO2处理方式最佳,延缓了玫瑰香葡萄的老化过程。
由于其不仅具有清除ROS(活性氧)的能力,还参与果蔬酶促褐变,可以催化酚类物质、谷胱甘肽、抗坏血酸的氧化,使果皮变色,在果蔬的生长发育和衰老等过程中POD活性不断变化[28]。由图7可以看出,各个处理的POD值都处于不断上升的趋势,其中CT+ClO2和CT+1-MCP在15 d时上升趋势明显大于CT+O3和CT。在30~75 d,CT+O3、CT+1-MCP、CT波动较大,CT+ClO2上升趋势较为平缓。贮藏后期45~75 d,CT+ClO2处理的POD明显优于其他处理组(P<0.05)。75 d时,CT+ClO2>CT+O3>CT+1-MCP>CT。由此可看出,从POD的发展趋势看,CT+ClO2处理方式最佳,延缓了玫瑰香葡萄的老化过程。
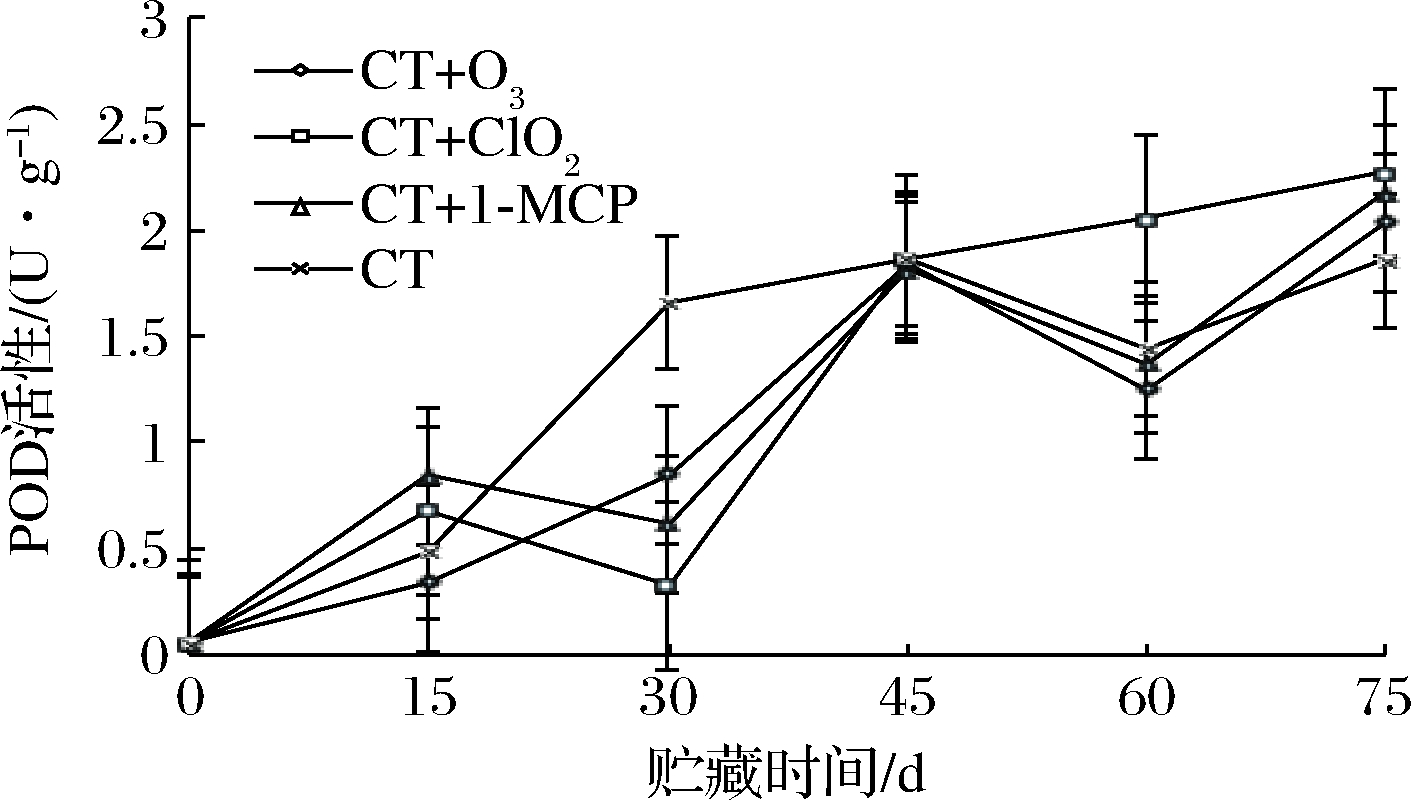
图7 不同保鲜处理对玫瑰香葡萄POD 活性的影响
Fig.7 Effects of different fresh-keeping treatments on POD activity of Muscat Hamburg grapes
由图8可知,第15天时,由于保鲜剂还没有达到保鲜效果最好的浓度,4种处理的初期保鲜效果和差异并不明显。30~60 d,CT+O3、CT+ClO2处理的APX活性变化趋势较于其他2种处理平缓;在这段时间内,30 d时,CT+ClO2>CT+1-MCP>CT>CT+O3;45 d时,CT+ClO2>CT+O3>CT+1-MCP>CT;60 d时,CT+ClO2>CT+O3>CT>CT+1-MCP,CT+ClO2处理的APX值高于其他3种处理。60~75 d,由于玫瑰香葡萄果实衰老,对葡萄中APX指标影响比较明显,4种处理的APX值都急剧下降,CT+O3处理的APX值在75 d时,显著高于其他处理组(P<0.05)。综合比较,于APX活性而言,CT+ClO2处理的保鲜效果好于其他3种,但在葡萄衰老期(75 d时),CT+O3处理的保鲜效果较优于其他3种处理。
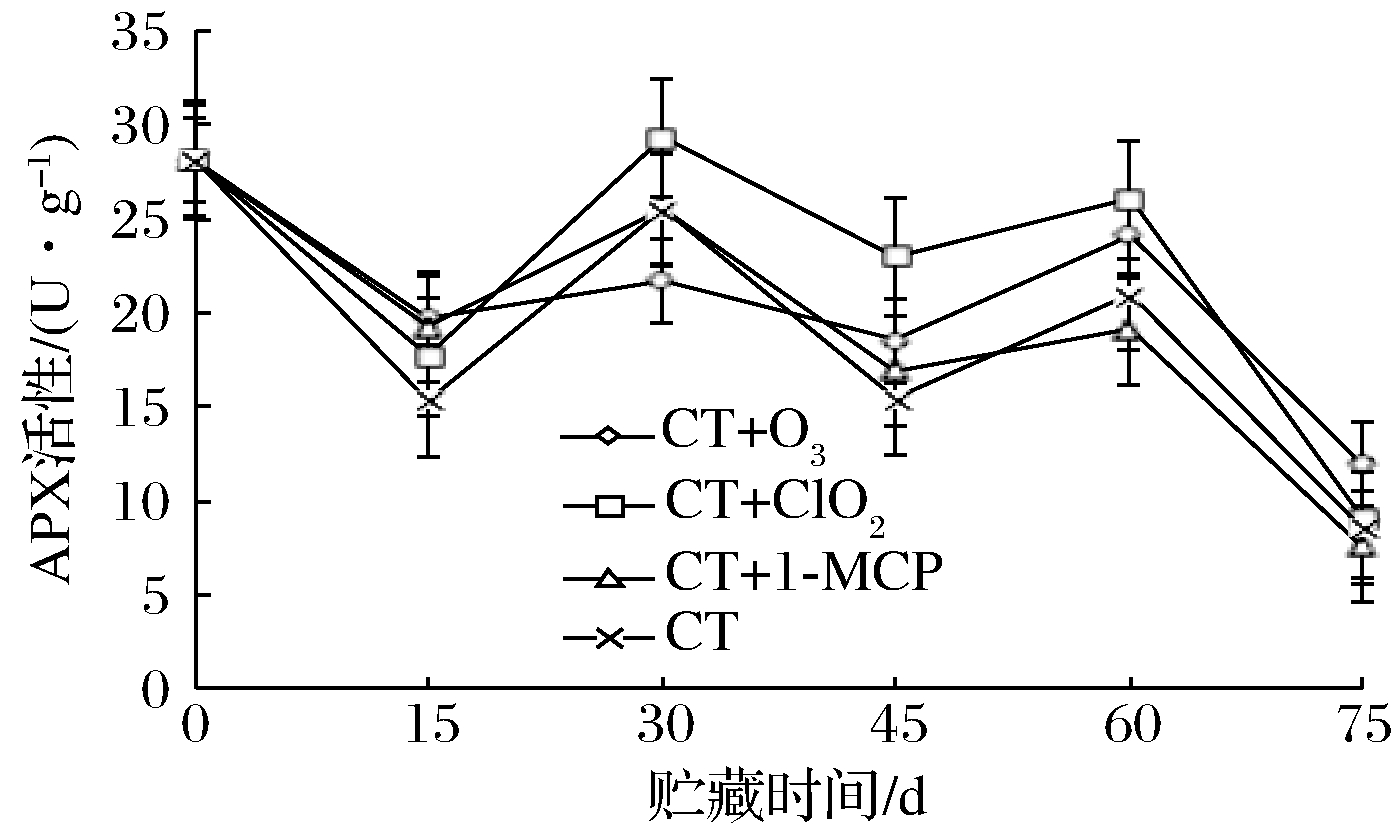
图8 不同保鲜处理对玫瑰香葡萄APX活性的影响
Fig.8 Effects of different fresh-keeping treatments on APX activity of Muscat Hamburg grapes
PPO能够催化酚类物质生成酮类物质,植物组织发生褐变与受到外界胁迫时,PPO活性都会升高,从而保护植物组织[29]。由图9可知,到第15天时,4种处理的PPO活性都大幅降低,说明保鲜处理对于葡萄起到了很好的保护作用,抑制了PPO的活性,30 d,CT+ClO2的PPO活性仍能很好地被抑制,CT+O3、CT+1-MCP、CT的PPO活性都有小幅升高。75 d时,CT处理的PPO活性明显高于其他3种(P<0.05),因CT处理只加了化学保鲜剂,并没有结合其他保鲜方式,说明化学保鲜剂对葡萄造成了伤害。结合其他保鲜方式,CT+O3、CT+ClO2、CT+1-MCP处理优于CT处理。而CT+ClO2在75 d时,抑制PPO的活性最佳,说明CT+ClO2处理添加的ClO2能更好地抑制化学保鲜剂对玫瑰香葡萄的伤害,并延缓其衰老。
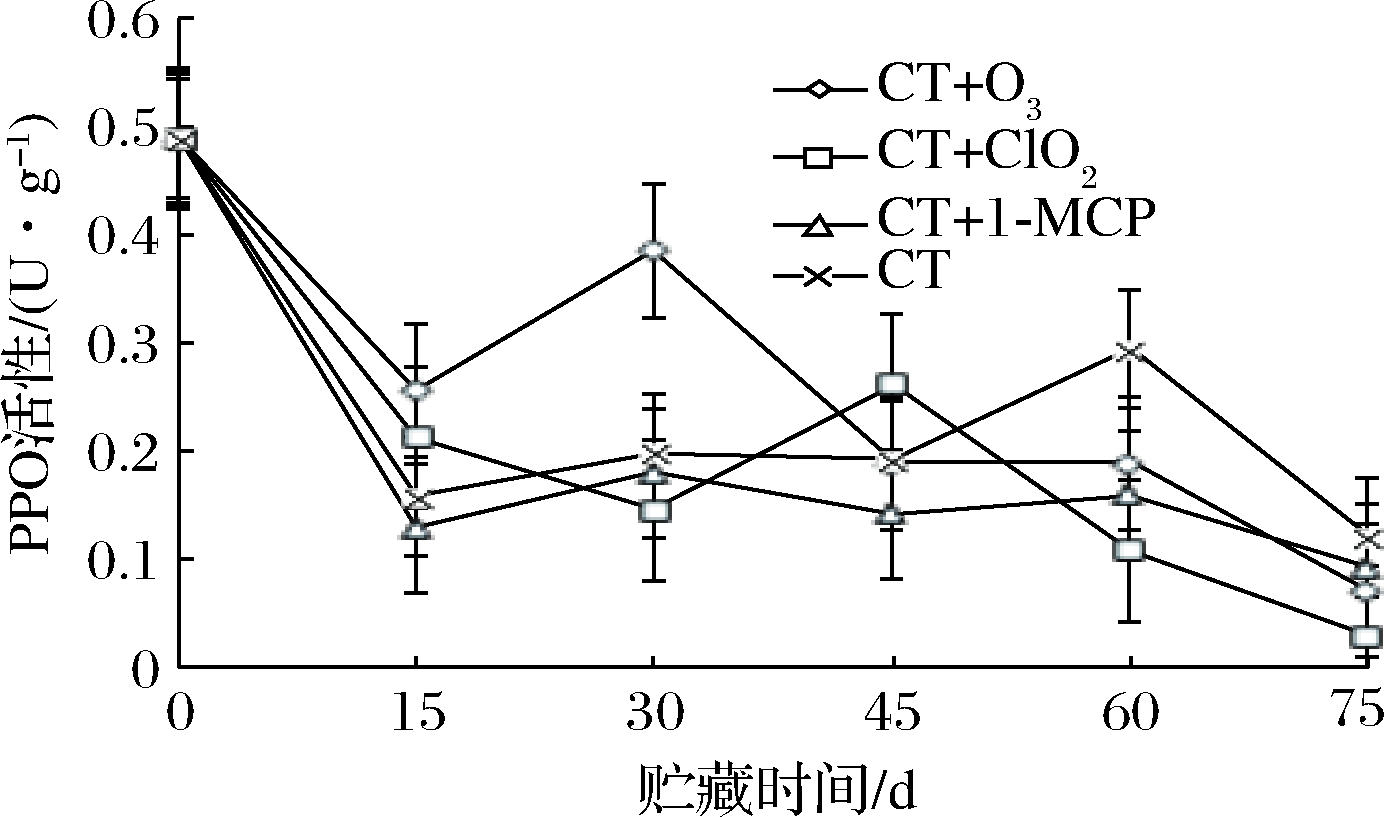
图9 不同保鲜处理对玫瑰香葡萄PPO活性的影响
Fig.9 Effects of different fresh-keeping treatments on PPO activity of Muscat Hamburg grapes
与传统的CT保鲜剂相比,结果表明,3种复合保鲜方式能对玫瑰香葡萄的呼吸强度进行有效的抑制,从而有效地延缓了玫瑰香葡萄的衰老。且传统的CT保鲜剂与复合保鲜剂处理后玫瑰香葡萄的硬度,果梗耐拉力、可滴定酸和可溶性固形物含量等指标没有明显差异。但CT+ClO2处理对于玫瑰香葡萄的硬度及PPO、POD、APX酶活控制CT+ClO2处理效果最好,更有效地延缓了玫瑰香葡萄的衰老并维持其品质处于较高水平,并且通过对腐烂率、漂白率及落粒率调查结果发现CT+ClO2处理要优于其他3组。综合比较,CT+ClO2处理在这4种保鲜处理中占很大优势,可在玫瑰香葡萄的保鲜贮藏中应用,从而降低SO2类化学保鲜剂的使用量。
[1] 杨立鹏, 马巧玲, 李金红. 玫瑰香葡萄贮藏保鲜技术[J]. 保鲜与加工, 2001, 1(6):29.
[2] 袁军伟, 赵胜建, 魏建梅, 等. 葡萄采后生理及贮藏保鲜技术研究进展[J]. 河北农业科学, 2009, 13(4):80-83.
[3] 张锐, 陈玉成, 于天颖, 等. 葡萄贮藏保鲜技术[J]. 农业科技与装备, 2012(8):73-74.
[4] 赵猛, 冯志宏, 王春生. 国内外葡萄贮藏保鲜技术及山西省葡萄产业化贮藏技术进展[J]. 山西果树, 2016(2):21-23.
[5] 关筱歆, 李江阔, 张鹏,等. 冰温结合CT-2保鲜剂对玫瑰香葡萄贮藏品质及生理的影响[J]. 食品与发酵工业, 2011,37(9):230-234.
[6] 朱志强, 高丕生, 张平, 等. 不同保鲜剂结合冰温对玫瑰香葡萄贮藏品质和生理生化的影响[J]. 食品工业科技, 2013,34(5):333-337.
[7] 刘丽青, 王燕楠, 仪慧兰, 等. 二氧化硫对玫瑰香葡萄果实采后保鲜的机理[J]. 应用与环境生物学报, 2016,22(2):338-341.
[8] 高海燕, 张华云, 王善广, 等. 不同用量SO2处理对两类葡萄冷藏中抗氧化性能的影响[J]. 农业工程学报, 2006, 22(9): 210-214.
[9] 贺光祖, 张才智, 晏宇, 等. 葡萄贮藏保鲜技术研究进展[J]. 现代农业科技, 2009(22):339-340.
[10] 杨敦敦, 张平, 赵飞, 等. 不同保鲜剂处理对红地球葡萄贮藏期间SO2残留量的影响[J]. 保鲜与加工, 2014,14(5):8-13.
[11] 张华云, 王善广, 高海燕, 等. 葡萄SO2伤害与影响因素研究[J]. 保鲜与加工, 2002, 2(5):17-19.
[12] 魏述亮, 东明学, 杨成发, 等. 贮藏红地球葡萄容易出现的问题及应对措施[J]. 落叶果树, 2004, 36(1):39-40.
[13] 林江丽, 朱亚娟, 王金霞,等. SO2处理对新疆3种葡萄香气成分的影响[J]. 食品科学, 2016, 37(6):116-120.
[14] 韩洁, 陈存坤, 王文生,等. 保鲜剂不同组合对袋内SO2积累及葡萄保鲜质量的影响[J]. 食品科学, 2015, 36(24):319-325.
[15] 周江.二氧化硫(SO2)间歇熏蒸对红地球葡萄采后品质的影响[D]. 乌鲁木齐:新疆农业大学, 2016.
[16] 田金强, 张子德, 陈志周. 红提葡萄贮藏保鲜过程中SO2伤害的防止技术研究[J]. 食品科学, 2006, 27(1):250-252.
[17] 李志文, 张平, 黄艳凤, 等. 贮藏保鲜中SO2伤害对红提葡萄香气组分的影响[J]. 西北植物学报, 2011, 31(2):385-392.
[18] 张华云, 王善广, 修德仁, 等. SO2对红地球葡萄的伤害及调控技术[J]. 中外葡萄与葡萄酒, 2000(3):19-21.
[19] 张国海, 郭香凤, 史国安, 等. 鲜食葡萄采后贮藏研究进展[J]. 河南科技大学学报(农学版), 2003, 23(3):31-34.
[20] 赵飞, 张平, 朱志强,等. SO2气态熏蒸结合固态缓释保鲜剂处理对红地球葡萄贮藏品质的影响[J]. 食品与发酵工业, 2013, 39(12):182-186.
[21] 周江, 魏佳, 张辉,等. 二氧化硫(SO2)间歇熏蒸对红地球葡萄贮藏品质的影响[J]. 食品科技, 2015,40(12):295-299.
[22] 王宁, 邓冰, 李珍,等. 低温贮藏结合SO2保鲜剂对无核白葡萄保鲜效果研究[J]. 食品工业科技, 2016, 37(6):330-334.
[23] 曹建康,姜微波,赵玉梅.果蔬菜后生理化实验指导[M].北京:中国轻工业出版社,2007.
[24] CHEN C, ZHANG X, ZHANG H, et al. Label-free quantitative proteomics to investigate the response of strawberry fruit after controlled ozone treatment[J]. RSC Advances, 2019, 9(2): 676-689.
[25] 张哲, 张志强, 张治权, 等. 贮藏温度对葡萄果胶含量及相关酶活性的影响[J]. 制冷学报, 2019,40(3):140-150.
[26] 薛桂新, 陈志军, 李永红. 木醋液对京亚葡萄保鲜效果的研究[J]. 食品科技, 2009,34(12):46-50.
[27] WAKABAYASHI K. Changes in cell wall polysaccharides during fruit ripening[J]. Journal of Plant Research, 2000, 113(3):231-237.
[28] 丁薪源, 曹建康. 果蔬过氧化物酶酶学特性研究进展[J]. 食品科技, 2012,37(10): 62-66.
[29] WEEMAES C A, LUDIKHUYZE L R, VAN D B I, et al. Activity, electrophoretic characteristics and heat inactivation of polyphenoloxidases from apples, avocados, grapes, pears and plums[J]. LWT - Food Science and Technology, 1998, 31(1):44-49.