酪蛋白(casein,CN)是牛乳中含量最高的蛋白质,是重要的营养成分之一。酪蛋白是一种磷酸化蛋白,主要由αs1-、αs2-、β-和κ-CN四部分组成。牛乳中,4种酪蛋白单体通过疏水相互作用、静电斥力等作用形成直径约80~400 nm的酪蛋白胶束(casein micelle,CM)[1-2]。目前,胶束态酪蛋白的内部结构并不明确,均以模型表示。众多模型一致认为,αs-CN和β-CN通过疏水作用、胶体磷酸钙连接构成胶束骨架,κ-CN位于胶束表面,维持胶体稳定,因此天然酪蛋白胶束是多孔状纳米级的球形聚合体[3-4]。
酪蛋白因较高的营养价值和乳化、发泡等功能特性,可作为乳化剂、增稠剂、营养强化剂等,是许多加工食品中关键功效成分[5]。膜过滤,特别是超滤技术,被广泛应用于乳品行业,以提取乳蛋白,使牛奶标准化或增加牛奶中的蛋白质含量[6]。超滤技术是一种根据目标物直径或分子量大小实现物料分离的技术,因此在乳蛋白分离中可以较为完整地保留胶束态酪蛋白天然的粒径和结构,从而保留其理化及功能特性;且具有操作简单、处理量大、绿色、高效、非热等特点[7]。膜分离法制备胶束态酪蛋白工艺被广泛关注[6,8-9]。陈建行等[7]用2种孔径的中空纤维陶瓷膜分离乳蛋白浓缩液,发现40nm膜渗滤液中不含酪蛋白,能减少酪蛋白的损失,提高胶束的得率。
喷雾干燥是食品工业中广泛应用的干燥技术,乳蛋白浓缩物的干燥处理大多采用这种方法,而干燥工艺对产品品质具有较大影响[7,9]。关于乳蛋白喷雾干燥相关研究主要集中在干燥工艺对乳蛋白理化性质及功能性质的影响方面。研究表明,在130 ℃下喷雾干燥获得的乳蛋白浓缩物溶解性高于160 ℃和190 ℃[10]。抗氧化性是乳蛋白及其活性肽的重要活性之一,已有大量研究报道酪蛋白酶解物、酪蛋白美拉德反应产物的抗氧化性活性[11-13]。然而,胶束态酪蛋白的抗氧化性鲜有报道,而喷雾干燥工艺对胶束态酪蛋白抗氧化性的影响未见报道。
本文采用超滤技术对荷斯坦牛乳进行分离获得胶束态酪蛋白,进而进行不同工艺的喷雾干燥,对干燥样品的结构特性(粒径、荧光特性、表面形貌)、溶解性、堆积密度,以及抗氧化性(还原力、DPPH和ABTS自由基清除率以及Fe2+螯合力)进行对比,探讨喷雾干燥工艺对胶束态酪蛋白结构及抗氧化性的作用规律,可为喷干工艺优化及其在胶束态酪蛋白生产中的应用提供参考依据。
材料:市购新鲜荷斯坦牛乳,置于装有冰袋的保温箱中,1h之内送达实验室。
试剂:1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS),上海麦克林生化科技有限公司;铁氰化钾(K3Fe(CN)6),三氯乙酸(TCA),天津市凯信化学工业有限公司;FeCl2、FeCl3,天津市百世化工有限公司;坩埚,北京天连和谐仪器仪表有限公司;其他试剂均为分析纯。
S-3400N扫描电子显微镜,日本日立公司;Bettersize2000激光粒度分布仪,丹东百特仪器有限公司;FD-1-50真空冷冻干燥机,北京博医康实验仪器有限公司;NAI-GZJ型实验室小型喷雾干燥机,上海那艾精密仪器有限公司;H1850台式高速离心机,湖南湘仪实验室仪器开发有限公司;TU-19系列双光束紫外可见分光光度计,北京普析通用仪器有限责任公司;RNF0460管式膜设备,厦门福美科技有限公司;PHS-3C实验室pH计,北京三信仪表厂;BSA224S电子天平,广州市深华生物技术有限公司。
1.3.1 酪蛋白胶束的制备
胶束浓缩液的制备:新鲜的牛乳在4 000×g离心脱脂20 min,脱脂乳过10 kDa的卷式膜浓缩。膜进口压力0.5 MPa,变频调速20 Hz,夹套循环水以保证低温超滤,截留液即是胶束态酪蛋白浓缩液。
干燥处理:胶束浓缩液一部分用于冷冻干燥,剩余部分用于喷雾干燥。喷干工艺按2个温度2个压强设置,分别是进口温度130 ℃和150 ℃、雾化压力0.05 MPa和0.1 MPa,撞针间隔时间1 s,物料流量250 mL/h。收集样品,粉碎后过100目筛,置于4 ℃冰箱保存备用。采用冻干温度-50 ℃、时间48 h冷冻干燥胶束态酪蛋白浓缩液。冻干样记作CM,4个喷雾干燥工艺分别为130 ℃-0.05 MPa、130 ℃-0.1 MPa、150 ℃-0.05 MPa、150 ℃-0.1 MPa,记作CM1、CM2、CM3、CM4。经测定,样品中蛋白质质量分数为66.78%,乳糖9.77%,脂肪2.65%,灰分8.51%。
1.3.2 水分含量的测定
不同干燥方式得到的胶束态酪蛋白按照GB 5009.3—2010食品中水分的测定,采用直接干燥法测定水分含量。
1.3.3 扫描电镜观察
取适量胶束态酪蛋白样品置于铜台上的导电胶条表面,小心涂抹使其分散为薄层,喷金后采用S-3400N扫描电子显微镜观察,电压12.0 kV。
1.3.4 粒径的测定
将不同干燥方式得到的胶束溶于水,配制成10 mg/mL pH 7.0的溶液,用Bettersize2000激光粒度分布仪测定,水作为分散剂,泵速1 800 r/min,样品折射率1.35,介质折射率1.33,取中位径D50表示平均粒径。
1.3.5 堆积密度的测定
堆积密度的测定参考GOULA等[14]的方法,将2 g胶束态酪蛋白样品倒入10 mL量筒(139 mm×13 mm),适当用玻璃棒轻轻敲击至量筒内样品表面水平且体积不再变化,记录样品体积,质量与体积之比即为堆积密度。
1.3.6 溶解度的测定
参考MILTON等[15]的方法,略有修改。用恒温磁力搅拌器在45 ℃下搅拌配制样品溶液,用1 mol/L的HCl和NaOH溶液调节pH直至稳定,定容至终质量浓度为10 mg/mL。磁力搅拌2 h,定容后室温放置2 h。将10 mL溶液移入15 mL恒重的离心管中,4 000 r/min离心10 min,去掉上清液,放入烘箱中于65 ℃烘至恒重,蛋白质质量记为A0,10 mL的溶液中蛋白质质量记为A1,每组平行3次,溶解性的计算如公式(1):
溶解度![]()
(1)
1.3.7 内源荧光的测定
参考YANG等[16]的方法,略有修改。用去离子水配制质量浓度为2 mg/mL pH 7.0的样品溶液,用荧光分光光度计在室温下测定其荧光发射光谱,激发波长设定为280 nm,发射光谱采集范围为290~450 nm,激发波长与发射波长狭缝均为3.0 nm。
1.3.8 抗氧化性的测定
1.3.8.1 还原力的测定
参照WANG等[17]的方法,略有修改。分别将2.5 mL pH 6.6质量浓度为 1、2、4、8 mg/mL的样品溶液与2.5 mL 0.2 mol/L pH 6.6 的磷酸盐缓冲液和2.5 mL 1% 的铁氰化钾溶液混合。50 ℃水浴温育20 min,冷却至室温后加入2.5 mL 10% TCA溶液,然后将混合物在4 000 r/min下离心10 min。取上清液2.5 mL加入2.5 mL超纯水和500 μL 0.1% FeCl3溶液,混匀后静置10 min,于700 nm下测量吸光度。还原力用700 nm处的吸光度表示。
1.3.8.2 Fe2+螯合力的测定
参照GU等[13]和WANG等[17]的方法,略有修改。分别将0.2 mL pH 6.6质量浓度分别为1、2、4、8 mg/mL的样品溶液与3.65 mL 去离子水、0.05 mL 2×10-3 mol/L FeCl2溶液混合,将混合物在28 ℃下静置30 s。随后加入0.1 mL 5×10-3 mol/L菲洛嗪并混合,在室温下静置10 min后于4 000 r/min离心5 min,取上清液于562 nm处测定吸光度,记为Ai。对照组用水代替,记为Aj,螯合力计算如公式(2):
螯合力![]()
(2)
1.3.8.3 DPPH自由基清除力的测定
参照WANG等[17]和XIE等[18]的方法,略有修改。分别将1.5 mL pH 6.6质量浓度分别为1、2、4、8 mg/mL的样品溶液加入到1.5 mL 1×10-4mol/L DPPH乙醇溶液中,振荡均匀,并室温避光静置20 min。将混合物于4 000 r/min下离心10 min,于517 nm处测量上清液的吸光值,记为A1,用等体积乙醇溶液代替DPPH溶液,记为A2,等体积水代替样品溶液,记为A0。等体积水和乙醇混合溶液调零。DPPH自由基清除力计算如公式(3)所示:
清除力![]()
(3)
1.3.8.4 ABTS自由基清除力的测定
参考KONG等[19]和RE等 [20]的方法配制ABTS工作液,在暗环境下放置12~16 h。测定时,取适量工作液,用pH 7.4的磷酸盐缓冲液稀释使其在波长734 nm处的吸光值为0.70±0.02(记为A0),即可使用。取50 μL pH 6.6的样品溶液,加入3 mL ABTS稀释液,室温反应6 min,测定734 nm处的吸光度值A。ABTS自由基清楚力计算公式如公式(4)所示:
清除力![]()
(4)
所有实验重复3次,试验数据采用Excel 2010处理并用平均数±标准偏差表示,用Origin Pro 9.0作图,用IBM SPSS Statistics 22进行差异显著性分析,数据间差异显著分析采用Duncan法。
酪蛋白的水分含量和粒径影响其功能性质和乳制品品质[21]。如表1所示,喷雾干燥工艺对胶束态酪蛋白水分含量具有显著影响(P<0.05)。随着进口温度的升高,同一雾化压力下样品含水量降低;从130 ℃提高到150 ℃,0.05 MPa和0.1MPa下水分含量分别降低了18.84%和19.27%;而CM4与CM1相比,水分含量降低了30.30%。同一温度下,随着雾化压力的升高,样品含水量显著降低(P<0.05)。冻干样品平均水分含量为(5.25±0.15)%,低于130 ℃喷干样,高于150 ℃喷干样,且与CM1、CM4差异显著(P<0.05)。
进口温度升高可提高样品的干燥速率,雾化压力增加可降低样品液滴的尺寸。随着温度和压力的增加,干燥器内部相同时间内蒸发能量增加,颗粒内部更多水分向外表面迁移,因此水分含量降低[22]。130℃喷干的胶束态酪蛋白含水量略高于相同温度下喷干的乳蛋白浓缩物含水量(4.25%)[10],这是由于不同原料的水分结合性不同,而且雾化压力也存在差异所造成的。由此可见,提高进口温度和雾化压力可降低胶束态酪蛋白水分含量,且一定条件下冷冻干燥也能获得和喷雾干燥样品较为接近的水分含量。
表1 不同干燥工艺对样品水分含量、粒径和堆积密度的影响
Table 1 Effect of different dry conditions on moisture content, particle size and bulk density of micellar casein
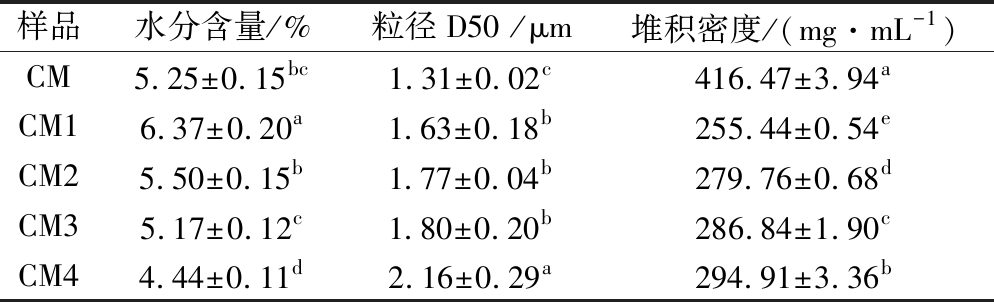
样品水分含量/%粒径D50 /μm堆积密度/(mg·mL-1)CM5.25±0.15bc1.31±0.02c416.47±3.94aCM16.37±0.20a1.63±0.18b255.44±0.54eCM25.50±0.15b1.77±0.04b279.76±0.68dCM35.17±0.12c1.80±0.20b286.84±1.90cCM44.44±0.11d2.16±0.29a294.91±3.36b
注:表中同一列不同小写字母表示差异显著(P<0.05)。
胶束态酪蛋白表面形貌如图1所示,冻干样品没有规则形貌,喷干样品为带有凹陷的球形颗粒且粒径分布范围较大。随着喷干温度和压力的增加,胶束态酪蛋白尺寸没有显著变化,但表面凹陷位点略有增加。

图1 不同干燥工艺下胶束态酪蛋白的扫描电镜图
Fig.1 SEM photos of micellar casein under different dry conditions
冷冻干燥过程中,胶束态酪蛋白逐渐失水且连成片状,干燥样品没有规则形状。喷雾干燥过程中,由于样品雾化成液滴,之后经历快速失水,形成球形形貌。由于喷干过程中,水分从液滴内部迅速迁移至表面蒸发,而酪蛋白分子量较大,迁移速率极慢,因而表面出现凹陷,呈葡萄干状[23-24]。
堆积密度是粉末样品的物理特性之一;堆积密度越大,表示相同质量的物料体积越小,比表面积越大。不同干燥工艺对样品堆积密度的影响如表1所示。CM的堆积密度最大,为416.47 mg/mL。喷雾干燥样品堆积密度随温度和压力的增加显著增大(P<0.05)。结合图1,冻干样品没有规则形貌,粉碎后体积较大,因此堆积密度较大。喷干样品的凹陷位点随着喷干温度和压力的升高而有所增多,致使其比表面积增加,在敲击塌陷过程中小颗粒恰好可填充大颗粒凹陷部位,所以堆积密度增大。有研究指出[25],牦牛乳粉堆积密度随着喷干温度的升高(130~170 ℃)而增大,与本文研究结论相似。
不同干燥工艺下胶束态酪蛋白粒径如表1所示。4个喷雾干燥样品的粒径随温度和压力的增加而增大,其中CM4粒径最大,CM1、CM2、CM3的粒径差异不显著(P>0.05)。冻干样品粒径显著低于喷雾干燥样品(P<0.05)。干燥温度的升高使残留的乳清蛋白与胶束的共价结合程度增加,而且残留的乳糖和胶束的热聚合也有所加剧,致使胶束表面附着物增多,故而粒径有所增加。
溶解特性是蛋白质发挥其功能性质的基础[25]。由图2可以看出,同一干燥处理样品不同pH下溶解性差异显著(P<0.05)。随着pH的升高,胶束态酪蛋白溶解性增加,表现出碱性解离。随着喷干温度的升高,样品溶解性降低;随着雾化压力的增大,溶解性也出现降低趋势。同一pH下,冻干样品CM和130 ℃-0.05 MPa条件下喷干样CM1的溶解性差异不显著(P>0.05)。中性和弱碱性pH下,CM1和CM3溶解性差异不显著(P>0.05),即0.05 MPa压力下温度对溶解性影响不大;CM2和CM4溶解性差异显著。可见,雾化压力对溶解性的影响取决于进口温度。
文献指出,随着温度的升高,喷干乳粉溶解性降低,且溶解度约80%[10,25],与本文研究结论基本一致。进口温度越高,乳清蛋白、酪蛋白热变性程度越高;同时,酪蛋白胶束和乳清蛋白以及乳糖之间的热聚合作用越明显,甚至出现明显的美拉德反应,从而形成分子量较大、溶解性较差的颗粒,所以样品溶解度会随温度的升高而降低[26]。另外,雾化压力增大,样品液滴变小,比表面积增加,热聚集和热变性程度加剧,因此高温下增加压力时溶解性的降低程度增大。由此可见,酪蛋白胶束在喷干过程中不宜采用过高的进口温度和雾化压力。

图2 不同干燥工艺对胶束态酪蛋白溶解性的影响
Fig.2 Effect of dry conditions on the solubility of micellar casein
注:图中不同小写字母表示相同干燥处理不同pH下差异显著,不同大写字母则表示相同pH不同干燥处理之间的差异显著(P<0.05)
内源荧光光谱分析主要用于判断蛋白质三级构象的变化以及色氨酸残基周围微环境变化[27]。若最大发射波长大于330 nm,则表明蛋白结构松散,色氨酸残基暴露在极性更大的环境中;反之,最大发射波长小于330 nm,则表明蛋白结构紧凑,残基处于疏水性更大的环境中[28]。如图3所示,样品的最大荧光强度依次为CM>CM1>CM3>CM2>CM4,最大发射波长都在336 nm处。由此可见,本文选取的喷雾干燥工艺对胶束态酪蛋白的内部结构没有产生显著影响。在喷干过程中,迅速干燥使得酪蛋白胶束结构来不及改变,依然保持原有的内部构象。随着干燥温度和压力的增大,最大荧光强度呈现降低趋势,这可能是由于酪蛋白胶束表面部分亲水性基团在温度和压力作用下暴露出来,因此荧光强度略有降低,且CM4的荧光值最低。综上所述,喷雾干燥可较好地保留胶束态酪蛋白天然内部结构。
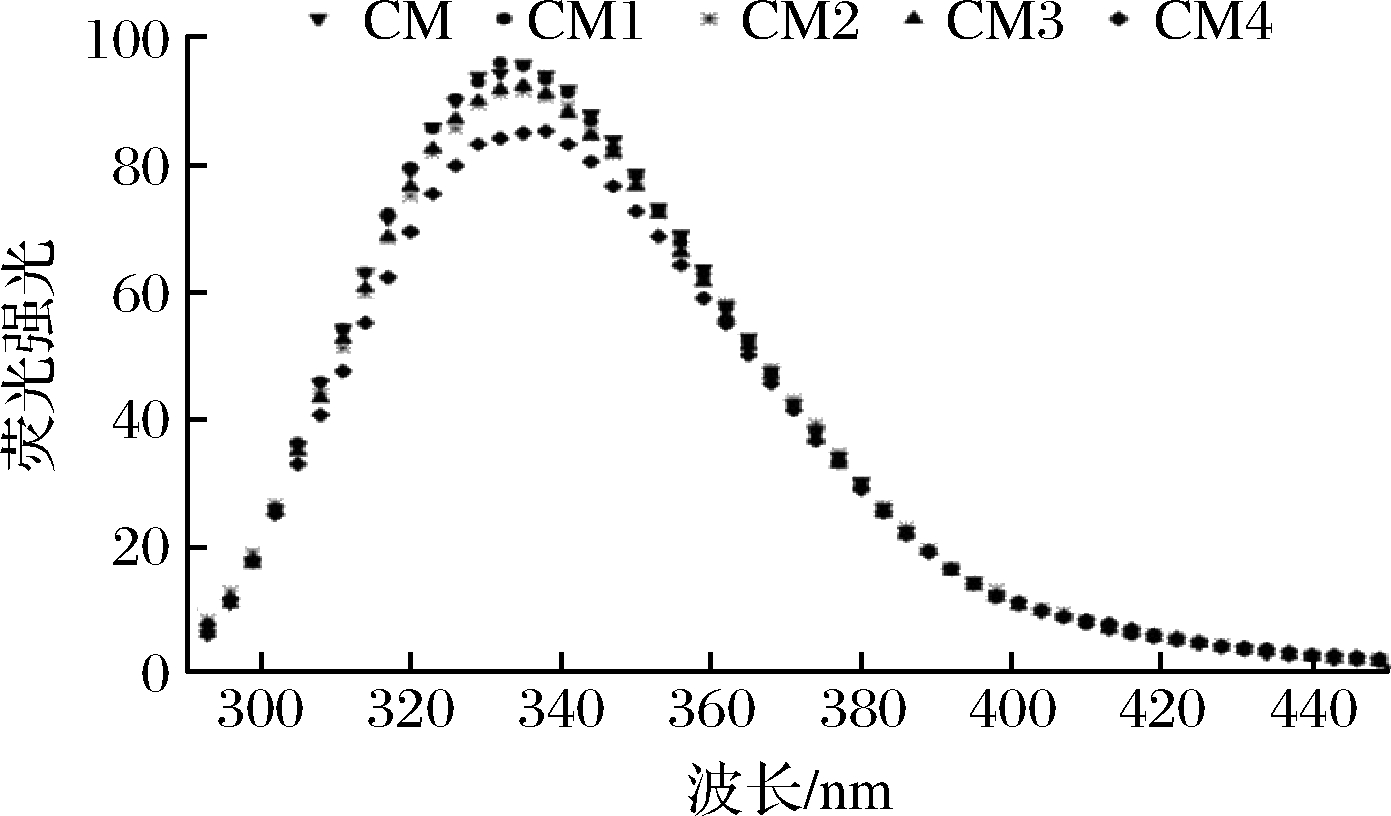
图3 不同干燥工艺下胶束态酪蛋白的内源荧光光谱
Fig.3 Intrinsic fluorescence spectra of micellar casein under different dry conditions
2.7.1 还原力
还原力表示抗氧化剂提供电子或氢的能力[18]。不同干燥方式对胶束态酪蛋白还原力的影响如图4所示。还原力大小与样品浓度之间存在一定的关系,随浓度增加,还原力基本呈现线性增大。同一样品不同浓度之间还原力差异显著(P<0.05),这与WANG等[17]的研究结果类似。5个干燥样品中,相同浓度条件下CM1的还原力最大,且显著高于其他4个样品;150 ℃-0.1 MPa干燥样CM4的还原力最差。样品质量浓度在8 mg/mL时, CM和CM2的还原力没有显著差异(P>0.05)。
随着进口温度的增大,样品还原力显著降低;随着雾化压力的增大,样品还原力显著降低(P<0.05)。溶解性研究结果显示,温度升高时样品溶解性降低(图2),而良好的溶解性是还原力发挥的前提。另一方面,粒径分析显示(表1),随着温度和压力的增加,样品粒径增大,说明样品热聚集增强,使其活性基团难以发挥或丧失还原能力。因此,胶束态酪蛋白样品随着喷干温度和雾化压力的增加,其还原力降低。综上所述,喷干条件对胶束态酪蛋白的还原力具有显著影响。

图4 不同干燥工艺对样品还原力的影响
Fig.4 Effect of dry conditions on the reduce power of micellar casein
注:图中不同小写字母表示相同干燥处理不同浓度之间差异显著,不同大写字母则表示相同浓度不同干燥处理之间的差异显著(P<0.05)(下同)
2.7.2 Fe2+螯合力
研究表明,蛋白质中的巯基、氨基等基团可以螯合Pb2+、Fe2+、Cu2+等金属离子,这类蛋白质既可以作为有效的抗氧化剂,也可以用作重金属解毒剂[29]。如图5所示,胶束态酪蛋白喷干粉的Fe2+螯合力随浓度的升高而增大。CM3的Fe2+螯合力大于同浓度的其他4个样品,且螯合力由1 mg/mL 的50.41%增加到8 mg/mL的88.49%;其次为CM4。冻干样的Fe2+螯合力最差。总体而言,升高温度有利于提升胶束态酪蛋白的Fe2+螯合能力,而雾化压力对Fe2+螯合力的影响与温度有关。
研究指出,蛋白质的金属结合能力一般与螯合金属离子的有效位点数量有关[30]。冻干过程中,酪蛋白胶束通过脱水作用可能会使内部结构收缩,变得紧致,其表现为粒径较小(表1),因此部分活性基团被包埋在紧致结构内部,难以与Fe2+结合,所以螯合能力较差。对喷干样品而言,温度较高时会增加美拉德反应程度,而美拉德反应产物具有较好的Fe2+螯合能力[17],因此温度升高时胶束态酪蛋白的Fe2+螯合力增大。然而,在150 ℃时,雾化压力增大后样品溶解度显著降低(图2),反而不利于螯合力的发挥。由此可见,适宜的进口温度和雾化压力可提升胶束态酪蛋白的Fe2+螯合力。
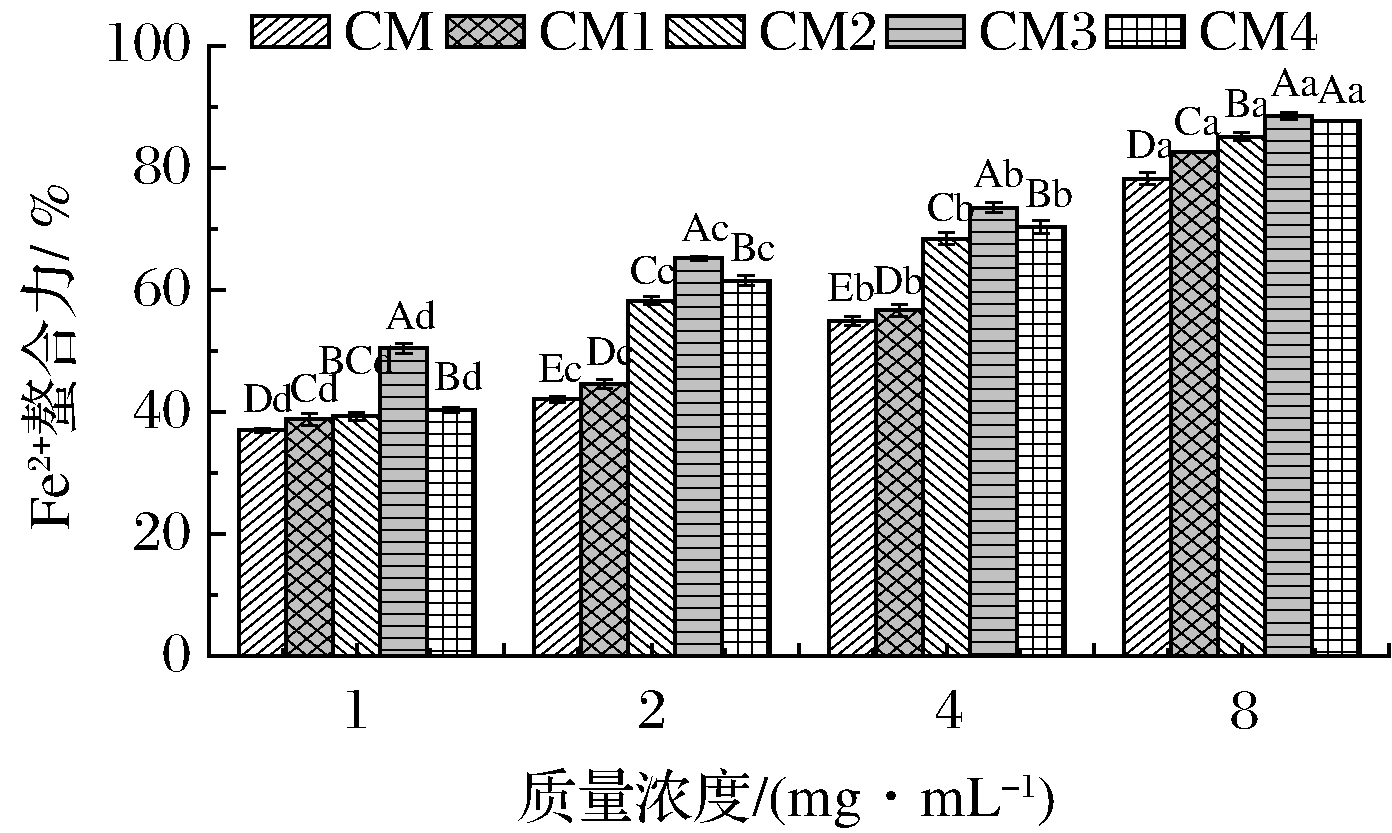
图5 不同干燥工艺对样品Fe2+螯合力的影响
Fig.5 Effect of dry conditons on the Fe2+ chelating capacity of micellar casein
2.7.3 DPPH自由基清除活力
DPPH是一种脂溶性自由基,当加入清除剂时,其褪色程度与清除剂呈一定剂量关系,因而可以通过吸光值的变化来判断清除力大小[31]。不同干燥工艺对胶束态酪蛋白DPPH自由基清除活力的影响如图6所示。胶束态酪蛋白的DPPH清除率表现出明显的浓度依赖性,浓度越大,其清除力越大(P<0.05),这与WANG等[17]的研究结果一致。样品质量浓度为8 mg/mL时,CM4的清除率为51.21%,显著高于其他4个样品。浓度为2 mg/mL时,清除率的大小依次为CM4、CM3、CM2、CM1、CM。这是因为,喷雾干燥温度和压力增加可能使胶束态酪蛋白表面美拉德反应程度增加,反应产物具有较好的自由基清除活力,因此CM4的DPPH自由基清除活力在浓度为2 mg/mL和8 mg/mL时高于其他样品。其他浓度下喷干工艺对4种喷干样品的DPPH自由基清除活力没有显著影响(P>0.05)。冻干样品的清除力低于喷干样品。

图6 不同干燥工艺对样品DPPH自由基清除活力的影响
Fig.6 Effect of different dry conditions on the DPPH free radical scavenging activity of micellar casein
2.7.4 ABTS自由基清除活力
不同干燥工艺下胶束态酪蛋白的ABTS自由基清除率如图7所示。ABTS自由基清除率与样品浓度存在显著正相关性(P<0.05)。CM1和CM3的ABTS自由基清除率最大,且差异不显著(P>0.05),但显著高于其他3个样品(质量浓度为8 mg/mL除外)。低浓度条件下,CM的清除力明显小于CM4,但是当质量浓度大于2 mg/mL时, CM的清除率略高于CM4,这是因为CM的溶解性较好(图2),浓度越大时其溶解的量较其他样品越多,溶液中可与ABTS自由基作用的活性基团越多,因此清除率增大[32]。
温度对样品的ABTS自由基清除活性影响不大,但同一温度下,压力越大,其清除活性越差。ABTS为水溶性自由基,蛋白质对其清除活性与溶解性相关。压力增加使样品的溶解性降低(图2),因此ABTS自由基清除活性也随之降低。

图7 不同干燥工艺对样品ABTS自由基清除率的影响
Fig.7 Effect of different dry conditions on the ABTS free radical clearance of micellar casein
喷雾干燥是粉末类乳制品的主要干燥方式。喷干工艺对胶束态酪蛋白的水分含量、粒径和堆积密度具有显著影响。随着喷干温度和压力的升高,胶束态酪蛋白的水分含量显著降低,堆积密度显著增大,粒径略有增大,但产品形貌没有发生改变。就溶解度而言,由于高温高压会加剧蛋白质的热聚集和变性,因此随着温度的升高,样品溶解性降低;随着雾化压力的增大,溶解性也出现降低趋势。内源荧光分析表明,喷雾干燥进口温度和雾化压力升高时,样品表面的亲水基团暴露程度增加,疏水性降低,但内部结构不发生显著改变。
抗氧化性是乳蛋白及乳源活性肽的主要生物活性之一。抗氧化活性分析表明,胶束态酪蛋白的抗氧化活性与其浓度正相关;同浓度下,抗氧化活性与喷干工艺有关。其中,温度较低时胶束态酪蛋白具有较好的还原力和ABTS自由基清除活力,这与其较好的溶解性有关。而较高的喷干温度有利于提升胶束态酪蛋白的DPPH自由基清除能力。温度和压力对酪蛋白胶束的Fe2+螯合力具有协同作用,进口温度150 ℃和雾化压力 0.05 MPa工艺下螯合能力最高。
由此可见,喷雾干燥温度和雾化压力对胶束态酪蛋白的理化性质和抗氧化性均具有影响。总体而言,进口温度130 ℃、雾化压力 0.05 MPa的工艺条件下胶束态酪蛋白的溶解性及抗氧化性较好。
[1] MCMAHON D J, OOMMEN B S. Supramolecular structure of the casein micelle[J]. Journal of Dairy Science, 2008, 91(5): 1 709-1 721.
[2] DE KRUIF C G, ZHULINA E B. κ-casein as a polyelectrolyte brush on the surface of casein micelles[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 1996, 117(1): 151-159.
[3] DALGLEISH D G, CORREDIG M. The structure of the casein micelle of milk and its changes during processing[J]. Annual Review of Food Science and Technology, 2012, 3(1): 449-467.
[4] HOLT C, DE KRUIF C G, TUINIER R, et al. Substructure of bovine casein micelles by small-angle X-ray and neutron scattering[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2003, 213(2-3): 275-284.
[5] YE A. Functional properties of milk protein concentrates: Emulsifying properties, adsorption and stability of emulsions[J]. International Dairy Journal, 2010, 21(1): 14-20.
[6] SALVATORE E, PIRISI A, CORREDIG M. Gelation properties of casein micelles during combined renneting and bacterial fermentation: Effect of concentration by ultrafiltration[J]. International Dairy Journal, 2011, 21(11): 848-856.
[7] 陈建行,刘鹭,孙颜君,等.酪蛋白胶束粉的陶瓷膜分离生产工艺[J].农业工程学报, 2013, 29(9):256-266.
[8] BELICIU C M, SAUER A, MORARU C I. The effect of commercial sterilization regimens on micellar casein concentrates[J]. Journal of Dairy Science, 2012, 95(10): 5 510-5 526.
[9] HURT E, ZULEWSKA J, NEWBOLD M, et al. Micellar casein concentrate production with a 3X, 3-stage, uniform transmembrane pressure ceramic membrane process at 50℃ 1[J]. Journal of Dairy Science, 2010, 93(12): 5 588-5 600.
[10] 陈建行,刘鹭,张书文,等. 乳蛋白浓缩物(MPC)的中试生产工艺研究[J]. 中国乳品工业, 2013, 41(10):11-14.
[11] 韩娜,杨敏,杨继涛,等.酪蛋白酶解物的分离及其抗氧化活性[J].食品工业科技, 2019, 40(9):166-170;229.
[12] TAVAF Z, TABATABAEI M, KHALAFI-NEZHAD A, et al. Evaluation of antibacterial, antibofilm and antioxidant activities of synthesized silver nanoparticles (AgNPs) and casein peptide fragments against Streptococcus mutans[J]. European Journal of Integrative Medicine, 2017, 12: 163-171.
[13] GU F L, KIM J M, HAYAT K, et al. Characteristics and antioxidant activity of ultrafiltrated Maillard reaction products from a casein-glucose model system[J]. Food Chemistry, 2009, 117(1): 48-54.
[14] GOULA A M, ADAMOPOULOS K G. Spray drying of tomato pulp in dehumidified air: II. The effect on powder properties[J].Journal of Food Engineering, 2004, 66(1): 35-42.
[15] CANO-CHAUCA M, STRINGHETA P C, RAMOS A M, et al. Effect of the carriers on the microstructure of mango powder obtained by spray drying and its functional characterization[J]. Innovative Food Science and Emerging Technologies, 2005, 6(4): 420-428.
[16] YANG M, CUI N, FANG Y, et al. Influence of succinylation on the conformation of yak casein micelles[J]. Food Chemistry, 2015, 179: 246-252.
[17] WANG H X, YANG J T, YANG M, et al. Antioxidant activity of Maillard reaction products from a Yak casein-glucose model system[J]. International Dairy Journal, 2018, 91: 55-63.
[18] XIE Z J, HUANG J, XU X M, et al. Antioxidant activity of peptides isolated from alfalfa leaf protein hydrolysate[J]. Food Chemistry, 2008, 111(2): 370-376.
[19] KONG B H, XIONG Y L L. Antioxidant activity of zein hydrolysates in a liposome system and the possible mode of action[J].Journal of Agricultural and Food Chemistry, 2006, 54(16): 6 059-6 068.
[20] RE R, PELLEGRINI N, PROTEGGENTE A, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J].Free Radical Biology and Medicine, 1999, 26(9): 1 231-1 237.
[21] 王鹏杰,简澍瑜,王辰元,等.不同前处理条件对动态光散射检测酪蛋白胶束粒径的影响[J].农业工程学报, 2015, 31(14): 298-302.
[22] 苏东晓,廖森泰,张名位,等.喷雾干燥工艺条件对速溶龙眼粉理化特性的影响[J].中国农业科学, 2011, 44(18): 3 830-3 839.
[23] TAN S, EBRAHIMI A, LANGRISH T. Controlled release of caffeine from tablets of spray-dried casein gels[J]. Food Hydrocolloids, 2019, 88:13-20.
[24] ZHANG Ruihua, PANG Xiaoyang, LU Jing, et al. Effect of high intensity ultrasound pretreatment on functional and structural properties of micellar casein concentrates[J]. Ultrasonics Sonochemistry, 2018, 47:10-16.
[25] 闫忠心,靳义超.喷雾干燥温度对牦牛乳粉溶解特性的影响[J].食品科学, 2016, 37(7):23-26.
[26] LIU D S, ZHANG J, YANG T Y, et al. Effects of skim milk pre-acidification and retentate pH-restoration on spray-drying performance, physico-chemical and functional properties of milk protein concentrates[J]. Food Chemistry, 2019, 272: 539-548.
[27] KERENSA B, ALPHONS G J V, ROB J H, et al. Glycoforms of beta-lactoglobulin with improved thermostability and preserved structural packing[J]. Biotechnology and Bioengineering, 2004, 86(1): 78-87.
[28] MANEEPHAN K, MATTEO M, STEFANIA I, et al. Structural changes of soy proteins at the oil-water interface studied by fluorescence spectroscopy[J].Colloids and Surfaces B: Biointerfaces, 2012, 93: 41-48.
[29] JOSHI R, SOOD S, DOGRA P, et al. In vitro cytotoxicity, antimicrobial, and metal-chelating activity of triterpene saponins from tea seed grown in Kangra valley[J].Indian Journal of Medical Research, 2015, 22: 4 030-4 038.
[30] GARCíA-MORENO P J, BATISTA I, PIRES C, et al. Antioxidant activity of protein hydrolysates obtained from discarded Mediterranean fish species[J]. Food Research International, 2014, 65: 469-476.
[31] KUMARAN A, JOEL K R. Antioxidant and free radical scavenging activity of an aqueous extract of Coleus aromaticus[J]. Food Chemistry, 2006, 97(1): 109-114.
[32] FAN L L, WANG Y, XIE P J, et al. Copigmentation effects of phenolics on color enhancement and stability of blackberry wine residue anthocyanins: Chromaticity, kinetics and structural simulation[J]. Food Chemistry, 2018, 275: 299-308.