食品的风味是影响消费者可接受性的重要属性,食品基质对风味的释放与感知引起众多学者的兴趣[1]。作为食品的重要成分,蛋白质可以通过特殊的分子键与风味化合物相互作用,从而影响食品的风味强度[2]。国内外集中于研究影响蛋白和风味结合的潜在因素上,包括pH值[3]、离子强度和类型[4]、蛋白质氧化[5]和酶促方法[6]等,这些因素可以修饰蛋白质构象,从而影响蛋白质与风味的结合。
肌原纤维蛋白是盐溶性蛋白,由肌动蛋白、肌球蛋白、肌动球蛋白等组成,占肌肉蛋白质的40%~60%[7],对肉品凝胶化和乳化特性具有重要影响。西式火腿属于低温肉制品,相较高温肉制品,其全程低温生产,肉质鲜嫩营养价值高[8]。烟熏赋予肉品独特的烟熏风味,烟熏制品常用传统直火发烟方式烟熏,但其设备成本高、耗时长易产生苯并芘、杂环胺等有害物质[9]。因此,以绿色烟熏液为核心的液熏法在烟熏肉品领域得到推崇。烟熏液作为食品添加剂,可以调节肉品的色泽和风味,提高肉品抗氧化和抗菌性能。研究表明,烟熏液中含有大量酚类(相对含量在68.33%~82.53%)、醛类、呋喃、有机酸等化合物[10],其中愈创木酚作为酚类物质的代表因其成分含量高、阈值较低且具有明显熏肉风味,是烟熏液主要风味物质[11]。
尽管许多研究表明蛋白质对酮类[12]、醇类、醛类物质[13]的吸附与温度、压力[14]、微波、超声等[15]因素相关,虽大多相关研究着重机理机制的探讨但尚未将相关研究与食品生产加工环节有机联系起来。事实上,在食品加工过程中,通过研究蛋白质与风味的结合,可以反映其产品风味强度,从而使食品生产商开发出具有理想风味的产品。因此,通过分析西式火腿关键加工环节肌原纤维蛋白结构变化,探讨加工环节对蛋白风味物质吸附能力的影响,对于烟熏液在西式火腿生产中的应用具有重要的实际指导意义。
西式火腿制作材料:新鲜猪后腿精瘦肉,购于合力超市;食盐、白砂糖、味精、黑胡椒粉、淀粉,购于花溪沃尔玛超市;乳酸钾,北京清源食品添加剂有限公司;亚硝酸盐,杭州龙山化工有限公司;三聚磷酸钠、焦磷酸钠、D-异抗坏血酸钠,河南万邦实业有限公司;黄原胶、卡拉胶,内蒙古阜丰生物科技有限公司;大豆分离蛋白,万利达生物科技有限公司;硬木烟熏香味料SmokeZ C-10-12、C-10-06,美国红箭公司。以上材料均为食品级。
尿素,天津市福晨化学试剂厂;Tris,美国Genview公司;KCl K2HPO4、(KH2PO4、KCl,成成金山化学试剂有限公司;2-硝基苯甲酸(DTNB),上海麦克林生物化学公司;8-苯胺基-1-萘磺酸(ANS),梯希爱(上海)化成工业发展有限公司;β-巯基乙醇,广东翁江化学试剂有限公司;KBr,上海阿拉丁生化科技股份有限公司。以上试剂均为分析纯。
CP214电子分析天平,奥豪斯仪器有限公司;Seven2GoTM梅特勒-托利多的便携式pH计,瑞士;XHF-DY高速分散均质机,宁波新芝生物科技股份有限公司;SpectraMAX190酶标仪,美国Molecular Devices公司;SB25-12DT超声清洗器,上海冠特超声仪器有限公司;VERTEX70型傅里叶变换红外光谱仪,日本岛津公司;UV2600紫外-可见分光光度计日本,Shimadzu公司;Cary eclipse型荧光分光光度计,美国Aglient公司;GC-MS QP2010 气相色谱质谱联用仪,日本岛津公司。
1.3.1 西式火腿制备
修整切块:将从超市购买的后腿精瘦肉切成肉块,(1 cm×2 cm×3 cm)。
腌制:按照腌制配方(质量分数)食盐2.5%,亚硝酸钠0.015%,异抗坏血酸钠0.06%,多聚磷酸钠0.1%,焦磷酸钠0.2%,白砂糖0.8%,蒸馏水5%制作好腌液,倒入切好的肉中,充分混合均匀,置于0~4 ℃下腌制24~48 h;
真空滚揉:滚揉时间为4 h,0~8 ℃每滚揉20 min间歇10 min,滚揉在滚揉快结束时按比例加入加工配方后再继续滚揉10 min,以保证其分布均匀。加工配方为(质量分数)胡椒粉0.5%、味精0.5%、大豆蛋白2.2%、淀粉6.5%、卡拉胶0.3%、黄原胶0.3%、红曲红0.01%、硬木烟熏香味料Smoke ZC-10-12型0.2%、Smoke ZC-10-06型 0.5%、乳酸链球菌素0.1%;
斩拌:真空滚揉结束,取25%(质量分数)肉料与斩拌机中进行斩拌,肉样呈肉泥形态时斩拌结束;
灌肠:塑料肠衣剪开,一端打卡后排气,操作灌肠机灌肠,每间隔约20 cm打1次卡;
蒸煮:蒸煮锅内加入清洁水,预热到85 ℃放入火腿,将水温恒定在80 ℃蒸煮2 h;
冷却:采用流水法冷却火腿,冷却后送入0~5 ℃冷库保藏。
依据上述实验室探索方法制作的西式火腿,分别在原料肉、腌制、真空滚揉、斩拌和蒸煮关键加工环节进行取样。
1.3.2 肌原纤维蛋白的提取
参考曹锦轩等[16]的方法。准确称取1 g肉或火腿样品,置于50 mL离心管中。分别加入20 mL 50 mmol/L的磷酸缓冲液(需预冷,pH=7.5),12 000 r/min匀浆10 s 1次,重复3次 (冰浴)。溶液在4 ℃下,8 000 r/min离心15 min,重复上述操作3次并收集沉淀。沉淀用5 mL 50 mmol/L (含0.5 mol/L NaCl的预冷磷酸缓冲液(pH=8.0)溶解。所得溶液在4 ℃下、 5 000 r/min离心15 min,收集上清液,于4 ℃冰箱储存并在36 h内使用。
以牛血清白蛋白作为标准,采用二辛可宁酸法测定蛋白质浓度。
1.3.3 肌原纤维蛋白巯基含量的测定
巯基总量的测定方法参考XU等[17]等的方法。20 mmol/L K2HPO4/KH2PO4缓冲液(含0.6 mol/L KCl, pH=7.0)将肌原纤维蛋白稀释到4 g/L左右。
巯基总量的测定:取0.75 mL蛋白溶液于5 mL离心管中,添加2.25 mL (8 mol/L)的尿素,尿素的终摩尔浓度为6 mol/L。取20 μL (1.5 g/L)的DTNB加入到蛋白尿素混合液中。于25 ℃下恒温孵化5 min,在412 nm处测定吸光度。未加入蛋白质的缓冲液混合体系为空白。巯基总量的计算公式如(1)所示:
(1)
式中:A412,减去空白后412 nm处肌原纤维蛋白吸光值;D,肌原纤维蛋白稀释倍数;C,肌原纤维蛋白质质量浓度,g/L。
1.3.4 肌原纤维蛋白质表面疏水性的测定
参考BOYER等[18]的方法。吸取适量肌原纤维蛋白溶液于2 mL离心管中,用磷酸盐缓冲液(含0.6 mol/L KCl,pH=7.0) 稀释到1 g/L备用。准确吸取200 μL蛋白液于96孔酶标板中,以ANS为探针,准确吸取6.5 μL 0.8 mmol/L的ANS到对应的蛋白液中。全波长酶标仪参数设定如下:激发波长380 nm,发射波长475 nm,激发和发射波长的狭缝均设定为5 nm。以原料肉中肌原纤维蛋白为对照,表面疏水性计算公式如公式(2)所示:
疏水强度![]()
(2)
1.3.5 肌原纤维蛋白傅里叶变换红外光谱分析
参考蓝蔚青等[19]的方法。
1.3.6 肌原纤维蛋白内源荧光光谱分析
参考李庆舒等[20]的方法。
1.3.7 肌原纤维蛋白紫外吸收光谱分析
参考康怀彬等[21]的方法。
1.3.8 肌原纤维蛋白对4-乙基愈创木酚吸附能力的测定
4-乙基愈创木酚标品用适量1,2-丙二醇溶解,用双蒸水调整溶液中各化合物终浓度为800 mg/kg,密封后置于-4 ℃冰箱备用。加入到试验样品中的4-乙基愈创木酚浓度为:0.5 g/mg,密封后于4 ℃冰箱储存备用。
将不同关键加工环节的肌原纤维蛋白溶液用20 mmol/L K2HPO4/KH2PO4磷酸盐缓冲液(含0.6 mol/L KCl, pH=7.0)稀释到质量浓度1 g/L。精准吸取5 mL混合溶液于20 mL顶空样品瓶中,添加4-乙基愈创木酚储备液使各4-乙基愈创木酚终质量浓度为1 mg/L。密封置于4 ℃下吸附16 h。空白组为不含蛋白而添加同等体积的磷酸盐缓冲液。
蛋白质对4-乙基愈创木酚吸附能力用溶液中4-乙基愈创木酚自由比例相对值表示,自由比例计算如公式(3)所示;空白溶液中4-乙基愈创木酚的顶空浓度定义为100%,吸附能力计算如公式(4)所示:
溶液中4-乙基愈创木酚自由比例![]()
(3)
肌原纤维蛋白对4-乙基愈创木酚吸附能力/%
(4)
式中:Ac,空白溶液中风味化合物的峰面积,As,白样品溶液中风味化合物的峰面积[22]。
每组实验设置3次平行,结果用(x±s)表示。采用IBM SPSS Statistics 23软件进行数据分析,数据统计方法采用ANOVA进行LSD差异分析,P<0.05表示差异显著。Origin 2016软件用于制图。
蛋白质巯基分为表面活性巯基和包埋于蛋白质分子内部的巯基,蛋白质中巯基与二硫键的形成紧密相关,二硫键是维持蛋白质空间结构的重要化学键[23]。由图1可知,相比于原料肉,不同关键加工环节肌原纤维蛋白中巯基含量均有不同程度下降,在斩拌环节巯基总量最少,降低了31.3%,这可能是因为外部高速剪切作用力使蛋白质结构发生延展,导致二硫键断裂,掩埋于蛋白质内部的巯基逐渐暴露至蛋白表面,引起表面巯基升高,从而使巯基总量升高[24]。蒸煮后肌原纤维蛋白巯基含量上升,这可能与高温促使肌原纤维蛋白变性,更多的巯基基团暴露,但蒸煮是一个持续性的过程,巯基基团暴露的同时也有巯基形成二硫键,最终使得蛋白结构趋于稳定。

图1 西式火腿关键加工环节肌原纤维蛋白巯基总量变化
Fig.1 Changes of key processing operations of western-style smoked ham on total sulfhydryl content of myofibrillar protein
蛋白质的表面疏水性是位于蛋白质表面的疏水性氨基酸的相对含量,表征蛋白质与水之间相互排斥的物理性质[25]。由图2可知,以原料肉为对照,不同加工关键环节肌原纤维蛋白表面疏水性显著升高(P<0.05)。腌制环节肌原纤维蛋白表面疏水性显著上升,可能与腌制过程中添加的食盐有关,NaCl使埋藏于肌原纤维蛋白分子内部的疏水性残基暴露到表面,使得表面疏水性升高。真空滚揉环节肌原纤维蛋白表面疏水性最高(P<0.05),相比原料肉升高了61%。推测原因为在真空环境下,间歇滚揉破坏了蛋白质的高级结构,蛋白的疏水性氨基酸如色氨酸、苯丙氨酸等残基暴露至蛋白表面,使得表面疏水性增加[26]。斩拌和蒸煮环节的肌原纤维蛋白表面疏水性未显示差异,说明高速剪切力与低温蒸煮对于西式火腿中肌原纤维蛋白表面疏水性的影响无明显差别。CHELH[27]的研究表明,随着加热温度的上升和加热时间的延长,肌原纤维蛋白的表面疏水性不断升高。其研究中,肌原纤维蛋白的加热温度最高为70 ℃,加热时间最长为60 min,而在西式火腿的蒸煮环节,蒸煮温度为80 ℃时间2 h,在长时间蒸煮过程中,蛋白质发生变性且结构趋于稳定,故蛋白质表面疏水性并不会一直升高。

图2 西式火腿关键加工环节肌原纤维蛋白表面疏水性变化
Fig.2 Changes of key processing operations of western-style smoked ham on surface hydrophobicity of myofibrillar protein
如图3所示,西式火腿原料肉中肌原纤维蛋白酰胺A带吸收峰为3 436 cm-1,酰胺B带吸收峰为2 933 cm-1,酰胺Ⅰ带为1 637 cm-1,酰胺Ⅱ带吸收峰为1 396 cm-1,酰胺Ⅲ带吸收峰未1 259 cm-1[29]。在红外光谱信息中,酰胺A带主要由N—H的伸缩振动产生,酰胺Ⅰ带则反应了C![]() O的伸缩振动,酰胺Ⅱ带主要有由C—H的伸缩或N—H的完全振动产生[28]。与原料肉肌原纤维蛋白酰胺A带吸收峰相比,腌制和斩拌环节肌原纤维蛋白的酰胺A带未发生明显位移,吸收峰出现在3 440 cm-1;真空滚揉环节肌原纤维蛋白酰胺A带吸收峰为3 444 cm-1,有轻微红移,这可能是因为真空环境下,间歇性滚揉使得蛋白质键长变短,使吸收峰向右移动。蒸煮环节肌原纤维蛋白的酰胺A带吸收峰左移至3 425 cm-1,表明N—H的伸缩振动发生变化。真空滚揉和斩拌环节酰胺B带吸收峰相比原料肉分别左移至2 925、2 923 cm-1,相比于原料肉中肌原纤维蛋白的酰胺Ⅲ带吸收峰,斩拌和蒸煮环节肌原纤维蛋白的吸收峰右移至1 271、1 272 cm-1,说明在西式火腿加工过程中,肌原纤维蛋白的酰胺A带、酰胺B带、酰胺Ⅲ带特征吸收峰发生了不同程度的移动,而且肌原纤维蛋白吸光度强度不同,表明了蛋白质二级结构发生了不同程度改变。
O的伸缩振动,酰胺Ⅱ带主要有由C—H的伸缩或N—H的完全振动产生[28]。与原料肉肌原纤维蛋白酰胺A带吸收峰相比,腌制和斩拌环节肌原纤维蛋白的酰胺A带未发生明显位移,吸收峰出现在3 440 cm-1;真空滚揉环节肌原纤维蛋白酰胺A带吸收峰为3 444 cm-1,有轻微红移,这可能是因为真空环境下,间歇性滚揉使得蛋白质键长变短,使吸收峰向右移动。蒸煮环节肌原纤维蛋白的酰胺A带吸收峰左移至3 425 cm-1,表明N—H的伸缩振动发生变化。真空滚揉和斩拌环节酰胺B带吸收峰相比原料肉分别左移至2 925、2 923 cm-1,相比于原料肉中肌原纤维蛋白的酰胺Ⅲ带吸收峰,斩拌和蒸煮环节肌原纤维蛋白的吸收峰右移至1 271、1 272 cm-1,说明在西式火腿加工过程中,肌原纤维蛋白的酰胺A带、酰胺B带、酰胺Ⅲ带特征吸收峰发生了不同程度的移动,而且肌原纤维蛋白吸光度强度不同,表明了蛋白质二级结构发生了不同程度改变。

图3 西式火腿关键加工环节肌原纤维蛋白傅里叶变换红外光谱图
Fig.3 Fourier transform infrared spectra of myofibrillar protein at key processing operations of western-style smoked ham
研究表明,蛋白质中的色氨酸 (Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)残基对紫外光具有吸收作用,使蛋白质具有吸收紫外光的能力[30]。如图4所示,以原料肉中肌原纤维蛋白紫外最大吸收峰波长(λmax)为289 nm,腌制和蒸煮环节肌原纤维蛋白λmax未发生明显偏移,分别为294和295 nm。真空滚揉和斩拌环节肌原纤维蛋白λmax分别红移至302 nm和301nm,红移现象的发生说明Tyr和Trp残基周围的微环境极性增加,表明蛋白质受到溶剂效应影响结构发生了变化,这些氨基酸残基在经过腌制、真空滚揉和斩拌后数量增加,以更高的浓度暴露于溶剂中。蒸煮环节肌原纤维蛋白λmax降低说明氨基酸参加对紫外吸收光能力降低,λmax轻微蓝移至284 nm,这说明蛋白质所处微环境发生改变。

图4 西式火腿关键加工环节肌原纤维蛋白紫外吸收光谱图
Fig.4 Ultraviolet-visible spectra of myofibrillar protein at key processing operations of western-style smoked ham
随着不同外界作用和所处环境的变化,蛋白质构象也会产生变化,其芳香族氨基酸残基的位置与其所处微环境也会随之发生改变[31]。DUFOUR等[32]还利用荧光光谱检测蛋白质与配体结合的构象变化。因此,内源性荧光光谱法可以作为研究蛋白质构象的一种方法。如图5所示,西式火腿原料肉中肌原纤维蛋白的荧光峰位置在328 nm,腌制、真空滚揉和斩拌后荧光峰位置相对原料肉发生轻微红移,荧光峰位置分别为335、339和340 nm,蒸煮环节肌原纤维蛋白荧光峰位置出现在334 nm。

图5 西式火腿关键加工环节肌原纤维蛋白内源荧光光谱图
Fig.5 Intrinsic fluorescence spectra of myofibrillar protein at key processing operations of western-style smoked ham
如图6所示,不同关键加工环节肌原纤维蛋白对4-乙基愈创木酚的吸附作用不同,原料肉中肌原纤维蛋白4-乙基愈创木酚的自由比例为83.42%,即16.58%的4-乙基愈创木酚被肌原纤维蛋白吸附。在腌制和真空滚揉环节4-乙基愈创木酚的自由比例显著降低(P<0.05),真空滚滚揉环节最低为69.79%,表明真空滚揉环节肌原纤维蛋白对4-乙基愈创木酚吸附能力最强,达到30.21%。蛋白质疏水区域与风味结合有紧密联系,验证了表面疏水性相对较强的环节其对风味物质吸附能力较强[33]。斩拌和蒸煮环节4-乙基愈创木酚自由比例自69.79%升高至95.38%、95.04%,此时肌原纤维蛋白对4-乙基愈创木酚吸附能力显著降低(P<0.05)。这可能与快速剪切和升高温度导致肌原纤维蛋白结构发生变化,从而抑制了蛋白对4-乙基愈创木酚的吸附有关。
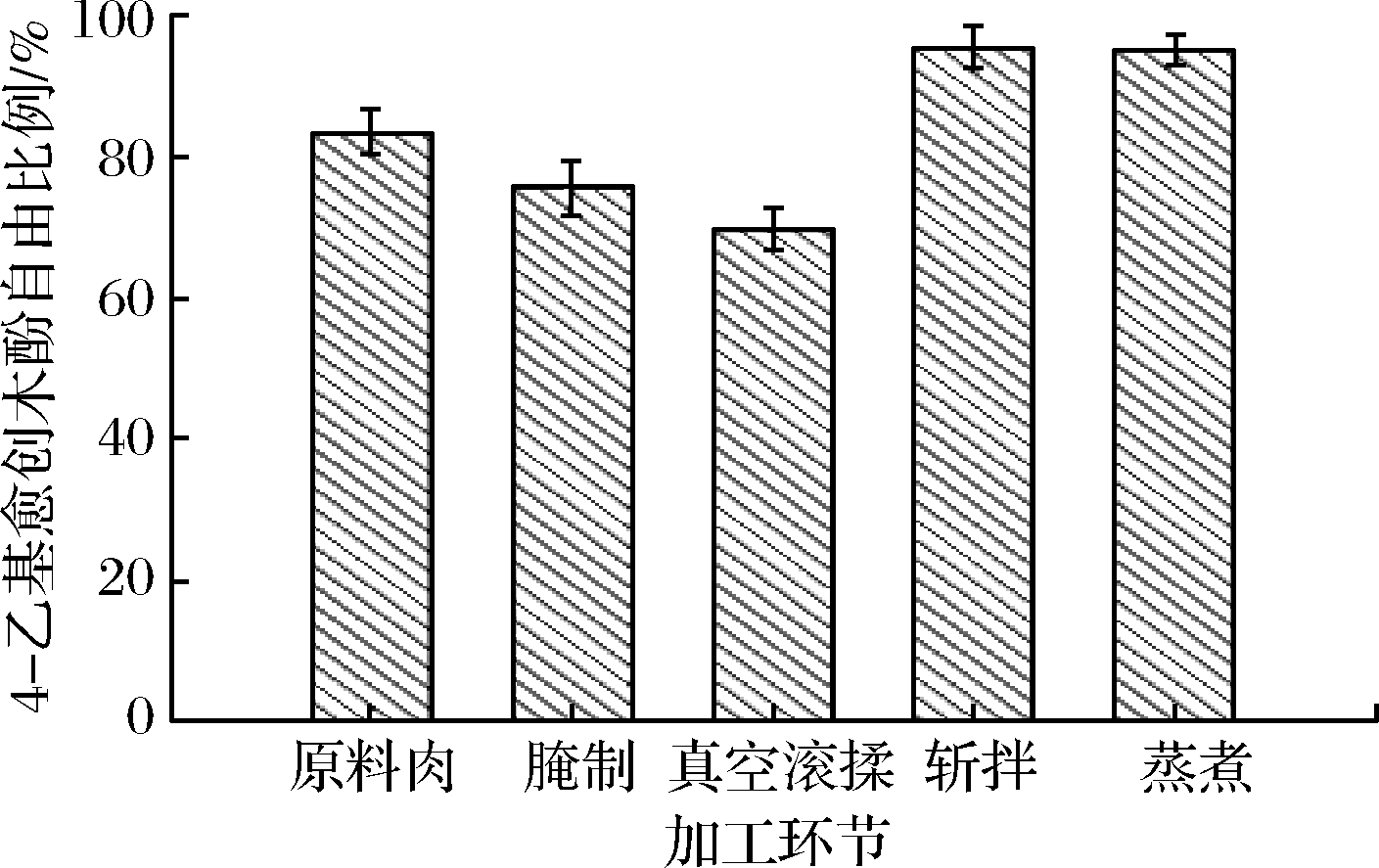
图6 西式火腿关键加工环节肌原纤维蛋白吸附4-乙基愈创木酚情况
Fig.6 Myofibrillar protein adsorption of 4-ethylguaiacol at key processing operations of western-style smoked ham
利用光谱学和SPME-GC-MS方法,探讨西式火腿不同关键加工环节肌原纤维蛋白结构的变化以及对烟熏液主体烟熏成分4-乙基愈创木酚吸附能力的影响。以原料肉肌原纤维蛋白为对照,各关键加工环节肌原纤维蛋白巯基总量均不同程度降低,斩拌环节最低,肌原纤维蛋白表面疏水性则呈不同程度升高趋势,在真空滚揉环节最高;光谱学信息反映,肌原纤维蛋白的酰胺A带、酰胺B带、酰胺Ⅲ带均发生变化,其中真空滚揉环节位移明显,真空滚揉环和斩拌节肌原纤维蛋白紫外最大吸收峰波长发生红移,荧光峰在腌制、真空滚揉和斩拌环节也出现红移,说明蛋白质结构在西式火腿加工进程中发生了明显变化,其中真空滚揉环节蛋白质结构向有利于风味结合转变;经过蛋白对4-乙基愈创木酚吸附能力实验,发现真空滚揉后肌原纤维蛋白对4-乙基愈创木酚依附能力最强,说明相比于其他环节,真空滚揉有利于蛋白质与风味物质结合。
综上,西式火腿不同关键加工环节对肌原纤维蛋白结构及对风味物质吸附能力影响不同,蛋白质构象的改变引起风味物质吸附能力不同;其中真空滚揉环节肌原纤维蛋白表面疏水性强,有更多疏水集团暴露于表面,对于4-乙基愈创木酚吸附能力最强。本研究为西式火腿生产中烟熏液的使用提供理论依据,同时对肉品加工环节与风味形成机制的探讨有积极意义。
[1] WANG Y, JIANG,Y T, CAO J X, et al. Study on lipolysis-oxidation and volatile flavour compounds of dry-cured goose with different curing salt content during production[J]. Food Chemistry,2016,190:33-40.
[2] LOU X W, YANG Q L, SUN Y Y, et al. The effect of microwave on the interaction of flavour compounds with G-actin from grass carp (Catenopharyngodon idella)[J]. Journal of the Science of Food and Agriculture, 2017,97(12):3 917-3 922.
[3] SHEN H, ZHAO M M, SUN W Z. Effect of pH on the interaction of porcine myofibrillar proteins with pyrazine compounds. Food Chemistry, 2019,287:93-99.
[4] P REZ-JUAN, M, FLORES, M, TOLDR
REZ-JUAN, M, FLORES, M, TOLDR , F. Binding of aroma compounds by isolated myofibrillar proteins: Effect of protein concentration and conformation[J].Food Chemistry,2007,105(3):932-939.
, F. Binding of aroma compounds by isolated myofibrillar proteins: Effect of protein concentration and conformation[J].Food Chemistry,2007,105(3):932-939.
[5] ZHOU F B, ZHAO M M, SU G W, et al. Binding of aroma compounds with myofibrillar proteins modified by a hydroxyl-radical-induced oxidative system[J]. Journal of Agricultural and Food Chemistry,2014,62(39):9 544-9 552.
[6] LV T, WANG Y, PAN D D, et al. Effect of trypsin treatments on the structure and binding capacity of volatile compounds of myosin[J]. Food Chemistry,2017,214:710-716.
[7] 彭林,马良,戴宏杰,等.多酚与肌原纤维蛋白相互作用机制及其对蛋白特性的影响研究进展[J/OL].食品科学:1-11[2019-11-08].http://kns.cnki.net/kcms/detail/11.2206.ts.20190917.1752.129.html.
[8] 蒋丽施.西式火腿类低温肉制品品质变化研究[D]. 重庆:西南大学, 2012.
[9] 高宁宁,胡萍,朱秋劲,等. 烟熏液及其在肉制品中的应用研究进展[J]. 肉类研究, 2019,33(1):66-70.
[10] 刘登勇,王逍,吴金城,等. 肉制品烟熏风味物质研究进展[J]. 肉类研究, 2018,32(10):53-60.
[11] 王维君,张义,王稳航. 3种烟熏液的成分分析及其对肠衣性能的影响[J]. 食品研究与开发, 2016,37(6):161-165.
[12] SHEN H, HUANG M, ZHAO M, et al. Interactions of selected ketone flavours with porcine myofibrillar proteins: The role of molecular structure of flavour compounds[J]. Food Chemistry, 2019,298:125060.
[13] 吕彤,林俊杰,周昌瑜,等. 热处理强度对猪肉肌球蛋白结构及风味成分吸附特性的影响[J]. 农业工程学报, 2016,32(8):285-291.
[14] ZHANG Z, YANG Y, ZHOU P, et al. Effects of high-pressure modification on conformation and gelation properties of myofibrillar protein[J]. Food Chemistry, 2017,217:678-686.
[15] ZHANG Z, REGENSTEIN J M, ZHOU P, et al. Effects of high intensity ultrasound modification on physicochemical property and water in myofibrillar protein gel[J]. Ultrasonics Sonochemistry, 2017,34:960-967.
[16] 曹锦轩,张玉林,韩敏义,等.腊肉加工过程中肌原纤维蛋白结构的变化[J].中国农业科学,2013,46(18):3 871-3 877.
[17] XU Y, ZHAO J, WANG R, et al. Effect of heat treatment on the binding of selected flavor compounds to myofibrillar proteins[J]. J Sci Food Agric, 2019,99(11):5 028-5 034.
[18] BOYER C, JOANDEL S, OUALI A, et al. Determination of surface hydrophobicity of fast and slow myosins from rabbit skeletal muscles: implication in heat-induced gelation[J]. Journal of the Science of Food and Agriculture, 1996,72(3):367-375.
[19] 蓝蔚青,胡潇予,阮东娜,等. 傅里叶红外结合拉曼分析卡拉胶寡糖对南美白对虾蛋白结构影响[J]. 光谱学与光谱分析, 2019,39(8):2 507-2 514.
[20] 李庆舒,程琳,邓红,等.三种多酚与牛血清蛋白相互作用的初步研究[J].食品与发酵工业,2020,46(3):128-135.
[21] 康怀彬, 邹良亮, 张慧芸, 等. 高温处理对牛肉蛋白质化学作用力及肌原纤维蛋白结构的影响[J]. 食品科学, 2018,39(23):80-86.
[22] 周昌瑜,蒋娅婷,曹锦轩,等.肌原纤维蛋白浓度对风味物质吸附能力的影响[J].核农学报,2016,30(5):904-911.
[23] ZHAO X, HAN G, SUN Q, et al. Influence of lard-based diacylglycerol on the rheological and physicochemical properties of thermally induced pork myofibrillar protein gels at different pH levels[J]. LWT, 2020,117:108 708.
[24] 胡熠,张进杰,唐艳,等. 没食子酸对海鳗肌原纤维蛋白氧化及凝胶特性的影响[J]. 核农学报, 2019,33(11):2 203-2 210.
[25] 鲁小川,窦川林,尚永彪.鼠尾草提取物对鲢鱼肌原纤维蛋白结构及功能特性的影响[J].食品与发酵工业,2019,45(15):100-107.
[26] 周丹蕾. 胞红蛋白的巯基修饰与光谱检测[J]. 光谱学与光谱分析, 2019,39(9):2 868-2 872.
[27] CHELH I, GATELLIER P, SANT -LHOUTELLIER V. Technical note: A simplified procedure for myofibril hydrophobicity determination[J]. Meat Science, 2006,74(4):681-683.
-LHOUTELLIER V. Technical note: A simplified procedure for myofibril hydrophobicity determination[J]. Meat Science, 2006,74(4):681-683.
[28] 曾斯杰,刘红,王友法,等. 近红外光谱在食品工业应用的研究进展[J]. 中国调味品, 2019,44(7):179-183.
[29] 冯静.脆肉鲩脆性形成过程中肌肉蛋白结构及风味成分变化研究[D]. 上海:上海海洋大学, 2017.
[30] LEFEVRE F, FAUCONNEAU B, THOMPSON J W, et al. Thermal denaturation and aggregation properties of atlantic salmon myofibrils and myosin from white and red muscles[J]. Journal of Agricultural and Food Chemistry, 2007,55(12):4 761-4 770.
[31] ANTOSIEWICZ J M, SHUGAR D. UV-Vis spectroscopy of tyrosine side-groups in studies of protein structure. Part 1: basic principles and properties of tyrosine chromophore[J]. Biophys Review, 2016,8(2):151-161.
[32] DUFOUR E, MARDEN M C, HAERTL T. β-Lactoglobulin binds retinol and protoporphyrin IX at two different binding sites[J]. FEBS Letters, 1990, 277(1-2): 223-226.
T. β-Lactoglobulin binds retinol and protoporphyrin IX at two different binding sites[J]. FEBS Letters, 1990, 277(1-2): 223-226.
[33] VOILLEY C D A A. Effect of food composition and microstructure on volatile flavour release[J]. Trends in Food Science & Technology, 1997,8(11):364-368.