干酪素又名乳酪素、酪素或酪蛋白,是一种性能独特的天然蛋白类基础原料,可以作为食品添加剂或品质改良剂广泛应用于食品、医药、轻工等领域[1]。国外干酪素的生产原料主要是鲜乳,但国内由于乳源不足,用鲜乳生产干酪素相对较少[2]。目前,我国干酪素生产的主要原料是来自藏族地区的“曲拉”,“曲拉”(藏语,指奶干渣)是牧民将牦牛乳提取酥油后进行凝固沉淀,再经过自然发酵、风干而成的蛋白质含量丰富的产品,因其价格低廉、来源方便,是制备干酪素的理想原料[3]。与酸法生产的干酪素相比,酶法干酪素具有持久的乳香味和良好的凝胶性,还具有较好的染色附着力,用途较广泛[4-5]。小牛皱胃酶是最常用的凝乳酶,用其生产的干酪素出品率较高、品质较好,但我国小牛皱胃酶的生产还没有实现产业化,目前主要依靠国外进口,单纯依靠屠宰小牛提取凝乳酶无法满足市场的需要[6]。
目前以曲拉为原料,利用酸法生产干酪素已有大量报道[7-8],但采用凝乳酶制备食品级干酪素的报道依然相对较少。凝乳酶干酪素制备过程中,由于单一酶的凝乳效果有限,本实验拟采用混合酶进行凝乳试验,但不同酶的混合比例是研究的难点。混料设计是一种特殊的回归设计,是研究混合料中不同组分比例变化对得率影响的一种有效方法,通过对多项式方程的回归分析,来预测混合料组分的最佳比例,现已在多学科领域广泛应用[9]。因此,本实验以曲拉为原料,采用胃蛋白酶、木瓜凝乳酶和酵母凝乳酶复配成混合凝乳酶,首先采用单因素实验研究混合凝乳酶添加量、凝乳pH、凝乳温度、凝乳时间和CaCl2添加量对出品率的影响,再通过混料设计优化混合凝乳酶中不同凝乳酶的组成比例,并对干酪素的理化性质、红外光谱特性、热力学性质进行分析,以期为凝乳酶干酪素开发利用提供参考。
曲拉,四川甘孜藏族自治州泸定县;小牛皱胃酶(酶活≥20 000 U/g),美国Sigma-Aldrich科技公司;胃蛋白酶(酶活≥800 000 U/g),上海瑞永生物科技有限公司;木瓜凝乳酶(酶活≥20 000 U/g),广西庞博生物工程有限公司;酵母凝乳酶(酶活≥60 000 U/g),DSM有限公司。
NaOH、HCl、CaCl2、KBr等试剂均为分析纯。
DF-101S恒温水浴锅,上海力辰科技有限公司;PHS-3C pH计,上海仪电科学仪器股份有限公司;KDN-1全自动凯氏定氮仪,上海雷磁科技有限公司;DHG-9245A电热恒温鼓风干燥箱,上海一恒科技有限公司;KH19A台式通用高速离心机,湖南凯达科学仪器有限公司;NicoletIS10傅里叶变换红外光谱仪,赛默飞世尔科技(中国)有限公司,Q200MDSC差示扫描量热仪,美国TA仪器(沃特世科技(上海)有限公司)。
1.3.1 小牛皱胃酶干酪素的制备工艺
小牛皱胃酶干酪素的制备工艺参考韩玲等[10]的方法进行。
1.3.2 混合凝乳酶干酪素的制备工艺
1.3.2.1 工艺流程
参考韩玲等[10]和常海军等[11]的方法,确定牦牛“曲拉”干酪素工艺流程为:
原料粉碎→碱液溶解→过滤→离心分离→巴氏杀菌→冷却→凝乳→洗涤→烘干→成品
1.3.2.2 操作要点
溶解:将曲拉粉粹后与水以1∶11体积比混合,置于65 ℃的水浴锅中搅拌溶解,同时缓慢滴加质量分数为16% NaOH溶液,直至曲拉全部溶解;搅拌30 min后用100目滤布过滤,除去机械杂质。
离心:将滤液加热到45 ℃,以4 000 r/min转速离心,除去脂肪以及杂质。
凝乳:按实验设计要求调整滤液pH值、温度,加入酶和CaCl2,并适当搅拌,使干酪素充分凝集沉淀。
脱水造粒:将200目滤布过滤得到的凝固物,用水洗涤3次,压榨脱水后,加压使水分充分挤出,揉搓造粒。
干燥:在42 ℃条件下于恒温干燥箱中干燥30 min,所得粉末即为成品。
出品率按公式(1)计算:
出品率![]()
(1)
1.3.2.3 实验设计
(1)单因素实验
以出品率为指标,首先研究不同种类酶(胃蛋白酶、木瓜凝乳酶和酵母凝乳酶)对出品率的影响;再研究混合凝乳酶(设定胃蛋白酶∶木瓜凝乳酶∶酵母凝乳酶的质量比为0.33∶0.33∶0.33,3种酶比例之和为1)在不同凝乳时间、温度、酶添加量和CaCl2添加量条件下对出品率的影响,以确定混合凝乳酶的最优酶凝条件,每次实验重复3次。
酶的种类:在预实验基础上,研究不同种类酶对出品率的影响。具体酶凝条件为:添加质量分数为1%的胃蛋白酶、pH 6.0、30 min、40 ℃、添加质量分数为1%的CaCl2;添加质量分数为1%木瓜凝乳酶、pH 6.0、30 min、40 ℃、添加质量分数为1%的CaCl2;添加质量分数为1%的酵母凝乳酶、pH 5.5、30 min、50 ℃、添加质量分数为1%的CaCl2。
凝乳时间:在pH 6.0、40 ℃、添加质量分数为1%的混合酶、质量分数为1%的CaCl2,研究凝乳时间对出品率的影响。
凝乳温度:在pH 6.0、30 min、添加质量分数为1%的混合酶、质量分数为1%的CaCl2,研究凝乳温度对出品率的影响。
凝乳pH:在凝乳时间30 min、45 ℃、添加质量分数为1%的混合酶、质量分数为1%的CaCl2,研究凝乳pH对出品率的影响。
凝乳酶添加量:在pH 6.3、30 min、45 ℃、添加质量分数为1%的CaCl2,研究混合凝乳酶添加量对出品率的影响。
CaCl2添加量:在pH 6.3、30 min、45 ℃、添加质量分数为1%的混合酶条件下,研究CaCl2添加量对出品率的影响。
(2)混料设计
在单因素试验基础上,按照Design-Expert软件(11.0版)有“上下限制约束”的混料设计,对混合凝乳酶中胃蛋白酶、木瓜凝乳酶、酵母凝乳酶的不同混合比例进行优化,以确定3种酶的适宜配比,每次实验重复3次。
在混合物设计中,实验条件必须满足约束条件,其中Xi表示第i分量的分数,0≤Xi≤1, i=1, 2, …, q。在这项研究中,混合酶由A(胃蛋白酶)、B(木瓜凝乳酶)和C(酵母凝乳酶)组成。混合酶的添加量以“曲拉”原料的质量百分比为基础,混合酶的总和等于100%。按照“上下限制约束”混料进行条件设置,即0<A<1、0<B<1、0<C<1为约束条件,研究不同组分比例对提取率的影响。通过Design-Expert软件自动优化,约束条件分别被修订为0.1≤A≤0.8、0.1≤B≤0.8和0.1≤C≤0.8。每个实验设计点的比例分数如表1所示。通过设计17个随机实验来拟合多项式方程,对不同酶的混合比例进行预测和优化。
1.3.3 常规理化指标检测
干酪素中蛋白质、酪蛋白、脂肪、水分的测定,按照GB31638—2016《食品安全国家标准 酪蛋白》进行。
1.3.4 红外光谱分析
红外光谱分析采用KBr片涂布法进行,取2.0 mg凝乳酶干酪素与一定量预先干燥的KBr混合后经均匀研细,再置于模具中,用油压机上压成透明薄片;然后用红外光谱仪在400~4 000 cm-1、分辨率为4 cm-1、扫描次数32次条件下进行扫描。
1.3.5 差示扫描量热分析
参考WEE 等[12]的方法,对凝乳酶干酪素进行差示扫描量热分析(differential scanning calorimetry,DSC)。取样品10.0 mg装入专用铝坩埚中,加盖密封后放入样品室内,用空坩埚作空白对照,DSC分析在高纯N2保护下进行。具体条件为在20 ℃保持3 min,以10 ℃/min的速率升至190 ℃,N2速率是50 mL/min,记录其热力学曲线。
2.1.1 酶的种类对出品率的影响
由图1可知,以小牛皱胃酶作为对照,在相同的酶添加量条件下,不同酶在各自较适宜凝乳条件下对出品率的影响较大。尽管胃蛋白酶的出品率高于木瓜凝乳酶和酵母凝乳酶,但3种酶的出品率均较低。LUCEY等[13]认为,凝乳酶干酪素制备中最重要的环节就是酶促进蛋白的凝结过程,由于选用凝乳酶种类不同,其凝乳特性和蛋白水解特性会有所差异,从而影响干酪素的出品率。YAN等[14]也认为,凝乳酶通常都是酸性蛋白酶,具有一定的蛋白水解活性,在凝乳过程要防止蛋白的过度水解。因此,胃蛋白酶、木瓜凝乳酶和酵母凝乳酶制备的干酪素出品率都偏低,可能与酪蛋白被其水解有关。由于不同蛋白酶之间存在相互抑制作用,而且3种酶都是酸性蛋白酶,因此,在后续实验中考虑将3种酶按适宜比例混合进行凝乳以提高出品率。
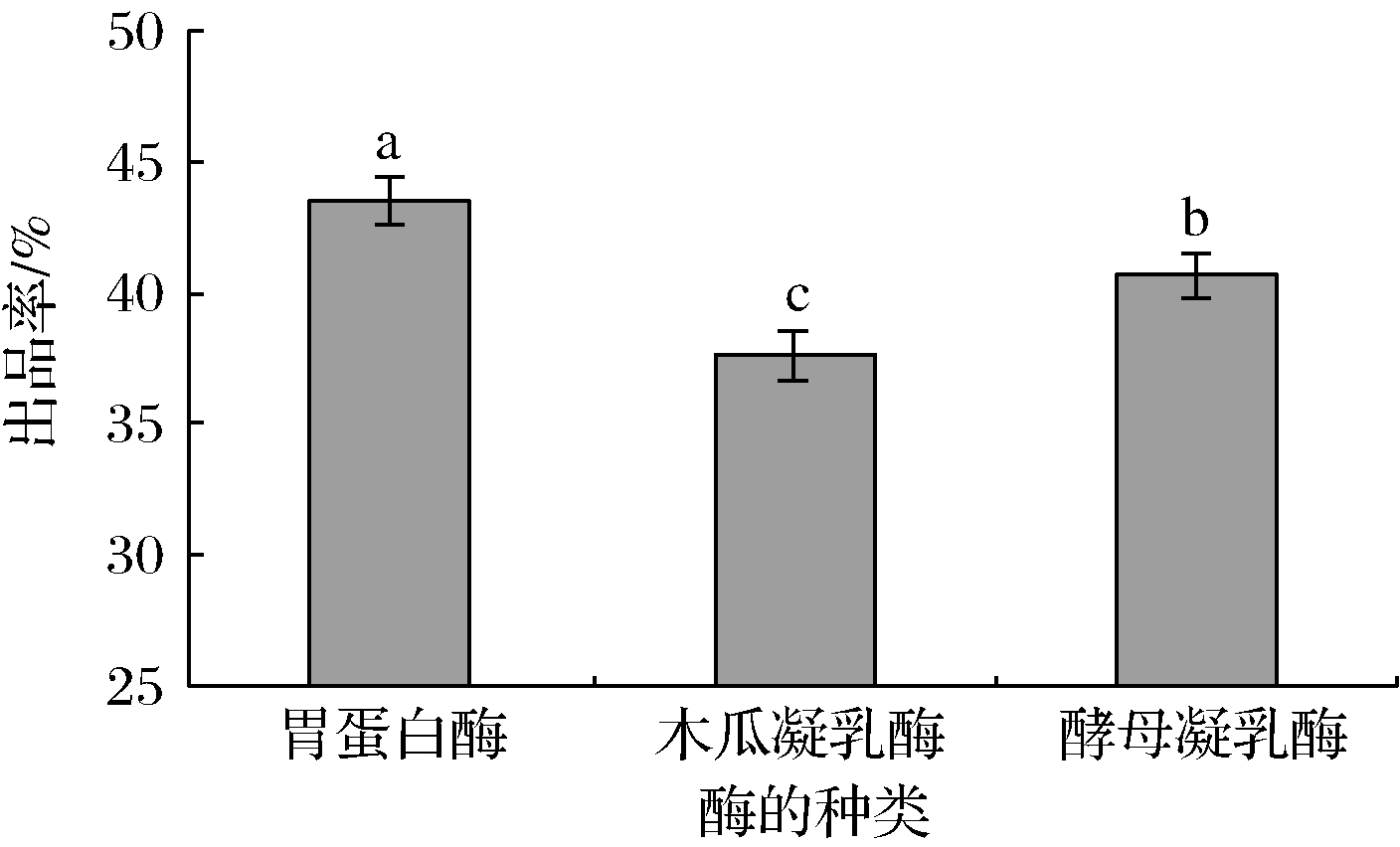
图1 不同种类酶对出品率的影响
Fig.1 Effects of chymosin type on product yield
注:图中不同小写字母表示差异显著(P<0.05)(下同)
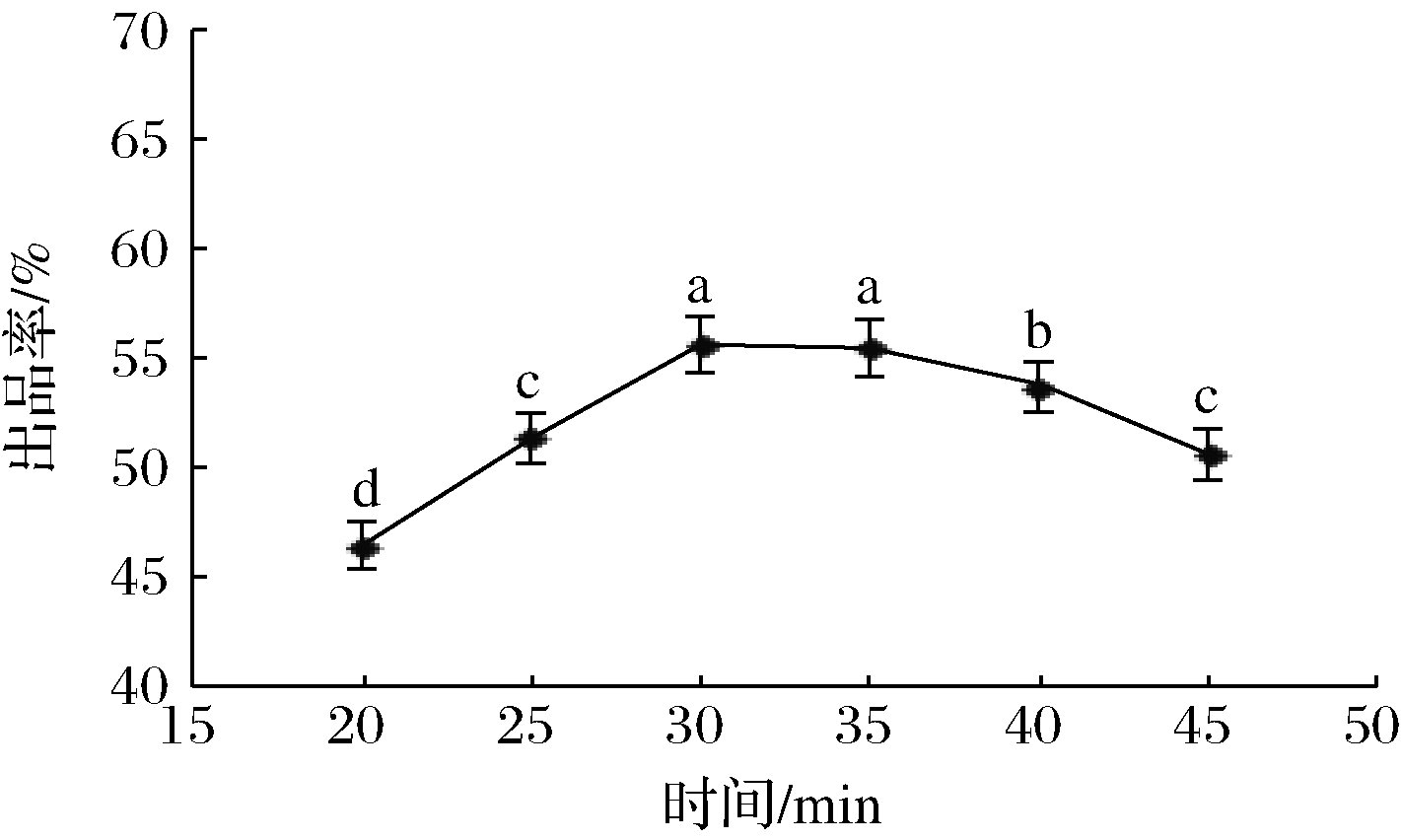
图2 凝乳时间对出品率的影响
Fig.2 Effects of curd time on product yield
2.1.2 凝乳时间对出品率的影响
在pH 6.0、40 ℃、混合酶质量分数1%、CaCl2质量分数1%条件下,研究凝乳时间对出品率的影响,结果如图2所示。
由图2可知,凝乳时间在20~30 min时,随着凝乳时间延长,出品率快速上升;在凝乳时间为30 min时达到最高,但凝乳时间超过30 min后,出品率随着凝乳时间延长而下降。这是因为凝乳时间较短,酪蛋白凝固不充分,出品率相对较低;而混合酶本身是蛋白酶,凝乳时间太长,混合酶可能会对酪蛋白进行降解,导致出品率下降[15]。HAROUN等[16]以骆驼乳和牛乳为原料,利用骆驼胃蛋白酶制备干酪素时证实,凝乳时间太长,蛋白酶的凝结作用下降,水解蛋白质的能力会增强,导致出品率降低。因此,本试验适宜凝乳时间为30 min。
2.1.3 凝乳温度对出品率的影响
在pH 6.0、30 min、混合酶质量分数1%、CaCl2质量分数1%条件下,研究凝乳温度对出品率的影响,结果见图3。
由图3可知,凝乳温度在35~45 ℃,出品率随着温度上升而增加;在凝乳温度为45 ℃时,出品率最高;当温度超过45 ℃时,出品率随着温度上升而下降。通常温度对酶促反应的影响有两方面,一方面是在一定温度范围内,随着反应温度上升,单位时间内酶与底物分子间接触频率增加,酶促反应速度加快;另一方面是由于酶的本质是蛋白质,反应温度过高,酶蛋白发生变性,其活性减弱从而降低酶促反应速度,导致出品率下降。酶促反应的最适温度就是这2个过程平衡的结果。张卫兵等[17]以新鲜牛乳为原料,采用细菌凝乳酶作制备干酪素时也发现,随着温度升高干酪素得率先上升后下降,与本研究结果类似。因此,本试验适宜酶解温度为45 ℃。
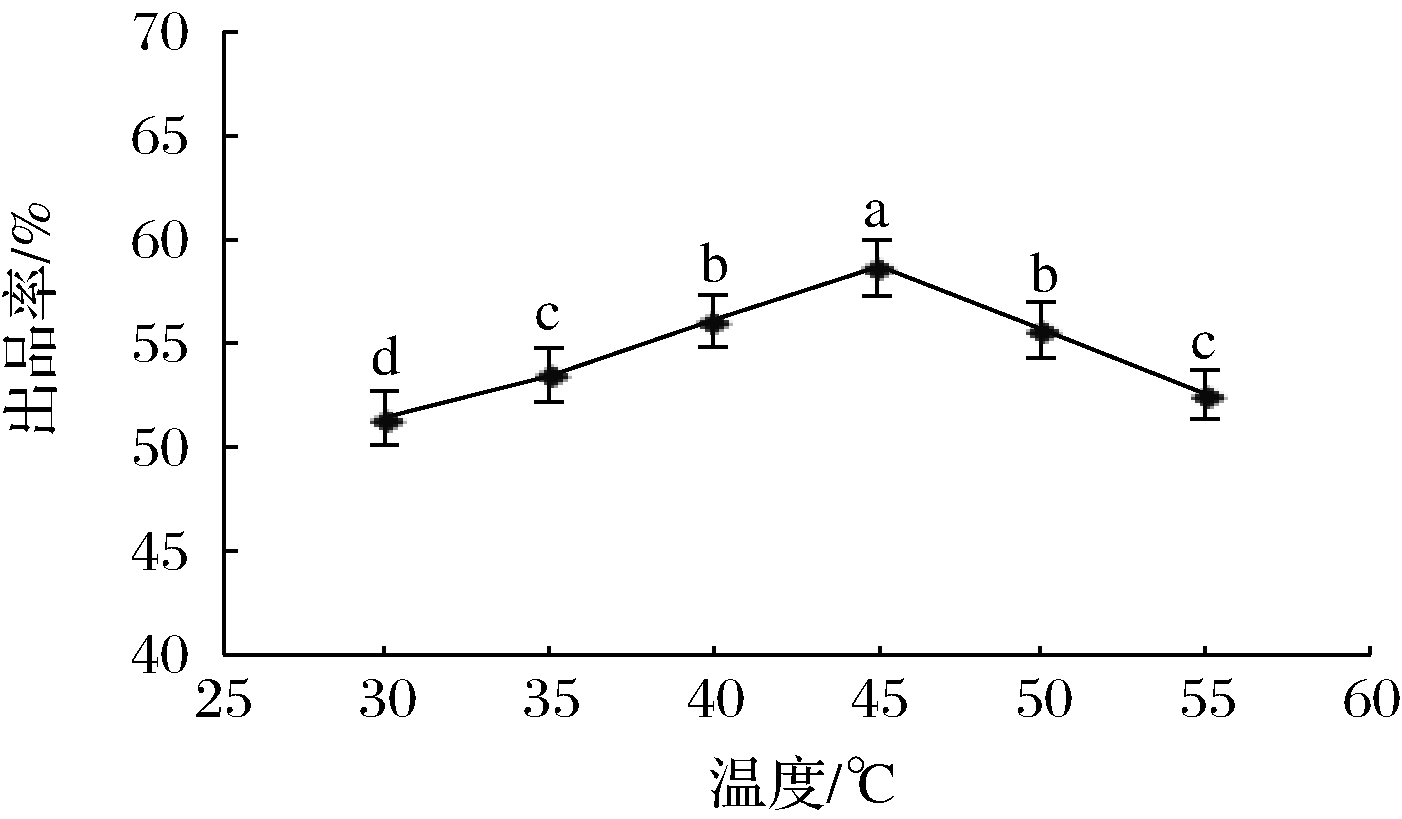
图3 凝乳温度对出品率的影响
Fig.3 Effects of curd temperature on product yield
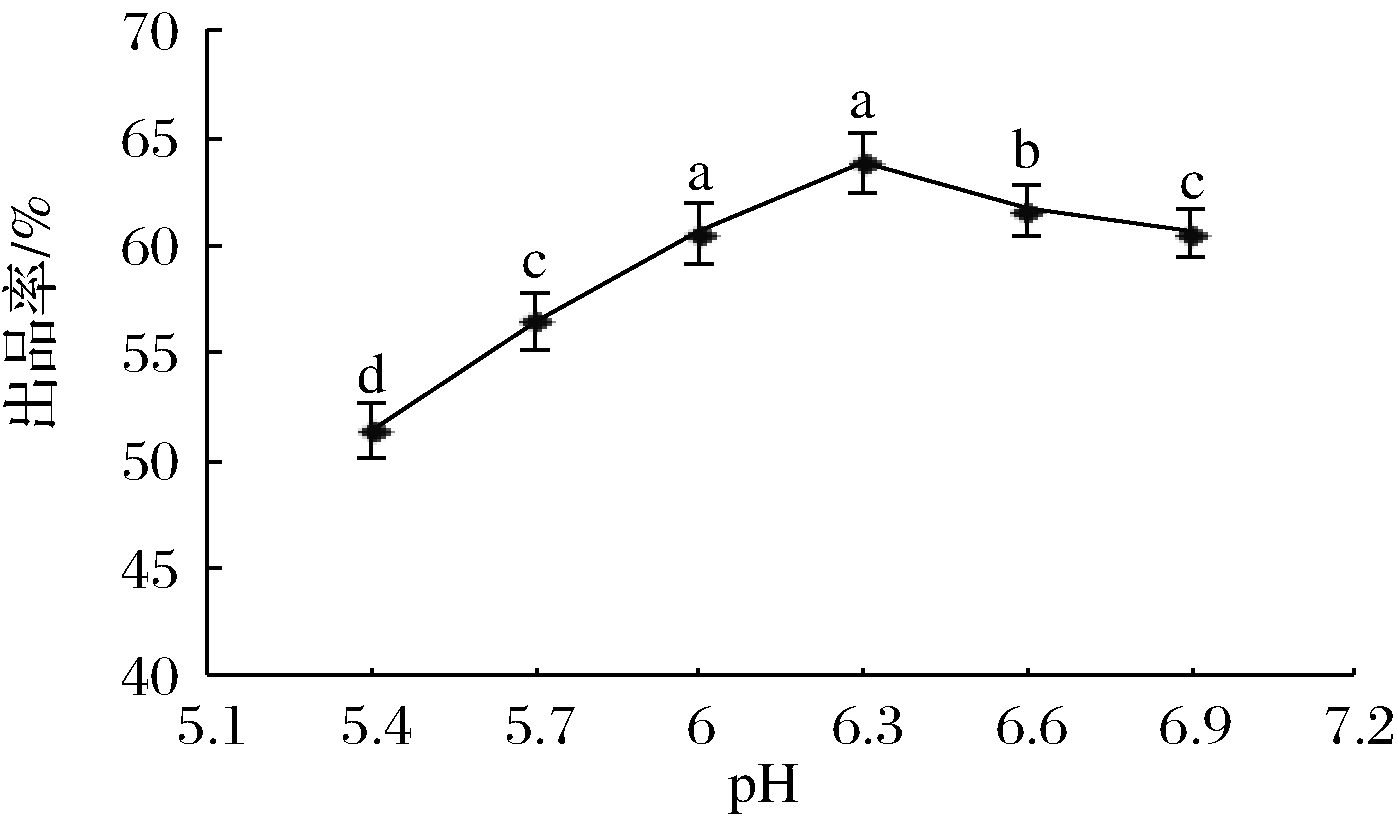
图4 凝乳pH对出品率的影响
Fig.4 Effects of curd pH on product yield
2.1.4 凝乳pH对出品率的影响
在凝乳时间30 min、45 ℃、混合酶质量分数1%、CaCl2质量分数1%条件下,研究凝乳pH对出品率的影响,结果如图4所示。
由图4可知,在pH 5.4~6.3,出品率随着凝乳pH的升高而增加;在pH 6.3时出品率最高;当pH超过6.3时,出品率随pH升高而下降。这可能与混合酶的最适酶解pH有关,过高或过低的pH都会对酶的结构产生影响,甚至使酶变性而失活,从而导致凝乳效果下降。而适宜的pH可以促进酶和底物之间的结合,改善凝乳效果,从而提高干酪素的出品率[18]。纪银莉等[19]在以“曲拉”为原料,采用微小毛霉凝乳酶为凝乳剂制备干酪素时也认为,凝乳pH直接影响凝乳酶的活力,过低或过高的pH都会对凝乳酶活性有抑制作用,影响出品率。因此,本试验适宜凝乳pH为6.3。
2.1.5 混合凝乳酶添加量对出品率的影响
在pH 6.3、30 min、45 ℃、CaCl2质量分数1%的条件下,研究混合凝乳酶添加量对出品率的影响,结果如图5所示。
由图5可知,酶添加量在0.4%~1%,随着凝乳酶添加量的增加,干酪素出品率呈上升趋势;酶质量分数在1%时,出品率达到最高值;当酶质量分数超过1%以后,继续增加酶添加量,出品率则降低。HSIEH等[20]研究认为凝乳酶主要是通过水解κ-酪蛋白中的Phe105-Met106的肽键,生成κ-酪蛋白巨肽和副κ-酪蛋白;当大量κ-酪蛋白被水解时,通过Ca2+的作用,使副κ-酪蛋白发生聚集形成三维网状凝胶。因此凝乳酶添加量较少时,κ-酪蛋白水解不充分,凝乳缓慢,出品率较低。当酶浓度过高,凝乳速度加快,但形成的凝块弹性较差、易碎,水洗时容易造成损失。此外,酶浓度过高,酪蛋白容易被彻底水解为多肽和氨基酸,导致干酪素出品率降低。HORNE等[21]认为,凝乳酶的本质是蛋白酶,添加过量会对底物蛋白产生水解作用,凝乳酶的添加应充分考虑凝乳酶的凝固作用,避免水解酪蛋白。李学朋等[22]在用米黑毛霉制备酶凝干酪素时证实,酶添加量对干酪素的出品率影响较大,与本研究结果类似。因此,本试验适宜添加凝乳酶质量分数为1%。
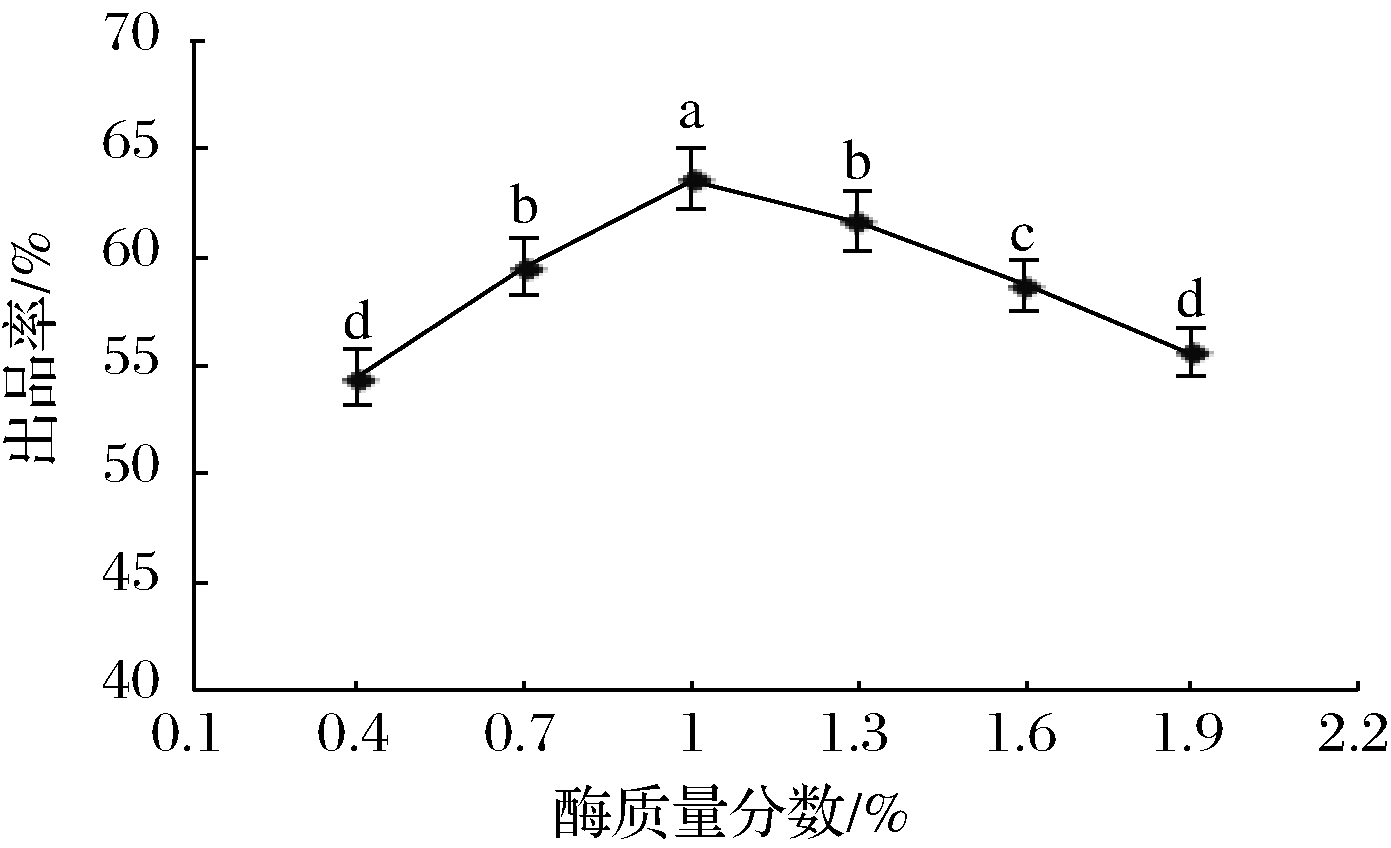
图5 凝乳酶添加量对出品率的影响
Fig.5 Effects of chymosin addition amount on product yield
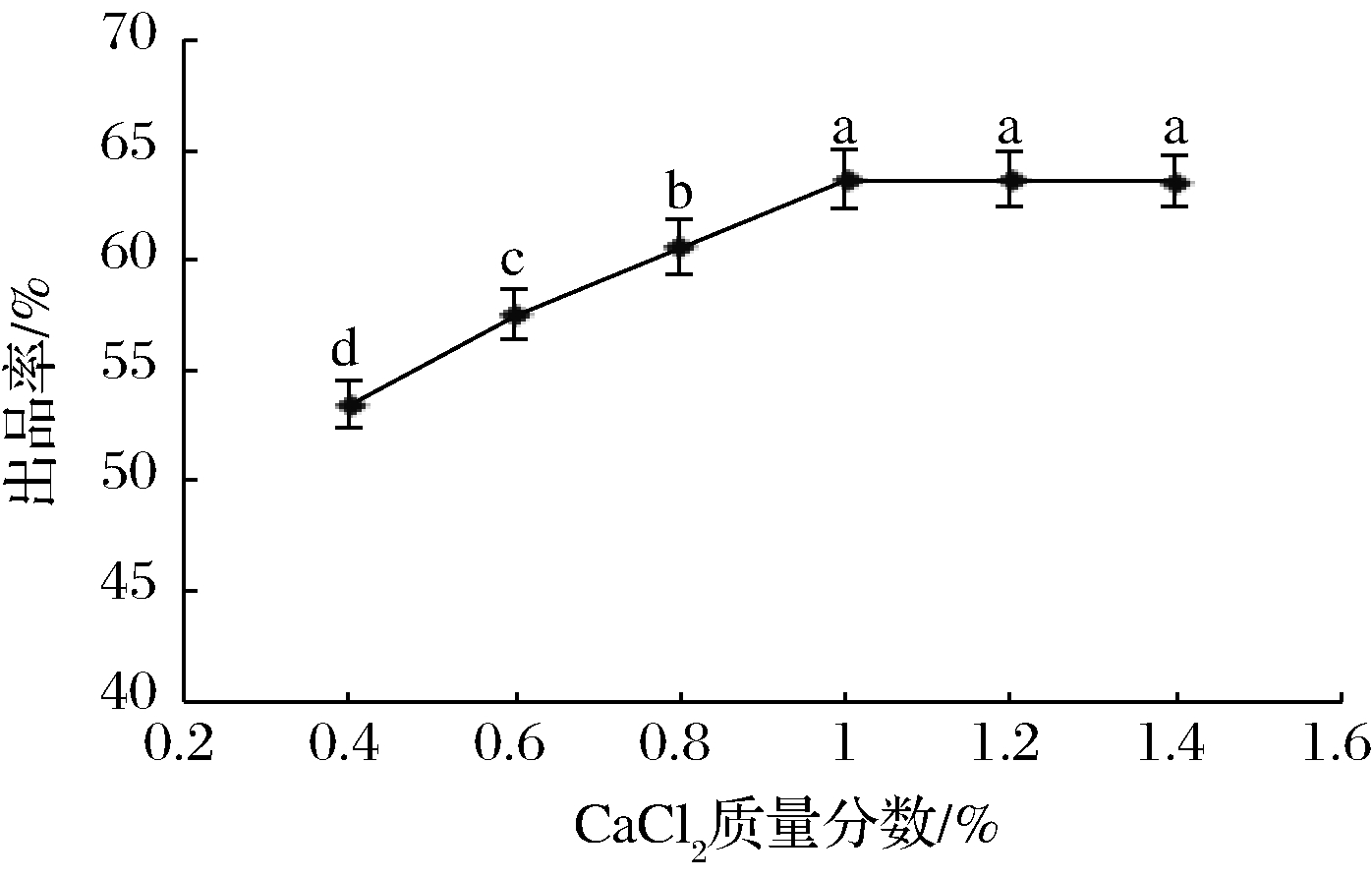
图6 CaCl2添加量对出品率的影响
Fig.6 Effects of CaCl2 addition amount on product yield
2.1.6 CaCl2添加量对出品率的影响
在pH 6.3、30 min、45 ℃、混合凝乳酶质量分数为1%条件下,研究CaCl2添加量对出品率的影响,结果如图6所示。
由图6可知,在添加CaCl2质量分数0.4%~1%,随着CaCl2添加量的增加,干酪素出品率增加;CaCl2质量分数为1%时,出品率最高;继续添加CaCl2,出品率变化不大。通常Ca2+通过增强静电吸附作用,在副酪蛋白分子间形成“钙桥”以促进酪蛋白胶体完成凝聚过程[23]。当Ca2+浓度较低时,钙桥形成不完全,影响凝乳效果。因此随着Ca2+的添加,出品率增加。SMIALOWSKA等[24]研究认为Ca2+不仅参与乳的凝固过程,而且还能稳定凝乳酶的三维结构,保护酶凝乳活性,使凝乳速度加快。当Ca2+浓度超过一定量时,对凝乳效果影响不大。因此,本试验适宜的添加CaCl2质量分数为1%。
2.2.1 混料试验模型的建立
通过Design-expert 11.0软件中混料试验设计原理,以胃蛋白酶添加比例(A)、木瓜凝乳酶添加比例(B)和酵母凝乳酶添加比例(C)为自变量,以出品率(Y)为响应值,将3种酶百分含量分别限定在0.1≤A<1,0.1≤B<1,0.1≤C<1范围内,且A+B+C=1(100%)。经过软件自动优化处理后,约束条件分别被修订为0.1≤A≤0.8、0.1≤B≤0.8和0.1≤C≤0.8,生成各因素的试验方案进行试验,结果如表1所示。
表1 混料设计试验方案及结果
Table 1 Test scheme and results of mixture design

序号A(胃蛋白酶)B(木瓜凝乳酶)C(酵母凝乳酶)Y(出品率)/%10.220.220.5755.65±0.6820.10.80.140.48±0.5230.45 0.10.4564.23±0.6140.570.330.170.29±0.6550.45 0.10.4565.82±0.5860.1 0.80.140.34±0.4170.57 0.10.3375.78±0.5780.330.330.3365.59±0.499 0.330.570.144.83±0.55100.330.330.3365.18±0.72110.45 0.450.158.85±0.6512 0.10.450.4544.19±0.34130.80.10.168.24±0.7514 0.220.570.2243.35±0.53150.330.330.3364.96±0.57160.330.330.3365.47±0.70170.1 0.10.844.54±0.56
通过软件对表1的数据进行优化分析,得到Y与A、B和C之间回归方程模型如下:
Y=68.25A+40.41B+44.58C+15.96AB+34.85AC+7.26BC+211.54ABC+107.87(A-B)+100.95(A-C)-74.30(B-C)
2.2.2 混料试验模型的显著性检验
对混料设计得到的回归方程模型进行方差分析,对模型系数进行显著性检验,结果如表2所示。
表2 回归方程方差分析结果
Table 2 Results of ANOVA for polynomial equation
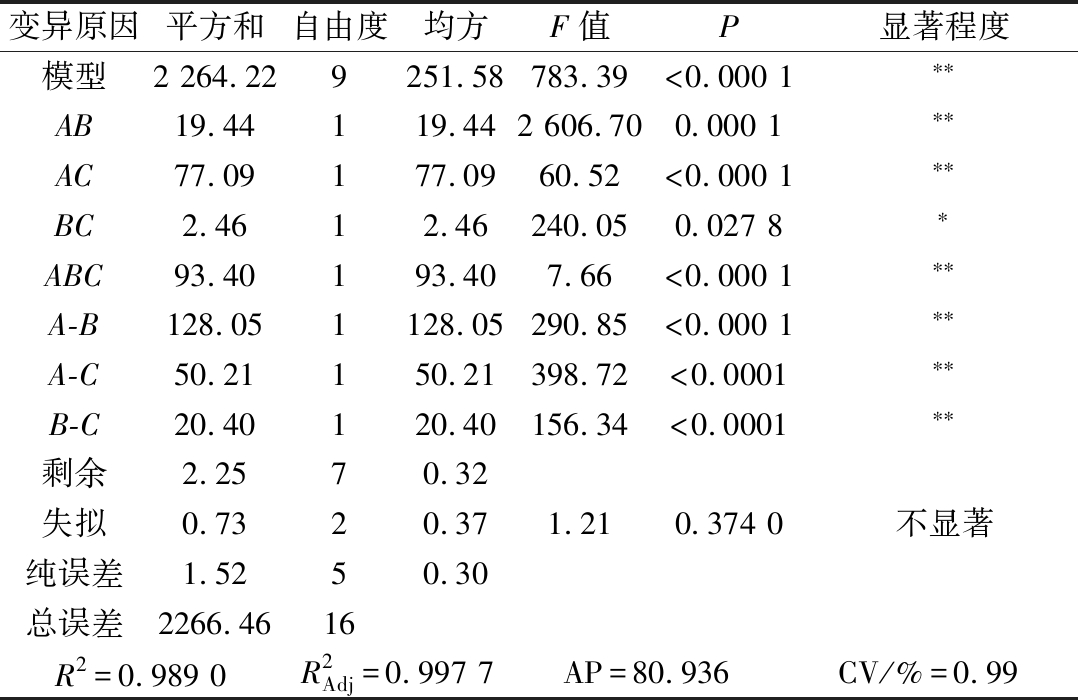
变异原因平方和自由度均方F值P显著程度模型2 264.229251.58783.39<0.000 1∗∗AB19.44119.442 606.700.000 1∗∗AC77.09177.0960.52<0.000 1∗∗BC2.4612.46240.050.027 8∗ABC93.40193.407.66<0.000 1∗∗A-B128.051128.05290.85<0.000 1∗∗A-C50.21150.21398.72<0.0001∗∗B-C20.40120.40156.34<0.0001∗∗剩余2.2570.32失拟0.7320.371.210.374 0不显著纯误差1.5250.30总误差2266.4616R2=0.989 0R2Adj=0.997 7AP=80.936CV/%=0.99
注:P<0.05表示差异显著,标注为*;P<0.01表示差异极显著,标注为**
由表3可知,该回归方程模型极显著(P<0.01),说明该回归方程的因变量与自变量之间的相关关系显著,其中A、B、C、AB、AC、BC、ABC、A-B、A-C、B-C对试验结果的影响显著(P<0.05)或极显著(P<0.01),表明各个试验因素对响应值不是简单的线性关系,而是二次抛物线关系。失拟项检测不显著(P>0.05),表明该方程对试验的拟合情况好,误差小,可以用该方程对不同条件下的提取效果进行分析和预测。由表3可知,ABC三因素间存在交互作用,对试验结果影响极显著(P<0.01)。3种酶交互作用的等高线图和响应面图如图7所示。
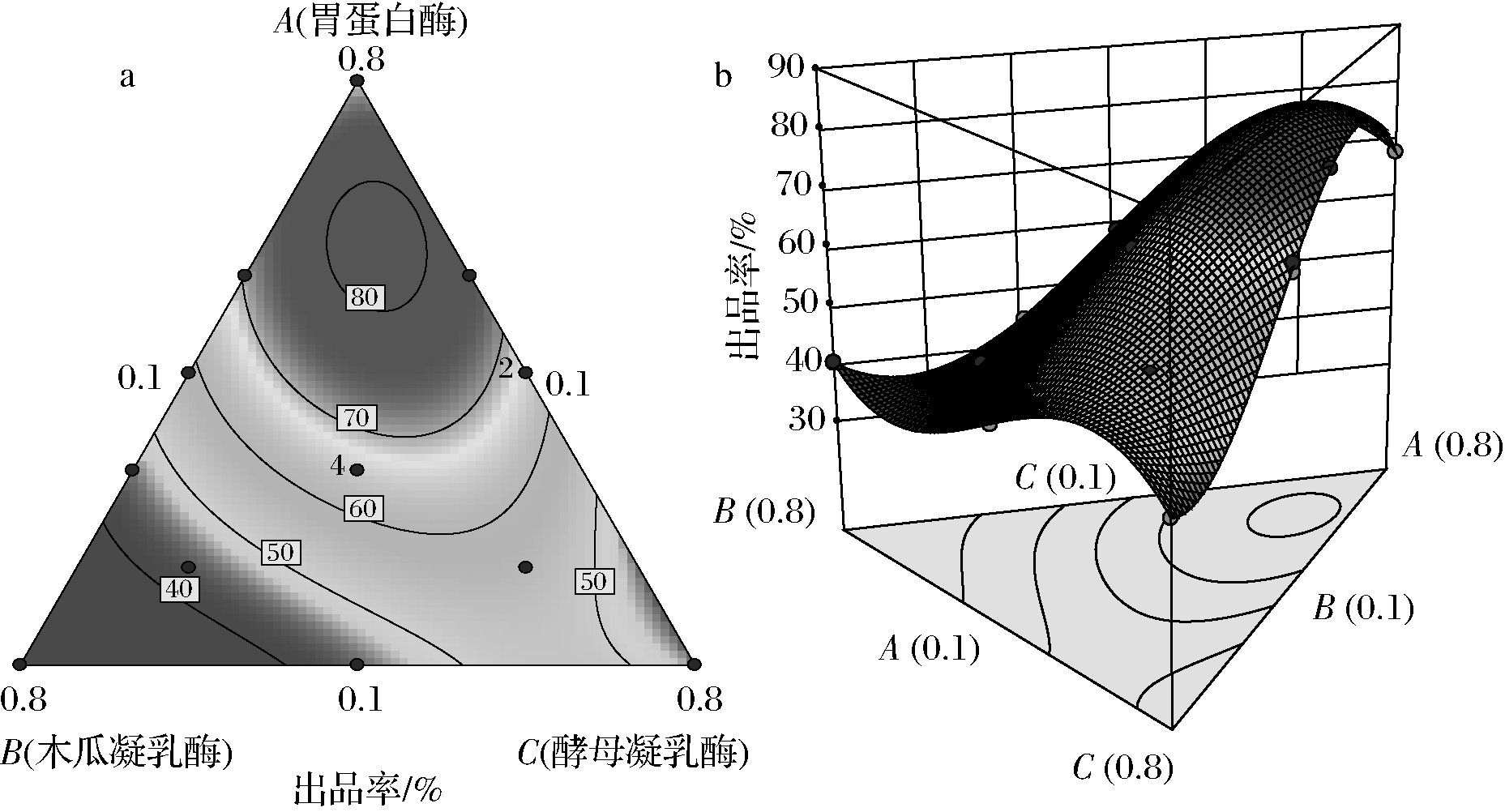
a-等高线图;b-响应面图
图7 混合凝乳酶交互作用对出品率影响的等高线图和响应面图
Fig.7 Contour plot and response surface for the influences of mixed chymosin on product yield
由图7可知,而当胃蛋白酶用量较高,木瓜凝乳酶和酵母凝乳酶用量较少时,出品率较高,为75%左右。当木瓜凝乳酶用量较高,胃蛋白酶和酵母凝乳酶用量较少,或酵母凝乳酶用量较高,胃蛋白酶和木瓜凝乳酶用量较少时,出品率约为45%,可见3种酶以不同比例混合对出品率影响显著。KRUIF等[25]认为,酶凝干酪素出品率的差异主要与酶对酪蛋白的凝结特性和分解活性的差异有关,凝乳酶凝结性强,分解性弱,则出品率较高。HUPPERTZ等[26]和JACOB等[27]认为,混合酶制备干酪素的核心是如何确定不同凝乳酶的比例,而凝乳酶干酪素凝胶是一种蛋白质凝胶,其形成主要是因为蛋白质分子的聚集作用,同时也是变性的蛋白质分子间吸附和水解相平衡的结果。本研究表明3种酶在凝乳过程中,胃蛋白酶起到了主导作用,而胃蛋白酶对蛋白质的分解作用可能被木瓜凝乳酶和酵母凝乳酶抑制。由于木瓜凝乳酶和酵母凝乳酶同样具有凝乳活性,但是其对蛋白质的降解能力更强。而胃蛋白酶的使用能够对木瓜凝乳酶和酵母凝乳酶降解蛋白质的能力产生抑制,因此木瓜凝乳酶和酵母凝乳酶对出品率同样有所贡献。由于图7中的响应面图出现了曲面,表明3种酶之间存在交互作用。因此在凝乳过程中,将3种酶按照适宜配比后组成的混合酶系对凝乳酶干酪素的制备可产生协同作用,显著提高出品率。
2.2.3 验证试验
通过Design expert 11.0软件对模型方程进行求解,得出理想的混合酶配比为m(胃蛋白酶)∶m(木瓜凝乳酶)∶m(酵母凝乳酶)=0.60∶0.18∶0.22,即胃蛋白酶添加质量分数60%、木瓜凝乳酶添加质量分数18%及酵母凝乳酶添加质量分数22%,此时理论出品率为81.77%。为了验证该配比的可靠性,通过3次验证试验,得到的出品率平均值为(80.35±0.62)%,与理论预测值基本吻合。这也表明将胃蛋白酶、木瓜凝乳酶和酵母凝乳酶按比例混合后进行凝乳酶干酪素的制备,其出品率明显高于单一酶的出品率。
将本实验获得的凝乳酶干酪素和小牛皱胃酶干酪素进行理化指标检测,结果如表3所示。
表3 产品理化指标检测 单位:g/100g
Table 3 Physical and chemical analysis of products

项目蛋白质酪蛋白脂肪水分小牛皱胃酶干酪素87.89±1.2897.15±1.330.91±0.087.53±0.48凝乳酶干酪素86.64±1.0996.72±1.140.92±0.077.61±0.52GB31638—2016≥ 84≥ 95≤ 2≤ 12
由表3可知,本实验获得的凝乳酶干酪素的蛋白质、酪蛋白、脂肪、水分等指标与小牛皱胃酶干酪素差异不显著(P>0.05),而且均符合GB31638—2016《食品安全国家标准 酪蛋白》的要求,这表明本实验获得的凝乳酶干酪素质量较好,具有开发前景。
将小牛皱胃酶制备的干酪素和混合酶制备的干酪素用傅立叶变换红外光谱仪进行官能团检测分析,结果如图8所示。

a-混合酶;b-小牛皱胃酶
图8 不同方法制备干酪素的红外光谱图
Fig.8 Infrared spectrogram of casein obtained by different preparation methods
由图8可知,小牛皱胃酶干酪素和混合酶干酪素的特征峰位置、峰的强弱、峰型基本一致。如在3 649 cm-1附近有N—H 伸缩振动吸收峰,2 962 cm-1附近处有C—H饱和振动吸收峰,1 536 cm-1附近处有C![]() O伸缩振动吸收峰,1 443 cm-1附近有C—H弯曲振动吸收峰,1 232 cm-1附近有C—N伸缩振动吸收峰,这些都是蛋白质分子的特征吸收峰,说明这2种干酪素主要都是由蛋白质分子组成,脂肪、碳水化合物含量极低。这主要是因为通过离心、水洗的作用,能够使脂肪、碳水化合物降解而并排出,从而降低了影响干酪素色泽、风味变化的因素,使干酪素品质得到提高[28]。因此,红外光谱分析结果表明,不同提取方法没有对干酪素的结构产生影响。
O伸缩振动吸收峰,1 443 cm-1附近有C—H弯曲振动吸收峰,1 232 cm-1附近有C—N伸缩振动吸收峰,这些都是蛋白质分子的特征吸收峰,说明这2种干酪素主要都是由蛋白质分子组成,脂肪、碳水化合物含量极低。这主要是因为通过离心、水洗的作用,能够使脂肪、碳水化合物降解而并排出,从而降低了影响干酪素色泽、风味变化的因素,使干酪素品质得到提高[28]。因此,红外光谱分析结果表明,不同提取方法没有对干酪素的结构产生影响。
将小牛皱胃酶制备的干酪素和混合酶制备的干酪素采用差示扫描量热仪进行热力学分析,结果如图9所示。
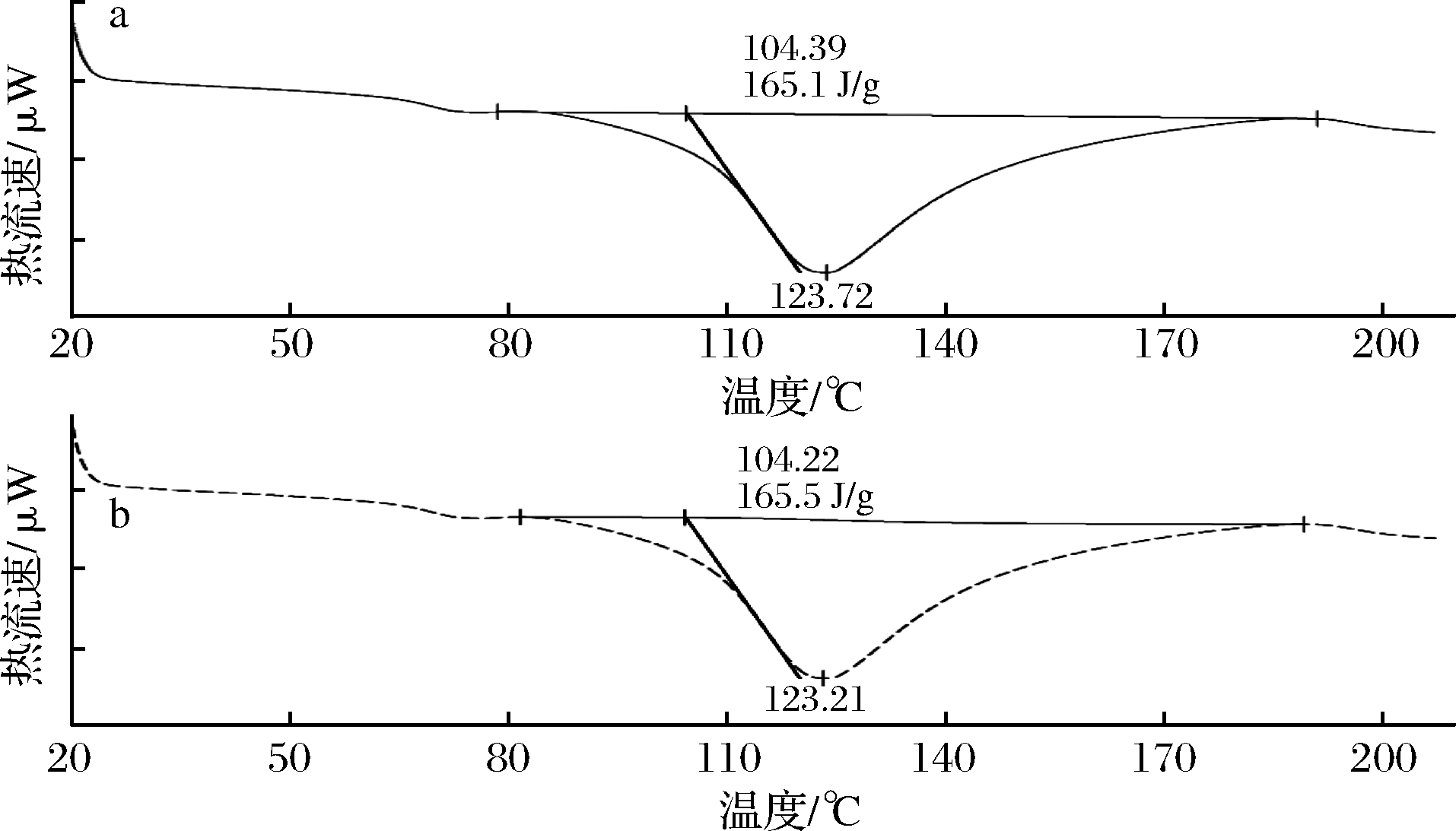
a-混合酶;b-小牛皱胃酶
图9 不同方法制备干酪素的热分析曲线
Fig.9 Thermograms of casein obtained by different preparation methods
由于加热能够使蛋白质的结构发生变化而导致其功能受到影响,因此研究食品蛋白质的热稳定性对于蛋白质的合理利用具有重要意义。对于DSC而言,在热分析图谱上出现吸热峰可以表示该点处在蛋白质热变性温度区,而且这个峰值对应的温度即为该样品的热变性温度[29]。由图9可知,2种方法制备干酪素的变性焓值(ΔH)也很接近,分别为165.1和165.5 J/g,表明2种方法制备干酪素在变性时吸入的热量相似。热分析曲线在123 ℃附近均出现1个主要的吸热峰,这可能是干酪素的变性温度。由于蛋白质的稳定性与蛋白质变性温度的高低密切相关,变性温度越高标志蛋白质的热稳定性越好。因此,干酪素具有相对较好的热稳定性。此外,2种方法制备的干酪素的热分析曲线形状和峰型均相似,表明酶法制备干酪素的工艺没有对其热力学性质产生影响。
以牦牛“曲拉”为原料,通过单因素试验和混料设计,确定了混合酶法制备干酪素的最优工艺条件为:添加混合酶质量分数1%(其中胃蛋白酶∶木瓜凝乳酶∶酵母凝乳酶的质量比为0.60∶0.18∶0.22),在pH 6.3、温度45 ℃、CaCl2质量分数1%条件下,凝乳30 min,出品率为(80.35±0.62)%,通过验证试验,证实了该工艺具有可靠性。
通过对本实验获得干酪素与小牛皱胃酶干酪素进行对比分析,结果表明,混合酶法制备干酪素的理化性质、红外光谱特性和热力学性质与小牛皱胃酶干酪素差异不显著,而且符合GB31638—2016《食品安全国家标准 酪蛋白》的要求,这表明本实验获得的凝乳酶干酪素质量较好,具有开发价值。
因此,采用混料设计优化混合酶制备干酪素,所需工艺设备简单、提取条件温和、操作安全,可为凝乳酶干酪素的生产提供参考。
[1] DIRIENZO D. Research gaps in the use of dairy ingredients in food aid products[J]. Food and Nutrition Bulletin, 2016, 37(1S): 51-57.
[2] 王琳琳,韩玲,敏文祥,等. 干酪素加工工艺研究进展[J]. 食品与发酵工业, 2016, 42(5): 277-282.
[3] LIU H N, ZHANG C, ZHANG H, et al. pH treatment as an effective tool to select the function and structural properties of yak milk caseins[J]. Journal of Dairy Science, 2013, 96(9): 5 494-5 500.
[4] LI Q, ZHAO Z T. Acid and rennet-induced coagulation behavior of casein micelles with modified structure[J]. Food Chemistry, 2019, 291(S1): 231-238.
[5] DALGLEISH D G, CORREDIG M. The structure of the casein micelle of milk and Its changes during processing[J]. Annual Review of Food Science and Technology, 2012, 3(1): 449-467.
[6] 曾祺, 张志国. 微生物凝乳酶研究进展[J]. 中国乳品工业, 2019, 47(3): 30-36.
[7] 杨晓丽,翟丹云,刘恭. 干酪素制作方法、应用现状及发展前景[J]. 农业科技与信息, 2018(13): 50-52.
[8] 武悦. 曲拉传统制备工艺的优化研究及应用[D]. 兰州:甘肃农业大学,2016.
[9] BAUGREET S, KERRY J P, ALLEN P, et al. Optimisation of protein-fortified beef patties targeted to the needs of older adults: a mixture designapproach[J]. Meat Science, 2017, 134: 111-118.
[10] 韩玲,张福娟,甘伯中,等. 牦牛“曲拉”干酪素凝乳酶的选择及工艺参数优化[J]. 农业工程学报, 2007, 23(7): 226-229.
[11] 常海军,韩玲,余群力. 食品级牦牛"曲拉"干酪素生产工艺条件优化[J]. 甘肃农业大学学报, 2016, 51(6): 143-148;154.
[12] WEE M S M, LOUD D E, TAN V W K, et al. Physical and sensory characterisation of noodles with added native and denatured pea protein isolate[J]. Food chemistry, 2019, 294: 152-159.
[13] LUCEY J A, HORNE D S. Perspectives on casein interactions[J]. International Dairy Journal, 2018, 85: 56-65.
[14] ZHANG Y, LI Y, WANG P J, et al. Rennet-induced coagulation properties of yak casein micelles: A comparison with cow casein micelles[J]. Food research international, 2017, 102: 25-31.
[15] HURLEY M J, LARSEN L B, KELLY A L, et al. The milk acid proteinase cathepsin D: A review[J]. International Dairy Journal, 2000, 10(10): 673-681.
[16] HAROUN B, LALEYE S, CHAHRA L C S, et al. Coagulation of camel milk using dromedary gastric enzymes as a substitute of the commercial rennet[J]. American Journal of Food Technology, 2012, 7(7): 409-419.
[17] 张卫兵,杨敏,梁琪,等. 细菌凝乳酶干酪素生产工艺参数优化[J]. 农业工程学报, 2013, 29(22): 292-298.
[18] GONZALEZ-JORDAN A, THOMAR P, NICOLAI T, et al. The effect of pH on the structure and phosphate mobility of casein micelles in aqueous solution[J]. Food Hydrocolloids, 2015, 51(1): 88-94.
[19] 纪银莉,何潇,高维东,等. 响应面法优化“曲拉”凝乳酶干酪素凝乳工艺[J]. 食品科学, 2013, 34(6): 12-15.
[20] HSIEH J F, PAN P H. Proteomic profiling of the coagulation of soymilk proteins induced by magnesium chloride[J]. Journal of Agricultural & Food Chemistry, 2012, 29(1): 219-225.
[21] HORNE D S. A balanced view of casein interactions[J]. Current Opinion in Colloid & Interface Science, 2017, 28: 74-86.
[22] 李学朋, 关明玲, 赵保堂, 等. 米黑毛霉酶凝干酪素生产工艺参数的优化研究[J]. 食品工业科技, 2016, 37(3): 191-195.
[23] IRENE M, MICHAEL O S, DOLORES O R. Effects of calcium chelators on calcium distribution and protein solubility in rennet casein dispersions[J]. Food Chemistry, 2016, 197: 233-239.
[24] SMIALOWSKA A, MATIA-MERINO L, INGHAM B, et al. Effect of calcium on the aggregation behaviour of caseinates[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2017, 522: 113-123.
[25] KRUIF C G D, HUPPERTZ T, URBAN V S, et al. Casein micelles and their internal structure[J]. Advances in Colloid and Interface Science, 2012, 171-172(1): 36-52.
[26] HUPPERTZ T, GAZI I, LUYTEN H, et al. Hydration of casein micelles and caseinates: implications for casein micelle structure[J]. International Dairy Journal, 2017, 74: 1-11.
[27] JACOB M, JAROS D, ROHM H. Recent advances in milk clotting enzymes[J]. International Journal of Dairy Technology, 2010, 64(1): 14-33.
[28] DALGLEISH D G, CORREDIG M. The structure of the casein micelle of milk and its changes during processing[J]. Annual Review of Food Science and Technology, 2012, 3(1): 449-467.
[29] BOWERS K, MARKOVA N. Value of DSC in characterization and optimization of protein stability[J]. Methods in molecular biology, 2019, 1964: 33-44.