鸭梨是我国优良水果品种之一,其种植面积广,肉质细嫩,清甜多汁,营养丰富,是酿制果酒的良好原料[1]。然而目前市售梨酒普遍存在果香较淡、风味不足的问题,因此如何丰富鸭梨酒的风味提高品质是生产亟待解决的问题[2]。
果酒的风味不仅取决于品种和酿造工艺,而且与酵母等微生物特性密切相关[3]。目前果酒酿造大多采用酿酒酵母(Saccharomyces cerevisiae)发酵,单一的发酵模式在追求高酒精度的同时,也出现果酒风味同质化的现象[4-5]。近年来大量的研究表明,非酿酒酵母在果酒酿造过程中起着积极的作用,能产生大量酯类、高级醇、甘油等代谢产物,起到增香、丰富口感以及降低酒度的作用。不同的非酿酒酵母对于果酒的发酵有不同的表现,产生不同的代谢产物,与酿酒酵母的相互作用也不同,有研究发现在樱桃酒发酵过程中酿酒酵母会导致美极梅氏酵母MJS22早期死亡,而对德布尔有孢酵母Alpha的生长没有影响[6]。非酿酒酵母与酿酒酵母混合发酵酿制果酒受到越来越多研究学者的关注,但针对鸭梨酒酿造的研究较少[7-9]。
本研究拟从6株产香酵母中优选1株产香酵母与酿酒酵母协同发酵酿制鸭梨果酒,并优化发酵条件,以期为产香酵母和酿酒酵母混菌发酵鸭梨果酒工艺提供一定的数据支持,同时为鸭梨果酒特色酿造菌剂的开发提供一定的参考。
鸭梨采用河北省石家庄优质鸭梨;白糖、SO2(食品级),市售。安琪葡萄酒果酒专用酵母A(SY酵母),购于安琪酵母股份有限公司;6种产香酵母B(异常毕赤酵母(Pichia anomala))、C(扣囊复膜酵母(Saccharomycopsis fibuligera))、D(异常汉逊酵母(Hansenula anomala))、E(产阮假丝酵母(Candida utilis))、F(葡萄汁有孢酵母(Hanseniaspora uvarum))和G(异常毕赤酵母(Pichia anomala)),保藏于酿酒生物技术及应用四川省重点实验室。
PHSJ-3F手持pH测定仪,上海精密科学仪器有限公司;WZ101手持糖度仪,海南博汉森科技开发有限公司;0/30 μmDVB/CAR/PDMS固相微萃取头,美国supelco 公司;7890A型气相色谱质谱联用仪,美国安捷伦科技公司。
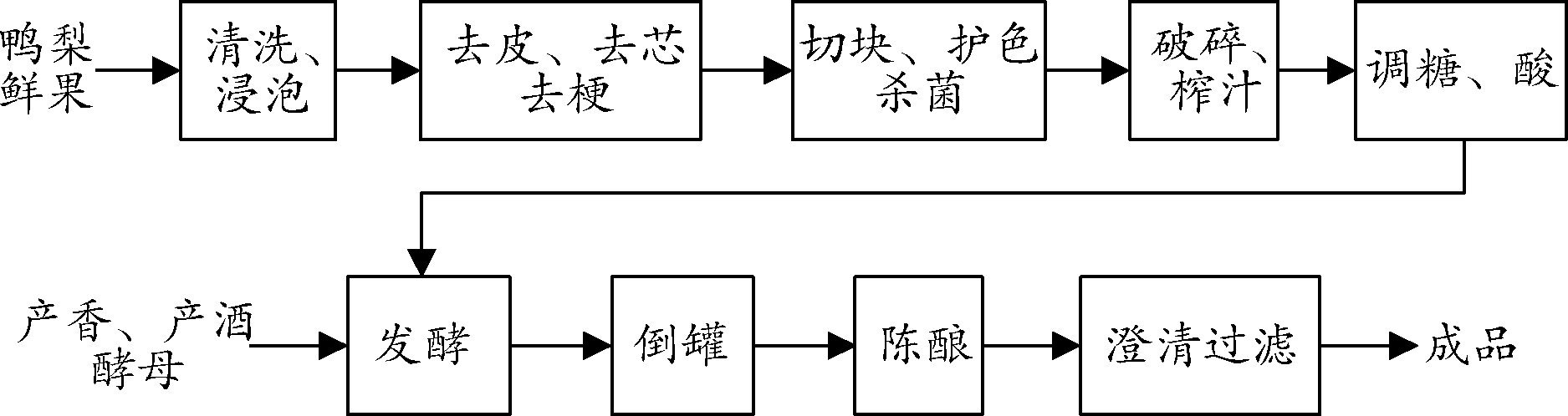
1.3.1 鸭梨酒发酵工艺流程
鸭梨就发酵工艺流程如下:

1.3.2 发酵工艺单因素试验
初始糖度均为18 Brix,24 ℃发酵,酿酒酵母接种量为3%,产香酵母采用PDA培养基浓缩菌悬液的形式接种,酿酒酵母干粉经30 min活化使用,测定相关理化指标。
产香酵母的确定:先接种酿酒酵母,24 h后分别接入3%的产香酵母。接种方式的确定:提前接种为先接种产香酵母B,发酵24 h后接种酿酒酵母;同时接种为酿酒酵母和产香酵母B同时接种;后接种为先接种酿酒酵母,发酵24 h后接种产香酵母B,接种量均为3%。发酵时间的确定:发酵前接种3%产香酵母B,发酵24 h后接入酿酒酵母,探究发酵时间。产香酵母接种量确定:发酵前接一定量的产香酵母B,发酵24 h后接入酿酒酵母。酿酒酵母接种时间的确定:发酵前接入2%的产香酵母B,不同时间接入酿酒酵母。
1.3.3 响应面试验设计
在单因素试验基础上,采用 Box-Behnken Design方法,感官评分为响应值,选择对感官评分影响较为显著的发酵时间、接种量、接种时间3个因素,通过响应面对工艺条件进行3因素3水平的试验设计,见表1。
表1 设计试验因素与水平
Table 1 Factors and the levels used for Box-Behnken Design

水平因素A(发酵时间)/dB(接种量)/%C(接种时间)/h-171120822419336
1.3.4 理化指标测定方法
可溶性固形物用手持糖度仪测定;pH用酸度计测定;酒精度和还原糖参考国标测定[10]。
1.3.5 挥发性成分分析[11]
风味物质萃取:取10 mL酒样和100 μL乙酸丁酯(4 g/L)内标于15 mL顶空瓶,加入2.5 g NaCl,30 ℃平衡10 min,插入PDMS纤维头,30 ℃吸附15 min,GC解析2 min,用于GC-MS分析[12]。色谱条件:色谱柱DB-WAX(60 m×0.25 mm×0.25 μm),载气He的总流速为19 mL/min;进样口温度230 ℃,柱温箱的起始温度为60 ℃,保持2 min,然后5 ℃/min升至160 ℃保持1 min,然后以10 ℃/min升至230 ℃保持1 min,最后运行31 min。质谱条件:电离方程式EI,电子能量70 eV,离子源温度为230 ℃,连接杆温度150 ℃。定性:化合物的质谱图与标准谱库对比鉴定。半定量:峰面积比值求得。
1.3.6 鸭梨酒的感官评定标准
选择10名果酒品评员进行品评(男女各5人,年龄20~40岁),评分标准参考葡萄酒和果酒评分标准。
每组试验重复3次,试验结果以X±Se表示,SPSS 20.0用于数据分析,Origin 8.5用于数据作图。
由图1可知,单菌发酵和混菌发酵的可溶性固形物、pH基本一致,单菌发酵酒精度最高为11.7%vol,但感官评价低于混菌发酵,AB混菌发酵梨酒的感官评分最高,除果香外有优雅的花香,酒香柔协。在混菌发酵时产香酵母赋予酒体复杂香气,同时对酒精产生有一定影响。综合考虑,选择产香酵母B与酿酒酵母A混合发酵。

图1 不同酵母配伍对鸭梨酒发酵的影响
Fig.1 Effect of different yeast compatibility on Yali wine fermentation
如图2所示,接种方式对酒精度、残糖有一定影响,对pH值影响不大。提前接种、同时接种、后接种的酒精度分别为11.2%vol、11.8%vol和12.1%vol。后接种的酒精度略高于同时接种,使得酿酒酵母有足够的生长空间和营养环境进行活跃代谢;提前接种的可溶性固形物和酒精度略低,感官评价最好,酒体协调、酒香舒适。综合考虑,提前接种优于其他接种方式,这与王星晨等[13]研究优选产香酵母提前接种酿酒酵母进行复合发酵,提升酒体香气结论相一致。
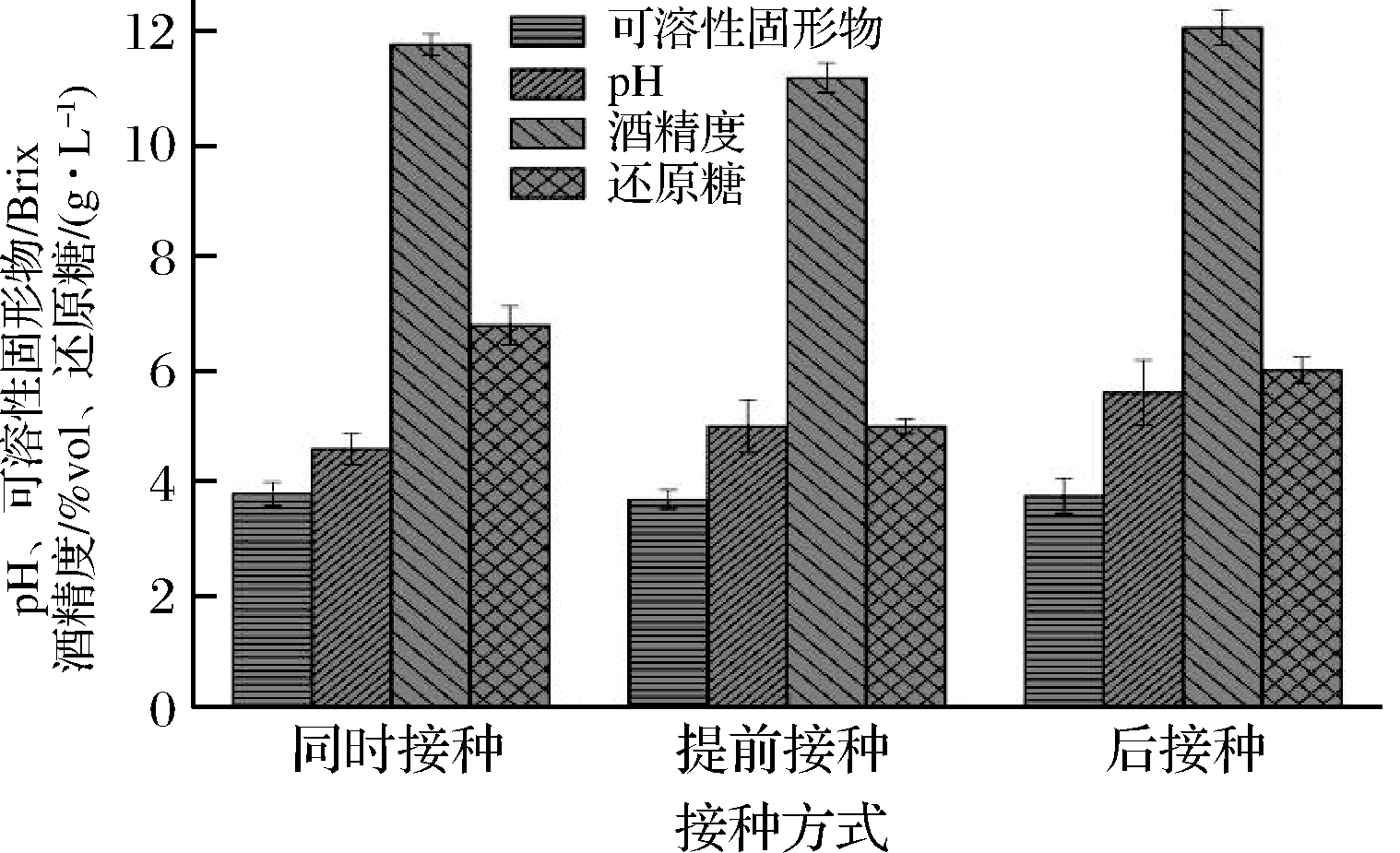
图2 接种方式对鸭梨酒发酵的影响
Fig.2 Effects of inoculation methods on the fermentation of Yali wine
如图3所示,随着发酵进行,混菌发酵和单菌发酵的pH、可溶性固形物都呈下降趋势,之后趋于平缓,可溶性固形物在3~5 d下降较快,此时发酵旺盛营养物质消耗较快;酒精度在2~8 d上升明显,8 d后趋于平缓;结合酒精生成、糖耗情况和感官评价,发酵8 d较好。此时单菌发酵酒精度为11.9%vol,混菌发酵酒精度略低为11.3%vol,可溶性固形物、还原糖略高,但香气浓郁、酒味协调。

图3 鸭梨果酒各理化指标随时间的变化情况
Fig.3 The changes of physical and chemical indexes of Yali wine with time
研究表明,非酿酒酵母与酿酒酵母的接种比例显著影响酿酒酵母及非酿酒酵母的生长从而影响其代谢活动,并影响酒体的感官质量[14]。由图4、图5可知,微生物的代谢繁殖产生大量酸性中间产物使pH先下降,而后中间产物继续被利用消耗,pH缓慢上升。可溶性固形物先下降,发酵8 d后趋于平稳。发酵过程中酒精度先上升8 d后趋于平稳。发酵8 d后,2%接种量的可溶性固形物含量最低,酒精度最高。还原糖变化随着发酵的进行逐渐降低,2%接种量的残糖最低,同时感官评价也较高,在该接种量下微生物发酵效果好,原料利用率高。KIM等[15]利用东方伊萨酵母和酿酒酵母按不同比例同时接种,发现接种比例为1∶1时酿造的葡萄酒感官质量最好,本试验发现接种比例为1∶1.5酿造的梨酒口感爽适、香气也较浓郁。
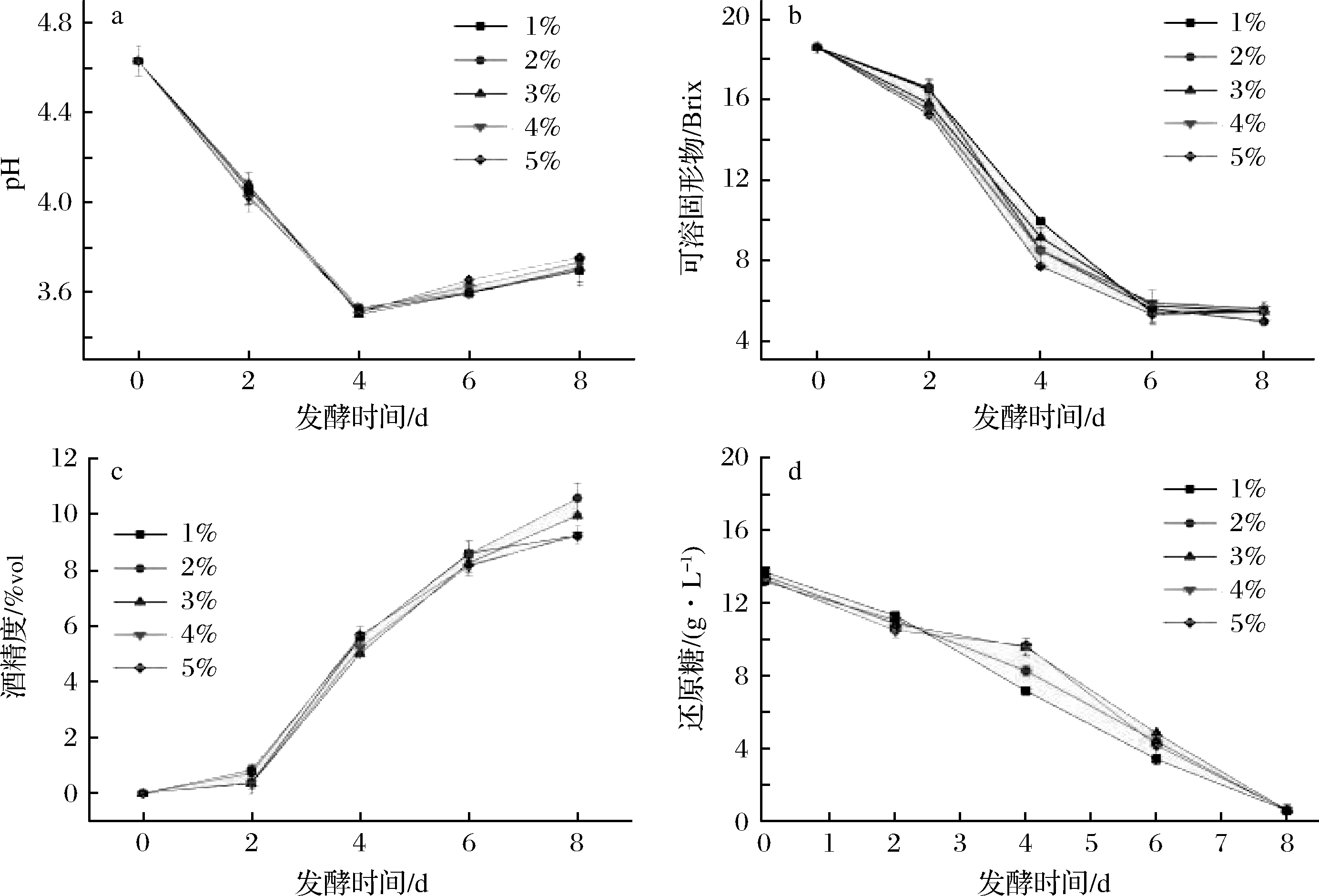
a-pH;b-可溶性固形物;c-酒精度;d-还原糖
图4 产香酵母不同接种量的理化指标随发酵时间的变化
Fig.4 Changes of Physical and chemical indexes of different inoculation amounts of aroma producing yeast with fermentation days

图5 产香酵母不同接种量对鸭梨酒发酵的影响
Fig.5 Effect of different inoculation amount of aroma producing yeast on fermentation of Yali Wine
由图6、图7可知,酿酒酵母不同的接种时间,pH呈先下降后缓慢回升的趋势,可溶性固形物含量和还原糖含量呈下降趋势,酒精度先上升后趋于稳定。发酵24 h后接入酿酒酵母的酒精度最高为11.4%vol,此时感官评价最好。研究表明,在混合发酵中酿酒酵母的接种时间影响酯酶活性[16],而酯酶可以调节酯类的合成-水解平衡状态[17-18],从而影响感官质量。随着接种时间的延迟,可能由于酿酒酵母接种时间晚,产香酵母生长繁殖耗用过多营养物质,造成酿酒酵母生长繁殖不好,影响酒精的生成。
2.6.1 响应模型的建立与分析
响应面分析方案及结果和回归方程的方差分析见表2、表3。
表2 响应面分析方案及结果
Table 2 Response surface analysis scheme and results

实验号ABC感官评分(Y)/分101-17820008930009040-1-1775-11066611078710174800089900088101-107211-10168120117813-1-1068140008815-10-172160-11711710-177
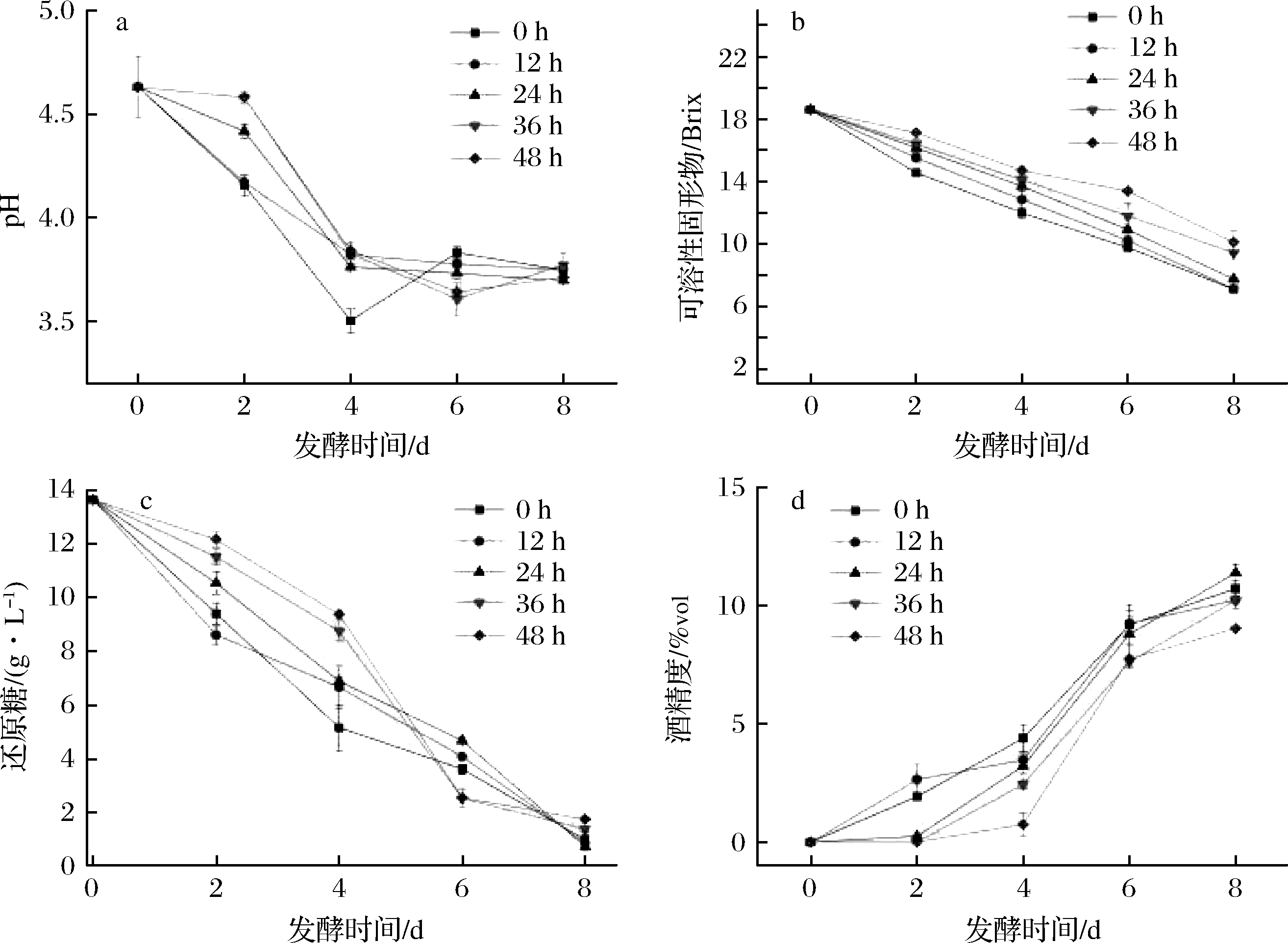
a-pH;b-可溶性固形物;c-还原糖;d-酒精度
图6 酿酒酵母不同接种时间的理化指标随发酵时间的变化
Fig.6 Changes of physical and chemical Indexes of different inoculation time of Saccharomyces cerevisiae with fermentation days
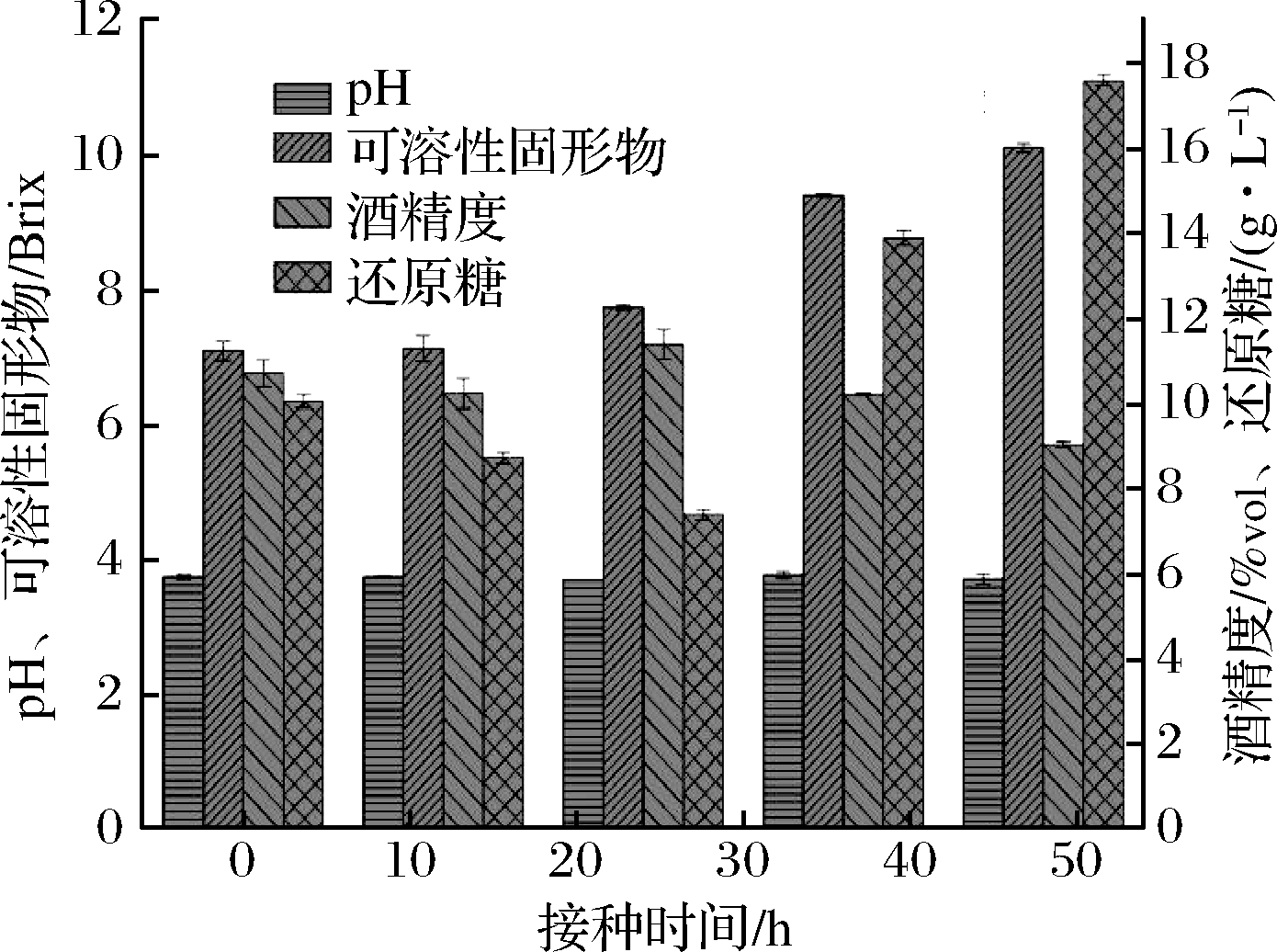
图7 酿酒酵母不同接种时间对鸭梨酒发酵的影响
Fig.7 Effect of different inoculation time of Saccharomyces cerevisiae on fermentation of Yali wine
拟合回归方程为:Y=88.80+3.38A+1.50B-1.63C+2AB+0.25AC+1.50BC-10.53A2-7.28B2-5.52C2
由表3可知,回归模型具有高度的显著性(P<0.000 1),此模型可对工艺参数进行分析与预测。由F值可知,混合发酵鸭梨酒感官评分影响大小顺序为发酵时间(A)>接种时间(C)>接种量(B)。
2.6.2 响应曲面和等高线图
响应面和等高线见图8~图10,等高线呈椭圆,交互作用显著,等高线呈圆形,交互作用不显著[19]。最佳发酵条件为发酵时间8 d,产香酵母接种量2%,酿酒酵母接种时间24 h,混合发酵鸭梨酒的感官评分的理论值为89分。
表3 回归方程的方差分析表
Table 3 Analysis of variance of regression equation

来源平方和df均方FP模型1 060.429117.82102.46<0.000 1显著发酵时间(A)91.13191.1379.24<0.000 1接种量(B)18.00118.0015.650.005 5接种时间(C)21.13121.1318.370.003 6AB16.00116.0013.910.007 4AC0.2510.250.220.655 2BC9.0019.007.830.026 6A2466.421466.42405.59< 0.000 1B2222.841222.84193.78< 0.000 1C2128.531128.53111.76< 0.000 1残差8.0571.15失拟项5.2531.752.500.198 5不显著纯误差2.8040.70总偏差1 068.4716
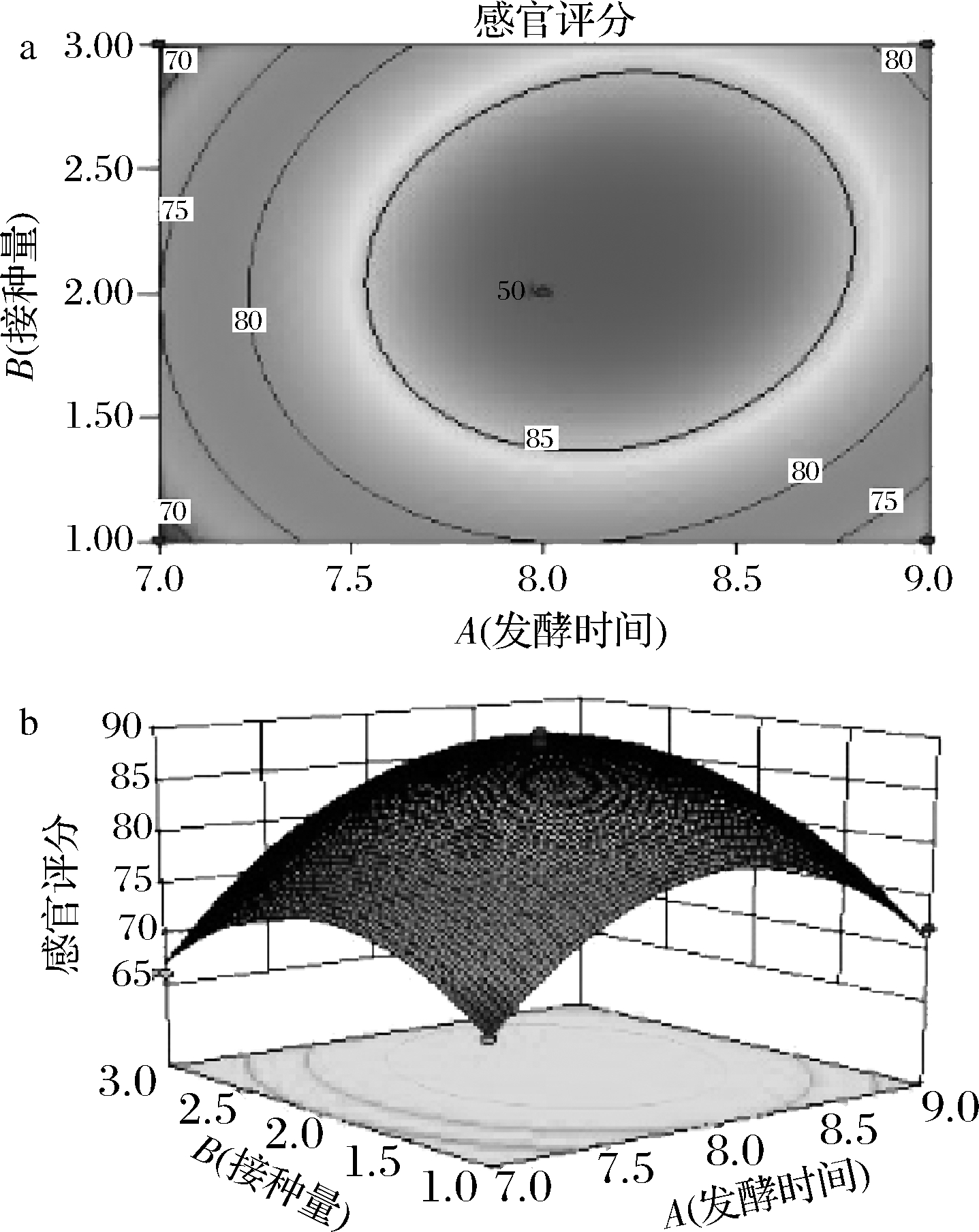
a-等高线图;b-响应面图
图8 发酵时间和接种量对感官评分的交互影响
Fig.8 Interaction of fermentation time and inoculation amount on sensory score
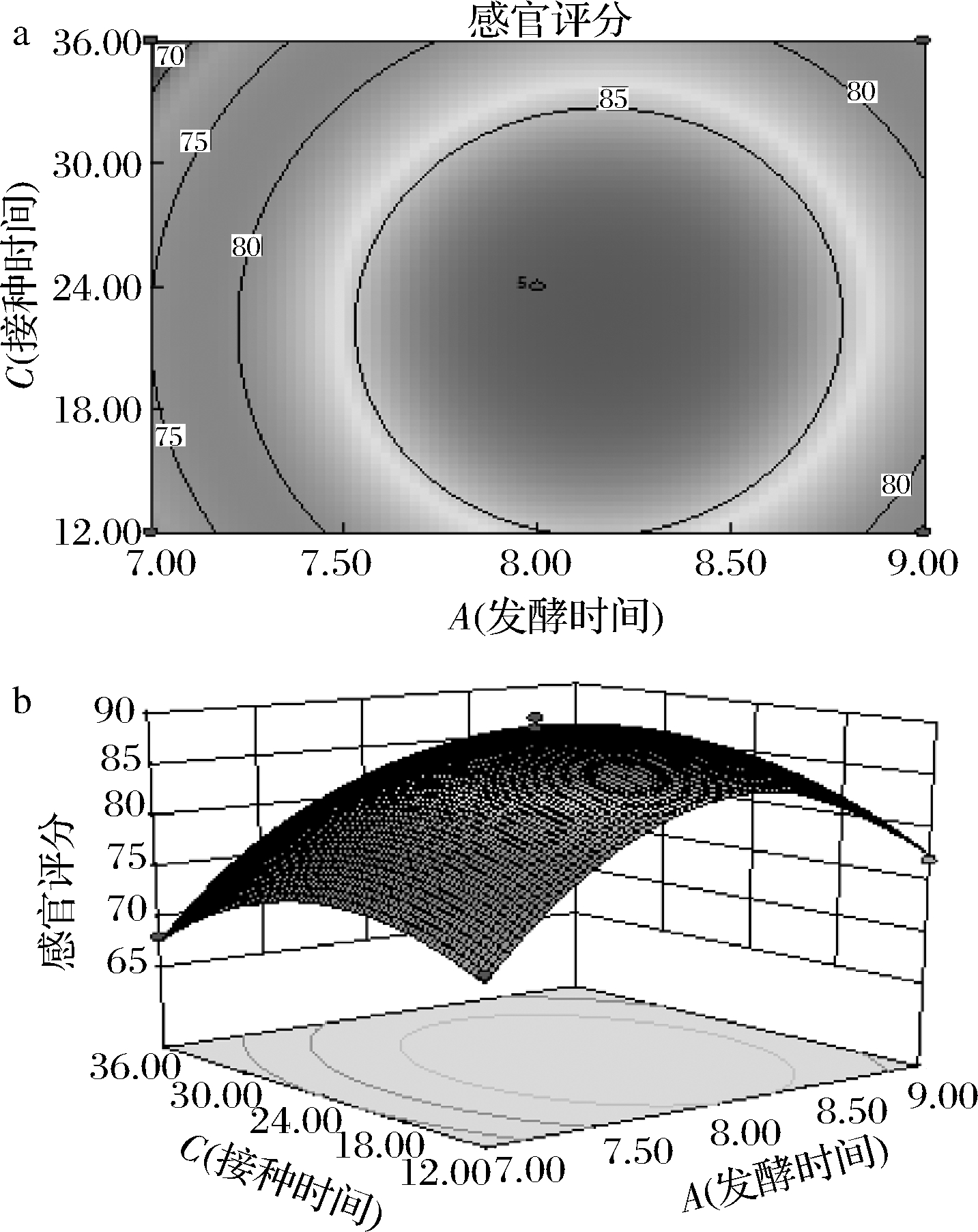
a-等高线图;b-响应面图
图9 发酵时间和接种时间对感官评分的交互影响
Fig.9 Interaction between fermentation time and inoculation time on sensory score
由表4可知,混菌发酵鸭梨酒感官评价较好,果香清雅,酒香柔协持久,香味协调,与最优条件下的理论值接近,采用响应面优化混菌发酵工艺是准确可行的。

a-等高线图;b-响应面图
图10 接种量和接种时间对感官评分的交互影响
Fig.10 Interaction between inoculation amount and inoculation time on sensory score
通过单因素和响应面优化得出,混菌发酵鸭梨酒最佳工艺条件为产香酵母B为最佳菌株,接种方式为提前接种,发酵时间8 d,产香酵母B接种量为2%,酿酒酵母接种时间为24 h。结果见表4。
本试验通过GC-MS方法对比分析了最佳混菌发酵工艺和单菌发酵工艺所得酒体的主要挥发性成分,由表5可知,单菌发酵和混菌发酵所得酒体主要的挥发性香气物质种类分别为16种、15种,其差别主要体现在酯类物质。非酿酒酵母本身含有的丰富酶类增加了酒体的风味,通过混菌发酵可以增加酯类的含量及种类[20-21]。不同发酵方式所得酒样挥发性成分相对含量和成分存在差异,混菌发酵辛酸乙酯相对含量较高,其具有白兰地酒香味,正己酸乙酯、癸酸乙酯、乙酸乙酯相对含量也较高,己酸乙酯具有强烈的果香和酒香,并有猕猴桃、菠萝、香蕉的香气,癸酸乙酯具有似葡萄酒香气,乙酸乙酯具有甜味,草氨酸乙酯是混菌发酵特有的香气,此外酒体中还有部分醇类物质,混菌发酵酒体中的异戊醇、异丁醇含量相对较少,这有利于改善液态酒饮后上头的问题。
表4 混菌发酵鸭梨酒的理化指标
Table 4 Physical and chemical index of Yali wine fermented with mixed bacteria

质量指标检测项目单菌发酵混菌发酵理化指标可溶性固形物/Brix55酒精度/%vol11.711.6还原糖/%0.480.46总酸(以乙酸计)/(g·L-1)2.52.0总酯(以乙酸乙酯计)/(g·L-1)1.233.21微生物菌落总数/(CFU·mL-1)≤40≤40大肠杆菌/(CFU·mL-1)≤3≤3致病菌未检出未检出感官评分7088
表5 鸭梨酒香气成分及相对含量
Table 5 aroma composition and relative content of Yali wine
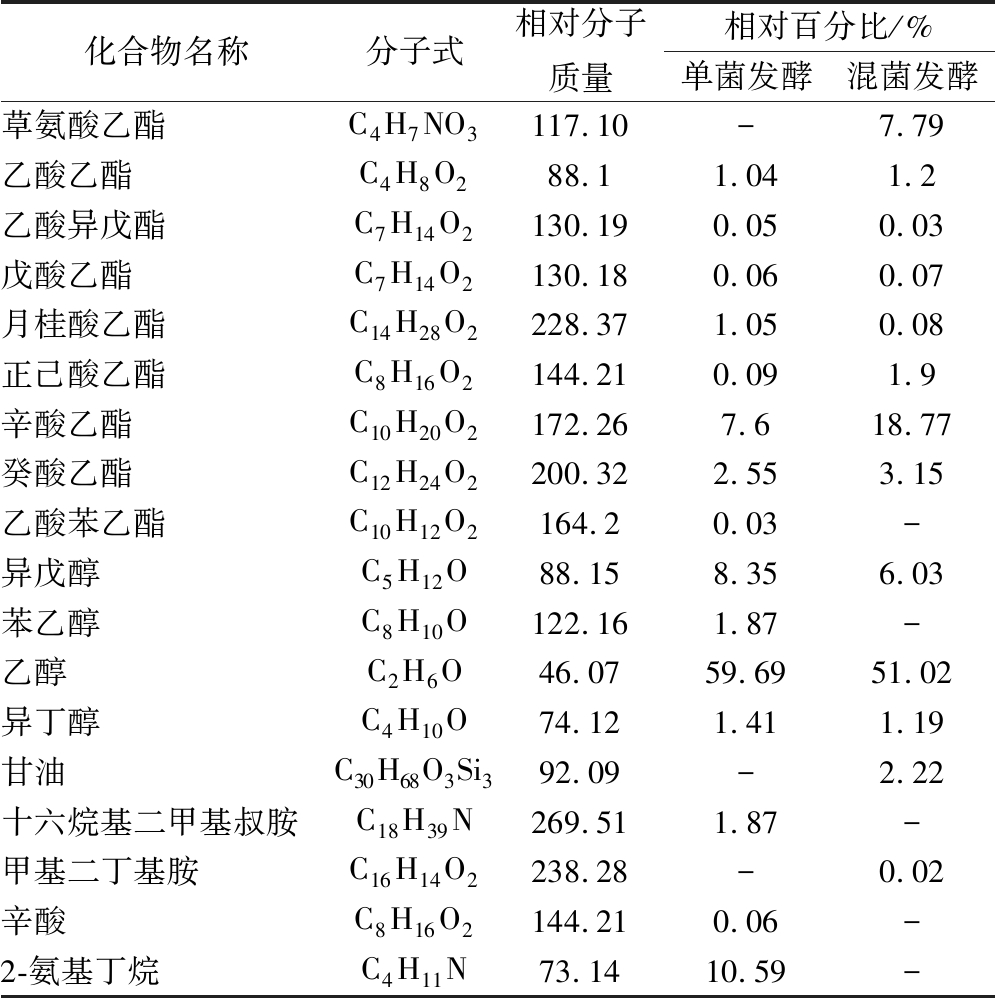
化合物名称分子式相对分子质量相对百分比/%单菌发酵混菌发酵草氨酸乙酯C4H7NO3117.10-7.79乙酸乙酯C4H8O288.11.041.2乙酸异戊酯C7H14O2130.190.050.03戊酸乙酯C7H14O2130.180.060.07月桂酸乙酯C14H28O2228.371.050.08正己酸乙酯C8H16O2144.210.091.9辛酸乙酯C10H20O2172.267.618.77癸酸乙酯C12H24O2200.322.553.15乙酸苯乙酯C10H12O2164.20.03-异戊醇C5H12O88.158.356.03苯乙醇C8H10O122.161.87-乙醇C2H6O46.0759.6951.02异丁醇C4H10O74.121.411.19甘油C30H68O3Si392.09-2.22十六烷基二甲基叔胺C18H39N269.511.87-甲基二丁基胺C16H14O2238.28-0.02辛酸C8H16O2144.210.06-2-氨基丁烷C4H11N73.1410.59-
注:-表示未检出
以鸭梨为原料,采用酿酒酵母和产香酵母混菌发酵,从实验室筛选的6株产香酵母中选出1株产香酵母与酿酒酵母共酵,探究了两种酵母接种顺序、发酵时间、接种量、接种时间对发酵的影响。在单因素试验的基础上,选择发酵时间、接种量、接种时间为影响因子,以混菌发酵鸭梨酒的感官评分为响应值,采用响应面法优化混菌发酵酿造工艺。结果表明,最佳发酵工艺参数为发酵时间8 d,产香酵母和酿酒酵母接种量分别为2%、 3%,酿酒酵母接种时间为发酵后24 h。在此条件下所酿造的鸭梨酒酒精度为11.6%,可溶性固形物为5 Brix,酒体澄清透亮,果香清雅,酒香柔协持久,香味协调,具有梨酒典型的风格。通过单菌发酵和混菌发酵的GC-MS对比分析,混菌发酵总酯含量是单菌发酵的2.6倍,辛酸乙酯含量最高,正己酸乙酯、癸酸乙酯、乙酸乙酯含量较高,一定程度上反映了混菌发酵酒体浓郁舒适香气的物质基础。
[1] 周雪艳,赵一凡,张晓腾,等. 不同发酵方式对鸭梨酒香气成分的影响[J]. 食品工业科技, 2018, 39(21):241-247;257.
[2] 袁丽,王颉,张伟,等. 鸭梨酒酿造中存在的问题及防止措施 [J]. 酿酒科技, 2003(1):72-73.
[3] MORENO J J, MILLANNC, ORTEGA J M, et al. Analytical differentiation of wine fermentations using pure and mixed yeast cultures [J]. Journal of Industrial Microbiology, 1991, 7(3):181-189.
[4] LIU N, QIN Y, SONG Y, YE D, et al. Selection of indigenous Saccharomyces cerevisiae strains in Shanshan County (Xinjiang, China) for winemaking and their aroma-producing characteristics[J]. World Journal of Microbiology and Biotechnology, 2015,31(11): 1 781-1 792.
[5] LIU P T, LU L, DUAN C Q, et al. The contribution of indigenous non-Saccharomyces wine yeast to improved aromatic quality of Cabernet Sauvignon wines by spontaneous fermentation[J]. LWT-Food Science and Technology, 2016, 71: 356-363.
[6] SUN S Y,GONG H S, JIANG X M, et al. Selected non-Saccharomyces wine yeasts in controlled multistarter fermentations with Saccharomyces cerevisiae on alcoholic fermentation behaviour and wine aroma of cherry wines[J]. Food Microbiology, 2014, 44:15-23.
[7] CIANI M, COMITINI F, MANNAZZU I, et al. Controlled mixed culture fermentation: A new perspective on the use of non-Saccharomyces yeasts in winemaking[J]. Fems Yeast Research, 2010, 10(2):123-133.
[8] MEDINA K, BOIDO E, FARINA L, et al. Increased flavour diversity of Chardonnay wines by spontaneous fermentation and co-fermentation with Hanseniaspora vineae[J]. Food Chemistry, 2013, 141(3): 2 513-2 521.
[9] GOBBI M, COMITINI F, DOMIZIO P, et al. Lachancea thermotolerans and Saccharomyces cerevisiae in simultaneous and sequential co-fermentation: A strategy to enhance acidity and improve the overall quality of wine[J]. Food Microbiology, 2013, 33 (2): 271-281.
[10] 郭新光,马佩选,任一平,等. 中华人民共和国国家标准GB/T15038[S]. 北京:中国标准出版社, 2006.
[11] 杨文斌,罗惠波,边名鸿,等. 桂花鸭梨复合型果酒的酿造工艺研究[J]. 食品工业科技, 2016, 37(2):199-203;208.
[12] 汪立平,徐岩,赵光鳌,等. 顶空固相微萃取法快速测定苹果酒中的香味物质[J]. 食品与生物技术学报, 2003, 22(1):1-6;20.
[13] 王星晨,胡凯,陶永胜. 葡萄汁有孢汉逊酵母和酿酒酵母的混合酒精发酵动力学[J]. 食品科学, 2016, 37(3):103-108.
[14] LEE P R, KHO S H C, YU B, et al. Yeast ratio is a critical factor for sequential fermentation of papaya wine by Williopsis saturnus and Saccharomyces cerevisiae[J]. Microbial Biotechnology, 2013, 6(4):385-393.
[15] KIM D H, HONG Y A, PARK H D. Co-fermentation of grape must by Issatchenkia orientalis and Saccharomyces cerevisiae reduces the malic acid content in wine[J]. Biotechnology Letters, 2008, 30(9):1 633-1 638.
[16] 李婷,陈景桦,马得草,等. 优选非酿酒酵母与酿酒酵母在模拟葡萄汁发酵中生长动力学及酯酶活性分析[J]. 食品科学, 2017,38(22):60-66.
[17] POZO-BAYON, M A, G-ALEGRIA E, POLO M C, et al. Wine volatile and amino acid composition after malolactic fermentation: Effect of Oenococcus oeni and Lactobacillus plantarum, starter cultures[J]. Journal of Agricultural and Food Chemistry, 2005, 53(22):8 729-8 735.
[18] UGLIANO M, MOIO L. Changes in the concentration of yeast-derived volatile compounds of red wine during malolactic fermentation with four commercial starter cultures of Oenococcus oeni[J]. Journal of Agricultural and Food Chemistry, 2005, 53(26):10 134-10 139.
[19] MONTGOMERY D C. Design and Analysis of Experiments[M]. London: John Wiley and Sons Inc, 1991.
[20] SADINENI V, KONDAPALLI N, OBULAM V S R. Effect of co-fermentation with Saccharomyces cerevisiae and Torulaspora delbrueckii or Metschnikowia pulcherrima on the aroma and sensory properties of mango wine[J]. Annals of Microbiology, 2012, 62(4): 1 353-1 360.
[21] CLEMENTE J J M, MINGORANCE C L, MART NEZ R S, et al. Influence of sequential yeast mixtures on wine fermentation[J]. International Journal of Food Microbiology, 2004, 98(3): 301-308.
NEZ R S, et al. Influence of sequential yeast mixtures on wine fermentation[J]. International Journal of Food Microbiology, 2004, 98(3): 301-308.