玉米秸秆含大量粗纤维,总糖,还含有少量蛋白质、VD、矿物质和脂肪,是一种具有广泛应用前景的可再生资源[1-3]。国内对玉米秸秆的利用研究主要集中在生产沼气、堆肥、还田等方面[4-6],作为饲料加工的不到10%。因其蛋白含量低、粗纤维含量高等缺点,只能用于反刍动物饲养和畜禽的辅助用料[7-8]。能有效地利用秸秆进行加工转化,生产优质的单细胞蛋白饲料已成为饲料研究热点。但秸秆结构复杂难以降解,需通过预处理提高降解率。稀酸法在秸秆预处理中应用较多,但会生成大量不能被多数微生物利用的木糖,此外生成的酸、酚类、醛类等物质会抑制微生物发酵,极大限制了微生物发酵转化秸秆的效率。目前主要采用混菌发酵、增加接种量和延长发酵时间等方法来避免发酵抑制因子对发酵造成的不良影响[9],但存在工艺复杂、成本高和发酵周期长等缺点。因此选育出能利用或耐受发酵抑制因子和高效利用木糖的菌株对秸秆饲料化具有重要经济价值。
荚膜红假单胞菌菌体蛋白高(质量分数60%以上),含胞外免疫多糖、类胡萝卜素、维生素等物质[10-12]。广泛应用于净化水质、生物制氢,又因其营养价值高、绿色安全可作为饵料添加剂,在防止鱼虾疾病和促进生长等方面表现良好[13-14],是生产蛋白饲料的理想菌株。但目前尚无利用荚膜红假单胞菌发酵转化玉米秸秆产单细胞蛋白饲料的研究报道。以荚膜红假单胞菌为出发菌株筛选出高效利用木糖、苯酚的诱变菌株,提升菌株对秸秆降解产物的利用率,提高菌体蛋白产量,将秸秆转化为饲料。对解决我国饲料源短缺的现状,减少木质纤维原料的浪费,降低焚烧秸秆对环境带来的污染等方面具有重要意义。
1.1.1 原料与菌种
采集四川宜宾南溪区收获玉米籽实后的玉米秸秆,剪至5~8 cm,80 ℃烘干,粉碎过40目筛。
荚膜红假单胞菌,购于中国普通微生物菌种保藏管理中心(CGMCC),编号1.1737。
1.1.2 设备与仪器
F800纤维测定仪、SOX500脂肪测定仪,海能仪器;Kjeltec 8400凯氏定氮仪,FOSS。
1.1.3 培养基
种子培养基 (g/L):NaHCO31.0,KH2PO4 1.0, Na2SO3 0.1,MgSO4·7H2O 0.01,CaCl2 0.000 5,FeSO4·7H2O 0.001,NH4Cl 1.0,酵母膏1.0,蛋白胨1.0,乙酸钠5.0,pH 7.0。
选择培养基:去除种子培养基中的碳源,以木糖或苯酚为唯一碳源。
以上培养基使用前121 ℃湿热灭菌20 min。
1.2.1 诱变与选育
诱变参照文献[15-16]。
将经诱变后的菌液诱导培养24 h后,吸取0.1 mL稀释液涂布相应选择培养基上,28 ℃培养24~72 h。挑取长势好的菌落,划线纯化,连续传代10次后保存。
1.2.2 试验流程
原料预处理:称取100 g玉米秸秆用0.75%稀H2SO4调整固液比为1∶5后转至1.5 L不锈钢管式反应器中150 ℃酸化1 h,得酸化糟,随后加入10 mL浓氨水100 ℃处理2 h,得氨化糟,加0.8%(体积分数)氨水调节pH到5.0,加纤维素酶至200 U/g 物料,50 ℃,120 r/min摇床水解72 h得酶处理糟。
发酵剂制备:采用三级培养工艺,将1.2.1节保存的菌株按2.4×109个/mL接种量接种于酶处理糟中,28 ℃培养5 d,为一级培养。一级培养后的菌液按1.5×109个/mL接种于酶处理糟中,培养条件不变,为二级培养,以二级培养后的菌液按6×108个/mL接种于酶处理糟中为三级培养,以三级培养液作为发酵剂。
接种发酵:酶处理糟按一定接种量接种诱变菌株发酵剂,加入无菌水,控制一定的料水比,在适宜的温度、摇床转速、糟层厚度条件下发酵数天,每日用0.8 %(体积分数)的氨水调整pH为7.0。烘干测定各项指标。
1.2.3 研究内容
诱变剂对诱变菌株的影响。以0、0.5%、1%、1.5%、2%和3%甲基环酸乙酯以及0、20、40、60、80 和120 s紫外线照射时间诱变荚膜红假单胞菌,按公式(1)计算致死率:
致死率![]()
(1)
式中:m,空白对照组菌落数;n,诱变后再生菌落数。
诱变菌去除苯酚和木糖能力测试。1.2.1中保存的菌株按3×107个/mL接种量于100 mL以木糖、苯酚为唯一碳源的培养液中培养,测定接种0、24、48、72 h后计算诱变菌株对木糖、苯酚的去除率,按公式(2)计算去除率:
(2)
式中:R,苯酚或木糖去除率,%;m0,接种前培养液苯酚或木糖含量,mg;m1,接种一段时间后培养液中苯酚或木糖含量,mg。
单因素实验。按1.2.2流程所示,在黑暗件下以温度(27、28、29、30、31、32 ℃)、发酵时间(2、3、4、5、6、7 d)、接种量(3%、5%、7%、9%、11%、13%)、糟层厚度(1、2、3、4、5、6 cm)、摇床转速(100、110、120、130、140、150 r/min)、料水比(g∶g)(1∶8、1∶9、1∶10、1∶11、1∶12、1∶13)6个因素,每个因素6个水平做单因素试验。测定粗纤维素和真蛋白质因发酵条件变化引起的含量变化。
正交试验。根据1.2.3中选取6因素最佳工艺参数作为参考,选取温度(29、30、31 ℃)、发酵时间(4、5、6 d)、接种量(8、10、12%)、糟层厚度(3.5、4.0、4.5 cm)、摇床转速(110、120、130 r/min)、料水比(1∶8、1∶9、1∶10)进行正交试验优化。以最佳条件组合重做验证试验,测定样品指标。
1.2.4 分析方法
木糖、苯酚含量测定分别参照管斌等[17]、GAO等[18]的实验方法。白酒丢糟与发酵干糟真蛋白含量测定参照沉淀法[19]与凯氏定氮法[20];菌落计数采用平板计数法,丢糟与发酵干糟粗蛋白、粗脂肪、粗灰分、粗纤维、水分测定分别按“中华人民共和国国家标准”GB/T 6432—94、GB/T 6433—2006、GB/T 6438—2007、GB/T 6434—2006、GB/T 6435—2006执行,作图、正交试验设计及显著性分析分别用Excel 2010和SPSS 21.0。
不同浓度的甲基环酸乙酯致死率分别为0、10.63%、36.87%、52.43%、75.27%和99.43%。不同紫外线照射时间的致死率分别为0、3.67%、19.12%、48.67%、88%和100%。选择致死率在50%左右的诱变剂量诱变,即1.5%甲基磺酸乙酯、紫外线照射60 s进行复合诱变,筛选获得1株菌落直径大,长势好的菌株记为FJM。
由表1可知,JM在接种72 h后对木糖去除率为92.54%,菌株FJM对木糖的去除率较原菌株有小幅提升。JM和FJM接种24 h后对400 mg/L苯酚去除率分别为5.53%和89.87%,当苯酚质量浓度达600 mg/L接种72 h后苯酚去除率分别为5.28%和97.73%,FJM菌株相较原菌株显示其高浓度耐受和高除去率的优势。当苯酚质量浓度达到800 mg/L时诱变菌株和原菌株均达到抑菌浓度。
表1 诱变菌株与原菌种对木糖和苯酚利用率测定结果
Table 1 Results of determination of xylose and phenol utilization rate between mutagenized strains and original strains

菌株木糖质量浓度/(mg·L-1)苯酚质量浓度/(mg·L-1)24 h48 h72 h质量浓度/(mg·L-1)去除率/%质量浓度/(mg·L-1)去除率/%质量浓度/(mg·L-1)去除率/%JM4 0000477.24±1688.07347.08±1291.32298.28±1592.54FJM4 0000428.43±1389.29314.55±1592.14222.35±1394.44JM0400377.90±8.35.53234.14±7.341.468.27±2.997.93FJM040040.51±2.589.872.60±1.699.350.97±1.399.76JM0600589.48±6.11.75572.63±6.54.56568.35±7.05.28FJM0600179.20±5.355.209.29±3.697.689.08±4.597.73JM0800799.45±5.20.07799.23±8.20.10799.08±3.80.11FJM0800798.12±6.70.23796.98±6.50.38796.23±6.90.47
注:JM为荚膜红假单胞菌,FJM为诱变的荚膜红假单胞菌突变菌株
如图1所示,发酵2~5 d真蛋白含量显著(P<0.05)上升达18.46%,粗纤维显著下降(P<0.05)至15.51%。之后随着发酵延续,发酵液达最大生物浓度,真蛋白和粗纤维含量变化不明显(P>0.05)。
如图2所示,27~30 ℃真蛋白含量随发酵温度提升而提高(P<0.05),达18.56%,粗纤维显著下降(P<0.05)至15.51%。之后随着发酵温度的继续提升,光合细菌生长受到抑制,真蛋白含量逐渐下降。粗纤维含量随着发酵温度的上升逐渐下降,当温度到达31℃后粗纤维含量无明显变化(P>0.05)。随着温度的继续上升菌株生长受到抑制。
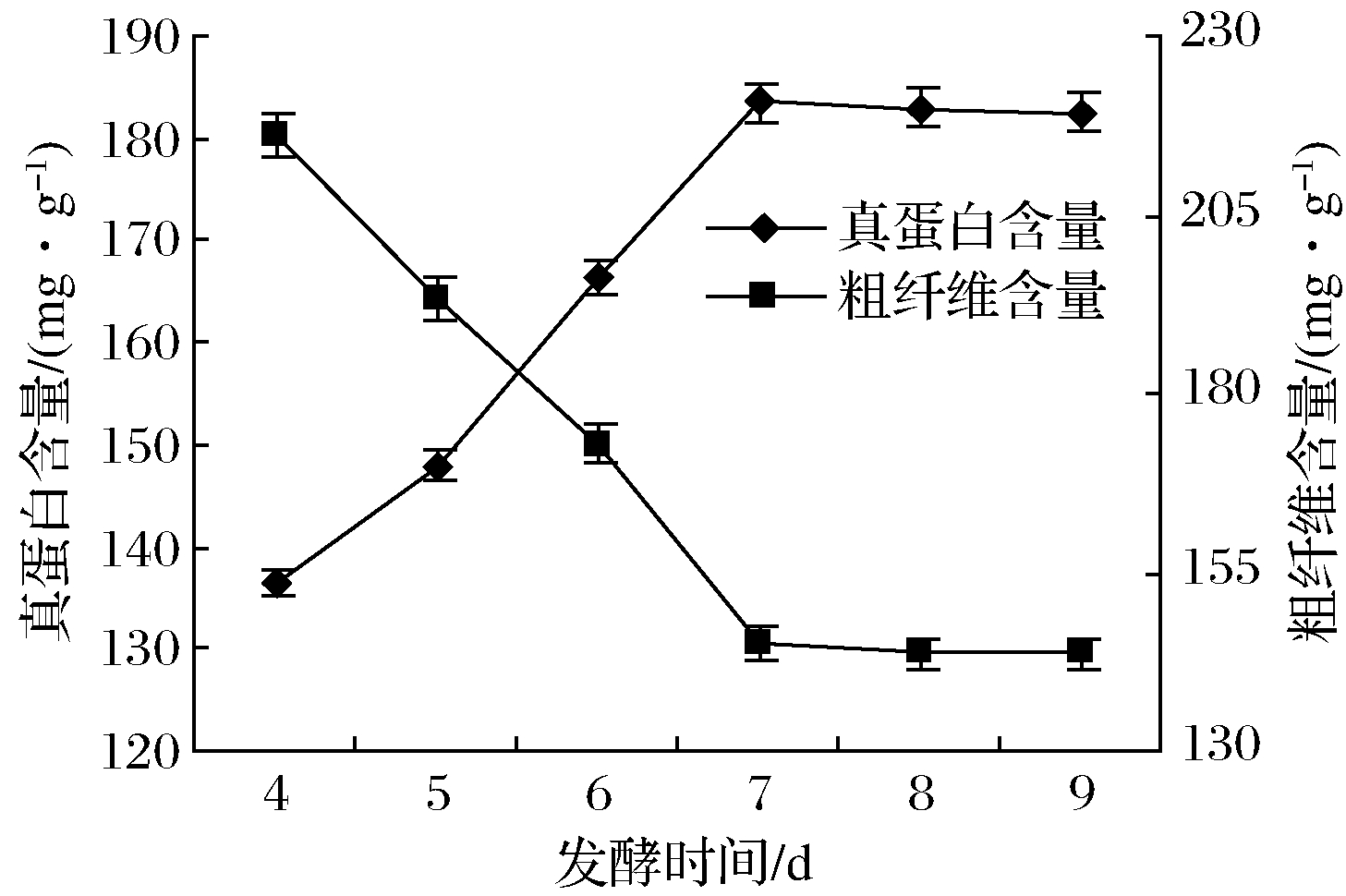
图1 发酵时间对秸秆真蛋白和粗纤维含量的影响
Fig.1 Effect of fermentation time on the content of true protein and crude fiber in straw
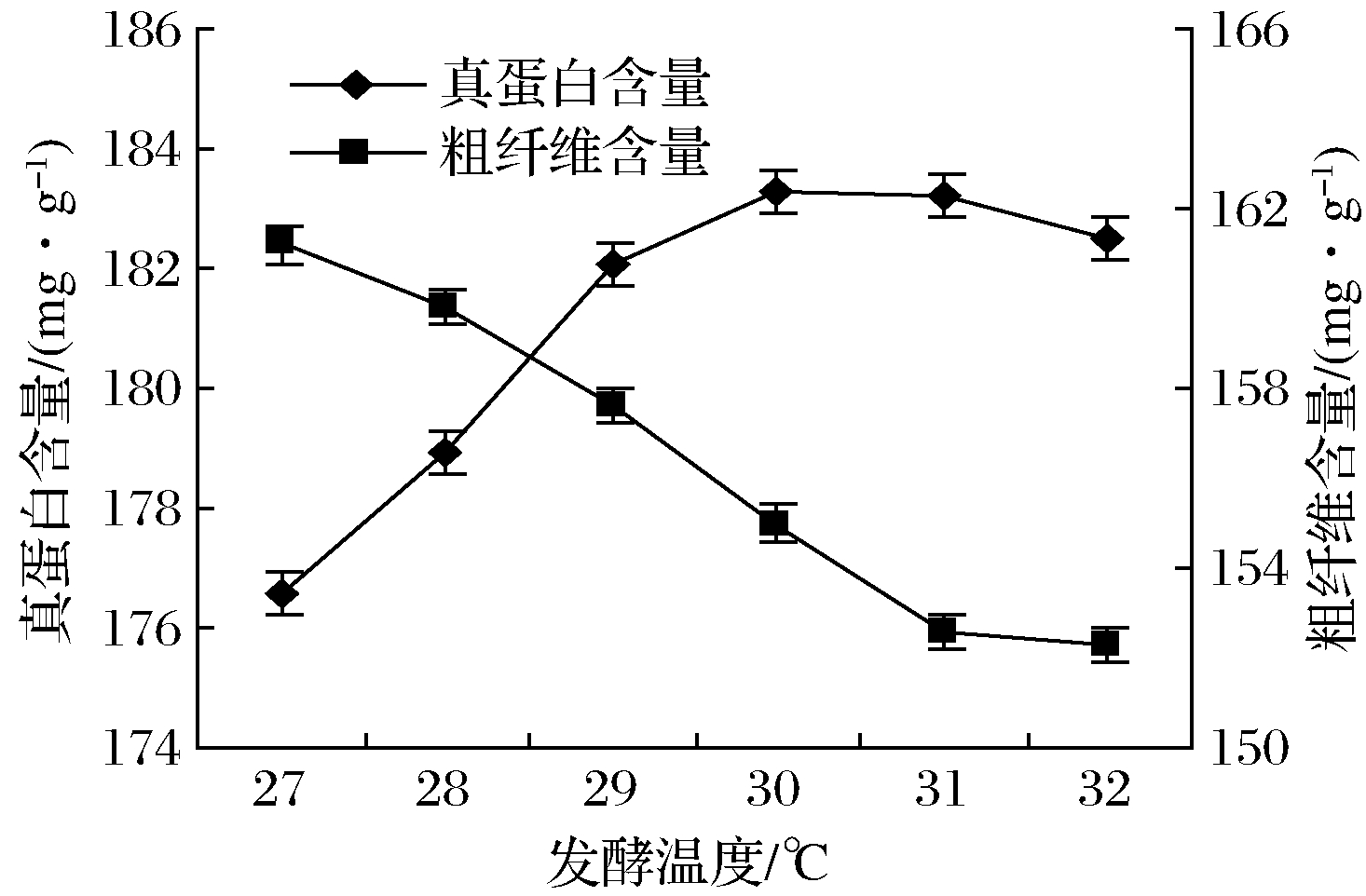
图2 发酵温度对秸秆真蛋白和粗纤维含量的影响
Fig.2 Effect of fermentation temperature on the content of true protein and crude fiber in straw
如图3所示,接种量为1.5×108~3.3×108个/mL时接种量小,菌体基数小增长慢,真蛋白含量随接种量的增加含量逐步提升(P<0.05),之后继续增加接种量,菌体增长达最大,真蛋白含量提升不明显(P>0.05)。接种量对发酵糟粗纤维含量影响较小(P>0.05)。
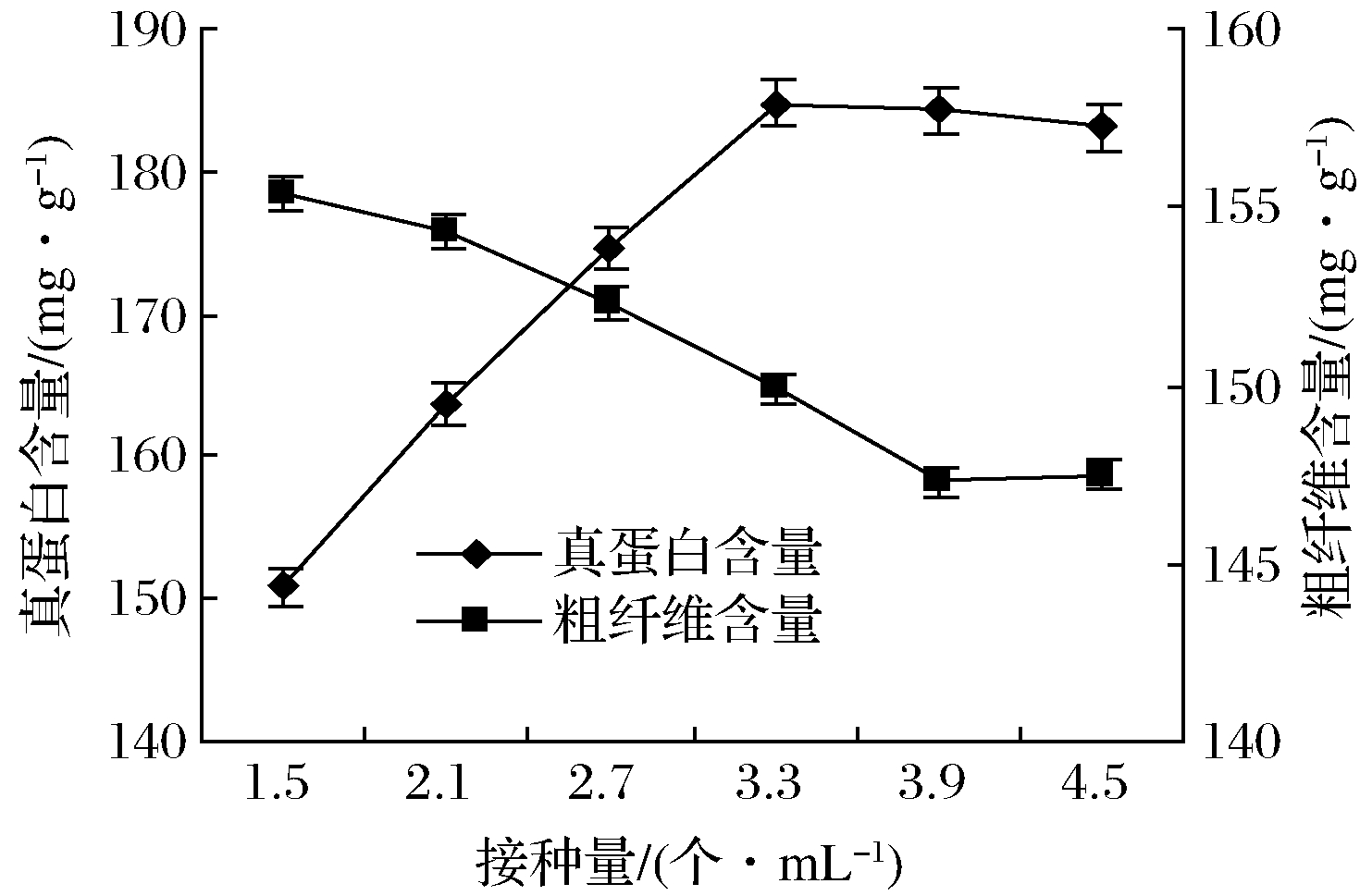
图3 接种量对秸秆真蛋白和粗纤维含量的影响
Fig.3 Effect of inoculum on the content of true protein and crude fiber in straw
注: 为方便展示,1.5×108在图中以1.5的形式表示
如图4所示,料水比值为1∶8~1∶10时,正蛋白明显上升(P<0.05),料水比值继续增大时真蛋白含量明显下降(P<0.05)。当料水比值低时,发酵液含水含量低、溶氧量低不利于光合细菌生长。当料水比值高时,发酵液中营养物质浓度低同样不利于光合细菌生长繁殖。粗纤维含量呈先上升后下降的趋势。

图4 料水比对秸秆真蛋白和粗纤维含量的影响
Fig.4 Effect of material to water ratio on the content of true protein and crude fiber in straw
如图5所示,随糟层厚度的增加真蛋白含量呈先上升后下降的趋势(P<0.05),粗纤维呈先下降后上升的趋势(P<0.05)。当糟层较薄时振荡剧烈,影响菌体生长,当糟层较厚时振荡程度减弱,溶氧量减少,不利于菌株的避光好氧生长。

图5 糟层厚度对秸秆真蛋白和粗纤维含量的影响
Fig.5 Effect of the thickness of the layer on the content of true protein and crude fiber in straw
如图6所示,真蛋白含量随摇床转速的提升呈先上升后下降的趋势(P<0.05),当摇床转速低时,发酵液中溶氧量低,限制了菌株的避光好氧生长。粗纤维含量随摇床转速的升高呈先下降后上升的趋势。
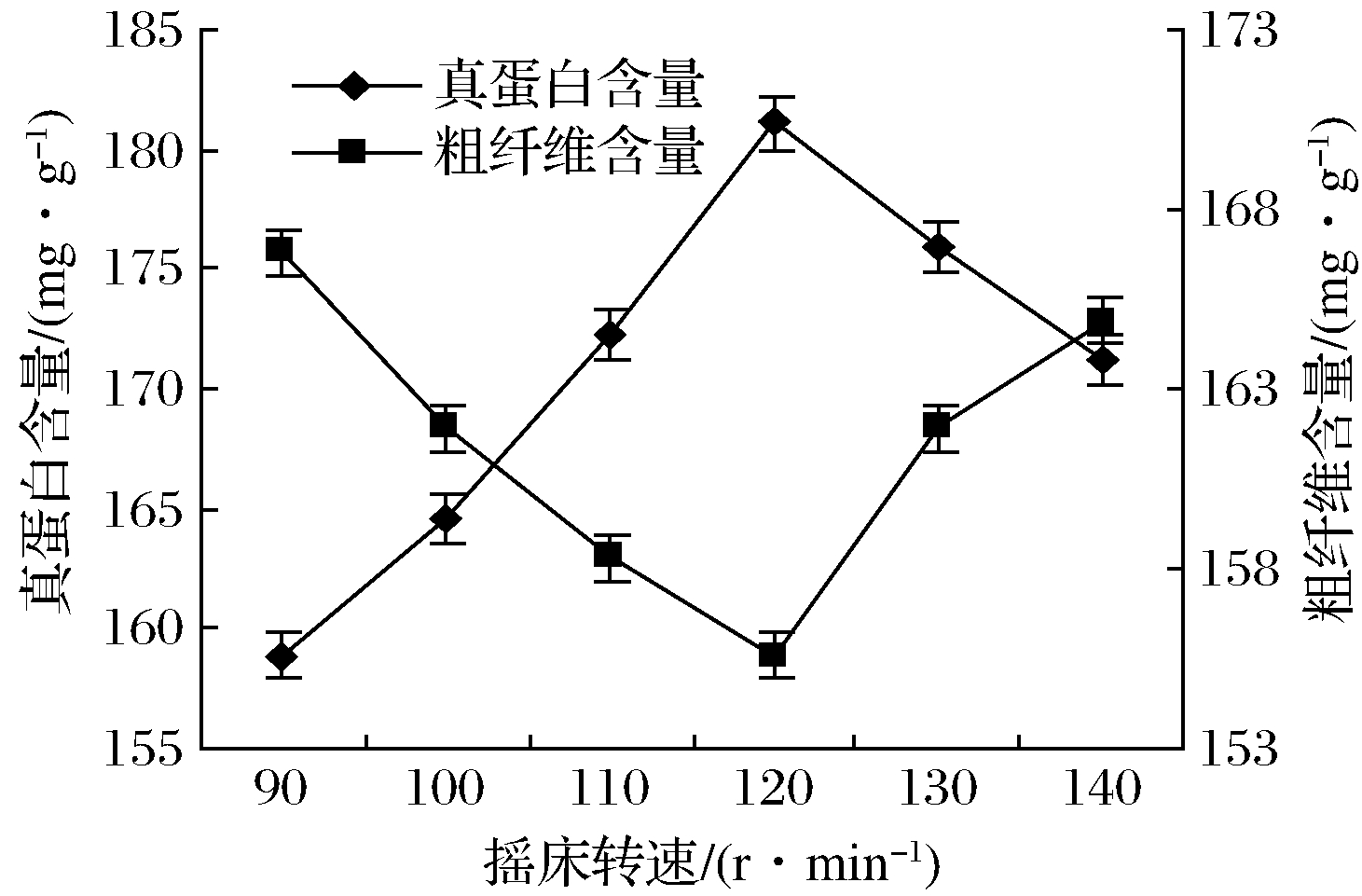
图6 摇床转速对秸秆真蛋白和粗纤维含量的影响
Fig.6 Effect of shaker speed on the content of true protein and crude fiber in straw
由表2发酵正交试验,各因素水平的均值和极差可知,最佳条件组合为糟层厚度4.5 cm、接种量8%、料水比值10、摇床转速120 r/min、发酵温度31 ℃、发酵时间6 d;因素对发酵糟真蛋白含量影响为摇床转速(2.52)>发酵温度(1.94)>糟层厚度(1.48)>发酵时间(0.92)>接种量(0.64)>料水比(0.36),按以上正交试验的最佳组合,重新接种发酵3 次,测定各项指标后对比发酵前玉米秸秆及原菌种发酵糟物质含量。
表2 正交试验结果
Table 2 Orthogonal test results
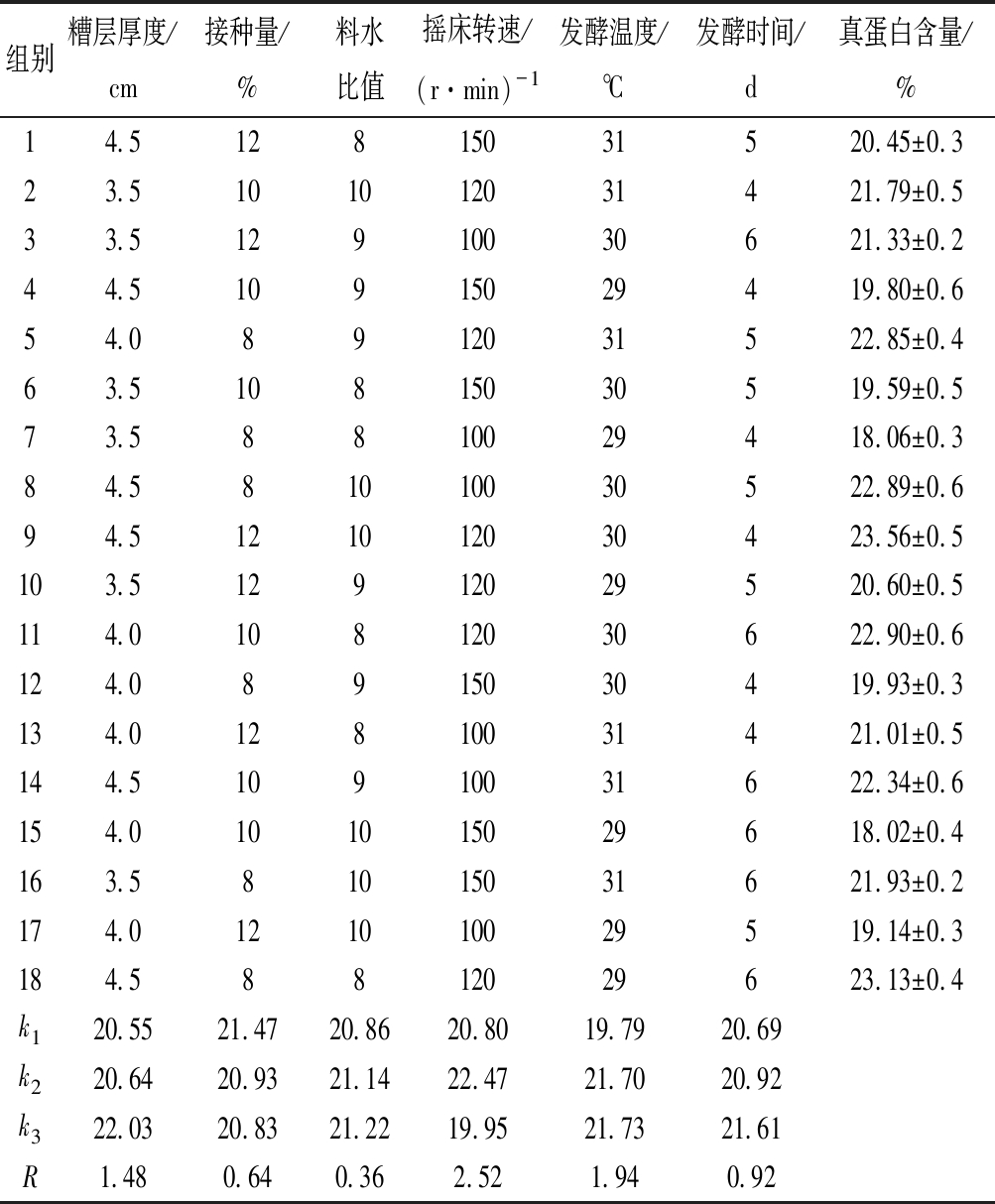
组别糟层厚度/cm接种量/%料水比值摇床转速/(r·min)-1发酵温度/℃发酵时间/d真蛋白含量/%14.512815031520.45±0.323.5101012031421.79±0.533.512910030621.33±0.244.510915029419.80±0.654.08912031522.85±0.463.510815030519.59±0.573.58810029418.06±0.384.581010030522.89±0.694.5121012030423.56±0.5103.512912029520.60±0.5114.010812030622.90±0.6124.08915030419.93±0.3134.012810031421.01±0.5144.510910031622.34±0.6154.0101015029618.02±0.4163.581015031621.93±0.2174.0121010029519.14±0.3184.58812029623.13±0.4k120.5521.4720.8620.8019.7920.69k220.6420.9321.1422.4721.7020.92k322.0320.8321.2219.9521.7321.61R1.480.640.362.521.940.92
注:料水比为方便展示,上表以值的方式显示,即料水比1∶8显示为8
由表3可知,营养成分对比可见,在高温、酸性条件下秸秆纤维结构被破坏,秸秆中超过80%半纤维素,少部分纤维素和木质素降解[21],之后加酶水解,粗纤维降低20.76%,灰分上升0.12%。之后加氨水中和使粗蛋白上升2.71%。接种夹膜红假单胞菌发酵后粗蛋白上升15.6%、真蛋白上升13.62%、粗脂肪上升1.2%、因无机盐离子被消耗灰分下降0.44%。接种诱变菌株FJM发酵后粗蛋白上升18.72%、真蛋白上升18.85%、粗脂肪上升1.82%、灰分降低0.49%,发酵糟的含水率为9.97%,显著提了高玉米秸秆饲用价值。
表3 预处理前后玉米秸秆与不同发酵糟的营养成分对比
Table 3 Comparison of nutrient composition between corn stalk and different fermented grains
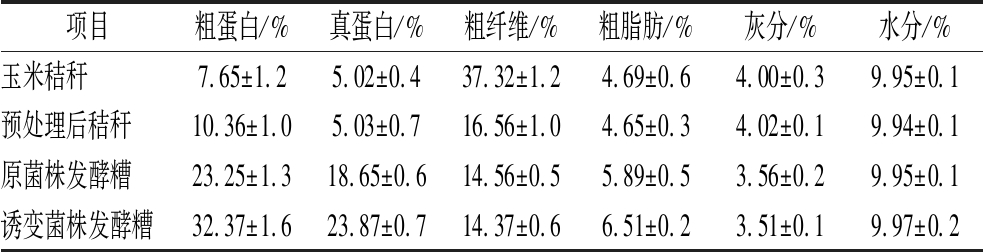
项目粗蛋白/%真蛋白/%粗纤维/%粗脂肪/%灰分/%水分/%玉米秸秆7.65±1.2 5.02±0.437.32±1.24.69±0.64.00±0.39.95±0.1预处理后秸秆10.36±1.05.03±0.716.56±1.04.65±0.34.02±0.1 9.94±0.1原菌株发酵糟23.25±1.3 18.65±0.614.56±0.55.89±0.53.56±0.29.95±0.1诱变菌株发酵糟32.37±1.6 23.87±0.714.37±0.66.51±0.23.51±0.19.97±0.2
近年,利用工农业废弃物生产单细胞蛋白的研究已相继报道[22-23],季彬等[24]用绿色木霉发酵玉米秸秆,使粗蛋白上升至17.3%,粗纤维下降至19.6%,但粗蛋白含量低,粗纤维含量高,达不到饲用要求。张阿强[25]用黑曲霉和产朊假丝酵母混菌分步发酵玉米秸秆,发酵结束后粗蛋白和真蛋白含量分别为30.93%和16.2%,虽粗蛋白上升较大但真蛋白含量较低,饲用价值较低。
荚膜红假单胞菌是一种对鱼虾有益、营养价值高、绿色安全的微生物,在单细胞蛋白饲料生产中具有极大的潜力[26]。前人研究结果表明荚膜红假单胞菌能利用葡萄糖,但不能利用五碳糖和酚类。本试验获得的能高效利用木糖和苯酚的菌株FJM,能有效利用玉米秸秆降解的第二大产物五碳糖和稀酸预处理产生的酚类物质。充分利用玉米秸秆的降解产物供自身生长繁殖而不受发酵抑制因子的影响,从而将玉米秸秆降解产物转化为菌体蛋白,因此使玉米秸秆真蛋白含量从5.02%提升至23.87%。发酵结果显示,粗蛋白含量提升至32.37%,高于邱宏端等[27]以荚膜红假单胞菌发酵转化酱渣,使粗蛋白提升至22.7%的研究。真蛋白含量提升374%,高于ZHANG等[28]用深红红螺菌(Rhodospirillum rubrum)发酵经预处理后的稻草秸秆,发酵后真蛋白含量提升286%的研究。曾宇等[29]利用嗜酸红假单胞菌(Rhodospirillum acidophila)和类球红细菌(Rhodospirillum sphaeroides)发酵氨化预处理的玉米秸秆,实现了利用光合菌转化玉米秸秆的目的,但存在纤维素含量高、蛋白质含量低等缺点。鉴此,采用诱变菌株FJM发酵经稀酸、氨化、酶解3种方法联合处理后的玉米秸秆,使秸秆粗纤维降低61.5%。较前人研究粗蛋白、真蛋白提升更大,粗纤维含量更低,此外,还较低水平提高粗脂肪,降低粗灰分。显示出诱变菌株FJM对玉米秸秆饲料化的显著优势。但该菌株自身不能利用木质纤维原料中的粗纤维组分,致使原料预处理存在工艺复杂,消耗大量的人力物力,成本较高等缺点。因此如何筛选出既能高效降解玉米秸秆粗纤维组分,自身又富含蛋白质等营养物质,且营养需求低的微生物是未来秸秆饲料化研究的主要方向。
[1] 吕中旺, 王建, 孙鹏, 等. 秸秆主产区三大作物秸秆饲用品质分析与评价[J]. 草业科学, 2018, 35(8): 2 016-2 021.
[2] JUAN L, AKIBER C W, HAIRONG Y, et al. Natural freezing-thawing pretreatment of corn stalk for enhancing anaerobic digestion performance[J]. Bioresource Technology,2019, 288:118-121.
[3] 王长波, 平英华, 刘先才, 等. 我国秸秆资源“五化”利用研究进展[J]. 安徽农业科学, 2018, 46(7): 22-26;29.
[4] HU X F, JIANG H F, ZHANG Y J. Effect of fipronil on biogas production performance during anaerobic digestion of chicken manure and corn straw[J]. Journal of environmental science and health, Part B, 2019, 54(6): 449-458.
[5] CHEN X G. Economic potential of biomass supply from crop residues in China[J]. Applied Energy, 2016, 166: 141-149.
[6] 王旭辉, 徐鑫, 宝哲, 等. 高通量测序分析玉米秸秆与牛粪联合发酵阶段微生物多样性变化[J]. 食品与发酵工业, 2019, 45(3): 47-55.
[7] VIOLA E, ZIMBARDI F, CARDINALE M, et al. Gambacorta. Processing cereal straws by steam explosion in a pilot plant to enhance digestibility in ruminants[J]. Bioresource Technology, 2008, 99(4): 681-689.
[8] SANCHEZ O J, CARDONA C A. Trends in biotechnological production of fuel ethanol from different feedstocks[J]. Bioresource Technology, 2008, 99(13): 5 270-5 295.
[9] MONLAU F, SAMBUSITI C, BARAKAT A, et al. Do furanic and phenolic compounds of lignocellulosic and algae biomass hydrolyzate inhibit anaerobic mixed cultures? A comprehensive review[J]. Biotechnology Advances,2014,32(5):934-951.
[10] 黎建斌, 何为. 粘稠性荚膜红假单胞菌对黄沙鳖稚鳖水质及生产性能的影响[J]. 河北渔业, 2011,32(10): 22-25.
[11] WU PAN, HAN Ziqiao, MO Wentao, et al. Soybean processing wastewater supported the removal of propyzamide and biochemical accumulation from wastewater by Rhodopseudomonas capsulata[J]. Bioprocess and biosystems engineering, 2019, 42(8): 1 375-1 384.
[12] SHI X Y, YU H Q. Conversion of individual and mixed volatile fatty acids to hydrogen by Rhodopseudomonas capsulata[J]. International Biodeterioration & Biodegradation, 2006, 58(2): 82-88.
[13] 黎建斌, 何为, 李大列, 等. 高活性荚膜红假单胞菌分离鉴定及应用[J]. 南方农业学报, 2012, 43(4): 540-543.
[14] SHI Xianyang, LI Wenwei, YU Hanqing. Key parameters governing biological hydrogen production from benzoate by Rhodopseudomonas capsulata[J]. Applied Energy, 2014, 133: 121-126.
[15] 路亚婷. 甲基磺酸乙酯(EMS)诱变定向提高酿酒酵母对糠醛耐受性的初步研究[D]. 雅安:四川农业大学, 2017.
[16] 李翔. 微生物诱变育种技术[J]. 现代商贸工业, 2017(34): 185-187.
[17] 管斌, 丁友昉, 谢来苏, 等. 还原糖测定方法的规范[J]. 无锡轻工大学学报, 1999,18(3): 74-79.
[18] GAO Mairui, XU Qianda, HE Qiang, et al. A theoretical and experimental study: The influence of different standards on the determination of total phenol content in the Folin-Ciocalteu assay[J]. Journal of Food Measurement and Characterization, 2019, 13(2): 1 349-1 356.
[19] 王海静, 朱风华. 三氯乙酸法与硫酸铜法测定饲料真蛋白比较[J]. 饲料研究, 2012(11):69-71.
[20] 吴国峰, 李国全, 马永强. 工业发酵分析[M]. 北京: 化学化工出版社, 2006.
[21] WANG Xing, XU Yong, FAN Li. Simultaneous sepapation and quantitative determination of monosaccharides, uronic acids, and aldonic acids by high performance anion-exchange chromatography coupled with pulsed amperometric detection in corn stover prehydrolysates[J]. Bioresources, 2012, 7 (4): 4 614-4 625.
[22] 巩莉, 华颖, 刘大群, 等. 利用番茄废渣混菌固体发酵生产蛋白饲料[J]. 食品与发酵工业, 2015, 41(5): 116-121.
[23] 黄林丽, 谢斌, 陈立, 等. 公共餐厨垃圾饲料化利用的混合菌发酵工艺[J]. 食品与发酵工业, 2019, 11(4):1-7.
[24] 季彬, 祁宏山, 杜军国, 等. 玉米秸秆发酵生产单细胞蛋白饲料前景研究[J]. 中国畜禽种业, 2016, 12(10): 33-35.
[25] 张阿强. 混菌固态发酵玉米秸秆产单细胞蛋白饲料的研究[D]. 兰州:兰州交通大学, 2017.
[26] 刘捷豹, 邱宏端, 林娟, 等. 荚膜红假单胞菌产类胡萝卜素的培养基优化实验[J]. 食品与发酵工业, 2005,31(5): 167-170.
[27] 邱宏端, 李明伟, 陈聪辉, 等. 耐盐红螺菌科细菌发酵酱渣生产蛋白饲料的工艺研究[J]. 农业工程学报, 2002,18(6): 118-122.
[28] ZHANG Jian, YUAN Jie, ZHANG Wenxue, et al. Anaerobic detoxification fermentation by Rhodospirillum rubrum for rice straw as feed with moderate pretreatment[J]. Preparative Biochemistry and Biotechnology, 2018, 48(1): 75-83.
[29] 曾宇, 谭四军. 利用光合菌发酵对玉米秸杆进行转化的研究[J]. 微生物学通报, 2001,28(6): 5-9.