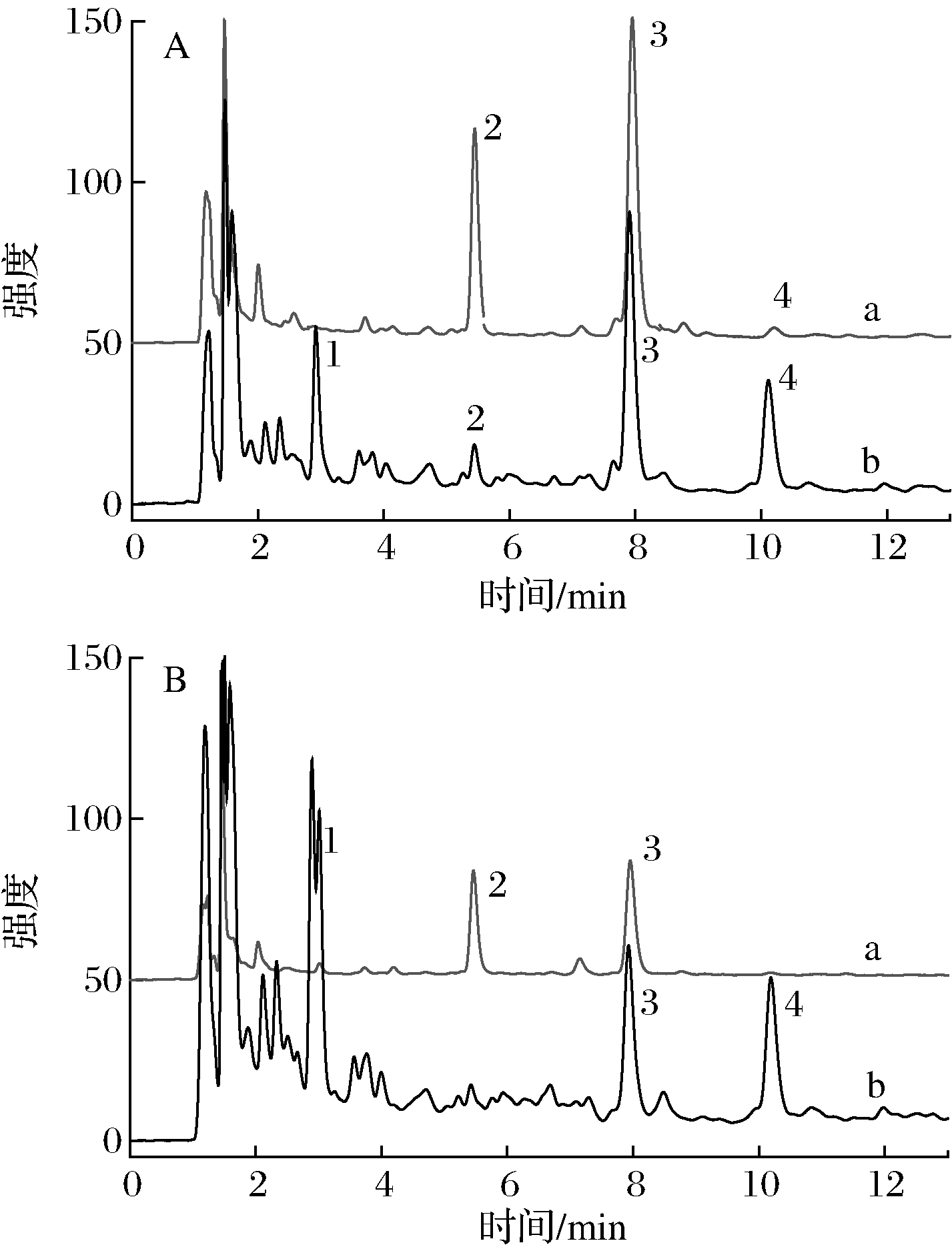
A-淡竹(a)、毛竹(b)水提液;B-淡竹(a)、毛竹(b)干馏液
图1 竹沥的UPLC色谱图(280 nm)
Fig.1 UPLC chromatogram of bamboo juice
竹子为禾本科竹亚科植物[1],其种类繁多,生长周期短,资源丰富。中国在竹资源种类、分布、产量、季节适应性均世界领先[2]。竹子在食品领域也被广泛使用,如中国自古就有食用竹笋的习惯,竹叶黄酮是国家卫计委批准的新食品原料[3]。传统竹沥是将竹竿用火烤灼后流出的淡黄色液体,我国有悠久的饮用历史,也是许多保健食品及夏季解暑饮料的原料。
中医记载竹沥有清热化痰,开窍定惊等功效,可用于治疗呼吸系统疾病。王芳等[4]研究发现竹沥能有效促进NO的分泌,减少烟熏所致慢性支气管炎模型大鼠肺组织炎症的介质分泌,减轻炎症损伤。罗怀浩等[5]发现竹沥不同程度的提高了小鼠气管酚红分泌,延迟了咳嗽潜伏期,减少咳嗽次数。巨亚敏等[6]应用市面上竹沥胶囊治疗急性咽喉炎,可更快缓解及明显消除相关临床症状。余亚平等[7]发现复方鲜竹沥液与布地奈德和孟鲁司特钠联合治疗咳嗽性哮喘可降低血清IgE、TNF-α 和IL-8水平,改善一些肺功能指标,减少复发率,安全性良好。目前研究认为竹沥中主要活性成分有愈创木酚、苯酚、紫丁香醇、去甲绵马酚和5-叔丁基焦酚等[1, 8-10]。姚金龙等[9]还从鲜竹沥乙酸乙酯萃取部分鉴定了丁香醛、松柏醛、香草酸、4-甲氧基肉桂酸等化合物。张规富等[11]鉴定了雷竹沥中甲肼、乙酸、糠醛、5-羟甲基糠醛等成分。
传统竹沥通常以禾本科刚竹属淡竹为原料制得。但禾本科刚竹属毛竹较淡竹分布更广,资源更丰富。但以毛竹为原料制备的竹沥在化学成分上是否与淡竹竹沥有显著差异?此外,现代竹沥工业生产通常将火烤灼改为干馏,但仍存在得率低、竹资源利用低下的特点。如能采用水煮方法将极大提高得率并简化工艺,但这是否会导致竹沥成分差异?针对这些问题,本研究以毛竹和淡竹为原料,分别经干馏和水煮获得竹沥,通过UPLC-DAD-QTOF-MS进行了成分分析;并对总酚、总黄酮、总氨基酸、对香豆酸等定量分析。
新鲜毛竹、淡竹竹竿产自江西省永丰县,由江西维莱营健高科有限公司提供。对香豆酸(≥98%)、芦丁(≥98%)、L-谷氨酸(≥99%)、福林酚等购自北京索莱宝科技公司;Na2CO3、CH3COOK、Al(NO3)3、K2HPO4、KH2PO4、茚三酮、没食子酸等购自天津市大茂化学试剂厂,所用试剂均为分析纯。仁和®复方鲜竹沥液,江西远东药业股份有限公司。
HPLC为Agilent 1260系统,配自动进样器和DAD检测器,美国安捷伦科技有限公司;V-5600可见分光光度计,上海元析仪器有限公司;UPLC-DAD-QTOF-MS,质谱部分为Q-TOF 5600+ (AB Sciex Corporation, Foster City, CA, USA),UPLC部分为岛津LC-30A-DAD系统(Shimadzu Corporation, Kyoto, Japan)。
1.3.1 干馏法制备竹沥
将竹竿切成长宽约1~2 cm的碎块,将500 mL圆底烧瓶装满后置于电热套中。将整体倒置并固定,200 oC烤制1 h,在瓶口流出的即为干馏竹沥。
1.3.2 水提法制备竹沥
将竹竿切成长宽约1~2 cm的碎块后,用粉碎机粉碎。按料液比1∶10加入蒸馏水,沸水浴中加热1 h,过滤后得水提竹沥。
1.3.3 竹沥HPLC分析条件
流动相为乙腈(A)及0.1%醋酸水溶液(B),线性梯度程序为0~15 min,10%~20% A;15~40 min,20%~40%A。流速1 mL/min,柱温为40 ℃ ,进样量10 μL。对香豆酸在310 nm下的定量标准曲线为Y=62.195X(R2=0.999),X为对香豆酸质量浓度(μg/mL),Y为峰面积。
1.3.4 UPLC-Q-TOF-MS分析
UPLC使用色谱柱为Acquity BEH C18柱(2.1 mm×100 mm, 1.7 μm, Waters)。流速为0.3 mL/min,进样量为2 μL,柱温为40 oC。流动相为乙腈(A)及0.1%甲酸水溶液(B),线性梯度程序为0~15 min,10%~15%A;15~20 min,15%~30% A。质谱系统为负离子模式,离子喷雾电压为-4 500 V,温度为500 ℃。数据分析软件为Analyst 1.6。
1.3.5 竹沥中总黄酮测定
参考国家标准[12]。配制芦丁标准液(200 μg/mL),吸取不同体积于25 mL容量瓶中,加95%乙醇至总体积为7.5 mL。依次加入100 g/L硝酸铝溶液0.5 mL,9.8 g/L醋酸钾溶液0.5 mL,定容摇匀,静置1 h。以30%乙醇溶液为空白,在415 nm下测定吸光度。绘制标准曲线为Y=1.23X(R2=0.999),X为反应体系中芦丁质量(mg),Y为吸光度。
1.3.6 竹沥中总多酚测定
参考何新益,刘清等[13-14]方法,配制没食子酸标准溶液(158 μg/mL)4 ℃保存,准确吸取不同体积于10 mL容量瓶中,依次加入福林试剂0.5 mL,15%的Na2CO3溶液1 mL,充分混合后定容,30 oC避光放置1 h,以蒸馏水为空白,在760 nm波长测定吸光度。绘制标准曲线得Y=9.03X(R2=0.996),X为没食子酸在反应体系中质量(mg),Y为吸光度。
1.3.7 竹沥中总游离氨基酸测定
参考国家标准[15]。配制L-谷氨酸溶液(205 μg/mL),准确吸取不同体积于25 mL容量瓶,加入2%茚三酮1 mL,磷酸缓冲液(pH 8.0)1 mL,100 oC水浴15 min后定容,静置15 mL,570 nm测定吸光度。绘制标准曲线Y=2.72X-0.395 6(R2=0.998)。X为谷氨酸在反应体系中质量(mg),Y为吸光度。
实验平行重复3次,取其平均值,结果均用Microsoft Excel 2010进行数据计算、分析。曲线图以Origin 9.0进行绘制。
图1为不同方法制备的毛竹和淡竹竹沥经UPLC分离后,由DAD检测器在280 nm波长下记录的色谱图。毛竹和淡竹竹沥主要化学成分很相似,都含有1~4 号峰,但含量差异很大。峰2、3为淡竹竹沥主要成分,峰1、3和4为毛竹竹沥主要成分。峰3是两者的共同的主要成分,但淡竹中峰面积要大于毛竹。峰2在淡竹中含量较高,而在毛竹中很低;而峰4在毛竹中含量较高,在淡竹中很低。水提和干馏法获得的各竹沥在成分上无显著差异,但水提液中主要峰(峰2和3)的峰面积更大。图2为通过DAD检测器获得的4个主要峰的UV图谱。峰1、2和4的最大吸收峰均在280 nm左右;而峰3的最大吸收峰为310 nm左右。

A-淡竹(a)、毛竹(b)水提液;B-淡竹(a)、毛竹(b)干馏液
图1 竹沥的UPLC色谱图(280 nm)
Fig.1 UPLC chromatogram of bamboo juice
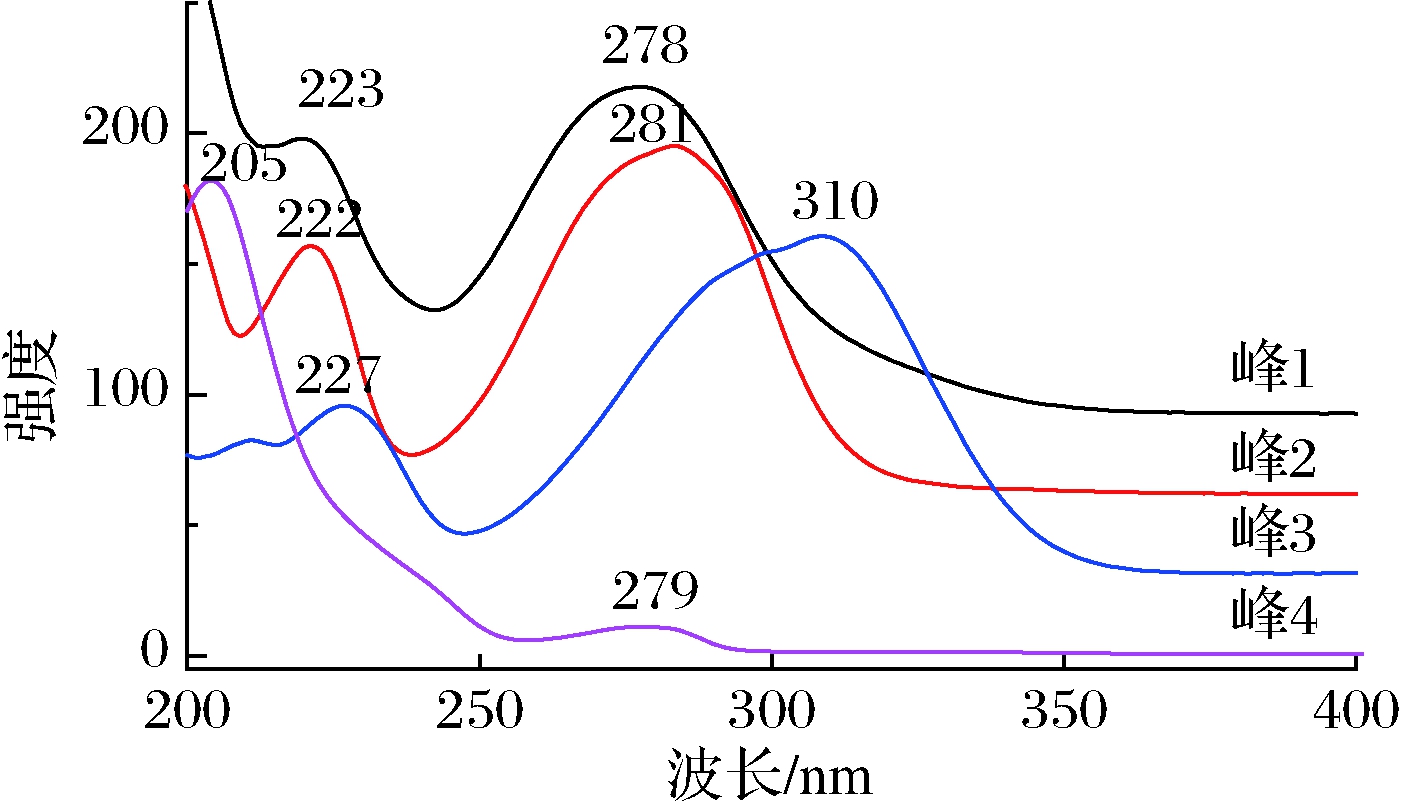
图2 淡竹和毛竹沥色谱图中4个主要色谱峰UV光谱图
Fig.2 UV spectra of four main chromatographic peaks in the UPLC chromatograms of P. glauca and P. heterocycla
通过QTOF-MS联用,我们可以进一步获得各色谱峰的分子质量和碎片离子情况,从而对其进行结构鉴定。表1为4个主要色谱峰的质谱信息及鉴定结果。除峰2外,其余3个峰都得到鉴定,它们的二级质谱图和可能化学结构见图3。峰3的分子离子([M-H]-)为m/z 163,主要碎片为m/z 119、117和93,经与文献比对鉴定为对香豆酸[16]。进一步比较了峰3和对香豆酸对照品的HPLC保留时间和UV光谱,发现两者完全一致。研究表明,对香豆酸具有较强的杀菌作用,可以破坏细菌细胞膜,结合细菌DNA;此外,还有抗氧化作用,能清除DPPH、ABTS等自由基及还原Fe3+[17-18]。峰4的分子离子([M-H]-)为m/z 581,其碎片离子m/z 419来源于[M-H]--162,说明其分子中含有已糖;此外,多个碎片间相差m/z 15,说明其分子结构中含有多个甲基。经与文献比对,峰4鉴定为lyoniresinol-glucopyranoside,是一种木质素糖苷[19]。因为含量较低,竹沥中一些成分的色谱峰在DAD检测器中可能会被掩盖。通QTOF-MS,可以对特定的离子进行提取。图5为淡竹和毛竹竹沥中绿原酸类化合物的离子提取色谱图。m/z 337.1,353.1,367.1,515.1分别为对香豆酰奎宁酸、咖啡酰奎宁酸、阿魏酰奎宁酸和二咖啡酰奎宁酸的分子离子([M-H]-)。以这些质荷比为离子提取条件,并通过提取色谱峰的二级质谱碎片进行进一步确认结构。奎宁酸有3-OH、4-OH和5-OH可与对香豆酸、咖啡酸等形成酰基,因此会有多个异构体。一些研究通过碎片峰形成及丰度情况来判定成酰位置。当酰基位于3-或5-时,[quinic acid-H]-(m/z 191)碎片丰度最强;且当位于3-时,[coumaroyl acid-H]-(m/z 163)、[caffeic acid-H]-(m/z 179)或[feruloyl acid-H]-(m/z 193)的碎片丰度相对于5-更强。当酰基位于4-时,[quinic acid-H2O-H]-(m/z 173)丰度最强[20]。一些其他二级质谱碎片来源,m/z 134为 [feruloyl acid-CO2-CH3-H]-,m/z 119为[coumaroyl acid-CO2-H]-,m/z 135为[caffeic acid-CO2-H] ̄。
根据图5几种绿原酸类化合物的离子提取色谱图来看,毛竹沥中绿原酸类含量及种类比淡竹沥要丰富得多。在毛竹沥中发现有9种绿原酸类物质,并且以咖啡酰奎宁酸含量较多;而淡竹沥中几乎没有咖啡酰奎宁酸,阿魏酰奎宁酸和对香豆酰奎宁酸含量也显著低于毛竹。绿原酸类化合物作为植物中常见的次生代谢产物,具有多种显著的生物活性,如抗氧化、抑菌、降血压等[21-22]。
此外,通过QTOF-MS,我们还发现竹沥中有苹果酸、柠檬酸等有机酸,并鉴定了一些其他痕量成分,包括一些酚酸糖苷(如水杨酸、原儿茶酸等)和黄酮苷(主要为芹菜素),详细结果见表3。另外,值得一提的是,许多研究认为愈创木酚是竹沥的主要功效成分[1, 10]。但我们以愈创木酚的准分子质量([M-H]-,m/z 123.1)为离子提取条件,提取色谱图中并没有明显的色谱峰。说明愈创木酚在竹沥中含量甚微,可能并不是竹沥主要功效成分。
UPLC-DAD-QTOF-MS分析结果表明,毛竹和淡竹竹沥成分非常相似;对香豆酸是2种竹沥主要的酚酸成分,但含量差异较大。比较了水提和干馏法制备的竹沥成分差异,表1和表3中的结果表明所有在干馏竹沥中发现的化学成分在水提竹沥中都可以检出,说明2种制备方法不影响竹沥主要成分。
表1 淡竹和毛竹沥色谱图中4个主要色谱峰的质谱信息及鉴定结果
Table 1 Mass spectrogram data and identification results of four major chromatographic peaks in the chromatogram of bamboo juice

峰号时间/min[M-H]-特征碎片(%基峰)R1R2R3R4化合物参考文献13.014327.107 6147(100),59(8)++++1-(4-hydroxyphenyl)-3-[(2R,3R,4S,5S,6R)-3,4,5-trihydrox-y-6-(hydroxymethyl)oxan-2-yl]oxypropan-1-onehttp://mona.fiehnlab.ucdavis.edu/spectra/browse?inchikey=NPAQHLFPEOMKAL-UXXRCYH-CSA-N25.536351.128 3101(100),249(45),351(50),113(20),59(19),85(19),231(10)++++未鉴定38.038163.042 0119(100),93(24),117(10)++++对香豆酸[16]410.301581.220 4419(100),373(95),404(87),371(57),581(50),359(43),389(25),401(15)++++lyoniresinol-glucopyranoside[19]http://mona.fiehnlab.uc-davis.edu/spectra/browse?inchikey=PQQRNPDHSJDAGV-UHFFFAOYSA-N
注:R1-淡竹水提液;R2-毛竹水提液;R3-淡竹干馏液;R4-毛竹干馏液。+表示有该成分(下同)
表2 淡竹和毛竹竹沥中绿原酸类化合物的质谱信息
Table 2 Mass spectrogram data of chlorogenic acid compounds in bamboo juice of P. glauca andP. heterocycla

[M-H]-峰号时间/min特征碎片(%基峰)化合物337.092 213.43119(100),163(95),191(42),173(10)对香豆酰奎宁酸25.95173(100),191(43),119(33)a2.49191(100),135(68),179(32)353.087 3b3.75191(100)咖啡酰奎宁酸c3.97191(100),135(85),173(52),179(33)A4.16134(100),193(43),191(10)367.102 6B5.16134(100),193(70),173(10)阿魏酰奎宁酸C7.40173(100),134(53),193(26)515.138 4α2.28179(100),173(80),135(33)二咖啡酰奎宁酸
根据QTOF-MS分析结果,对香豆酸是毛竹和淡竹竹沥中主要酚酸成分。此化合物具有多种显著生物活性,因此我们通过HPLC对其进行了定量测定。同时,还测定了干馏和水提法获得的2种竹沥中总黄酮、总多酚和总游离氨基酸,详细比较结果见表4。相对于原料重量,干馏法竹沥的得率不足10%;而水提法得率与料液比有关,本实验中料液比为1∶10,因此得率为1 000 %。定量分析结果表明,水提淡竹竹沥中对香豆酸、总黄酮、总多酚和总游离氨基酸含量分别为28.2、8.2、162.6、92.7 μg/mL,这些值都高于干馏法获得的淡竹竹沥。比较不同方法获得的毛竹竹沥,除多酚外,其他成分也是水提竹沥样品中含量最高。此外,毛竹竹沥的总多酚和总黄酮含量远高于淡竹竹沥。
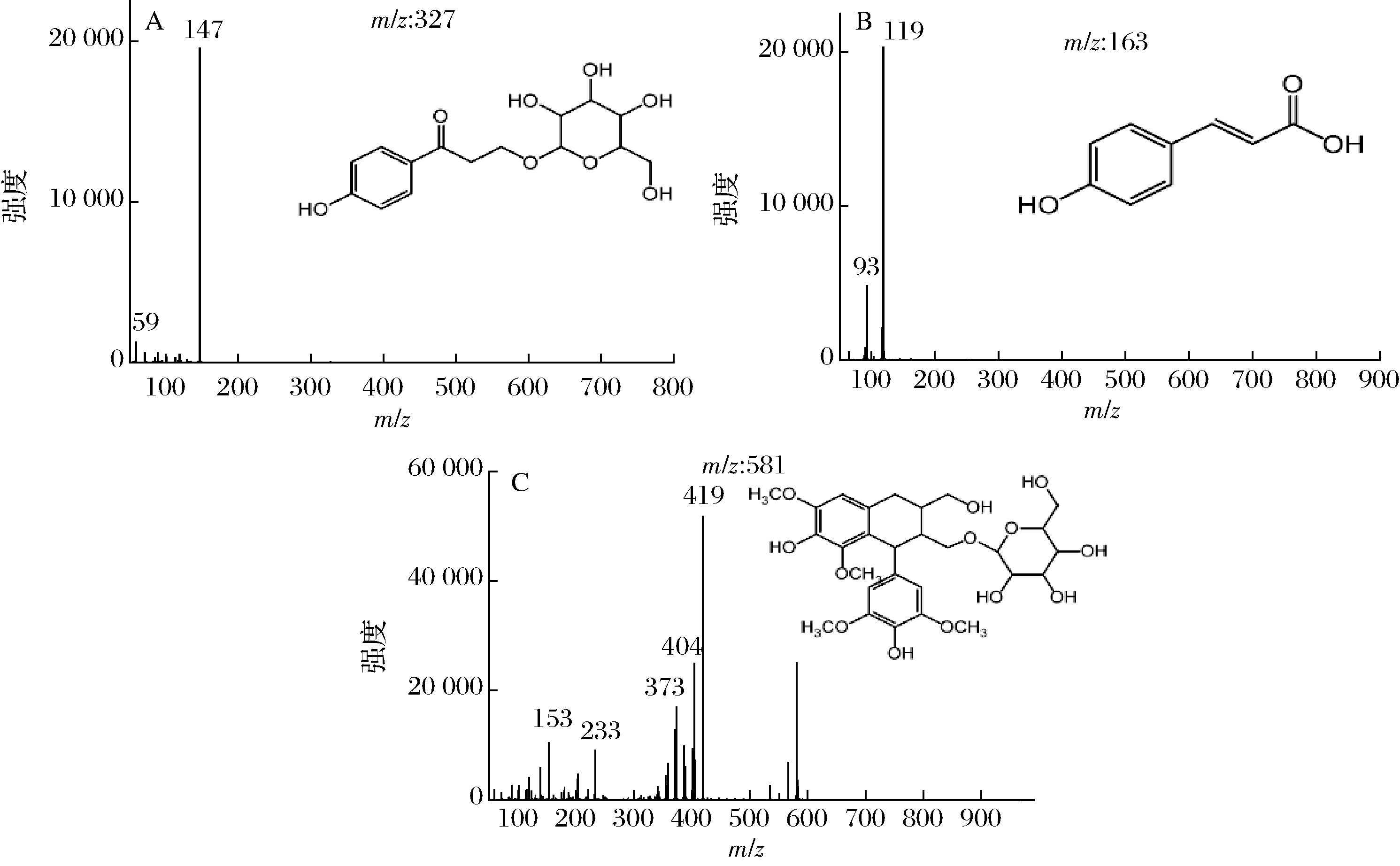
A-峰1;B-峰3;C-峰4
图3 竹沥中主要成分的二级质谱图和可能化学结构
Fig.3 MS/MS chromatogram and possible chemical structure of main components in bamboo juice
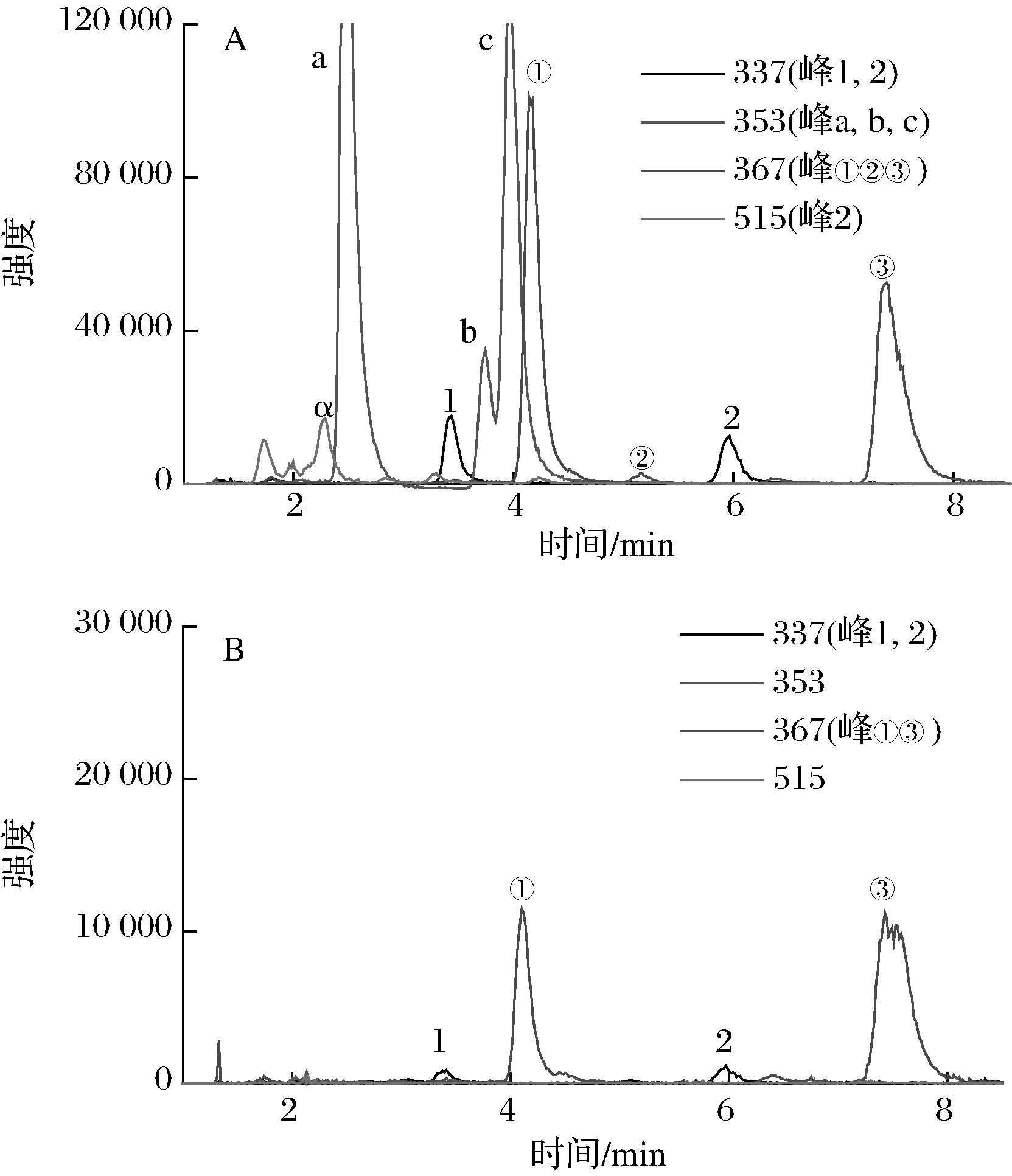
A-毛竹水提竹沥:B-淡竹水提竹沥
图4 竹沥中绿原酸类化合物的提取离子色谱图
Fig.4 Extract ions chromatogram of chlorogenic acids from bamboo juice
复方鲜竹沥是较受欢迎的中成药,它以竹沥为主要成分,常用于治疗小儿咳嗽。图5是对香豆酸标准品,毛竹、淡竹水提液和市售仁和®复方鲜竹沥液的HPLC分析色谱图。对香豆酸标准品的出峰时间为16.3 min。在相同保留时间下毛竹、淡竹水提液和复方鲜竹沥液均有对应的色谱峰,其UV光谱图也和对香豆酸标准品一致。说明市售复方鲜竹沥中确实含有来自于竹沥的对香豆酸。另外,复方鲜竹沥原料中还有鱼腥草、生半夏等,因此其色谱图中还有很多其他成分峰。对香豆酸具有较强的杀菌和抗氧化作用,因此可能是竹沥功效的重要物质基础;其含量也远高于常用于评价竹沥质量的愈创木酚。因此,我们认为对香豆酸是竹沥一个重要的质量指标。
表4 毛竹和淡竹竹沥定量分析结果
Table 4 Quantitative analysis of bamboo juice components of P. heterocycla and P. glauca
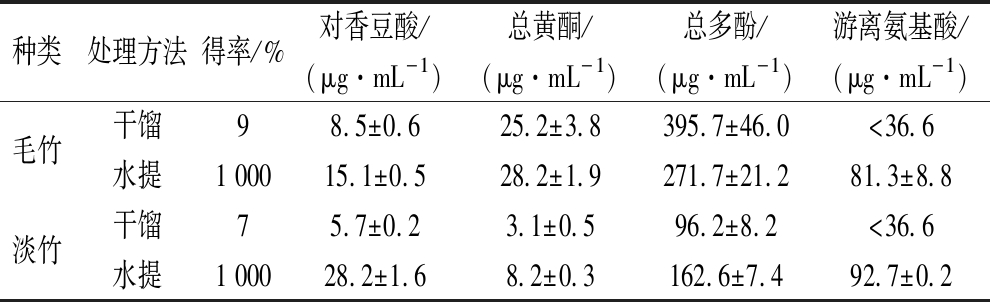
种类处理方法得率/%对香豆酸/(μg·mL-1)总黄酮/(μg·mL-1)总多酚/(μg·mL-1)游离氨基酸/(μg·mL-1)毛竹干馏98.5±0.625.2±3.8395.7±46.0<36.6水提1 00015.1±0.528.2±1.9271.7±21.281.3±8.8淡竹干馏75.7±0.23.1±0.596.2±8.2<36.6水提1 00028.2±1.68.2±0.3162.6±7.492.7±0.2
表3 淡竹和毛竹竹沥中鉴定的其他成分质谱信息
Table 3 Mass spectrogram data of other components identified in bamboo juice
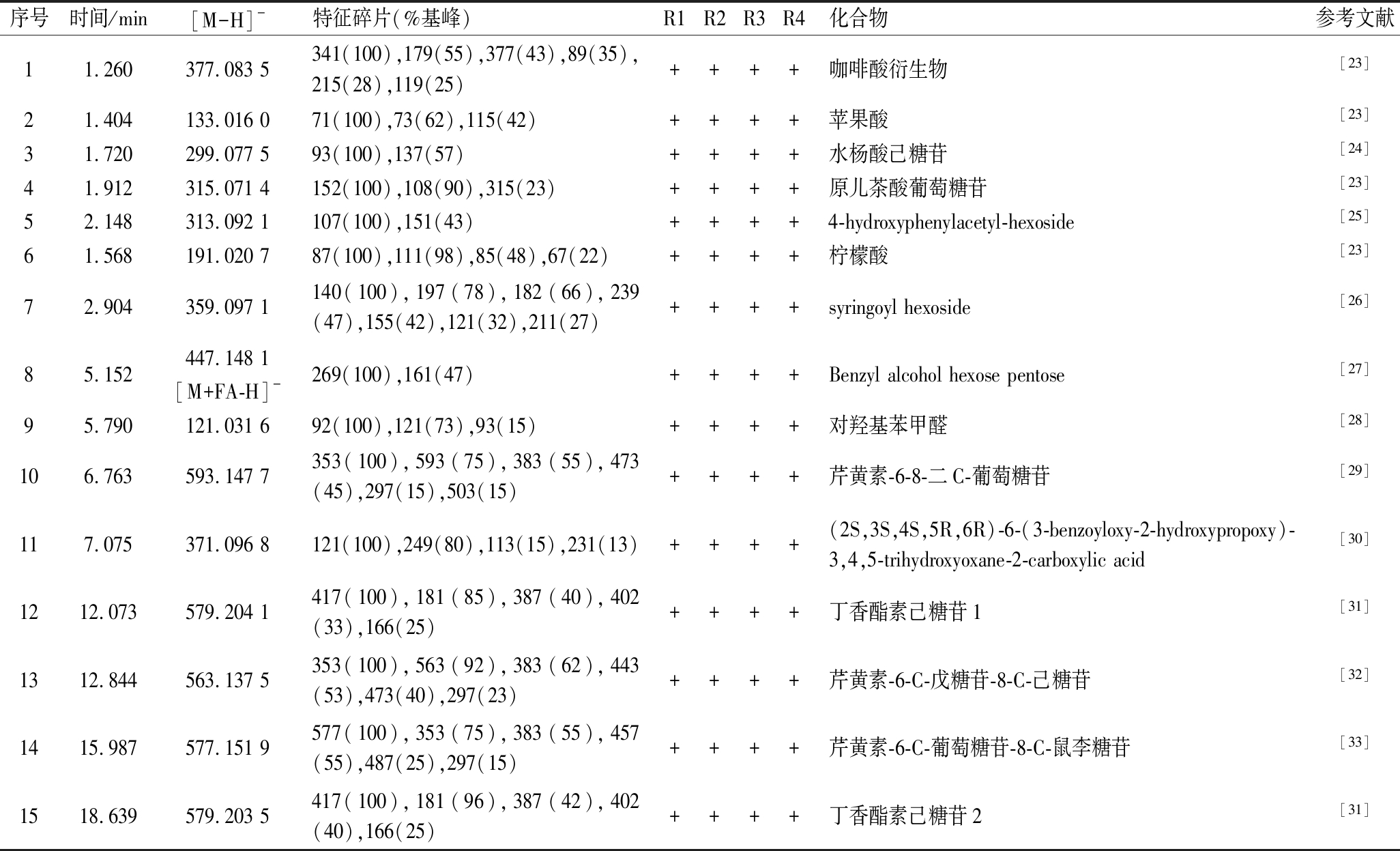
序号时间/min[M-H]-特征碎片(%基峰)R1R2R3R4化合物参考文献11.260377.083 5341(100),179(55),377(43),89(35),215(28),119(25)++++咖啡酸衍生物[23]21.404133.016 071(100),73(62),115(42)++++苹果酸[23]31.720299.077 593(100),137(57)++++水杨酸己糖苷[24]41.912315.071 4152(100),108(90),315(23)++++原儿茶酸葡萄糖苷[23]52.148313.092 1107(100),151(43)++++4-hydroxyphenylacetyl-hexoside[25]61.568191.020 787(100),111(98),85(48),67(22)++++柠檬酸[23]72.904359.097 1140(100),197(78),182(66),239(47),155(42),121(32),211(27)++++syringoyl hexoside[26]85.152447.148 1[M+FA-H]-269(100),161(47)++++Benzyl alcohol hexose pentose[27]95.790121.031 692(100),121(73),93(15)++++对羟基苯甲醛[28]106.763593.147 7353(100),593(75),383(55),473(45),297(15),503(15)++++芹黄素-6-8-二C-葡萄糖苷[29]117.075371.096 8121(100),249(80),113(15),231(13)++++(2S,3S,4S,5R,6R)-6-(3-benzoyloxy-2-hydroxypropoxy)-3,4,5-trihydroxyoxane-2-carboxylic acid[30]1212.073579.204 1417(100),181(85),387(40),402(33),166(25)++++丁香酯素己糖苷1[31]1312.844563.137 5353(100),563(92),383(62),443(53),473(40),297(23)++++芹黄素-6-C-戊糖苷-8-C-己糖苷[32]1415.987577.151 9577(100),353(75),383(55),457(55),487(25),297(15)++++芹黄素-6-C-葡萄糖苷-8-C-鼠李糖苷[33]1518.639579.203 5417(100),181(96),387(42),402(40),166(25)++++丁香酯素己糖苷2[31]
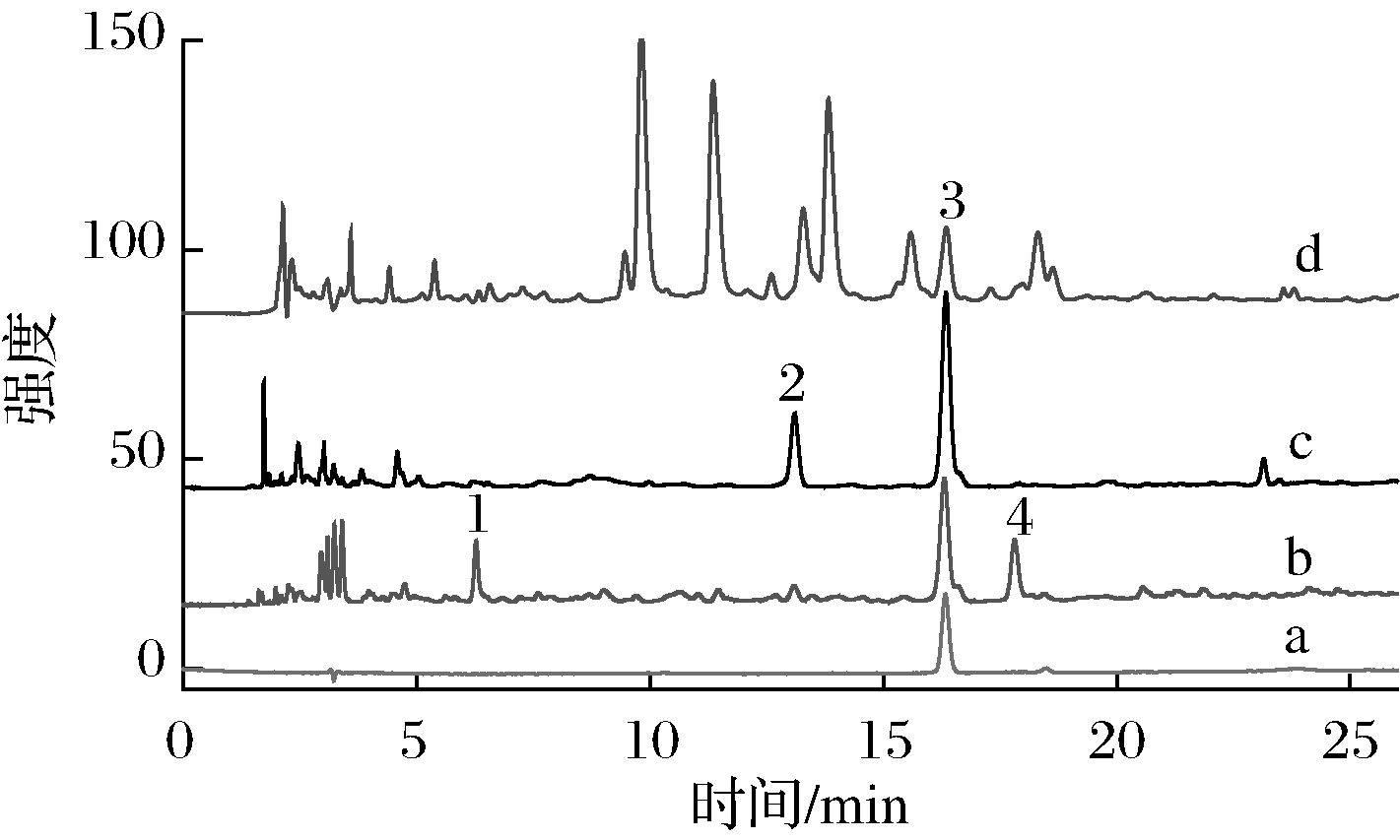
图5 对香豆酸标准品(a),毛竹水提液(b),淡竹水提液(c)和市售仁和®复方鲜竹沥液(d)的HPLC分析色谱图(280 nm)
Fig.5 HPLC chromatogram comparison of bamboo juice (280 nm), (a) p-coumaric acid, (b water extract of P. heterocycla, (c) water extract of P. glauca, (d) Market selling bamboo juice medicine
UPLC-DAD-QTOF-MS分析结果表明,毛竹和淡竹竹沥成分差异不大。对香豆酸是两者主要的酚酸成分,但淡竹中含量高于毛竹;毛竹沥中木质素糖苷Lyoniresinol-glucopyranoside含量高于淡竹。从痕量成分看,毛竹沥中绿原酸类含量及种类较淡竹沥丰富;此外,两者还含有苹果酸、柠檬酸、及酚酸糖苷和黄酮苷等15个共有成分。水提法制备竹沥操作简单,且得率远高于干馏法;并且产品中对香豆酸、总黄酮、总多酚和总游离氨基酸含量也更高。对香豆酸和绿原酸类物质是抑菌、抗炎活性研究较多的植物次生代谢产物,与竹沥传统功效相吻合。在市售复方竹沥中同样发现了对香豆酸成分。基于实验结果,我们认为毛竹可以用于生产竹沥,并且用对香豆酸比愈创木酚更适合作为竹沥质量评价指标。
[1] 金晓飞, 李红, 蒋孟良, 等. 不同种竹沥的化学组分分析及其药效研究[J]. 中医药导报, 2014, 20(5): 82-85.
[2] 江云, 孙佳彬, 张超, 等. 竹沥的研究现状与思考[J]. 中国药房, 2017, 28(28): 4 014-4 018.
[3] NIRMALA C, BISHT M S, BAJWA H K, et al. Bamboo: A rich source of natural antioxidants and its applications in the food and pharmaceutical industry[J]. Trends in Food Science & Technology, 2018, 77: 91-99.
[4] 王芳. 竹沥颗粒对慢性支气管炎模型大鼠的疗效及机制探讨[D]. 成都: 成都中医药大学, 2017:18-29.
[5] 罗怀浩, 蒋孟良, 金晓飞, 等. 不同干馏时间所制竹沥对小鼠止咳化痰作用的影响[J]. 中医药导报, 2015, 21(19): 33-35.
[6] 巨亚敏, 朱旭敏. 急性咽喉炎给予竹沥胶囊治疗的临床观察[J]. 世界最新医学信息文摘, 2018, 18(61): 110; 121.
[7] 高田娟,翁娅韵,余亚平. 复方鲜竹沥液联合布地奈德和孟鲁司特钠治疗咳嗽性哮喘临床疗效及对炎症因子和肺功能的影响[J]. 浙江中西医结合杂志, 2019, 29(1): 49-51.
[8] 金晓飞, 李红, 杨欣, 等. 四种竹沥化学成分分析研究[J]. 西部中医药, 2014, 27(5): 13-15.
[9] 姚金龙, 付辉政, 周志强, 等. 鲜竹沥乙酸乙酯部位的化学成分研究[J]. 中药材, 2018, 41(10): 2 354-2 358.
[10] 熊艳, 吴学文, 蒋孟良. 淡竹沥四种不同制备工艺的比较研究[J]. 中成药, 2006, 28(12): 1 825-1 826.
[11] 张规富, 陈亚. 不同方法制备的雷竹竹沥化学成分分析[J]. 湖北农业科学, 2017, 56(9): 1 730-1 733;1 800.
[12] 中国国家标准化管理委员会.GB/T 20574—2006 蜂胶中总黄酮含量的测定方法—分光光度比色法[S].北京:中国标准出版社,2006.
[13] 何新益,刘金福,何菲.糙米发芽前后抗氧化活性比较研究[J]. 中国粮油学报, 2009, 24(11): 6-8;16.
[14] 刘清, 李玉, 姚惠源. Folin-Ciocalteu比色法测定大麦提取液中总多酚的含量[J]. 食品科技, 2007(4): 175-177.
[15] 中国国家标准化管理委员会.GB/T 8314—2013 茶—游离氨基酸总量的测定[S]. 北京: 中国标准出版社, 2013.
[16] MENA P,S CNCHEZ-SALCEDO E M, TASSOTTI M, et al. Phytochemical evaluation of eight white (Morus alba L.) and black (Morus nigra L.) mulberry clones grown in Spain based on UHPLC-ESI-MSn metabolomic profiles[J]. Food Research International, 2016, 89: 1 116-1 122.
CNCHEZ-SALCEDO E M, TASSOTTI M, et al. Phytochemical evaluation of eight white (Morus alba L.) and black (Morus nigra L.) mulberry clones grown in Spain based on UHPLC-ESI-MSn metabolomic profiles[J]. Food Research International, 2016, 89: 1 116-1 122.
[17] ISMAIL KILIÇ,YE IM YE
IM YE
![]() Spectroscopic studies on the antioxidant activity of p-coumaric acid[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2013, 115: 719-724.
Spectroscopic studies on the antioxidant activity of p-coumaric acid[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2013, 115: 719-724.
[18] STOJKOVIC D, PETROVIC J, SOKOVIC M, et al. In situ antioxidant and antimicrobial activities of naturally occurring caffeic acid, p-coumaric acid and rutin, using food systems[J]. Journal of the Science of Food and Agriculture, 2013, 93(13): 3 205-3 208.
[19] SUN G L, ZHANG X P,XU X, et al. The isolation and structure identification of four Lignan’s stereoisomers from Uncaria sinensis (Oliv.) Havil[J]. Journal of Medicinal Plants Research, 2012, 6(11): 2 200-2 205.
[20] WEISZ G M, KAMMERER D R, CARLE R.Identification and quantification of phenolic compounds from sunflower (Helianthus annuus L.) kernels and shells by HPLC-DAD/ESI-MSn[J]. Food Chemistry, 2009, 115(2): 758-765.
[21] ZHELEVA-DIMITROVA D, GEVRENOVA R, ZAHARIEVA M M, et al. HPLC‐UV and LC-MS analyses of acylquinic acids in Geigeria alata (DC) Oliv. & Hiern. and their contribution to antioxidant and antimicrobial capacity[J]. Phytochemical Analysis, 2017, 28(3): 176-184.
[22] ONAKPOYA I, SPENCER E, THOMPSON M, et al. The effect of chlorogenic acid on blood pressure:a systematic review and meta-analysis of randomized clinical trials[J]. Journal of human hypertension, 2015, 29(2): 77-81.
[23] QIU X L, GUO Y X, ZHANG Q F. Chemical profile and antioxidant activity of Gynura bicolor DC. ethanolic extract[J]. International Journal of Food Properties, 2018, 21(1): 407-415.
[24] ELSADIG KARAR M G, KUHNERT N. UPLC-ESI-Q-TOF-MS/MS characterization of phenolics from crataegus monogyna and crataegus laevigata (Hawthorn) Leaves, fruits and their herbal derived drops (Crataegutt Tropfen)[J]. Journal of Chemical Biology & Therapeutics, 2015, 1: 1-23.
[25] PAPETTI A, MAIETTA M, CORANA F, et al. Polyphenolic profile of green/red spotted Italian Cichorium intybus salads by RP-HPLC-PDA-ESI-MSn[J]. Journal of Food Composition and Analysis, 2017, 63: 189-197.
[26] STEINGASS C B, GLOCK M P, SCHWEIGGERT R M, et al. Studies into the phenolic patterns of different tissues of pineapple (Ananas comosus [L.] Merr.) infructescence by HPLC-DAD-ESI-MS and GC-MS analysis[J]. Analytical and bioanalytical chemistry, 2015, 407(21): 6 463-6 479.
[27] BYSTROM L M, LEWIS B A, BROWN D L, et al. Characterization of phenolics by LC-UV/vis,LC-MS/MS and sugars by GC in Melicoccus bijugatus Jacq.'Montgomery' fruits [J]. Food chemistry, 2008, 111(4): 1 017-1 024.
[28] RAJAURIA G, FOLEY B, ABU-GHANNAM N. Identification and characterization of phenolic antioxidant compounds from brown Irish seaweed Himanthalia elongata using LC-DAD-ESI-MS/MS[J]. Innovative Food Science & Emerging Technologies, 2016, 37: 261-268.
[29] AHMAD-QASEM M H, BARRAJ N-CATAL
N-CATAL N E, MICOL V, et al. Influence of freezing and dehydration of olive leaves (var. Serrana) on extract composition and antioxidant potential[J]. Food Research International, 2013, 50(1): 189-196.
N E, MICOL V, et al. Influence of freezing and dehydration of olive leaves (var. Serrana) on extract composition and antioxidant potential[J]. Food Research International, 2013, 50(1): 189-196.
[30] KANG J, PRICE W E, ASHTON J, et al. Identification and characterization of phenolic compounds in hydromethanolic extracts of sorghum wholegrains by LC-ESI-MSn [J]. Food Chemistry, 2016, 211: 215-226.
[31] SANZ M, DE SIM N B F, CADAH
N B F, CADAH A E, et al. LC-DAD/ESI-MS/MS study of phenolic compounds in ash (Fraxinus excelsior L. and F. americana L.) heartwood.Effect of toasting intensity at cooperage[J]. Journal of Mass Spectrometry, 2012, 47(7): 905-918.
A E, et al. LC-DAD/ESI-MS/MS study of phenolic compounds in ash (Fraxinus excelsior L. and F. americana L.) heartwood.Effect of toasting intensity at cooperage[J]. Journal of Mass Spectrometry, 2012, 47(7): 905-918.
[32] LLORENT-MART NEZ E J, SP
NEZ E J, SP NOLA V, GOUVEIA S, et al. HPLC-ESI-MSn characterization of phenolic compounds,terpenoid saponins, and other minor compounds in Bituminaria bituminosa[J]. Industrial Crops and Products, 2015, 69: 80-90.
NOLA V, GOUVEIA S, et al. HPLC-ESI-MSn characterization of phenolic compounds,terpenoid saponins, and other minor compounds in Bituminaria bituminosa[J]. Industrial Crops and Products, 2015, 69: 80-90.
[33] HAN J, YE M, QIAO X, et al. Characterization of phenolic compounds in the Chinese herbal drug Artemisia annua by liquid chromatography coupled to electrospray ionization mass spectrometry[J]. Journal of Pharmaceutical and Biomedical Analysis, 2008, 47(3): 516-525.