冠突散囊菌发酵苦丁茶工艺研究
陈敏1,谢发1,游玲1,2,王涛1,2*
1(宜宾学院 生命科学与食品工程学院,四川 宜宾, 644000)2(固态发酵资源利用四川省重点实验室,宜宾学院,四川 宜宾, 644000)
摘 要 为开发苦丁茶新产品,将冠突散囊菌(Eurotium cristatum)接种至小叶苦丁茶(Ligustrum robustum)上,以菌丝生长量、菌丝球大小、孢子量为评价指标,优化了冠突散囊菌液体菌种制备参数(10%的接种量,CZG培养基,转速140 r/min,装液量250 mL/L);以菌丝覆盖度为主要指标,优化了发酵参数(苦丁茶含水质量分数30%,培养4 d的液体菌种,28~30 ℃,发酵10 d)。所制得的发酵产品表面遍布金黄色培养物,茶汤色黄亮,滋味醇和,苦味消失;挥发性物质变化显著,涉及多种物质的出现、消失及含量上的变动,尤其是甲基庚烯酮大幅度减少,柠檬醛、香叶醛在发酵至第10天时显著增加,持续发酵2 d后又大幅下降;桉叶油醇、芳樟醇在发酵至第12天时大量增加,同时4-羟基丁酸乙酰酯、水杨酸甲酯等酯类与桧烯等不饱和烃增多。该研究为苦丁茶新产品的开发提供了思路和方法。
关键词 苦丁茶;冠突散囊菌;发酵;挥发性物质;感官审评
DOI:10.13995/j.cnki.11-1802/ts.022491
引用格式:陈敏,谢发,游玲,等.冠突散囊菌发酵苦丁茶工艺研究[J].食品与发酵工业,2020,46(6):224-228.CHEN Min,XIE Fa,YOU Ling, et al. Fermentation of Ligustrum robustum by Eurotium cristatum[J].Food and Fermentation Industries,2020,46(6):224-228.
第一作者:本科生(王涛教授为通讯作者,E-mail:289615848@qq.com)
基金项目:宜宾市科技局计划项目(2018JY001);宜宾学院创新团队项目(2018ZRTD01)
收稿日期:2019-09-27,改回日期:2019-12-23
Fermentation of Ligustrum robustum by Eurotium cristatum
CHEN Min1,XIE Fa1,YOU Ling1,2, WANG Tao1,2*
1(College of Life Science and Food Engineering, Yibin University, Yibin 644000, China)2(Key Laboratory of Sichuan Province for the Utilization of Solid State Fermentation Resources, Yibin University, Yibin 644000, China)
ABSTRACT In order to develop new products of Ligustrum robustum, Eurotium cristatum was inoculated to L. robustum. Depending on the biomass of mycelium, diameter of mycelium-ball and the status of spore, CZG medium were selected to prepare the liquid spawn on optimized parameters of 10% inoculation, 140 r/min, and 25% capacity in 1 L conical flask. The tea made by L. robustum with 30% water was then inoculated by the liquid spawn cultured for 4 d, and incubated for 10 d at 28-30 ℃ when dense golden mycelium were observed in the substrate. The soup of the fermented tea appeared bright yellow and tasted mellow without bitterness. Significant changes were observed in volatile compounds, involving the emergence, disappearance and changes in the content of a variety of compounds. Especially, the methyl heptanone content significantly reduced; while citral and geranial content substantially increased at 10 d of fermentation and followed by a decline in the next 2 d. Eudesmol and linalool content increased at 12 d of fermentation. The content of 4-hydroxybutyrate, methyl salicylate, birchene and other volatile compounds also increased. The results provide a new perspective on the development of the tea of L. robustum.
Key words Ligustrum robustum; Eurotium cristatum; fermentation; volatile compound; sensory evaluation
冠突散囊菌(Eurotium cristatum)是主要存在于茯砖茶中的一种益生真菌,可产生金黄色闭囊壳,即“金花”[1],该菌是影响茯砖茶品质的重要因素,不仅可以降低茶的涩味,其菌花香及产生的色素都可增强茶的品质[2]。该菌的代谢产物具有降脂、抗肿瘤细胞活性、促消化等多种功效,菌丝体营养丰富且对人体无毒害[3-7],常见应用于黑茶[8]的发酵,目前也见中草药[9-10]、食品[11-12]发酵。
小叶苦丁茶是由木犀科女贞属粗壮女贞(Ligustrum robustum)的鲜叶经杀青、脱水解块、揉捻、粗烘、二次揉捻、干燥、精制而成,具有多种保健功能[13],本研究借鉴茯砖茶“散茶发花”[14]技术,通过接种冠突散囊菌发酵苦丁茶,赋予其“菌花香”,减少其苦味和粗青气,为苦丁茶新产品开发提供新思路。
1 材料与方法
1.1 材料
小叶苦丁茶,由四川省筠连县冬青御品科技有限公司提供。冠突散囊菌(CICC 2422),购于中国工业微生物保藏中心。CZG培养基(g/L):蔗糖40,NaCl 50,K2HPO4 1,NH3NO3 3,MgSO4·7H2O 0.5。
1.2 实验方法
1.2.1 液体菌种条件优化
以CZG液体培养基为基准培养基,装液量300 mL/L,28 ℃,120 r/min,培养5 d为基准条件,菌丝干重、菌丝球大小及有性孢子量为评估指标,对蔗糖质量分数(6%、4%、2%)、NaCl质量分数(6%、4%、2%)、pH(4.5、5.5、6.5)采用IBM SPSS Statistics19软件设计正交实验。菌丝干重计量方法、菌丝球大小测量方法分别参照文献[15-16],有性孢子评估方法为以肉眼评判菌液黄色深浅。
在优化后的CZG培养基(蔗糖60 g/L、NaCl 40 g/L、pH 6.5)中,以28 ℃、培养5 d为基础条件,评估指标同上,围绕转速(140、120、100 r/min)、接种量(12%、10%、8%)、装液量(300、250、200 mL/L)采用上述软件设计正交实验,优化培养条件。
1.2.2 冠突散囊菌发酵工艺
小叶苦丁茶中加入一定量的无菌水后,70 ℃汽蒸20 min,自然冷却后取100 g于1 L锥形瓶中,接种10 mL液体菌种,发酵12 d(前8 d 28 ℃,后4 d 30 ℃),70 ℃干燥90 min。肉眼评判的菌丝覆盖度为评估指标,单因子试验方法先后探究了接种菌龄、茶叶含水量(mL/g)对发酵的影响。菌龄设定分别为2、3、4、6、8、10 d(含水量为30%);含水量(质量分数)分别设定为20%、 25%、 30%、 35%。
1.2.3 挥发性物质检测
前处理:0.4 g原叶,发酵10、12 d的苦丁茶,0.6 g NaCl于20 mL顶空瓶中,加入2 mL沸蒸馏水密封。60 ℃水浴15 min,使用65 μm PDMS/DVB固相微萃取头顶空吸附60 min,230℃解析5 min进样,采用气相色谱-质谱联用仪(7890A-5975C,Agilent)检测其挥发性成分。
色谱柱条件:HP-5MS弹性石英毛细管柱(300 mm×0.25 mm×0.25 μm)分析样品挥发性成分,载气为高纯He,流速0.8 mL/min,柱温40 ℃,保持2 min,以2 ℃/min升至110 ℃,保持2 min,以3 ℃/min升温至170 ℃,保持2 min,以10 ℃/min升至260 ℃,保持5 min;进样温度300 ℃,接口温度250 ℃,离子源温度230 ℃,四级杆温度150 ℃;EI电子能量70 eV,扫描范围45~350 amu。
1.2.4 茶叶感官审评
组织12位经专业培训的人员,根据GB/T 23776—2018,采用轻松感官分析系统,对样品进行定量描述分析和成对偏爱调查。
2 结果与分析
2.1 液体菌种制备工艺优化
培养基成分含量和培养条件对冠突散囊菌生长的影响如表1和表2所示。
由表1可知,pH 6.5、蔗糖6%(质量分数)、NaCl 4%(质量分数)的条件下菌丝体生物量最高,菌液颜色最深,菌丝蓬松,菌丝球大小与其他组合差异不大。由于菌液黄色深浅是有性孢子数量的直观呈现[17],同时菌丝球大小影响菌种接种在物料上的分散度,从而影响发酵的均匀度,综合评估,确定该培养基组合为最佳,与其他研究者类似研究[17]结果相符。在pH 6.5的组合下,菌丝干重、菌液颜色的结果均优于其他组合,可见pH为菌丝体生物量和有性孢子量的主要影响因素。
由表2可知,组合2、4的条件下菌丝体生物量高,菌液颜色最深,菌丝球较小,菌丝状态与其他组合一致,但组合4装液量更少,确定组合2为最佳培养条件。9种组合中,转速相同时,装液量增加,菌丝球体积趋于增大;装液量相同时,转速增加,菌液颜色趋于加深,表明菌丝球大小、有性孢子量分别与装液量、转速呈一定的正相关关系。
表1 培养基成分对冠突散囊菌生长的影响
Table 1 The effects of medium composition on E. cristatum
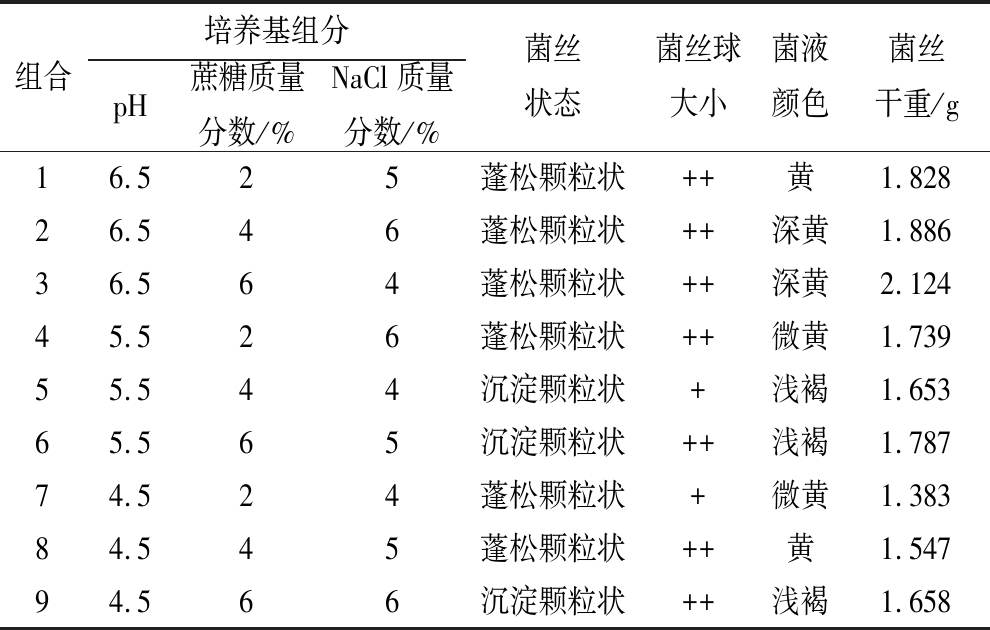
组合培养基组分pH蔗糖质量分数/%NaCl质量分数/%菌丝状态菌丝球大小菌液颜色菌丝干重/g16.525蓬松颗粒状++黄1.82826.546蓬松颗粒状++深黄1.88636.564蓬松颗粒状++深黄2.12445.526蓬松颗粒状++微黄1.73955.544沉淀颗粒状+浅褐1.65365.565沉淀颗粒状++浅褐1.78774.524蓬松颗粒状+微黄1.38384.545蓬松颗粒状++黄1.54794.566沉淀颗粒状++浅褐1.658
注:菌丝球大小,“+”表示直径约1 mm;“++”表示直径约2 mm;以此类推(下同)
表2 培养条件对冠突散囊菌生长的影响
Table 2 The effects ofculture conditions on E. cristatum
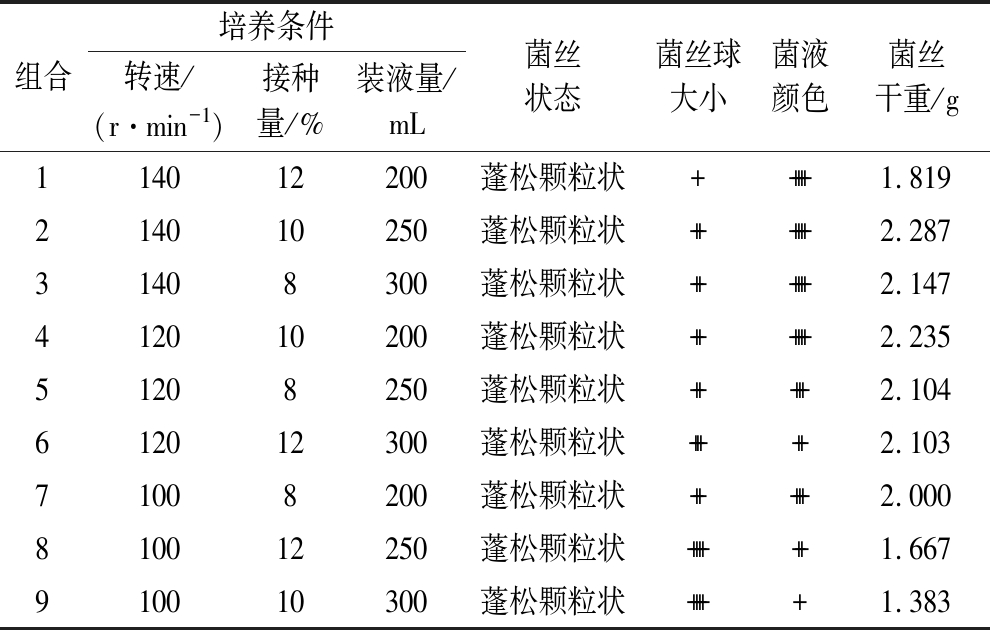
组合培养条件转速/(r·min-1)接种量/%装液量/mL菌丝状态菌丝球大小菌液颜色菌丝干重/g114012200蓬松颗粒状+++++1.819214010250蓬松颗粒状++++++2.28731408300蓬松颗粒状++++++2.147412010200蓬松颗粒状++++++2.23551208250蓬松颗粒状+++++2.104612012300蓬松颗粒状+++++2.10371008200蓬松颗粒状+++++2.000810012250蓬松颗粒状++++++1.667910010300蓬松颗粒状+++++1.383
注:菌液颜色“+”表示不变黄;“++”表示微黄;“+++”表示黄;“++++”表示深黄
2.2 发酵参数对冠突散囊菌培养物的影响
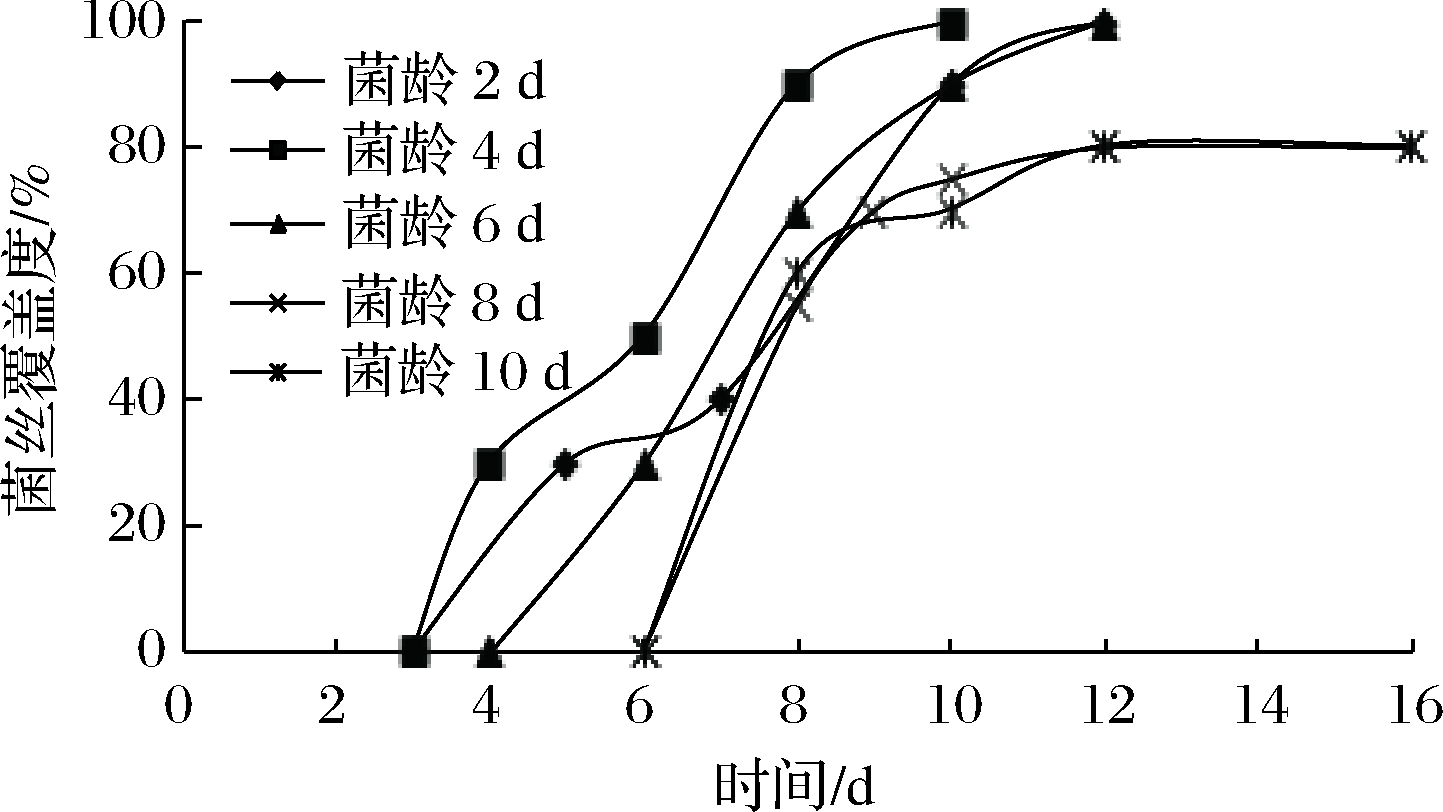
茶叶含水量和接种菌龄对冠突散囊菌菌丝生长的影响如图1和图2所示。
如图1所示,当含水质量分数为35%和30%时,延滞期最短,发酵4和8 d,菌丝覆盖度分别达到30%和80%以上,10 d即完全覆盖,周期最短。前者发酵4 d后,菌丝生长状况较后者略差,可确定30%含水质量分数为发酵最佳,低于茯砖茶发酵所需水分的10%[18],也进一步说明30%(质量分数)左右的水分条件已达到冠突散囊菌生长需求,水含量过高或过低都会影响其生长。从菌丝生长的各阶段来看,延滞期最长8 d,最短3 d;进入指数期后,菌丝覆盖速率在含水质量分数最佳(30%)与最低(20%)的条件下可分别达到30%/d和10%/d,后者最终不能完全覆盖,可见水分含量对发酵的整个阶段均有显著影响。
如图2所示,菌龄为4 d的菌种,接种后延滞期最短,发酵4和8 d,菌丝覆盖度分别达到30%和90%,10 d完全覆盖,周期最短。可确定接种菌龄4 d最佳。不同菌龄间延滞期相差最多4 d;菌龄8、10 d的菌种虽最终不能完全覆盖,但进入指数期后,其菌丝覆盖速率在6~8 d略高于短菌龄菌种,可见菌龄主要影响延滞期与发酵周期。
2.3 苦丁茶发酵过程中挥发性物质的变化
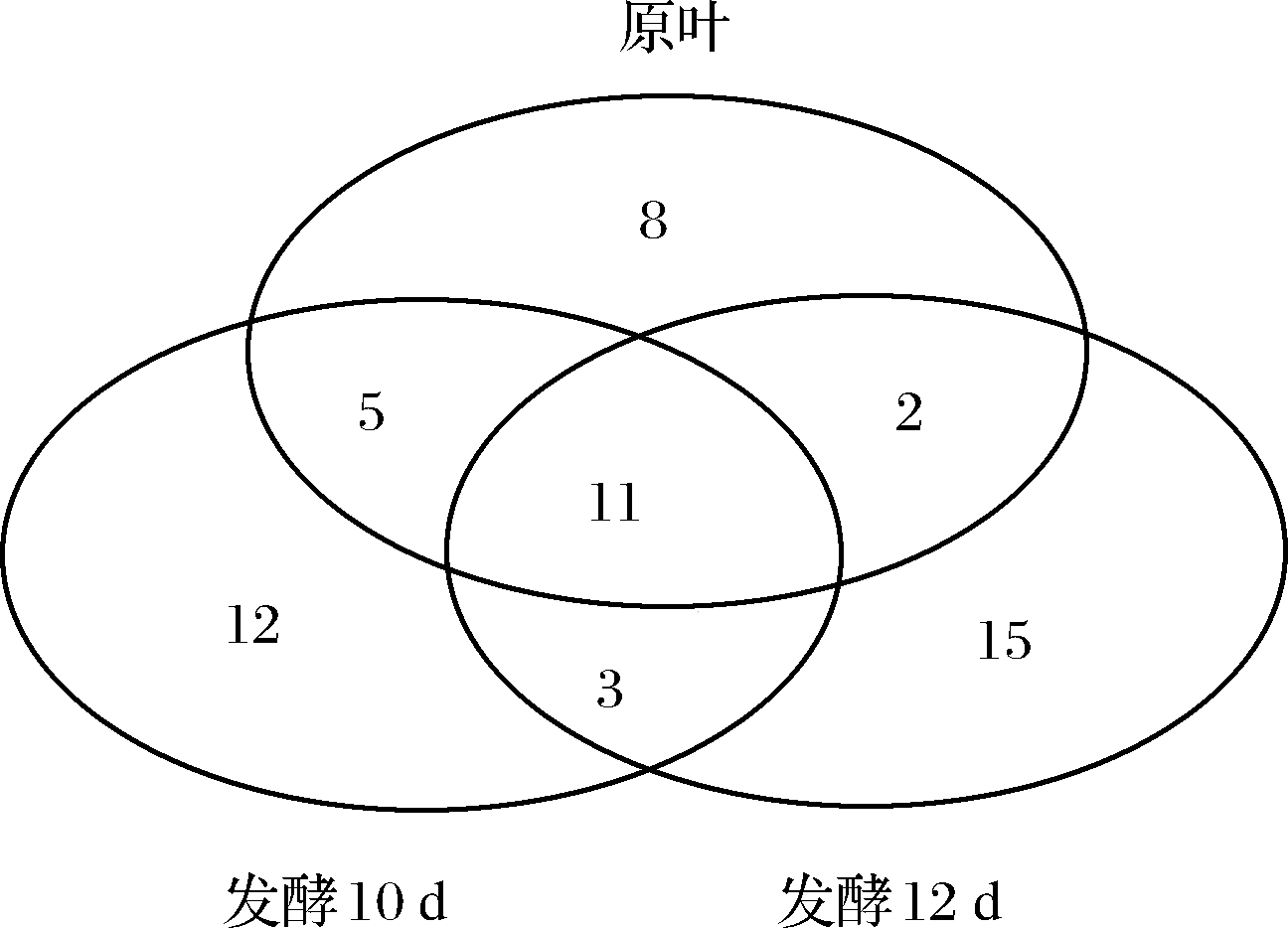
苦丁茶发酵过程中挥发性物质种类的变化如图3,表3~表5所示。
由图3可知,3个阶段的样品共检测出58种物质,其中苦丁茶原叶26种,发酵10 d的样品31种,发酵12 d的样品32种。3个样品共有相同物质11种(具体物质见表4),原叶中的8种物质消失(具体物质见表3);发酵10、12 d的样品分别新增15、18种物质,而且这些物质仅有3种在2阶段同时存在(具体物质见表4);反,顺-2,6-壬二烯醛、5-甲基呋喃醛、香叶基丙酮、1-乙酰环己烯、甲基庚烯酮5种物质在原叶、发酵10 d的样品中检出;萜品烯、2,4-二叔丁基苯酚2种物质在原叶、发酵12 d的样品中检出。说明苦丁茶接种“金花”菌发酵及发酵的过程中挥发性物质发生了复杂而显著的变化。
表3 原叶中消失的物质
Table 3 Substance disappeared from the original leaves

序号成分CAS 序号相对含量/%1邻伞花烃000527-84-42.032马鞭草烯酮001196-01-61.6233,5,5-三甲基 - 2-环戊烯-1-酮024156-95-41.174α-蒎烯007785-70-80.5652,3-二氢-2-甲氧苯并呋喃001746-11-80.4563-乙烯-1,2-二甲基-1,4-环己二烯062338-57-20.187十五烷000629-62-90.178α-异松油烯000586-63-00.13
由表4可知,发酵10和12 d新增两阶段新增物质交叉少、基数小、种类多,而且仅分别有3、4种物质从茯砖茶中被检出[19-23],表明随着发酵的进行,物质变化在持续,物质成分与茯砖茶有较大的差异。
由表5可知,发酵10 d的样品中柠檬醛、香叶醛为含量最多的2种物质,占到了54.05%,相对苦丁茶原叶共增加了24.45%,但在发酵12 d的样品中含量则下降为12.55%。发酵12 d的样品中桉叶油醇、芳樟醇含量最多,占到了45.21%,相对原叶和发酵10 d的样品分别共增加了22.34%和37.91%。这些显示不同发酵阶段样品中挥发性主体物质也发生了巨大的变化。
芳樟醇和癸醛是所有物质中随着发酵的进行其含量持续上升的物质,其中芳樟醇的变化趋势与在茯茶发酵研究[19]的结果是一致的。甲基庚烯酮在原叶中含量高(7.97%),在发酵10 d的样品中仅为0.93%。从芳樟醇、甲基庚烯酮变化规律来看,这2种物质具备成为生产监控指标物质的可能性,但需进一步验证。
表4 发酵10、12 d新增物质
Table 4 New substances for 10、12 d fermentation
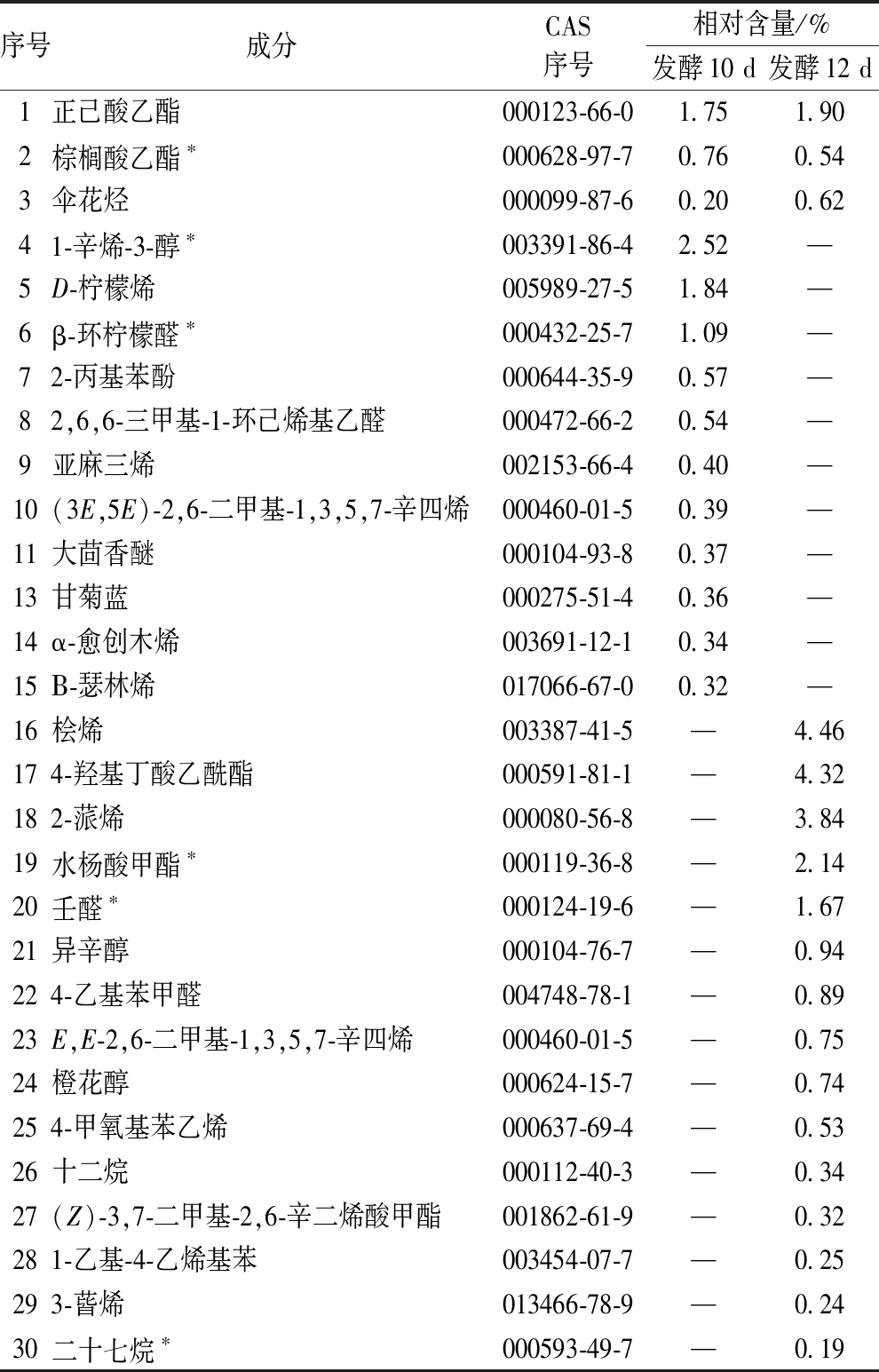
序号成分CAS序号相对含量/%发酵10 d发酵12 d1正己酸乙酯000123-66-01.751.902棕榈酸乙酯∗000628-97-70.760.543伞花烃000099-87-60.200.6241-辛烯-3-醇∗003391-86-42.52—5D-柠檬烯005989-27-51.84—6β-环柠檬醛∗000432-25-71.09—72-丙基苯酚000644-35-90.57—82,6,6-三甲基-1-环己烯基乙醛000472-66-20.54—9亚麻三烯002153-66-40.40—10(3E,5E)-2,6-二甲基-1,3,5,7-辛四烯000460-01-50.39—11大茴香醚000104-93-80.37—13甘菊蓝000275-51-40.36—14α-愈创木烯003691-12-10.34—15Β-瑟林烯017066-67-00.32—16桧烯003387-41-5—4.46174-羟基丁酸乙酰酯000591-81-1—4.32182-蒎烯000080-56-8—3.8419水杨酸甲酯∗000119-36-8—2.1420壬醛∗000124-19-6—1.6721异辛醇000104-76-7—0.94224-乙基苯甲醛004748-78-1—0.8923E,E-2,6-二甲基-1,3,5,7-辛四烯000460-01-5—0.7524橙花醇000624-15-7—0.74254-甲氧基苯乙烯000637-69-4—0.5326十二烷000112-40-3—0.3427(Z)-3,7-二甲基-2,6-辛二烯酸甲酯001862-61-9—0.32281-乙基-4-乙烯基苯003454-07-7—0.25293-蒈烯013466-78-9—0.2430二十七烷∗000593-49-7—0.19
注:—表示未检测到相应物质;*表示茯砖茶中检出物质
表5 三个样品中相同的挥发性物质
Table 5 The same volatiles in the three samples.
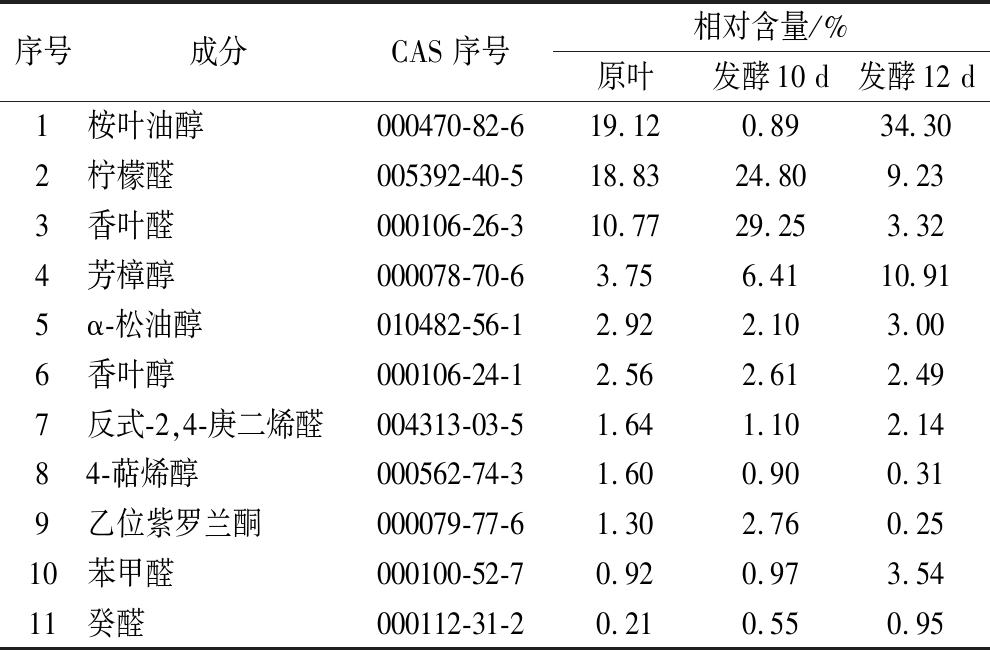
序号成分CAS 序号相对含量/%原叶发酵10 d发酵12 d1桉叶油醇000470-82-619.120.8934.302柠檬醛005392-40-518.8324.809.233香叶醛000106-26-310.7729.253.324芳樟醇000078-70-63.756.4110.915α-松油醇010482-56-12.922.103.006香叶醇000106-24-12.562.612.497反式-2,4-庚二烯醛004313-03-51.641.102.1484-萜烯醇000562-74-31.600.900.319乙位紫罗兰酮000079-77-61.302.760.2510苯甲醛000100-52-70.920.973.5411癸醛000112-31-20.210.550.95
此外,发酵10、12 d的苦丁茶所呈现出的物质差异和感官特征差异均较明显,综合前述物质比较分析,发酵10 d可作为一个发酵节点,但还需结合茶汤感官特征、菌体色泽、生产周期确定发酵周期。
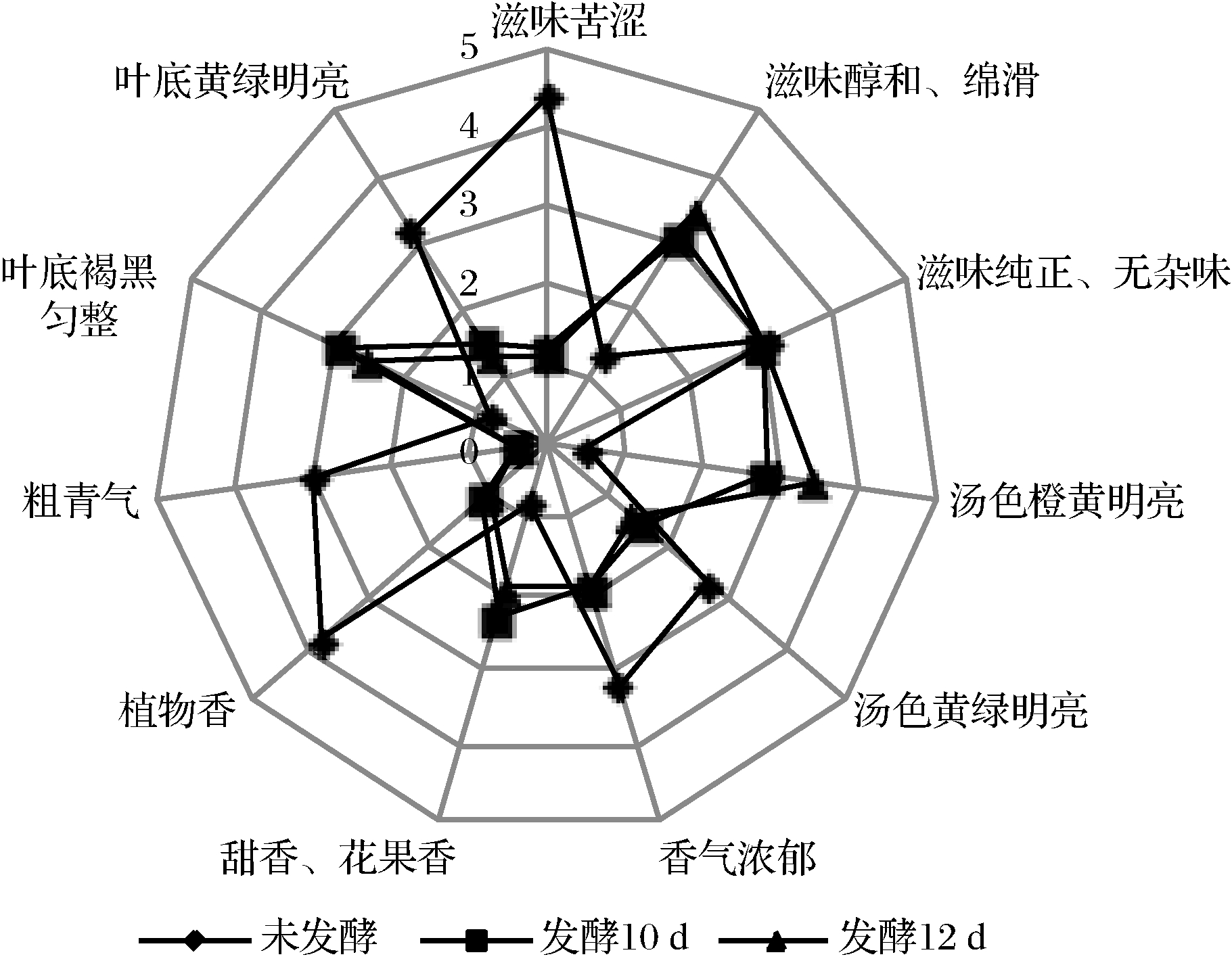
2.4 发酵苦丁茶的感官评价
发酵后苦丁茶表面遍布金黄色培养物。从感官评价雷达图(图4)可知,发酵10 d后,感官风味变化明显,茶汤苦味消失,粗青气、植物香显著下降,有菌香和淡淡的甜香,汤色橙黄明亮,滋味醇和,有绵滑感;继续发酵2 d(发酵12 d),茶汤感官变化不大。同时,75%的人更喜欢发酵后的苦丁茶。
综合发酵参数、感官特征和生产效率,确定优化后的工艺为蔗糖质量分数6%、NaCl质量分数4%、pH 6.5的CZG培养基(装液量1/4),140 r/min、28 ℃振荡培养制备冠突散囊菌液体菌种,培养4 d后接种到70 ℃汽蒸20 min灭菌后的苦丁茶中,调整含水量为30%,28 ℃发酵8 d后升温至30 ℃,继续发酵2 d,70 ℃烘90 min。
3 结论
本文首次将冠突散囊菌应用于苦丁茶发酵,发酵工艺与茯砖茶相比,时间更短,工艺更简洁[24];而物料含水量、发酵温度等发酵参数差异不大[14],在一定程度上与茯砖茶发酵的实际工艺研究相吻合。
苦丁茶接种“金花”菌发酵后,感官特征明显改善;发酵过程中,挥发性物质持续变化,尤其是挥发性主体物质大幅度改变,酮类物质减少,酯类物质持续增加。
参考文献
[1] 杨抚林,邓放明,赵玲艳,等.茯砖茶发花过程中优势菌的研究进展[J].茶叶科学技术,2005(1):4-7.
[2] 王亚丽,秦俊哲,黄亚亚,等.冠突散囊菌对茯砖茶品质形成的影响[J].食品与发酵工业,2018,44(4):194-197.
[3] 丁婷,吕嘉枥.茯砖茶中“金花”菌的研究进展[J].食品工业科技,2012,33(1):419-420;425.
[4] 邓放明,龚淑莉,杨伟丽.冠突散囊菌胞外多糖生物活性高通量筛选试验[J].食品与机械,2007,23(6):48-51;113.
[5] 杨抚林.冠突散囊菌液体发酵工艺及其发酵液对消化酶活性影响的研究[D].长沙:湖南农业大学,2005.
[6] 刘作易,秦京.“金花”菌与茯砖茶品质[J].贵州农学院学报,1991(1):79-82.
[7] 刘子音.“金花”菌纯培养物的安全性评价研究[D].长沙:湖南农业大学,2011.
[8] 吴凯为,杨立娜,朱力杰,等.冠突散囊菌在发酵茶中应用的研究进展[J].食品研究与开发,2018,39(1):189-193.
[9] 吴凯为.冠突散囊菌发酵刺五加茶的制备及品质分析[D].大连:渤海大学,2019.
[10] 杨立娜,吴凯为,徐清莹,等.冠突散囊菌发酵对荔枝草茶主要成分及风味的影响[J].食品与发酵工业,2019,45(13):121-125.
[11] 兰晓勇,刘素纯,李再贵.冠突散囊菌不同发酵条件对苦荞蛋白质的影响[J].中国酿造,2019,38(10):72-76.
[12] 唐梓尧,刘素纯,林辉,等.冠突散囊菌发酵制备燕麦面酱工艺研究[J].中国酿造,2019,38(2):117-121.
[13] 易帆,彭勇,许利嘉,等.小叶苦丁茶的研究进展[J].中国现代中药,2013,15(10):906-912.
[14] 贾洪信,刘素纯,黄建安,等.影响散茶发花主要因素探讨[J].安徽农业科学,2010,38(14):7 541-7 543.
[15] 陈博文,李贞蓉,常明昌,等.香菇产α-半乳糖苷酶的液体发酵工艺优化[J].食用菌学报,2018,25(2):79-89.
[16] 李秋阳,雷于国,胡国元,等.香菇摇瓶补料分批发酵的研究[J].化学与生物工程,2018,35(3):41-44.
[17] 郑欣欣.茯砖茶中“金花”菌产孢机制及其功能性研究[D].西安:陕西科技大学,2015.
[18] 张锐.散茶发花工艺研究及其主要功效成分分析[D].西安:陕西科技大学,2016.
[19] 何红霞,金莉莎.茯茶“散茶发花”过程香气成分的变化[J].茶叶通讯,2012,39(1):15-19.
[20] 张亚,李卫芳,肖斌.25个湖南、陕西茯砖茶样品挥发性成分的HS-SPME-GC-MS分析[J].西北农林科技大学学报(自然科学版),2017,45(2):151-160.
[21] 沈程文,邓岳朝,周跃斌,等.湖南茯砖茶品质特征及其香气组分研究[J].茶叶科学,2017,37(1):38-48.
[22] 赵仁亮,吴丹,姜依何,等.不同产地黑毛茶加工的茯砖茶香气成分和品质分析[J].湖南农业大学学报(自然科学版),2017,43(5):551-555.
[23] 赵仁亮,胥伟,吴丹,等.黑毛茶不同产区发花对茯砖茶品质的影响[J].食品科学,2017,38(21):8-14.
[24] 钟晓雪. 四川黑砖茶和茯砖茶的加工技术及品质评价[D].雅安:四川农业大学,2017.