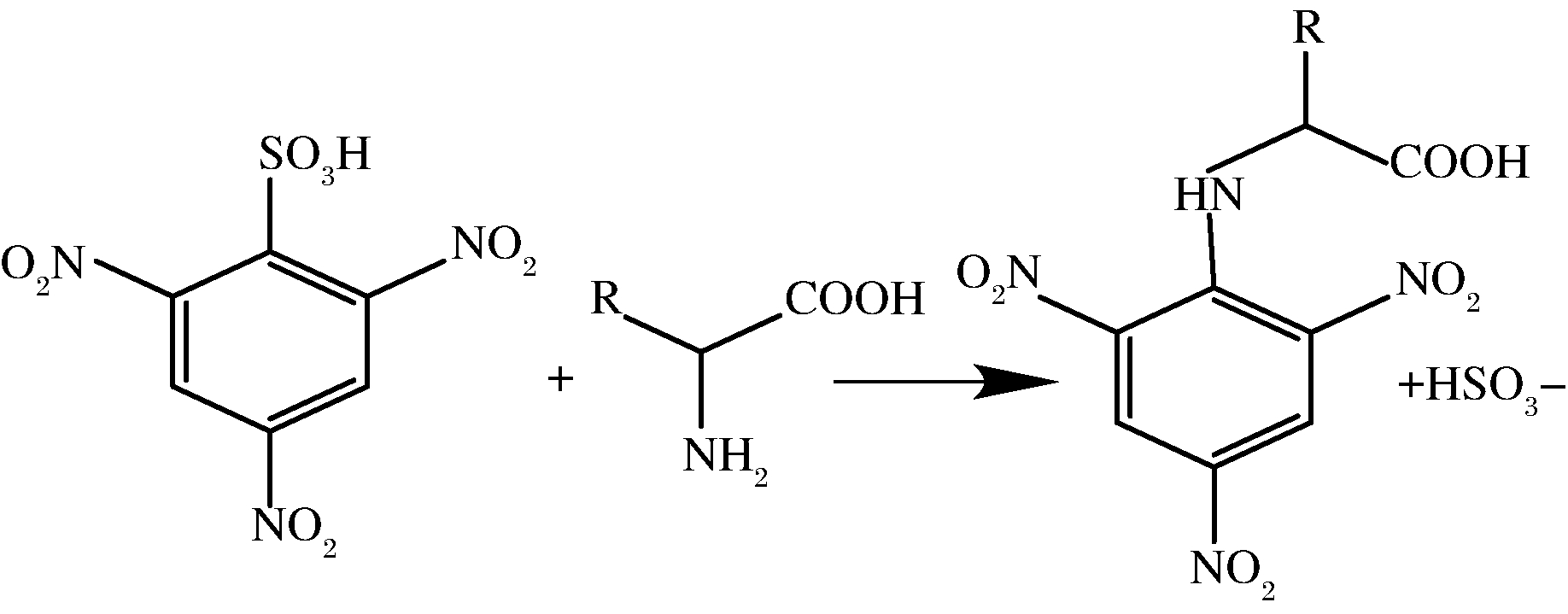
图1 TNBS与游离氨基的反应
Fig.1 Reaction of TNBS with free amino groups
食品是一个复杂的混合体系,蛋白质可以与其他食物成分形成复合物,导致其结构、功能和营养特性的变化。通过分析蛋白质游离氨基、巯基、二硫键、表面疏水性等指标的变化可以评价蛋白质与其他物质发生的反应[1-3]。其中蛋白质的游离氨基含量可采用茚三酮法[4]、三硝基苯磺酸 (trinitrobrnzen sulfonic acid,TNBS) 法[5]、邻苯二甲醛 (O-phthaladehyde,OPA) 法[6]、高效液相色谱法[7]等方法进行分析。其中TNBS法因其灵敏度高、操作方便应用最为广泛,本文针对TNBS法进行探讨。
TNBS法是基于伯氨基与TNBS的定量反应,通过TNBS与伯胺在弱碱性条件下反应形成具有发色团的中间络合物(图1),中间络合物在355 nm和420 nm附近有最大吸收值。蛋白质中的巯基含量会影响TNBS法结果的准确性[8],因为巯基基团会和TNBS发生反应。TNBS法应用最广泛的是测定蛋白质水解物中游离氨基的含量[9-12]。近年来有些学者也用此方法,通过分析蛋白质游离氨基的变化研究小分子物质与蛋白质反应的机理[13-16]。以上研究中,终止反应的方法部分采用加入盐酸,也有加入亚硫酸氢钠,但未见文献对这2种终止反应的方法进行比较和探讨。因此本文在采用TNBS法时,在分析较优的反应条件基础上,选择巯基含量不同的蛋白质(牛血清蛋白、溶菌酶、胰蛋白酶),用紫外-可见分光光度计和酶标仪比较分析蛋白质游离氨基含量的准确性和灵敏性,并讨论了它们的优势和不足。同时,探讨了蛋白质中的巯基含量对分析结果的影响,以期为采用TNBS法评价蛋白质游离氨基含量的变化提供参考。

图1 TNBS与游离氨基的反应
Fig.1 Reaction of TNBS with free amino groups
牛血清蛋白(BSA),上海美伦生物科技有限公司;溶菌酶,上海生物工程股份有限公司;胰蛋白酶,国药集团化学试剂有限公司;TNBS,Sigma;L-亮氨酸,国药集团化学试剂有限公司;盐酸、NaH2PO4·2H2O、Na2HPO4·12H2O、NaHSO3等,均为分析纯。
UV1102紫外分光光度计,上海谱元仪器有限公司;SH-1000 Lab连续光波可调全波长酶标仪,广州济恒生物科技有限公司;96孔酶标板,上海康宁有限公司;HH-4数显恒温水浴锅,深圳市超杰生物科技有限公司。
1.2.1 TNBS与游离氨基的反应
1.2.1.1 酸性条件下终止反应
紫外-可见分光光度计测定:参照ADLER-NISSE[5]的方法,略有改动。取待测溶液125 μL,加入1 mL pH 8.2的缓冲溶液及1 mL 0.1% TNBS,将混合好的样品置于50 ℃的暗处摇匀1 h。将样品取出后加入2 mL HCl,至于暗处,30 min后于最大吸收波长下测吸光值。
酶标仪测定:分析步骤同分光光度计,在测定体系中样品用量以及反应底物均缩减为紫外-可见分光光度计测定的10倍。用石英96孔酶标板进行测定。
1.2.1.2 碱性条件下终止反应
紫外-可见分光光度计测定:参照CROWELL[8]的方法,略有改动。取待测溶液125 μL,加入1 mL pH 8.2的缓冲溶液及1 mL 0.1% TNBS,将混合好的样品置于50 ℃的暗处摇匀1 h。将样品取出后加入2 mL NaHSO3,至于暗处,30 min后于最大吸收波长下测吸光值。
酶标仪测定:分析步骤同分光光度计,在测定体系中样品用量以及反应底物均缩减为紫外-可见分光光度计测定的10倍。用96孔酶标板进行测定。
1.2.2 测定波长的选择
酸性条件:准确配制0.5 mmol/L的L-亮氨酸,分析步骤同1.2.1.1。以超纯水作对照进行基线扫描,在200~400 nm波长扫描,确定反应产物的最大吸收波长。
碱性条件:准确配制0.5 mmol/L的L-亮氨酸,分析步骤同1.2.1.2。以超纯水作对照进行基线扫描,在400~600 nm波长扫描,确定反应产物的最大吸收波长。
1.2.3 标准曲线的绘制
以L-亮氨酸为游离氨基底物,做标准曲线,方法同1.2.1。比较不同条件下得到的标准曲线,选择TNBS与游离氨基反应的最优条件。
1.2.4 三种蛋白质游离氨基含量的分析
准确配制不同浓度的牛血清蛋白、溶菌酶、胰蛋白酶的水溶液,在最优条件下测定游离氨基含量,测定方法同1.2.1。
1.2.5 统计与分析
本文实验所有样品均为3组平行。作图采用Origin Pro 9.1软件,采用SPSS statistic 22.0进行方差分析。
由图2可知,TNBS与0.5 mmol/L L-亮氨酸在酸性条件终止反应得到的反应产物在340 nm处有最大吸收波长,结果与SATAKE等[17]得到的一致;在碱性条件终止反应得到的反应产物的最大吸收波长为420 nm,(图3),结果与FIELDS[18]的描述一致。
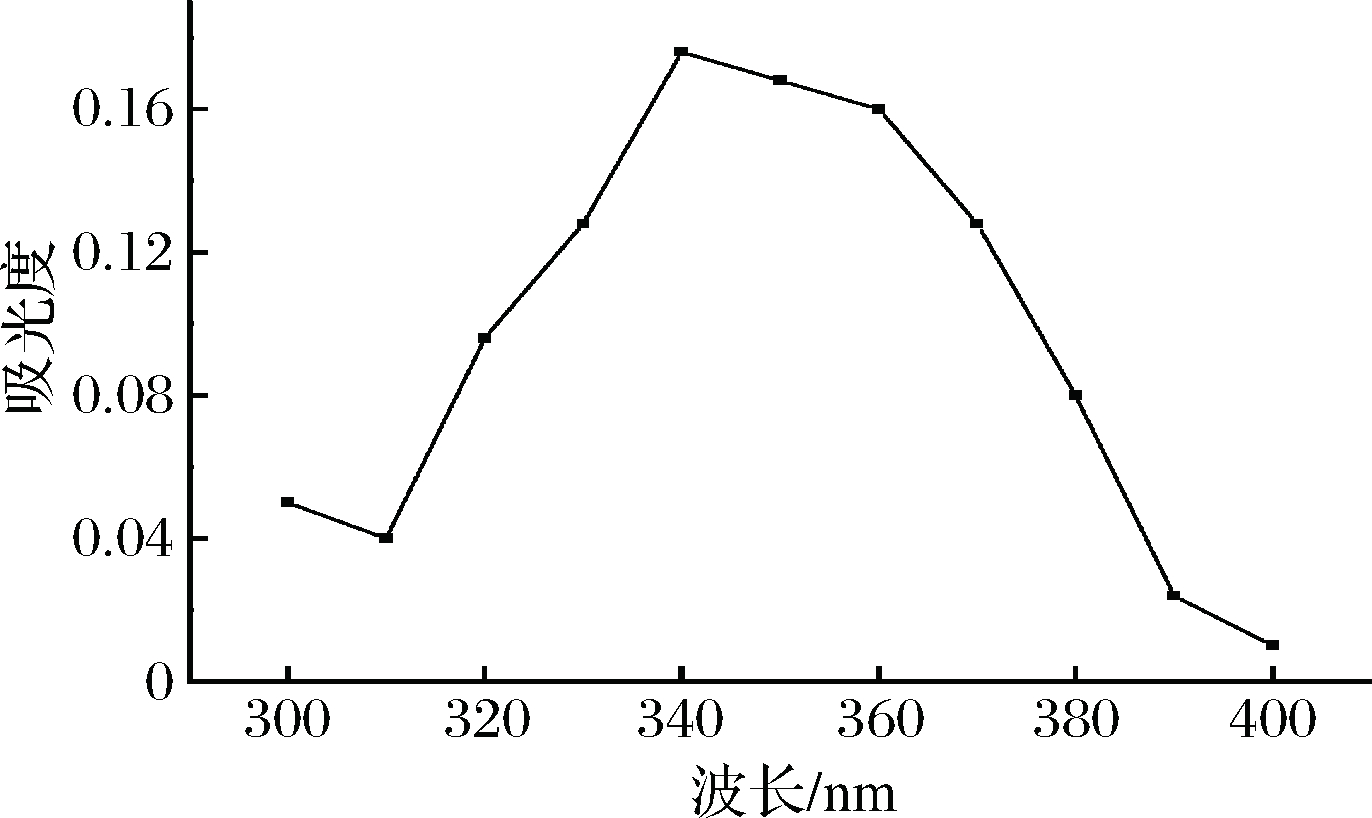
图2 TNBS与L-亮氨酸在酸性条件下反应产物的波长扫描
Fig.2 Wavelength scanning of reaction products of TNBS and L-leucine under acidic conditions
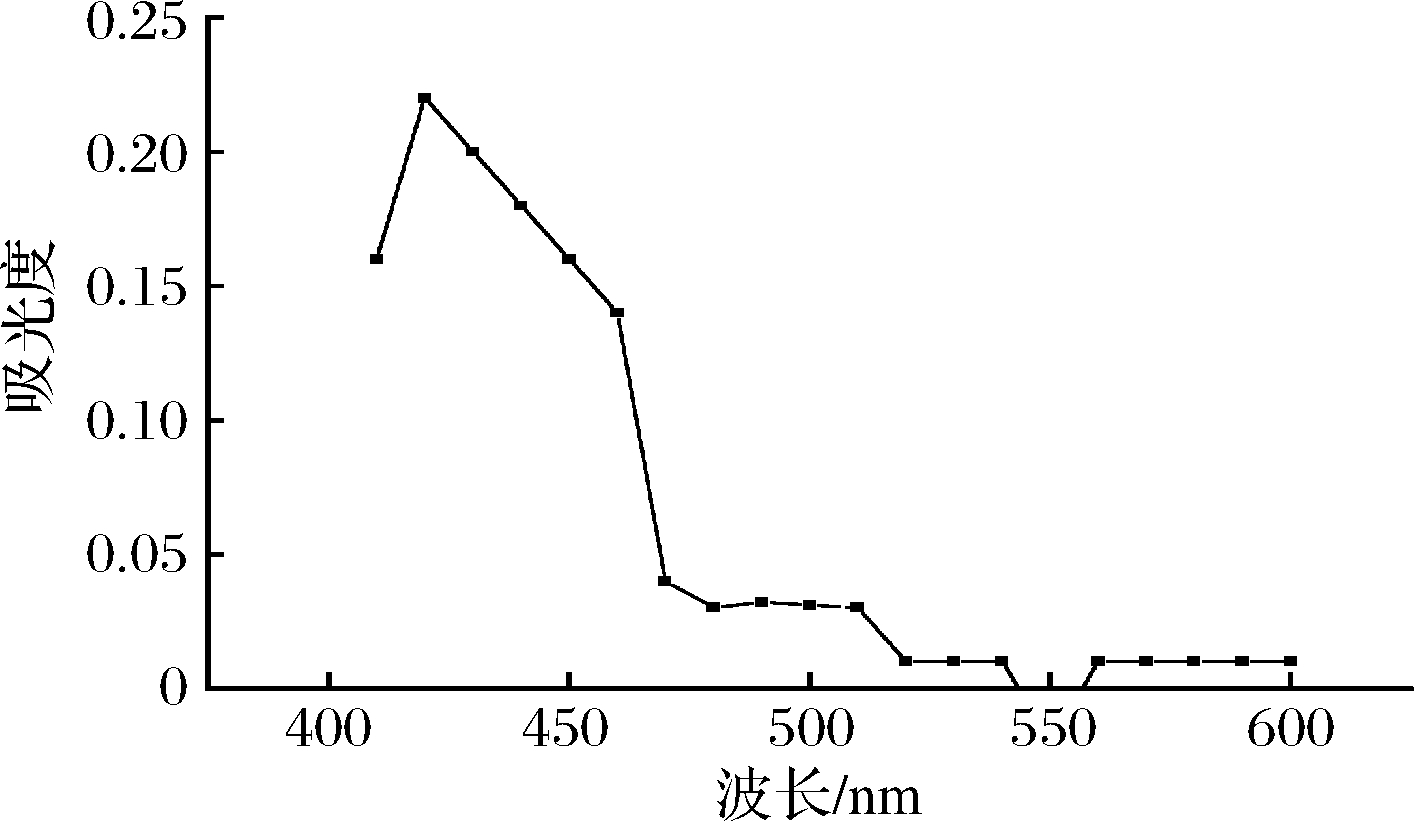
图3 TNBS与L-亮氨酸在碱性条件下反应产物的波长扫描
Fig.3 Wavelength scanning of reaction products of TNBS and L-leucine under alkaline conditions
图4、图5为酸性与碱性反应条件下分别采用紫外-可见分光光度计和酶标仪所获得的L-亮氨酸标准曲线。不论是采用紫外-可见分光光度计还是酶标仪进行测定,同一浓度L-亮氨酸在碱性条件下得到的吸光度值都高于酸性条件。采用紫外-可见分光光度计测定时,各浓度L-亮氨酸在碱性条件下所得到的吸光度值比酸性条件的高0.03~0.04;采用酶标仪时,碱性比酸性条件下吸光度值高0.03。说明此反应在碱性条件下有更高的响应。特别是在L-亮氨酸浓度很低时(0.1 mmol/L),2种仪器测得的酸性条件下的吸光度值很低。因而碱性条件更适合作为TNBS法的终止方式,特别是在样品浓度较低的情况下。因此在测定蛋白质游离氨基含量时我们选择在碱性条件下终止反应。
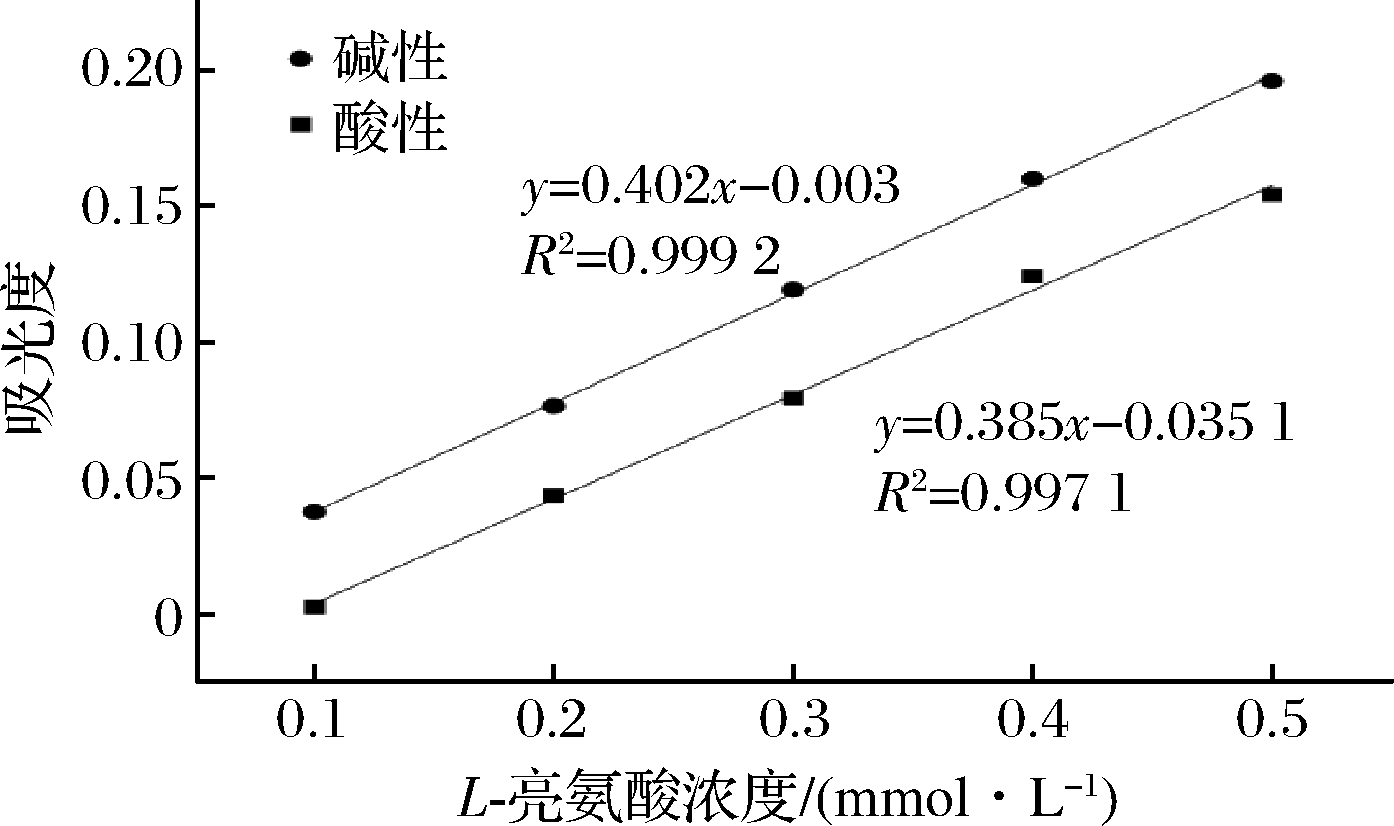
图4 紫外-可见分光光度计酸性与碱性条件下标准曲线的比较
Fig.4 Comparison of the standard curve under acidic and alkaline conditions using an ultraviolet-visible spectrophotometer
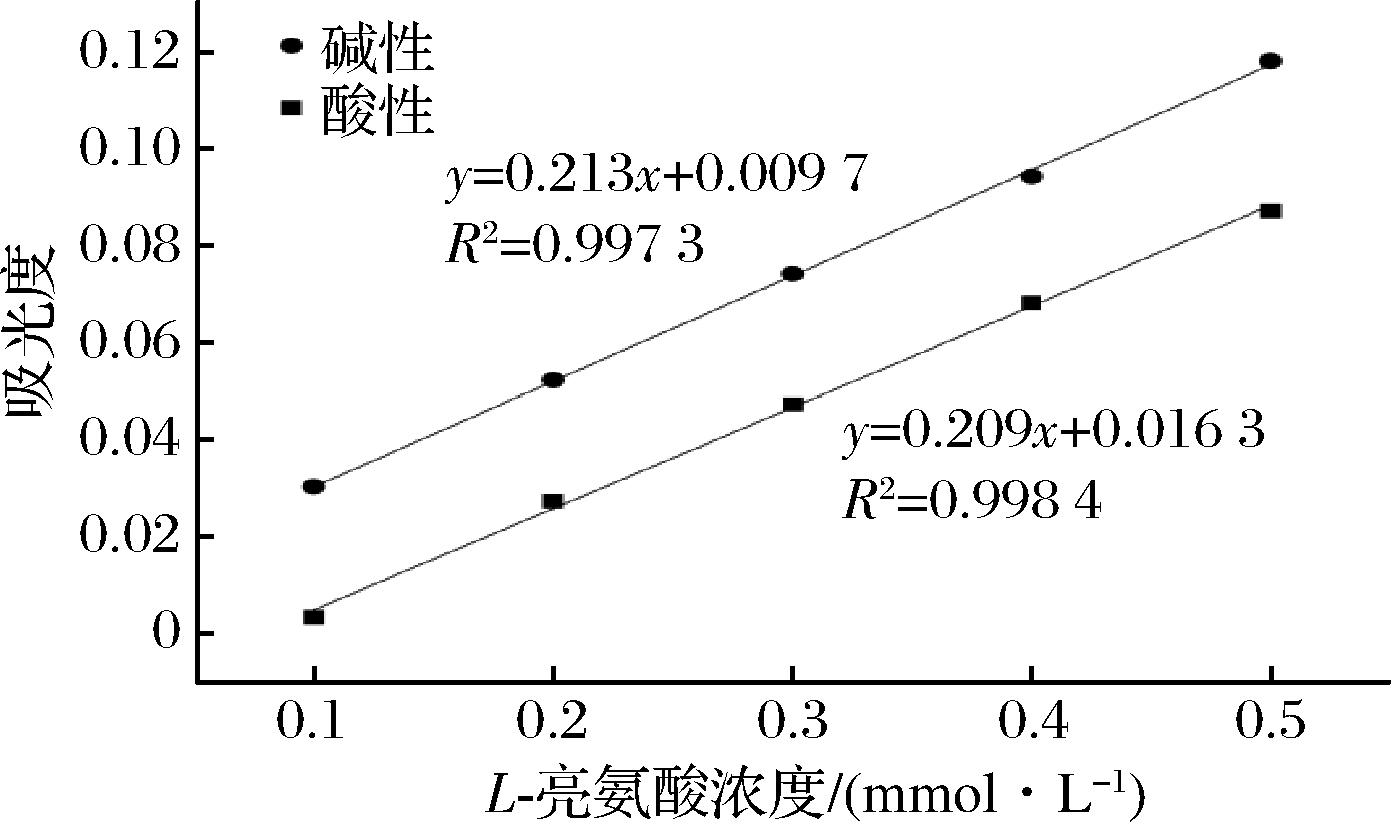
图5 酶标仪酸性与碱性条件下标准曲线的比较
Fig.5 Comparison of standard curves under acidic and alkaline conditions using a microplate reader
图6为碱性反应条件下紫外-可见分光光度计和酶标仪所得标准曲线的比较。紫外-可见分光光度计所得到的标准曲线的斜率明显高于酶标仪(P<0.01),说明紫外-可见分光光度计测得的吸光度值对浓度的敏感程度高于酶标仪,底物浓度即使变化较小,紫外-可见分光光度计所得数据的变化较酶标仪更明显。范鹏等[19]采用紫外分光光度计与酶标仪测定盐酸川芎嗪含量时发现紫外标准曲线的斜率也高于酶标仪,与本文得到的结果一致。因此,在测定浓度变化较小的样品的游离氨基含量时,可以优先考虑采用紫外-可见分光光度计进行分析。
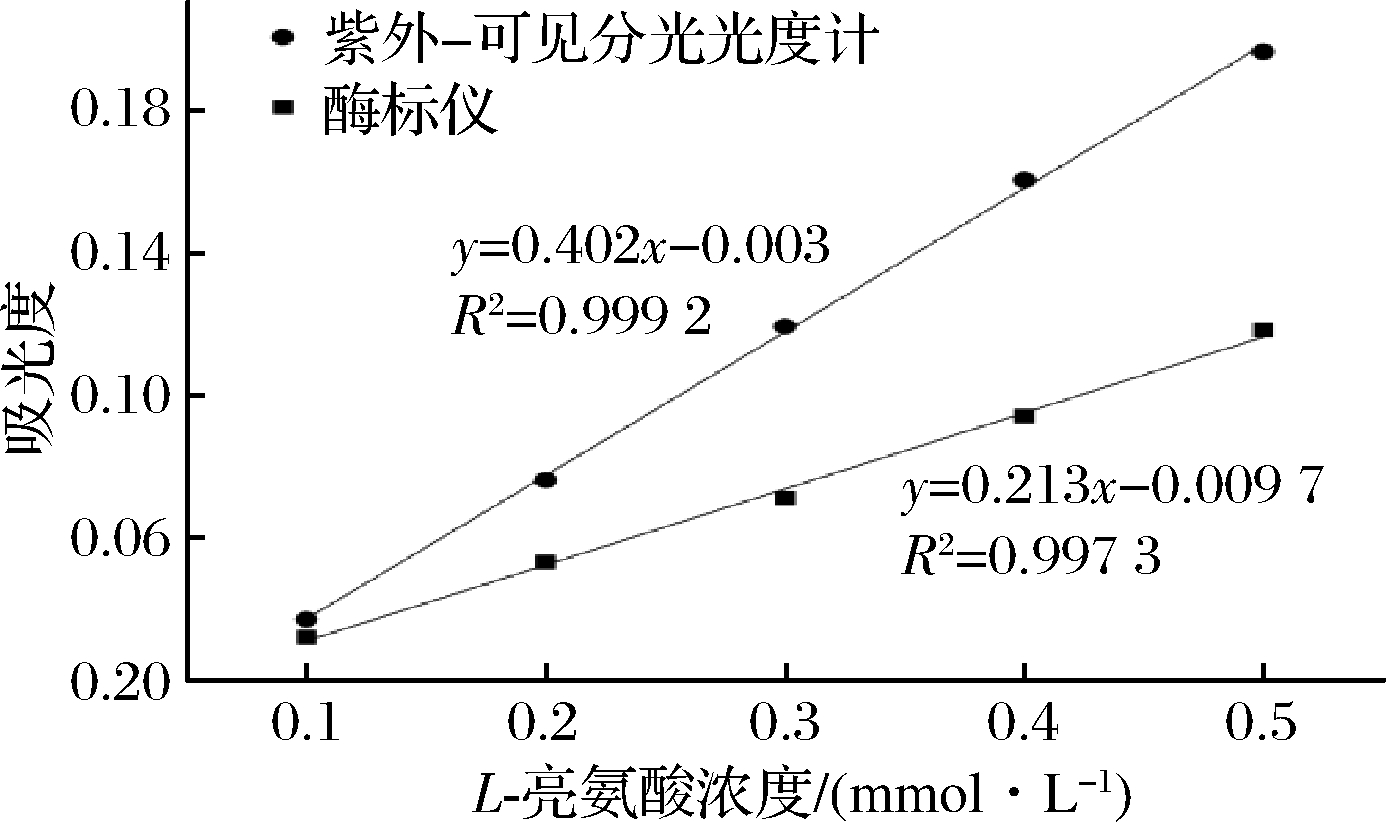
图6 碱性条件下紫外-可见分光光度计与酶标仪标准曲线的对比
Fig.6 Comparison of the standard curve under alkaline conditions with an ultraviolet-visible spectrophotometer and a microplate reader
综上所述,通过不同条件下标准曲线的比较可知,TNBS法测定游离氨基含量时,选择在碱性条件下终止反应,采用紫外-可见分光光度计测定是较优的方法。
选择在碱性反应条件下,利用紫外-可见分光光度计和酶标仪,测定不同浓度牛血清蛋白、胰蛋白酶、溶菌酶的游离氨基含量,并对分析结果进行比较。
2种仪器测得的牛血清蛋白、胰蛋白酶、溶菌酶的游离氨基含量都随浓度的增加而增加(表1)。在0.02 mmol/L下,2种仪器测得的牛血清蛋白、胰蛋白酶游离氨基含量差异显著(P<0.05),其他浓度下差异不显著(P>0.05)。在0.1 mmol/L下,2种仪器测得的溶菌酶游离氨基含量差异显著(P<0.05),其他浓度下差异性不显著(P>0.05)。当样品浓度较低时,由于仪器检出限的不同,会出现差异性。肖婷等[20]等采用紫外分光光度计比色法与酶标仪微量法比较了菜青虫Pieris rapae(L.)体内酚氧化酶蛋白含量和活力,发现微量法和比色法在检测酚氧化酶(phenoloxidase,PO)蛋白含量、酶活力和抑制剂对PO抑制作用时结果无显著性差异。此外,由标准差可以看出,紫外-可见分光光度法的变异程度较酶标仪较小,说明误差较小;由标准误可以看出,紫外-可见分光光度法的精确度较酶标仪高。因此,紫外-可见分光光度计与酶标仪都可用于游离氨基含量测定,综合二者的优缺点并且根据实验条件和样品性质选择合适的方法进行测定。
表1 两种方法测定不同浓度蛋白质游离氨基含量的比较
Table 1 Comparison of two methods for determination of free amino groups in different concentrations of proteins
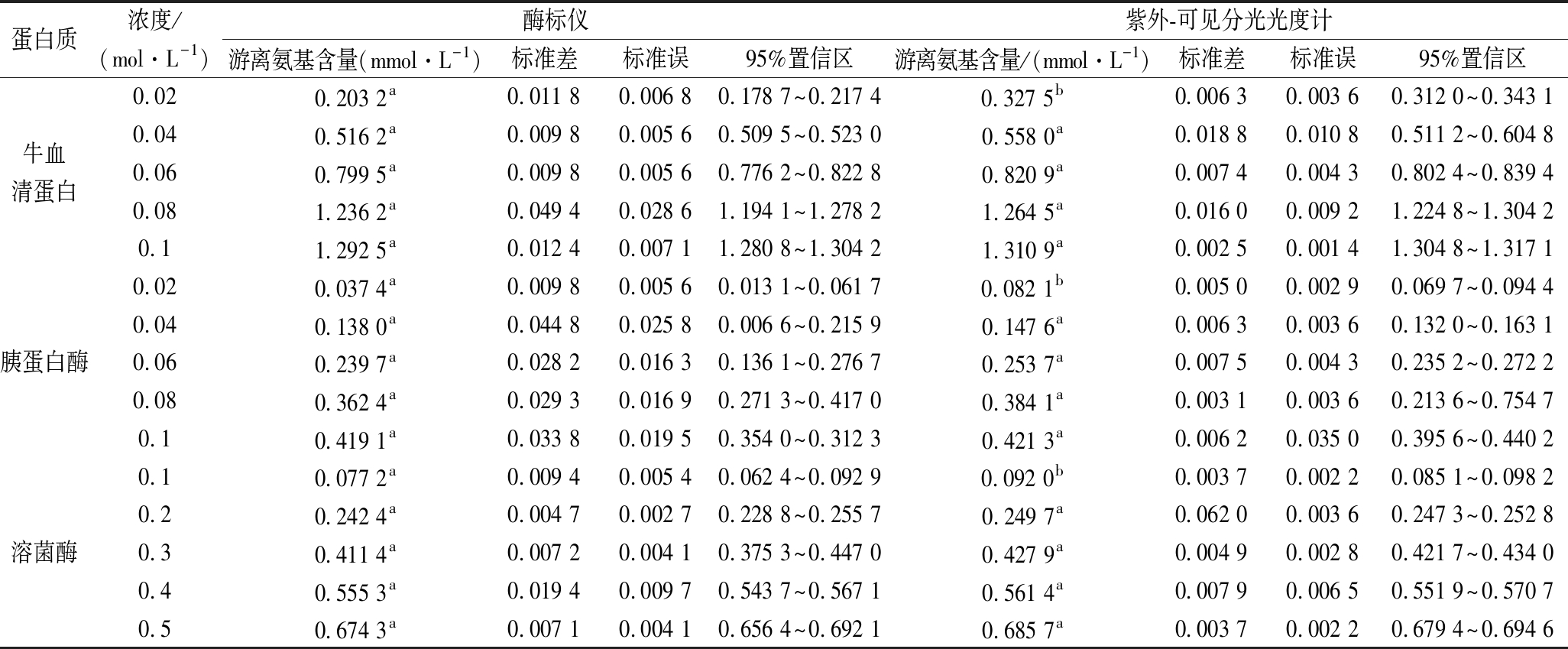
蛋白质浓度/(mol·L-1)酶标仪紫外-可见分光光度计游离氨基含量(mmol·L-1)标准差标准误95%置信区游离氨基含量/(mmol·L-1)标准差标准误95%置信区0.020.203 2a0.011 80.006 80.178 7~0.217 40.327 5b0.006 30.003 60.312 0~0.343 1牛血0.040.516 2a0.009 80.005 60.509 5~0.523 00.558 0a0.018 80.010 80.511 2~0.604 8清蛋白0.060.799 5a0.009 80.005 60.776 2~0.822 80.820 9a0.007 40.004 30.802 4~0.839 40.081.236 2a0.049 40.028 61.194 1~1.278 21.264 5a0.016 00.009 21.224 8~1.304 20.11.292 5a0.012 40.007 11.280 8~1.304 21.310 9a0.002 50.001 41.304 8~1.317 10.020.037 4a0.009 80.005 60.013 1~0.061 70.082 1b0.005 00.002 90.069 7~0.094 40.040.138 0a0.044 80.025 80.006 6~0.215 90.147 6a0.006 30.003 60.132 0~0.163 1胰蛋白酶0.060.239 7a0.028 20.016 30.136 1~0.276 70.253 7a0.007 50.004 30.235 2~0.272 20.080.362 4a0.029 30.016 90.271 3~0.417 00.384 1a0.003 10.003 60.213 6~0.754 70.10.419 1a0.033 80.019 50.354 0~0.312 30.421 3a0.006 20.035 00.395 6~0.440 20.10.077 2a0.009 40.005 40.062 4~0.092 90.092 0b0.003 70.002 20.085 1~0.098 20.20.242 4a0.004 70.002 70.228 8~0.255 70.249 7a0.062 00.003 60.247 3~0.252 8溶菌酶0.30.411 4a0.007 20.004 10.375 3~0.447 00.427 9a0.004 90.002 80.421 7~0.434 00.40.555 3a0.019 40.009 70.543 7~0.567 10.561 4a0.007 90.006 50.551 9~0.570 70.50.674 3a0.007 10.004 10.656 4~0.692 10.685 7a0.003 70.002 20.679 4~0.694 6
注:同一行不同小写字母表示具有显著性差异(P<0.05)
为了探讨蛋白质种类对TNBS法分析游离氨基的影响,我们比较了同一浓度下的牛血清蛋白、胰蛋白酶、溶菌酶的游离氨基含量。当浓度为0.1 mmol/L时,牛血清蛋白、胰蛋白酶和溶菌酶的游离氨基含量分别为(1.30±0.01) mmol/L、(0.42±0.04)mmol/L、(0.08±0.001) mmol/L(图7)。这种差异首先是由蛋白质的一级结构决定。牛血清蛋白是包含583个氨基酸残基,86个游离氨基的一种球蛋白;胰蛋白酶是一种丝氨酸蛋白水解酶,含有223个氨基酸残基,36个游离氨基;溶菌酶由129个氨基酸组成,含有15个游离氨基[21]。因而,在用此方法分析蛋白质游离氨基含量时,样品的浓度要根据蛋白质本身含有的游离氨基数量进行调整,样品中所含蛋白质的游离氨基数量多,取样量可适当减少。
值得注意的是,采用TNBS法测得的每2个蛋白之间游离氨基含量的比值高于理论上每2个蛋白之间游离氨基数量的比值。牛血清蛋白的游离氨基含量约是胰蛋白酶的3倍,而理论上牛血清蛋白的游离氨基数量约是胰蛋白酶的2.4倍;胰蛋白酶的游离氨基含量约是溶菌酶的12倍,而理论上胰蛋白酶的游离氨基含量约是溶菌酶的6倍。推测蛋白质中可能存在其他能与TNBS反应的基团。ADLER-NISSEN[5]曾提出过蛋白质中的巯基基团会影响TNBS和蛋白质中游离氨基的反应。巯基存在于蛋白质半胱氨酸残基上,牛血清蛋白含有35个半胱氨酸,17个二硫键;胰蛋白酶含有14个半胱氨酸,12个二硫键;溶菌酶是4个二硫键衔接起来的单链多肽,含有8个半胱氨酸。这些巯基很可能与TNBS反应,造成这些蛋白所测的游离氨基含量高于实际游离氨基的含量,影响到游离氨基分析的准确性。KOTAKI等[22] 也证实了在氨基和巯基共同存在的情况下,TNBS优先与氨基结合。因此采用TNBS法时,如果比较不同蛋白质游离氨基的含量,需要考虑巯基含量对结果的影响。另外,巯基很容易氧化成二硫键,而二硫键由于不牢固也很容易还原成巯基。因此,二硫键的存在也可能会对结果造成影响。对于涉及到二硫键的还原的反应体系,不适合用该法测定。
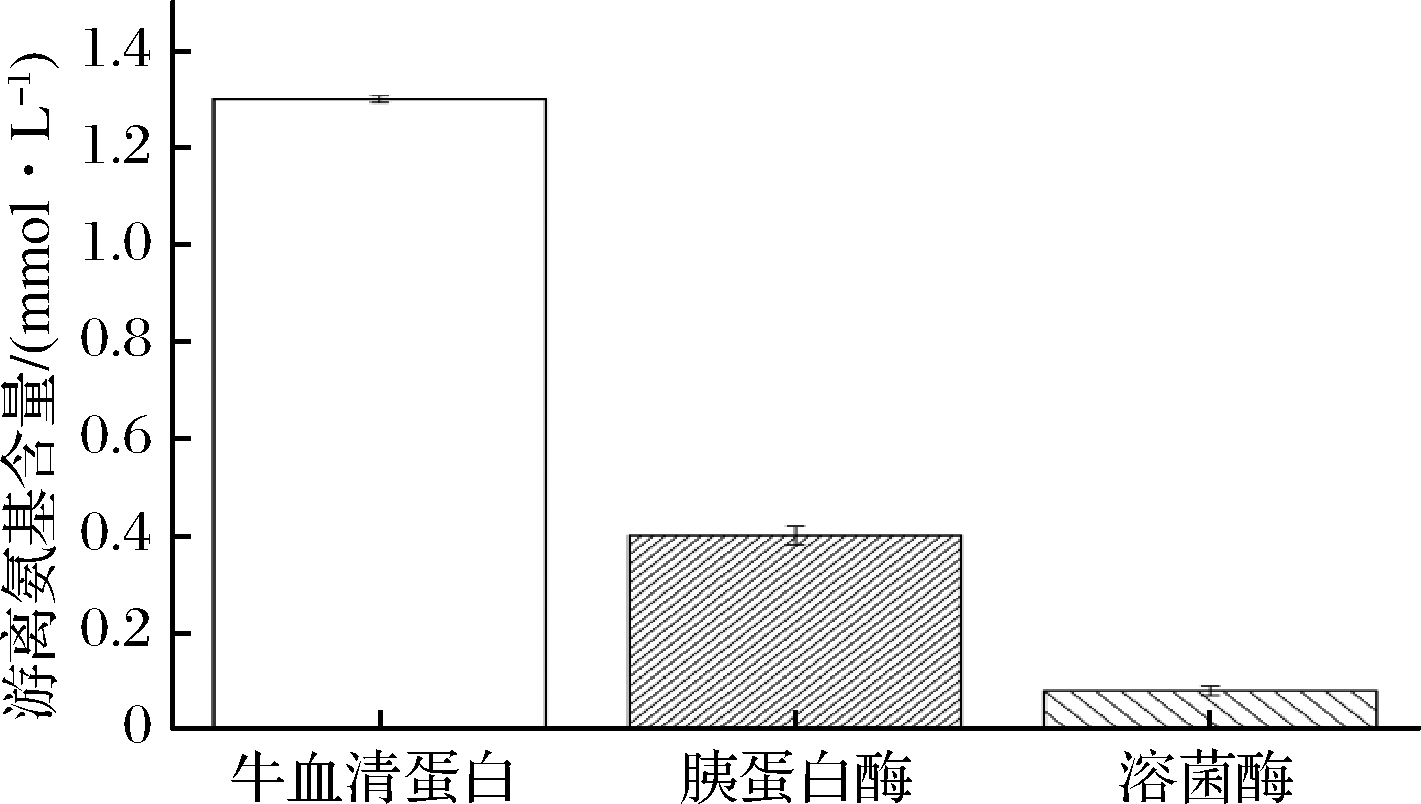
图7 不同种类蛋白质游离氨基含量的变化
Fig.7 Changes in free amino group content of different kinds of proteins
TNBS法是一种可以直接测量蛋白质游离氨基含量的简便方法,碱性条件下的吸光度值对浓度的响应值高于酸性条件,在样品浓度较低的情况下,建议选择碱性终止条件。紫外可见分光光度计和酶标仪2种测定方法对蛋白质游离氨基含量的测定结果在蛋白浓度非常低的范围内有显著差异,浓度较高时,其结果没有显著性差异,但是紫外-可见分光光度计对浓度变化响应更灵敏,误差小且精确度高。综合紫外-可见分光光度计与酶标仪的优缺点,在实际应用时根据实验条件和样品性质选择合适的方法,保证实验的可行性与结果的准确性。同时采用方法时,需要根据样品中蛋白质游离氨基的数量确定样品分析浓度,且需考虑蛋白质中巯基和二硫键的多少和变化对该方法结果准确性的影响。
[1] PRIGENTS V E, VORAGENAG J, KONINGSVELD G A, et al. Interactions between globular proteins and procyanidins of different degrees of polymerization[J]. Journal of Dairy Science, 2009, 92(12): 5 844-5 853.
[2] JIA Na, WANG Letian, SHAO Junhua,et al. Changes in the structural and gel properties of pork myofibrillar protein induced by catechin modification[J]. Meat Science, 2017, 127: 45-50.
[3] BORDENAVE N, HAMAKER B R, FERRUZZI M G. Nature and consequences of non-covalent interactions between flavonoids and macronutrients in foods[J]. Food Funct, 2014, 5: 18-34.
[4] 胡京枝, 余大杰. 牛奶及其制品中游离氨基酸含量的测定方法研究[J]. 河南畜牧兽医(综合版), 2007(10): 29-31.
[5] ADLER-NISSEN J. Determination of the degree of hydrolysis of food protein hydrolysates by trinitrobenzenesulfonic acid [J]. J. Agric. Food Chem., 1979, 27 (6): 1 256-1 262.
[6] MULCAHY E M, FARGIER-LAGRANGE M, DANIEL M, et al. Characterisation of heat-induced protein aggregation in whey protein isolate and the influence of aggregation on the availability of amino groups as measured by the ortho-phthaldialdehyde (OPA) and trinitrobenzenesulfonic acid (TNBS) methods[J]. Food Chemistry, 2017, 229: 66-74.
[7] 王丽, 宋志峰, 纪锋, 等. 高效液相色谱法测定大豆中游离氨基酸含量[J].中国粮油学报, 2008(1):180-184.
[8] CROWELL E A. Determination of alpha amino nitrogen in musts and wines by TNBS method [J]. Am. J. Enol. Vitic., 1985, 36 (2): 175-177.
[9] 罗艳华, 王全杰, 陈沛海,等.蛋白水解物水解度测定方法的研究[J]. 皮革与化工, 2017, 34 (2): 26-31.
[10] 冯岩, 冯志彪,王楠. 乳清蛋白水解物游离氨基浓度测定方法比较[J]. 中国乳品工业, 2010, 38 (5): 46-48.
[11] 李天娇, 徐响, 孙丽萍,等.油菜蜂花粉蛋白水解度测定方法比较[J]. 食品科学, 2010, 31 (16): 184-187.
[12] 周慧江, 朱振宝, 易建华. 核桃蛋白水解物水解度测定方法比较[J]. 粮食与油脂, 2012, 25 (2): 28-30.
[13] RAWEL H M, KROLL J, ROHN S. Reactions of phenolic substances with lysozyme physicochemical characterisation and proteolytic digestion of the derivatives[J]. Food Chemistry, 2001, 72: 59-71.
[14] RAWEL H M, KROLL J, HOHL U C. Model studies on reactions of plant phenols with whey proteins[J]. Nahrung Food, 2001, 45 (2): 72 - 81.
[15] 曹艳芸. 乳清蛋白与多酚在中性pH条件下的相互作用对蛋白功能性质的影响研究[D].无锡:江南大学, 2017.
[16] 王耀松. 共价交联对乳清蛋白成膜的影响及作用机理[D]. 无锡:江南大学, 2012.
[17] SATAKE K. The spectrophotometric determination of amine, amino acid and peptide with 2,4,6-trinitrobenzenesulfonic acid [J]. The Journal of Biochemistry, 1960, 47 (5): 654-660.
[18] FIELDS R. The rapid determination of amino groups with TNBS[J]. Methods in Enzymology, 1972, 25: 464-468.
[19] 范鹏,蒋林东, 王小丹. 紫外分光光度计与酶标仪测定盐酸川芎嗪含量的比较[J]. 西南国防医药, 2010, 20 (7): 720-722.
[20] 肖婷, 刘守柱, 薛超彬, 等. 紫外分光光度计法与酶标仪微量法测定酚氧化酶蛋白含量及活力的比较[J]. 昆虫知识, 2008 (2): 306-309.
[21] 赵新淮,徐红华,姜毓敏. 食品蛋白质—结构、性质与功能[M].北京:科学出版社, 2009: 207.
[22] KOTAKI A, HARAND M, MAGI K.Reaction between sulfhydryl compounds and 2, 4, 6-trinitrobenzenelsulfonic acid[J]. The Journal of Biochemistry, 1964, 55 (5): 553-561.