枸杞多糖的提取方式、结构及生物活性研究进展
叶兴乾*,周声怡,姚舒婷,吴文艳,陈士国
(浙江大学 生物系统工程与食品科学学院, 馥莉食品研究院浙江省农产品加工技术研究重点实验室, 浙江 杭州, 310058)
摘 要 枸杞(Lycium barbarum)果实为传统的名贵滋补药材,在我国有2 000多年的历史。枸杞多糖(Lycium barbarum polysacchavides,LBP)是枸杞中最重要的活性成分之一。在过去的几年中,LBP由于具有良好的生物活性而备受关注。然而,多糖的生物活性与其化学结构密切相关,而化学结构又被提取方式所影响。该文对LBP的提取方法、化学结构和主要生物活性的对应关系进行总结,比较通过不同提取方式制备得到的枸杞多糖的不同之处,旨在提出枸杞多糖的构效关系,关注特定结构和活性的枸杞多糖的定向提取。大部分研究表明,采用热水提取法制备的枸杞多糖多为含有酸性糖组分的杂多糖,其中的中性糖组分多以阿拉伯糖、葡萄糖及半乳糖为主。此外,枸杞多糖通过不同的机制显示出良好的抗氧化、免疫调节、抗肿瘤及神经保护活性。
关键词 枸杞多糖;提取方式;化学结构;生物活性;构效关系
DOI:10.13995/j.cnki.11-1802/ts.022778
引用格式:叶兴乾,周声怡,姚舒婷,等.枸杞多糖的提取方式、结构及生物活性研究进展[J].食品与发酵工业,2020,46(6):292-300.YE Xingqian, ZHOU Shengyi, YAO Shuting, et al. Research progress on extraction methods, structures and bioactivities of Goji (Lycium barbarum) polysaccharides[J].Food and Fermentation Industries,2020,46(6):292-300.
Research progress on extraction methods, structures and bioactivities of Goji (Lycium barbarum) polysaccharides
YE Xingqian*, ZHOU Shengyi, YAO Shuting, WU Wenyan, CHEN Shiguo
(College of Biosystems Engineering and Food Science, Zhejiang University, Fuli Institute of Food Science, Zhejiang Key Laboratory for Agro-Food Processing, Hangzhou 310058,China)
ABSTRACT Goji (Lycium barbarum) berries have been used as a traditional medicinal herb and food supplement in China for more than 2 000 years. Goji (Lycium barbarum) polysaccharides (LBP) are one of the most important active components in Goji berries. In the past few years, LBP have attracted great attention due to their great bioactivities. However, the bioactivities of polysaccharides are closely related to their chemical structures, while the chemical structures are affected by the extraction methods. Hence, the present paper summarized the correspondence relationship among extraction methods, chemical structures and major bioactivities of LBP, and compared the differences between the polysaccharides obtained by different extraction methods. This study aims to propose the structure-function relationship and to focus on the targeted extractions of LBP with specific structures and bioactivities. Most of the LBP prepared by hot water extraction are heteropolysaccharides containing acidic glycoconjugate and the neutral sugar components are mostly arabinose, glucose and galactose. Moreover, LBP possess good antioxidant, immunomodulatory, antitumor and neuroprotective activities via different mechanisms.
Key words Goji polysaccharide; extraction methods; chemical structures; bioactivities; structure-function relationship
枸杞(Lycium barbarum L.)属茄科落叶灌木,花紫、果红,全球共有70种枸杞属植物,产于中国西北部、南北美、南非以及欧洲东南部地区[1],我国是主要产地。枸杞在中国有2 300年的历史,其果实是我国传统的名贵滋补中药材,《本草纲目》记载其具有滋阴补气、养肝明目、调节免疫力等药理作用[2]。如今,枸杞作为食品补充剂也已广泛应用于西方国家。
枸杞果实的生物活性成分复杂,主要包括枸杞多糖(Lycium barbarum polysaccharides,LBP)、玉米黄质、β-胡萝卜素、甜菜碱、类黄酮、脑苷和部分微量元素[3]。LBP是从枸杞果实中提取得到的一种水溶性多糖,因其具有许多生物学功效,被认为是枸杞果实中最主要的活性成分之一。研究表明,枸杞多糖除了能改善氧化及炎症导致的糖尿病并发症外,还能影响血糖水平的稳态、体重以及脂质代谢[4]。枸杞多糖由高度支化和仅部分表征的多糖和糖蛋白的复杂混合物组成。
提取枸杞多糖所用的方法较局限,现所用的方法主要有热水提取、冷水提取、酶提取、碱醇提取以及基于水提取的新型辅助提取方法,如微波辅助以及超声辅助提取。不同的提取方法将会释放植物细胞壁中不同的部分并导致多糖化学结构的差异[5],而多糖的生物活性与其化学结构紧密相关。迄今为止,共有数10种枸杞多糖被文献报道。本文基于此背景,总结了枸杞多糖的提取纯化方法及其对应的化学特性,并对枸杞多糖主要的生物活性进行综述。如何控制提取条件以获得目标枸杞多糖是今后的研究重点。
1 枸杞多糖的提取和纯化
多糖的化学结构与提取方法密切相关,因此,如何从枸杞果实中定向提取枸杞多糖是研究其化学结构的关键。目前,研究中多采用水提取、酶提取及基于水提取的新型辅助技术等进行枸杞多糖的制备(表1)。
在提取枸杞多糖之前,通常将枸杞晒干后磨成粉末,加入V(氯仿)∶V(甲醇)=2∶1以回流脱脂,并用80%(体积分数)乙醇浸泡搅拌,以除去低聚糖和色素等小分子杂质[6]。也有研究将磨成粉的枸杞和石油醚在80 ℃下混合回流[7],将脂类、低聚糖和小分子色素一并除去。过滤并烘干后,得到的枸杞残渣用于提取水溶性枸杞多糖。由于枸杞果实的采后期会影响其内源酶代谢,进而影响枸杞多糖的化学结构,故未有研究从新鲜采摘的枸杞果实中直接进行提取。
水提醇沉是提取水溶性枸杞多糖的传统方法,被大多数研究采用。水提取过程中,料液比控制在1∶10~1 ∶35,提取时间为2~7 h,提取温度为70~90 ℃。ZHU[8]将枸杞干果在索氏提取器中用氯仿-甲醇溶液在80 ℃下脱脂2次,并用80%乙醇处理,以除去一些有色小分子物质,预处理后的枸杞渣置于80℃的热水中提取枸杞多糖,重复3次,得到1种分子质量为1.92 × 106 Da的酸性多糖LBP-s-1,由鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖、半乳糖醛酸以1.00 ∶8.34 ∶1.25 ∶1.26 ∶1.91 ∶7.05 ∶15.28的摩尔比组成。HUANG等[9]将枸杞果实置于100 ℃的蒸馏水中提取30 min,将提取液过截留分子质量为3 500 Da的滤膜以除去小分子物质,将提取液浓缩并冻干后,得到枸杞多糖XLBP。通过阴离子交换色谱法及凝胶色谱法分离粗多糖,收集得到1种分子质量为4.196×105 Da的果胶类多糖XLBP-I-I,由阿拉伯糖,鼠李糖,半乳糖和半乳糖醛酸以26.5 ∶12.9 ∶16.8 ∶40.8的摩尔比组成。
除了传统的热水提取外,近年来许多研究都采用基于热水提取的新型辅助提取技术,如超声辅助提取、微波辅助提取。与传统水提取法相比,超声及微波辅助提取具有提取率高、耗时短等优点。MUATASIM等[10]证实双频超声提取枸杞多糖的提取率比传统水提取提高了73.41%。YANG等[11]比较了热水(100 ℃),超声水(30~40 ℃ ),亚临界水(110 ℃)以及超声增强亚临界水(110 ℃)对枸杞多糖提取率的影响,研究发现超声增强亚临界水的提取率最高14%(质量比),热水提取率最低7.6%(质量比)。
酶提取具有反应迅速、条件温和等优点。ZHOU等[12]采用纤维素酶,木瓜蛋白酶和淀粉酶在55 ℃下提取枸杞粗多糖LBP1,通过阴离子交换色谱法及凝胶色谱法分离粗多糖,分别收集0.1 mol/L NaCl及0.2 mol/L NaCl洗脱的级分,得到一种分子量为80 kDa的酸性多糖LBP1B-S-2,由阿拉伯糖、鼠李糖、半乳糖和半乳糖醛酸组成,摩尔比为53.55 ∶3.13 ∶39.37 ∶3.95。ZHANG等[13]通过正交试验和响应面试验设计发现,采用2.0%(质量分数)纤维素酶和1.0%木瓜蛋白酶在97 ℃,pH 5.0的条件下提取91 min,能够得到枸杞多糖的相对最大得率(6.81±0.10)%。
在BUCHELI [14]的研究中提到,冷水提取枸杞多糖的得率可达到2%~3%。在枸杞多糖粗提物中加入Yariv试剂,得到的沉淀被鉴定为阿拉伯半乳糖蛋白;其余可溶性多糖主要由果胶组成;而不溶于冷水的多糖组分约占枸杞干果的20%,由纤维素和半纤维素组成;这些多糖共同组成了枸杞的细胞壁。
提取完成后,通常在提取液中加入3~4倍体积的95%乙醇以沉淀多糖,在4 ℃下静置过夜。随后收集沉淀,用无水乙醇和丙酮轮流洗涤,风干后冷冻干燥并储存,以用于进一步分析。
枸杞粗多糖由不同的组分组成,可以采用离子交换色谱、凝胶渗透色谱、反相高效液相色谱及分级沉淀进行分离纯化[1]。
然而,目前大多数关于LBP提取的研究都集中在提高提取率上,未曾有研究系统地比较LBP的提取方法与理化性质之间的关系。基于不同的提取条件,已经发现了具有多种复杂结构的LBP,但是关于LBP的所有研究都难以联系到一起,之后应着重探究多糖的提取方法与化学结构之间的关系。
表1 枸杞多糖的前处理、提取及纯化方法
Table 1 Summary of the pretreatment, extraction and purification methods of Goji polysaccharides

前处理条件提取条件沉淀条件得率/%分离纯化条件参考文献100 ℃热水浸提2 h,重复3次将提取液过截留分子量为3 500 Da的滤膜以除去小分子物质,将提取液浓缩并冻干6.4将粗多糖上样至阴离子交换色谱柱,用蒸馏水和0.2、0.4、0.6、0.8、1.0 mol/L NaCl分别洗脱。收集主要组分上样至凝胶色谱柱分离。[9]蒸馏水浸泡过夜并搅拌3 min100 ℃热水浸提2 h,重复3次将提取液在40 ℃下浓缩至25%体积,然后在4 ℃下加入4倍体积的无水乙醇进行沉淀。将沉淀物用95%乙醇,100%乙醇和丙酮轮流洗涤,并在40 ℃下干燥8.4将枸杞粗多糖施上样至DEAE Sepha-rose Fast Flow柱(2.5 cm×20 cm)上,以2.0 mL/min的流速用蒸馏水和0.05、0.1、0.25和0.5 mol/L NaCl分别洗脱2 h。[15] 80%乙醇萃取3次,去除醇溶性成分80 ℃热水浸提4 h0.93±0.06将枸杞粗多糖施上样至DEAE Sepha-rose Fast Flow柱(15 mm×460 mm)1 h,用不同浓度的NaCl溶液洗脱(0.1、0.2、0.3 mol/L、各梯度1 h)。收集各组分,分别上样至Sephacryl S-200HR(15 mm×460 mm)凝胶色谱柱。[16]冷水浸泡过夜2%~3% (0.4%阿拉伯半乳糖蛋白)[14]在60 ℃下干燥24 h超声增强亚临界水提取4.444亚临界水提取3.990[17]热水提取3.440冷冻干燥48 h微波辅助提取(900 W, 120 ℃, 7min)将上清液在40 ℃下浓缩至25%体积,然后加入4体积的乙醇进行沉淀[18]用石油醚在90 ℃条件下回流3 h酶提取(纤维素酶2.0%,木瓜蛋白酶1.0%),59.7 ℃,pH 5.0, 91 min6.81±0.10[13]用石油醚在90 ℃下萃取3h超声辅助酶提取6.31±0.03[19]
2 枸杞多糖的结构鉴定
枸杞多糖因具有良好的生物活性,其组分的化学结构自20世纪以来一直广为研究。根据现有文献可知,枸杞粗多糖是一种由高度支化和仅部分表征的多糖及蛋白多糖共同组成的复杂混合物。这些糖缀合物的分子质量高达10~2 250 kDa。糖苷部分由阿拉伯糖、葡萄糖、半乳糖、甘露糖、鼠李糖、木糖组成。同时,枸杞多糖还含有半乳糖醛酸,葡糖醛酸和氨基酸[20]。Yariv试剂可沉淀出枸杞多糖溶液中的阿拉伯半乳糖蛋白,其与枸杞多糖的化学结构与生物活性功能之间的关系为枸杞多糖的研究重点之一。
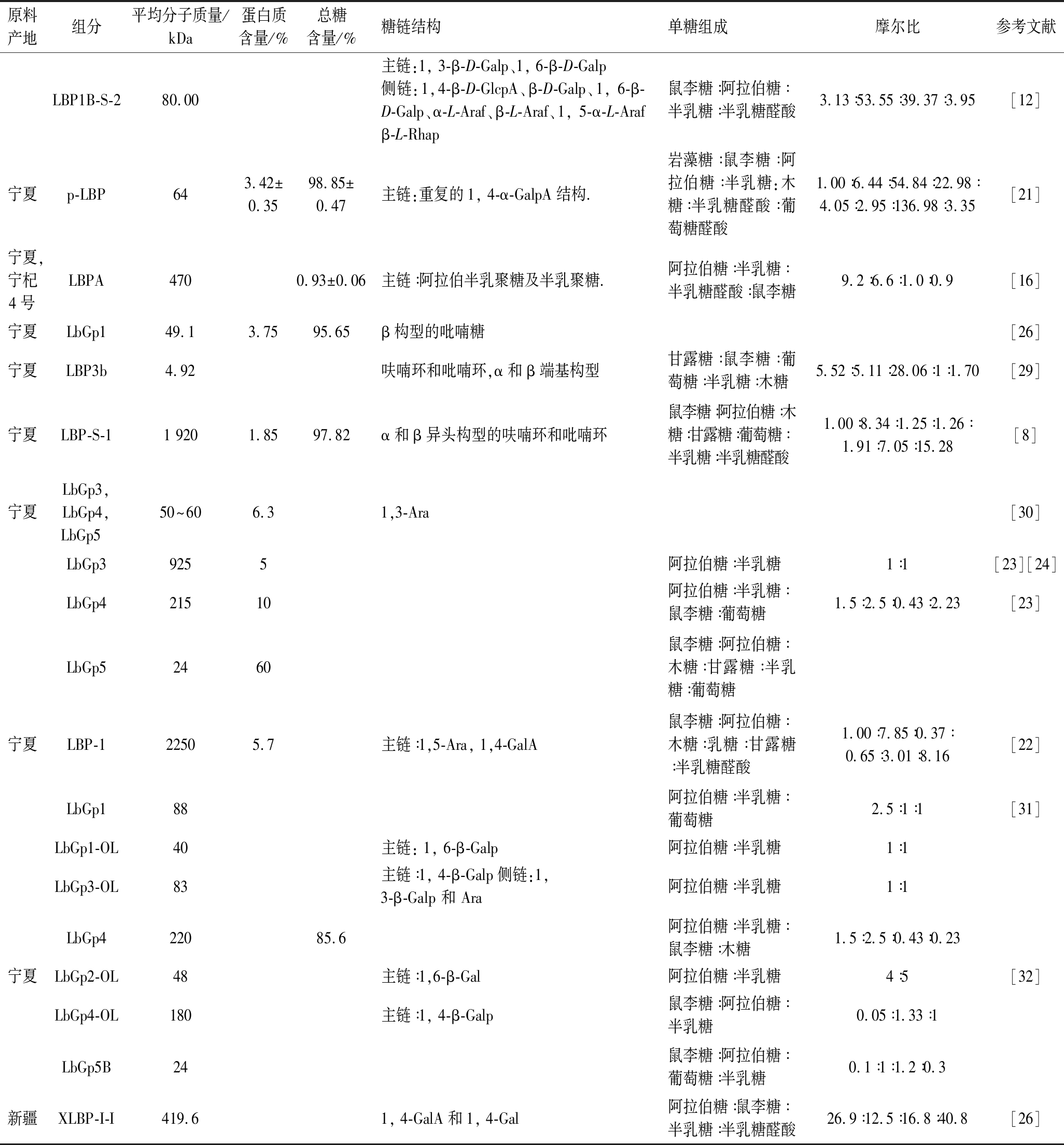
多糖由于其单糖组成、链构形、环构象和分子量等方面的多样性,使其分析具有一定的挑战性。聚糖的化学特性可借助相关化学技术进行表征,包括气相色谱(gas chromatography,GC)、高效液相色谱(high performance liquid chromatography,HPLC)、核磁共振(nuclear magnetic resonance,NMR)、红外光谱(infrared spectroscopy,IR)、高效凝胶排阻层析(high performance size exclusion chromatogaraphy,HPSEC) 及气相色谱-质谱联用仪(gas chromatogtaphy-mass spectrometry,GC-MS)等。迄今为止,不同的文献数据在枸杞多糖缀合物的单糖、氨基酸残基的组成以及聚糖的主链、分支位点的分析方面呈现出不同的结果(表2)。
LIU[21]用80 ℃的热水从枸杞中提取出酸性多糖p-LBP,脱色后,过离子交换色谱和凝胶色谱进行纯化。根据配有脉冲电流检测器的高效阴离子交换色谱(high performance anion exchange chromatography-pulsed amperometric detertor,HPAEC-PAD)、HPSEC、FT-IR、GC-MS和NMR的一级结构分析得知,p-LBP的平均分子质量为64 kDa,是一种果胶类均相杂多糖。
ZOU等[22]和ZHU等[8]采用相同的温度从宁夏产的枸杞中分别提取得到LBP-1和LBP-S-1。然而,ZOU[22]提取的杂多糖LBP-1主要由阿拉伯糖,甘露糖和半乳糖醛酸组成,平均分子质量为2 250 kDa。而根据ZHU等[8]的研究,半乳糖醛酸(42%)在LBP-S-1中占比最大。LBP-s-1的平均分子质量为1 920 kDa。
ZHOU等[12]通过纤维素酶、木瓜蛋白酶和淀粉酶在55 ℃下提取出了平均分子质量为80 kDa的枸杞多糖,命名为LBP1B-S-2。LBP1B-S-2由鼠李糖、阿拉伯糖、半乳糖和葡糖醛酸以3.13 ∶53.55 ∶39.37 ∶3.95的摩尔比组成,为一种酸性阿拉伯半乳聚糖。
BUCHELI等[14]从枸杞中提取出的可溶性大分子为一种糖缀合物,被鉴定为阿拉伯半乳聚糖蛋白,但其在大多数文献中被统称为“枸杞多糖”。目前,已有部分枸杞糖缀合物的化学结构被表征。HUANG等[23]通过提取得3种糖缀合物:LbGp3、LbGp4和LbGp5。糖缀合物LbGp3的平均分子质量为925 kDa,糖苷部分由阿拉伯糖和半乳糖组成。LbGp4的平均分子质量为215 kDa,糖苷部分由阿拉伯糖,半乳糖,鼠李糖和葡萄糖以1.5 ∶2.5 ∶0.43 ∶0.23的摩尔比组成。LbGp5的平均分子质量为24 kDa,糖苷部分由鼠李糖、阿拉伯糖、木糖、半乳糖、甘露糖和葡萄糖以0.33 ∶0.52 ∶0.42 ∶0.94 ∶0.85 ∶1.0的摩尔比组成。接着LIN等[24]对LbGp3进行了结构分析。阿拉伯糖和半乳糖的摩尔比为1 ∶1,半乳糖残基构成其主链。PENG等[25]以类似的方式对LbGp4进行了结构分析,发现聚糖部分(LbGp4-OL)通过β-消除反应释放,由阿拉伯糖,半乳糖,鼠李糖以1.33 ∶1.0 ∶0.05的摩尔比组成。LbGp3和LbGp4-OL均为阿拉伯半乳聚糖。WANG等[26]与HUANG等[9]采用相同的提取条件,WANG从枸杞中提取得到LbGp1,平均分子质量为49.1 kDa,蛋白含量为3.75%(质量分数)。用气相色谱法分析得知糖苷部分由阿拉伯糖和半乳糖组成,摩尔比为5.6 ∶1。部分水解后通过甲基化和电喷雾质谱分析得知LbGp1的主链是由半乳聚糖构成。
目前大多研究均采用宁夏枸杞为原料对枸杞多糖进行结构及生物活性研究。在最近HUANG等[9]的研究中,以新疆枸杞为原料,用沸水提取枸杞多糖XLBP,并经离子交换色谱和凝胶层析柱,分离纯化出XLBP-I-I组分。甲基化、红外光谱及核磁分析结果表明,XLBP-I-I主链为重复的1, 4-GalA结构,这提示XLBP-I-I为一种果胶类多糖,且分子质量为419.6 kDa,高于约40种从宁夏枸杞(L. barbarum)、中华枸杞(L. chinense)和黑果枸杞(L. ruthenicum)分离得到的多糖分子质量。然而,同作为果胶类多糖,XLBP-I-I的分子质量小于从宁夏枸杞中提取得到的LBP-S-1 (1 920 kDa)[8] 和 LBP-1 (2 250 kDa)[22]。李越鲲等[27]以枸杞的“宁杞1号”品种为材料, 对新疆、青海、宁夏、甘肃、内蒙等共10个产区3批次“宁杞1号”的主要化学成分进行了测定分析。结果表明,宁夏产区“宁杞1号”的总糖和还原糖含量最低,但枸杞多糖(3.61%)含量居首位。李重[28]选定宁夏枸杞的3个栽培品种“宁杞4号”、“宁杞7号”、“中科绿川1号”为研究对象,评价包括总多糖含量在内的活性成分指标,结果表明3个枸杞栽培品种均表现出夏果品质优于秋果,且宁夏中宁枸杞产区的枸杞总多糖大于内蒙沙海及青海都兰产区。综上可知,不同产地及品种的枸杞因具有不同的化学成分或采用了不同的预处理方式,导致即使采用相同的提取温度,枸杞多糖也会表征出不同的结构特征[9]。
3 枸杞多糖的生物活性
枸杞多糖具有多种重要的生物活性,例如抗氧化,保护神经,免疫调节,抗肿瘤,辐射防护,抗糖尿病,护肝,抗骨质疏松[33]等。
根据被研究的广泛性,将讨论4种主要的生物活性。
3.1 抗氧化活性
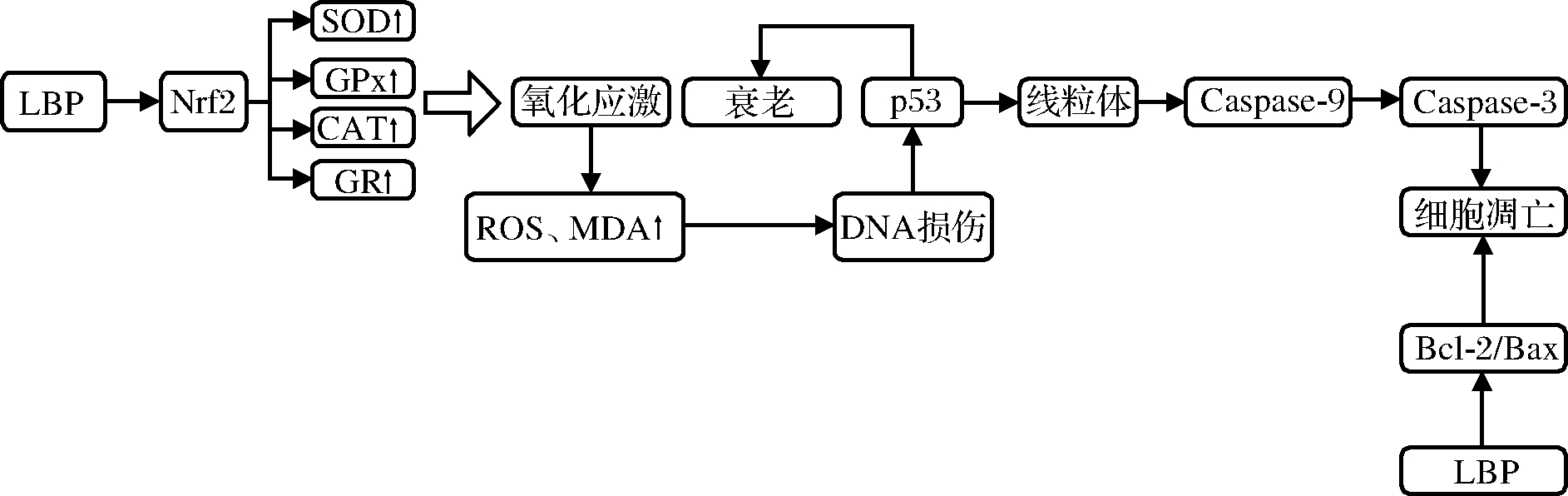
LBP的抗氧化活性已经在体外进行了广泛的研究可能的抗氧化活性机制如图1所示。CAO等[34]证实LBP通过上调Nrf2/HO-1信号传导,起到对神经毒性的保护作用。YANG等[36]发现LBP通过增强抗氧化酶的效力和减弱环玲酰胺注射后氧化产物的水平降低氧化应激。但是,以上研究均未提及LBP的精细结构,因此无法进一步研究核心活性成分。
LBP的抗氧化作用也已在体内进行了研究。AMAGASE等[36]通过30 d的随机、双盲、对照临床实验,研究了枸杞多糖对50名55~72岁健康成年人的抗氧化作用。结果表明,食用LBP可使血清超氧化物歧化酶(superoxide dismutase,SOD)显着提高8.4%,谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)提高9.9%,并显着降低血清丙二醛(malondialdehyde,MDA)含量8.7%。这表明LBP可以通过刺激内源性因子使细胞免受氧自由基介导的损伤。BOKANG等[37]研究了LBP对高脂饮食小鼠的血脂代谢、血糖和氧化应激的影响,实验结果显示食用LBP可以显著降低低密度脂蛋白、总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、血糖和硫代巴比妥酸反应性物质的水平,并提高抗氧化酶的活性。这表明LBP对高脂饮食引起的脂质氧化具有明显的抑制作用。
表2 枸杞多糖组分的结构研究
Table 2 Structural studies of Goji polysaccharides fractio
原料产地组分平均分子质量/kDa蛋白质含量/%总糖含量/%糖链结构单糖组成摩尔比参考文献LBP1B-S-280.00主链:1, 3-β-D-Galp、1, 6-β-D-Galp 侧链:1,4-β-D-GlcpA、β-D-Galp、1, 6-β-D-Galp、α-L-Araf、β-L-Araf、1, 5-α-L-Araf β-L-Rhap鼠李糖∶阿拉伯糖∶半乳糖∶半乳糖醛酸3.13∶53.55∶39.37∶3.95[12]宁夏 p-LBP643.42±0.3598.85±0.47主链:重复的1, 4-α-GalpA结构. 岩藻糖∶鼠李糖∶阿拉伯糖∶半乳糖:木糖∶半乳糖醛酸∶葡萄糖醛酸1.00∶6.44∶54.84∶22.98∶4.05∶2.95∶136.98∶3.35[21] 宁夏,宁杞4号LBPA4700.93±0.06主链∶阿拉伯半乳聚糖及半乳聚糖. 阿拉伯糖∶半乳糖∶半乳糖醛酸∶鼠李糖9.2∶6.6∶1.0∶0.9[16]宁夏LbGp149.13.7595.65β构型的吡喃糖[26]宁夏LBP3b4.92呋喃环和吡喃环,α和β端基构型甘露糖∶鼠李糖∶葡萄糖∶半乳糖∶木糖5.52∶5.11∶28.06∶1∶1.70[29]宁夏LBP-S-11 9201.8597.82α和β异头构型的呋喃环和吡喃环鼠李糖∶阿拉伯糖∶木糖∶甘露糖∶葡萄糖∶半乳糖∶半乳糖醛酸1.00∶8.34∶1.25∶1.26∶1.91∶7.05∶15.28[8]宁夏LbGp3, LbGp4, LbGp5 50~606.3 1,3-Ara[30]LbGp39255阿拉伯糖∶半乳糖1∶1[23][24]LbGp421510阿拉伯糖∶半乳糖∶鼠李糖∶葡萄糖1.5∶2.5∶0.43∶2.23[23]LbGp52460鼠李糖∶阿拉伯糖∶木糖∶甘露糖∶半乳糖∶葡萄糖宁夏LBP-122505.7主链∶1,5-Ara, 1,4-GalA鼠李糖∶阿拉伯糖∶木糖∶乳糖∶甘露糖∶半乳糖醛酸1.00∶7.85∶0.37∶0.65∶3.01∶8.16[22]LbGp1 88阿拉伯糖∶半乳糖∶葡萄糖2.5∶1∶1[31]LbGp1-OL40主链: 1, 6-β-Galp阿拉伯糖∶半乳糖1∶1LbGp3-OL83主链∶1, 4-β-Galp侧链:1, 3-β-Galp 和 Ara阿拉伯糖∶半乳糖1∶1LbGp422085.6阿拉伯糖∶半乳糖∶鼠李糖∶木糖1.5∶2.5∶0.43∶0.23宁夏LbGp2-OL48主链∶1,6-β-Gal阿拉伯糖∶半乳糖4∶5[32]LbGp4-OL180主链∶1, 4-β-Galp鼠李糖∶阿拉伯糖∶半乳糖0.05∶1.33∶1LbGp5B24鼠李糖∶阿拉伯糖∶葡萄糖∶半乳糖0.1∶1∶1.2∶0.3新疆XLBP-I-I419.61, 4-GalA和1, 4-Gal阿拉伯糖∶鼠李糖∶半乳糖∶半乳糖醛酸26.9∶12.5∶16.8∶40.8[26]
综上,LBP的抗氧化活性主要归因于抗氧化酶活性的提高。此外,有报道称,由于O—H键的解离能较弱,多糖可能具有向超氧阴离子提供氢的能力[38]。
3.2 免疫调节活性
多糖能够通过与巨噬细胞、T细胞、单核细胞和多形核淋巴细胞的相互作用来影响先天免疫和细胞介导免疫。LBP作为被研究最多的多糖之一,已被发现具有多种体内外免疫调节活性。可能的免疫调节机制如图2所示。
LBP可通过活化巨噬细胞增强机体的先天免疫功能,其机制可能是通过影响肿瘤坏死因子α(tumour necrosis factor-α,TNF-α)和上调主要组织相容性复合体II(major histocompatibility Complex-II,MHC-II)的共刺激分子来实现的。活化细胞核因子蛋白(nuclear factor of activated T cells 1-5,NFAT 1-5)在免疫系统的发育和功能活动中起关键作用。CHEN等[39]的研究表明,将枸杞在4 ℃的蒸馏水中浸泡过夜得到的LBP能够显著促进小鼠脾细胞的增殖。细胞周期分析表明,LBP激活了T细胞表达NFAT蛋白,并干扰了介导炎症反应的IL -2和(IFN)-γ的表达。
树突状细胞(dendritic cell,DC)是免疫系统中功能最强的抗原提呈细胞。JING等[40]的研究证实LBP可以增加DCs表型的表达,混合淋巴细胞反应中白细胞介素和γ干扰素的分泌,并增强NF-κB的表达。这表明LBP在病毒相关的情况下起到了更强的抗肿瘤作用,并且这种活性作用与NF-κB信号通路有关。
3.3 抗肿瘤活性
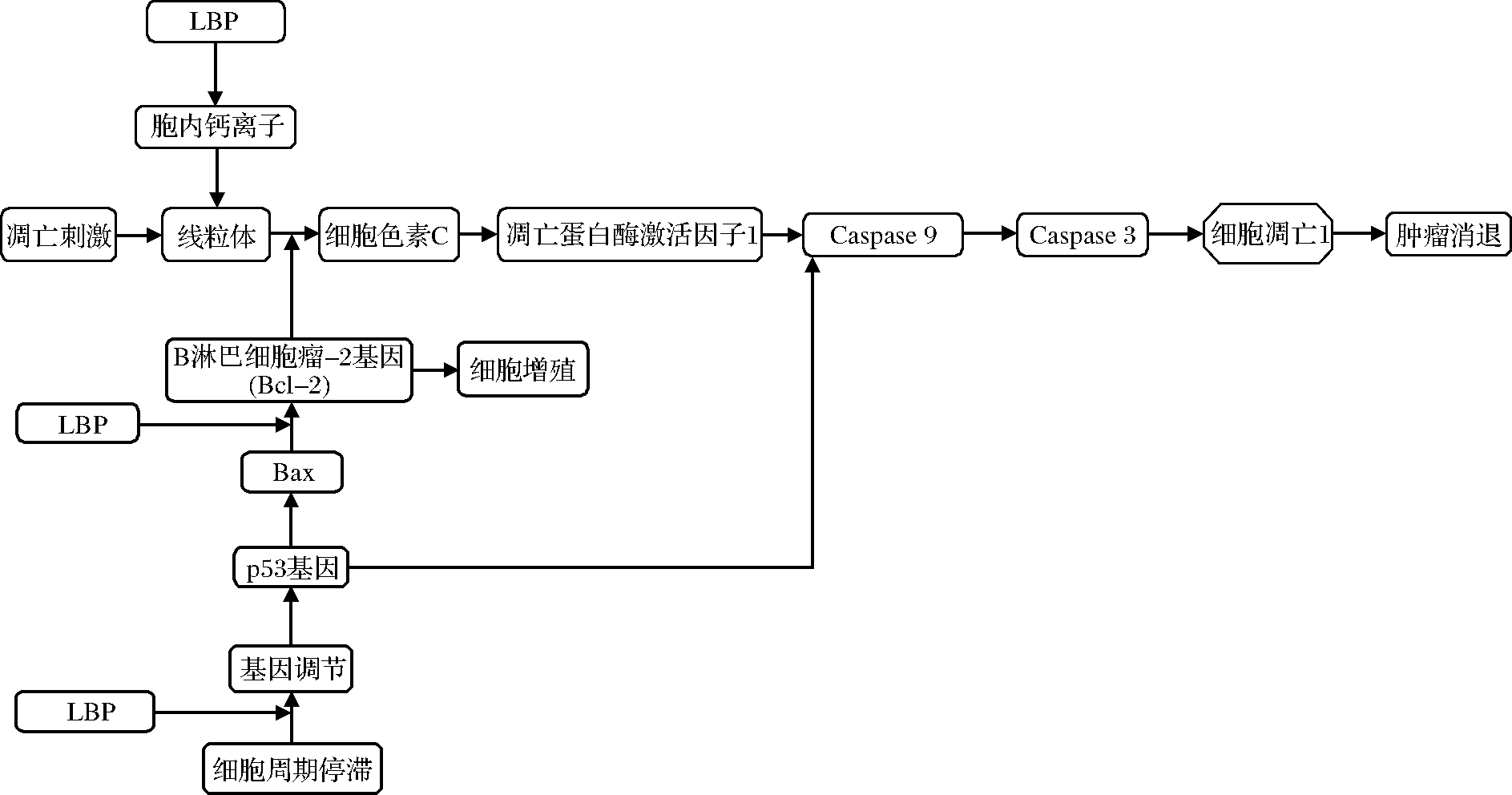
癌症治疗方式主要包括手术、放射疗法、激素疗法、化学疗法和免疫疗法。其中,放射疗法、化学疗法、免疫疗法和激素疗法的效果通常会有严重副作用,且机体易产生耐药性。所以急需从自然资源中找到安全有效的抗癌化合物。可能的抗肿瘤活性机制如图3所示。
KE等[41]用蒸馏水在室温下提取3 h得到的水溶性枸杞多糖LBPF5,流式细胞仪分析结果表明,其剂量依赖性地抑制人膀胱癌细胞株BIU87的生长,并能诱导BIU87凋亡。MAO等[42]证明LBP能够抑制2种结肠癌细胞系SW480和Caco-2的生长,并呈剂量依赖性。LI等[43]首次报道LBP通过改变雌二醇的代谢途径来抑制乳腺癌细胞MCF-7的生长,且LBP在第3天对MCF-7细胞表现出剂量依赖性的生长抑制作用。ZHANG等[44]从枸杞粗多糖中分离出5个组分:LBP-a8、LBP-p8、LBP-a3、LBP-a1、LBP-a4。LBP-a8、LBP-a3、LBP-a1和LBP-a4,均对肝癌细胞SMMC-7721的增殖具有剂量依赖性和时间依赖性。此外,LBP-a4 (10.2 kDa)由糖醛酸(11.5%)、蛋白质(0.34%)和中性糖(39.02%)组成,可以在G0/G1期阻滞SMMC-7721细胞分裂,显著提高细胞内Ca2+浓度。
综上所述,LBP在体内可通过诱导细胞凋亡和阻滞细胞周期,从而表现出对多种类型癌细胞的抑制活性。
3.4 神经保护活性
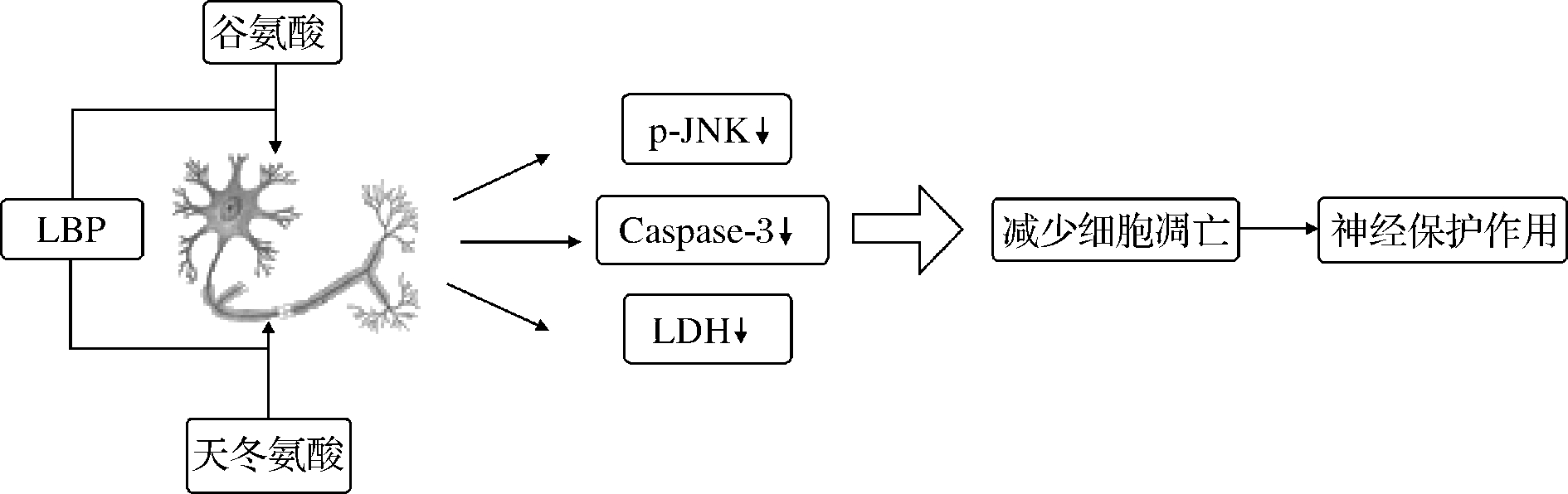
LBP在多种动物模型中均有神经保护作用,但其作用机制尚未完全阐明(图4)。在神经系统中,LBP可以防止由缺血/再灌注损伤、β淀粉样蛋白、谷氨酸引起的神经元损伤。
谷氨酸兴奋性毒性是缺血后神经元死亡的主要原因之一。SHI等[45]的研究表明LBP通过抗氧化作用来保护神经元免受缺血性损伤。他们证实了LBP具有调节含有NMDA受体信号通路的NR2B和NR2A作用。除此之外,谷氨酸兴奋性毒性还与许多神经退行性疾病有关,包括阿尔茨海默病,降低谷氨酸神经毒性是该病的治疗策略之一。HO等[46]的研究结果表明,LBPs可降低乳酸脱氢酶(lactate dehydrogenase,LDH)的活性,抑制应激活化蛋白激酶(c-Jun N-terminal kinase,JNK)的磷酸化和caspase-3的表达,从而减少细胞凋亡。
右美沙芬(dextromethorphan,DXM)是止咳药中的有效成分,也是青少年滥用的常见毒品之一。高剂量的DXM会导致快感甚至产生幻觉。长期食用DXM也可能导致抑郁症相关疾病。PO等[47]用70 ℃的热水提取得到的LBP减轻了DXM诱导的抑郁和社交焦虑相关行为和神经抑制现象。
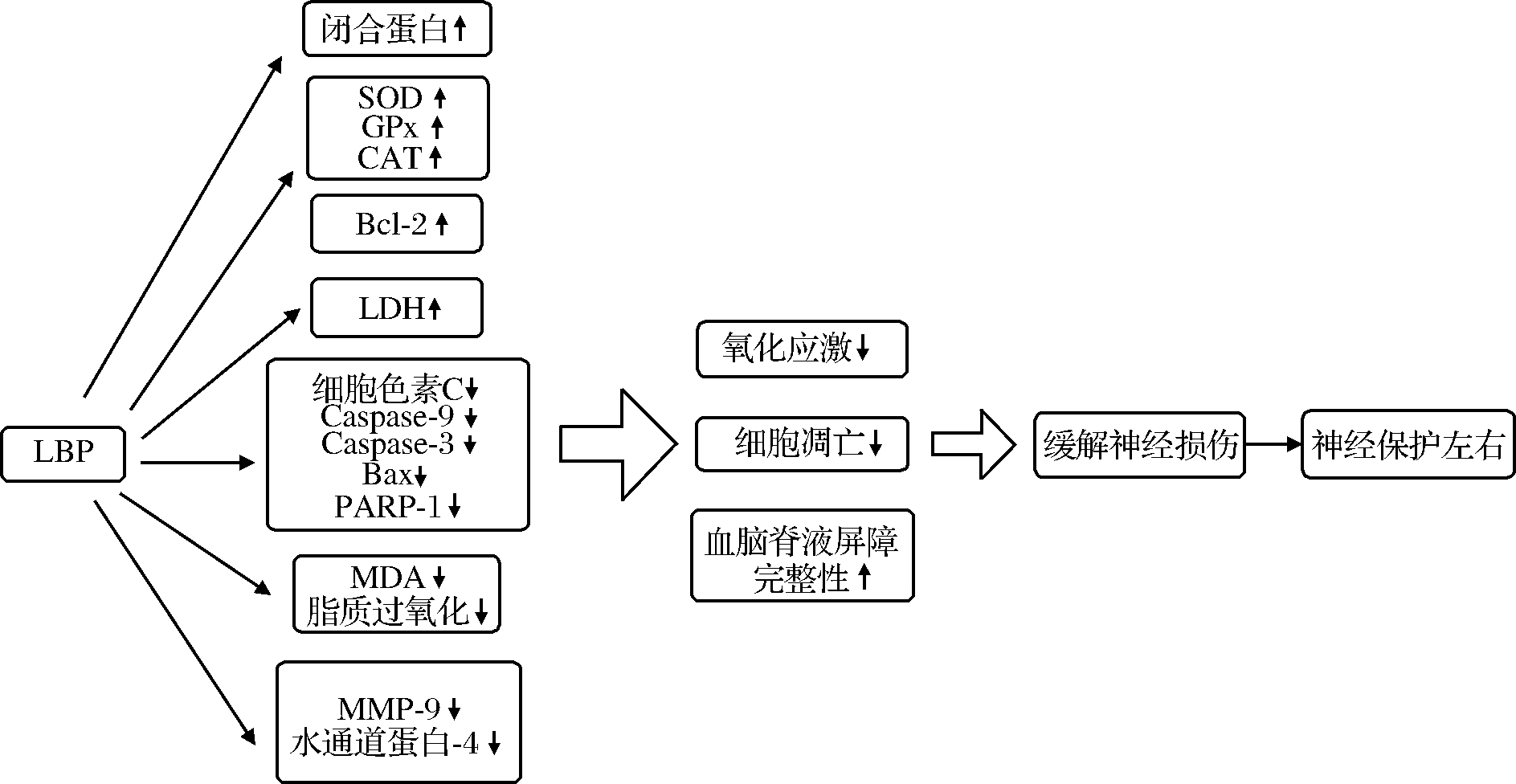
视网膜缺血是许多眼病的共同症状,缺血性损伤会导致视网膜功能障碍和神经元死亡。在YANG等[49]的研究中,C57BL/6N雄性小鼠先用PBS或LBP(1 mg/kg或10 mg/kg)给药7 d,随后对小鼠进行2 h的脑动脉(middle cerebral artery occlusion,MCAO)闭塞处理,对神经功能缺陷进行评估,结果表明,LBP处理显著改善了脑动脉闭塞诱导的神经功能缺损,减少了梗死面积、脑半球肿胀和含水量。这提示LBP可作为缺血性卒中高危患者的预防性神经保护药。此研究组进一步探究发现[49],在LBP处理的视网膜中观察到活细胞数量增加,以及蛋白质激酶C-α的增加和胶质纤维酸性蛋白的减少。研究结果表明每天摄入LBP可以有效减轻因局部缺血引起的视网膜功能障碍以及相关的神经元死亡和神经胶质细胞活化的减少。
4 展望
综上所述,由于具有多种生物活性,LBP作为保健食品具有广阔的开发前景。考虑到多糖的生物活性与其化学结构密切相关,而多糖的理化性质又很大程度取决于提取方式,枸杞多糖在生物活性方面的精准应用将是基于对某些特定结构组分的定向提取。然而,大多数对制备枸杞多糖的研究仅专注于提高得率,提取方法对枸杞多糖结构影响的研究甚少。此外,LBP中活性成分的精细结构未得到研究,构效关系尚不明确。
因此,日后的研究应着重建立枸杞多糖的提取方式、化学结构及生物活性三者之间的对应关系,让活性组分的提取具有可控性,可为高效利用枸杞多糖提供理论依据与实践参考。
参考文献
[1] JIN Mingliang, HUANG Qingsheng. Biological activities and potential health benefit effects of polysaccharides isolated from Lycium barbarum L [J]. International Journal of Biological Macromolecules, 2013, 54(1): 16-23.
[2] 如克亚·加帕尔,孙玉敬,钟烈州,等. 枸杞植物化学成分及其生物活性的研究进展[J]. 中国食品学报, 2013, 13(8): 161-172.
[3] POTTERAT O. Goji (Lycium barbarum and L. chinense): Phytochemistry, Pharmacology and Safety in the Perspective of Traditional Uses and Recent Popularity [J].Plamta Med,2010, 76(1): 7-19.
 B, GRAMZA M A. Goji Berry (Lycium barbarum): composition and health effects-a review[J]. Polish Journal of Food & Nutrition Sciences, 2016, 66(2): 67-76.
B, GRAMZA M A. Goji Berry (Lycium barbarum): composition and health effects-a review[J]. Polish Journal of Food & Nutrition Sciences, 2016, 66(2): 67-76.
[5] BROXTERMAN S E, SCHOLS H A. Interactions between pectin and cellulose in primary plant cell walls [J]. Carbohydr Polymers, 192: 263-272.
[6] DONG Jingzhou,WANG Zhicheng,WANG Ying.Rapid extraction of polysaccharides from fruits of Lycium barbarum L.[J].Journal of Food Biochemistry,2011,35(4):1 048-1 057.
[7] BAO Han, ZHENG Guoqi, QI Guoliang, et al. Cellular localization and levels of arabinogalactan proteins in Lycium barbarum’s fruit [J]. Pakistan Journal of Botany, 2016, 48(5): 1 951-1 963.
[8] ZHU Jing, LIU Wei, YU Juping, et al. Characterization and hypoglycemic effect of a polysaccharide extracted from the fruit of Lycium barbarum L.[J]. Carbohydrate Polymers, 2013, 98(1): 8-16.
[9] HUANG Chao, YAO Ruyu, ZHU Zhongkai, et al. A pectic polysaccharide from water decoction of Xinjiang Lycium barbarum fruit protects against intestinal endoplasmic reticulum stress [J]. International Journal of Biological Macromolecules, 2019, 130: 508-514.
[10] MUATASIM R, MA H, YANG Xue. Effect of multimode ultrasound assisted extraction on the yield of crude polysaccharides from Lycium barbarum (Goji) [J]. Food Science and Technology, 2018, 38: 160-166.
[11] YANG Rifu, ZHAO Chao, CHEN Xia, et al. Chemical properties and bioactivities of Goji (Lycium barbarum) polysaccharides extracted by different methods [J]. Journal of Functional Foods, 2015, 17: 903-909.
[12] ZHOU Lishuang, HUANG Lulin, YUE Han, et al. Structure analysis of a heteropolysaccharide from fruits of Lycium barbarum L. and anti-angiogenic activity of its sulfated derivative [J]. International Journal of Biological Macromolecules, 2018, 108: 47-55.
[13] ZHANG Jiao, JIA Shaoyi, LIU Yong, et al. Optimization of enzyme-assisted extraction of the Lycium barbarum polysaccharides using response surface methodology [J]. Carbohydrate Polymers, 2011, 86(2): 1 089-1 092.
[14] BUCHELI P, GAO Q T, REDGWELL R, et al. Biomolecular and Clinical Aspects of Chinese Wolfberry [M]. 2th ed. America: Herbal Medicine, 2011.
[15] FAN H P, MAZZA G, LIAO X. Purification, composition and antioxidant activity of polysaccharides from wolfberry, cherry, kiwi and cranberry fruits [J]. Croatian Journal of Food Science & Technology, 2010, 2(1): 9-17.
[16] YUAN Yunfei, WANG Yanbo, JIANG Yueming, et al. Structure identification of a polysaccharide purified from Lycium barbarium fruit[J]. International Journal of Biological Macromolecules, 2015, 82: 696.
[17] ZHAO Chao, YANG Rifu, QIU Taiqiu. Ultrasound-enhanced subcritical water extraction of polysaccharides from Lycium barbarum L [J]. Separation & Purification Technology, 2013, 120: 141-147.
[18] WU Dingtao, CHEONG K L, DENG Yong, et al. Characterization and comparison of polysaccharides from Lycium barbarum in China using saccharide mapping based on PACE and HPTLC [J]. Carbohydrate Polymers, 2015, 134: 12-19.
[19] LIU Yong, GONG Guili, ZHANG Jiao, et al. Response surface optimization of ultrasound-assisted enzymatic extraction polysaccharides from Lycium barbarum [J]. Carbohydrate Polymers, 2014, 110(38): 278-284.
[20] MASCI A,CARRADORI S,CASADEI M A,et al. Lycium barbarum polysaccharides:extraction,purification,structural characteriastion and evidence about hypoglycarmic and hypolildaemic effects:A review[J].Food Chemistry,2018,254:377-389.
[21] LIU Wei, LIU Yameng, ZHU Rui, et al. Structure characterization, chemical and enzymatic degradation, and chain conformation of an acidic polysaccharide from Lycium barbarum L.[J]. Carbohydrate Polymers, 2016, 147: 114-124.
[22] ZOU Shan, ZHANG Xian, YAO Wenbing, et al. Structure characterization and hypoglycemic activity of a polysaccharide isolated from the fruit of Lycium barbarum L.[J]. Carbohydrate Polymers. 2010, 80(4): 1 161-1 167.
[23] HUANG Linjuan, LIN Ying, TIAN Gengyuan, et al. Isolation, purification and physico-chemical properties of immunoactive constituents from the fruit of Lycium barbarum L.[J]. Acta Pharmaceutica Sinica, 1998, 33(7): 512-516.
[24] LIN Juanhuang, GENG Yuantian, GUO Zhengji. Structure Elucidation of glycan of glycoconjugate Lbgp3 isolated from the fruit of Lycium barbarum L.[J]. Journal of Asian Natural Products Research, 1999, 1(4): 259-267.
[25] PENG Xuemei, HUANG Linjuan, QI Chunhui, et al. Studies on chemistry and immuno-modulating mechanism of a glycoconjugate from Lycium barbarum L [J]. Chinese Journal of Chemistry, 2001, 19(12): 1 190-1 197.
[26] WANG Zhongfu,LIU Yang,SUN Yujiao,et al.Structural characterization of LaGP1 form Lycium barbarum L.[J].Food Chemistry,2014,159:137-142.
[27] 李越鲲,米佳,闫亚美,等.不同产地宁夏枸杞主要化学成分分析[J].食品工业科技,2017, 38 (21): 286-288.
[28] 李重.土壤和采收季节对三个产地宁夏枸杞活性成分的影响[D]. 福州:福建农林大学, 2016.
[29] TANG Huali, CHEN Chen, WANG Shaokang, et al. Biochemical analysis and hypoglycemic activity of a polysaccharide isolated from the fruit of Lycium barbarum L [J]. International Journal of Biological Macromolecules, 2015, 77: 235-242.
[30] REDGWELL R J, CURTI D, WANG J K, et al. Cell wall polysaccharides of Chinese Wolfberry (Lycium barbarum): Part 2. Characterisation of arabinogalactan-proteins [J]. Carbohydrate Polymers, 2011, 84(3): 1 075-1 083.
[31] 齐春会,黄琳娟,张永详,等.枸杞糖缀合物及糖链的化学结构与免疫活性[J].中国药理与毒理学杂志,2001,15(3):185-190.
[32] PENG Xuemei, TIAN Gengyuan. Structural characterization of the glycan part of glycoconjugate LbGp2 from Lycium barbarum L.[J]. Carbohydr Res,2001, 331(1): 95-99.
[33] LIANG Bin, JIN Minglin, LIU Hongbo. Water-soluble polysaccharide from dried Lycium barbarum fruits: Isolation, structural features and antioxidant activity [J]. Carohydr Ploym,2011,83(4): 1 947-1 951.
[34] CAO Shumei, DU Jianlong, HEI Qiaohong. Lycium barbarum polysaccharide protects against neurotoxicity via the Nrf2-HO-1 pathway [J]. Experimental & Therapeutic Medicine, 2017, 14(5): 4 919-4 927.
[35] YANG Dongmei, ZHANG Jingqin, FEI Yifei. Lycium barbarum polysaccharide attenuates chemotherapy-induced ovarian injury by reducing oxidative stress: LBP attenuates ovarian injury [J]. The Journal of Obstetrics and Gynaecology Research, 2017, 43(10): 1 621-1 628.
[36] AMAGASE H, SUN Buxiang, BOREK C. Lycium barbarum (GOJI) juice improves in vivo antioxidant biomarkers in serum of healthy adults [J]. Nutrition Research, 2009, 29(1): 19-25.
[37] BOKANG C, SU L, LIN X J, et al. Effects of Lycium barbarum aqueous and ethanol extracts on high-fat-diet induced oxidative stress in rat liver tissue [J]. Molecules, 2011, 16(11): 9 116-9 128.
[38] JIN Mingliang, LU Zeqing, HUANG Ming, et al. Sulfated modification and antioxidant activity of exopolysaccahrides produced by enterobacter cloacae Z0206 [J]. International Journal of Biological Macromolecules, 2011, 48(4): 607-612.
[39] CHEN Z S, TAN B K, CHAN S H. Activation of T lymphocytes by polysaccharide-protein complex from Lycium barbarum L.[J]. International Immunopharmacology, 2008, 8(12): 1 663-1 671.
[40] CHEN Jingrui, LI Enqing, DAI Congqi, et al. The inducible effect of LBP on maturation of dendritic cells and the related immune signaling pathways in hepatocellular carcinoma (HCC) [J]. Current Drug Delivery, 2012, 9(4):414-420.
[41] KE Mang, ZHANG Xianjun, HAN Zihua, et al. Extraction, purification of Lycium barbarum polysaccharides and bioactivity of purified fraction [J]. Carbohydrate Polymers, 2011, 86(1): 136-141.
[42] MAO Fang, XIAO Bingxiu, JIANG Zhen, et al. Anticancer effect ofLycium barbarumpolysaccharides on colon cancer cells involves G0/G1 phase arrest [J]. Medical Oncology, 2011, 28(1): 121-126.
[43] LI G, SEPKOVIC D W, BRADLOW H L, et al. Lycium barbarum inhibits growth of estrogen receptor positive human breast cancer cells by favorably altering estradiol metabolism[J]. Nutrition and Cancer-an International Journal, 2009, 61(3): 408-414.
[44] ZHANG Min, TANG Xiuli, WANG Fang, et al. Characterization of Lycium barbarum polysaccharide and its effect on human hepatoma cells [J]. International Journal of Biological Macromolecules, 2013, 61: 270-275.
[45] SHI Zhongshan, ZHU Lihui, LI Tingting, et al. Neuroprotective mechanisms of Lycium barbarum polysaccharides against ischemic insults by regulating NR2B and NR2A containing NMDA receptor signaling pathways[J]. Frontiers in Cellular Neuroscience, 2017, 11: 288.
[46] HO Y S, YU M S, YIK S Y, et al. Polysaccharides from wolfberry antagonizes glutamate excitotoxicity in rat cortical neurons[J]. Cellular and Molecular Neurobiology, 2009,29(8): 1 233-1 244.
[47] PO KAITING, LEUNG J W, CHAN J N, et al. Protective effect of Lycium barbarum polysaccharides on dextromethorphan-induced mood impairment and neurogenesis suppression [J]. Brain Research Bulletin, 134: 10-17.
[48] YANG D, LI S Y, YEUNG C M, et al. Lycium barbarum extracts protect the brain from blood-brain barrier disruption and cerebral edema in experimental stroke [J]. Plos One, 2012, 7(3): e33 596.
[49] YANG DING, SO K F,LO A C. Lycium barbarum polysaccharides extracts preserve retinal function and attenuate inner retinal neuronal damage in a mouse model of transient retinal ischemia [J]. Clinical & Experimental Ophthalmology, 2017, 45(7): 717-729.