羧甲基茯苓多糖(carboxymethylpachyman,CMP)是一种将茯苓聚糖的多糖链进行羧甲基化修饰后得到的具有抗氧化[1-2]、抗肿瘤[3-6]与增强免疫调节[7-9]等多种生物功能的水溶性多糖[10]。目前获取羧甲基茯苓多糖的方法多是依据液固相振荡半合成法和液固相不振荡半合成法这两种化学修饰法制备或对其进行优化[11-15]。但是均存在化学药剂残留、环境污染等问题,不适于绿色生产[16-17]。
王海波等在发酵培养基中添加羧甲基纤维素制备改性细菌纤维素,用红外光谱对其表征,结果显示改性细菌纤维素中存在明显的羧甲基特征吸收峰[18]。本课题组前期通过向茯苓液体发酵培养基中添加羧甲基纤维素,经茯苓发酵制备出羧甲基茯苓多糖[17,19]。该法成本低、转化条件温和、转化过程绿色自然,并且能够借助发酵过程研究进一步放大[20-21]。
采用数学模型来定量地描述在发酵过程中的菌体浓度、生成物浓度和底物浓度等主要的代谢指标的变化规律,例如,Logistic模型[22]、Sigmoid模型[23]、SGompertz模型或DoseResp模型[24],从而为多糖的发酵过程的优化控制、小罐实验数据的放大提供理论基础。另外,一个模型的可靠性评价不能只依赖于回归分析中的相关系数,即相关系数越接近1越准,还应该用其他的统计学方法作为模型拟合时的可靠性分析[25]。
在目前的研究中,对于羧甲基茯苓多糖动力学方面尚未有相关文献报道,本研究以茯苓为发酵菌株,在添加了1%的羧甲基纤维素的液体发酵培养基中进行改性发酵,对发酵过程中主要理化指标测定,采用Logistic模型、Sigmoid模型、SGompertz模型以及DoseResp模型对茯苓发酵过程中菌丝体生长、胞内羧甲基茯苓多糖生成、底物(还原糖)消耗情况进行拟合,并对模型进行可靠性评价,得到最适的拟合模型的方程,从而为羧甲基茯苓多糖进一步实现工业化生产提供理论基础。
1.1.1 材料与试剂
茯苓(Poria cocos)Z1,由湖北中医药研究院王克勤研究员惠赠;玉米粉,市售食品,生产于北京密云;麸皮,市售食品,生产于河南郑州;羧甲基纤维素(carboxymethyl cellulose,CMC),取代度为0.7,分析纯,山东西亚化学股份有限公司;葡萄糖、浓H2SO4,分析纯,国药集团;KH2PO4、酒石酸钾钠、无水乙醇,分析纯,天津博迪化工股份有限公司;3,5-二硝基水杨酸,分析纯,成都科龙化工试剂厂。
1.1.2 仪器与设备
BL-220H电子天平,日本SHIMADZU公司;LDZX-50KBS高压蒸汽灭菌锅,上海申安医疗器械厂;SW-CJ-1FD超净工作台,苏州净化设备有限公司;GNP-9080恒温培养箱,上海精宏实验设备有限公司;MQT-60恒温摇床,上海旻泉仪器有限公司;PHS-3CpH计,上海理达仪器厂。
1.1.3 培养基
马铃薯葡萄糖培养基(potato dextrose agar, PDA)(g/L):土豆200、葡萄糖20、琼脂20[26],用于菌种活化;
种子培养基(g/L):葡萄糖3、蛋白胨1、KH2PO4 0.1、MgSO4 0.05、CaCl2 0.008、MnSO40.006、VB10.02、柠檬酸铁铵0.000 5[27];
发酵培养基(g/L):葡萄糖30、玉米粉40、麸皮60、(NH4)2SO4 2、MgSO4·7H2O 0.5、KH2PO4 1、pH 5.5[28],另外添加CMC 10[17]。
1.2.1 发酵培养
将茯苓Z1菌种从斜面挑起1块至PDA培养基平板中央,置于27 ℃恒温培养箱中培养4 d,作为活化固体菌种;将活化的茯苓固体种的菌丝外缘打孔,使成直径为0.672 cm小块,挑起4块菌种接入到装有60 mL液体种子培养基的250 mL的三角瓶中,然后置于27 ℃、120 r/min的摇床中培养7 d;将茯苓液体种子按6%的接种量转入到装有60 mL液体发酵培养基的250 mL的三角瓶中,然后置于27 ℃、150 r/min的摇床中培养,设3个重复。
1.2.2 检测方法
每隔1 d测1次指标,每次都在固定时间取样并按照相应的检测方法检测不同时间各个理化指标数值,每个检测重复3个平行,求其平均值。以发酵时间为横坐标,各个理化指标为纵坐标,利用Origin 8.0软件绘制各理化指标随时间的曲线图。
1.2.2.1 菌丝体生物量的测定
将发酵液用3层纱布过滤得到菌丝球,并用流水冲洗3次,将收集的菌丝球置于烘至恒重的培养皿(培养皿的质量为m1)中于60 ℃烘干,取出置于干燥器中,待冷却至室温下称重得m2,菌丝生物量 m=m2-m1。
1.2.2.2 多糖含量的测定
将烘干的茯苓菌丝体研磨成粉末,称取0.5 g加入100 mL蒸馏水,沸水浴3 h后抽滤、收集滤液,将滤渣分别重复沸水浴2、1 h后合并滤液,60 ℃旋蒸后定容至100 mL。取1 mL用苯酚-硫酸法测定多糖含量[29]。
1.2.2.3 还原糖含量的测定
采用3.5-二硝基水杨酸法测定发酵液中还原糖的含量[30]。
1.2.2.4 pH的测定
采用pH计测定发酵液中pH值。
每组试验重复3次,采用Origin8.0软件进行作图分析,选取合适的模型对茯苓生物量、胞内羧甲基茯苓多糖生成、还原糖的消耗数据进行非线性拟合,并用相关系数R2、均方误差(mean square error,MSE)和准确因子(accuracy factor,AF)、偏差因子(Bias factor,BF)作为可靠性评价标准筛选出最合适的模型进行定量描述[31-33],如公式(1)~公式(3)所示:
(1)
(2)
(3)
式中:VO,试验观测值;Vp,模型所得出的预测值;n,次数。
由图1所示,茯苓在0~96 h为快速生长期,随后进入稳定期,168 h后进入衰亡期,发酵结束。茯苓在0~96 h消耗葡萄糖的速度迅速增加,随后逐渐降低,在发酵第168 h时,发酵液中葡萄糖浓度为4.908 g/L,在第216 h时,发酵液中残余的葡萄糖浓度为0.890 5 g/L。茯苓在发酵时间为0~96 h生长速度迅速,在发酵第168 h时,生物量达到最大值,其生物量干重为11.425 6 g/L。胞内茯苓多糖在24~96 h内最快,并在第96 h时,多糖含量为1.459 1 g/L,在96 h后积累缓慢,在发酵第192 h时,多糖含量达到1.527 3 g/L。发酵液的pH在0~96 h内逐渐降低,在发酵96~192 h时,逐渐平缓,但第192 h后,在衰亡期稍有浮动。
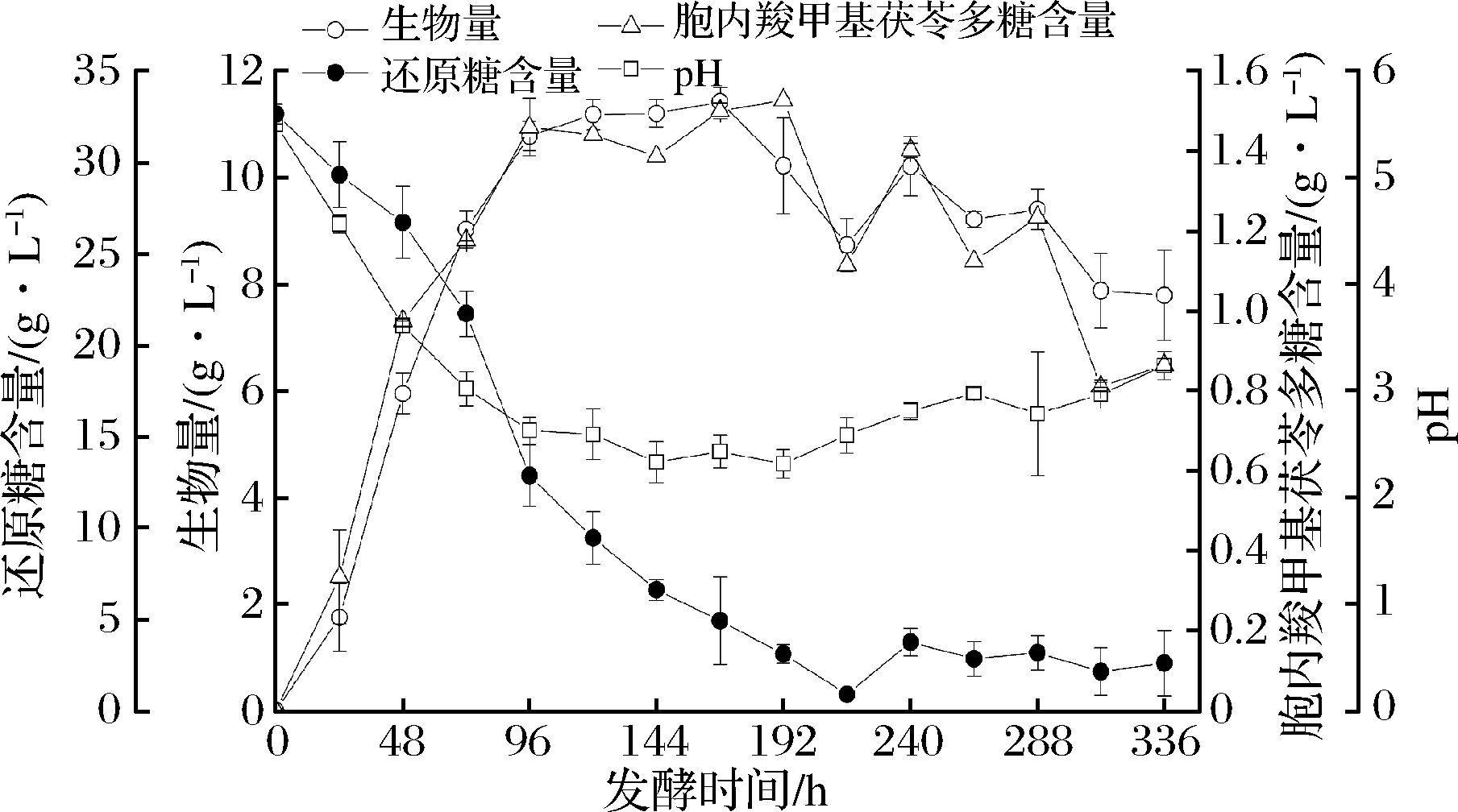
图1 茯苓发酵过程中各理化指标的变化
Fig.1 The changes of physicochemical indexes during P. cocos fermentation process
2.2.1 茯苓生长动力学模型
图1可知,由于茯苓在168 h后进入衰亡期,而在0~168 h时茯苓处于生长期和稳定期,故本研究拟对发酵0~168 h时期茯苓生长情况进行非线性拟合。采用模型Logistic模型、Sigmoid模型和SGompertz模型对茯苓生长情况进行非线性拟合,由表1可知,3个模型偏差因子BF均在0.90~1.05,即3个模型都能够很好地预测茯苓的生长状况,而由相关系数R2和准确因子AF更接近于1更好预测,均方误差MSE越小越好,可得SGompertz模型相比其他2个模型更适合用于对胞内羧甲基茯苓多糖发酵过程茯苓的生长情况进行定量描述。拟合曲线如图2 所示。
表1 茯苓生长拟合方程及其评价
Table 1 Fitting equation of P. cocos and its evaluation

选择模型拟合方程R2MSEAFBFLogisticx(t)=11.853 0-11.760 11+t47.338 9()2.840 10.997 40.027 51.024 90.989 7Sigmoidx(t)=11.335-12.280 61+et-44.77817.4230.998 60.015 11.020 81.008 7SGompertzx(t)=11.449×e-e-0.044 3×(t-38.418)0.999 30.0091.0080.998 3
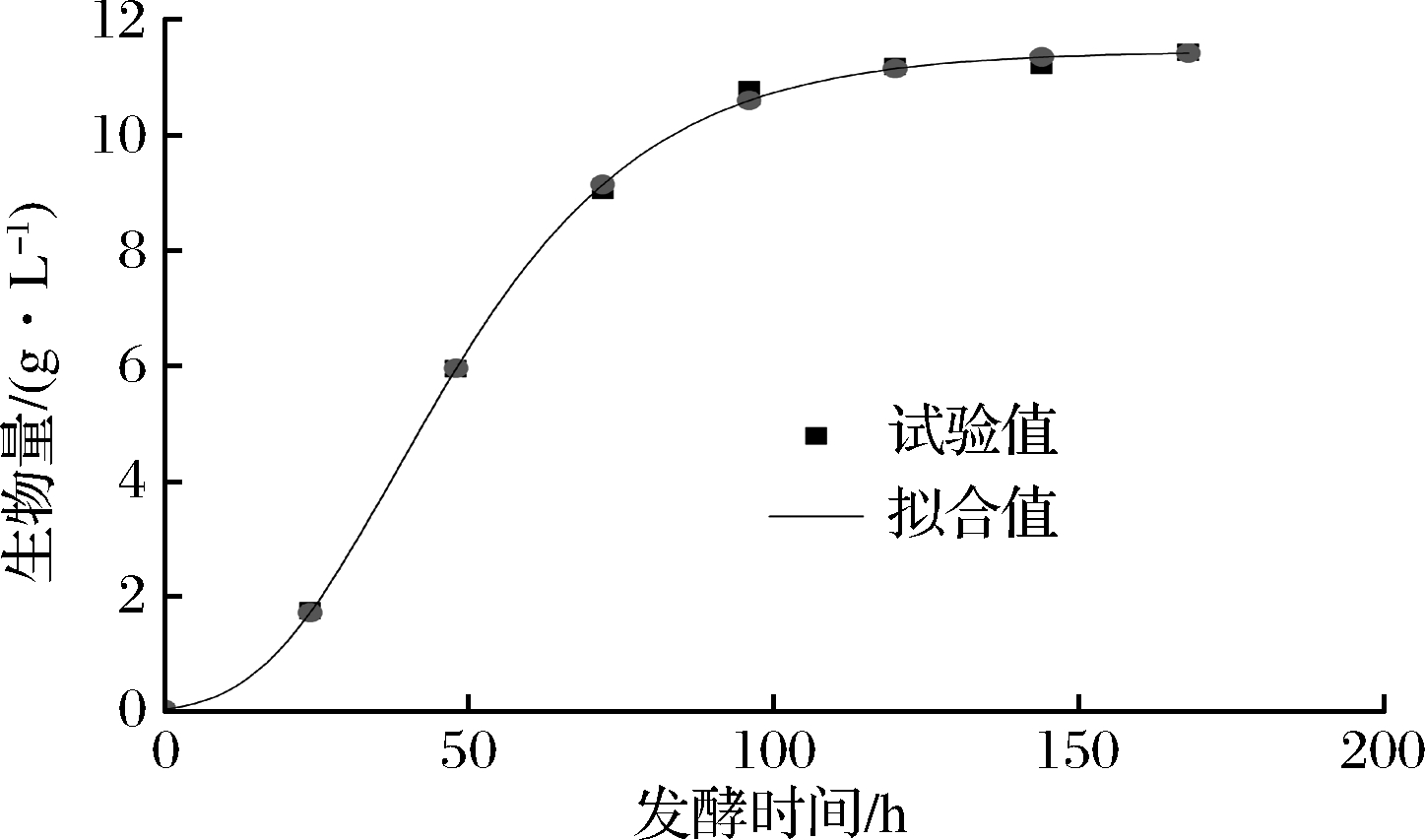
图2 茯苓发酵过程中的生长拟合曲线
Fig.2 The growth fitting curve of during P.cocos fermentation process
2.2.2 胞内羧甲基茯苓多糖生成动力学模型
由表2可得,3种模型对胞内羧甲基茯苓多糖生成情况拟合,其相关系数R2均为0.98左右,而偏差因子BF均在0.90~1.05,说明3种模型均能很好预测胞内羧甲基茯苓多糖的生成状况,由于Logistic模型的准确因子AF更接近于1,均方误差MSE更小,所以选用Logistic模型对胞内羧甲基茯苓多糖发酵过程中的生成情况进行定量描述。拟合曲线如图3所示。
表2 胞内羧甲基茯苓多糖的生成拟合方程及其评价
Table 2 Fitting equation of intracellular carboxymethylpachyman and its evaluation

选择模型拟合方程R2MSEAFBFLogisticx(t)=1.508 3-1.509 51+t38.878 5()2.560 60.985 20.002 41.029 71.001 6Sigmoidx(t)=1.452 1-1.673 71+et-34.788 317.883 60.9820.002 91.046 51.009 4SGompertzx(t)=1.456×e-e-0.048×(t-31.45)0.987 20.002 61.0361.003 2

图3 茯苓发酵过程中胞内羧甲基茯苓多糖生成拟合曲线
Fig.3 The fitting curve of intracellular carboxymethylpachyman formation during P. cocos fermentation process
2.2.3 底物(还原糖)消耗动力学模型
由表3可知,3种模型的偏差因子BF均在0.90~1.05,说明3种模型均能很好地预测还原糖的消耗状况,虽然Logistic模型的准确因子AF小于其他模型,但是其相关系数R2小于其他模型并且其均方误差MSE偏大,而Sigmoid模型和DoseResp模型经验证得到的参数一样,所以Sigmoid模型和DoseResp模型均可以用于定量描述发酵过程中还原糖的消耗情况。其拟合曲线分别如图4、图5。
由图6可知,在限制性条件下发酵的茯苓菌体生长的初期受发酵液底物高浓度抑制或菌体生长速度较慢,随后菌体生长加快,当茯苓菌体生长的比生长速率达到最大比生长速率后会逐渐降低甚至菌体停止生长,即茯苓的菌体比生长速率呈现一个“钟”形曲线,表示每小时单位质量的菌体所增加的菌体量[34]。另外微生物产物生成的动力学模型从产物与菌体细胞生长的方面可以划分为3种:1类为生长偶联型,即产物生成与菌体细胞生长有紧密联系;第2类是部分生长偶联型,即产物的生成伴随菌体细胞生长,但其生成速率与菌体生长速率部分偶联,还与菌体积累量有关;第3类是非生长偶联型,即产物合成与菌体细胞生长无直接关系,产物的生成速率只与已有的菌体生物量有关[35]。根据图6可知,胞内羧甲基茯苓多糖的生成与菌体生长呈紧密的直接联系,即为生长偶联型。根据图1,茯苓在0~96 h为快速生长期,随后进入稳定期,168 h后进入衰亡期,发酵结束。结合图6中葡萄糖比消耗速率曲线可知,茯苓在生长稳定期,其葡萄糖的比消耗速率是变化的。
表3 还原糖消耗的拟合方程及其评价
Table 3 Fitting equation of reducing sugar consumption and its evaluation

选择模型拟合方程R2MSEAFBFLogisticx(t)=1.341 9+29.9891+t86.4444()3.07350.985 70.853 81.037 60.999 1Sigmoidx(t)=4.402 9+28.74111+et-78.82724.7460.991 60502 3 1.0421.001 1DoseRespx(t)=4.402 9+28.74111+1078.8280-t()-0.01760.991 60.502 31.0421.001 1
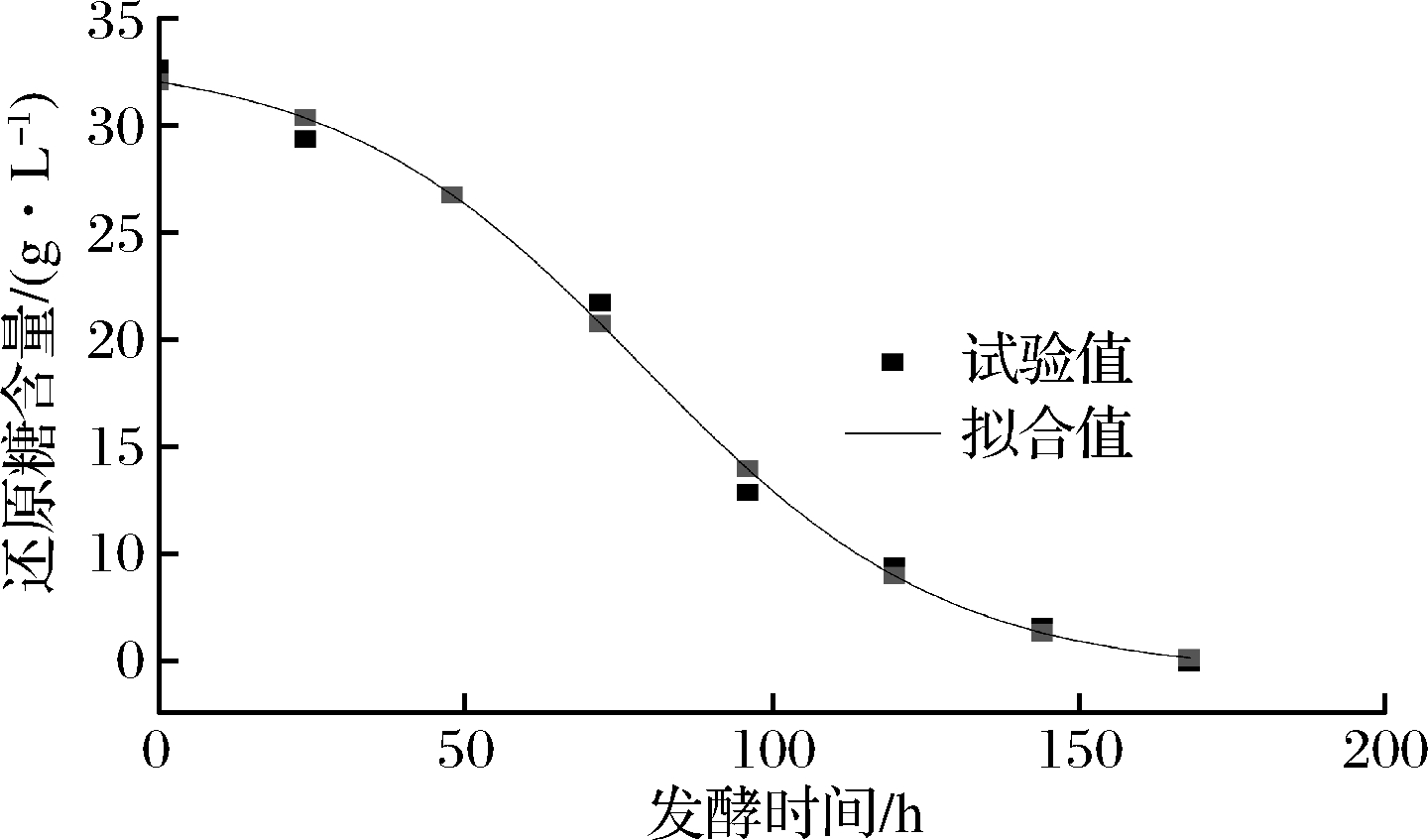
图4 Sigmoid模型还原糖消耗拟合曲线
Fig.4 The fitting curve of reducing sugar consumption in Sigmoid model
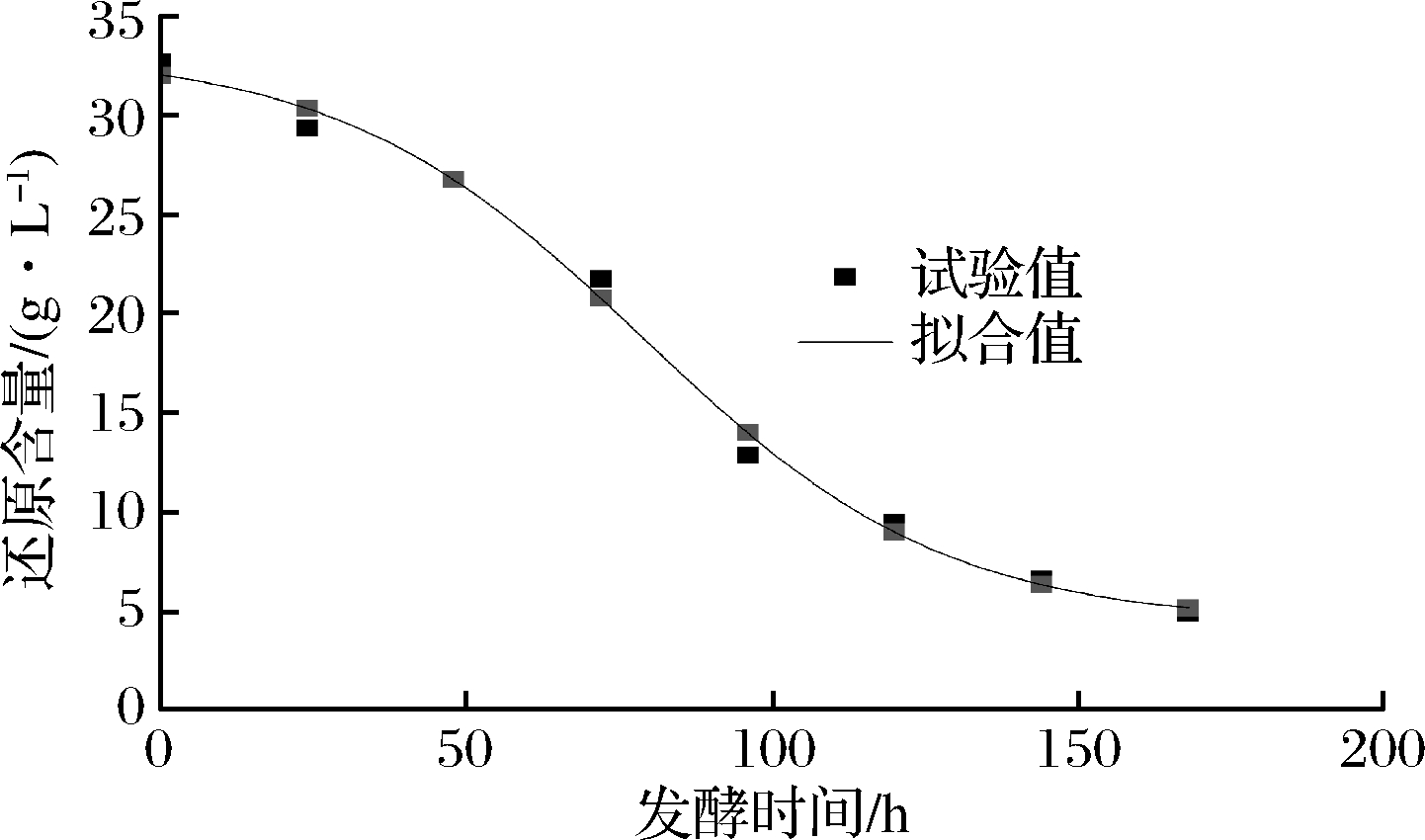
图5 DoseResp模型还原糖消耗拟合曲线
Fig.5 The fitting curve of reducing sugar consumption in DoseResp model
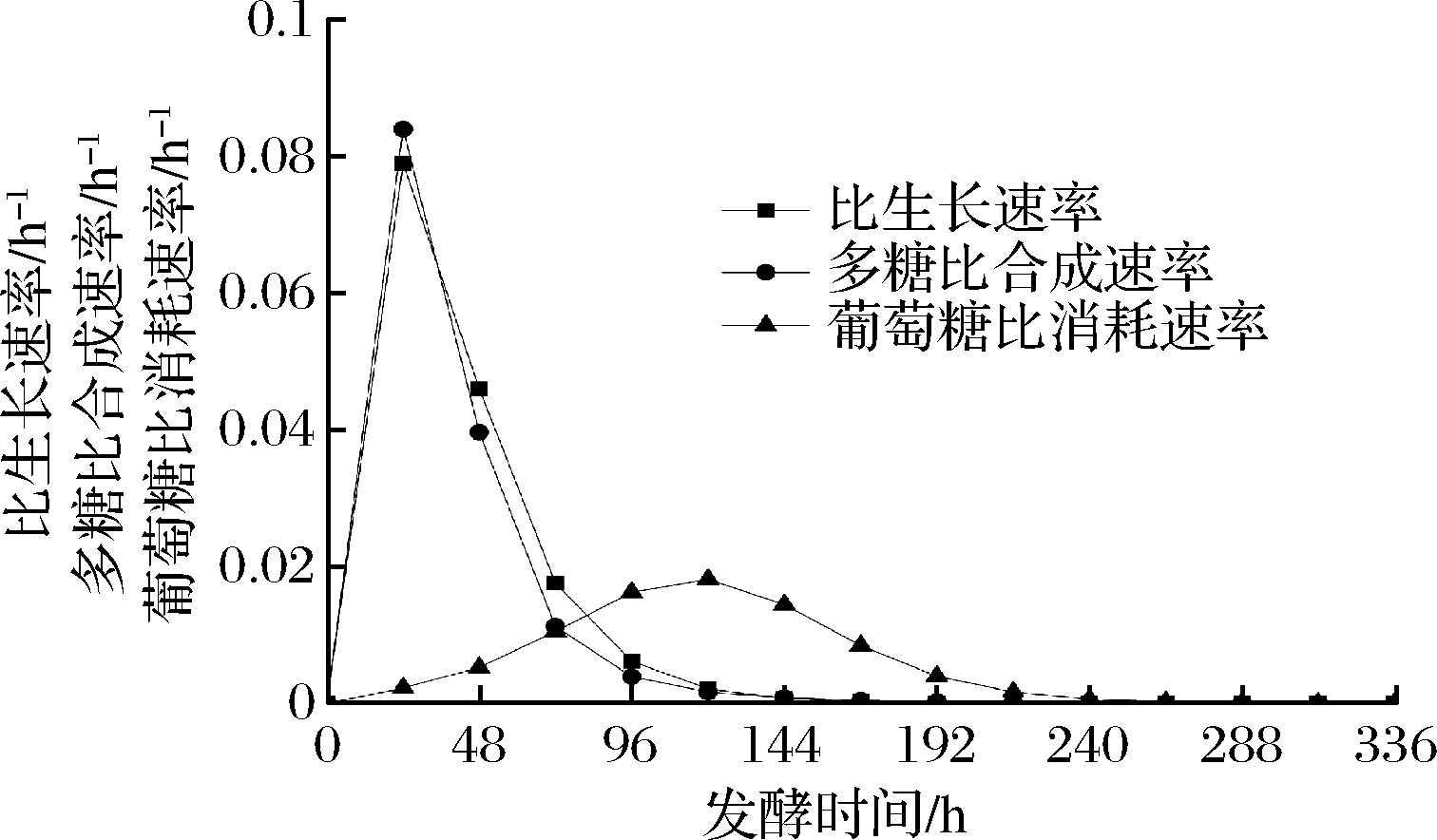
图6 茯苓发酵过程中比生长速率、多糖比合成速率、葡萄糖比消耗速率随时间的变化曲线
Fig.6 The variation curves of specific growth rate, polysaccharide production rate and specific glucose consumption rate with time during P. cocos fermentation process
目前利用茯苓发酵制备羧甲基茯苓多糖的发酵动力学研究还未见文献报道,本文通过Logistic模型、Sigmoid模型、SGompertz模型以及DoseResp模型能够较好地对茯苓生长、胞内羧甲基茯苓多糖生成和还原糖消耗进行非线性拟合,并采用均方误差(MSE)、准确因子(AF)和偏差因子(BF)对拟合模型进行可靠性评价,所选模型能够较好地描述胞内羧甲基茯苓多糖的发酵过程的动力学特征,从而为羧甲基茯苓多糖进一步实现工业化生产提供理论基础。
通过对比生长速率、比合成速率与比消耗速率研究,茯苓的比生长速率、胞内羧甲基茯苓多糖的比合成速率在整个发酵过程中随时间的变化趋势与联系,可知胞内羧甲基茯苓多糖的生成与菌体生长是生长偶联型的。
[1] 熊芳琪,刘欣,杨岚,等.羧甲基茯苓多糖体外抗氧化活性研究[J].中国食物与营养,2017,23(7):39-41.
[2] 程水明,刘莹,梅光明,等.羧甲基茯苓多糖的抗氧化活性研究[J].食品研究与开发,2013,34(3):1-5.
[3] WANG Y J,MO Q,LI Z,et al.Effects of degree of carboxymethylation on physicochemical and biological properties of pachyman[J].International Journal of Biological Macromolecules,2012,51(5):1 052-1 056.
[4] 马玲,尹蕾,王兵,等.茯苓研究进展[J].亚太传统医药,2015,11(12):55-59.
[5] 陈继岩.羧甲基茯苓多糖抗乙型肝炎病毒的体内与体外研究[J].中国生化药物杂志,2015,35(2):66-70.
[6] 何丽丽.羧甲基茯苓多糖的制备及生物活性研究[D].武汉:武汉轻工大学,2015.
[7] 林标声,陈小红,罗茂春.高取代度羧甲基茯苓多糖(CMP)的制备及其注射剂的研制[J].中国农学通报,2015,31(29):59-64.
[8] 廖海锋,邓向亮,罗霞,等.羧甲基茯苓多糖对巨噬细胞极化的影响[J].中国实验方剂学杂志,2016,22(13):122-126.
[9] WYNN T A,CHAWLA A,POLLARD J.Macrophage biology in development,homeostasis and disease[J].Nature,2013,496(7 446):445-455.
[10] 申林卉,刘丽侠,陈冠,等.多糖化学结构修饰方法的研究进展[J].药物评价研究,2013,36(6):465-468.
[11] HAMURA J, YAMASHITA Y, OHSAKA Y, et al.Carboxymethyl-pachymaran,a newwater soluble polysaccharide withmarked antitumor activity[J].Nature,1971,233(5 320):486-488.
[12] 陈春霞.羧甲基茯苓多糖(CMP)的制取及鉴定[J].食用菌学报,1996,3(3):31-36.
[13] 朱卫平.茯苓低聚糖的制备及其生理活性研究[D].广州:华南理工大学,2011.
[14] 李外,赵雄虎,季一辉,等.羧甲基纤维素制备方法及其生产工艺研究进展[J].石油化工,2013,42(6):693-702.
[15] 李健,刘雅南,刘宁,等.羧甲基纤维素的制备研究及应用现状[J].食品工业科技,2014,35(8):379-382.
[16] 胡国元,李伟伟,袁军,等.茯苓多糖的修饰技术及其构效关系研究进展[J].林产化学与工业,2013,33(5): 121-126.
[17] 陈默.发酵法制备羧甲基茯苓多糖的研究[D].武汉:武汉工程大学,2014.
[18] 王海波,关凤梅,马霞,等.改性细菌纤维素的发酵生产及性能测定[J].食品科技,2009,34(5):29-31.
[19] 胡国元,陈默,李伟伟,等.一种羧甲基茯苓多糖的制备方法:中国,201310466107.0[P].2014-01-01.
[20] 廖彦.茯苓多糖的液体发酵及抗氧化研究[D].长沙:湖南中医药大学,2017.
[21] 王荣荣,姜兴旭,陈龙,等.茶酒发酵动力学研究[J].食品研究与开发,2019,40(15):91-96.
[22] 王天娇,唐传红,张劲松,等.灵芝杂交菌株选育及其菌丝体液态深层发酵动力学[J].食品与发酵工业,2014,40(3):107-112.
[23] 徐鹏,钱竹,董亮,等.灵芝深层发酵生产胞外多糖和灵芝酸的动力学分析[J].应用于环境生物学报, 2008,14 (4):562-565.
[24] 陈永浩.透明质酸发酵法制备及其复合改性研究[D].无锡:江南大学,2010.
[25] 张怀强,金建玲,刘波,等.构建限制性条件下微生物群体生长模型时的问题[J].应用于环境生物学报,2005,11(5):595-599.
[26] 王伟霞,李福后,陈立国.茯苓菌丝体液体培养条件的研究[J].食用菌,2006,28(2):6-8.
[27] 薛正莲,欧阳明,王岚岚.茯苓菌液体培养条件的优化及其多糖的提取[J].工业微生物,2006,36(2):44-47.
[28] 李慧,常景玲.茯苓多糖发酵工艺的优化[J].安徽农业科学,2006,34(5):920-921.
[29] 李羿,万德光,刘忠荣,等.发酵茯苓菌丝体和天然茯苓多糖的研究[J].天然产物研究与开发,2006,18(4):667-669;673.
[30] 余志坚,陈传红,赵晋宇.DNS法检测食用菌多糖含量条件优化研究[J].江苏农业科学,2012,40(1):259-260.
[31] 王晓玲,周广乙,刘高强.蛹虫草多糖和D-甘露醇深层发酵的非结构动力学模型[J].菌物学报,2016,35(10):1 250-1 257.
[32] 袁逢春,苏罗毅,李庆华,等.初烤烟叶霉变率随时间变化的SPSS曲线拟合分析[J].西南农业学报,2014,27(3):1 130-1 135.
[33] 代志凯,印遇龙,阮征.微生物发酵动力学模型及其参数拟合的软件实现[J].计算机与应用化学,2011,28(4):437-441.
[34] 宋健,林建群,金燕,等.以比生长速率时间曲线为基础的生物群体生长数学模型[J].微生物学通报,2007,34(5):836-838.
[35] 黄瑞杰,蓝平,钟磊,等.圆弧青霉发酵右旋糖酐酶过程动力学模型的建立[J].食品与发酵工程,2019,45(14):57-62.