大豆分离蛋白(soybean protein isolate,SPI)是许多食品配方中的重要成分,其氨基酸组成和比例平衡且合理,可以与动物蛋白相媲美,能够替代和拓展动物蛋白在食品体系中的功能作用[1]。为了满足工业上对专用功能型大豆分离蛋白的需求,常采用改性的手段来显著改善大豆分离蛋白的某一功能特性。糖基化改性是通过美拉德反应与糖进行接枝改性,这种改性方式不需要催化剂,安全可靠。KATO等[2]在1988年研究表明了乳清蛋白的功能性质可以通过与葡聚糖的糖基化反应得到改善,从此利用蛋白质的糖基化改性提高功能性特性逐渐成为人们研究的热点[3-12]。
葫芦巴是一种生长在北非,地中海,西亚,北印度并且现在在加拿大也培育的豆科植物。葫芦巴胶(fenugreek gum,FG)是一种半乳甘露聚糖,具有很好的表面活性,可以作为一种有效的水包油乳化液的稳定剂[13]。在11种商业用胶和5种实验室制备胶中葫芦巴胶在水包油乳状液模型系统中表现出最好的稳定性[14]。KASRAN等[15]研究了大豆乳清分离蛋白与葫芦巴胶在干热的条件下进行美拉德共价交联反应,使乳化特性得到提高。但采用干法进行糖基化改性普遍存在耗时长、能耗大、不适合工业生产等缺点。本文利用微波辅助大豆分离蛋白与葫芦巴胶的糖基化反应,通过微波作用使大豆分离蛋白结构变得更加松散,使内部包埋的基团暴露,加快糖基化反应的进程,大大缩短了糖基化反应的时间。该文研究了不同的微波时间、大豆分离蛋白与葫芦巴胶的质量比、糖基化反应时间、反应温度对大豆分离蛋白乳化性的影响,通过响应面法优化出最佳改性条件,考察了结合物乳化性的变化,使大豆分离蛋白能够更好地应用在工业生产之中。
大豆分离蛋白,河南万邦实业有限公司;葫芦巴胶,中凯食品配制有限公司;十二烷基磺酸钠,天津市科密欧化学试剂有限公司;大豆油,九三集团非转基因大豆油;Na2HPO4和Na2HPO4,长春化学试剂厂;KBr,天津市博迪化工有限公司;所有试剂均为分析纯。
海尔微波炉(MK-2485MG),青岛海尔微波制品有限公司;高速分散机(T18),德国IKA公司;紫外可见分光光度计(UV-5100),上海元析仪器有限公司;冷冻干燥机(FD5),美国SIM公司。
1.3.1 微波辅助糖基化SPI的乳化液制备
将SPI与FG以一定的质量比均匀混合后,用水溶解调至6%,利用功率为850 W的微波炉进行辐射加热,为了防止升温过快, 采用间歇式加热, 即微波辐射3 min,冰浴3 min,使温度降下来并停止反应,再进行微波辐射[16];微波处理一定时间后于-20 ℃保存再冷冻干燥。将干燥后的粉状物放置在底部含有饱和NaCl溶液的干燥器内进行反应,保持温度60 ℃,相对湿度75%[15]。
1.3.2 大豆分离蛋白乳化性的测定[17]
用0.2 mol/L pH 7.0的磷酸盐缓冲溶液配制1 mg/mL大豆分离蛋白溶液,取30 mL样品,加入10 mL大豆油以转速为10 000 r/min在室温下均质1 min形成均匀的乳化液然后静置。分别在静置后的第0 min和第10 min从乳化液底部吸取100 μL,用5 mL 0.1%的十二烷基磺酸钠(SDS)稀释,在500 nm条件下测定吸光值。乳化活性(EA)用0 min的样品吸光值A0表示,乳化稳定性(ES)用乳化稳定指数(ESI)表示为A0×Δt/ΔA,其中Δt为时间差10 min,ΔA为Δt内的吸光值之差。
1.3.3 糖基化程度的测定
参考LERTITTIKULA等[18]的方法测定糖基化程度。将125 μL改性SPI溶液加入pH 8.2的2 mL 0.21 mol/L的磷酸盐缓冲溶液中,与1 mL 0.01%的2,4,6-三硝基苯磺酸溶液混匀并充分振荡,置于50 ℃水浴中避光反应1 h,再将2 mL 0.1 mol/L Na2SO3溶液置于反应液中,在室温下冷却30 min,在420 nm处测定吸光度At。然后在上述溶液中加入125 μL未经水浴加热的SPI溶液作为空白对照,于420 nm处测定其吸光度A0,根据公式(1)计算糖基化程度:
糖基化程度![]()
(1)
式中:A0表示未经改性SPI吸光度;At表示改性SPI吸光度。
1.3.4 改性产物的表征
1.3.4.1 红外光谱分析[19]
改性前后的样品分别准确称取10 mg,将一定量的KBr加入其中,研磨成均匀粉末后,压制成薄片,并用傅里叶变换红外光谱仪测试。
1.3.4.2 紫外光谱分析[20]
用50 mmol/L、pH 7.0的Tris-HCl缓冲溶液配制样品浓度为10 g/L,测量在不同波长下的吸光度值。
1.3.5 单因素实验
1.3.5.1 微波时间对微波辅助糖基化SPI乳化性的影响
SPI与FG质量比1∶3,反应时间为30 min时,反应温度为60 ℃,考察微波时间为0、1、2、3、4、5、6、7、8、9、10 min时对SPI糖基化程度及乳化性的影响。
1.3.5.2 SPI与FG质量比对微波辅助糖基化SPI乳化性的影响
SPI与FG质量比1∶3,微波时间3 min,反应时间为30 min时,反应温度为60 ℃,考察SPI与FG质量比分别为1∶1、1∶2、1∶3、1∶4、1∶5时对SPI糖基化程度及乳化性的影响。
1.3.5.3 反应时间对微波辅助糖基化SPI乳化性的影响
SPI与FG质量比为1∶3,微波时间3 min,反应温度为60 ℃,考察干燥器反应时间为0、5、10、30、50、70、90、110 min时对SPI糖基化程度及乳化性的影响。
1.3.5.4 反应温度对微波辅助糖基化SPI乳化性的影响
SPI与FG质量比1∶3,微波时间3 min,反应时间为30 min时,使其反应温度分别是40、50、60、70、80 ℃时对SPI糖基化程度及乳化性的影响。
1.3.6 响应面分析法优化工艺
依据上述单因素实验的讨论,根据Box-Benhnken的中心组合实验设计原理[21-22], 采用响应面法[23]在3因素3水平上对微波辅助糖基化改性SPI条件进行优化。对试验数据结果采用Design Expert 8.0.6软件进行分析,因素和水平见表1。
表1 响应面分析因素和水平表
Table 1 Factors and levels of the response surface methodology
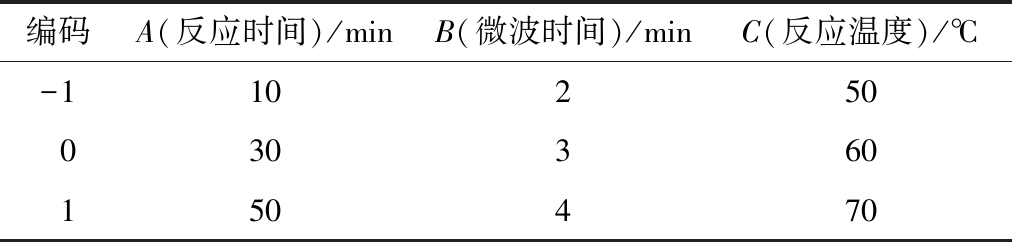
编码A(反应时间)/minB(微波时间)/minC(反应温度)/℃-110250030360150470
2.1.1 微波时间对微波辅助糖基化SPI乳化性影响
由图1、图2可以看出,在SPI与FG质量比1∶3、反应时间30 min、糖基化反应温度60 ℃时, 随着微波时间的延长,乳化活性、乳化稳定性和糖基化程度都是先上升后下降的趋势,在微波时间在3 min时均达到最高值。这是由于适当的微波处理SPI能够减弱蛋白分子间和分子内的非共价作用,SPI的结构变得松散,暴露更多的糖基化反应位点,从而促进糖基化反应的发生,同时引入更多含有亲水羰基的糖链[24]。由于FG以共价键连接入SPI肽链中,增加了空间阻力,使得界面蛋白很难发生聚合,从而提高其乳化活性和乳化稳定性。但过度的微波预处理,就会使得蛋白分子重新聚集,SPI糖基化反应减弱,乳化活性和乳化稳定性也随之降低[25]。
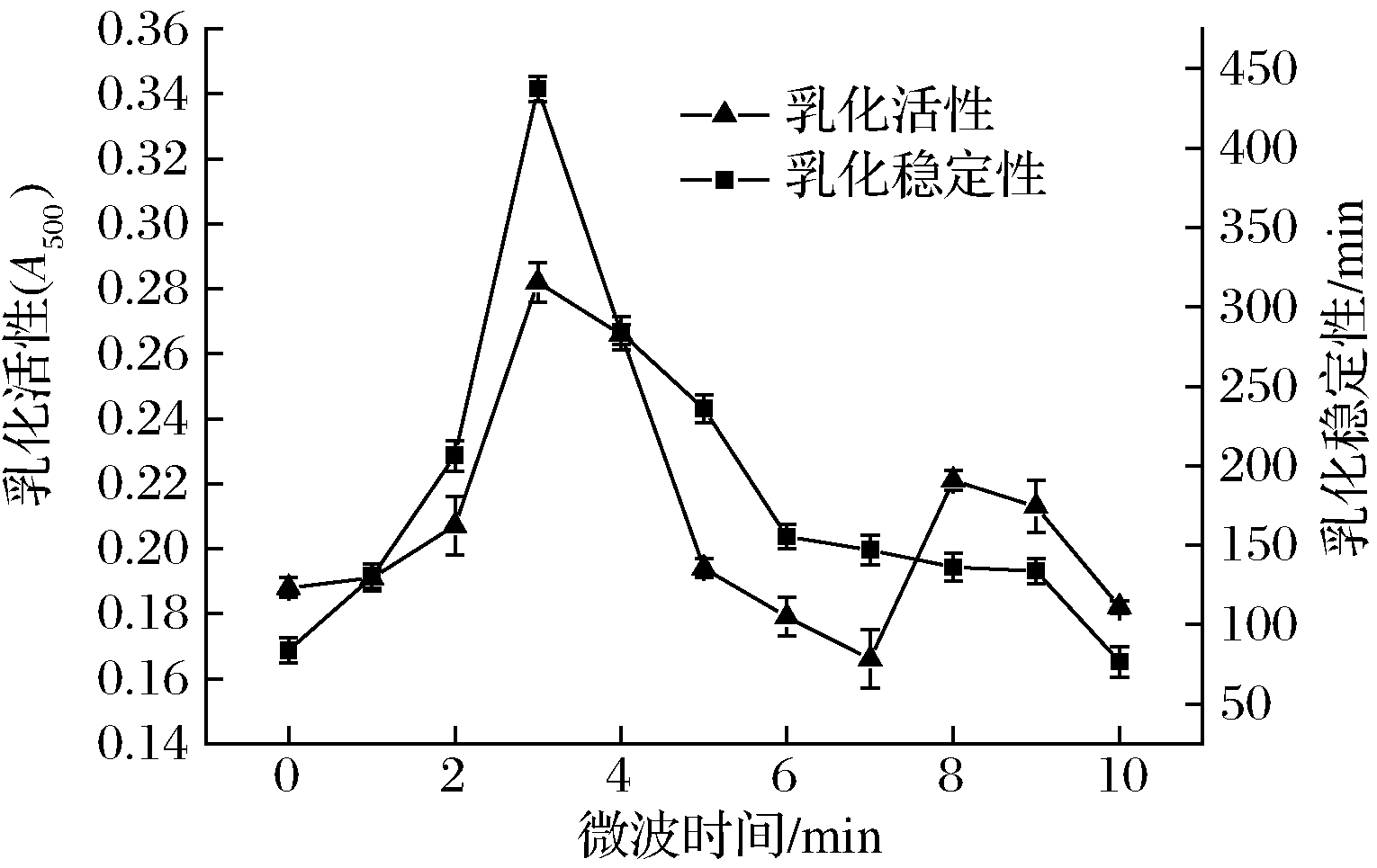
图1 微波时间对微波辅助糖基化SPI乳化性影响
Fig.1 Effect of microwave time on emulsification of SPI assisted by microwave glycosylation

图2 微波时间对微波辅助糖基化SPI糖基化程度影响
Fig.2 Effect of microwave time on degree of glycosylation of SPI assisted by microwave glycosylation
2.1.2 SPI与FG质量比对微波辅助糖基化SPI乳化性影响
由图3、图4可以看出,在微波3 min、反应时间30 min、糖基化反应温度60 ℃时,随着质量比的增加,乳化活性、乳化稳定性和糖基化程度都是先上升后下降的趋势,在质量比为1∶3时均达到最高值。当FG的质量增加时,单位体积内与SPI分子接触的糖分子数量就会变多,糖基化反应的速率就会变大,乳化活性和乳化稳定性呈上升趋势;但随着添加的葫芦巴胶的量继续增加,由于不适当的SPI和FG比例导致加剧副反应(焦糖化)的发生以及FG分子的空间位阻对糖基化反应有阻碍,所以随着FG的继续添加,乳化活性和乳化稳定性呈下降的趋势[26]。
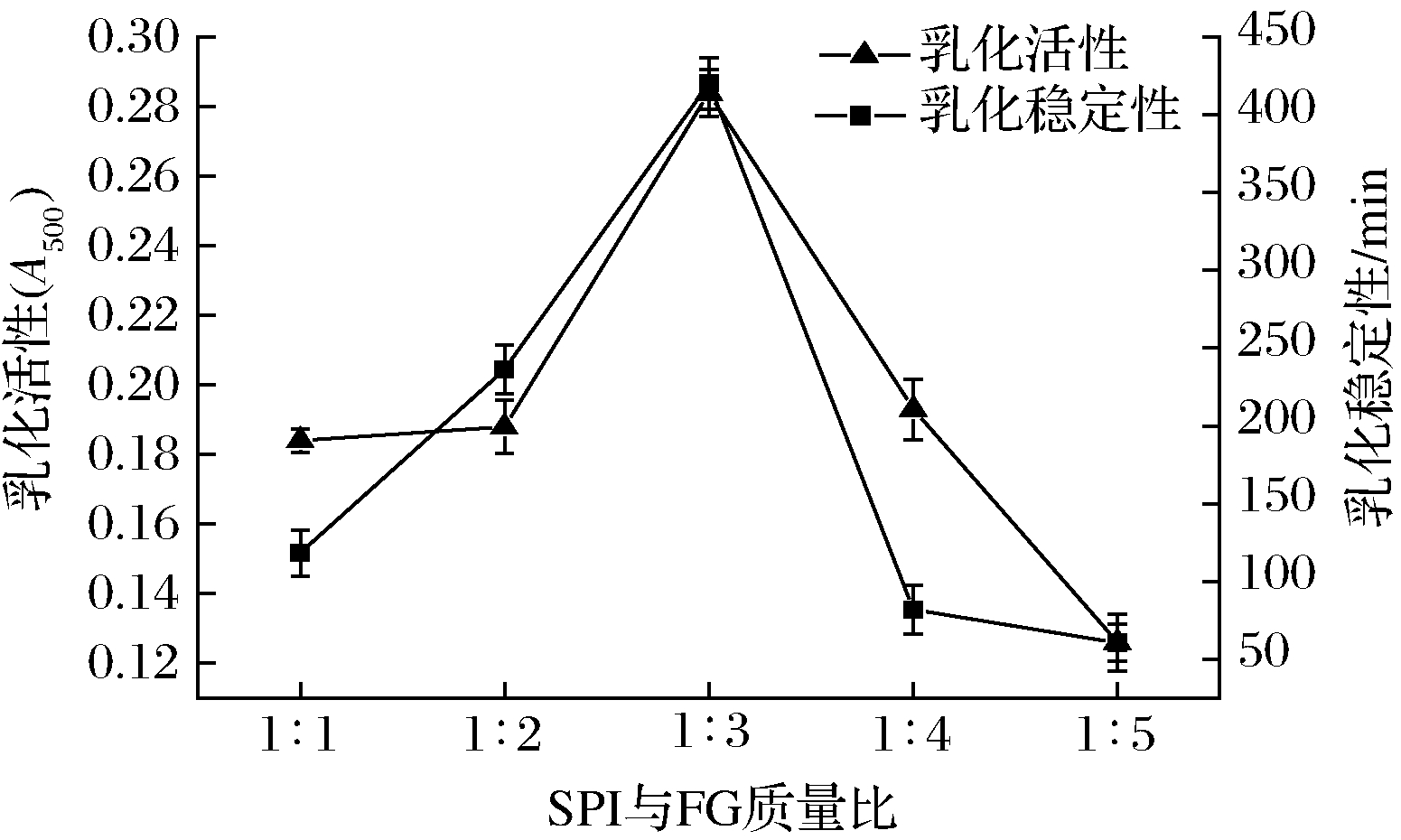
图3 SPI与FG质量比对微波辅助糖基化SPI乳化性影响
Fig.3 Effect of SPI and FG on emulsification of microwave assisted glycosylation SPI
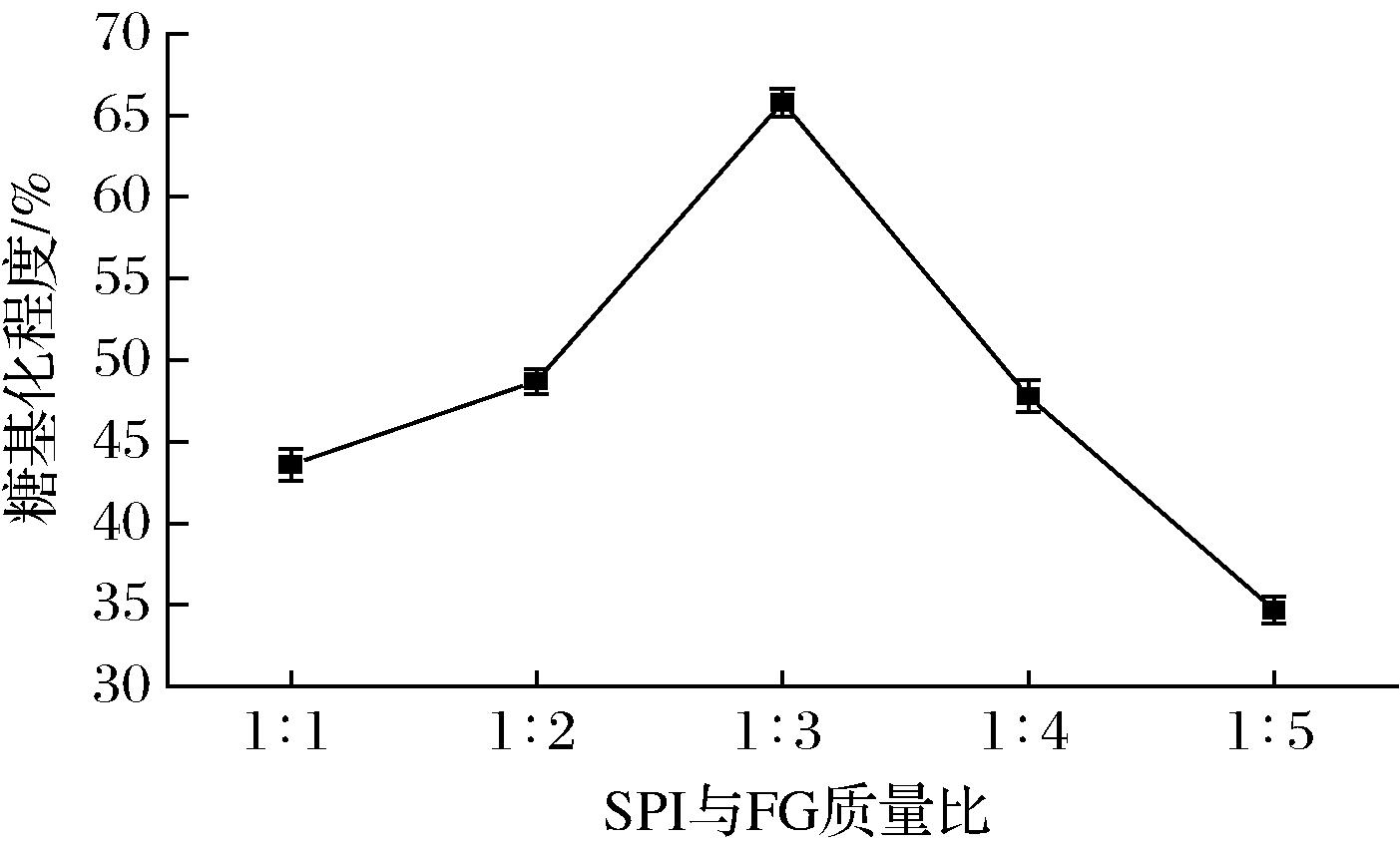
图4 SPI与FG质量比对微波辅助糖基化SPI糖基化程度影响
Fig.4 Effect of SPI and FG on degree of glycosylation of microwave assisted glycosylation SPI
2.1.3 反应时间对微波辅助糖基化SPI乳化性影响
由图5、图6可以看出,在SPI与FG质量比1∶3、微波3 min、糖基化反应温度60 ℃时,随着反应时间的增大,乳化活性、乳化稳定性都是先上升后下降,反应时间在30 min时均达到最高值;糖基化程度呈逐渐增大的趋势,在30 min后趋于平缓。微波辅助糖基化的反应时间逐渐增大到30 min时,SPI和FG糖基化反应程度逐渐加深,糖基化SPI降低了油水界面的张力,乳化能力有所提高[27]。随着反应时间的继续延长,过多的葫芦巴胶接枝到SPI,体现出显著的亲水性,所以糖基化SPI的乳化性开始呈下降的趋势[28]。
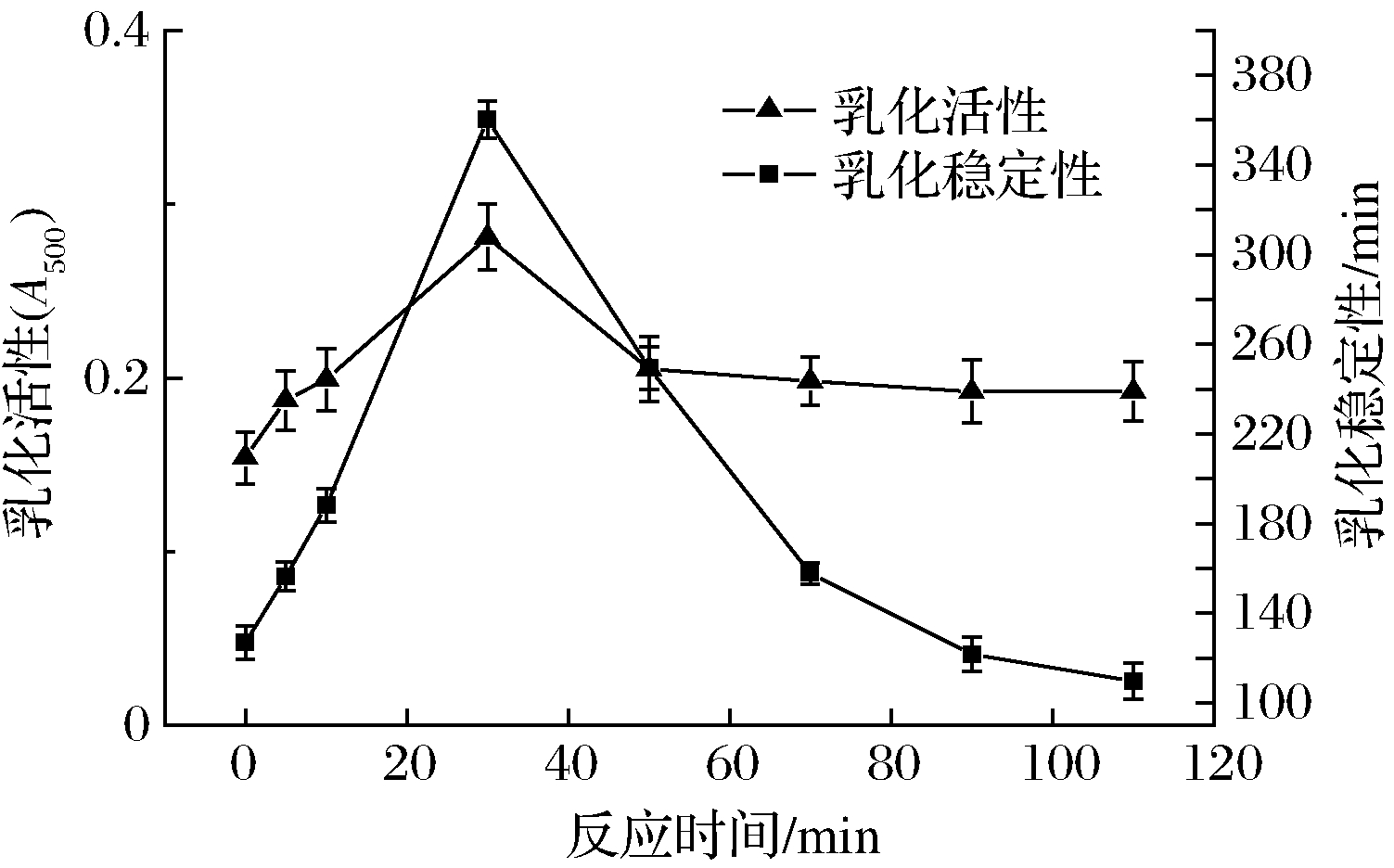
图5 反应时间对微波辅助糖基化SPI乳化性影响
Fig.5 Effect of reaction time on emulsification of SPI assisted by microwave glycosylation
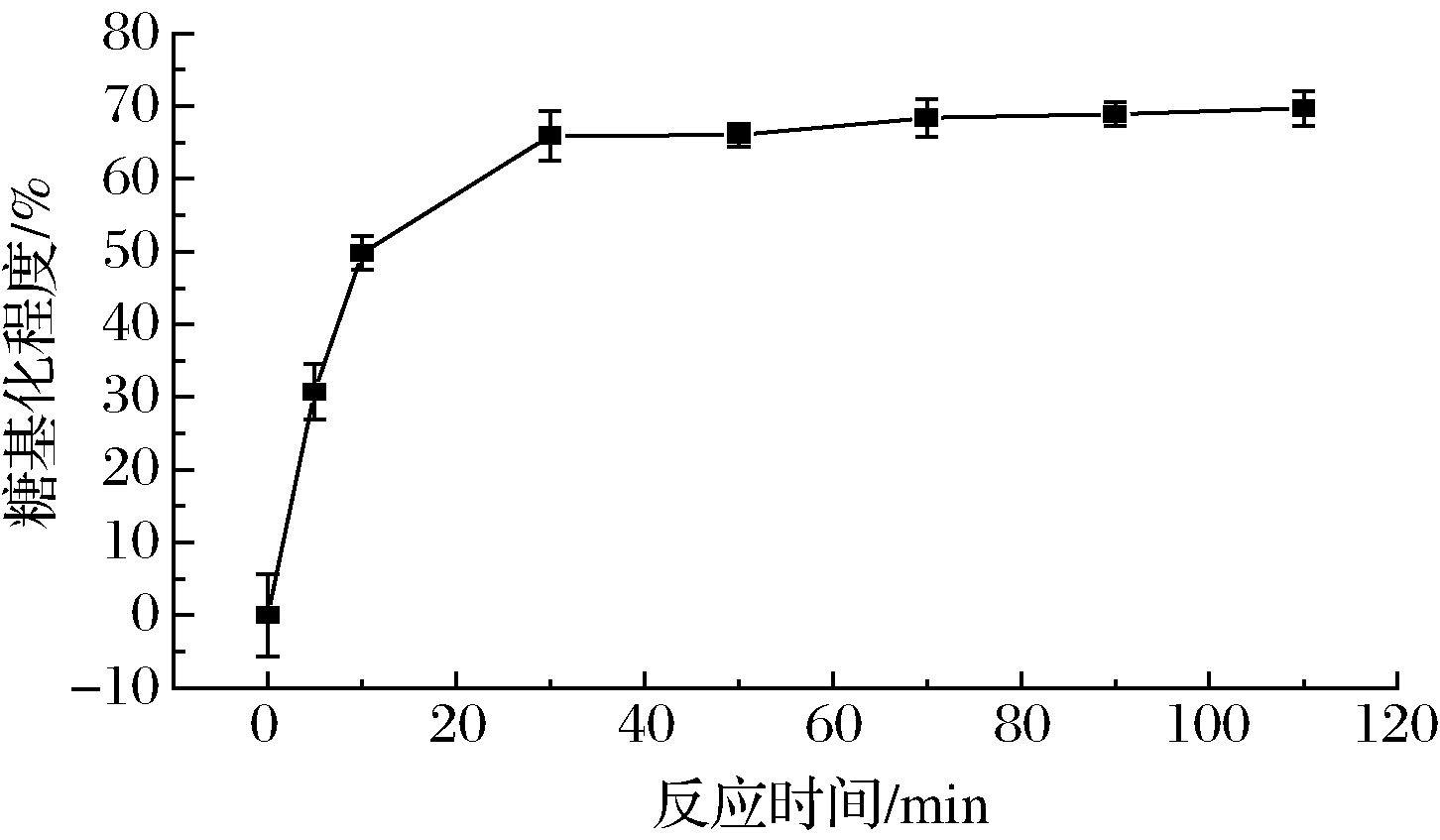
图6 反应时间对微波辅助糖基化SPI糖基化程度影响
Fig.6 Effect of reaction time on degree of glycosylation of SPI assisted by microwave glycosylation
2.1.4 反应温度对微波辅助糖基化SPI乳化性影响
由图7、图8可以看出,在SPI与FG质量比1∶3、微波3 min、反应时间30 min时,随着糖基化反应温度的增加,乳化活性、乳化稳定性和糖基化程度都是先上升后下降的趋势,在60 ℃均达到最高值。说明温度为60 ℃时,SPI糖基化反应的效果较好,显著地降低了油水界面的张力,提高了SPI的乳化性。但随着温度的继续升高,大豆分离蛋白由于高温容易发生热变形,阻碍了糖基化反应的进行,所以糖基化的程度降低,乳化性也呈下降的趋势[29]。
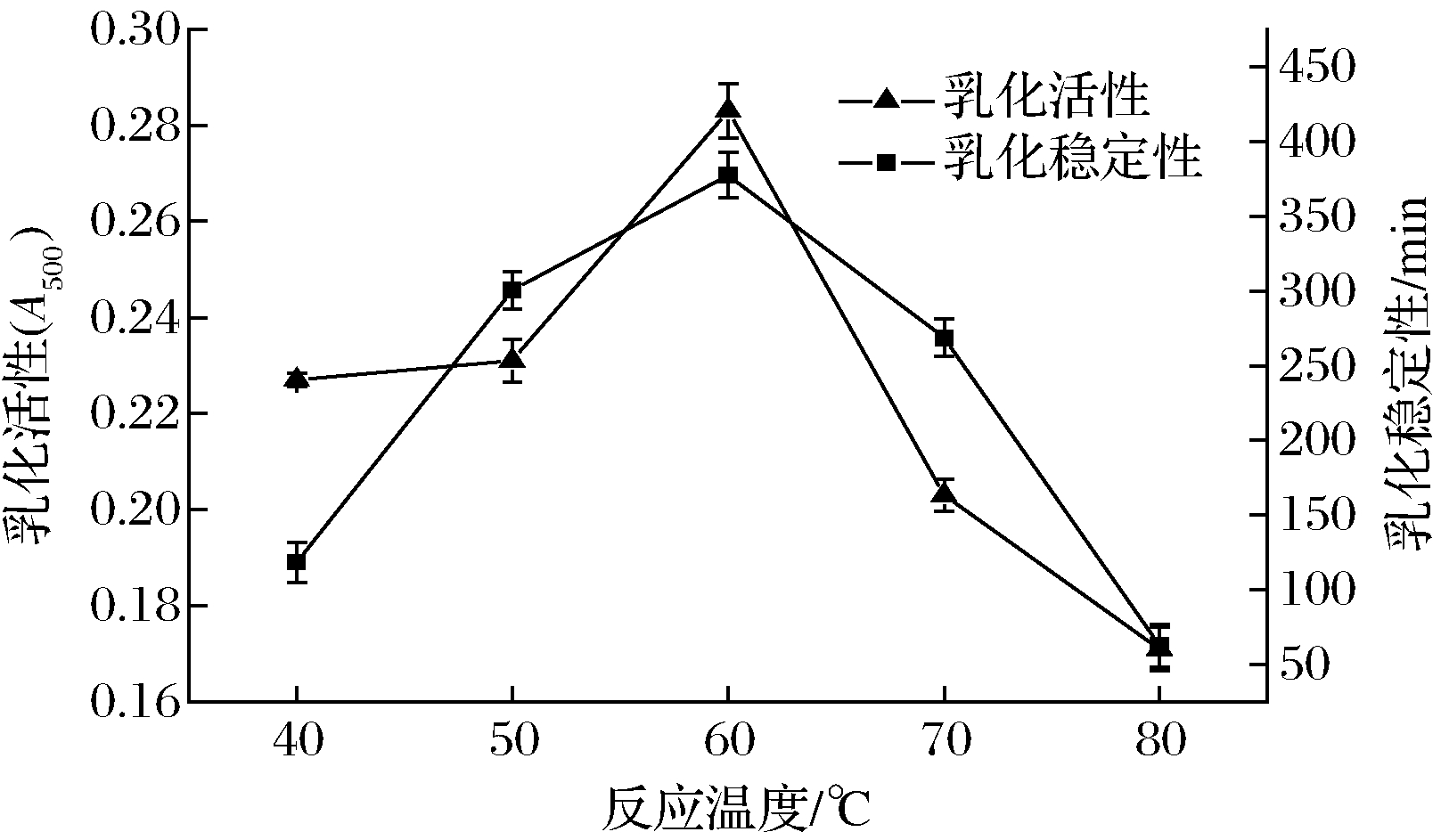
图7 糖基化反应温度对微波辅助糖基化SPI乳化性影响
Fig.7 Effect of glycosylation temperature on emulsification of SPI assisted by microwave glycosylation

图8 糖基化反应温度对微波辅助糖基化SPI糖基化程度的影响
Fig.8 Effect of glycosylation temperature on degree of glycosylation of SPI assisted by microwave glycosylation
在单因素实验的基础上,以反应时间(A)、微波时间(B)、反应温度(C)为自变量,以乳化稳定性(ES)为响应值,进行响应面分析实验,实验结果见表2。
表2 响应面所设计的方案和实验结果
Table 2 Experimental design and results of response surface methodology
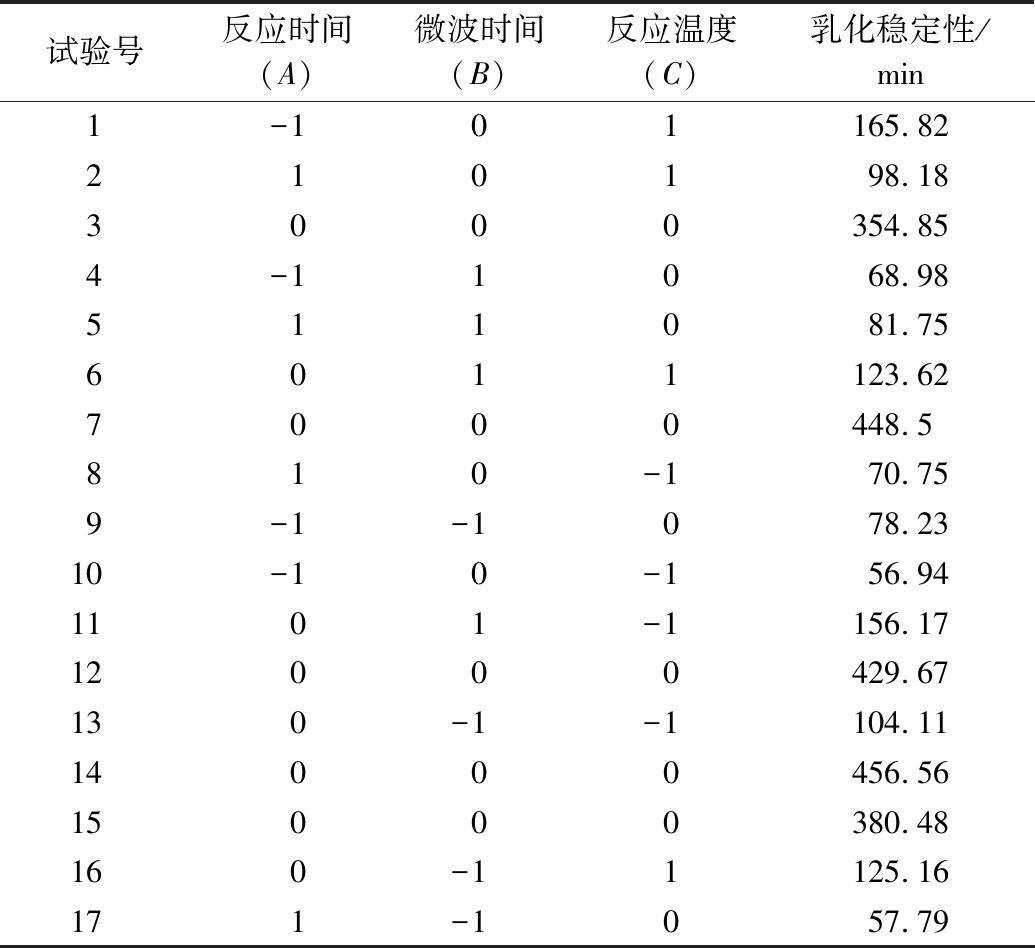
试验号反应时间(A)微波时间(B)反应温度(C)乳化稳定性/min1-101165.82210198.183000354.854-11068.98511081.756011123.627000448.5810-170.759-1-1078.2310-10-156.941101-1156.1712000429.67130-1-1104.1114000456.5615000380.48160-11125.16171-1057.79
利用Design Expert 8.0.6软件设计实验方案,对实验结果进行二次回归方程的分析,可以得出,SPI乳化稳定性Y的二次回归方程,并对它用方差的方法分析(见表3)可知。乳化稳定性Y的标准回归方程为:
Y=372.01-7.69A+8.15B+15.60C+8.30AB-20.36AC-13.40BC-164.83A2-135.49B2-109.26C2
模型的决定系数与调整决定系数分别为0.965 0、0.9200,说明此模型与试验之间拟合程度较高,证明用此模型优化反应时间、微波时间和反应温度对微波辅助糖基化改性SPI影响具有可行性。由反应时间、微波时间、反应温度对响应值的影响可以得出,回归方程Y中的A2、B2、C2对微波辅助糖基化SPI的乳化稳定性都有明显的影响,而其他因素影响不是很明显,表明各影响因素对于微波辅助糖基化SPI的影响不是简单的线性关系。用中心标准化处理回归方程,Y回归方程一次项回归系数的绝对值大小依次为C、B、A,因此,3个影响因素对乳化稳定性影响顺序为:反应温度(C)>微波时间(B)>反应时间(A)。
表3 乳化稳定性试验结果的方差分析表
Table 3 ANOVA for the results of emulsifying stability

变异来源平方和自由度均方F值Prob>F显著性模型3.531E+005939 229.067.660.006 8显著A87.78187.780.0170.899 5B6 203.3116 203.311.210.307 4C3 836.4413 836.44 0.75 0.415 3AB5 989.9915 989.991.170.315 2AC1 658.5311 658.530.320.587 0BC538.241538.240.110.755 2A21.998E+00511.998E+00539.030.000 4B254 232.45154 232.4510.590.014 0C250 260.52150 260.529.820.016 5残差35 833.6575 119.09失拟误差29 232.7039 744.235.900.059 6不显著纯误差6 600.9441 650.24总和3.889E+00516
对模型中的反应时间(A)、微波时间(B)、反应温度(C)其中的一个因素让它在0水平不动时,由此可知,另外2个影响因素相互交叉作用对乳化稳定性Y的子模型,并根据子模型,分别绘制出a、b、c三个三维响应曲面图,见图9。
图9说明了各因素对微波辅助糖基化SPI乳化稳定性的影响。由图9-a、9-b、9-c可以看出,3个因素与Y呈抛物线关系,随着反应时间、微波时间和反应温度的增加,乳化稳定性先呈不同程度的上升趋势,先达到最高点后,继而随着各影响因素值的增加,乳化稳定性呈下降趋势,这与单因素的实验结果不约而同。并且由图9-a和图9-b可以看出,与反应温度和微波时间相比,反应时间对SPI乳化活性的影响相对较小。
通过所得到的模型,可预测采用微波辅助糖基化法提高SPI乳化稳定性的最好的工艺条件为:反应时间41 min、微波时间3 min、反应温度58 ℃。在此条件下,微波辅助糖基化法SPI乳化稳定性(OD500)在理论上可达371.156 min。
根据上述结果进行近似验证试验,检测真实值是否与试验结果相一致。在最佳工艺条件下进行3次平行试验,测得微波辅助糖基化SPI的乳化稳定性(OD500)为370.38 min,与理论值相比,相对误差在±1%以内,而且重复性好,说明优化结果是准确可靠的。

a-反应时间和微波时间对乳化稳定性影响的响应面图;b-反应时间和反应温度对乳化稳定性影响的响应面图;c-微波时间和反应温度对乳化稳定性影响的响应面图
图9 微波辅助糖基化SPI乳化稳定性的响应面图
Fig.9 The response surface of emulsifying stability of SPI by microwave assisted glycosylation
由图10可以看出,在最佳的微波辅助糖基化改性条件下,将未改性的SPI、微波改性SPI和微波辅助糖基化SPI的乳化性进行对比,未改性SPI的乳化活性和乳化稳定性数值最小,微波辅助糖基化SPI的乳化活性和乳化稳定性数值最大,微波改性SPI的乳化活性和乳化稳定性数值处于二者之间。由此,可知微波辅助糖基化可以显著提高SPI的乳化性。
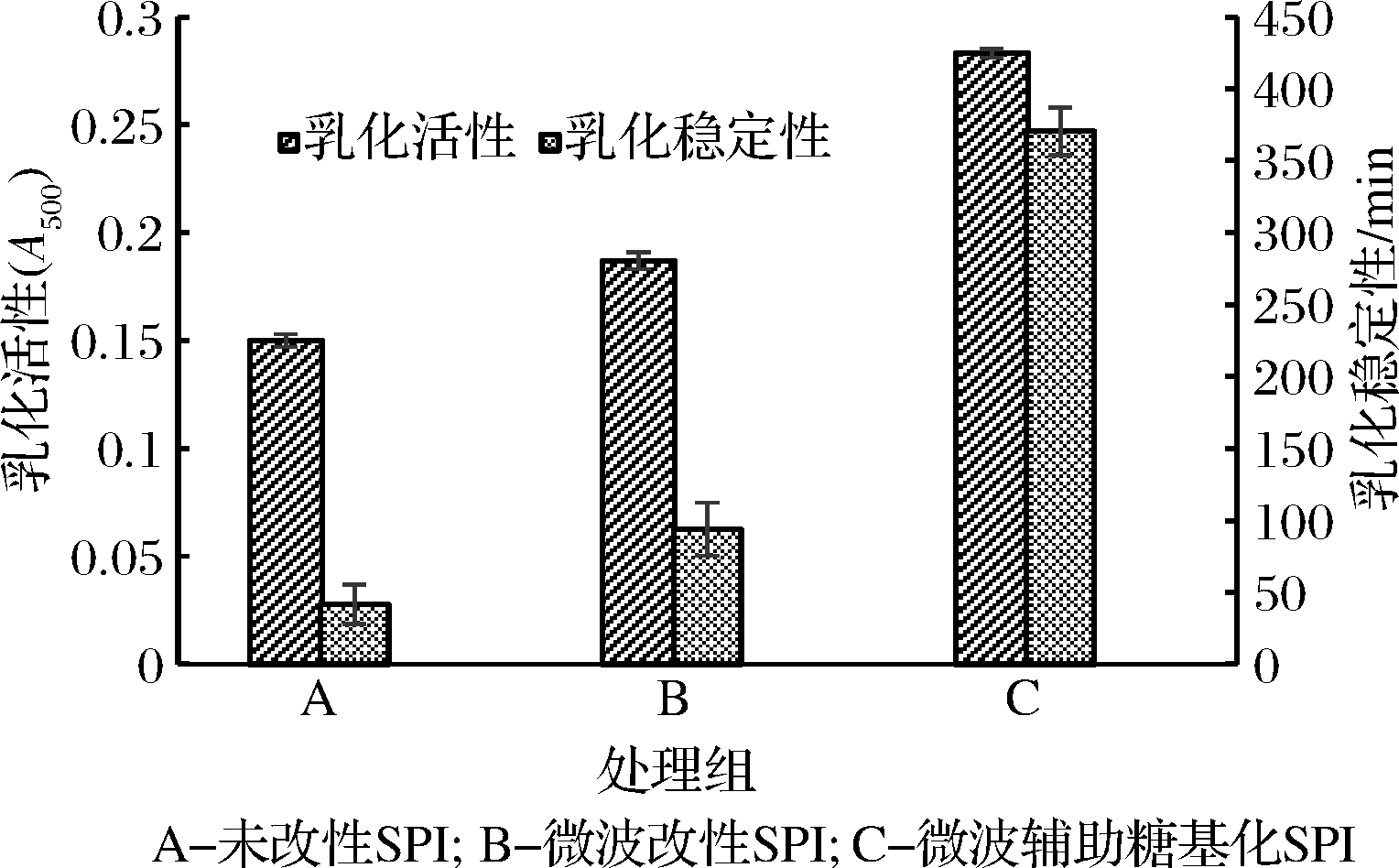
图10 未改性SPI、微波改性SPI与微波辅助糖基化SPI乳化性的对比
Fig.10 Comparison of emulsification of unmodified SPI, microwave modified SPI and microwave assisted glycosylation SPI
红外光谱是用来分析蛋白质功能基团变化的一种方法。由图11可知,微波改性的SPI和微波辅助糖基化改性的SPI的吸收峰在3 500 cm-1宽于未改性的SPI;微波辅助糖基化改性的SPI在1 000~1 500 cm-1处与未改性的SPI吸收峰明显不同,由此说明产物的羟基数增加,引起了C—OH的伸缩振动,并且在此范围内产物吸收峰强度增加,证明糖基化反应引起了C—N、C—H和C![]() O键的伸缩振动增加[30],也因此证明了SPI与FG发生了共价交联从而改变了蛋白质的结构。
O键的伸缩振动增加[30],也因此证明了SPI与FG发生了共价交联从而改变了蛋白质的结构。
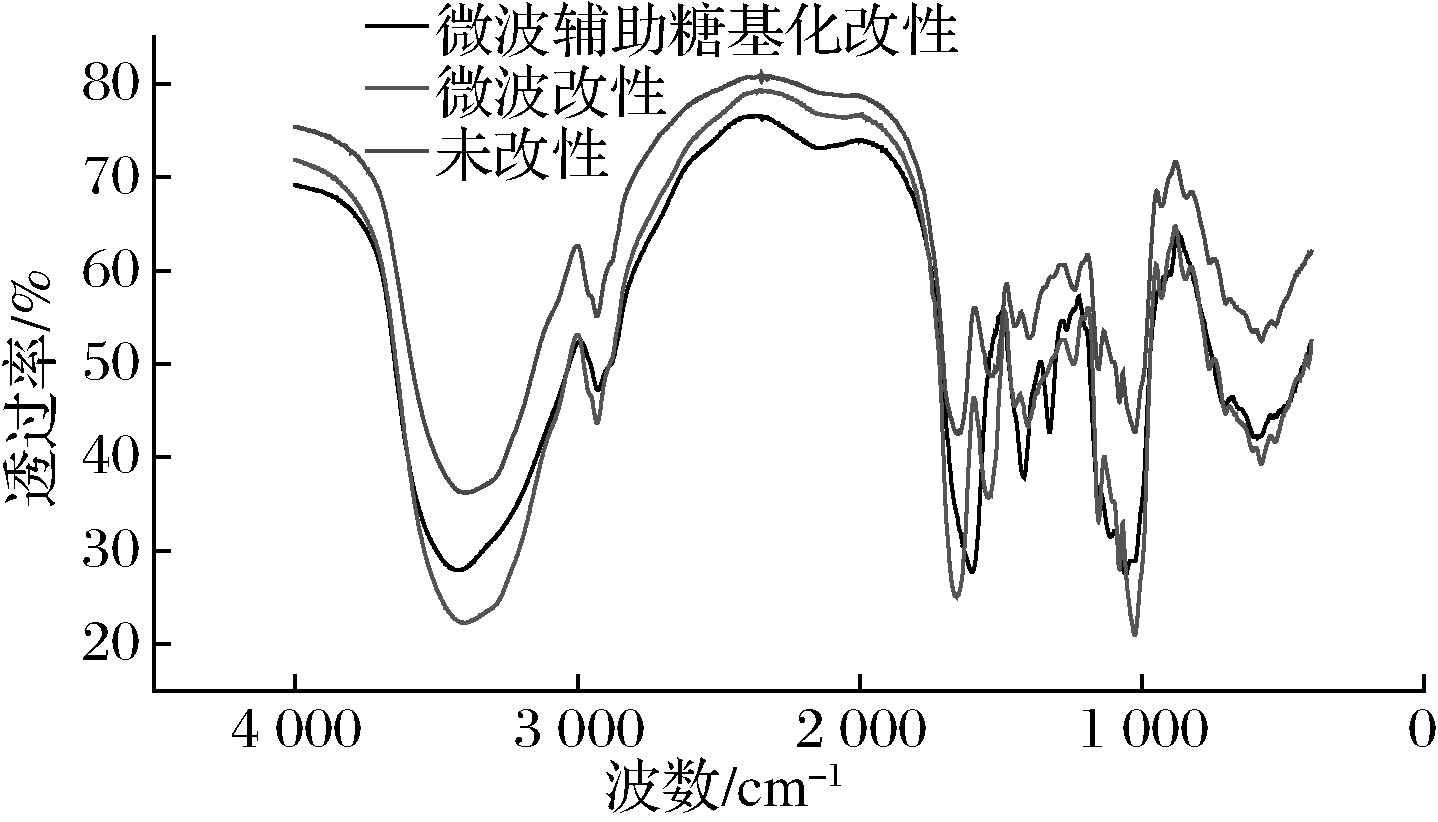
图11 微波辅助糖基化改性SPI样品的红外光谱图
Fig.11 The infrared spectrogram of microwave assisted glycosylation modified SPI sample
紫外光谱是研究蛋白质构象的一种方法,主要体现在芳香族氨基酸。由图12可知,蛋白吸收峰有所变化。微波改性的SPI吸收峰高于未改性的SPI,在270 nm附近处的吸光值也高于未改性SPI,这可能是因为微波过程中使蛋白质疏水性生色基团露出从而使吸光值变大。微波辅助糖基化改性后的SPI在280 nm附近的吸收峰弱于未改性的SPI,并向短波方向移动,说明了SPI与FG发生了共价交联[31],使蛋白分子空间结构发生了变化,导致酪氨酸和色氨酸对紫外线的吸收降低。
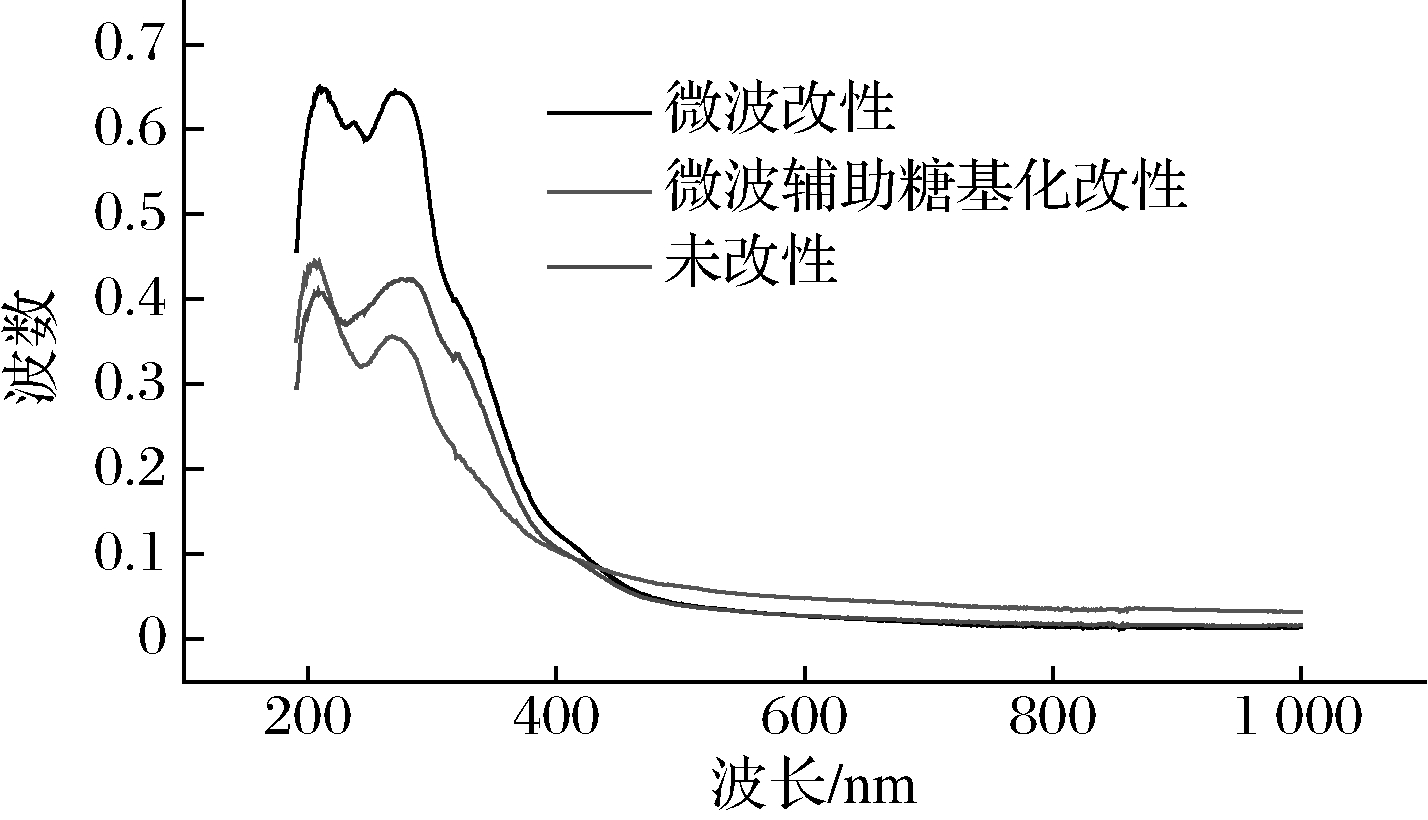
图12 微波辅助糖基化改性SPI样品的紫外光谱图
Fig.12 The ultraviolet spectrogram of microwave assisted glycosylation modified SPI sample
在单因素实验基础上,并通过对显著影响因素反应时间、微波时间和反应温度做响应面分析,确定微波辅助糖基化的最佳工艺条件为反应时间41 min、微波时间3 min、SPI与FG质量比1∶3和反应温度58 ℃。其制备的微波辅助糖基化SPI的乳化稳定性(OD500)为370.38 min,与理论值相比差异不显著。
在最佳工艺下制备的微波辅助糖基化SPI乳化稳定性有较大的提高,与微波改性的SPI相比,微波辅助糖基化SPI乳化活性提高了51.33%,乳化稳定性提高了294.14%;与未改性的SPI对比,微波辅助糖基化SPI乳化活性提高了88.67%,乳化稳定性提高了788.84%。
红外光谱和紫外光谱分析得知,改性前后SPI的各吸收峰强度均有不同程度的变化,因此表明SPI与FG之间发生了共价交联,改变了蛋白分子空间结构。
[1] DIFTIS N K V. Physicochemical properties of dry-heated soy protein isolate-dextran mixtures[J]. Food Chemistry, 2006, 96:228-233.
[2] KATO A, MURATA K, KOBAYASHI K. Preparation and characterization of ovalbumin-dextran conjugate having excellent emulsifying proper-ties[J].Journal of Agricultural and Food Chemistry,1988,36(3):421-425.
[3] SONG C L, ZHAO X H. Structure and property modification of an oligochitosan-glycosylated and crosslinked soybean protein generated by microbial transglutaminase[J]. Food Chemistry, 2014, 163(15):114-119.
[4] GUAN Y G, LIN H, HAN Z, et al. Effects of pulsed electric field treatment on a bovine serum albumin-dextran model system, a means of promoting the Maillard reaction[J]. Food Chemistry, 2010, 123(2):275-280.
[5] MU L, ZHAO M, YANG B, et al. Effect of ultrasonic treatment on the graft reaction between soy protein isolate and gum acacia and on the physicochemical properties of conjugates[J]. Journal of Agricultural and Food Chemistry, 2010, 58(7):4 494-4 499.
[6] SONG Y, BABIKER E E, USUI M, et al. Emulsifying properties and bactericidal action of chitosan-lysozyme conjugates[J]. Food Research International, 2002, 35(5):459-466.
[7] EICHLER J. Protein glycosylation[J]. Current Biology, 2019,29:225-240.
[8] DUTTA D, MANDAL C. Unusual glycosylation of proteins: Beyond the universal sequon and other amino acids[J]. Biochimica et Biophysica Acta (BBA) - General Subjects, 2017, 1 861(12):3 096.
[9] XU Y, ZHAO X, BIAN G, et al. Structural and solubility properties of pale, soft and exudative (PSE)-like chicken breast myofibrillar protein: Effect of glycosylation[J]. LWT,2018,95:209-215.
[10] YANG Rui, ZUO Peng, ZHANG Min, et al. Transglutaminase induced oligochitosan glycosylation of ferritin as a novel nanocarrier for food bioactive molecules[J].Food Hydrocolloids,2019,94:500-509.
[11] SHENG Long, HE Zhenjiao, LIU Yaping, et al. Mass spectrometry characterization for N-glycosylation of immunoglobulin Y from hen egg yolk[J]. International Journal of Biological Macromolecules,2017,108(6):533-540.
[12] YUAN F, LYU L, LI Z, et al. Effect of transglutaminase-catalyzed glycosylation on the allergenicity and conformational structure of shrimp (Metapenaeus ensis) tropomyosin[J]. Food Chemistry, 2017, 219:215-222.
[13] BRUMMER Y, CUI W, WANG Q. Extraction, purification and physicochemical characterization of fenugreek gum[J]. Food Hydrocolloids, 2003,17(3): 229-236.
[14] HUANG X, KAKUDA Y, CUI W. Hydrocolloid in emulsions: Particle size distribution and interfacial activity. Food Hydrocolloids, 2001,15(4):533-542.
[15] KASRAN M, CUI S W, GOFF H D. Covalent attachment of fenugreek gum to soy whey protein isolate through natural Maillard reaction for improved emulsion stability[J]. Food Hydrocolloids, 2013, 30(2):552-558.
[16] 管军军, 裘爱泳, 刘晓亚, 等. 加热方式对大豆分离蛋白-糖接枝反应的影响[J]. 中国油脂, 2005, 30(6):53-56.
[17] PEARCE K N, KINSELLA J E. Emulsifying properties ofprotein: evaluation of turbidimetric technique [J]. Journal of Agricultural and Food Chemistry, 1978, 26(3):716-723.
[18] LERTITTIKUL W, BENJAKUI S, TANAKA M. Characteristics and antioxidative activity of Maillard reaction products from porcine plasma protein-glucose model system as influenced by pH [J]. Food Chemistry, 2007, 100(2): 669-677.
[19] 朱明华.仪器分析[M].北京:高等教育出版社,2000.
[20] 布冠好, 朱婷伟, 陈复生, 等. 大豆蛋白-乳糖复合物的结构及功能特性研究[J]. 中国粮油学报, 2014,29(7):40-44.
[21] 刘振学,王力. 实验设计与数据处理 [M].北京:.化学工业出版社,2001:111-124.
[22] BOX G E P, HUNTER W G. Statistics for experiments: an introduction to Design, Data analysis and Model Building[M]. New Nork: Wiley, 1990.
[23] YAMAZAKI, KUSHIDA N, OGUCHI A, et al. Response Surface Design and Analyses [M]. New York:Marcel Dekker Inc, 1987:149-205.
[24] 许彩虹, 于淑娟, 杨晓泉. 糖基化对大豆7S球蛋白凝胶流变性质的影响(Ⅱ)[J]. 现代食品科技, 2010, 26(12):1 293-1 296.
[25] 杨雪飞, 臧艳妮, 赵妍嫣, 等. 微波预处理对小麦面筋蛋白糖基化改性的影响[J]. 中国粮油学报, 2019,34(1):10-17.
[26] 程熙茜. 超声辅助湿热法制备大豆分离蛋白糖接枝物[D]. 无锡:江南大学, 2012.
[27] MEZDOUR S,LEPINE A,ERAZO-MAJEWICZ P,et al.Oil/water surface rheological properties of hydroxypropyl cellulose (HPC) alone and mixed with lecithin:Contribution to emulsion stability[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects,2008,331(1-2): 76-83.
[28] 徐苇, 杨晓泉, 齐军茹. 大豆分离蛋白-食用胶复合物乳化性质的研究[J]. 河南工业大学学报(自然科学版), 2005, 26(3):19-23.
[29] 包怡红, 邓启, 伊文慧. 黑木耳多糖—大豆蛋白复合物的制备及其功能物性研究[J]. 食品与机械, 2014,30(6):47-53.
[30] 穆利霞.大豆蛋白—糖接枝改性及其结构与功能特性研究[D].广州:华南理工大学,2010.
[31] 左颖昕, 布冠好. 葡萄糖接枝对大豆分离蛋白功能特性和结构的影响[J]. 河南工业大学学报(自然科学版), 2018,39(2):58-71.