表1 鉴定结果的概率
Table 1 Percentage of probability of identification results

ID信息置信水平概率/%极好96~99非常好93~95好89~92可接受85~88
天然防腐剂易被人体消化水解且无毒副作用,是一种新型的生物防腐剂,其主要功能成分为抗菌肽,抗菌肽又叫肽抗生素、抗微生物肽,是指具有抵御外界微生物侵害、清除体内突变细胞的一类小分子肽[1],该物质可有效抑制微生物的生长。其主要来源于动物、植物和微生物等,因微生物来源的天然抗菌物质生产成本低、周期短、效率高、效果好等优点,甚至可直接通过微生物菌体的拮抗、竞争作用抑制或杀灭病菌,而达到对果蔬进行防腐、抑菌及保鲜的作用[2],因此,生物拮抗菌成为近年食品微生物研究的热点之一,探究对微生物天然防腐保鲜剂开发利用的有效途径,以期广泛应用于食品防腐保鲜领域。
近年来,不同来源的解淀粉芽孢杆菌不断被鉴定,并且分析其抑菌效果,如蔡国林等[3]研究了解淀粉芽孢杆菌胞外多糖抑制大肠杆菌的血凝性;尹珺伊等[4]从玉米种植地土壤中分离并坚定了解淀粉芽胞杆菌SSY2,并研究对霉菌的拮抗效果;陈建军等[5]从海底淤泥样品中分离鉴定了Bacillus amyloliquefaciens MBRC1,并研究其抗菌活性;SHAHZADI等[6]分离鉴定了1株煤油降解细菌(解淀粉芽孢杆菌6a)。解淀粉芽孢杆菌在果蔬防腐保鲜方面的应用研究也有报道,洪鹏等[7]对解淀粉芽孢杆菌防治果蔬采后病害研究情况进行了综述,同时有学者对其防治效果进行探索,如CALVO等[8]研究了buz-14在采后水果腐烂中的作用;耿阳阳等[9]将解淀粉芽孢杆菌发酵液应用于新鲜核桃的保鲜。近年来,解淀粉芽孢杆菌在生物防治方面的研究也时有报道,如CUI等[10]研究发现,b9601-y2可使玉米叶枯病病情指数下降61.38%;AGUSTIN等[11]对83对不同生理阶段炭疽病菌生长和生存能力的影响进行研究;ZHANG等[12]发现并鉴定了解淀粉芽孢杆菌6256能够产生抗真菌小肽。邝格灵等[13]和赵龙等[14]分别研究了解淀粉芽孢杆菌对食醋风味和酱油酿造的影响。从近年对解淀粉芽孢杆菌的研究可知,该菌在食品防腐保鲜、生防、环境保护、发酵等方面具有很大的开发利用价值和潜力。
前期课题组在对柑橘的防腐保鲜研究中,从柑橘上分离筛选得到1株细菌,本研究对该柑橘源细菌进行形态、生化和分子鉴定,并对其抑菌谱和抑菌活性进行初步研究,以期为进一步探索柑橘采后生防保鲜技术的应用和研究提供参考,为生物防腐剂和微生物制剂的开发与应用提供理论基础与技术支持。
枯草芽孢杆菌 (ATCC6633-1),购自北京陆桥技术股份有限公司; KHQH-1,由本课题组从柑橘上分离;红曲霉(Monascus spp.)、根霉(Rhizopusspp.)、米曲霉(Aspergillus oryzae)、黄曲霉(Aspergillus flavus)、青霉(Penicillium spp.)、绿色木霉(Trichoderma viride)、大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)等菌种,由本实验室提供。
营养琼脂(NA)培养基,北京陆桥技术股份有限公司;大豆酪蛋白琼脂(TSA)平板,南通凯恒生物科技有限公司;革兰氏染色液、卢戈氏碘液,广东环凯微生物科技有限公司;琼脂(生物试剂),杭州百思生物技术有限公司;DNA提取试剂盒,天根生化科技(北京)有限公司。
形态鉴定培养基,营养琼脂(nutrient agar,NA)培养基。生化鉴定培养基,胰酪大豆胨琼脂(tryptose soya agar,TSA)。抗菌试验培养基,马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基;马铃薯葡萄糖液体培养基,根据参考文献[17]的配方,不加琼脂。
DNP-9272BS-Ⅲ电热恒温培养箱,上海新苗医疗器械制造有限公司;HZ-HG-502N电子天平,福州衡之展电子有限公司;LDZX-40AI立式自动电热压力蒸汽灭菌器,上海申安医疗器械厂;TG16-WS台式高速离心机,湖南湘仪实验仪器开发有限公司;BSA224S电子天平,赛多利斯科学仪器(北京)有限公司; HNY-200D台式智能恒温培养摇床,天津欧诺仪器股份有限公司;VITEK 2 Compact 全自动细菌鉴定系统(VITEK2 Compact Systems Version7.01)、VITEK® 2 BCL 鉴定卡(芽孢杆菌鉴定卡)、麦氏比浊仪(DensiCHEKTM Plus),梅里埃诊断产品(上海)有限公司;PCR 仪(Applied Biosystems),赛默飞世尔科技中国有限公司;AB2-3S3生物安全柜,艺斯高(上海)贸易有限公司。
1.5.1 菌株形态鉴定
分离菌的纯培养物接种在NA固体培养基上,37 ℃培养8~72 h定时观察菌落颜色、形态,并进行革兰氏染色和个体形态观察。
1.5.2 菌株的生化鉴定
生化鉴定采用VITEK2Compact全自动微生物分析系统,该系统是目前国内应用较多的全自动细菌分析系统,具有自动化程度高、鉴定速度快的特点,目前已有部分鉴定结果准确性的报道,如孙燕萍等[15]证明革兰氏阳性菌的准确率为97.4%(75/77),2016年,林杰[16]使用该系统对牛乳中葡萄球菌的鉴定效果进行评价。
1.5.2.1 菌株的生化鉴定操作流程
将细菌纯培养物转移至TSA培养基上传代培养18~24 h,实施孵育;以无菌方法,将 3.0 mL 无菌盐水(质量分数0.45%~0.50% NaCl 溶液,pH 4.5 至7.0)加入比浊仪测试管(Ref 21255) (12×75) mm中;用无菌棉签挑取足量细菌的菌落加入准备的比浊仪盐水测试管,用经过校准的 VITEK® 2 DensiCHETM Plus 比浊仪按相当于 McFarland No.1.80~2.20 OD的浊度准备均质菌悬液。将菌悬液试管和 BCL 卡放入卡架中,导液管插入到菌悬液中。然后按照规定时长进行反应,结束后通过电脑端获得打印结果(参阅 VITEK® 2 仪器使用手册)。以上操作过程按照VITEK®2compact全自动微生物分析系统标准化操作流程(SOP)(版本7.01,梅里埃诊断产品上海有限公司)及VITEK® 2 Systems产品信息对BCL鉴定卡使用方法的指导,对分离菌株KHQH-1进行生化鉴定。
1.5.2.2 菌株生化鉴定的结果概率百分比
在鉴定过程中,软件会将可由VITEK 2 Compact 全自动细菌鉴定系统鉴定的每种细菌或某细菌群的试验反应与预期反应相比较。概率百分比是一个由软件计算的定量数值,表示每种细菌观察到的反应与典型反应之间的相关程度。如果某细菌或细菌群的试验反应模式和独特反应模式完美匹配,概率将达99%。如果不是完美的匹配,反应模式仍可能与预期反应模式足够接近,可以此(表1)明确鉴定细菌。单选时,概率为85%~99%。数值越接近99%,表示越接近特定细菌的典型模式, BCL卡的模式菌菌种为ATCC 51663/LMG 15103 地短芽孢杆菌。
1.5.3 菌株16S rRNA基因序列分析
取培养24 h的KHQH-1菌液,使用DNA提取试剂盒提取该菌的基因组DNA。16S rRNA 基因序列PCR 扩增引物为细菌通用引物,27F(5′-AGTTTGATCMTGGCTCAG-3′) 和1492R(5′-GGTTACCTTGTTACGA-CTT-3′)[18]。PCR反应为25 μL体系为10×PCR缓冲液2.5 μL,dNTPs 2 μL,Taq聚合酶0.2 μL,引物27F和1492R各1μL,DNA模板1μL,ddH2O 17.3 μL。94 ℃预变性10 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,35个循环;72 ℃延伸7 min,然后4 ℃保存备用。PCR扩增产物送交上海伯杰医疗科技有限公司测序。菌株KHQH-1的16S rRNA序列测定后提交到NCBI(http://ncbi.nlm.nih.gov/)GeneBank数据库,登录号为MN443572,通过NCBI的在线BLAST系统与数据库中16S rRNA序列进行比对。然后选取与目标菌株相似性较近的菌株序列,通过MEGA 7.0中的ClustalW进行同源性比对分析,并利用MEGA 7.0软件对计算后的序列进行系统发育分析,构建系统发育树 (N-J 法,Bootstrap重复1 000次,对于序列中的空缺部分,采用50%删除的办法处理)[22]。
表1 鉴定结果的概率
Table 1 Percentage of probability of identification results

ID信息置信水平概率/%极好96~99非常好93~95好89~92可接受85~88
1.5.4 分离菌株和霉菌的拮抗试验[19]
食品中的有益菌红曲霉、根霉和米曲霉与分离菌株的抑菌试验,采用点值法;食品中的有害菌黄曲霉、青霉和绿色木霉的抑菌试验,采用滤纸片法。
1.5.5 分离菌株和细菌的拮抗试验
分离菌株KHQH-1和细菌的拮抗试验采用点值法,将溶化的NA培养基15~20 mL倒入无菌培养皿制成平板,平板放置30 ℃恒温箱5 d,使培养基表面的冷凝水彻底蒸发,将活化2次的待试细菌,用接种环取2环加入9 mL无菌生理盐水中,混匀待用;用无菌吸管取细菌悬液0.2 mL均匀涂布平板;静止1 h,用灭菌牙签蘸取平板上的纳豆菌1次,在涂布细菌的平板上连续点种4次,接种点之间和培养皿边缘要间隔1 cm以上距离。36 ℃恒温培养18~72 h,培养过程中观察抑菌情况,并测定抑菌圈大小。
1.5.6 抑菌圈大小测量方法
从平板背面分别测量抑菌圈和KHQH-1的外边缘直径,然后将抑菌圈直径减去KHQH-1外边缘直径即为KHQH-1抑菌圈的大小。以抑菌圈数据不再变化时的大小为最终测定结果,为了避免平均值不能体现平行试验中的偶然误差的弊端,对平均值进行了标准差分析。
2.1.1 菌株群体培养特征
在固体NA平板上进行划线后36 ℃培养,菌株KHQH-1形成菌落近似圆形,较扁平,边缘不整齐,中间有小突起,不分泌色素。培养18 h,菌落为白色,皱褶、干燥不透明;24 h后颜色由白色转为偏黄色(图1)。
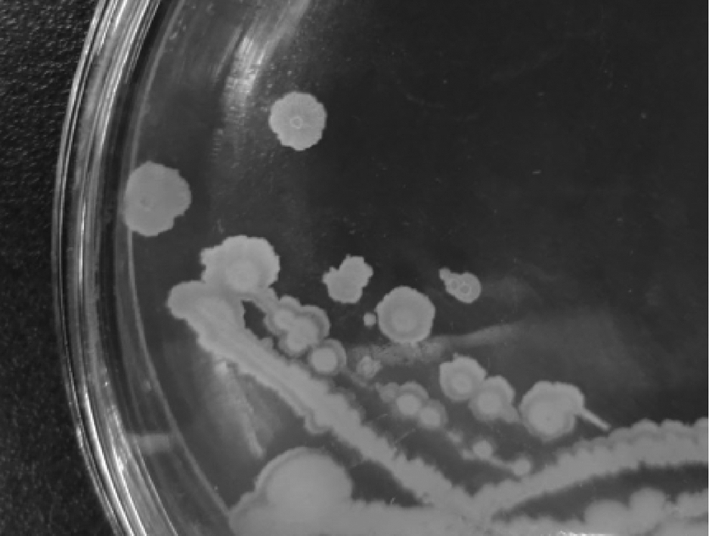
图1 KHQH-1在NA平板上生长24 h之后的菌落形态
Fig.1 Colony morphology of KHQH-1 after 24 h growth on NA Plate
2.1.2 菌株个体形态特征
将KHQH-1转接NA斜面试管,36 ℃恒温培养,分别对培养8 h和24 h的菌进行革兰氏染色,使用显微镜10×目镜,100×接物镜观察其形态(图2)发现,培养8 h的菌基本没有芽孢形成,呈杆状,菌体细长,呈深紫色,为革兰氏阳性细菌;培养24 h之后,菌体细胞质浓缩形成芽孢,芽孢椭圆到柱状,位于菌体中央,芽孢形成后,菌体变短变粗。
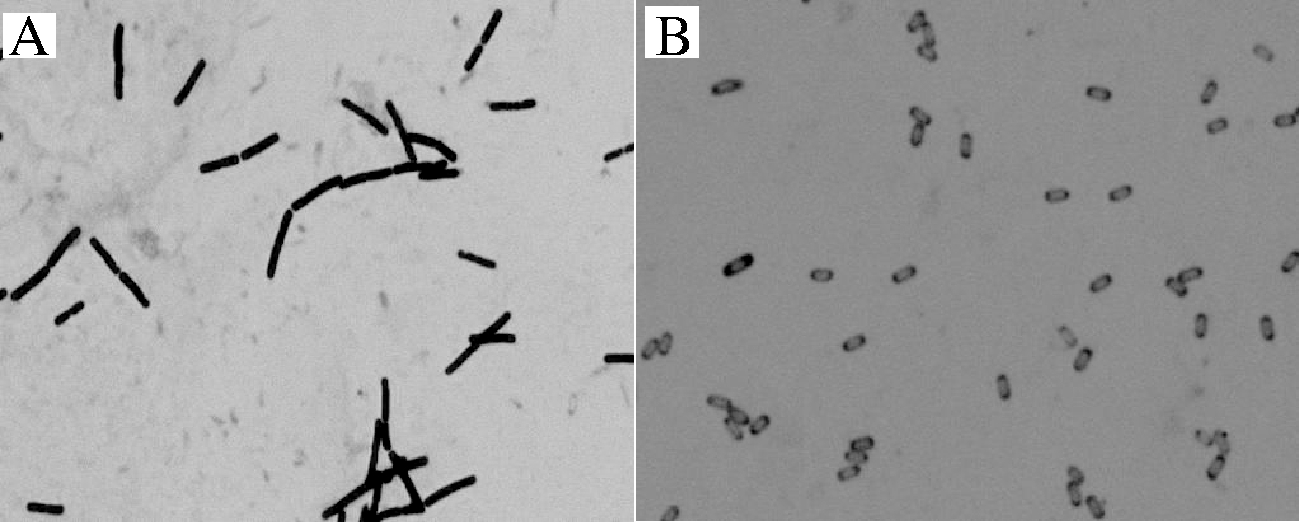
A-培养8 h的革兰氏染色结果;B-培养24 h的革兰氏染色结果
图2 KHQH-1的革兰氏染色结果
Fig.2 Gram staining results of KHQH-1
2.2.1 菌株的生化鉴定
由个体形态观察可知,该菌为革兰氏阳性芽孢杆菌,选择BCL芽孢杆菌鉴定卡。按照1.5.2.1的方法,对分离菌株KHQH-1进行生化鉴定,试验详情见表2,鉴定结果见表3。
根据表2的生化试验详情,VITEK 2鉴定结果(表3)显示, KHQH-1在枯草芽孢杆菌/解淀粉芽孢杆菌/萎缩芽孢杆菌中的概率为94%,此为可信度非常好的鉴定。枯草芽孢杆菌和解淀粉芽孢杆菌具有很近的亲缘关系,致使最初人们将解淀粉芽抱杆菌称为枯草芽抱杆菌的亚种,后来确定解淀粉芽抱杆菌是独立的有效物种之一[20-21]。为了进一步确定分离菌株的种别,采用分子生物学鉴定方法进行验证。
表2 菌株的生化试验详情
Table 2 Details of biochemical tests of strains

反应孔试验缩写剂量/反应孔/mg生化试验详情1β - 木糖苷酶BXYL0.032 4+3L-赖氨酸芳胺酶LysA0.022 8-4L-天冬氨酸芳胺酶AspA0.024+5亮氨酸芳胺酶LeuA0.023 4+7苯丙氨酸芳胺酶PheA0.026 4+8L-脯氨酸芳胺酶ProA0.023 4-9β -半乳糖苷酶BGAL0.036-10L-吡咯烷酮芳胺酶PyrA0.018+11α-半乳糖苷酶AGAL0.036+12丙氨酸芳胺酶AlaA0.022 2+13酪氨酸芳胺酶TyrA0.028 2+14β -N-乙酰氨基葡糖苷酶BNAG0.040 8(-)15丙氨酸-苯丙氨酸-脯氨酸芳胺酶APPA0.038 4-18环糊精CDEX0.3-19D-半乳糖dGAL0.3-21糖原GLYG0.187 5-22肌醇INO 0.3(-)24甲基-α -D-吡喃葡萄糖苷酸化MdG0.3+25ELLMANELLM0.03-26甲基-D-木糖苷MdX0.3-27α-甘露糖苷酶AMAN0.036-29麦芽三糖MTE0.3-30甘氨酸芳胺酶GlyA0.012+31D-甘露醇dMAN0.3 +32D-甘露糖dMNE0.3 +34D-松三糖dMLZ0.3 -36N-乙酰-D-氨基葡萄糖NAG0.3 -37古老糖PLE0.3 +39L-鼠李糖IRHA 0.3 -41β -葡糖苷酶BGLU 0.036 +43β -甘露糖苷酶BMAN0.036 -44磷酰胆碱PHC 0.036 6 -45丙酮酸盐PVATE 0.15 +46α -葡糖苷酶AGLU 0.036 +47D-塔格糖dTAG 0.3 -48D-海藻糖dTRE 0.3 +50菊粉INU 0.12 -53D-葡萄糖dGLU0.3 +54D-核糖dRIB0.3 -56腐胺同化PSCNa0.201 -58在 6.5% NaCl 中生长NaCl 6.5%1.95 +59对卡那霉素耐药KAN 0.006 -60对竹桃霉素耐药OLD0.003 -61七叶苷水解ESC 0.022 5 +62红四氮唑TTZ 0.018 9+63对多黏菌素 B 耐药POLYB_R0.000 93-
注:表中未注明编号的反应孔(1~64)为空白;带PC计算机的VITEK® 2 Systems结果显示为+、-、(-) 或(+);+=95%~100% 阳性;-=0%~5% 阳性;当无法确定某结果为明确阳性或明确阴性时,如果反应稍低于阈值则显示为弱阴性(-),如果反应稍高于阈值则显示为弱阳性(+)
表3 菌株的生化鉴定结果
Table 3 Biochemical identification results of strains

菌株VITEK 2鉴定结果结果概率/%置信度ATCC6633-1Bacillus subtilis/amyloliquefaciens/atrophaeus90好的鉴定KHQH-1 Bacillus subtilis/amyloliquefaciens/atrophaeus94非常好的鉴定
注:相似细菌的(混合)分类群鉴定结果当所列分类群的生化谱相同时会出现这种情况
2.2.2 16S rRNA 基因序列及系统进化分析
采用试剂盒提取DNA,按1.5.3方法进行基因组PCR 扩增、测序、序列与GeneBank数据库比对,确定该菌为芽孢杆菌属。其中与其拟合度最高(99.75%以上)的为解淀粉芽孢杆菌(Bacillus amyloliquefaciens),其他拟合度98%以上的细菌有丝状芽孢杆菌(Bacillus velezensis)、死谷芽孢杆菌(Bacillus vallismortis)、枯草芽孢杆菌(Bacillus subtilis)等。选取芽孢杆菌属中与目标菌株相似性较近的菌株序列,构建系统发育树,结果(图3)显示,分离菌株KHQH-1与解淀粉芽孢杆菌的亲缘关系较近。
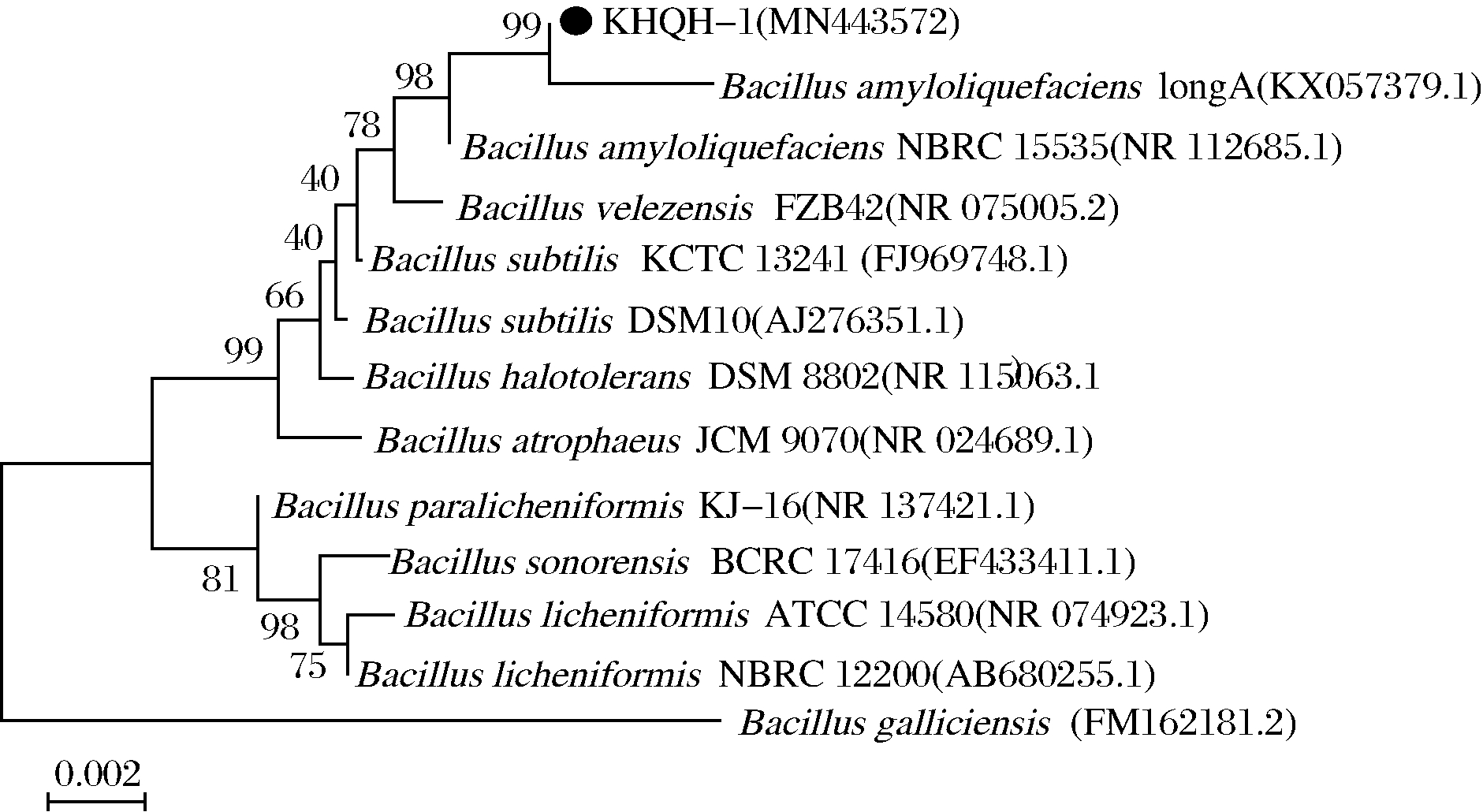
图3 菌株 KHQH-1 系统发育进化树
Fig.3 Phylogenetic tree based on 16S rRNA sequence of strain KHQH-1
分别将菌株KHQH-1与霉菌和细菌进行抑菌试验,实验过程中定期观察是否有拮抗现象,有拮抗现象的等到KHQH-1抑菌圈大小不再发生变化时,分别测量抑菌圈和菌落外缘的垂直直径,并计算该菌抑菌圈的大小如表4、图4、图5所示。
由表4可知, KHQH-1对红曲霉没有抑制作用;对根霉和米曲霉均有一定抑菌作用,抑菌圈大小分别为6.30和6.43 mm,抑制效果不强,可以考虑在发酵食品和饲料中进行应用,但是要注意不同菌种使用先后顺序和时间间隔;纳豆菌对食品和饲料中常见的霉菌—黄曲霉、青霉和绿色木霉均有较强抑制效果,其抑菌圈大小分别为13.70、9.30和10.87 mm,抑菌圈大小可作为拮抗作用强弱的标志,抑菌圈≥9.0 mm表示抑菌能力较强[23],可见对黄曲霉抑制效果最强,因为不存在有益菌和有害菌共同用于发酵的情况,此处选择滤纸片法,主要用滤纸片吸收KHQH-1发酵上清液,考察其抑菌情况;纳豆菌对食品中常见细菌大肠杆菌和金黄色葡萄球菌均有抑制作用,抑菌圈大小分别为8.20和3.20 mm,可见对革兰氏阴性细菌大肠杆菌抑制效果更好。
表4 KHQH-1对不同微生物抑菌圈大小 单位:mm
Table 4 Bacteriostasis circle size of KHQH-1 to different microorganisms
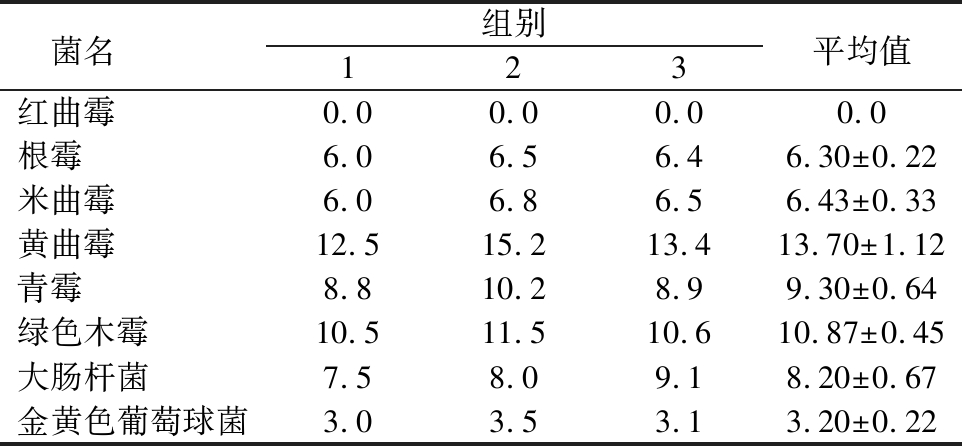
菌名 组别平均值1 2 3 红曲霉 0.0 0.0 0.0 0.0 根霉 6.0 6.5 6.4 6.30±0.22米曲霉 6.0 6.8 6.5 6.43±0.33黄曲霉 12.5 15.2 13.4 13.70±1.12青霉 8.8 10.2 8.9 9.30±0.64绿色木霉 10.5 11.5 10.6 10.87±0.45大肠杆菌 7.5 8.0 9.1 8.20±0.67金黄色葡萄球菌3.0 3.5 3.1 3.20±0.22
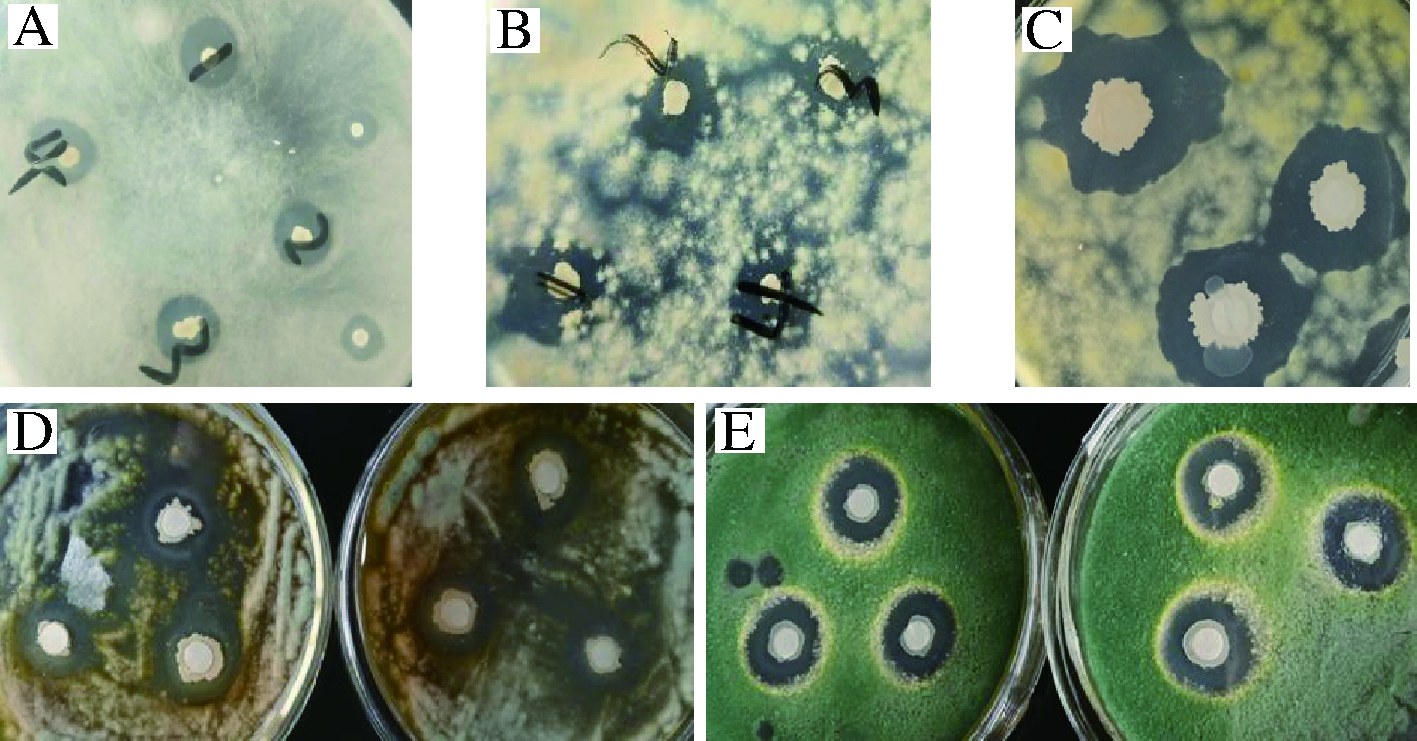
A-根霉;B-米曲霉;C-黄曲霉;D-青霉; E-绿色木霉
图4 KHQH-1对霉菌的抑制效果
Fig.4 Inhibitory effect of KHQH-1 on mould
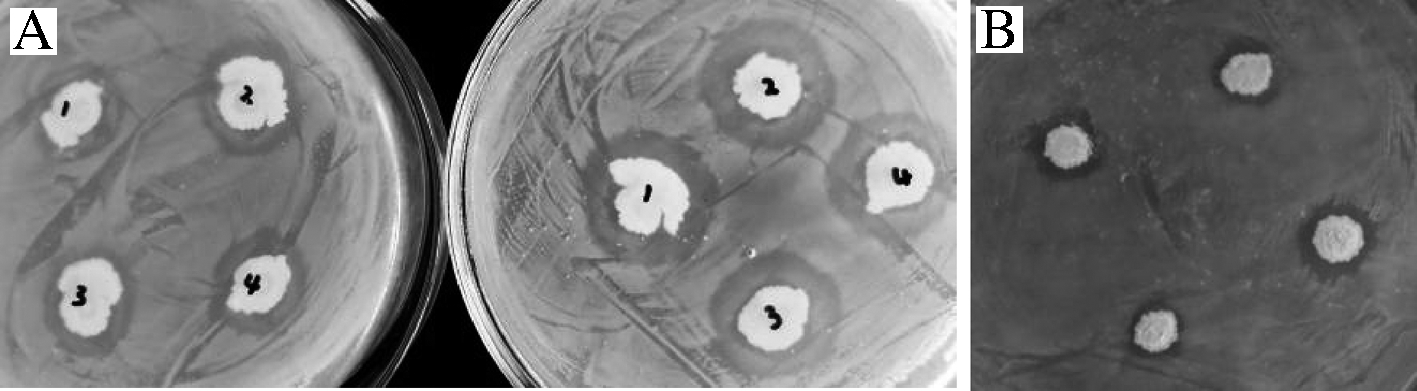
A-大肠杆菌;B-金黄色葡萄球菌
图5 KHQH-1对细菌的抑制作用
Fig.5 Inhibitory effect of KHQH-1 on bacteria
目前不同来源的解淀粉芽孢杆菌不断被分离鉴定,但是其应用主要集中在作物生防方面,将其应用于食品防腐保鲜方面的研究鲜见报道。刘超等[24]研究了解淀粉芽胞杆菌BA-26 抗菌粗提物的抑菌谱,发现BA-26 抗菌粗提物对所试真菌都有十分明显的抑制作用,抑菌圈直径均在 15.7 mm 以上;而对金黄色葡萄球菌和大肠杆菌没有抑菌作用。柴庆凯等[25]将解淀粉芽孢杆菌 LJ02的粗提液应用于黄瓜灰霉病,粗提液通过喷施、灌根、注射3种施用方式的抑制率分别为 47.50%、66.23%和 49.33%。史一然等[26]研究了解淀粉芽孢杆菌LZN01对西瓜专化型尖孢镰刀菌的抑制效应。陈照等[27]对从槟榔树根际土壤中分离到的1株解淀粉芽孢杆菌HAB-9进行鉴定并对17种植物病原菌的拮抗作用进行试验,其中对槟榔炭疽效果最好。杨帆等[28]筛选出拮抗菌株解淀粉芽孢杆菌BA-26,该菌对所试8 种马铃薯病原真菌均表现出较强的拮抗作用。由此可知,本研究对从柑橘分离的解淀粉芽孢杆菌,分别对食品中有益霉菌、有害霉菌和有害细菌进行了抗菌谱实验,得到了有价值的拮抗效果。
近几年关于解淀粉芽孢杆菌的研究较多,主要集中在解淀粉芽孢杆菌在动物饲料、植物病虫害防治及作物生长调节方面的研究,而且抗菌谱方面的研究也主要集中在引起植物病害的微生物方面,然而对食品中应用的微生物及引起食品腐败变质微生物的研究较少。本研究进行了扩大解淀粉芽孢杆菌应用范围的尝试,对于在食品生产及防腐方面的应用提供新的思路及参考。
前期课题组在对柑橘的防腐保鲜研究中,从柑橘上分离筛选得到1株细菌,经形态、生化和分子鉴定,确定该菌为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。该菌对红曲霉没有任何抑制效果,这与红曲霉本身能产生抑菌物质有关。然而该解淀粉芽孢杆菌对食品中常见的霉菌具有抑制作用,对根霉和米曲霉具有一定抑制效果;对能够产生黄曲霉毒素的黄曲霉、危害蔬果的青霉和对食用菌栽培危害严重的绿色木霉3种霉菌具有较强的抑制作用。该菌对使用浓度较大的革兰氏阳性细菌金黄色葡萄球菌具有一定抑制效果,并且对革兰氏阴性细菌大肠杆菌具有较高抑制能力。由此可见该菌具有广谱抗菌活性。Bacillus amyloliquefaciensKHQH-1的分离及鉴定丰富了抗菌微生物资源,具有潜在开发出新抗菌化合物的可能,对具体的抑菌物质分离及其结构分析鉴定有待进一步研究,将其广谱抗菌能力应用于食品防腐保鲜、生防、饲料添加等方面的方式方法亟待进一步探索。
[1] 金红,叶锐,徐晶,等.抗菌肽对食品腐败菌抑制效果的研究进展[J].农产品加工,2018(3):59-63.
[2] 黄应维,徐匆,马锞,等.果蔬微生物保鲜技术的研究进展[J].现代食品科技,2013,29(6): 1 455-1 458.
[3] 蔡国林,冯文旭,刘逸凡,等.高产抑制大肠杆菌血凝性的胞外多糖的解淀粉芽孢杆菌[J].食品与发酵工业,2019,45(5):14-18.
[4] 尹珺伊,陈楠楠,王岩,等. 解淀粉芽胞杆菌SSY2分离鉴定及其拮抗霉菌特性研究[J].动物医学进展,2019,40(4):75-79.
[5] 陈建军,郝之奎,廖祥儒,等. Bacillus amyloliquefaciens MBRC1 的鉴定与抗菌活性研究[J]. 食品与生物技术学报,2019,38(2):126-132.
[6] SHAHZADI S,KHAN Z,REHMAN A,et al.Isolation and characterization of bacillus amyloliquefaciens 6a: A novel kerosene oil degrading bacterium[J].Environmental Technology & Innovation, 2019, 14: 100 359.
[7] 洪鹏,安国栋,胡美英, 等. 解淀粉芽孢杆菌防治果蔬采后病害研究进展[J]. 中国农学通报,2013, 29(12):168-173.
[8] CALVO H,MENDIARA I,ARIAS E, et al. The role of iturin A from B. amyloliquefaciens BUZ-14 in the inhibition of the most common postharvest fruit rots[J]. Food Microbiology, 2019, 82: 62-69.
[9] 耿阳阳,徐俐,刘昕,等. 解淀粉芽孢杆菌发酵液在鲜核桃保鲜中的应用[J]. 食品与发酵工业, 2013, 39(9):214-218.
[10] CUI W Y, HE P J, MUNIR S, et al. Efficacy of plant growth promoting bacteria Bacillus amyloliquefaciens B9601-Y2 for biocontrol of southern corn leaf blight[J]. Biological Control,2019,139:104 080.
[11] AGUSTIN L B, RAUNEL TV, GERARDO C, et al. Effects of bacillomycin D homologues produced by Bacillus amyloliquefaciens 83 on growth and viability of Colletotrichum gloeosporioides at different physiological stages[J]. Biological Control, 2018,127(12): 145-154.
[12] ZHANG Qingxia, ZHANG Ying, HE Lingling, et al. Identification of a small antimycotic peptide produced by Bacillus amyloliquefaciens 6256[J]. Pesticide Biochemistry and Physiology, 2018,150(9):78-82.
[13] 邝格灵,张洁,孔德华,等. 植物乳杆菌与解淀粉芽孢杆菌对食醋风味的影响[J].中国酿造,2018,37(6):25-29.
[14] 赵龙,周池虹伶,赵谋明,等.解淀粉芽孢杆菌SWJS22和米曲霉混合制曲在酱油发酵中的应用[J].食品科学, 2017,38(22):125-130.
[15] 孙燕萍,彭浩,凌霞,等. VITEK2Compact全自动微生物分析系统的应用及鉴定结果分析[J]. 现代预防医学,2010, 37(20):3 891-3 893.
[16] 林杰,张景艳,王磊,等.VITEK2 Compact全自动微生物分析系统对牛乳中葡萄球菌的鉴定效果评价[J].微生物学通报,2016, 43(11):2 514-2 520.
[17] 杨玉红,陈淑范.食品微生物学.[M].第2版.武汉:武汉理工大学出版社,2014.
[18] FRANK J A,REICH C I,SHARMA S,et al.Critical evaluation of two primers commonly used for amplification of bacterial 16S rRNA genes[J].Applied and Environmental Microbiology,2008,74(8):2 461-2 470.
[19] 付志英,刘彩珍,周红艳,等.纳豆菌拮抗黄曲霉试验方法的研究[J].中国调味品,2019,44(4):93-96.
[20] 权春善,王军华,徐洪涛,等.一株抗真菌解淀粉芽孢杆菌的分离鉴定及其发酵条件的初步研究[J].微生物学报,2006,46(1):7-12.
[21] 张超,王祥红,徐涛,等.一株解淀粉芽孢杆菌的分离鉴定及其抑菌条件研究[J].生物技术通报,2015,31(9):170-176.
[22] FELSENSTEIN J. Confidence limits on phylogenies: An approach using the bootstrap[J]. Evolution, 1985, 39(4): 783-791.
[23] 冯志珍.解淀粉芽胞杆菌FB-16的筛选及其对作物疫霉菌的抑制作用[D].杨凌:西北农林科技大学,2012.
[24] 刘超,刘洪伟,汪步青,等. 解淀粉芽孢杆菌BA-26抗菌物质分离及对灰葡萄孢抑菌作用研究[J]. 生物技术通报, 2019,35(7):83-89.
[25] 柴庆凯,张斌,常若葵,等.解淀粉芽孢杆菌LJ02对黄瓜抗灰霉病菌的生防效果及其诱导抗性机理的初步研究[J].植物病理学报,2019,49(6):828-835.
[26] 史一然,徐伟慧,吕智航,等. 解淀粉芽孢杆菌 LZN01 对西瓜专化型尖孢镰刀菌的抑制效应[J].江苏农业科学,2019,47(12): 141-145.
[27] 陈照,李培征,刘惠芳,等.解淀粉芽孢杆菌HAB-9的鉴定及对17株植物病原菌的拮抗作用[J]. 热带农业科学, 2019,39(7):47-52.
[28] 杨帆,张飞燕,孙劲冲,等.马铃薯真菌病害拮抗菌株鉴定及初步应用[J].中国蔬菜,2019(11):56-62.