丙酮酸(pyruvic acid)是一种重要的小分子有机酸,在临床上可以用于治疗抑郁症和创伤性脑损伤[1],也常用来制备谷物保护剂和氢化阿托酸[2],还可用作食品添加剂改善人体机能[3]。目前,丙酮酸的生产方法主要有化学合成法、酶转化法以及微生物发酵法。工业生产常用的方法是化学合成法,主要为酒石酸法,但这种方法成本普遍较高且对环境污染严重[4]。酶转化法是利用微生物中某些酶催化底物分子结构中的某一部分转变为与底物结构类似的物质[5]。多年来研究者利用了不同的酶,如L-氨基酸脱氨酶、丙酮酸合成酶、D-乳酸脱氢酶等催化不同底物以生产丙酮酸[6-9]。虽然酶转化法具有较大的优势,可以大幅度降低污染,而且有些具有较高的底物转化率[10],但是由于底物成本较高等条件的限制,实现产业化仍存在较大困难。
相比化学合成法和酶转化法,微生物发酵法可以利用廉价的可再生碳源生产丙酮酸,大幅降低生产成本,同时能提高产品的安全性,降低生产过程中的污染。目前有一些微生物用于发酵法生产丙酮酸,如光滑球拟酵母[11]、酿酒酵母[12]、大肠杆菌[13]等。许多策略被开发用于强化丙酮酸的生产。周景文等[14]借助代谢工程及微生物生理学手段,阐述了光滑球拟酵母中ATP对胞内微环境的调控以及对菌株生长和丙酮酸合成机制的影响。徐沙等[15]借助多种组学技术解释了光滑球拟酵母酸胁迫下的丙酮酸积累机制,并进一步改善了菌株的酸耐受性。罗正山等[16]通过控制能量代谢提高了糖酵解效率和丙酮酸的积累水平,最终丙酮酸摇瓶产量为40.2 g/L。目前关于微生物发酵法主要通过基因工程手段激活或改善胞内转运途径、糖酵解和TCA循环中靶基因的转录翻译水平以强化丙酮酸的生产,有关发酵过程优化与控制的报道相对较少。
本研究通过对筛选得到的突变菌株进行发酵鉴定,对具有较强丙酮酸生产能力的光滑球拟酵母进行发酵优化。通过改善相关培养基成分与质量浓度,大幅度提高了摇瓶发酵水平。在此基础上,进一步在15 L发酵罐上分析了发酵过程的动力学参数,设计了一种恒速补料流加方案,强化了丙酮酸的生产,为进一步提升工业水平丙酮酸发酵性能奠定了基础。
1 材料与方法
1.1 实验材料
1.1.1 菌株与质粒
光滑球拟酵母(Candida glabrata)CCTCC M202019 4种维生素营养缺陷型菌株(硫胺素、生物素、烟酸、吡哆醇),为本实验室保存[17],C.glabrata 5D1、4C4、4A4,3G5、4H2和5C6为筛选得到的高产突变株[18]。
1.1.2 主要试剂
大豆蛋白胨、蛋白粉、酵母粉,Oxoid公司,硫胺素、吡哆醇、烟酸和生物素,Sigma-Aldrich公司,其他试剂来自国药试剂。
1.1.3 培养基
YPD培养基(g/L):蛋白胨 20,酵母膏 10,葡萄糖20。
种子培养基(g/L):葡萄糖 30,大豆蛋白胨 10,MgSO4·7H2O 0.5,KH2PO4 1,2 mol/L HCl调节培养基初始pH至5.5,于115 ℃下灭菌20 min。固体培养基中加入15~20 g/L琼脂,于115 ℃下灭菌20 min。
发酵培养基(g/L):葡萄糖 120,尿素 3.86,MgSO4·7H2O 0.8,KH2PO4 2,CH3COONa 3。微量元素液 10 mL/L,维生素液 10 mL/L,于115 ℃下灭菌20 min。
微量元素液(g/L):MnCl2·4H2O 12,FeSO4·7H2O 2,CaCl2·2H2O 2,CuSO4·5H2O 0.05,ZnCl2 0.5,用2 mol/L HCl溶解,过滤除菌后于4 ℃保存。
维生素液(g/L):生物素 0.004,硫胺素 0.75 mg/L,吡哆醇 0.04,烟酸 0.8,用2 mol/L的HCl溶解,过滤除菌后于4 ℃保存[19]。
1.1.4 仪器与设备
安捷伦1200液相色谱仪,美国安捷伦公司;15 L全自动灭菌发酵罐,上海迪比尔生物工程有限公司;恒温摇床,上海知楚仪器有限公司;恒温培养箱,上海跃进医疗器械厂;台式高速离心机,德国Eppendorf公司;722s可见分光光度计,上海棱光技术有限公司;葡萄糖-乳酸生物传感器分析仪,深圳西尔曼科技有限公司。
1.2 实验方法
1.2.1 培养条件
种子培养:挑取活化的单菌落于液体种子培养基中,于30 ℃,220 r/min培养20~22 h。
摇瓶发酵培养:培养好的种子液以10%(v/v)的接种量接入装有发酵培养基的摇瓶中,在30 ℃,220 r/min的摇床上进行发酵培养。同时加入40 g/L的CaCO3作为发酵过程中pH缓冲剂。
发酵罐培养:以10%接种量将培养好的种子液转接到15 L发酵罐中,总装液量为9 L,搅拌转速600 r/min,通气量9 L/min,8 mol/L NaOH溶液调节pH恒定控制在5.5,30 ℃下培养。发酵过程中多次取样测定菌株的发酵参数。
1.2.2 分析方法
取适当体积的发酵液,加入适量的HCl除去CaCO3,加入去离子水将菌液稀释至合适的倍数,测定OD660。细胞干重(DCW)与吸光度之间的关系为![]() ;利用葡萄糖-乳酸生物传感器分析仪对发酵液中葡萄糖含量进行测定;利用高效液相色谱对丙酮酸含量进行检测分析。其色谱检测条件为:有机酸柱型号为Amin HPX-87H column(Bio-Rad, Hercules, CA, USA),紫外检测波长210 nm,柱温箱温度为40 ℃,进液量为10 μL,流速为0.5 mL/min,流动相为5 mmol/L的稀H2SO4,样品稀释成合适的倍数并进行0.22 μm的膜过滤处理;最终糖酸转化率(g/g)按公式(1)计算:
;利用葡萄糖-乳酸生物传感器分析仪对发酵液中葡萄糖含量进行测定;利用高效液相色谱对丙酮酸含量进行检测分析。其色谱检测条件为:有机酸柱型号为Amin HPX-87H column(Bio-Rad, Hercules, CA, USA),紫外检测波长210 nm,柱温箱温度为40 ℃,进液量为10 μL,流速为0.5 mL/min,流动相为5 mmol/L的稀H2SO4,样品稀释成合适的倍数并进行0.22 μm的膜过滤处理;最终糖酸转化率(g/g)按公式(1)计算:
(1)
式中:ρ,丙酮酸最终质量浓度,g/L;V,发酵液总体积,L;m,总耗糖质量,g。
采用Origin 2019b对单因素实验结果进行显著性分析,统计显著性表示如下,*为P<0.05, **为P<0.01。
2 结果与分析
2.1 高产丙酮酸生产菌株的筛选
实验筛选获得的光滑球拟酵母菌株共7株,分别为C.glabrata CCTCC M202019、5D1、4C4、4A4,3G5、4H2和5C6。在相同条件下,对该7株菌株进行摇瓶水平发酵。通过高效液相色谱对各菌株丙酮酸的最终产量进行检测,得到相对高产的丙酮酸生产菌株。
由图1和表1可以看出,7株菌株丙酮酸最终产量有所差异。其中C.glabrata 4H2的丙酮酸产量相对最高,达到(38.85±0.16)g/L,丙酮酸生产强度qv为0.61 g/(L·h),糖酸转化率Q(丙酮酸/葡萄糖)为0.32 g/g。综上,选择菌株C.glabrata 4H2进行进一步地发酵优化以强化丙酮酸的生产。
2.2 氮源及其浓度对丙酮酸发酵过程的影响
氮源作为种子液中最重要的组成成分,其种类对种子的生长代谢有重要影响。本研究中,在摇瓶水平首先比较了大豆蛋白胨、大豆蛋白粉、玉米蛋白粉3种不同氮源对发酵的影响。通过比较发酵过程中菌体生长和产物丙酮酸积累的差异,确定种子培养基中的最佳氮源种类。由图2-A及2-B可知,在以大豆蛋白胨作为氮源时,菌株丙酮酸产率和菌体生长浓度均为最佳。
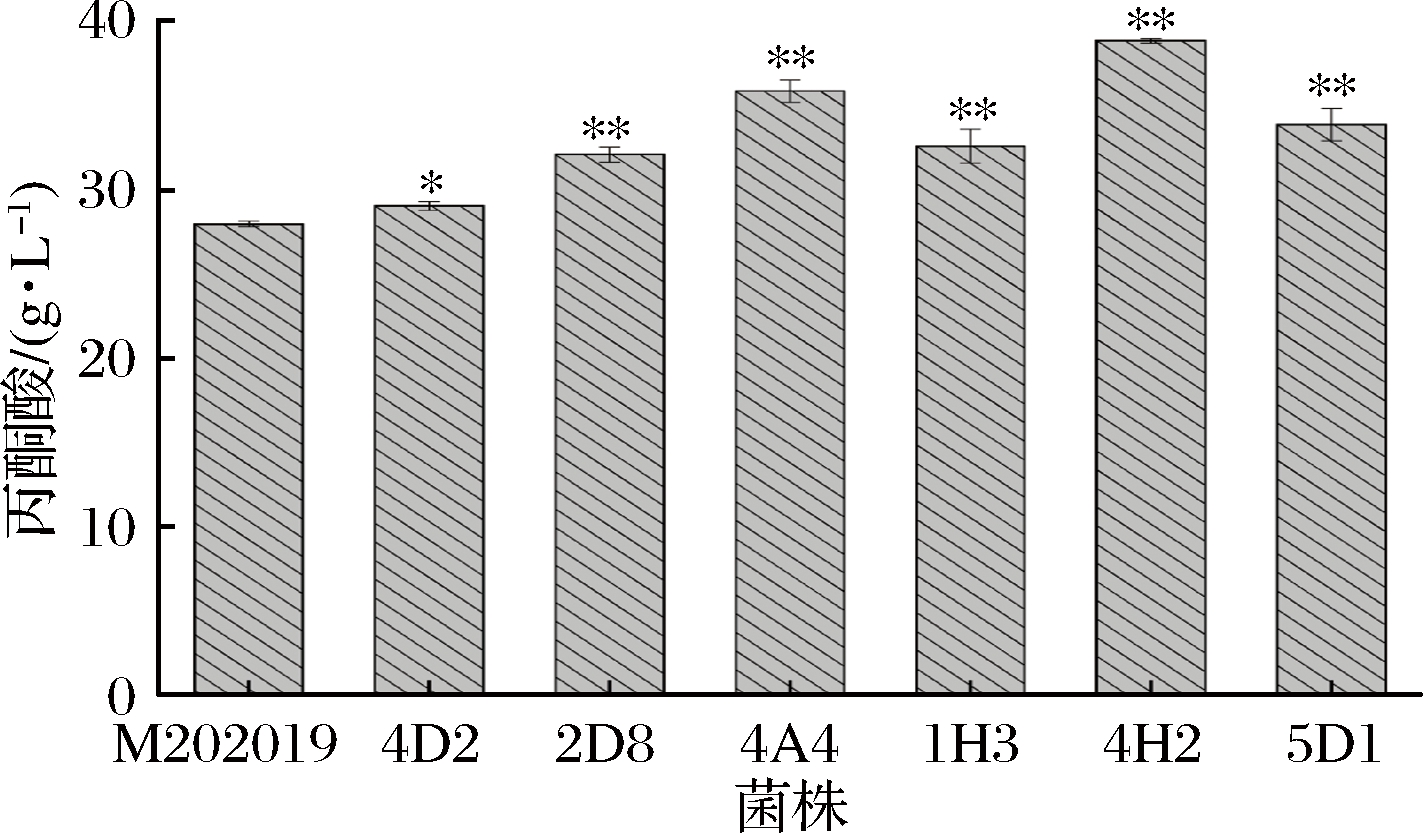
图1 筛选菌株丙酮酸产量对比
Fig.1 Comparison of pyruvate production of screened strains
表1 筛选菌株发酵参数的对比
Table 1 Comparison of fermentation parameters of screened strains
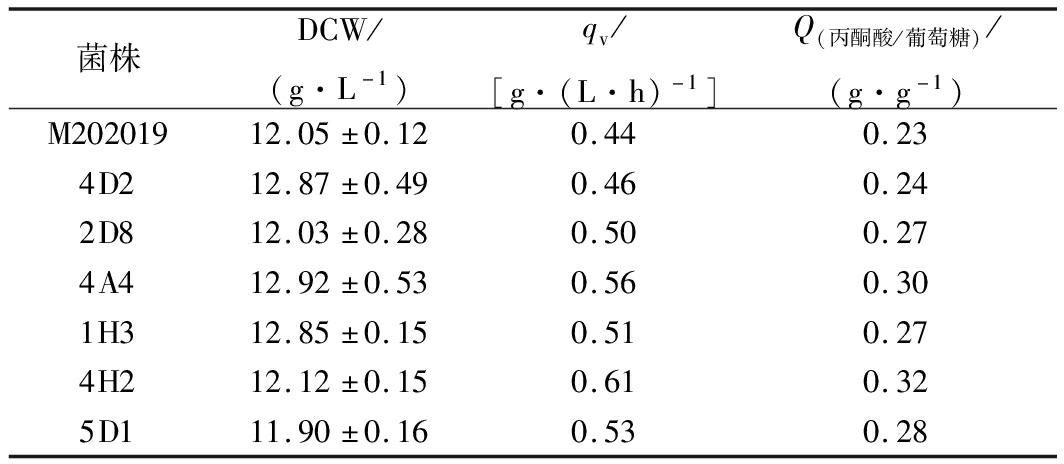
菌株DCW/(g·L-1)qv/[g·(L·h)-1]Q(丙酮酸/葡萄糖)/(g·g-1)M20201912.05±0.120.440.234D212.87±0.490.460.242D812.03±0.280.500.274A412.92±0.530.560.301H312.85±0.150.510.274H212.12±0.150.610.325D111.90±0.160.530.28
在确定该菌株丙酮酸生产最佳的氮源为大豆蛋白胨之后,继续选取了4个浓度梯度的该种氮源进行发酵,以探究该种氮源的添加量对丙酮酸发酵的影响。不同浓度的大豆蛋白胨对丙酮酸的产率和菌体的生长有着不同程度的影响。由图2-C可知,在大豆蛋白胨质量浓度为10 g/L时,丙酮酸产量和菌体生长状况都相对较好,在15 g/L时,丙酮酸产量有所下降。对比丙酮酸产量并考虑经济性因素,确定发酵生产最适氮源为大豆蛋白胨,且其添加的质量浓度为10 g/L。
2.3 摇瓶水平发酵检测
将菌株C.glabrata 4H2在上述优化后的培养基中培养,接种至250 mL摇瓶中进行发酵,结果如图3-A所示。菌株在52 h丙酮酸产量即达到(48.56±0.46)g/L,丙酮酸生产强度为0.93 g/(L·h),糖酸转化率为0.46 g/g,比优化之前(图3-B)分别提高25.0%、52.5%和43.8%。由图3-C和3-D可看出,在前14.3和25.1 h,菌株在优化培养基中的比生长速率和产物比合成速率均强于优化前,表明菌株前中期具有更好的生长状况,以及具有较快的丙酮酸积累速率。其最大比生长速率与最大比丙酮酸合成速率分别为0.21 h-1和0.42 g/(g·h),比优化前有所提升。
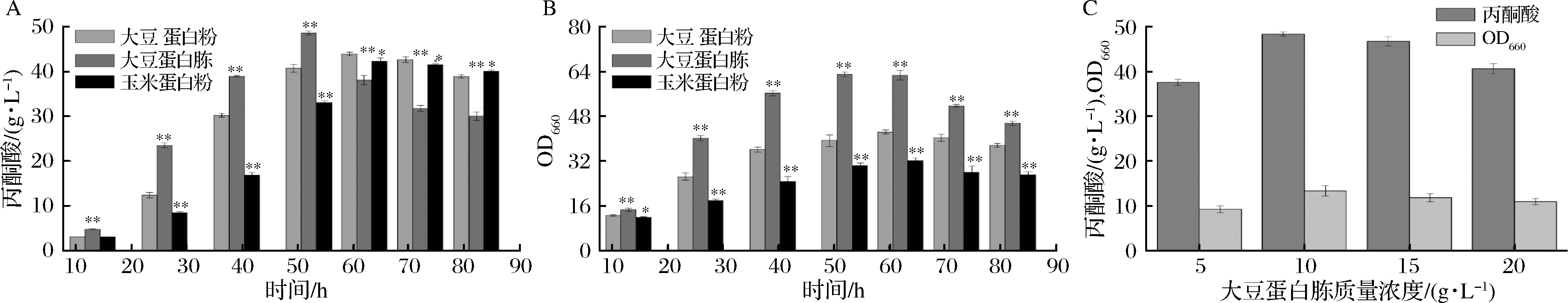
A-氮源种类对丙酮酸产量的影响;B-氮源种类对菌体生长的影响;C-大豆蛋白胨浓度对产量及菌体生长的影响
图2 氮源种类与浓度对菌体生长及丙酮酸产量的影响
Fig.2 Effects of nitrogen sources on the growth of strain and pyruvate production
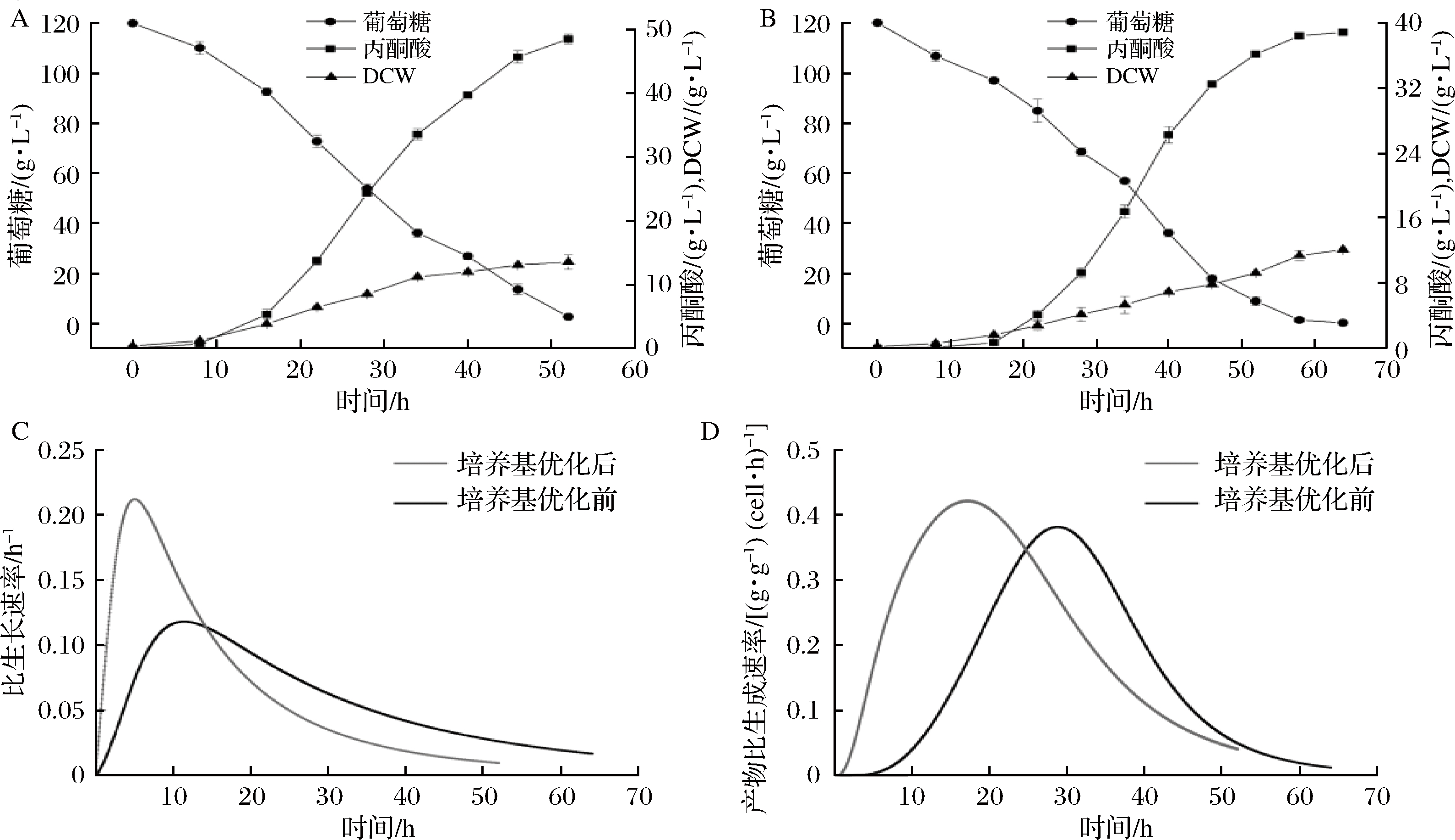
A-优化后摇瓶发酵过程;B-优化前摇瓶发酵过程;C-菌体比生长速率曲线;D-菌体丙酮酸比生成速率曲线
图3 种子培养基优化后菌株摇瓶发酵情况
Fig.3 Shaking flasks fermentation of strain after medium optimization
2.4 15 L发酵罐分批发酵
经过上述在摇瓶水平对种子培养基成分进行探索和验证后,确定了种子培养基的基本组分,在15 L发酵罐中进行菌株4H2的分批发酵培养(图4-A)。发酵0~16 h时,葡萄糖的消耗速率较为缓慢,丙酮酸产量处于较低水平;16 h之后,葡萄糖含量以较快速率下降,丙酮酸产量也迅速提升,并在70 h时达到最高值,最终丙酮酸产量为(67.81±0.27)g/L,较摇瓶水平提高39.64%。由图4-B和4-C可知,15 L发酵罐中分批发酵菌株最高比生长速率为0.19 h-1,最高比丙酮酸生产速率为0.41 g/(g·h),与摇瓶水平发酵动力学参数基本相同。上述结果表明,在15 L发酵罐中进行放大发酵培养,可在不影响菌体生长的情况下提高光滑球拟酵母积累丙酮酸的能力。
2.5 15 L罐流加补料发酵
2.5.1 流加发酵总糖浓度的影响
基于上述结果,在15 L自动发酵罐中对突变株4H2进行恒速补料发酵优化。初始葡萄糖浓度设为120 g/L,分别流加20、30、40 g/L质量浓度的葡萄糖。结果表明,在发酵前期丙酮酸产量很低,16 h之后丙酮酸产量迅速增加,葡萄糖消耗速率也逐渐增加,在28 h时已消耗至55~60 g/L,为延长细胞对数生长期和平衡期的持续时间,增加生物量及平衡期细胞代谢产物的积累,对其进行底物的流加发酵。当补料质量浓度为20 g/L时,发酵中后期葡萄糖消耗速度较快,在76 h时葡萄糖浓度几乎耗完,丙酮酸最终产量为(76.36±0.26)g/L(图5-A)。当补料质量浓度提高至30 g/L时,在发酵的中后期,丙酮酸含量继续以较高合成速率上升,在进行至64 h时,产量为73.79 g/L,丙酮酸合成速率放缓,在81 h时产量达到(80.15±0.35)g/L,糖酸转化率为0.69 g/g,生产强度0.99 g/(L·h)(图5-B)。继续提高补料浓度至40 g/L,发酵进行至76 h时丙酮酸的产量基本保持不变,最终产量为(78.42±0.33)g/L,直到87 h,培养基中仍有8.8 g/L的葡萄糖未耗尽(图5-C)。综上所述,考虑到丙酮酸终产量及经济效益等因素,选择30 g/L质量浓度的葡萄糖进行流加补料。
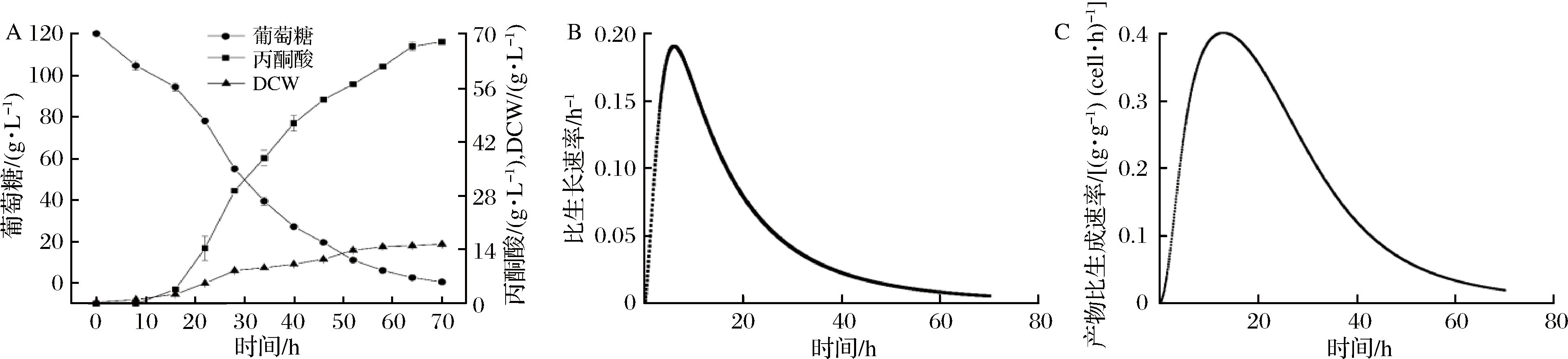
A-15 L发酵罐分批发酵过程;B-菌体比生长速率曲线;C-菌体丙酮酸比生成速率曲线
图4 C.glabrata 4H2在15 L罐中的分批发酵过程曲线
Fig.4 Process curve of batch fermentation of C.glabrata 4H2 in 15 L fermentor
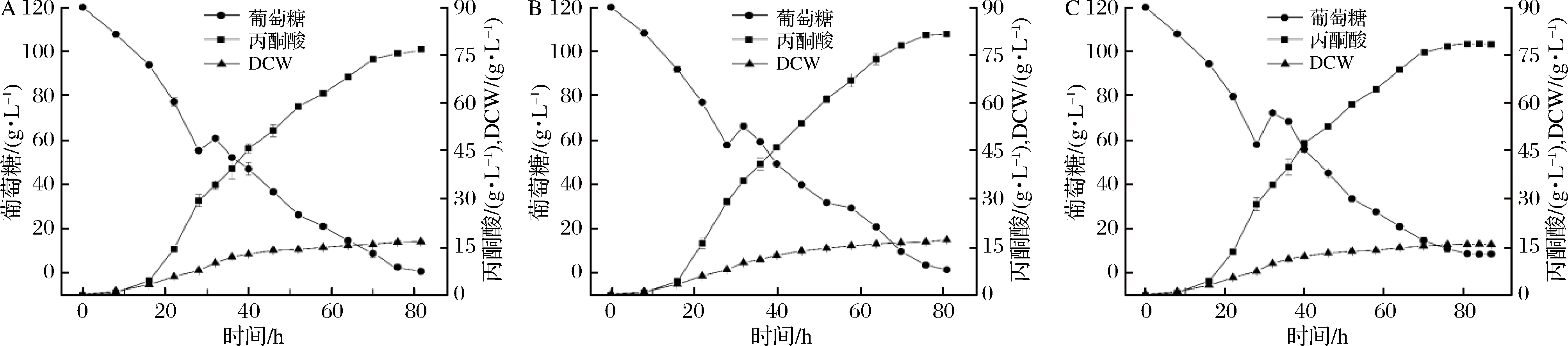
流加葡萄糖质量浓度分别为:A-20 g/L; B-30 g/L; C-40 g/L
图5 流加发酵总葡萄糖浓度的选择
Fig.5 Selection of total glucose concentration in fed batch fermentation
2.5.2 初始糖浓度的影响
在以葡萄糖为主要原料的发酵生产中,初始葡萄糖的质量浓度会对丙酮酸的生产有很大影响,因此为进一步改善丙酮酸的发酵过程,需要寻找一个适宜的初始葡萄糖质量浓度。为此,选择40、60、80、100、120、140 g/L的初始糖浓度,以探究其对C.glabrata 4H2的生长以及丙酮酸的积累的影响。由图6-A可知,较高浓度的初始葡萄糖(120、140 g/L)会对菌体的生长产生抑制,较低质量浓度的初始葡萄糖在前期可较快达到较高的细胞比生长速率。由图6-B可看出,20 h后初始浓度为40 g/L的发酵培养基葡萄糖耗尽;初始糖浓度为80 g/L时,丙酮酸/DCW值最高,为(2.26±0.02)g/g;24 h后初始浓度为60 g/L的发酵培养基葡萄糖耗尽,此时初始糖浓度为80 g/L时菌株丙酮酸/DCW依然最高,达到(2.65±0.01)g/g,而葡萄糖浓度为140 g/L时,丙酮酸/DCW明显降低。表明初始培养基中高浓度的葡萄糖对前期的菌体发酵确实存在抑制作用。综上所述,选择初始葡萄糖浓度为80 g/L的培养基进行发酵。
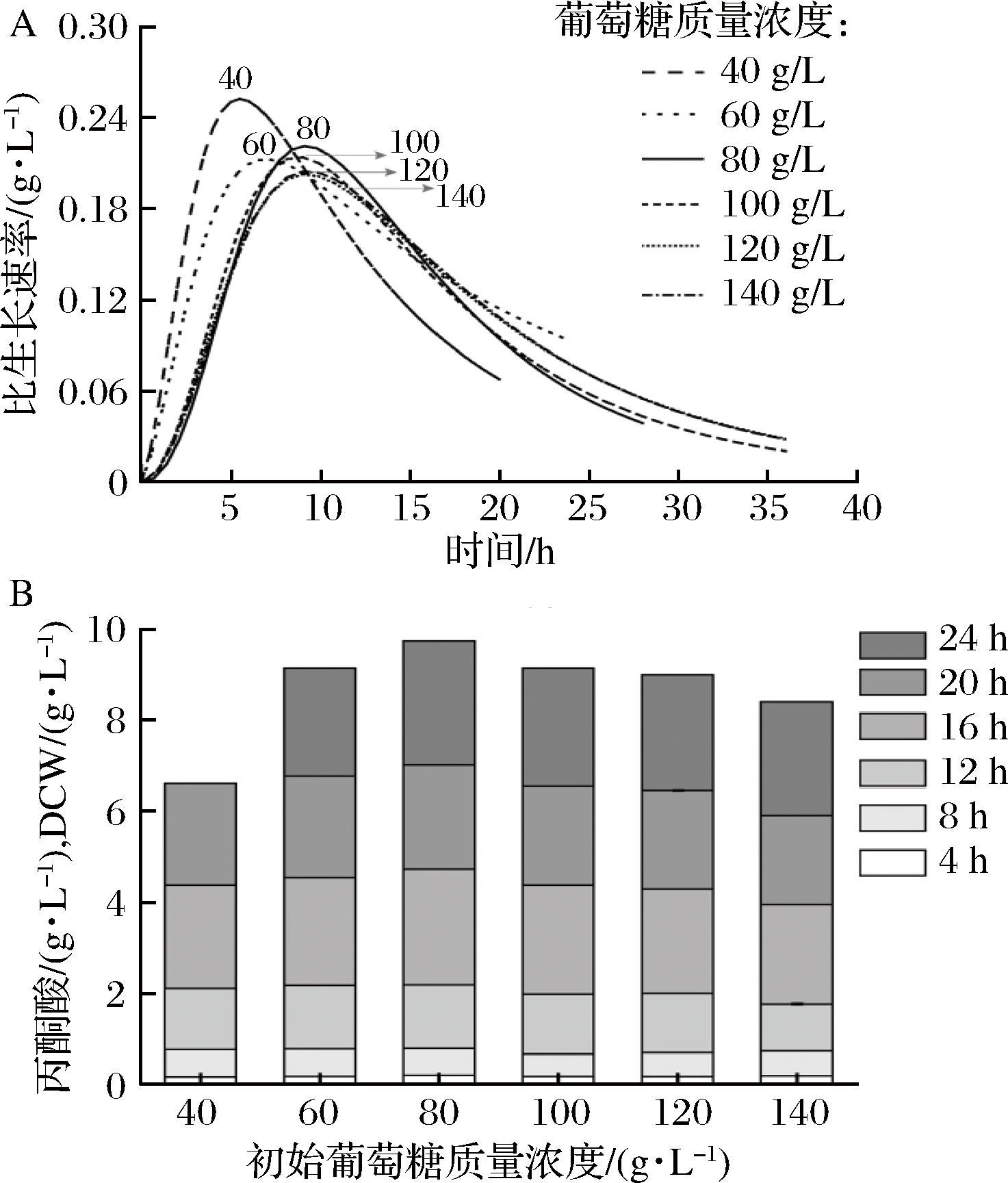
A-不同初始葡萄糖质量浓度对比生产速率的影响;B-不同初始葡萄糖质量浓度对单位菌体丙酮酸生成能力的影响
图6 初始葡萄糖质量浓度的影响
Fig.6 Effect of initial glucose concentration
2.5.3 补料时机对发酵的影响
为进一步强化光滑球拟酵母突变菌株生产丙酮酸,继续考察了补料时机对发酵过程的影响。初始糖质量浓度为80 g/L,以发酵液中的葡萄糖质量浓度为参考,分别选取其浓度降低至65、55、45、35以及25 g/L五个不同浓度时期进行补料,为保持葡萄糖总浓度为150 g/L,补加的葡萄糖质量浓度为70 g/L。对比发现,如图7-A,当发酵进行至12 h时,残糖为65 g/L时进行补料,此时葡萄糖消耗速度相对较慢,其浓度迅速积累,81 h发酵结束时丙酮酸终产量为(81.37±0.42)g/L, 生产强度为1.01 g/(L·h)。如图7-C和7-D,当发酵分别进行至23与27 h时,葡萄糖含量分别降低至45与35 g/L,分别在此时进行补料流加,发现这2种补料策略在发酵中后期的耗糖速率均较快,丙酮酸的终产量分别为(79.94±0.72)g/L和(83.62±0.86)g/L。如图7-E,当发酵进行至33 h时,葡萄糖质量浓度降低至约25 g/L进行补料,发现菌株在72 h后葡萄糖消耗速率严重降低,发酵至91 h时,发酵液中仍有约22.3 g/L的葡萄糖未被利用,丙酮酸终产量仅为(72.58±0.33)g/L,生产强度与底物利用率均较低,表明在发酵后期高质量浓度的葡萄糖对丙酮酸合成具有一定的抑制作用。如图7-B,当发酵至17 h时,葡萄糖含量降低至55 g/L时进行补料流加,发现中后期葡萄糖消耗较快,丙酮酸的终产量最高,达到(86.63±0.29)g/L,糖酸转化率为0.78 g/g,生产强度为1.07 g/(L·h)。

剩余葡萄糖质量浓度分别为: A-65 g/L; B-55 g/L; C-45 g/L; D-35 g/L; E-25 g/L
图7 补料时机对发酵的影响
Fig.7 Effect of feeding time on fermentation
3 讨论
丙酮酸作为一种重要的工业原料,广泛应用于制药、日化、食品以及农业等领域[21]。目前主要通过基因工程手段激活或改善细胞中转运途径、糖酵解或TCA循环中某些靶基因的转录翻译水平以强化丙酮酸的生产[16],有关发酵过程优化与控制的报道相对较少。本文从7株菌种鉴定出最佳菌株C.glabrate 4H2,并对其生产丙酮酸的发酵过程进行优化,确定了最佳种子培养基相关成分以及质量浓度。在此条件下,摇瓶水平发酵52 h丙酮酸最高产量为(48.56±0.46)g/L,生产强度为0.93 g/(L·h),糖酸转化率为0.46 g/g,较未优化前分别提高了25.0%、52.5%和43.8%。在此基础上进行15 L发酵罐的放大发酵,丙酮酸产量达(67.8±0.27)g/L,并对过程中的发酵动力学参数进行了分析。进一步对15 L罐中流加发酵生产丙酮酸的工艺进行探究,确定了总葡萄糖质量浓度为150 g/L,初始葡萄糖为80 g/L,并在剩余葡萄糖浓度为55 g/L时进行恒速补料的策略,最终丙酮酸产量、糖酸转化率和生产强度分别达到(86.63±0.29)g/L、0.78 g/g和1.07 g/(L·h)。已有的研究表明,光滑球拟酵母代谢副产物多糖的积累是影响丙酮酸转化率提升的主要原因之一[22-23]。近年来,关于光滑球拟酵母的基因编辑方法日趋成熟[24-25]。在后续研究中,通过建立光滑球拟酵母高效基因编辑系统并弱化潜在副产物合成相关基因表达,以及对胞内中心化合物进行精细调控,有望进一步提升丙酮酸积累水平。本研究相关优化与补料策略为利用光滑球拟酵母发酵生产丙酮酸的放大实验提供了理论与技术参考。
[1] XU P, JIANHUA Q, CHAO G, et al.Biotechnological routes to pyruvate production[J].Journal of Bioscience and Bioengineering, 2008, 105(3): 169-175.
[2] KERBER R C, FERNANDO M S.α-Oxocarboxylic acids[J].Journal of Chemical Education, 2010, 87(10): 1 079-1 084.
[3] YANG M, XING J.Improvement of pyruvate production based on regulation of intracellular redox state in engineered Escherichia coli[J].Biotechnology and Bioprocess Engineering, 2017, 22(4): 376-381.
[4] ARTHUR J L C, JAMES Z G, ALTON M.Synthesis and properties of the alpha-keto acids[J].Chemical Reviews, 1983, 83(3): 321-358.
[5] SONG Y, LI J, SHIN H-D, et al.Biotechnological production of alpha-keto acids: Current status and perspectives[J].Bioresource Technology, 2016, 219: 716-724.
[6] HOSSAIN G S, SHIN H-D, LI J, et al.Transporter engineering and enzyme evolution for pyruvate production from D/L-alanine with a whole-cell biocatalyst expressing L-amino acid deaminase from Proteus mirabilis[J].RSC Advances, 2016, 6(86): 82 676-82 684.
[7] CHAO G, XIAOMAN X, CHUNHUI H, et al.Pyruvate producing biocatalyst with constitutive NAD-independent lactate dehydrogenases[J].Process Biochemistry, 2010, 45(12): 1 912-1 915.
[8] EISENBERG A, SEIP J E, GAVAGAN J E, et al.Pyruvic acid production using methylotrophic yeast transformants as catalyst[J].Journal of Molecular Catalysis B Enzymatic, 1997, 2(4): 223-232.
[9] KAWAI S, OHASHI K, YOSHIDA S, et al.Bacterial pyruvate production from alginate, a promising carbon source from marine brown macroalgae[J].Journal of Bioscience and Bioengineering, 2014, 117(3): 269-274.
[10] MIYAZAKI M, SHIBUE M, OGINO K, et al.Enzymatic synthesis of pyruvic acid from acetaldehyde and carbon dioxide[J].Chemical Communications, 2001, 33(18): 1 800-1 801.
[11] YANG S, CHEN X, XU N, et al.Urea enhances cell growth and pyruvate production in Torulopsis glabrata[J].Biotechnology Progress, 2014, 30(1): 19-27.
[12] VAN MARIS A J A, GEERTMAN J M A, VERMEULEN A, et al.Directed evolution of pyruvate decarboxylase-negative Saccharomyces cerevisiae, yielding a C2-independent, glucose-tolerant, and pyruvate-hyperproducing yeast[J].Applied and Environmental Microbiology, 2004, 70(1): 159-166.
[13] ZHU Y, EITEMAN M A, ALTMAN R, et al.High glycolytic flux improves pyruvate production by a metabolically engineered Escherichia coli strain[J].Applied and Environmental Microbiology, 2008, 74(21): 6 649-6 655.
[14] JINGWEN Z, LUXI H, LIMING L, et al.Enhancement of pyruvate productivity by inducible expression of a F0F1-ATPase inhibitor INH1 in Torulopsis glabrata CCTCC M202019[J].Journal of Biotechnology, 2009, 144(2): 120-126.
[15] SHA X, JINGWEN Z, LIMING L, et al.Arginine: A novel compatible solute to protect Candida glabrata against hyperosmotic stress[J].Process Biochemistry, 2011, 46(6): 1 230-1 235.
[16] LUO Z, ZENG W, DU G, et al.Enhanced pyruvate production in Candida glabrata by engineering ATP futile cycle system[J].ACS Synthetic Biology, 2019, 8(4): 789-795.
[17] ZHOU J, LIU L, DU G, et al.Citrate protect the growth of Torulopsis glabrata CCTCC M202019 against acidic stress as additional ATP supplier[J].Journal of Biotechnology, 2008, 136: S741.
[18] LUO Z, ZENG W, DU G, et al.A high-throughput screening procedure for enhancing pyruvate production in Candida glabrata by random mutagenesis[J].Bioprocess and Biosystems Engineering, 2017, 40(5): 693-701.
[19] LUO Z, LIU S, DU G, et al.Enhanced pyruvate production in Candida glabrata by carrier engineering[J].Biotechnology and Bioengineering, 2018, 115(2): 473.
[20] LI Y, CHEN J, LUN S Y, et al.Efficient pyruvate production by a multi-vitamin auxotroph of Torulopsis glabrata: key role and optimization of vitamin levels[J].Applied Microbiology and Biotechnology, 2001, 55(6): 680-685.
[21] QIN Y, JOHNSON C H, LIU L, et al.Introduction of heterogeneous NADH reoxidation pathways into Torulopsis glabrata significantly increases pyruvate production efficiency[J].Korean Journal of Chemical Engineering, 2011, 28(4): 1 078.
[22] LUO Z, LIU S, DU G, et al.Identification of a polysaccharide produced by the pyruvate overproducer Candida glabrata CCTCC M202019[J].Applied Microbiology and Biotechnology, 2017, 101(11): 4 447-4 458.
[23] CELI?SKA E.Debottlenecking the 1,3-propanediol pathway by metabolic engineering[J].Biotechnology Advances, 2010, 28(4): 519-530.
[24] ENKLER L, RICHER D, MARCHAND A L, et al.Genome engineering in the yeast pathogen Candida glabrata using the CRISPR-Cas9 system[J].Scientific Reports, 2016, 6: 35 766.
[25] CEN Y, FIORI A, DIJCK P V.Deletion of the DNA ligase IV gene in Candida glabrata significantly increases gene-targeting efficiency[J].Eukaryotic Cell, 2015, 14(8): 783-791.