红曲色素是红曲菌代谢过程中形成的聚酮类化合物[1],主要有黄、橙、红3种色调[2],具有抗氧化[3]、抗肥胖[4]、增强免疫力、调节血脂[5]以及抑制阿尔茨海默病[6]的功效,在食品、酿酒、保健品等行业均有广泛应用。其中红色素的生产工艺已十分成熟,而橙、黄色素因其良好的感官性能,来源天然以及不受季节、地域性限制等优点,具有良好的发展潜力和经济潜能,因此成为天然色素产品开发的新方向。
然而在红曲菌的发酵过程中,桔霉素常常伴随红曲色素的合成而产生。桔霉素有损害肝脏代谢、致畸[7]、致癌和致突变的作用[8],并可能对中枢神经系统产生抑制[9],这使得红曲产品的食用安全性受到挑战,限制了它的应用。目前,降低桔霉素含量主要是通过筛选菌株、基因工程及控制发酵条件3种方法[10]。已有学者通过菌株筛选获得了低产桔霉素的红曲菌株[11]。此外,通过优化发酵条件也能够控制红曲的生长情况[12],以及利用低频磁场能够抑制桔霉素的产生[13]。本研究通过改变红曲菌液态发酵条件(如培养基成分、培养条件),研究红曲色素和桔霉素在红曲菌中的积累规律[14],通过外部调控选择安全有效的培养方式,为红曲色素的安全应用提供借鉴。
1 材料与方法
1.1 实验材料
1.1.1 菌株
红曲菌株(Monascus purpureus ZH2),由江南大学固态发酵研究室提供。
1.1.2 试剂
葡萄糖、麦芽糖、可溶性淀粉、蔗糖、(NH4)2SO4、K2HPO4、KH2PO4、MgSO4、MnSO4,国药集团化学试剂有限公司;玉米浆干粉、酵母膏,南京茂捷微生物科技有限公司;马铃薯、大米粉、糯米粉,市售;桔霉素(标准品),上海源叶生物科技有限公司产品;甲醇、磷酸,天津风船化学试剂科技有限公司;乙腈,上海星可高纯溶剂有限公司。
1.1.3 主要仪器设备
RXZ-288A人工气候箱,宁波江南仪器厂;LS-30立式压力蒸汽灭菌器,上海东亚压力容器制造有限公司;QYC-2102全温培养摇床,宁波市科技园区新江南仪器有限公司;T9CS双光束紫外可见光度计,北京普析通用仪器有限责任公司;1260高效液相色谱仪,安捷伦科技有限公司。
1.2 实验方法
1.2.1 培养基与培养条件
将红曲菌接种于PDA斜面,放置于28 ℃恒温培养箱中静置培养7 d,4 ℃保藏。
制备孢子悬浮液:用无菌水洗下PDA斜面上的红曲菌孢子,然后用玻璃珠将菌团打散后过滤,血球计数板计数,使孢子数达到1×(107~108)个/mL。
种子培养基(g/L):葡萄糖60,大豆水解液60,蛋白胨10,NaNO3 1.0,MgSO4·7H2O 2.0,KH2PO4 5.0,ZnSO4 0.02,pH自然。在28 ℃、180 r/min的条件下培养48 h。
初始发酵培养基(g/L):葡萄糖60,蛋白胨10,NaNO3 3.0,初始pH自然。
所有培养基均在121 ℃下灭菌20 min。
1.2.2 实验方法
1.2.2.1 不同碳源对红曲菌生长的影响
采用葡萄糖、麦芽糖、可溶性淀粉、蔗糖、大米粉、糯米粉,分别设置40、50、60 g/L三个梯度,氮源统一为蛋白胨,无机盐为KH2PO4和K2HPO4,pH自然。250 mL三角瓶装液50 mL,经121 ℃灭菌20 min,接种10%种子培养基,每组样品做3个平行,在28 ℃,180 r/min下振荡培养5 d。
1.2.2.2 不同氮源对红曲菌生长的影响
可溶性淀粉作为碳源,添加量为60 g/L,(NH4)2SO4、NH4Cl、蛋白胨、玉米浆干粉、酵母膏、NaNO3为氮源,分别设置10、20、30 g/L 3个梯度,无机盐及培养条件同上。
1.2.2.3 不同无机盐对红曲菌生长的影响
可溶性淀粉添加量为60 g/L,(NH4)2SO4添加量为10 g/L,向发酵培养基中分别添加KH2PO4、K2HPO4、MgSO4(1.0、2.0、3.0 g /L)、ZnSO4(0.05、0.1、0.15 g/L)、MnSO4(0.1、0.2、0.3 g /L)。培养条件同上。
1.2.2.4 复合添加无机盐对红曲菌生长的影响
以添加K2HPO4的发酵培养基为对照,在此基础上分别将MgSO4、MnSO4、ZnSO4设计成不同的添加组合,各种无机盐的添加量与1.2.2.3优化出的单因素添加量一致。培养条件同上。
1.2.2.5 不同温度对红曲菌生长的影响
可溶性淀粉添加量为60 g/L,(NH4)2SO4添加量为10 g/L,K2HPO4添加量为2 g/L,接种量为8%,将接种好的摇瓶分别放置在18、23、28、33 ℃的条件下培养5 d。
1.2.2.6 不同装液量对红曲菌生长的影响
可溶性淀粉添加量为60 g/L,(NH4)2SO4添加量为10 g/L,K2HPO4添加量为2 g/L,接种量为8%,分别向250 mL锥形瓶中添加50、60、70、80、90、100、110、120 mL发酵培养基,在28 ℃条件下培养5 d。
1.2.2.7 不同pH对红曲菌生长的影响
可溶性淀粉添加量为60 g/L,(NH4)2SO4添加量为10 g/L,K2HPO4添加量为2 g/L,接种量为8%,装液量为50 mL/250 mL,初始pH用HCl和NaOH调至2、3、4、5、6、7、8,在28 ℃条件下培养5 d。
1.2.2.8 不同转速对红曲菌生长的影响
可溶性淀粉添加量为60 g/L,(NH4)2SO4添加量为10 g/L,K2HPO4添加量为2 g/L,接种量为8%,装液量为50 mL/250 mL,初始pH为3,将摇床转速分别设置为160、180、200、220 r/min,在28 ℃条件下培养5 d。
1.3 测定方法
1.3.1 测定色价
将发酵液研磨破碎后取1 mL于25 mL比色管中,用体积分数为70%的乙醇定容至25 mL,颠倒混匀,置于60 ℃恒温水浴中浸提40 min。浸提结束后,取出冷却至室温,用乙醇稀释适当倍数,并以70%乙醇为空白对照,在全波长扫描下找出橙、黄色素的最大吸收峰,得到黄、橙色素的OD值。通过公式(1)、(2)计算色价:
黄色价/(U·mL-1)=OD410×总稀释倍数
(1)
橙色价/(U·mL-1)=OD470×总稀释倍数
(2)
1.3.2 测定菌体干重
将滤纸烘干至恒重,精确称量滤纸的质量。充分混合后精确量取30 mL发酵液进行抽滤,滤渣用蒸馏水充分洗涤数遍后,55 ℃烘干至恒重,精确称量滤渣及滤纸的总质量。
1.3.3 桔霉素含量测定
将发酵液经破碎后取5 mL置于15 mL比色管中,并用同体积的甲醇定容至10 mL,超声萃取30 min后于8 000 r/min下离心10 min,然后将提取液微滤后用HPLC分析检测桔霉素含量。
HPLC色谱条件:流动相,V(0.1%磷酸水)∶V(乙腈)=66∶34;VWD检测器λ=330 nm;色谱柱5 μm,Agilent XDB Reversed-phase C18;柱长及柱径250 mm×4.6 mm;体积流量1.0 mL/min;温度30 ℃;标准样及样品进样量均为20 μL。
1.4 数据统计分析
显著性差异分析使用非参数秩和检验的方法(IBM SPSS Statistics 20,NY,USA)。数据作图使用Origin 8.5(Originlab corporation,Inc.MA,USA)。
2 结果与分析
2.1 300~600 nm内的波长扫描
按照1.3.1方法对发酵提取液进行可见光波长范围内扫描,确定橙、黄色素所在的波长范围,结果如图1所示。可以看出,在410 nm和470 nm附近有明显的吸收峰,分别为黄色素和橙色素。
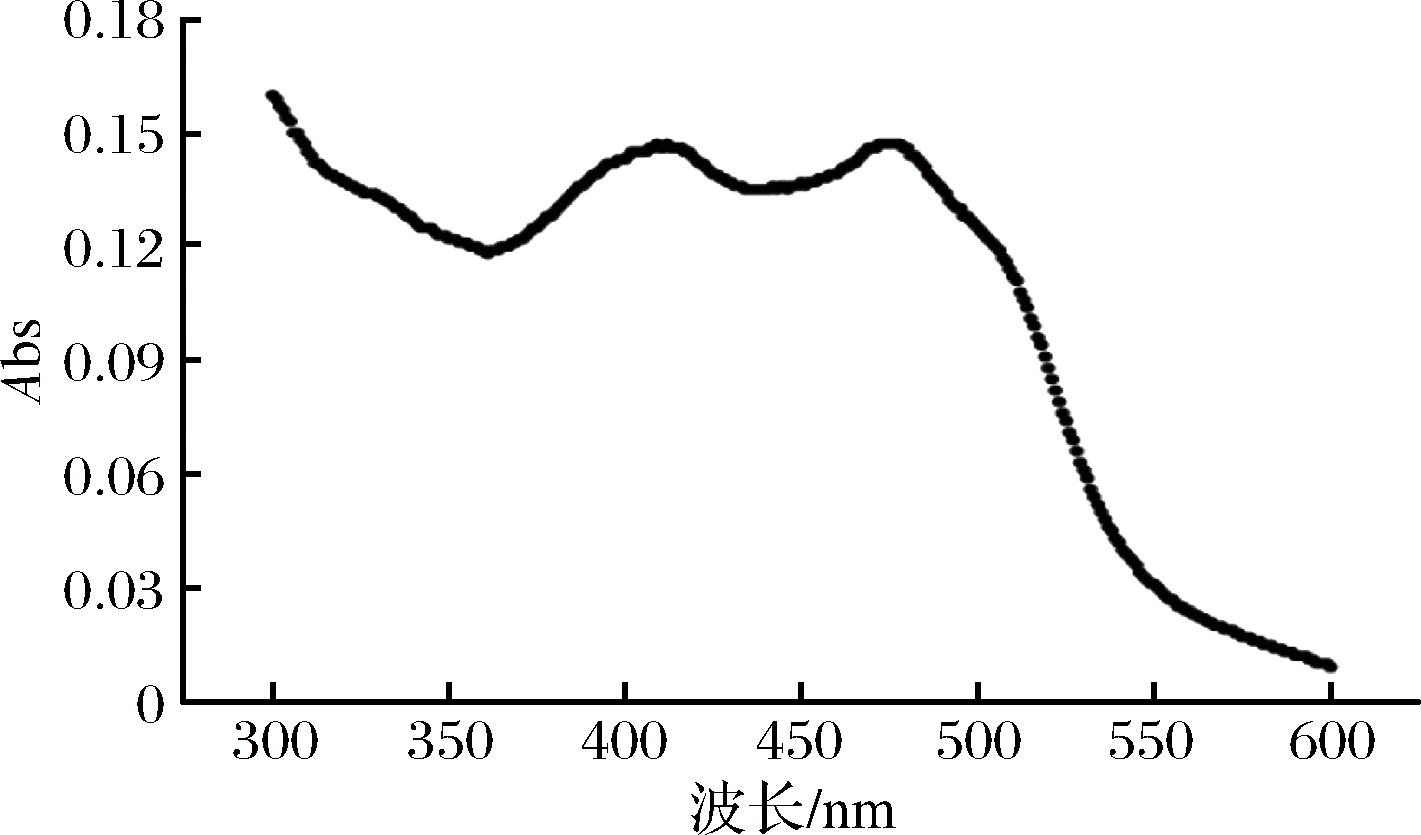
图1 红曲菌液态发酵色素提取液的光谱扫描图
Fig.1 Spectrum of Monascus pigments extractants by submerged fermentation
2.2 碳源对红曲菌生长的影响
由表1可知,葡萄糖、麦芽糖、可溶性淀粉促进红曲菌ZH2色素生长的效果相对明显。可溶性淀粉作为碳源时,红曲菌在代谢过程中产生淀粉酶和糖化酶将淀粉缓慢分解,从而使发酵液中的单糖浓度维持在一定水平,不会造成菌体快速地大量生长,有利于红曲色素的产生和积累。而高浓度的葡萄糖作为碳源时,会产生乙醇,从而抑制菌体的生长和色素的合成[15]。当蔗糖作为碳源时,菌体成大块团状,与培养基接触面积过小,导致菌体缺乏营养,不利于色素的积累。麦芽糖和葡萄糖为碳源时,桔霉素质量浓度最高达到7.15、8.35 μg/mL,可溶性淀粉质量浓度为60 g/L时,桔霉素含量最低,为5.91 μg/mL,所以选择60 g/L可溶性淀粉为红曲菌ZH2发酵的碳源。
2.3 氮源对红曲菌生长的影响
以60 g/L可溶性淀粉作为碳源,分析氮源对红曲菌生长的影响。由表2可知,不同种类及浓度的氮源对红曲菌ZH2的橙黄色素产量、菌丝干重、桔霉素的含量影响差异较大,表现出无机氮源整体优于有机氮源。(NH4)2SO4等无机氮源更适合橙黄色素生长,这可能是因为铵盐作为氮源被消耗时,降低了发酵液pH值,使发酵体系处于酸性环境中,影响相关代谢酶活性,抑制桔霉素生成或加速其作为中间代谢产物的分解,促进红曲黄色素生物合成[16]。
表1 不同碳源对红曲菌ZH2生长的影响
Table 1 Effects of different carbon sources on the growth of M.purpueus ZH2
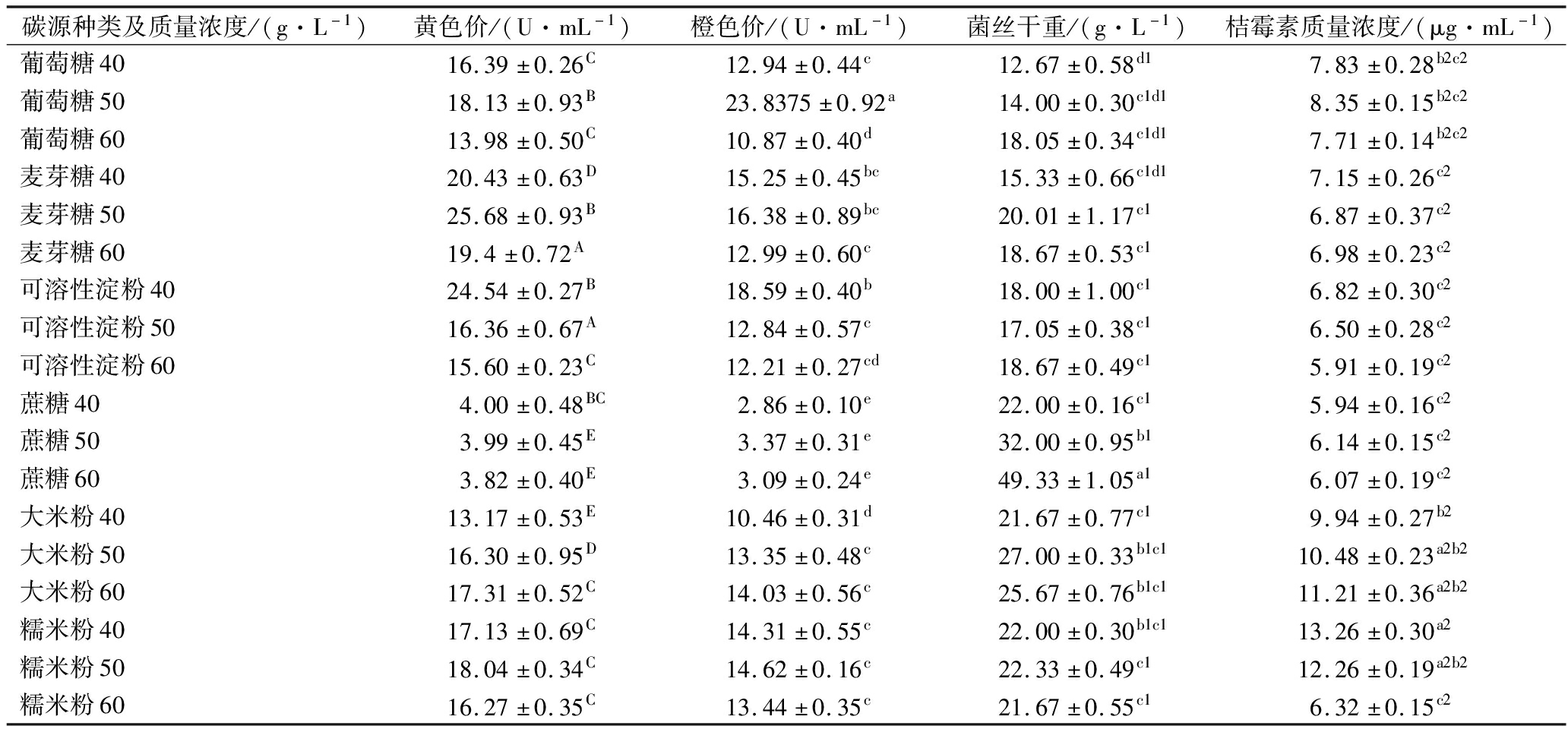
碳源种类及质量浓度/(g·L-1)黄色价/(U·mL-1)橙色价/(U·mL-1)菌丝干重/(g·L-1)桔霉素质量浓度/(μg·mL-1)葡萄糖4016.39±0.26C12.94±0.44c12.67±0.58d17.83±0.28b2c2葡萄糖5018.13±0.93B23.8375±0.92a14.00±0.30c1d18.35±0.15b2c2葡萄糖6013.98±0.50C10.87±0.40d18.05±0.34c1d17.71±0.14b2c2麦芽糖4020.43±0.63D15.25±0.45bc15.33±0.66c1d17.15±0.26c2麦芽糖5025.68±0.93B16.38±0.89bc20.01±1.17c16.87±0.37c2麦芽糖6019.4±0.72A12.99±0.60c18.67±0.53c16.98±0.23c2可溶性淀粉4024.54±0.27B18.59±0.40b18.00±1.00c16.82±0.30c2可溶性淀粉5016.36±0.67A12.84±0.57c17.05±0.38c16.50±0.28c2可溶性淀粉6015.60±0.23C12.21±0.27cd18.67±0.49c15.91±0.19c2蔗糖404.00±0.48BC2.86±0.10e22.00±0.16c15.94±0.16c2蔗糖503.99±0.45E3.37±0.31e32.00±0.95b16.14±0.15c2蔗糖603.82±0.40E3.09±0.24e49.33±1.05a16.07±0.19c2大米粉4013.17±0.53E10.46±0.31d21.67±0.77c19.94±0.27b2大米粉5016.30±0.95D13.35±0.48c27.00±0.33b1c110.48±0.23a2b2大米粉6017.31±0.52C14.03±0.56c25.67±0.76b1c111.21±0.36a2b2糯米粉4017.13±0.69C14.31±0.55c22.00±0.30b1c113.26±0.30a2糯米粉5018.04±0.34C14.62±0.16c22.33±0.49c112.26±0.19a2b2糯米粉6016.27±0.35C13.44±0.35c21.67±0.55c16.32±0.15c2
注:大写字母、小写a、a1、a2等字母分别代表各种类间黄色价、橙色价、菌丝干重、桔霉素含量的显著性差异(P<0.05)(下同)
表2 不同氮源对红曲菌ZH2生长的影响
Table 2 Effects of different nitrogen sources on the growth of M.purpueus ZH2
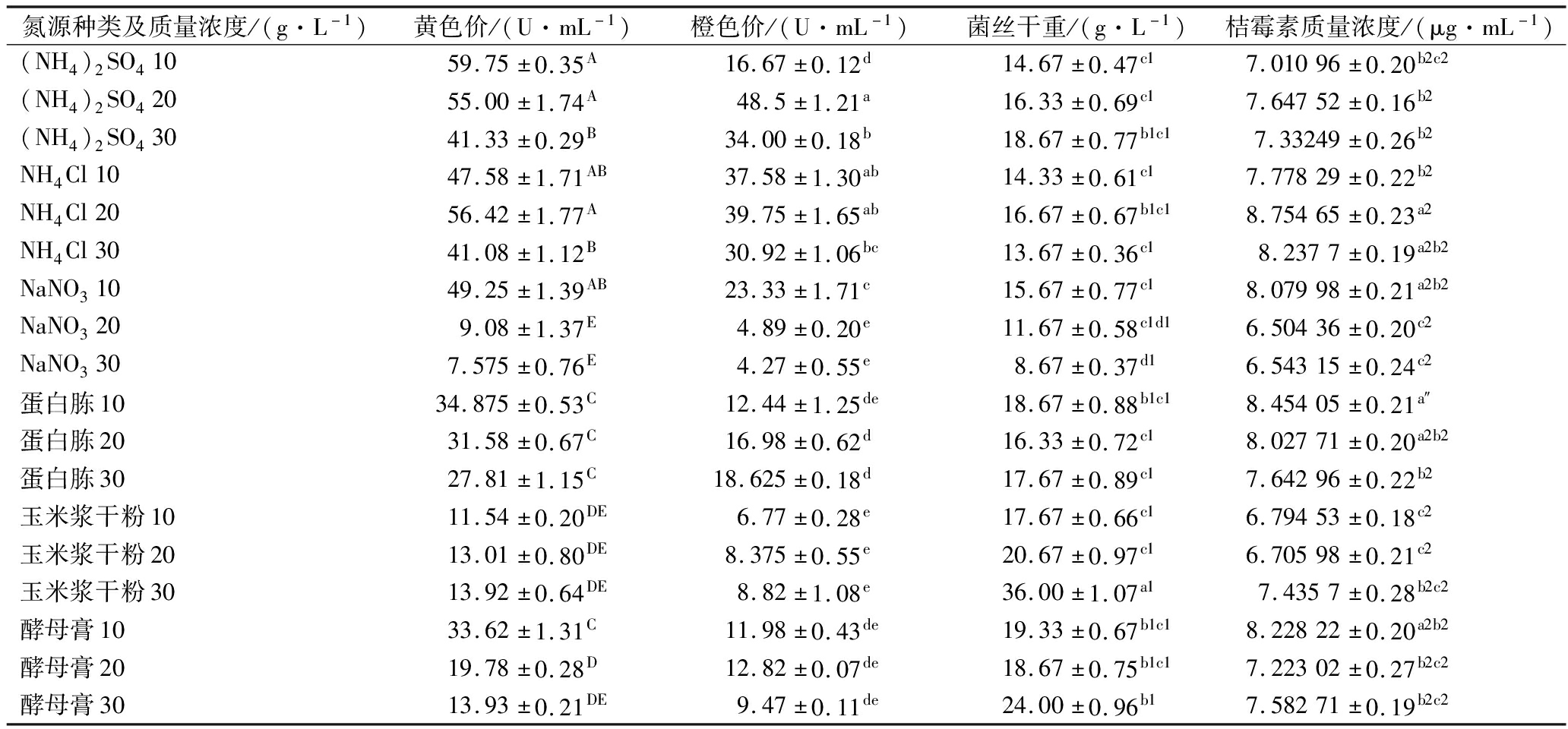
氮源种类及质量浓度/(g·L-1)黄色价/(U·mL-1)橙色价/(U·mL-1)菌丝干重/(g·L-1)桔霉素质量浓度/(μg·mL-1)(NH4)2SO41059.75±0.35A16.67±0.12d14.67±0.47c17.01096±0.20b2c2(NH4)2SO42055.00±1.74A48.5±1.21a16.33±0.69c17.64752±0.16b2(NH4)2SO43041.33±0.29B34.00±0.18b18.67±0.77b1c17.33249±0.26b2NH4Cl1047.58±1.71AB37.58±1.30ab14.33±0.61c17.77829±0.22b2NH4Cl2056.42±1.77A39.75±1.65ab16.67±0.67b1c18.75465±0.23a2NH4Cl3041.08±1.12B30.92±1.06bc13.67±0.36c18.2377±0.19a2b2NaNO31049.25±1.39AB23.33±1.71c15.67±0.77c18.07998±0.21a2b2NaNO3209.08±1.37E4.89±0.20e11.67±0.58c1d16.50436±0.20c2NaNO3307.575±0.76E4.27±0.55e8.67±0.37d16.54315±0.24c2蛋白胨1034.875±0.53C12.44±1.25de18.67±0.88b1c18.45405±0.21a″蛋白胨2031.58±0.67C16.98±0.62d16.33±0.72c18.02771±0.20a2b2蛋白胨3027.81±1.15C18.625±0.18d17.67±0.89c17.64296±0.22b2玉米浆干粉1011.54±0.20DE6.77±0.28e17.67±0.66c16.79453±0.18c2玉米浆干粉2013.01±0.80DE8.375±0.55e20.67±0.97c16.70598±0.21c2玉米浆干粉3013.92±0.64DE8.82±1.08e36.00±1.07a17.4357±0.28b2c2酵母膏1033.62±1.31C11.98±0.43de19.33±0.67b1c18.22822±0.20a2b2酵母膏2019.78±0.28D12.82±0.07de18.67±0.75b1c17.22302±0.27b2c2酵母膏3013.93±0.21DE9.47±0.11de24.00±0.96b17.58271±0.19b2c2
当有机氮源作为红曲菌的氮源时,会被红曲菌在代谢过程中产生的蛋白酶分解成多种氨基酸,从而与红曲橙色素发生反应,将橙色素转变成水溶性红色素。而无机氮源中不含氨基酸类物质,所以不会出现上述现象。当(NH4)2SO4质量浓度为10 g/L时,黄色素含量最高,菌体生长状况良好,且桔霉素含量为7.011 μg/mL,处于较低水平。结合显著性差异分析,选择(NH4)2SO4 10 g/L作为红曲菌ZH2发酵的最佳氮源及添加量。通过氮源的优化选择,发酵液由之前的棕红色变成了明显的橙黄色。
2.4 外加无机盐对红曲菌生长的影响
以可溶性淀粉及(NH4)2SO4作为发酵培养基的碳、氮源,添加不同的无机盐到发酵培养基中,产生的色素色价各有不同,其中 KH2PO4和K2HPO4比其他几种无机盐发酵产生的橙、黄色素优势明显,这是因为KH2PO4和K2HPO4能够作为培养基的缓冲体系,维持并稳定培养基在红曲菌代谢过程中的pH。由表3可知,添加K2HPO4比KH2PO4产生的桔霉素含量要少,在质量浓度为2.0 g/L时,橙、黄色价分别达到113.51 U/mL,79.63 U/mL,桔霉素含量为6.82 μg/mL。从原材料的来源及贮存等方面考虑,选用K2HPO4为红曲菌ZH2发酵的无机盐。
磷酸盐在微生物生长和代谢调节中,具有重要的生理功能,但在合成产物的过程中还需要一些无机离子的参与[17]。以添加K2HPO4的发酵培养基为对照,在此基础上分别添加MgSO4、MnSO4、ZnSO4、MnSO4+ZnSO4、MgSO4+ZnSO4、MgSO4+MnSO4、MgSO4+MnSO4+ZnSO4等不同无机盐组合,考察复合无机盐对红曲生长的影响。由表3可知,添加了2 g/L的MgSO4和0.02 g/L的ZnSO4组合生产色素的能力最高,橙、黄色素色价分别达到119.28 U/mL,94.38 U/mL,相对应的桔霉素含量为7.10 μg/mL。综上所述,将2.0 g/L K2HPO4、2.0 g/L MgSO4及0.02 g/L ZnSO4作为红曲菌ZH2的外加无机盐。
表3 不同无机盐对红曲菌ZH2生长的影响
Table 3 Effects of different mineral salt on the growth of M.purpueus ZH2

无机盐种类及质量浓度/(g·L-1)黄色价/(U·mL-1)橙色价/(U·mL-1)菌丝干重/(g·L-1)桔霉素质量浓度/(μg·mL-1)空白73.12±2.11B93.08±2.01b23.35±0.53a18.18±0.33a2K2HPO41.042.25±0C59.69±1.03c20.67±0.43b16.44±0.25b2K2HPO42.079.63±2.29A113.51±3.35a22.33±0.42a16.82±0.28b2K2HPO43.060.94±0.22BC83.94±1.33bc21.30±0.34b16.53±0.27b2KH2PO41.085.81±2.61A116.00±2.65a21.33±0.37b16.91±0.23b2KH2PO42.093.38±2.42A120.63±3.01a22.31±0.45a18.08±0.31a2KH2PO43.059.81±1.56C86.88±2.10bc22.67±0.51a16.95±0.31b2MgSO41.062.69±2.56BC78.37±2.09bc21.00±0.43b16.92±0.30b2MgSO42.082.50±0.53A102.38±0.88ab22.67±0.49a17.97±0.36a2MgSO43.072.00±2.47B92.19±2.62b21.33±0.47b16.93±0.20b2ZnSO40.0559.56±1.15BC78.10±2.21c20.00±0.41b1c16.38±0.25c2ZnSO40.1032.50±1.18D42.00±14.77d21.00±0.39b16.81±0.29b2ZnSO40.1564.56±1.62BC87.31±2.56b20.67±0.43b16.92±0.31b2MnSO40.146.19±1.99BC61.34±2.34bc19.33±0.42b1c16.10±0.30c2MnSO40.245.88±1.21BC61.00±2.53c19.00±0.25b1c16.50±0.26b2MnSO40.338.25±1.33D50.69±2.34c17.33±0.33c16.72±0.13b2K2HPO4对照78.21±1.95B82.96±2.64c14.35±0.36c16.72±0.06c2K2HPO4+Mg2+85.59±2.43AB90.14±0.94bc16.00±0.88b17.25±0.17b2K2HPO4+Mn2+68.10±0.88C73.71±1.86d15.50±0.79b17.64±0.30a2K2HPO4+Zn2+74.18±1.30BC100.46±1.63b20.00±0.76a1b17.83±0.16a2K2HPO4+Mn2++Zn2+85.66±0.88B105.84±0.86ab22.00±0.91a17.33±0.15b2K2HPO4+Mg2++Zn2+94.38±1.96A119.28±3.53a17.50±0.83b1c17.10±0.19b2c2K2HPO4+Mg2++Mn2+75.86±1.09BC88.54±1.61c16.05±1.04b1c16.81±0.03c2K2HPO4+Mg2++Mn2++Zn2+73.29±0.52BC80.23±1.43cd17.65±0.40b1c16.75±0.15c2
注:后7组中无机盐的添加量(g/L)分别为MgSO4 2;MnSO4 0.04;ZnSO4 0.02;MnSO4 0.04+ZnSO4 0.02;MgSO4 2+ZnSO4 0.02;MgSO4 2+MnSO4 0.04;MgSO4 2+MnSO4 0.04+ZnSO4 0.02
2.5 温度对红曲菌生长的影响
由图2可知,在18~28 ℃的温度范围下,随着温度升高,橙、黄色素色价升高。当培养温度为28 ℃时,发酵液的色价最大,橙、黄色素色价分别为59.06 U/mL,38.56 U/mL;温度超过30 ℃,发酵液的色价明显降低,原因可能是因为温度对微生物细胞生长、产物合成及代谢的影响是多方面的,不仅可以改变培养基的性质,而且会影响细胞代谢过程中各种关键酶的活性[18]。过高或过低的温度,不利于菌体的生长和色素的积累,从桔霉素含量可以看出,在28 ℃下桔霉素含量最低,达到5.70 μg/mL,故选择28 ℃为培养的最适温度。
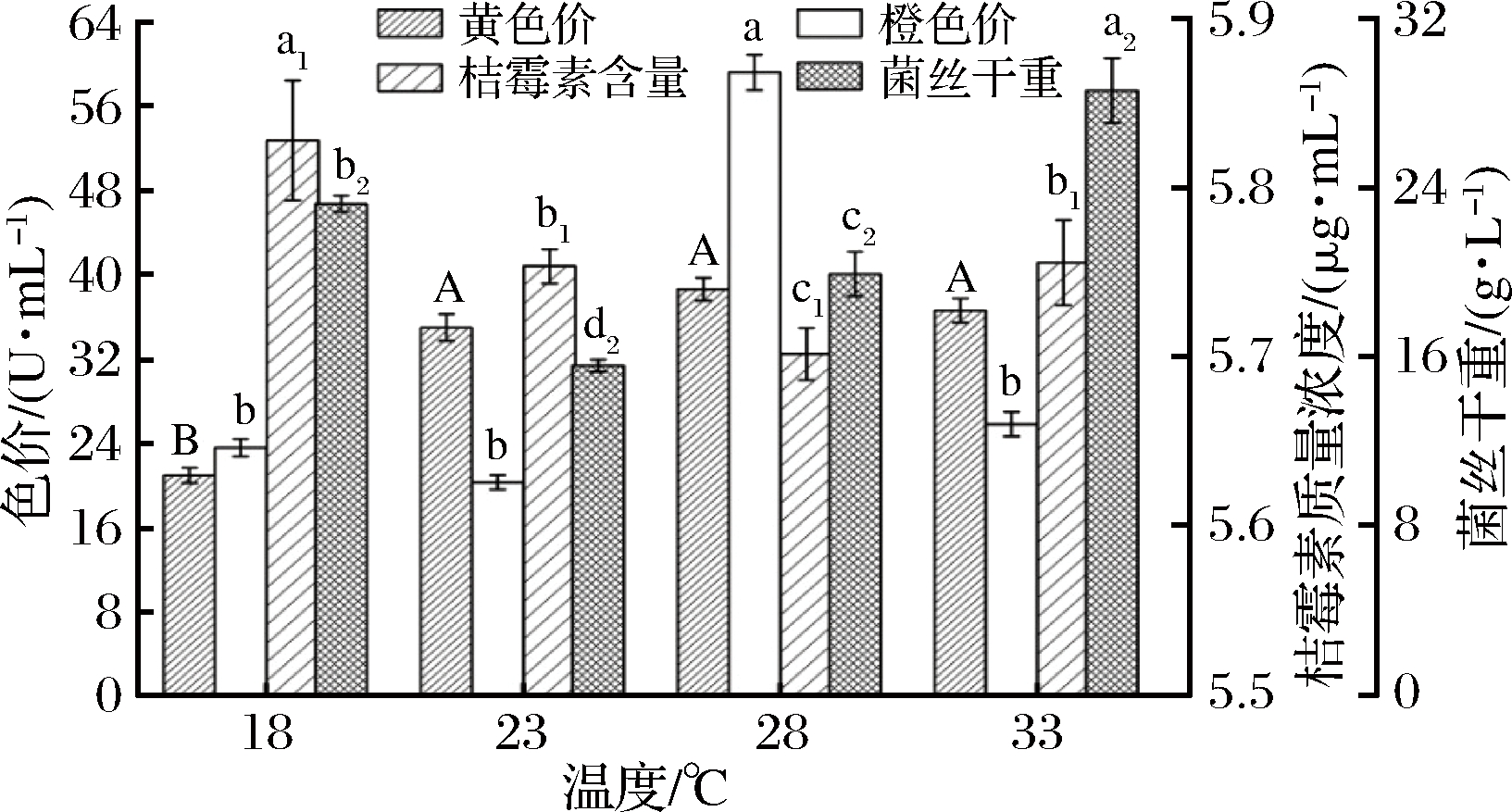
图2 温度对红曲菌生长的影响
Fig.2 Effects of different temperatures on the growth of M.purpueus ZH2
注:大写字母、小写a、a1、a2等字母分别代表各种类间黄色价、橙色价、桔霉素含量、菌丝干重的显著性差异(P<0.05)(下同)
2.6 装液量对红曲菌生长的影响
从图3可以看出,随着装液量的增加,橙、黄色素产量逐渐降低,菌丝干重逐渐减少,说明装液量越大,越不利于红曲菌的生长[19]。这是因为红曲菌是好氧菌,在营养充足的情况下,装液量越少其通气量越大,溶氧量越多,有利于菌体生长以及产生色素等代谢产物。同时装液量不同,桔霉素的含量差别较大,在50~100 mL时,桔霉素逐渐增加,直到装液量为110 mL时,桔霉素含量随有所降低,但仍高于50 mL时的桔霉素含量。装液量为50 mL时,橙、黄色素分别达到85.50 U/mL,83.63 U/mL,菌丝干重更多,说明该条件下更有利于菌体的生长,对应的桔霉素含量最低,仅为5.73 μg/mL,故选择50 mL为最佳装液量。
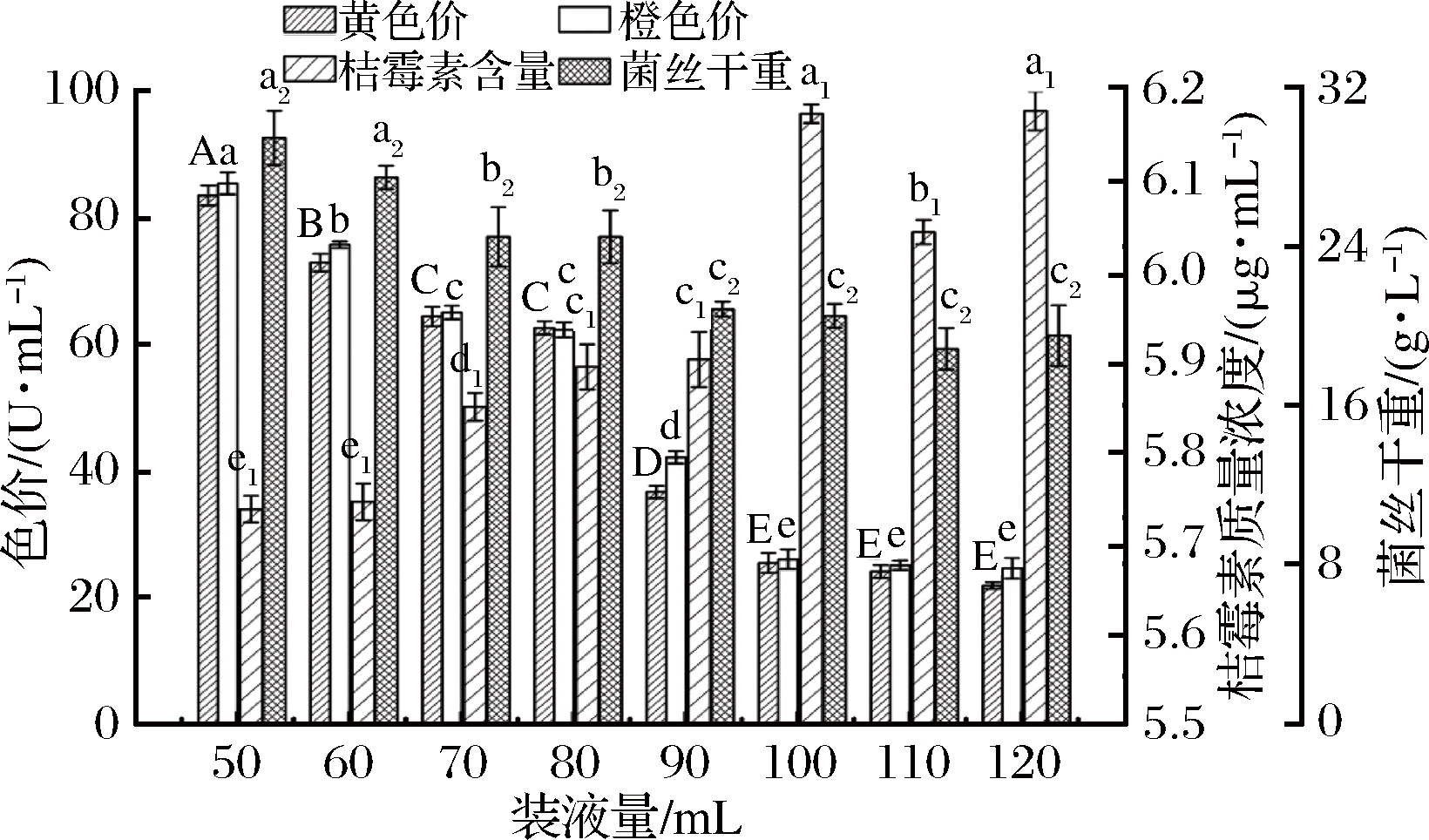
图3 不同装液量对红曲菌ZH2生长的影响
Fig.3 Effects of different liquid volume on the growth of M.purpueus ZH2
2.7 不同pH对红曲菌生长的影响
由图4可知,中性环境促进红曲菌产色素的能力不够突出;中性偏酸环境有利于红曲菌产色素,菌体得率也较高,过酸环境既不利于菌体的生长也不利于色素的生成;在碱性环境下菌体基本不生长,色价也很低[20]。综上,过酸或碱性环境都不利于色素的生长积累,当pH 3~4时,菌体生长良好,总色价较高,发酵液颜色较深,其中pH 3的效果最好,红曲菌产色素的最适pH应该最接近3[21]。pH为3时,橙、黄色素含量分别达到75.63 U/mL,107.00 U/mL,而且其相对应的桔霉素含量为6.43 μg/mL,低于产色素能力相近的pH 4所对应的桔霉素含量8.27 μg/mL,所以选择pH 3作为红曲菌ZH2发酵的初始pH。

图4 不同pH对红曲菌ZH2产红曲色素的影响
Fig.4 Effects of different pH on the growth of M.purpueus ZH2
2.8 不同转速对红曲菌生长的影响
由图5可知,随着转速的增加,橙、黄色素色价逐渐增大,在200~220 r/min时达到稳定状态。转速越大,通气量越大,红曲菌的溶氧就越大,从而越有利于菌体生长,但是转速过大,虽能增加溶氧量,但会因剪切力过大,对菌丝的生长产生影响,从而导致色素的生长能力降低[19]。由图5看出,在200 r/min和220 r/min条件下的色素产量相当,但后者的菌体生长量达到最大,且桔霉素含量低于200 r/min时,所以选择220 r/min作为培养的最佳转速。在此条件下,红曲菌ZH2的橙、黄色素色价分别达到152.96、108.38 U/mL,桔霉素含量为5.80 μg/mL。
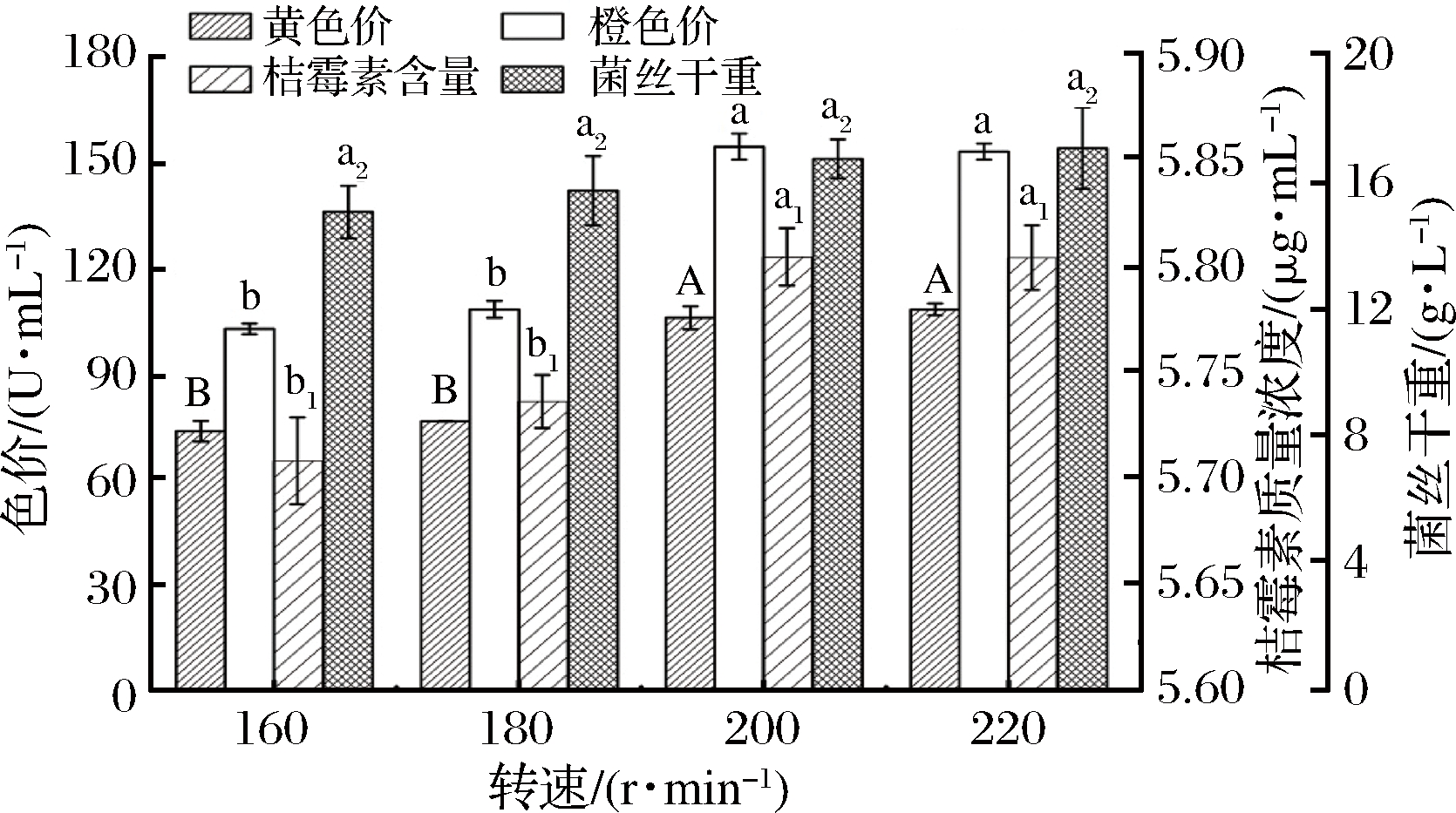
图5 不同转速对红曲菌ZH2生长的影响
Fig.5 Effects of different rotating speeds on the growth of M.purpueus ZH2
3 结论
通过对红曲菌ZH2进行单因素优化实验,得到了在摇床水平下发酵红曲菌ZH2高产红曲色素、低产桔霉素的最佳培养基配方:碳源为可溶性淀粉60 g/L,氮源为(NH4)2SO4 10 g/L,无机盐K2PO4 2.0 g/L,MgSO4 2.0 g/L,ZnSO4 0.02 g/L;最适的发酵条件为温度28 ℃,装液量50 mL/250 mL,初始pH 3,转速220 r/min,发酵5 d。经过优化后,发酵液中橙、黄色素由最初的18.59 U/mL,24.54 U/mL分别提高到152.96 U/mL,108.38 U/mL,桔霉素含量由最初的8.35 μg/mL减少到5.80 μg/mL,降低了30%。
[1] 王艳,邱树毅,王啸,等.紫色红曲霉FBKL3.0018液态发酵产红曲色素条件的优化研究[J].中国酿造, 2017, 36(12):57-62.
[2] KIM D, KU S.Beneficial effects of Monascus sp.KCCM 10093 pigments and derivatives:A mini review[J].Molecules, 2018, 23(1):98-113.
[3] SHI Y C, LIAO V H C, PAN T M.Monascin from red mold dioscorea as a novel antidiabetic and antioxidative stress agent in rats and Caenorhabditis elegans[J].Free Radical Biology & Medicine, 2012, 52(1):109-117.
[4] LEE C L, WEN J Y, HSU Y W, et al.Monascus fermented yellow pigments monascin and ankaflavin showed antiobesity effect via the suppression of differentiation and lipogenesis in obese rats fed a high-fat diet[J].Journal of Agricultural and Food Chemistry, 2013, 61(7):1 493-1 500.
[5] SHI Y C, PAN T M.Characterization of a multifunctional Monascus isolate NTU 568 with high azaphilone pigments production[J].Food Biotechnology, 2010, 24(4):349-363.
[6] LEE C L, LIN P Y, HSU Y W,et al.Monascus -fermented monascin and ankaflavin improve the memory and learning ability in amyloid β-protein intracerebroventricular-infused rat via the suppression of Alzheimer's disease risk factors[J].Journal of Functional Foods, 2015, 18(A):387-399.
[7] CIEGLER A, VESONDER R F, JACKSON L K.Produciton and biological activity of patulin and citrinin from Penicillium expansum[J].Applied and Environmental Microbiology, 1977, 33(4):1 004-1 006.
[8] AMBROSE A M, DEEDS F.Some toxicological and pharmacological properties of citrinin[J].Journal of Pharmacology and Experimental Therapeutics, 1946, 88(2):173-186.
[9] BAI C L, STACEY N H.Determination of bulky DNA adducts in biomonitoring of carcinogenic chemical exposures: features and comparison of current techniques[J].Biomarkers, 1997, 2(1):3-16.
[10] 李琦,高健信,陈福生,等.不产桔霉素高产红曲色素的基因工程红曲菌株构建[J].中国酿造, 2018, 37(6):38-43.
[11] 蒋冬花,冯青青,任浩,等.高产莫纳可林K低产桔霉素红曲霉菌株的筛选和发酵条件初步优化[J].微生物学杂志, 2016, 36(6):10-16.
[12] 叶昌亚,张薄博,许赣荣.液态发酵条件对红曲菌菌体形态及产物Monacolin K的影响[J].食品与发酵工业, 2016, 42(9):27-33.
[13] WAN Y L, ZHANG J L, HAN H X, et al.Citrinin-producing capacity of Monascus purpureus in response to low-frequency magnetic fields[J].Process Biochemistry, 2016, 53:25-29.
[14] 杨悦,王硕,杜欣军,等.不同培养基对紫色红曲霉发酵规律的影响[J].食品科技, 2014, 39(8):21-27.
[15] 毛鹏,张薄博,许赣荣.碳、氮源对红曲黄色素色价和色调值的影响[J].食品工业科技, 2015, 36(15):165-168.
[16] 岳建明,杨强,肖潇,等.铵盐对紫色红曲霉合成代谢红曲色素及桔霉素的影响[J].食品科学, 2016, 37(5):102-107.
[17] 殷博薇.橙色红曲菌AS3.4384及其基因缺失株的发酵以及几种代谢产物的分析[D].南昌:南昌大学, 2016.
[18] 周建建.高色价红曲红色素液态深层发酵工艺的研究[D].济南:齐鲁工业大学, 2013.
[19] 李慧,兰时乐.红曲霉液体深层发酵生产红曲色素条件的研究[J].安徽农业科学, 2014(19):6 360-6 363.
[20] 黄娟,姚若一,黄邵培,等.红曲霉产色素和桔霉素影响因素的研究进展[J].酿酒科技, 2018(2):109-112.
[21] 付荣霞,崔艳,杨树成,等.红曲霉液态发酵条件的优化[J].黑龙江农业科学, 2015(7):130-133.