低聚半乳糖(galacto-oligosaccharides,GOS)是一种公认的优质益生元,是功能性低聚糖的重要组成部分,以重要原辅料应用于乳品和代乳品、发酵制品、饲料和微生态制剂等工业[1-3]。通过酶法催化乳糖转苷为半乳二糖、半乳三糖、半乳四糖等低聚半乳糖,是目前工业化制备GOS的主要方法。具有转苷活性的乳糖酶则是制约这一产业发展的核心要素。长期以来,我国缺乏制备GOS所必需的高转苷活性专业酶制剂,GOS产品质量与生产技术水平较低。
β-半乳糖苷酶(β-galactosidase, EC 3.2.1.23),又称乳糖酶(lactase),能够催化乳糖水解形成葡萄糖和半乳糖或转苷形成低聚半乳糖[4-6]。利用乳糖酶的水解活性,可以进行牛奶中乳糖的水解,消除健康人群对乳糖的不耐受性;借助乳糖酶的转苷活性,则可以将乳糖转化为功能价值更优的GOS。在这一过程中,低聚半乳糖形成的比例取决于β-半乳糖苷酶的水解活性和转苷活性比例关系[7-10]。因此,获得具有高转苷活性的β-半乳糖苷酶新酶分子,对推动酶法制备GOS技术进步极为重要。
现有评价β-半乳糖苷酶转苷活性的方法,主要通过HPLC或TLC等检测技术检测样本中GOS的形成量[11-12]。这些方法准确可靠,但检测通量有限,无法应用于大规模样本的快速筛选。为此,笔者研究并建立了一种基于GOS和生物量相关关系的新型高转苷活性β-半乳糖苷酶的高通量筛选方法,运用此方法对菌种库进行大规模筛选,获得了具有显著转苷活性β-半乳糖苷酶的产酶菌株。
1 材料与方法
1.1 材料
1.1.1 菌株
本研究供试细菌分离物保藏物共3 759株,其中2 259株从中国高校工业微生物资源与信息中心(CICIM-CU)获得,另1 500株细菌分离物为近期从乳品样本和环境土样等自然样本中分离、鉴定并保藏。细菌的分子鉴定按实验室常规方法进行[13]。
1.1.2 培养基
MRS培养基(g/L):蛋白胨10,牛肉膏10,酵母膏5,K2HPO4 2,柠檬酸三铵2,乙酸钠5,葡萄糖20,吐温-80 1(mL),MgSO4 1,MnSO4 0.5,琼脂粉20;pH 6.0。
筛选培养基A(g/L):蛋白胨10,牛肉膏10,酵母膏5,K2HPO4 2,柠檬酸三铵2,乙酸钠5,GOS 20,吐温-80 1(mL),MgSO4 1,MnSO4 0.5,琼脂粉20;pH 6.0。
筛选培养基B(g/L):蛋白胨10,牛肉膏10,酵母膏5,K2HPO4 2,柠檬酸三铵2,乙酸钠5,乳糖5,半乳糖5,葡萄糖5,吐温-80 1(mL),MgSO4 1,MnSO4 0.5,琼脂粉20;pH 6.0。
1.2 实验方法
1.2.1 指示菌的筛选
将待检菌株用相应培养基活化后,分别点种于筛选培养基A和筛选培养基B,37 ℃培养60 h,记录生长情况与生长菌落大小,分别标注为“-”或“+”。以“-”表示不生长,“+”表示有明显生长,“+”越多表示菌落生长越显著。
1.2.2 GOS-生物量相关关系
以筛选培养基A为基础,调整其中的低聚半乳糖添加量分别为:0、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5和5.0 g/L。接入指示菌后于37 ℃下液体培养一定时间,在600 nm下检测指示菌株的生长情况,用OD600表示。
1.2.3 半乳糖基转移活性的筛选
将待筛选菌株在37 ℃下培养24 h后,加入终浓度为200 g/L的乳糖,50 ℃条件下孵育12 h,离心收集上清再经0.2 μm滤膜过滤除菌后备用;将上述反应液按照体积分数10%的添加量,添加至不含GOS组分的液体筛选培养基A中;接入指示菌,于37 ℃培养下培养,检测指示菌的增殖情况,用OD600值表示。
1.2.4 摇瓶发酵与酶液的制备
在250 mL三角瓶中进行,培养基为筛选培养基A液体培养基,装液量为50 mL。培养在37 ℃、230 r/min下进行。发酵过程中定时取样,离心收集上清液,分析酶活力。发酵结束时,离心取上清液并冻干,用于后续试验。
1.2.5 β-半乳糖苷酶酶活力测定
β-半乳糖苷酶酶活力测定:1 mL反应体系中含有200 g/L的乳糖和一定体积的酶液,用0.05 mol/L的醋酸缓冲液调节pH至5.0,在50 ℃水浴中反应12 h。反应结束后,在沸水中灭活20 min,再通过生物传感仪检测葡萄糖的含量。β-半乳糖苷酶的活性定义为:在pH 5.0、50 ℃下1 min催化乳糖底物释放1 μmol/L葡萄糖所需的酶量为1个酶活力单位(u)。
1.2.6 酶解乳糖及其产物分析
采用300 g/L乳糖为底物,添加20 u/g的β-半乳糖苷酶,反应在50 ℃下进行,定时取样,采用HPLC法分析酶促产物特征与生成。色谱条件为:流动相为体积分数65%乙腈,1.0 mL/min流速;TSK-GEL G3000PWXL-CP(7.8 mm×300 mm,7 μm)色谱柱,柱温25 ℃;蒸发光散射检测器,漂移管温度90 ℃,载气流速2.2 mL/min。
2 结果与讨论
2.1 指示菌的获得
鉴于现有GOS检测方法无法用于乳糖酶转苷活性的高通量筛选目的[11-12],建立适合高通量筛选目的的筛选方法是必要的。为此,本文试图建立起基于指示菌以GOS为碳源的生长状况的高通量筛选方法。即:运用可利用GOS生长,但对乳糖、葡萄糖和半乳糖的代谢利用弱或不利用的微生物菌株为指示菌,进而以此菌对样本中形成的GOS(细菌分离物形成的乳糖酶转化乳糖为GOS)的生长为依据,筛选获得具有转苷活性乳糖酶产酶菌株。
对分离保藏的细菌菌株进行GOS为唯一碳源生长的筛选,并以乳糖、葡萄糖和半乳糖为混合碳源为对照,通过筛选,获得了27株在GOS唯一碳源平板上生长,在乳糖、葡萄糖和半乳糖为混合碳源平板上不生长或生长较弱的菌株(表1)。具备指示菌属性的细菌分离物主要来源于乳杆菌属和双歧杆菌属,其中乳杆菌属16株,双歧杆菌属9株,戊糖片球菌和粪链球菌各1株。以生长优势最为明显的长双歧杆菌B1172菌株作为最佳指示菌用于后续研究。
表1 初筛获得的指示菌株及其生长情况
Table 1 Preliminary screening and the growth properties of the indicating isolates

序号菌株编号菌种名GOS平板生长情况混合碳源平板生长情况1B0532植物乳杆菌+++-/+2B0537长双歧杆菌+++++/-3B0540植物乳杆菌++-4B0543长双歧杆菌++++-5B0546植物乳杆菌+-6B0547植物乳杆菌++-/+7B1172长双歧杆菌++++++-8B1174戊糖片球菌+++/-9B1192弯曲乳杆菌++++-10B1194长双歧杆菌++++++/-11B1194弯曲乳杆菌++-12B1422副干酪乳杆菌+++/-13B2209长双歧杆菌++++-/+14B2245植物乳杆菌+-15B2512詹氏乳杆菌+++-/+16B2757长双歧杆菌+++++/-17B3040植物乳杆菌++-18B3143干酪乳杆菌++++-19B3246嗜酸乳杆菌+-20B3341嗜热双歧杆菌+++++-/+21B3472长双歧杆菌++++-22B3474短双歧杆菌+++++/-23B3492弯曲乳杆菌++-24B3594棒状乳杆菌++/-25B3644粪链球菌++-26B3722副干酪乳杆菌+++/-27B3729植物乳杆菌++++-/+
注:“-”表示不生长,“+”表示有明显生长,“+”越多表示菌落生长越显著
2.2 指示菌B1172筛选灵敏度范围确认
考察了指示菌B1172以GOS为碳源的生长情况(图1)。以不添加GOS的筛选培养基为对照,添加1.0 g/L GOS后,菌株B1172生物量已超过0.5,比不添加GOS条件下菌株菌体量高10倍以上(对照条件下菌体积累量为0.05)。可见,培养体系中,较低的GOS质量浓度(≥1.0 g/L)下即可通过指示菌的生长情况反映出来,指示菌的生物量与GOS质量浓度存在良好的相关关系(图1),可以用于对样本中GOS形成情况和形成量进行快速批量检出。
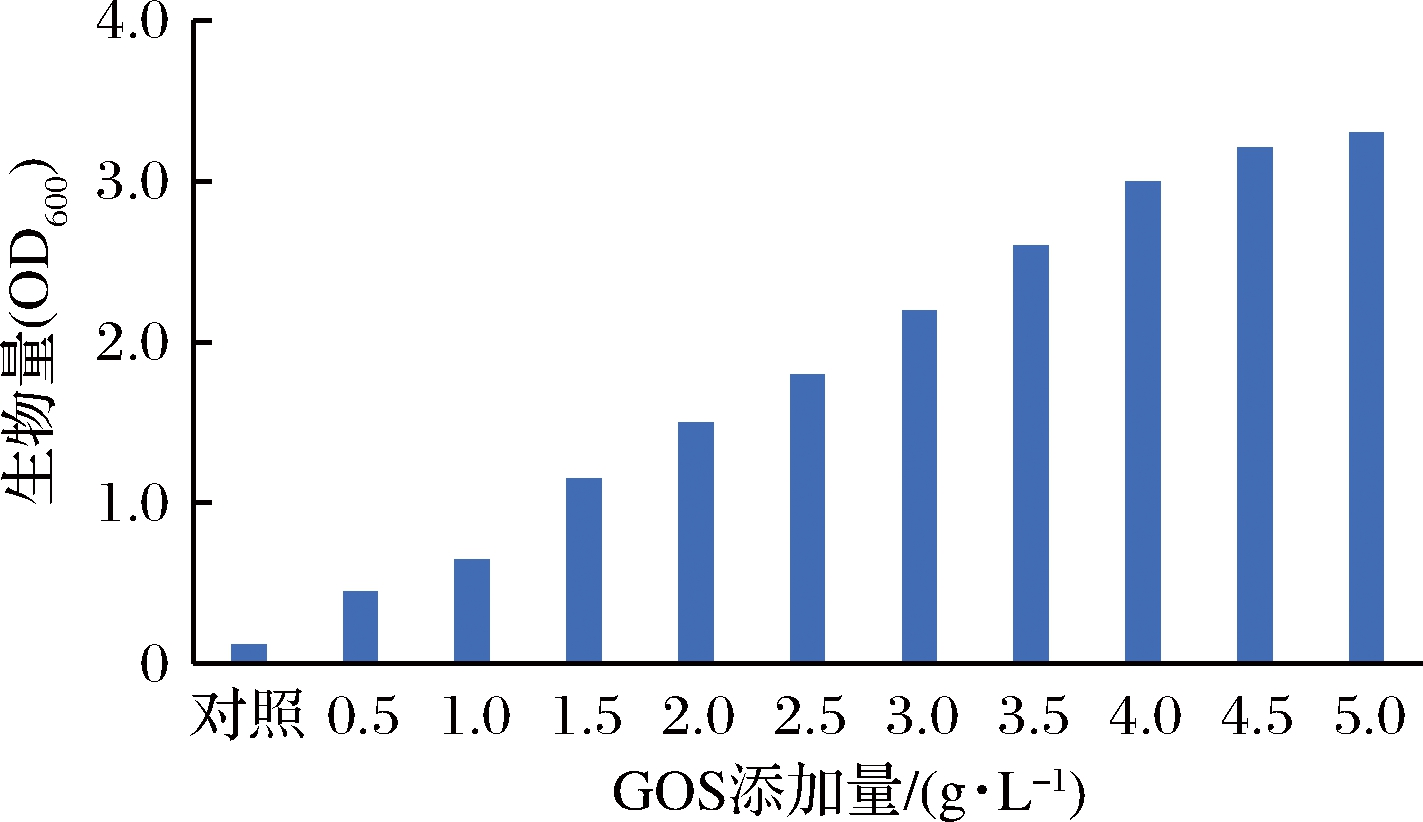
图1 GOS-指示菌B1172生物量相关关系
Fig.1 Correlation between GOS concentration and biomass of indicating strain B1172
2.3 半乳糖基转移酶活力的高通量筛选
在供试的菌种培养物中加入最终质量浓度为200 g/L的乳糖液,50 ℃反应后收集上清液用于GOS生成的快速检测样本,以10%的补加量替代筛选培养基A中的GOS碳源,接入指示菌B1172,培养后测定指示菌生长情况。从3 700余株细菌分离保藏菌中,获得了5株具有较强转化乳糖为GOS的菌株(表2)。进一步分析发现,菌株B0212和B2301的转半乳糖苷酶活力主要集中于胞内,菌株B0809、B2809和B3156的转半乳糖苷酶活力则主要集中于发酵液中;以菌株B2301为对象,进一步确认其乳糖酶产酶水平和催化GOS合成情况。
表2 转半乳糖苷酶活高通量筛选结果
Table 2 High throughput screening for transgalact-osylation in bacterial isolates

菌株种属指示菌株生长情况(OD600)B0212Bacilluscirculans2.1B0809Paenibacilluspini1.8B2301Bacilluscirculans3.2B2809Paenibacilluspini0.7B3156Paenibacilluspolymyxa1.6
2.4 菌株B2301产酶水平及其催化GOS合成
在摇瓶发酵下,定时取样并检测乳糖酶酶活力。发酵中后期,由于菌株B2301的裂解等原因,可在其发酵上清液中测定到乳糖酶酶活力(图2),发酵95 h时发酵上清液中酶活力达到最高,约为2.5 u/mL。
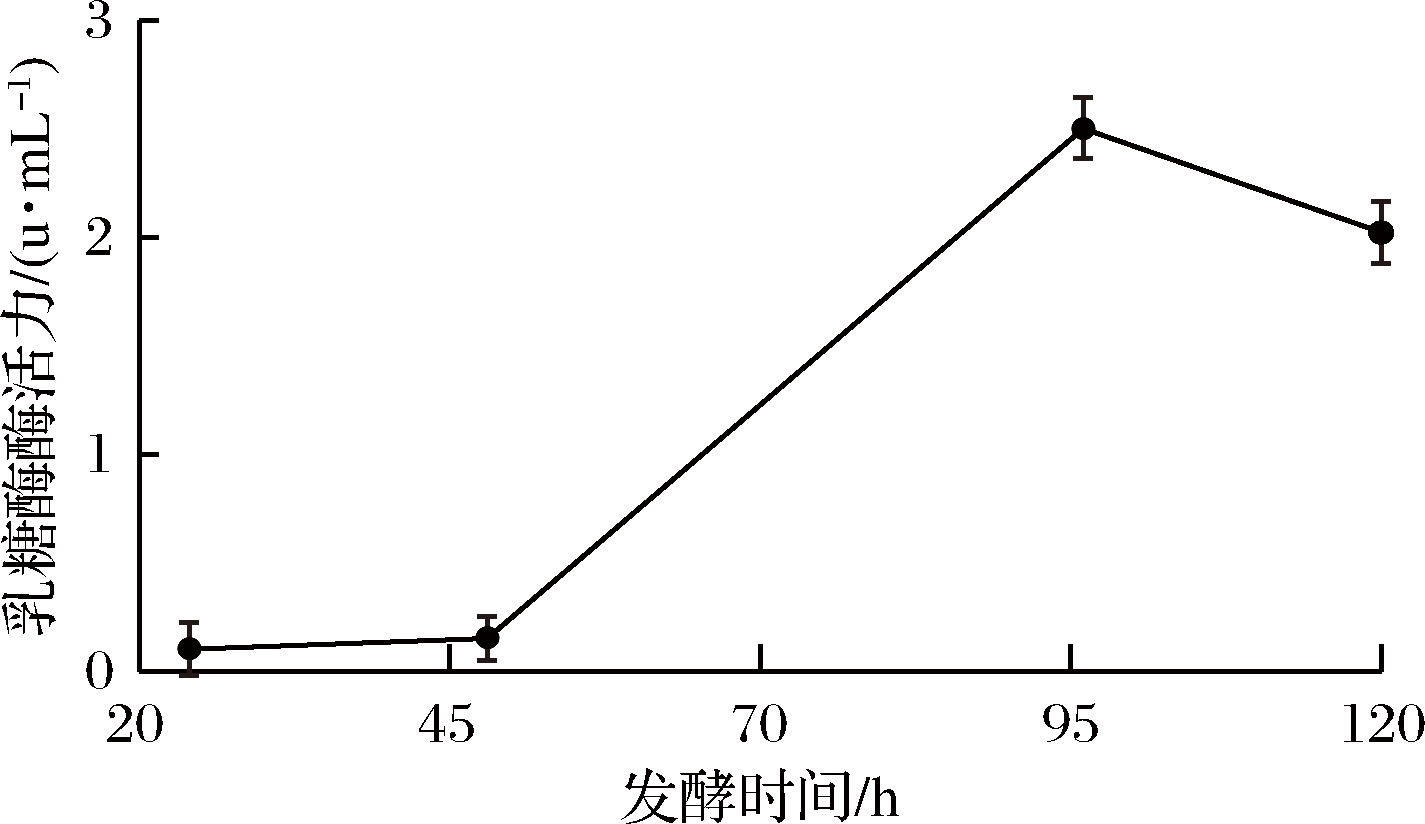
图2 摇瓶条件下菌株B2301产乳糖酶进程
Fig.2 Production of lactase by strain B2301 in shaking flask
以300 g/L乳糖为底物,添加20 u/g的B2301乳糖酶,在50 ℃下反应不同时间,取样进行HPLC糖谱分析,结果见图3。可以看出,B2301乳糖酶具有催化乳糖底物转化为GOS的能力,最高转化率可以达到54.5%;B2301乳糖酶水解乳糖的能力较低,仅生成较低水平的游离葡萄糖(图3)。
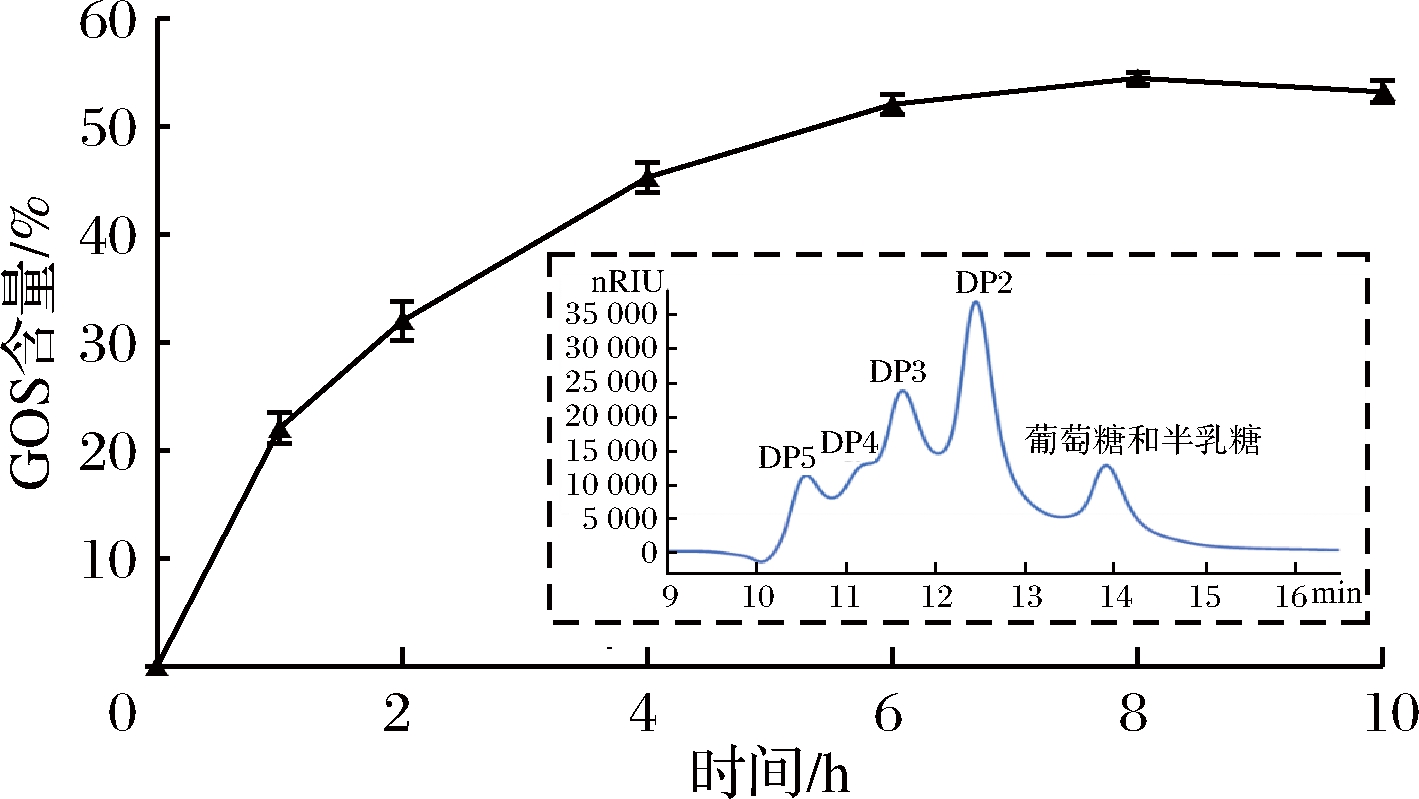
图3 B2301乳糖酶合成GOS的高能力
Fig.3 Lactase from strain B2301 efficiently catalyzed formation of GOS from lactose
注:图中虚框嵌图为反应终了时样本的HPLC糖谱分析
基于GOS依赖性生物量相关关系,建立了乳糖酶半乳糖基转移酶活力的高通量筛选方法。现有乳糖酶酶活力测定方法[14-18]主要包括:1)使用天然底物乳糖,通过检测葡萄糖和/或半乳糖的生成量确定酶活力;2)使用化学合成底物,如邻硝基苯-β-D-吡喃半乳糖苷,通过检测所生成的发色产物生成量确定酶活力。上述方法皆基于乳糖酶的水解活性,无法应用于乳糖酶的转苷活性的检测与筛选。HPLC是目前定量检测GOS组成与含量的基本方法,但操作成本与操作时限无法满足高通量筛选目的[11,19]。本文首次报道了基于GOS-指示菌生物量相关关系的高转苷活性乳糖酶的高通量筛选方法,成功用于具有转苷活性的乳糖酶产生菌株的筛选,此方法也将有助于后续乳糖酶的转苷活性分子进化突变库的高通量筛选。
3 结论
基于GOS-生物量相关关系,建立了一种高转苷活性乳糖酶的高通量快速筛选方法,成功运用此方法进行了3 700余株细菌分离物的筛选并获得高转苷活性乳糖酶产生菌。
[1] GOSLING A,STEVENS G W,BARBER A R,et al.Recent advances refining galactooligosaccharide production from lactose[J].Food Chemistry,2010,121(2):307-318.
[2] MACFARLANE G T,STEED H,MACFARLANE S.Bacterial metabolism and health-related effects of galacto-oligosaccharides and other prebiotics[J].Journal of Applied Microbiology, 2008,104(2):305-344.
[3] 卢丽丽,李正义,肖敏.微生物酶法合成低聚半乳糖的新进展[J].微生物学报,2008,48(7):980-985.
[4] 陈真真,张涛,江波,等.低聚半乳糖酶法合成条件的研究[J].食品与发酵工业,2012,38(10):39-43.
[5] HUSAIN Q.β-Galactosidases and their potential applications: A review[J].Critical Reviews in Biotechnology,2010,30(1):41-62.
[6] GAO X,WU J,WU D.Rational design of the beta-galactosidase from Aspergillus oryzae to improve galactooligosaccharide production[J].Food Chemistry,2019,286(1):362-367.
[7] 董艺凝,陈海琴,张灏,等.β-半乳糖苷酶的研究现状与进展[J].食品与生物技术学报,2018,37(4):337-343.
[8] RODRIGUEZ-COLINA B,FERNANDEZ-ARROJO L,BALLESTEROS A O,et al.Galactooligosaccharides formation during enzymatic hydrolysis of lactose: Towards a prebiotic-enriched milk[J].Food Chemistry,2014,145(4):388-394.
[9] SAQIB S,AKRAM A,HALIM S A,et al.Sources of β-galactosidase and its applications in food industry[J].3 Biotech,2017,7(1):e79.
[10] TORRES D,MARIA F,CALVES G,et al.Galacto-oligosaccharides:Production,properties,applications,and significance as prebiotics[J].Comprehensive Reviews in Food Science and Food Safety,2010,9(5):438-454.
[11] HSU C A,LEE S L,CHOU C C.Enzymatic production of galactooligosaccharides by beta-galactosidase from Bifidobacterium longum BCRC 15708[J].Journal of Agricultural and Food Chemistry,2007,55(6):2 225-2 230.
[12] 李静芳,彭美纯.高效液相色谱法测定低聚半乳糖的含量[J].食品科技,2012,33(7):279-282.
[13] 陈源源,沈微,樊游,等.16S rDNA序列在大批量细菌分离物分子鉴定中的应用研究[J].工业微生物,2013,43(2):1-5.
[14] PLACIER G,WATZLAWICK H,RABILLER C,et al.Evolved β-galactosidases from Geobacillus stearothermophilus with improved transgalactosylation yield for galacto-oligosaccharide production[J].Applied and Environmental Microbiology,2009,75(19): 6 312-6 321.
[15] LI L,LI G,CAO L C,et al.Characterization of the cross-linked enzyme aggregates of a novel β-galactosidase,a potential catalyst for the synthesis of galacto-oligosaccharides[J].Journal of Agricultural and Food Chemistry,2015,63(3):894-901.
[16] ESKANDARLOO H,ABBASPOURRAD A.Production of galacto-oligosaccharides from whey permeate using β-galactosidase immobilized on functionalized glass beads[J].Food Chemistry,2018,251(1):115-124.
[17] NIU D D,TIAN X J,MCHUNU N P,et al.Biochemical characterization of three Aspergillus niger β-galactosidases[J].Electronic Journal of Biotechnology,2017,27(3):37-43.
[18] 牛丹丹,贾超,田晓靓,等.黑曲霉F0215中β-半乳糖苷酶系的生化特征[J].中国食品学报,2017,18(11):203-212.
[19] HERNANDEZ-HERNANDEZ O,MONTANES F,CLEMENTE A,et al.Characterization of galactooligosaccharides derived from lactulose[J].Journal of Chromatography A,2011,1218(42):7 691-7 696.